难消化糊精是一类富含α-1,6、α-1,2、α-1,3糖苷键或环状糖链结构的可溶性糊精的总称。不易被人体消化吸收,可促进肠道蠕动和益生菌增殖[1],有效维持肠道益生菌种群的数量,预防亚健康的发生或减轻其程度。同时,相较于不溶性膳食纤维的口感粗糙,高分子可溶性膳食纤维的高黏度,难消化糊精具有水溶性好、溶速快、无色无味等特性,在改善食品口感、优化食品加工性能等方面独具优势,因此在饮料、烘焙、乳制品等行业具有广泛的应用。
传统的制备方法为利用糖苷键重构的高温酸解化学法。日本松谷化学工业株式会社的OHKUMA等[2]采用酸热法制备获得难消化糊精。在此基础上,许多学者对其制备方法进行了改进。如酸热法与酶法结合,李泽润等[3]使用转苷酶进行改性处理,LIU等[4]使用分支酶进行改性,李泽西等[5]使用环糊精葡萄糖基转移酶进行改性,获得产物快消化成分仅含2.01%。但酸热法始终存在能耗大、污染严重、产率低、分离纯化工艺复杂等突出问题,因此,近年来关于纯酶制备难消化糊精的研究越来越多。
实验室前期表达的构巢曲霉来源α-葡萄糖苷酶AgdB具有转苷酶活较高的优点,使用AgdB与环糊精葡萄糖基转移酶复配制备难消化糊精,其产物α-1,6-糖苷键含量高,符合难消化糊精的特性。但受限于α-葡萄糖苷酶产物键型较单一,聚合度较低,最终的慢消化和抗消化成分不高。本研究的目的即是通过对该构巢曲霉来源的α-葡萄糖苷酶进行改造,提高其产物的键型复杂程度及聚合度,从而达到提高难消化糊精制备得率的目的。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
大肠杆菌(Escherichia coli)、毕赤酵母(Pichia pastoris) GS115及含有构巢曲霉(Aspergillus nidulans)来源的α-葡萄糖苷酶基因的质粒pPIC9K均保藏于作者所在实验室。
1.1.2 材料与试剂
麦芽糊精,菏泽天邦生物制品有限公司产品;嗜热芽胞杆菌(Bacillus stearothermophilus) NO2来源的环糊精葡萄糖基转移酶(cyclodextrin glycosyltransferase ,CGTase),自制并保藏于本实验室;葡萄糖淀粉酶[A7095,EC 3.2.1.3来源于黑曲霉菌(Aspergillus niger)]、胰酶[P7545,EC 232-468-9,8×USP,USP指美国药典(United States pharmacopeia),8×USP表示这个胰酶活性达到了美国药典标准的8倍],美国Sigma-Aldrich公司;葡萄糖检测试剂盒,北京利德曼生化股份有限公司;葡萄糖、麦芽糖、麦芽三糖、麦芽三糖、麦芽五糖、麦芽六糖混标(G1~G6),上海慧诚生物;异麦芽糖、潘糖、异麦芽三糖标准品,日本Glycarbo公司产品;其他试剂均为国产分析纯,上海国药集团。
培养基为培养大肠杆菌及毕赤酵母常用培养基:LB、TB、酵母浸出粉胨葡萄糖培养基(yeast extract peptone dextrose medium,YPD)、甘油缓冲复合培养基(buffered glycerol-complex medium,BMGY) 、诱导表达培养基(buffered methanol-complex medium,BMMY)等培养基。
1.2 仪器与设备
Waters 1525型高效液相色谱仪、2414 RID示差检测器,美国沃特世公司产品;HYPERSIL APS2(250 mm×4.6 mm, 5 μm)色谱柱Dionex ICS-5000 HPIC高压离子色谱仪系统,美国赛默飞公司产品;AVANCE NEO 600MHz全数字化核磁共振波谱仪,德国布鲁克公司。
1.3 实验方法
1.3.1 AnidAgdB突变位点的选择
来自大豆曲霉(Aspergillus sojae)的α-葡萄糖苷酶AgdL具有很强的转糖基化活性[6],产生α-1,6-糖苷键,产物聚合度较高,其晶体结构[PDB(protein data bank):7XOI]已被解析。来自酱油曲霉(Aspergillus oryzae)的α-葡萄糖苷酶AgdS产物既含α-1,6-糖苷键,又含α-1,3-糖苷键。经多序列比对发现,AgdB、AgdS、AgdL三者序列相似度高。因此以AgdL的结构为模板,使用实验室搭建的AlphaFold2进行同源建模,获得AgdS、AgdB蛋白的模拟结构。将AgdB分别与AgdL和AgdS进行结构比对,推测可能与产物键型、聚合度相关的关键氨基酸残基位点,构建突变体。
1.3.2 引物
基于突变位点的选择设计引物如表1所示。
表1 AgdB定点突变引物设计
Table 1 Primers of AgdB

注:加粗及下划线为突变氨基酸对应碱基。
引物名称引物序列(5′-3′)Y202A-FORTACACAAGAGATGCCGCTGGTACTCCACY202A-REVTTGTGGAGTACCAGCGGCATCTCTTGTGR450H-FORGCCAACTTTTACAACCATCCTTATCCTGGTAACR450H-REVACCAGGATAAGGATGGTTGTAAAAGTTGGCN466D-FORTTTGCTGAGGCCGATGATAATCCACCAGAACN466D-REVTGGTGGATTATCATCGGCCTCAGCAAACTCTTCA445S-FORGATATGAACGAACCCTCTAACTTTTACAACA445S-REVGTTGTAAAAGTTAGAGGGTTCGTTCATATC
1.3.3 AnidAgdB突变体的构建
实验室前期构建了E.coli JM3-pPIC9K-AgdB菌株。提取质粒后使用两步法PCR对目的基因进行定点突变。第一步,将模板与上下游引物分开进行PCR,扩增程序为98 ℃预变性5 min;98 ℃变性30 s,55 ℃退火30 s,72 ℃延伸3 min,共3个循环;72 ℃再延伸5 min。第二步,将第一步的PCR反应液收集到一个PCR管中,程序与第一步一致,但循环数改为15。连接产物经消除模板后转化到E.coli JM109,挑取阳性克隆进行DNA测序,鉴定突变位点是否成功突变。
1.3.4 α-葡萄糖苷酶及CGTase酶液的制备
将测序正确的突变体质粒转化到P.pastoris GS115,使用组氨酸缺陷型固体培养基MD平板对转化子进行筛选,挑取阳性转化子到YPD培养基中,使用毕赤酵母常用培养方法培养构巢曲霉来源α-葡萄糖苷酶野生型及突变体。以E.coli BL21(DE3)为宿主,对CGTase基因进行表达,使用大肠杆菌常用培养方法培养对应重组菌株。发酵结束后于8 000 r/min下离心20 min收集上清液,即得到对应粗酶液。
1.3.5 酶活力测定
α-葡萄糖苷酶转苷酶活力在pH 5.5的50 mmol/L乙酸-乙酸钠缓冲液中测定,使用该缓冲液将麦芽糖稀释成50 g/L的麦芽糖溶液。在45 ℃下,以900 μL麦芽糖溶液为底物,加入100 μL稀释一定倍数的酶液,精确反应5 min后煮沸灭酶。体系中转苷生成的异麦芽糖、异麦芽三糖、潘糖含量由HPLC测定[7]。酶活力定义:在上述条件下,将每分钟催化转苷1 μmol葡萄糖基所需的酶量定义为一个酶活力单位。α-葡萄糖苷酶水解酶活力同样在pH 5.5的50 mmol/L乙酸钠缓冲液中测定。取900 μL缓冲液及50 μL的10 mmol/L pNP-α-G底物于45 ℃孵育10 min后,加入50 μL稀释一定倍数的酶液,45 ℃下精确反应15 min后加入0.2 mL 1 mol/L Na2CO3溶液中止反应并显色,于405 nm处测定其吸光度值。酶活力定义:上述条件下,每分钟时间催化产生 1 mmol pNP-α-G的酶量为一个酶活力单位。CGTase的歧化酶活力测定方法参考VAN DER VEEN等[8]的外源性聚合物(exopolysaccharide,EPS)法。酶活力定义:该测定条件每分钟转化1 μmol EPS所需的酶量定义为一个酶活力单位。
1.3.6 酶转化产物糖苷键键型的检测
采用核磁共振波谱法(nuclear magnetic resonance spectroscopy,NMR)进行测定。以溶于50 mmol/L pH 5.5乙酸-乙酸钠缓冲液的质量浓度300 g/L的麦芽糊精为底物,加入5 U/g底物的α-葡萄糖苷酶酶液,在45 ℃下于转速为200 r/min水浴摇床中反应12 h,煮沸灭酶后离心取上清液。冷冻干燥后,称取样品多糖30 mg,添加500 μL的重水D2O溶解,其中含质量浓度为3 mg/L的3-(三甲基硅基)丙炔酸用于调整1H NMR化学位移的内标,然后吸取溶液至核磁共振管中。1H NMR光谱使用数字化核磁光谱仪,检测温度设置为298 K。
1.3.7 难消化糊精的制备
以溶于50 mmol/L pH 5.5乙酸-乙酸钠缓冲液的质量浓度300 g/L的麦芽糊精为底物,加入5 U/g底物的α-葡萄糖苷酶酶液及7 U/g底物CGTase酶液,在45 ℃下于转速为200 r/min水浴摇床中反应一定时间,反应完成后煮沸灭酶。将反应液离心取上清液进行冷冻干燥,所得白色固体为难消化糊精样品。
1.3.8 体外模拟酶水解法消化性测定
参照Englyst法进行体外消化实验,并稍作修改[9]:精确称取100 mg样品,分散于2.5 mL的醋酸钠缓冲液(0.25 mol/L、pH 5.2)中,沸水浴加热30 min使样品充分糊化,随后于37 ℃、160 r/min水浴摇床中预热10 min。随后,加入0.83 mL混酶液,模拟小肠消化过程。模拟小肠消化20、120 min时,分别于吸取200 μL消化液于5 mL 66.6%乙醇中终止反应,混合物于3 500 r/min室温离心5 min后,准确吸取0.05 mL上清液,用葡萄糖氧化酶法测定葡萄糖含量,并计算快消化淀粉(rapidly digestible starch,RDS)、慢消化淀粉(slowly digestible starch,SDS)和抗性淀粉(resistant starch,RS)组分的比例。
具体计算如公式(1)~公式(3)所示:
RDS/%=G20×0.9×100
(1)
SDS/%=(G120-G20)×0.9×100
(2)
RS/%=100-RDS-SDS
(3)
式中:G20表示样品消化20 min产生的葡萄糖比例,G120表示样品消化120 min产生的葡萄糖比例。
2 结果与分析
2.1 AnidAgdB突变位点的选择
将AsojAgdL、AnidAgdB、AoryAgdS进行序列比对发现三者之间序列一致性极高。用实验室搭建的AlphaFold2以AgdL为模板对AsojAgdL、AnidAgdB、AoryAgdS进行模拟(图1)。比对发现,三者均具有经典(β/α)8桶催化结构域[6],主链结构几乎重叠,但受体位点区域存在差异,推测可能与产物键型或聚合度有关。最终选择了A445、R450、N466为突变位点,同时因为Y202可能是AnidAgdB高转苷的关键位点[10]。由此设计了突变体Y202A、A445S、R450H、N466D。

图1 三种来源α-葡萄糖苷酶AsojAgdL、AnidAgdB、AoryAgdS蛋白质模拟结构比对
Fig.1 Alignment of the modeling structure of AgdB, AgdS with the crystal structure of AgdL
注:图中黄色标注的是催化关键氨基酸催化三联体中的酸碱催化残基和亲核残基;彩色标记的为选择突变的位点:绿色为AsojAgdL,粉色为AnidAgdB,蓝色为AoryAgdS。
2.2 突变酶的表达与纯化
将构建好的突变体质粒转化到P.pastoris GS115感受态中,使用组氨酸缺陷型固体培养基MD平板对转化子进行筛选。在30 ℃条件下,培养96 h后,突变体N446D、R450H、A445S、Y202A成功表达。发酵液离心后上清液经超滤浓缩,SDS-PAGE检测显示其蛋白条带出现在74 kDa和55 kDa处,是因为该酶由大小亚基组成[10],与理论分子质量相符(图2)。
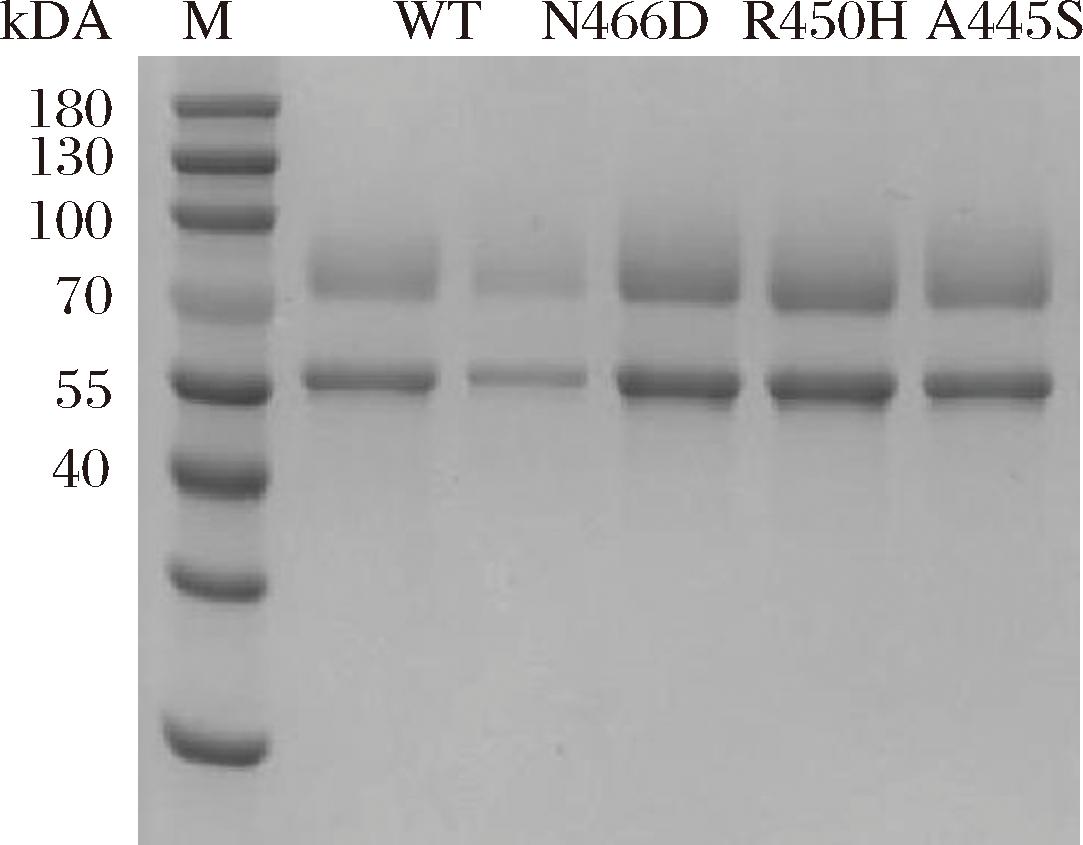
M-蛋白标准分子量;WT-AgdB野生型;N446D、R450H、A445S、Y202A-突变体
图2 AgdB野生型及突变体的SDS-PAGE电泳检测
Fig.2 SDS-PAGE analysis of AgdB and mutants
2.3 突变酶的酶活特性
对所有突变体及野生型检测其转苷酶活力(以麦芽糖为底物)和水解酶活力(pNP-α-G法)并计算转苷水解比,转苷水解比能体现α-葡萄糖苷酶的转苷能力[11],由表2可知,可以看出突变体仍保留了高转苷能力的特性。
表2 野生型及突变体酶活
Table 2 Enzyme activity of WT and mutants

组别水解酶活力/(U/mL)转苷酶活力/(U/mL)蛋白质量浓度/(mg/mL)水解纯酶活力/(U/mg)转苷纯酶活力/(U/mg)转苷水解比WT0.1522.700.520.2943.54151.46N466D0.0215.060.250.1061.12620.02R450H0.0917.270.440.2239.54182.86Y202A0.0114.680.640.0223.091 064.23A445S0.17 17.51 0.54 0.31 32.50 105.82
2.4 突变体的产物性质分析
以麦芽糖为底物使用突变体进行酶转化,酶转化产物用高效离子色谱检测组分(图3)。标品分别使用了混标标样(从左到右依次为异麦芽糖、曲二糖、异麦芽三糖、黑曲霉二糖、潘糖)和混标G1~G6(从左到右为葡萄糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖)。结果显示,突变体Y202A、N466D、R450H、A445S在以麦芽糖为底物时生成了更多高聚合度的糖(R450H为15 min处,其余为11 min处)。酶转化产物用核磁共振波谱仪检测糖苷键键型比例(图4)。其中,化学位移4.99处的峰为α-1,6糖苷键的特征峰,化学位移5.16、5.34、5.40处的特征峰对应α-1,2、α-1,3、α-1,4糖苷键。除突变体A445S外,α-1,6键比例均显著下降,α-1,4键比例升高。其中,N466D产物的α-1,4键比例升高最突出,突变体R450H产物α-1,3键型比例提高最多,产物键型更复杂(表3)。
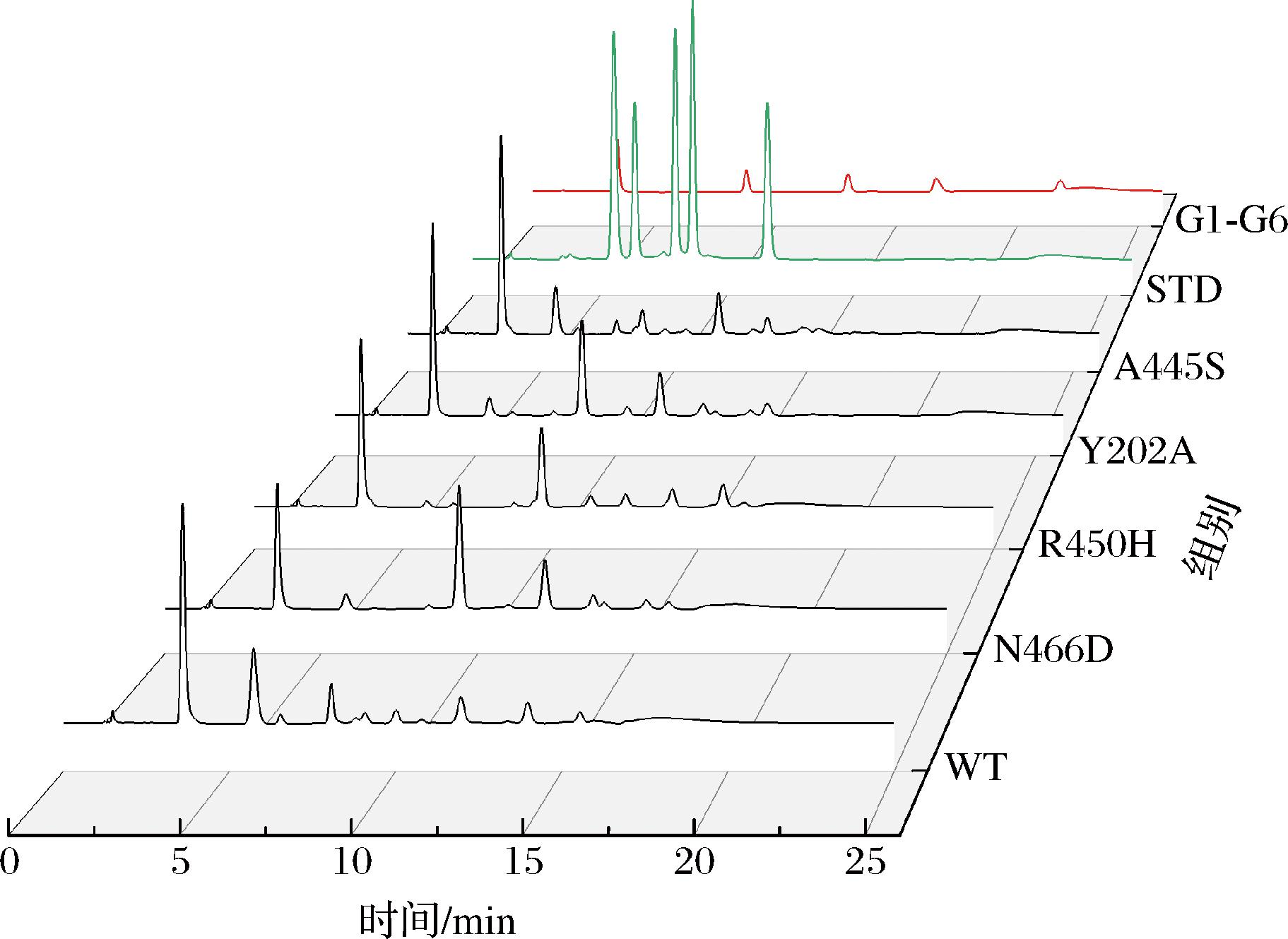
图3 突变体及野生型产物组分
Fig.3 Content of products by WT and mutant

图4 野生型及突变体产物核磁图谱
Fig.4 NMR of products by WT and mutants
表3 野生型及突变体α-1,4,α-1,3,α-1,6键型比例 单位:%
Table 3 Ratio of α-1,4,α-1,3,α-1,6 bonds in wild type and mutants

组别 1,4键型1,3键型1,6键型WT16.78.275.1A445S20.28.571.3R450H38.825.635.7N466D57.18.634.3Y202A43.36.949.8
2.5 使用突变酶复配制备难消化糊精
分别使用野生型、突变体与环糊精葡萄糖基转移酶复配制备难消化糊精。经冷冻干燥处理后,对样品进行体外模拟消化性实验,结果如表4所示。就快消化成分而言,突变体R450H、A445S、Y202A复配产物的快消化成分均较野生型有明显下降。其中,突变体A445S和Y202A的复配产物快消化成分相较于野生型的55.5%,分别下降到了43.18%和41.7%。而突变体N466D的快消化成分却有所增长,推测是突变后产物α-1,4糖苷键含量过高的原因。分析抗消化成分的变化则可以看出(图5、表5),R450H和Y202A的复配产物抗消化成分相较于野生型的28.79%分别上升到了42.92%和47.04%,原因是产物的α-1,3键含量增多,而α-1,3键比α-1,6键更难被水解所致。经改造后,突变体仍保留了高转苷特性,在此基础上转苷产物聚合度上升的突变体R450H、A445S、Y202A均能使复配产物抗消化性提升。由此可见,对α-葡萄糖苷酶进行改造时,在不显著提高α-1,4键的前提下,增加α-1,3键的比例,使产物键型更复杂,或增加产物聚合度,均能有效降低快消化组分、增加抗消化组分。
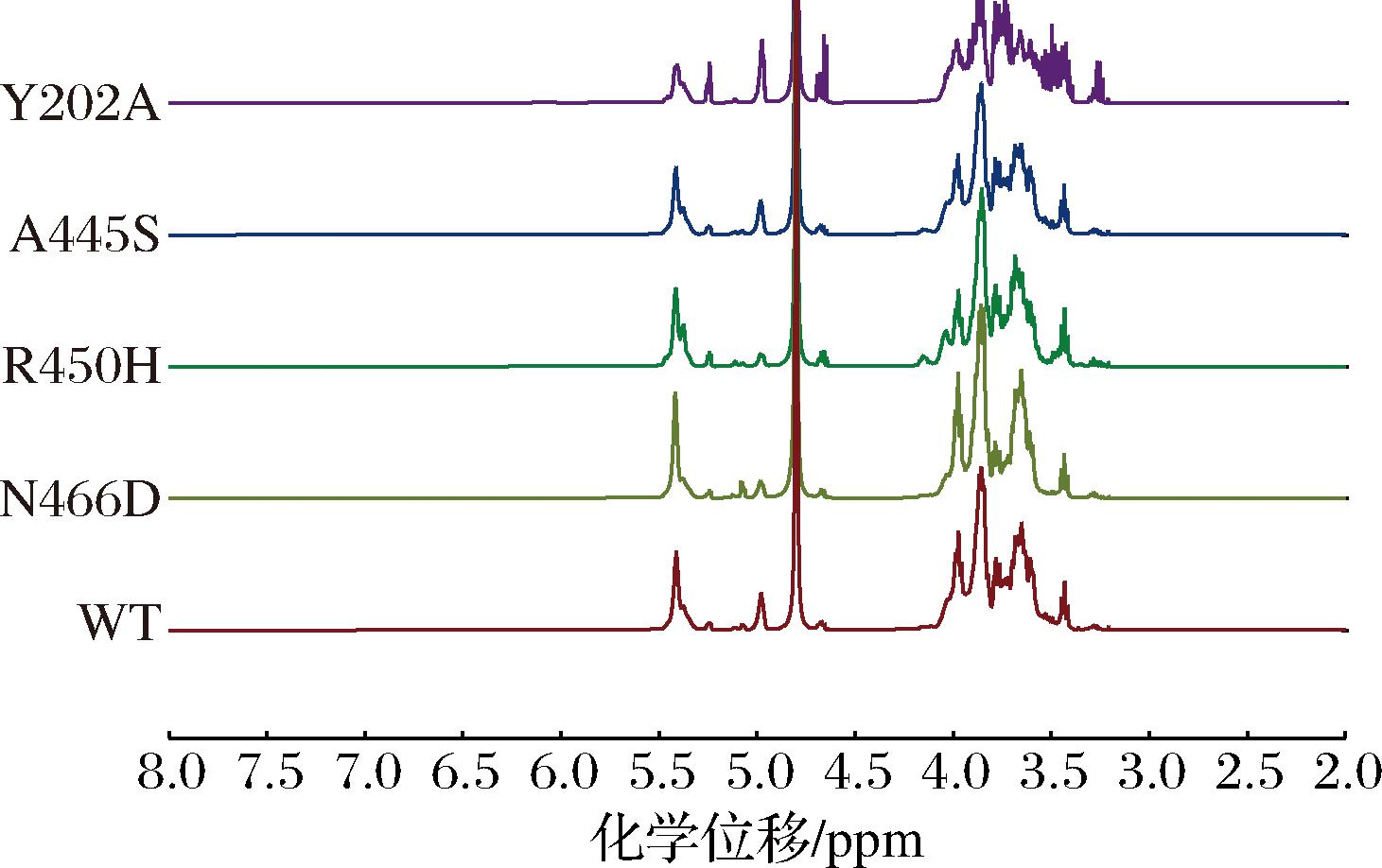
图5 野生型及突变体复配产物核磁图谱
Fig.5 NMR of compound product by WT and mutants
表4 野生型及突变体产物的体外消化性 单位:%
Table 4 In vitro digestibility of the wild-type and mutant products
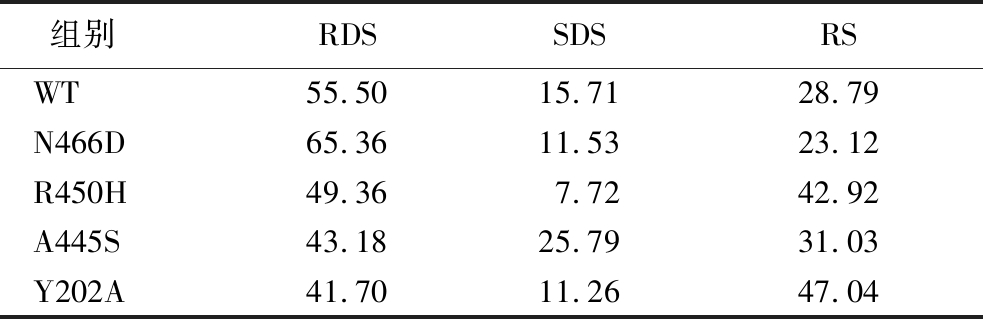
组别 RDSSDSRSWT55.50 15.71 28.79 N466D65.36 11.53 23.12R450H49.36 7.72 42.92A445S43.18 25.79 31.03Y202A41.70 11.26 47.04
表5 野生型及突变体复配产物α-1,4,α-1,3,α-1,6键型比例 单位:%
Table 5 The ratio of α -1,4, α -1,3, α -1,6 bond types of compound product by WT and mutants

组别 1,4键型1,3键型1,6键型WT56.715.627.7N466D71.913.114.9R450H52.637.010.4A445S46.028.625.5Y202A31.431.137.5
3 讨论
构巢曲霉来源的α-葡萄糖苷酶转苷能力强而水解能力弱。研究者首先对多个来源的α-葡萄糖苷酶进行多序列比对及结构分析,并根据结果对构巢曲霉来源的α-葡萄糖苷酶AgdB进行了改造,探究了影响α-葡萄糖苷酶产物键型或聚合度的关键氨基酸位点,接着研究了突变体对复配制备难消化糊精的影响。结果表明,以麦芽糊精为底物时,增加α-葡萄糖苷酶产物的α-1,3键比例或增加其产物聚合度,可以有效降低在与环糊精葡萄糖基转移酶复配制备抗消化糊精时产物的快消化成分,使抗消化性提高。本研究结果能够为高品质难消化糊精的开发提供新的思路,在后续对酶的改造中,也可对产物键型、聚合度做进一步探究,进一步提高难消化糊精的比例。
[1] SONG Y B, LAMOTHE L M, ESMERALDA NAVA RODRIGUEZ N, et al.New insights suggest isomaltooligosaccharides are slowly digestible carbohydrates, rather than dietary fibers, at constitutive mammalian α-glucosidase levels[J].Food Chemistry, 2022, 383:132456.
[2] OKUMA K, MATSUDA I.Indigestible fractions of starch hydrolysates and their determination method[J].Journal of Applied Glycoscience, 2002, 49(4):479-485.
[3] 李泽润, 田延军, 黄艳红, 等.不同制备工艺对抗性糊精构效的影响[J].食品科学, 2023, 44(11):79-85.LI Z R, TIAN Y J, HUANG Y H, et al.Effect of different preparation techniques on the structure-activity of resistant dextrin[J].Food Science, 2023, 44(11):79-85.
[4] LIU Z Z, LIU J, REN L Q, et al.Preparation of high-quality resistant dextrin through pyrodextrin by a multienzyme complex[J].Food Bioscience, 2022, 47:101701.
[5] 李泽西, 张睿逸, 何萌, 等.高温酸解结合酶法改性制备高品质抗性糊精[J].中国食品添加剂, 2022, 33(12):1-7.LI Z X, ZHANG Y R, HE M, et al.Thermal-acid treatment combined with enzymatic modification for high-quality resistant dextrin preparation[J].China Food Additives, 2022, 33(12):1-7.
[6] DING Y F, OYAGI A, MIYASAKA Y, et al.Structural basis for proteolytic processing of Aspergillus sojae α-glucosidase L with strong transglucosylation activity[J].Journal of Structural Biology, 2022, 214(3):107874.
[7] 许滢,王蕾,魏贝贝, 等.高聚合度异麦芽寡糖的制备及体外益生功能评价[J].食品与生物技术学报, 2023, 42(1):66-74.XU Y, WANG L, WEI B B, et al.Synthesis of isomaltooligosaccharides with high degree of polymerization and its in vitro probiotic function evaluation[J].Journal of Food Science and Biotechnology, 2023, 42(1):66-74.
[8] VAN DER VEEN B A, LEEMHUIS H, KRALJ S, et al.Hydrophobic amino acid residues in the acceptor binding site are main determinants for reaction mechanism and specificity of cyclodextrin-glycosyltransferase[J].The Journal of Biological Chemistry, 2001, 276(48):44557-44562.
[9] WEI B B, WANG L, SU L Q, et al.Structural characterization of slow digestion dextrin synthesized by a combination of α-glucosidase and cyclodextrin glucosyltransferase and its prebiotic potential on the gut microbiota in vitro[J].Food Chemistry, 2023, 426:136554.
[10] 任莉琼. 构巢曲霉来源α-葡萄糖苷酶的克隆表达及其应用研究[D].无锡:江南大学,2019.REN L Q.Cloning-expression and application of α-glucosidase from Aspergillus nidulans [D].Wuxi:Jiangnan University, 2019.
[11] DU AN V, NENAD M, DEJAN B, et al.The specificity of α-glucosidase from Saccharomyces cerevisiae differs depending on the type of reaction:Hydrolysis versus transglucosylation[J].Applied Microbiology and Biotechnology, 2014, 98(14):6317-6328.
AN V, NENAD M, DEJAN B, et al.The specificity of α-glucosidase from Saccharomyces cerevisiae differs depending on the type of reaction:Hydrolysis versus transglucosylation[J].Applied Microbiology and Biotechnology, 2014, 98(14):6317-6328.