β-胡萝卜素是一种橙色类胡萝卜素,主要存在于水果、蔬菜和藻类中。β-胡萝卜素作为四萜家族的一员,具有重要的生物学价值,可作为一种抗氧化剂,增强人体免疫力,还具有抗癌作用[1]。它也是维生素A的前体,在药品、营养保健品、化妆品和食品中有许多应用[2]。随着人们健康意识的不断提高,营养保健品的市场价值逐步增长,市场前景广阔,类胡萝卜素的应用受到了广泛关注,特别是β-胡萝卜素、虾青素、番茄红素和叶黄素。根据预测,到2027年,全球类胡萝卜素市场规模有望从2022年的20亿美元增长至27亿美元,复合年增长率将达到5.7%(https://www.bccresearch.com/market-research/food-and-beverage/the-global-market-for-carotenoids.html)。目前,β-胡萝卜素的生产主要依靠天然提取、化学合成和微生物合成[3]。天然提取一般是从植物、蔬菜和藻类中提取,提纯工艺困难,收率低。化学合成存在需要多步反应、反应过程不环保、伴随副产物和有害物质的产生等问题。微生物合成具有产品产量高、无副产物形成、生产成本低、生产条件温和、使用更少的人力和工艺环保等优点,因此,构建微生物细胞工厂来异源合成β-胡萝卜素越来越受到研究者的关注。
β-胡萝卜素因其众多的生物学功能,市场需求日益增长,急需开发新型的生物技术生产平台。使用合成生物学技术来合成β-胡萝卜素这项研究已取得重大进展,例如代谢工程策略的创新、发酵水平的优化以及底盘细胞选择的多样化等,使得β-胡萝卜素的产量有着显著的提高,但是由于生物技术水平的限制,距离进行工业化生产还是有一定的差距。因此,本文对β-胡萝卜素的理化性质、生物合成途径和目前研究现状进行综述,系统总结了合成β-胡萝卜素的代谢工程策略,并提出利用合成生物学技术生产β-胡萝卜素存在的问题及未来的研究方向,为构建β-胡萝卜素的微生物细胞工厂以及其他天然产物的生物合成提供参考。
1 理化性质及作用
β-胡萝卜素是一种类异戊二烯化合物,是在植物和微生物中发现的一种脂溶性类胡萝卜素,化学式为C40H56,相对分子质量为536.88,熔点约为178 ℃。β-胡萝卜素是由8个异戊二烯单元和2个β-紫罗酮环构成的四萜化合物,其分子完全由碳和氢组成,核心结构含有40个碳原子。在自然界中,大多数β-胡萝卜素以全反式形式存在,少数是顺式结构,其具体结构如图1所示。β-胡萝卜素由于共轭双键和中心对称性而具有脂溶性和高度疏水性[4]。β-胡萝卜素在不同的溶剂中具有不同的溶解度,易溶于氯仿、丙酮等有机溶剂,不溶于水。该物质对光和热均不稳定,易分解,需低温避光保存[5],并且在提取β-胡萝卜素时,常需加入维生素C或2,6-二叔丁基对甲酚等抗氧化剂来防止其被氧化分解,提高稳定性。
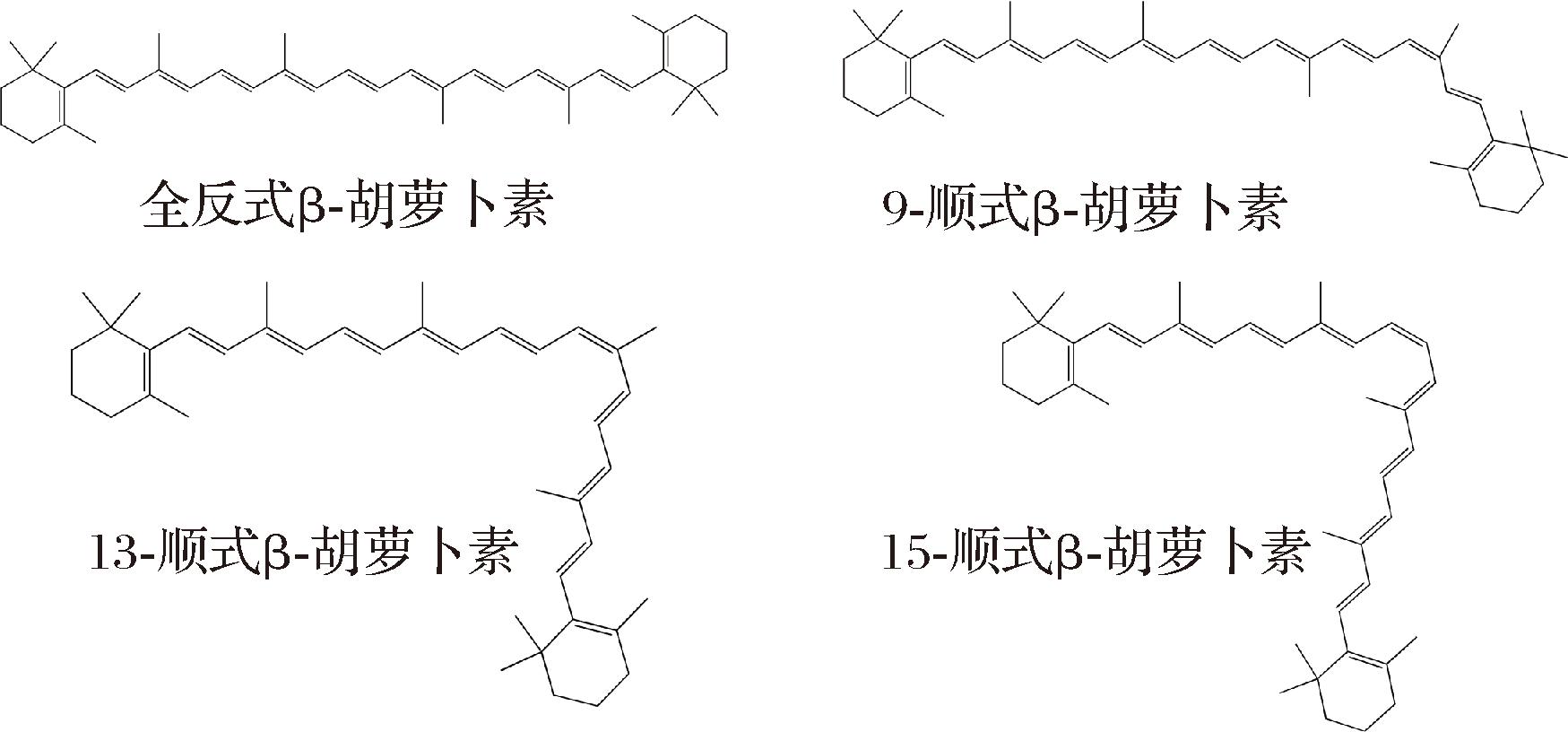
图1 β-胡萝卜素的化学结构式
Fig.1 Chemical structure of β-carotene
β-胡萝卜素具有多种预防和治疗疾病的作用,有益于人体健康。首先,β-胡萝卜素有预防癌症的作用,有研究指出,β-胡萝卜素的摄入量与患肺癌风险之间存在显著关联,即摄入更多的β-胡萝卜素有助于降低患肺癌的风险[6]。其次,β-胡萝卜素还具有预防心血管疾病的功能,能够抑制巨噬细胞介导的低密度脂蛋白氧化修饰的能力,进而降低动脉粥样硬化的风险,减少心血管疾病和相关死亡病例的发生[7]。更值得一提的是,β-胡萝卜素作为一种高效的抗氧化剂,能够清除人体内的氧自由基,具备高效的单线态氧猝灭能力。此外,β-胡萝卜素作为一种维生素A原,是维生素A的重要来源,对于细胞分化、胚胎发育以及预防干眼病起着至关重要的作用,同时也有助于增强免疫系统,提高抵抗感染的能力[8]。β-胡萝卜素的潜在健康益处不断被挖掘,富含β-胡萝卜素的功能性食品的开发和利用也日益增多[9]。因此,构建微生物细胞工厂以高效合成β-胡萝卜素的生物合成技术显得极具市场应用价值。
2 β-胡萝卜素生物合成途径
类胡萝卜素是由异戊二烯骨架构成的四萜化合物,β-胡萝卜素的生物合成是类胡萝卜素合成代谢的一部分。异戊二烯焦磷酸(isopenteny diphosphate, IPP)和二甲基丙烯焦磷酸(dimethylallyl diphosphate, DMAPP)是合成番茄红素、β-胡萝卜素和其他类胡萝卜素的初始结构单元[10]。IPP和DMAPP的合成主要来源于2种途径:胞质内的甲羟戊酸(mevalonic acid, MVA)途径和质体内的甲基赤藓糖醇(methyl erythritol phosphate, MEP)途径。β-胡萝卜素的生物合成途径大致可以分为上下游两部分, 上游生物合成途径即为利用MVA与MEP途径得到五碳前体IPP的生物合成模块,下游途径即为五碳前体转化为β-胡萝卜素的β-胡萝卜素生物合成模块(图2)。

图2 β-胡萝卜素的生物合成途径
Fig.2 Biosynthetic pathway of β-carotene
注:甲羟戊酸激酶 (mevalonate kinase,MVK);磷酸甲羟戊酸激酶(phosphomevalonate kinase, MPK);甲羟戊酸焦磷酸脱羧酶(mevalonate pyrophosphate decarboxylase,MVD1) ;甘油醛-3-磷酸(glyceraldehyde-3-phosphate,G3P);香叶基香叶基二磷酸合酶(geranylgeranyl diphosphate synthase,CrtE) ;法尼基二磷酸合酶(farnesyl diphosphate synthase,IspA); 2-C-甲基-D-赤藓醇-4-磷酸胞苷酰转移酶(2-C-methyl-D-erythritol 4-phosphate cytidylyltransferase,IspD);4-胞啶-2-C-甲基-D-赤藓醇激酶(4-(cytidine 5′-diphospho)-2-C-methyl-D-erythritol kinase,IspE); 2-C-甲基-D-赤藓醇激酶(2-C-methyl-D-erythritol 2,4-cyclodiphosphate synthase,IspF); 4-羟基-3-甲基乙烯基-2-磷酸合酶((E)-4-hydroxy-3-methylbut-2-enyl-diphosphate synthase,IspG); 4-羟基-3-甲基乙烯-2-烯基-二磷酸还原酶(4-hydroxy-3methylbut-2-enyl diphosphate reductase,IspH)。
2.1 IPP生物合成模块
MVA途径存在于大多数真核生物、古细菌和高等植物中,利用糖酵解产生的乙酰辅酶A (acetyl-coenzyme A,acetyl-CoA)作为初始底物,2分子的乙酰CoA通过乙酰乙酰CoA硫解酶(acetoacetyl-CoA thiolase, AACT)合成乙酰乙酰CoA(acetoacetyl-CoA, AACoA),然后通过羟甲基戊二酸CoA合酶(hydroxymethylglutaryl-CoA synthase, HMGS)缩合形成3-羟基-3-甲基戊二酰CoA(hydroxymethylglutaryl-CoA, HMG-CoA)。最后,HMG-CoA由羟甲基戊二酰CoA还原酶(hydroxymethylglutaryl-CoA reductase, HMGR)还原为MVA,这是一个不可逆反应,为MVA途径的主要限速步骤[11]。然后在多种酶的连续催化下,经过磷酸化和脱羧将MVA转化为IPP,IPP在异戊烯基二磷酸异构酶(isopentenyl diphosphate isomerase, IDI)的催化下可以异构化为DMAPP。
同时存在于许多细菌、藻类和植物中的MEP途径以丙酮酸和甘油醛-3-磷酸为原料,在1-脱氧-D-木酮糖-5-磷酸合酶(1-deoxy-D-xylulose-5-phosphate synthase, DXS)的催化下缩合形成1-脱氧-D-木酮糖-5-磷酸(1-deoxy-D-xylulose-5-phosphate,DXP)。然后脱氧木酮糖磷酸盐还原异构酶(1-deoxy-D-xylulose-5-phosphate reductoisomerase, DXR)将DXP转化为MEP,最后在多种酶的作用下进一步形成IPP和DMAPP。DXS和IDI被认为是异戊二烯合成途径中的限速酶,增强这2种酶的活性可以提高β-胡萝卜素的产量[12]。除了合成类胡萝卜素外,IPP和DMAPP也是合成许多重要药物的前体,如青蒿素、齐墩果酸和角鲨烯等。
2.2 β-胡萝卜素生物合成模块
在β-胡萝卜素生物合成模块中,IPP在一系列酶的生物催化下发生缩合、环化等修饰生成β-胡萝卜素,β-胡萝卜素的合成主要发生在藻类的叶绿体或微生物的细胞质中。具体是由MVA和MEP途径产生的IPP和DMAPP分子通过连续的酶促反应依次缩合生成牻牛儿基焦磷酸(geranyl pyrophosphate, GPP)、法尼基焦磷酸(farnesyl pyrophosphate, FPP)和牻牛儿基牻牛儿基焦磷酸(geranylgeranyl pyrophosphate, GGPP)。然后两分子的GGPP首先通过八氢番茄红素合酶(phytoene synthase, CrtB)转化为八氢番茄红素,然后通过八氢番茄红素脱氢酶(phytoene desaturase, CrtI)进一步转化为番茄红素。形成的番茄红素可以在番茄红素β-环化酶(lycopene-β-cyclase, CrtY)的催化下环化成β-胡萝卜素,也可以作为合成其他类胡萝卜素的前体。在研究中发现CrtYB是一种双功能酶,既可以负责GGPP转化为八氢番茄红素,还可以将番茄红素环化为β-胡萝卜素[13]。来自于Mucor circinelloides的CarRP也是一种具有2种不同酶活性的蛋白质,其同时具有八氢番茄红素合酶和番茄红素环化酶的催化活性[14]。此外,IWASAKA等[15]还发现在Aurantiochytrium sp.Strain KH105中发现一种三功能酶CrtIBY,可以直接将GGPP转化为β-胡萝卜素。
3 微生物合成β-胡萝卜素的相关研究进展
由于β-胡萝卜素的潜在商业价值,构建微生物细胞工厂来生产β-胡萝卜素越来越受到关注。利用分子生物学手段,将β-胡萝卜素合成途径的多个关键基因过表达,显著提高了β-胡萝卜素在细菌、酵母和藻类中的积累。目前用于生产β-胡萝卜素的底盘微生物主要有大肠杆菌、酿酒酵母和解脂耶氏酵母等,其中部分产量相当可观,具体改造策略和产量已在表1中列出。
表1 合成β-胡萝卜素细胞工厂的构建示例
Table 1 Construction examples of a synthetic β-carotene cell factory

底盘细胞改造策略生产规模产量文献大肠杆菌对MEP途径、ATP合成、TCA循环、磷酸戊糖途径和β-胡萝卜素合成途径进行模块化调控,增加前体IPP和辅因子的供应7 L生物反应器2.1 g/L[18]通过膜工程改变细胞膜的形态,增加膜表面积,提高其贮存β-胡萝卜素的能力摇瓶44.2 mg/g[28]建立了一种新的人工膜囊泡转运系统,并调控相关基因的表达,敲除tolR和nlpI,过表达AccABCD 和PlsBC摇瓶44.8 mg/g[29]使用调控元件对大肠杆菌内源MEP途径的7个基因和ispA基因进行表达调控摇瓶17.59 mg/g[30]对中心碳代谢进行调控以及提高NADPH的供应,如磷酸转移酶系统和磷酸戊糖途径的调控5 L生物反应器2 579.1 mg/L[31]引入外源MVA途径,过表达FNI、GPPS2和MEP途径,以及优化培养条件摇瓶256.8 mg/L[20]酿酒酵母利用外源性有机酸结合代谢工程方法,扩大β-胡萝卜素的贮存能力和增强生物合成途径的代谢通量,并且动态下调角鲨烯合酶ERG9的表达摇瓶142 mg/L[32]将脂质代谢途径的通量重定向到β-胡萝卜素的合成,过表达甾醇酰基转移酶ARE1和ARE2并敲除磷脂酸磷酸酶PAH1、DPP1和LPP1摇瓶8.98 mg/g[33]发现提高β-胡萝卜素产量的几个新靶点,如DID2摇瓶5.9 mg/g[34]通过结合改良的GAL调节系统和HXT1启动子控制的角鲨烯合成途径来进行有序调控5 L生物反应器1 156 mg/L[23]解脂耶氏酵母 增强胞内脂质的积累,过表达tHMGR,增加相关基因的拷贝数,优化工艺条件和培养基5 L生物反应器2.7 g/L[25]去除番茄红素环化酶的底物抑制,平衡β-胡萝卜素和脂质合成之间的乙酰CoA通量3 L生物反应器39.5 g/L[35]β-胡萝卜素生物合成途径中多拷贝基因的迭代整合2 L生物反应器4 g/L[26]代谢工程与形态学工程结合,整合β-胡萝卜素生物合成途径中13个基因的多个拷贝,敲除CLA4和MHY1基因进行形态改造,抑制菌丝形成,将菌丝体转化回酵母形式1 L生物反应器7.6 g/L[36]将CRISPR/Cas9系统(clustered regularly interspaced short palindromic repeat/CRISPR-associ-ated protein 9)与发酵工艺相结合,增加 carB和carRP基因的拷贝数以及过表达MVA途径5 L生物反应器4.5 g/L[37]路径基因启动子的组合适配并结合发酵条件优化5 L生物反应器6.5 g/L[27]
大肠杆菌是一种非常常见的模式微生物,因其遗传背景清楚、遗传操作简单、生长速度快等优势使大肠杆菌逐渐成为构建微生物细胞工厂最常用的底盘细胞之一,是一种理想的宿主细胞。戴冠苹等[16]利用RBS文库在大肠杆菌菌株CAR005 中调控β-胡萝卜素合成途径中的关键基因dxs、idi和crt操纵子的表达,提高β-胡萝卜素的产量,crt操纵子、dxs和idi基因的联合调控使β-胡萝卜素产量提高了35%。五碳前体IPP和辅助因子是生产萜类化合物的2个重要因素。因此,通过在大肠杆菌中过表达MEP途径中的限速酶DXS,以提高IPP的碳通量,类胡萝卜素的产量增加了3.5倍[17]。ZHAO等[18]将来源于Pantoea agglomerans的β-胡萝卜素合成基因整合到大肠杆菌基因组中,然后设计中枢代谢模块以增加前体物质(IPP和DMAPP)以及辅因子(ATP和NADPH)的供应,从而提高β-胡萝卜素的产量,最后进行补料分批发酵得到2.1 g/L的β-胡萝卜素。MVA途径在类异戊二烯化合物合成方面具有巨大潜力,完整MVA途径和β-胡萝卜素合成基因的异源表达,使工程大肠杆菌中β-胡萝卜素的产量增加到了465 mg/L[19]。在工程大肠杆菌中,YANG等[20]通过同时过表达MEP和MVA途径来提高胞内IPP和GPP的浓度,导致β-胡萝卜素的产量显著提升,最终发酵得到了3.2 g/L的产量。
酿酒酵母被普遍认为是一种安全的酵母菌,因其遗传操作简单和对生产条件的耐受性等特点,使其在工业化生产中得到广泛应用,被用作生产各种高附加值化合物的宿主。虽然酿酒酵母自身不产生β-胡萝卜素,但它会天然合成GGPP这一重要的前体物质,如果在酿酒酵母中异源表达CrtB、CrtI以及Crt Y,就可以达到生产β-胡萝卜素的目的。YAMANO等[21]首次在酿酒酵母中报道了β-胡萝卜素的异源生产,他们通过表达来自Pantoea ananatis的crtE、crtB、crtI和crtY基因实现了番茄红素和β-胡萝卜素的产生,但是产量很低,仅有103 ug/g。为了进一步提高β-胡萝卜素的产量,调控关键基因的表达,VERWAAL等[22]在酿酒酵母里初步构建了β-胡萝卜素的细胞工厂,并且过表达了GGPP合酶和tHMG1,重组酿酒酵母最终产生5.9 mg/g的β-胡萝卜素。生物合成过程中维持代谢流的平衡和基因的可控表达是高效生产高附加值化学品的关键。XIE等[23]以β-胡萝卜素生物合成途径中的关键代谢中间产物FPP为节点,进行有序调控,调整下游的通量、提高前体的供应和抑制竞争途径,通过发酵实现了376 mg/L的β-胡萝卜素生产。FAN等[24]将多种代谢策略结合,优化碳代谢途径提高前体物质乙酰CoA的供应、减弱麦角甾醇合成途径和增加β-胡萝卜素的贮存能力,并且优化铜离子诱导的GAL系统提高酿酒酵母的生物量,最终经过多种策略的改造,β-胡萝卜素的滴度达到了约166 mg/L,较改造前的亲本菌株提高了5倍。
解脂耶氏酵母是一种很有前途的非模式真菌,也是不能天然合成β-胡萝卜素,但能够产生大量的乙酰CoA前体和积累大量的脂质,而β-胡萝卜素又是一种脂溶性物质,所以解脂耶氏酵母可能是过量生产β-胡萝卜素的优良宿主。目前各种基因操纵工具已被开发利用,越来越多的科研人员对其进行工程化改造。JING等[25]首先在解脂耶氏酵母中过表达外源基因,构建β-胡萝卜素生物合成途径,通过代谢工程手段解除了MVA途径中的限速步骤,同时进一步提高了工程菌株的脂质合成能力,最后增加合成途径中关键基因的拷贝数,获得能够高效合成β-胡萝卜素的工程菌,进行补料分批发酵可得到2.7 g/L的β-胡萝卜素。结果表明细胞内脂质的增加可以促进β-胡萝卜素的合成,关键基因的多拷贝表达是提高代谢通量的重要手段。GAO等[26]使用较强的启动子及过表达β-胡萝卜素生物合成途径,构建的工程菌比原始菌株产生的β-胡萝卜素产量多出100多倍,并且使用优化培养基进行补料分批发酵,产生4 g/L β-胡萝卜素,这项研究表明解脂耶氏酵母是异源合成β-胡萝卜素的理想宿主。LARROUDE等[27]将传统的代谢工程策略与新型合成生物学工具相结合,强化脂质合成和基因拷贝数以及使用最佳的启动子,导致流向MVA途径的代谢通量增加,大大提高了β-胡萝卜素的产量,补料分批发酵得到β-胡萝卜素的总产量为6.5 g/L。将代谢工程策略与补料发酵工艺相结合,为利用解脂耶氏酵母合成类胡萝卜素和其他萜类化合物提供了新方案。
4 优化策略
随着生物技术的不断创新发展,通过代谢工程和合成生物学技术可以快速、便捷地在解脂耶氏酵母和大肠杆菌等微生物中实现β-胡萝卜素的异源合成,导致β-萝卜素的产量获得不断突破。为了进一步探索提高β-胡萝卜素产量的方法,获得更高的经济效益,还需要对代谢工程策略进行创新。目前,已经发掘了几种可以提高β-萝卜素产量的策略,这些策略主要集中在NADPH和ATP的供应、前体乙酰CoA的供应、削弱竞争途径、细胞区室化和增强脂质合成等(图3)。

图3 异源合成β-胡萝卜素的优化策略
Fig.3 Optimal strategy for heterologous synthesis of β-carotene
4.1 NADPH及ATP的供应
ATP和NADPH是生产萜类化合物的2个重要辅助因子,细胞内辅助因子的水平决定了代谢通量,因为辅助因子可以参与酶促反应并调节化学平衡状态。因此,可以通过调节细胞内辅助因子的水平来提高流向β-胡萝卜素合成的代谢通量。NADPH是生物合成代谢所需还原当量的主要提供者,是保护细胞免受氧化应激的必需还原因子,同时NADPH也被报道为解脂耶氏酵母中脂质合成的主要限速因子[38]。ATP在生物合成、调节代谢和维持细胞生长中起着至关重要的作用,调节细胞内ATP的供应可以有效调节细胞代谢[39]。使用MVA和MEP途径需要超过17步酶促反应和辅酶因子的再生,通过MVA途径合成1分子的IPP需要消耗2分子的NADPH和3分子ATP,使用MEP途径则需要消耗3分子的NADPH和2分子ATP[40]。例如在酵母中通过HMGR将HMG-CoA还原为甲羟戊酸需要NADPH作为辅助因子[41]。因此,一些研究人员试图通过增加NADPH的供应来改善β-胡萝卜素的产量。ZHAO等[18]在大肠杆菌中构建了β-胡萝卜素合成途径,然后设计中枢代谢模块增加ATP和NADPH的供应,以提高β-胡萝卜素的产生,通过调控参与ATP合成的基因、磷酸戊糖途径和三羧酸循环后,β-胡萝卜素产量分别提高了21%、17%和39%,其中三羧酸循环和磷酸戊糖途径模块的组合优化对β-胡萝卜素产量具有协同作用,导致β-胡萝卜素产量提高64%。LIU等[42]探究了解脂耶氏酵母中NADPH的可能来源途径,除磷酸戊糖途径能为胞质提供NADPH外,甘露醇循环、苹果酸酶、醛脱氢酶和谷氨酸脱氢酶都参与了解脂耶氏酵母胞质NADPH的生成,以用于脂质的生物合成。在类胡萝卜素的生物合成途径中,β-胡萝卜素的前体物质是番茄红素,在SUN等[43]的研究中,其通过调节中枢代谢模块中编码α-酮戊二酸脱氢酶、琥珀酸脱氢酶和转醛缩酶B基因的表达,提高NADPH及ATP的供给,使番茄红素产量增加76%,可为β-胡萝卜素的生物合成提供借鉴。
4.2 增加前体乙酰CoA供应
解脂耶氏酵母是合成类胡萝卜素的理想宿主,其胞内具有较高的乙酰CoA通量,是MVA途径的原料,充足的乙酰CoA供应对于萜类化合物的合成至关重要,增加细胞内乙酰CoA的供应,有利于增强β-胡萝卜素的合成。胞质中大部分乙酰CoA是由ATP柠檬酸裂解酶裂解产生的,将来自线粒体的柠檬酸盐裂解为草酰乙酸和乙酰CoA[44]。为维持胞质中有较高乙酰CoA水平,需要柠檬酸盐从线粒体中持续流出进行裂解,ZHANG等[45]在解脂耶氏酵母中过表达AMPD,抑制异柠檬酸脱氢酶的活性,从而增加柠檬酸和乙酰CoA水平。FAN等[24]为了探究胞内乙酰CoA的供应对β-胡萝卜素产量的影响,在酿酒酵母中构建了异源的PK/PTA途径、强化磷酸戊糖途径以及抑制内源的糖酵解途径来提高乙酰CoA的供应,最终工程菌的β-胡萝卜素产量达到105.94 mg/L,与对照菌株相比提高了56%。JIN等[46]应用了一种不同的策略,他为了改善进入MVA途径的乙酰CoA,通过过表达TGL3、PXA1、MFE1、POT1和PEX10来增强脂肪酸的β-氧化,削弱脂质合成途径,从脂质中回收乙酰CoA,从而来提高β-胡萝卜素合成途径的碳通量。
4.3 增加脂质积累
β-胡萝卜素是一种脂溶性化合物,主要贮存在细胞膜和脂滴中。WU等[28]在大肠杆菌中运用膜工程对细胞膜进行改造,以提高储存β-胡萝卜素的能力,同时改造膜形态和膜合成途径表现出协同效应,导致β-胡萝卜素产量提高2.9倍。ZHAO等[33]为了在酿酒酵母中增加β-胡萝卜素的积累,利用代谢工程手段提高脂质的含量,在产β-胡萝卜素的菌株中设计了不同的脂质代谢途径,其中甾醇酰基转移酶ARE1和ARE2的过表达使β-胡萝卜素产量提高了1.5倍,磷脂酸磷酸酶PAH1、DPP1和LPP1的缺失使β-胡萝卜素产量提高了2倍,将这两种策略相结合,与原始菌株相比,β-胡萝卜素的产量提高了2.4倍。解脂耶氏酵母是一种天然的产油酵母,使其比酿酒酵母更适合生产疏水性的β-胡萝卜素,但是由于脂质合成与β-胡萝卜素合成都需要以乙酰CoA为前体,因此还需要探究如何平衡这两个合成途径之间的通量分布,以达到可以进一步提高β-胡萝卜素产量的最佳状态。LARROUDE等[27]构建了一株可以高产脂质和β-胡萝卜素的脂耶氏酵母菌株,与对照菌株相比,其积累的脂质增加了3.6倍,产生的β-胡萝卜素为8.9 mg/g DCW和35.7 mg/L,是对照的2.61倍和1.93倍。
4.4 下调竞争途径
在β-胡萝卜素的生物合成途径中,IPP和DMAPP作为主要的代谢中间体,两者依次缩合生产GPP、FPP、GGPP,在各种酶的催化下进一步生成单萜、倍半萜、二萜、三萜和四萜化合物[47]。为了将代谢通量尽可能地流向β-胡萝卜的合成,往往需要抑制竞争途径,削弱副反应,提高目标产物产量。麦角甾醇合成途径是β-胡萝卜素合成的一个竞争途径,但麦角甾醇是细胞膜的一种组成成分,不能合成甾醇会导致严重的生长缺陷[48]。为了维持细胞的正常生长且提高β-胡萝卜的代谢通量,KILDEGAARD等[49]在解脂耶氏酵母中通过截短天然启动子或使用弱启动子来下调麦角甾醇的生物合成,所得菌株的β-胡萝卜素滴度增加了2~2.5倍,当启动子缩短至50 bp时β-胡萝卜素滴度最高,为797.1 mg/L。FAN等[24]在角鲨烯合酶的N端引入PEST序列来降低蛋白的稳定性,削弱麦角甾醇的合成。结果表明PEST序列的引入可以将代谢通量从麦角甾醇合成途径转移到β-胡萝卜素合成中,进而提高β-胡萝卜素的产量。CAO等[44]为了削弱麦角甾醇的生物合成,采取类似的策略,通过使用弱的HXT1启动子替换其天然启动子,来下调角鲨烯合酶ERG9的表达。
4.5 区室化策略
采取区室化策略也可以抑制代谢通量向竞争途径转移,这是提高微生物细胞工厂生产效率的有效调控策略[50]。区室化是指细胞内的不同功能区域被分隔成不同小室,主要有线粒体、过氧化物酶体、内质网和高尔基体[51]。每个细胞区室都有独特的物理化学环境,具有不同的代谢物、酶和辅助因子,利用细胞区室化可以促进萜类化合物的合成[52]。在细胞区室内组装途径可以减少内源途径和异源途径之间的干扰,可以增加特定空间内底物和酶的浓度,从而提高反应速率和生产效率,还可以将关键的代谢中间体限制在区室内,抑制其向竞争途径的转移。线粒体是一种半自主细胞器,MATSUMOTO等[53]尝试将类胡萝卜素合成途径定位到线粒体中,以改善酿酒酵母中类胡萝卜素的生成。与在胞质中表达类胡萝卜素合成途径的菌株相比,利用区室化合成类胡萝卜素的产量提高了13.82倍。异戊二烯是合成β-胡萝卜素的前体,LYU等[54]将线粒体工程和细胞质工程相结合,综合利用乙酰CoA,与单独利用线粒体或细胞质工程的重组菌相比,异戊二烯的水平分别提高了2.1和1.6倍,该策略为改善酵母中异戊二烯的水平提供了一种有效的方法,也可能适用于β-胡萝卜素的生物合成。β-胡萝卜素与虾青素都属于类胡萝卜素,MA等[55]分别将虾青素合成途径定位到脂质体、内质网和过氧化物酶体中,相比于胞质途径,将合成途径定位到亚细胞器中,产量显著提升,不仅加速了β-胡萝卜素向虾青素的转化,而且显着减少了中间体的积累,还将虾青素合成途径同时定位到脂质体、内质网和过氧化物酶体中,得到的虾青素产量最高,达到858 mg/L。
5 总结与展望
β-胡萝卜素已经广泛应用于食品、营养保健品、药品以及化妆品行业,近年来其市场需求不断扩大,所以建立一个高效、环保、可持续生产β-胡萝卜素的方法至关重要。随着代谢工程与合成生物学的迅速发展,以及对其生物合成途径的不断深入研究,构建微生物细胞工厂生产β-胡萝卜素已成为最有前景的生产方式之一。本文主要对利用微生物合成β-胡萝卜素这一方法进行综述,重点介绍了β-胡萝卜素的相关研究进展,并汇总了常用的代谢工程策略。目前,提高β-胡萝卜素产量的策略主要有前体乙酰CoA的供应、ATP和NADPH等辅因子的供应、增强脂质积累、下调竞争途径与区室化策略等。MVA与MEP途径的优化是提高IPP通量的常用方法,除了上述的代谢工程策略外,引入非天然途径以增强前体的供应可能会对β-胡萝卜素的产量产生重大影响。例如,通过在解脂耶氏酵母中引入人工异戊烯醇利用途径(artificial isopentenol utilization pathway, IUP),可将IPP和DMAPP的水平提高15.7倍,这也导致了类胡萝卜素产量的显著增加[40]。因此,利用微生物生产β-胡萝卜素具有巨大的发展前景。
尽管当前β-胡萝卜素的生物合成已取得了一定的研究成果,但因在微生物中构建细胞工厂是一项复杂、影响因素较多的研究,β-胡萝卜素的生物合成还存在诸多问题,很少有工程微生物能够工业化生产β-胡萝卜素,还需要继续对生物技术方法进行改革和创新。例如,微生物的遗传特性限制了其在生产中的应用。在构建生物合成途径时,尽管少数微生物的改造过程会注重基因组整合,但大多数微生物仍然采用质粒表达的方式,这种方式往往需要大量使用抗生素,并增加了代谢负担,同时质粒表达还存在遗传不稳定性的问题。因此需要进一步开发更高效、更快速的基因操作工具来解决这一问题,如CRISPR/Cas9基因编辑系统,SCHWARTZ等[56]开发了一个基于CRISPR/Cas9的工具,用于靶向、无标记地将目标基因整合到解脂耶氏酵母的基因组中。酶在构建细胞工厂的过程中至关重要,不同来源的酶在宿主中进行异源表达可能具有不同的表达水平,因此需要很好地选择酶的来源或者对酶进行定向改造。KANG等[57]利用RIAD-RIDD组装构建Idi-CrtE多酶复合物,衔接代谢通路,使得类胡萝卜素的通量得到大幅度的提高。β-胡萝卜素是一种胞内产物,在提取过程中需要涉及到细胞破碎和有机溶剂萃取,β-胡萝卜素又极其不稳定,对光和热均不稳定,易被氧化分解。因此,细胞破碎方法的选择很大程度上决定了β-胡萝卜素的提取效果,必须慎重选择适当的提取方法,以确保其稳定性,需要继续深入研究β-胡萝卜素的提取工艺。解决这些问题可能会推动β-胡萝卜素工业化应用的进程,也可以为其他类胡萝卜素的生产提供参考。
[1] FIEDOR J, BURDA K. Potential role of carotenoids as antioxidants in human health and disease[J]. Nutrients, 2014, 6(2):466-488.
[2] WANG J, HU X G, CHEN J B, et al. The extraction of β-carotene from microalgae for testing their health benefits[J]. Foods, 2022, 11(4):502.
[3] SINGH R V, SAMBYAL K. An overview of β-carotene production: Current status and future prospects[J]. Food Bioscience, 2022, 47:101717.
[4] RODRIGUEZ-AMAYA D B. Structures and analysis of carotenoid molecules[J]. Sub-Cellular Biochemistry, 2016, 79:71-108.
[5] BOGACZ-RADOMSKA L, HARASYM J. β-Carotene—Properties and production methods[J]. Food Quality and Safety, 2018, 2(2):69-74.
[6] YU N, SU X M, WANG Z F, et al. Association of dietary vitamin A and β-carotene intake with the risk of lung cancer: A meta-analysis of 19 publications[J]. Nutrients, 2015, 7(11):9309-9324.
[7] CARROLL Y L, CORRIDAN B M, MORRISSEY P A. Lipoprotein carotenoid profiles and the susceptibility of low density lipoprotein to oxidative modification in healthy elderly volunteers[J]. European Journal of Clinical Nutrition, 2000, 54(6):500-507.
[8] HASKELL M J. The challenge to reach nutritional adequacy for vitamin A: β-carotene bioavailability and conversion: Evidence in humans[J]. The American Journal of Clinical Nutrition, 2012, 96(5):1193S-1203S.
[9] YANG J Q, ZHANG Y L, NA X N, et al. β-carotene supplementation and risk of cardiovascular disease: A systematic review and meta-analysis of randomized controlled trials[J]. Nutrients, 2022, 14(6):1284.
[10] WANG J L, NIYOMPANICH S, TAI Y S, et al. Engineering of a highly efficient Escherichia coli strain for mevalonate fermentation through chromosomal integration[J]. Applied and Environmental Microbiology, 2016, 82(24):7176-7184.
[11] KIZER L, PITERA D J, PFLEGER B F, et al. Application of functional genomics to pathway optimization for increased isoprenoid production[J]. Applied and Environmental Microbiology, 2008, 74(10):3229-3241.
[12] LI C, SWOFFORD C A, SINSKEY A J. Modular engineering for microbial production of carotenoids[J]. Metabolic Engineering Communications, 2020, 10: e00118.
[13] VERDOES J C, SANDMANN G, VISSER H, et al. Metabolic engineering of the carotenoid biosynthetic pathway in the yeast Xanthophyllomyces dendrorhous (Phaffia rhodozyma)[J]. Applied and Environmental Microbiology, 2003, 69(7):3728-3738.
[14] VELAYOS A, ESLAVA A P, ITURRIAGA E A. A bifunctional enzyme with lycopene cyclase and phytoene synthase activities is encoded by the carRP gene of Mucor circinelloides[J]. European Journal of Biochemistry, 2000, 267(17):5509-5519.
[15] IWASAKA H, KOYANAGI R, SATOH R, et al. A possible trifunctional β-carotene synthase gene identified in the draft genome of Aurantiochytrium sp. strain KH105[J]. Genes, 2018, 9(4):200.
[16] 戴冠苹, 孙涛, 苗良田, 等. RBS文库调控重组大肠杆菌β-胡萝卜素合成途径关键基因提高β-胡萝卜素合成能力[J]. 生物工程学报, 2014, 30(8):1193-1203.DAI G P, SUN T, MIAO L T, et al. Modulating expression of key genes within β-carotene synthetic pathway in recombinant Escherichia coli with RBS library to improve β-carotene production[J]. Chinese Journal of Biotechnology, 2014, 30(8):1193-1203.
[17] KIM M J, NOH M H, WOO S, et al. Enhanced lycopene production in Escherichia coli by expression of two mep pathway enzymes from Vibrio sp. dhg[J]. Catalysts, 2019, 9(12):1003.
[18] ZHAO J, LI Q Y, SUN T, et al. Engineering central metabolic modules of Escherichia coli for improving β-carotene production[J]. Metabolic Engineering, 2013, 17:42-50.
[19] YOON S H, LEE S H, DAS A, et al. Combinatorial expression of bacterial whole mevalonate pathway for the production of β-carotene in E. coli[J]. Journal of Biotechnology, 2009, 140(3-4):218-226.
[20] YANG J M, GUO L Z. Biosynthesis of β-carotene in engineered E. coli using the MEP and MVA pathways[J]. Microbial Cell Factories, 2014, 13:160.
[21] YAMANO S, ISHII T, NAKAGAWA M, et al. Metabolic engineering for production of beta-carotene and lycopene in Saccharomyces cerevisiae[J]. Bioscience, Biotechnology, and Biochemistry, 1994, 58(6):1112-1114.
[22] VERWAAL R, WANG J, MEIJNEN J P, et al. High-level production of beta-carotene in Saccharomyces cerevisiae by successive transformation with carotenogenic genes from Xanthophyllomyces dendrorhous[J]. Applied and Environmental Microbiology, 2007, 73(13):4342-4350.
[23] XIE W P, YE L D, LV X M, et al. Sequential control of biosynthetic pathways for balanced utilization of metabolic intermediates in Saccharomyces cerevisiae[J]. Metabolic Engineering, 2015, 28:8-18.
[24] FAN J, ZHANG Y, LI W H, et al. Multidimensional optimization of Saccharomyces cerevisiae for carotenoid overproduction[J]. Biodesign Research, 2024, 6:0026.
[25] JING Y W, WANG J N, GAO H Y, et al. Enhanced β-carotene production in Yarrowia lipolytica through the metabolic and fermentation engineering[J]. Journal of Industrial Microbiology &Biotechnology, 2023, 50(1): kuad009.
[26] GAO S L, TONG Y Y, ZHU L, et al. Iterative integration of multiple-copy pathway genes in Yarrowia lipolytica for heterologous β-carotene production[J]. Metabolic Engineering, 2017, 41:192-201.
[27] LARROUDE M, CELINSKA E, BACK A, et al. A synthetic biology approach to transform Yarrowia lipolytica into a competitive biotechnological producer of β-carotene[J]. Biotechnology and Bioengineering, 2018, 115(2):464-472.
[28] WU T, YE L J, ZHAO D D, et al. Membrane engineering-A novel strategy to enhance the production and accumulation of β-carotene in Escherichia coli[J]. Metabolic Engineering, 2017, 43(Pt A):85-91.
[29] WU T, LI S W, YE L J, et al. Engineering an artificial membrane vesicle trafficking system (AMVTS) for the excretion of β-carotene in Escherichia coli[J]. ACS Synthetic Biology, 2019, 8(5):1037-1046.
[30] 赵婧, 刘怡, 李清艳, 等. 多个调控元件调控萜类合成途径基因表达提高β-胡萝卜素的生产 [J]. 生物工程学报, 2013, 29(1): 41-55.ZHAO J, LIU Y, LI Q Y, et al. Modulation of isoprenoid gene expression with multiple regulatory parts for improved β-carotene production[J]. Chinese Journal of Biotechnology, 2013, 29(1): 41-55.
[31] WU Y Q, YAN P P, LI Y, et al. Enhancing β-carotene production in Escherichia coli by perturbing central carbon metabolism and improving the NADPH supply[J]. Frontiers in Bioengineering and Biotechnology, 2020, 8:585.
[32] BU X, LIN J Y, DUAN C Q, et al. Dual regulation of lipid droplet-triacylglycerol metabolism and ERG9 expression for improved β-carotene production in Saccharomyces cerevisiae[J]. Microbial Cell Factories, 2022, 21(1):3.
[33] ZHAO Y J, ZHANG Y P, NIELSEN J, et al. Production of β-carotene in Saccharomyces cerevisiae through altering yeast lipid metabolism[J]. Biotechnology and Bioengineering, 2021, 118(5):2043-2052.
[34] LI J, SHEN J, SUN Z Q, et al. Discovery of several novel targets that enhance β-carotene production in Saccharomyces cerevisiae[J]. Frontiers in Microbiology, 2017, 8:1116.
[35] MA Y S, LIU N, GREISEN P, et al. Removal of lycopene substrate inhibition enables high carotenoid productivity in Yarrowia lipolytica[J]. Nature Communications, 2022, 13(1):572.
[36] LIU M M, ZHANG J, YE J R, et al. Morphological and metabolic engineering of Yarrowia lipolytica to increase β-carotene production[J]. ACS Synthetic Biology, 2021, 10(12):3551-3560.
[37] ZHANG X K, WANG D N, CHEN J, et al. Metabolic engineering of β-carotene biosynthesis in Yarrowia lipolytica[J]. Biotechnology Letters, 2020, 42(6):945-956.
[38] QIAO K J, WASYLENKO T M, ZHOU K, et al. Lipid production in Yarrowia lipolytica is maximized by engineering cytosolic redox metabolism[J]. Nature Biotechnology, 2017, 35(2):173-177.
[39] MAN Z W, GUO J, ZHANG Y Y, et al. Regulation of intracellular ATP supply and its application in industrial biotechnology[J]. Critical Reviews in Biotechnology, 2020, 40(8):1151-1162.
[40] LUO Z S, LIU N, LAZAR Z, et al. Enhancing isoprenoid synthesis in Yarrowia lipolytica by expressing the isopentenol utilization pathway and modulating intracellular hydrophobicity[J]. Metabolic Engineering, 2020, 61:344-351.
[41] CAO X, WEI L J, LIN J Y, et al. Enhancing linalool production by engineering oleaginous yeast Yarrowia lipolytica[J]. Bioresource Technology, 2017, 245:1641-1644.
[42] LIU H, MARSAFARI M, DENG L, et al. Understanding lipogenesis by dynamically profiling transcriptional activity of lipogenic promoters in Yarrowia lipolytica[J]. Applied Microbiology and Biotechnology, 2019, 103(7):3167-3179.
[43] SUN T, MIAO L T, LI Q Y, et al. Production of lycopene by metabolically-engineered Escherichia coli[J]. Biotechnology Letters, 2014, 36(7):1515-1522.
[44] CAO X, YU W, CHEN Y, et al. Engineering yeast for high-level production of diterpenoid sclareol[J]. Metabolic Engineering, 2023, 75:19-28.
[45] ZHANG X K, NIE M Y, CHEN J, et al. Multicopy integrants of crt genes and co-expression of AMP deaminase improve lycopene production in Yarrowia lipolytica[J]. Journal of Biotechnology, 2019, 289:46-54.
[46] JIN C C, ZHANG J L, SONG H, et al. Boosting the biosynthesis of betulinic acid and related triterpenoids in Yarrowia lipolytica via multimodular metabolic engineering[J]. Microbial Cell Factories, 2019, 18(1):77.
[47] SADRE R, KUO P, CHEN J X, et al. Cytosolic lipid droplets as engineered organelles for production and accumulation of terpenoid biomaterials in leaves[J]. Nature Communications, 2019, 10(1):853.
[48] TANAKA S, TANI M. Mannosylinositol phosphorylceramides and ergosterol coodinately maintain cell wall integrity in the yeast Saccharomyces cerevisiae[J]. The FEBS Journal, 2018, 285(13):2405-2427.
[49] KILDEGAARD K R, ADIEGO-PÉREZ B, DOMÉNECH BELDA D, et al. Engineering of Yarrowia lipolytica for production of astaxanthin[J]. Synthetic and Systems Biotechnology, 2017, 2(4):287-294.
[50] YAO L, WU X M, JIANG X, et al. Subcellular compartmentalization in the biosynthesis and engineering of plant natural products[J]. Biotechnology Advances, 2023, 69:108258.
[51] MORE T H, HILLER K. Complexity of subcellular metabolism: Strategies for compartment-specific profiling[J]. Current Opinion in Biotechnology, 2022, 75:102711.
[52] WANG R W, LIU X, LV B, et al. Designing intracellular compartments for efficient engineered microbial cell factories[J]. ACS Synthetic Biology, 2023, 12(5):1378-1395.
[53] MATSUMOTO T, OSAWA T, TANIGUCHI H, et al. Mitochondrial expression of metabolic enzymes for improving carotenoid production in Saccharomyces cerevisiae[J]. Biochemical Engineering Journal, 2022, 189:108720.
[54] LYU X M, WANG F, ZHOU P P, et al. Dual regulation of cytoplasmic and mitochondrial acetyl-CoA utilization for improved isoprene production in Saccharomyces cerevisiae[J]. Nature Communications, 2016, 7:12851.
[55] MA Y S, LI J B, HUANG S W, et al. Targeting pathway expression to subcellular organelles improves astaxanthin synthesis in Yarrowia lipolytica[J]. Metabolic Engineering, 2021, 68:152-161.
[56] SCHWARTZ C, SHABBIR-HUSSAIN M, FROGUE K, et al. Standardized markerless gene integration for pathway engineering in Yarrowia lipolytica[J]. ACS Synthetic Biology, 2017, 6(3):402-409.
[57] KANG W, MA T, LIU M, et al. Modular enzyme assembly for enhanced cascade biocatalysis and metabolic flux[J]. Nature Communications, 2019, 10(1):4248.