淀粉是一类重要的食品加工原料,同时也是人类能量的主要来源。当前商业化淀粉主要来自小麦、玉米、稻谷、马铃薯等粮食作物。近年来,随着大食物观的逐步树立,以及人们对淀粉需求量的增加,开发耕地以外土地空间的淀粉资源受到重视。水生植物如菱角、莲藕、荸荠、芡实等的淀粉已被广泛研究开发,并形成一定产业规模。浮萍、藻类等水生生物可生产淀粉,而且可采取代谢调控手段提高淀粉累积量,亟待开发利用[1]。草本植物如油莎豆过去作为防风固沙植物和提取油脂的原料,其地下块茎含约25% ~ 30%淀粉,具有成为淀粉加工原料来源的潜力[2]。木本植物同样是淀粉的重要来源。据统计,我国现有棕榈科、榆科、大戟科等21科木本淀粉植物资源[3]。传统上,橡实淀粉被加工制作成豆腐、凉粉、粉丝等形态来食用,银杏、板栗、猕猴桃等林产淀粉因其独特的结构和性能而备受关注。目前,菠萝蜜、龙眼、枇杷、荔枝、芒果、鳄梨等果实的核或种子作为加工废弃物未能得到很好的利用,因其富含淀粉且产量巨大,近年来对这些来源淀粉的研究受到重视[4]。有学者从马来苹果种子中提取淀粉,得率为24.2%,淀粉纯度为95.6%,经测定,该淀粉中磷含量0.08%,这或许是继马铃薯淀粉之后另一类天然的磷酸酯化淀粉[5]。
枇杷是蔷薇科亚热带水果,在全球广泛种植。据不完全统计,我国枇杷栽培面积近13.4万hm2,年产量超90万t,已形成一定规模的枇杷加工产业。研究显示,枇杷核约占果实鲜重的17%~30%,枇杷核淀粉含量约59%~71%(干基)[6]。COSTA等[7]报道,枇杷核淀粉为C-型淀粉,相对结晶度为42.39%,而TUROLA BARBI等[8]报道枇杷核淀粉相对结晶度为23.82%~24.99%,直链淀粉含量为6.22%~45.69%。最近,KONG等[9]报道5种枇杷核淀粉相对结晶度为17.14%~21.06%,直链淀粉含量为54.5%~66.9%。方修贵等[10]报道枇杷核淀粉的直链淀粉含量为49.30%。由此可见,不同产地、品种及成熟度的枇杷核淀粉组成结构存在较大差异。在应用研究方面,许佳玉等[11]探索了枇杷核抗性淀粉的制备工艺;CAO等[12]制备了添加牛至精油和刺梧桐树胶的枇杷核淀粉膜,该淀粉膜具有一定的抗菌活性和抗拉伸性;COSTA等[13]将枇杷核淀粉、甘油和山梨醇混合用于草莓涂膜保鲜,可以使草莓在冷藏条件下保鲜期达到16 d。
当前,枇杷核淀粉仍为一类未被广泛开发利用的淀粉资源。基于此,本研究以不同产地(浙江、重庆)的2个主栽枇杷品种(大红袍、大五星)为对象提取枇杷核淀粉,对比分析其组成结构和理化性能,以期为枇杷核淀粉高值化利用提供实验参考。
1 材料与方法
1.1 材料与试剂
2023年5月,大红袍枇杷采摘自浙江余杭,大五星枇杷采摘自重庆云阳,均在成熟期采摘,果实形态如图1-A所示。总淀粉含量试剂盒,苏州梦犀生物医药科技有限公司;猪胰腺α-淀粉酶(A3176-500KU, Sigma-Aldrich)、淀粉葡萄糖苷酶(黑曲霉来源,A9913-10 mL, Sigma-Aldrich),重庆昂科生物科技有限公司;GOPOD试剂盒(G0504F),苏州格锐思生物科技有限公司;玉米油,上海福临门食品有限公司;其他试剂均为分析纯。
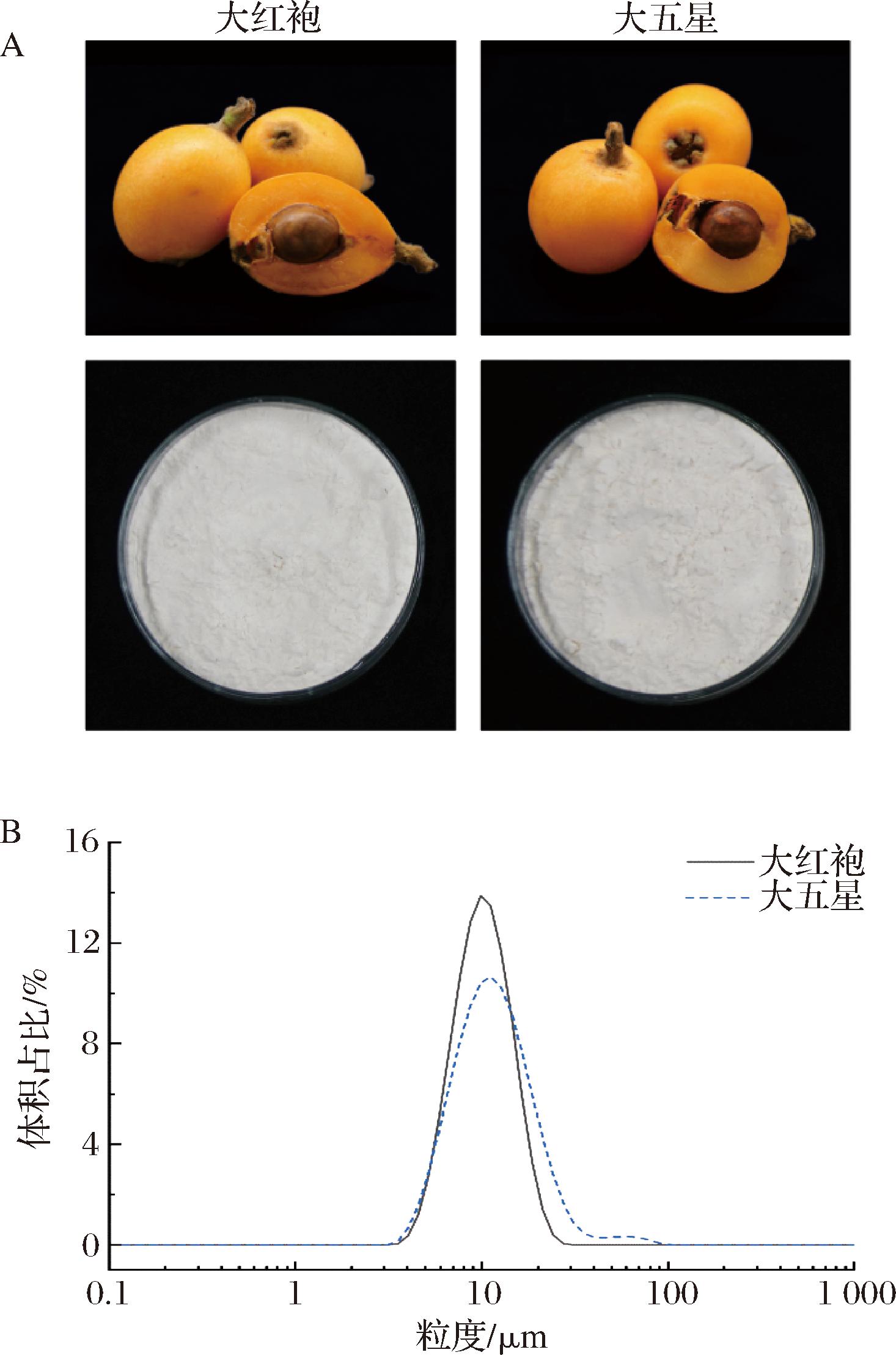
A-枇杷及枇杷核淀粉照片;B-淀粉的粒度分布
图1 枇杷及提取的枇杷核淀粉的照片及淀粉的粒度分布
Fig.1 Images of loquat fruit and the extracted loquat kernel starches, the particle size distribution of starches
1.2 仪器和设备
JP828A型打浆机,浙江苏泊尔股份有限公司;DHG-9245型烘箱,上海一恒科学仪器有限公司;WR-18型手提式色差仪,苏州威福光电科技有限公司;Mastersizer 3000激光粒度仪,英国马尔文仪器有限公司;Phenom Pro扫描电子显微镜,荷兰Phenom-World公司;LC20AD尺寸排阻色谱系统、XRD-6100型X-射线衍射仪,日本岛津公司;Spectrum Two傅里叶变换红外光谱、DSC4000差示扫描量热仪,美国铂金埃尔默公司;RVA-TecMaster快速黏度分析仪,澳大利亚瑞典波通仪器公司;TA.XT Plus质构仪,英国Stable Micro System公司。
1.3 实验方法
1.3.1 枇杷核淀粉的提取
从果实中取出枇杷核,洗净并沥干。将枇杷核剥去种皮后称重(m1),以果核与水料液比1∶2(g∶mL)打浆4 min,浆液过100目筛,筛子上残留物用蒸馏水清洗并过滤3~5次以充分提取枇杷核中的淀粉。合并过滤液,在室温下静置3 h后倒掉上层清液,向沉淀中加入蒸馏水使其成为悬浮液,静置后再次倾去上清液,该过程重复3次。抽滤,得到湿淀粉,在40 ℃的烘箱中干燥20 h后称重(m2),用粉碎机粉碎,过100目筛,将样品装入塑料袋中密封,备用。枇杷核淀粉的得率(鲜重)根据公式(1)计算:
得率![]()
(1)
1.3.2 淀粉颜色的测定
淀粉的颜色参数用色差仪进行测定,以标准白板[L*(亮度)=92.90, a*(红度)=0.36, b*(黄度)=-0.08]对色差仪进行校准,从而获得淀粉样品的L*、a*、b*值。白度指数(white index,WI)根据公式(2)计算:
(2)
1.3.3 粒度分布
使用激光粒度仪测量样品的粒度分布,将淀粉样品分散在蒸馏水中,控制遮光度在8%~20%再开始测量。平均直径分别用D10,D50,D90(累积体积百分比分别为10%、50%和90%时的颗粒直径),D[4,3](体积加权平均直径)和D[3,2](面积加权平均直径)表示[14]。粒度的分散度(Span)根据公式(3)计算:
(3)
1.3.4 扫描电子显微镜
用双面胶带将淀粉样品固定在铝柱上,然后在真空条件下使用溅射镀膜机进行喷金处理。用扫描电子显微镜在10 kV的加速电压和3 000倍的放大倍率下拍摄淀粉颗粒的微观结构图像。
1.3.5 化学成分分析
淀粉含量使用淀粉含量试剂盒进行测定;水分含量测定采用直接干燥法(GB 5009.3—2016《食品安全国家标准 食品中水分的测定》);蛋白质含量采用凯氏定氮法测定(GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》);脂质测定采用索氏抽提法(GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》)。
1.3.6 尺寸排阻色谱(size exclusion chromatography,SEC)
首先,根据VILAPLANA等[15]的方法制备脱支淀粉,并做了一些修改。将4 mg淀粉样品与0.9 mL蒸馏水混合后在90 ℃水浴中加热1 h,使淀粉充分糊化。待淀粉溶液冷却至室温后,与2.5 μL异淀粉酶溶液(2 000 U/mL)、0.1 mL乙酸钠溶液(0.1 mol/L,pH 3.5)和5 μL叠氮化钠溶液(0.04 g/mL)混合,混匀后放入37 ℃的恒温振荡器中培养3 h。向混合物中加入0.1 mL氢氧化钠(0.1 mol/L),在恒温振荡器中80 ℃加热1 h。将混合物冷冻干燥后溶解于二甲基亚砜/LiBr(0.5%,质量分数)中,在8 000×g下离心10 min以除去非淀粉成分。然后,应用SEC系统进行链长分布测定,该系统配备了3根色谱柱,依次为前预备柱、Gram 100和Gram 1000(德国聚合物标准服务公司)。使用RID-10A折射率(differential refractive index,DRI)检测器来收集折射率信号。流动相为二甲基亚砜/LiBr溶液(0.5%,质量分数),流速0.6 mL/min,柱温80 ℃。利用分子质量342~2.35×106 Da的普鲁兰标准样品(Mark-Houwink参数K=2.427×10-4 dL/g,α=0.680 4)进行SEC校准。通过SEC洗脱体积(Vel)计算流体力学体积(Vh),进而得到脱支淀粉样品的流体力学半径(Rh),根据DRI信号得到SEC质量分布w(lgRh)与聚合度(X)的函数图像。其中聚合度(X)由Mark-Houwink关系式的分子质量M确定,M=162.2(X-1)+18.0(162.2为脱水葡萄糖单体单元的分子质量,18.0为末端基团中过量水的分子质量),其中Mark-Houwink参数K=1.5×10-4 dL/g,α=0.743[16]。分支度(degree of branching,DB)计算如公式(4)所示:

(4)
式中:Nde(X)为脱支的支链淀粉分子的数量分布。
1.3.7 X-射线衍射(X-ray diffraction, XRD)测定
先将淀粉样品在室温下平衡水分以消除水分含量对结晶度的影响。X-射线衍射测试条件:电压40 kV,电流200 mA,扫描范围4°~40° (2θ),扫描速度4°/min,发散狭缝宽度为1°,步长为0.02°,衍射狭缝宽度为1°,接收狭缝宽度为0.02 mm。相对结晶度用MDI Jade 6.5软件对XRD图谱进行处理后获得。
1.3.8 傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)测定
采用配备了带有金刚石晶体的衰减全反射附件的FTIR仪,分析淀粉的短程有序结构。FTIR的波数为4 000~400 cm-1,分辨率为4 cm-1,平均扫描次数为4次。使用OMNIC软件在1 200 cm-1和800 cm-1处各画一条直线,对光谱进行去卷积。设置峰宽为40 cm-1,分辨率的增强因子为1.9。在去卷积的红外光谱上获得1 047 cm-1、1 022 cm-1和995 cm-1处样品的峰强度比(R1 047/1 022和R995/1 022)。
1.3.9 小角X-射线散射(small angle X-ray scattering,SAXS)测定
SAXS实验在北京同步辐射装置的1W2A小角散射实验站完成[17]。将0.6 g淀粉样品与600 μL蒸馏水混合,在室温下平衡24 h后使用。样品转移到样品池后,在入射X射线光束(Cu-Kα,λ=1.54 nm)下曝光,曝光时间为20 s。该测试使用Pilatus 1MF探测器,其有效面积为169 mm×179 mm,像素尺寸为172 μm。样品到检测器的距离为1 452 mm,检测区域q为0.1~3.18 nm-1。散射矢量q (nm-1)=4πsinθ/λ,其中2θ为散射角。散射强度由光电二极管读取。在测量SAXS后获得二维光散射图像,并使用Fit2D.exe软件将二维图像转换为一维图像。根据图像计算出回转半径(Rg)、分形维数(Dm或Ds)和片层厚度(dBragg)等参数。
1.3.10 溶解度(solubility,SOL)和膨胀度(swelling power,SP)测定
将0.5 g淀粉(干基)与25 g蒸馏水混合,制备成2%(质量分数)的淀粉悬浮液后置于离心管中,在85 ℃水浴中持续振荡培养30 min。冷却至室温后,将混合物在4 025×g转速下离心15 min。将上清液倒入蒸发皿中,在105 ℃下干燥至恒重并称重(g)。沉淀物为溶胀的淀粉颗粒,同样在105 ℃下干燥至恒重并称重(g)。SOL和SP的计算如公式(5)、公式(6)所示[18]:
(5)
(6)
1.3.11 持油性(oil binding capacity,OBC)测定
将0.5 g淀粉(干基)(m0)和10 mL玉米油放入预先称重的离心管(m1)中。悬浮液在室温下静置1 h后在11 180 ×g转速下离心10 min。倾去上清液,对装有沉淀的离心管称重(m2)。OBC用淀粉样品吸附油脂的百分比表示[18],并根据公式(7)计算:
(7)
1.3.12 差示扫描量热分析(differential scanning calorimetry,DSC)
DSC测定参照之前的研究并作了一些修改[14]。将淀粉样品与蒸馏水按质量比1∶2混合后密封在铝锅中,在室温下平衡24 h。然后以10 ℃/min的速度将样品从10 ℃扫描至120 ℃。利用软件TA Universal Analysis从DSC吸热曲线中得出起始温度(To)、峰值温度(Tp)、结束温度(Tc)和糊化焓(ΔHg)。
1.3.13 快速黏度分析(rapid visco analyser,RVA)
用快速黏度分析仪测定淀粉的糊化特性。参照PAES等[19]的测试方法并略作修改。在铝盒中称3 g淀粉样品(干基),然后加入蒸馏水使总质量达到28 g。用塑料桨叶在960 r/min转速下搅拌淀粉悬浮液(12%,质量分数)10 s,在50 ℃下保持1 min,然后以12 ℃/min分别升温至95、85、75、65 ℃,在最高温度下保持2.5 min,再以12 ℃/min的速度降至50 ℃。糊化参数包括糊化温度(pasting temperature,PT)、峰值黏度(peak viscosity,PV)、谷值黏度(trough viscosity,TV)、终值黏度(final viscosity,FV)、回生值(setback value,SB)和崩解值(breakdown value,BD)均由RVA曲线得出。
1.3.14 质构特性
测试方法根据NIE等[14]进行了修改。将1.3.13节中95 ℃糊化得到的淀粉糊收集到直径3 cm的圆柱形模具中,在4 ℃下冷藏24 h以形成凝胶。凝胶的质构特性由TA.XT Plus质构仪和P/36R型探头测量。测试前速度、测试速度和测试后速度均设定为1.0 mm/s,应变40%,触发类型为自动触发,触发力为5 g。
1.3.15 消化特性
称取2.42 g(11 U/mg)的猪胰腺α-淀粉酶和455 μL 淀粉葡萄糖苷酶加入100 mL乙酸钠缓冲溶液(0.5 mol/L,pH=5.2)中,以1 789×g离心10 min后取上清液备用。取300 mg的淀粉样品加入10 mL乙酸钠缓冲溶液(0.5 mol/L,pH 5.2),在37 ℃条件下以120 r/min的速度进行水浴振荡10 min后加入混合酶液10 mL,而后于0、20和120 min取1 mL消化液。用4 mL无水乙醇终止反应后,以1 789×g离心10 min,用GOPOD试剂盒测定上清液的葡萄糖含量。沉淀物置于通风橱内进行干燥,然后用研钵轻轻研磨,将得到的粉末样品用于进行酶解后淀粉的电子显微镜测试。快消化淀粉(rapid digestiable starch,RDS)、慢消化淀粉(slowly digestiable starch,SDS)及抗性淀粉(resistant starch, RS)含量分别按照公式(8)~公式(10)计算[20]:
(8)
(9)
RS/%=100%-RDS-SDS
(10)
式中:G20和G120分别为20 min和120 min时葡萄糖的释放量,mg;FG为原样中游离葡萄糖含量,mg,TS为样品的总淀粉含量,mg。
1.4 数据处理
所有试验至少重复3次,结果以平均值±标准差表示。使用SPSS软件(v.27.0,美国IBM公司)进行单因素方差分析,采用邓肯的多重范围检验,P<0.05表示差异显著。应用Origin软件(v.2022,美国Originlab公司)绘图。
2 结果与分析
2.1 枇杷核淀粉的提取及物性分析
从2个品种枇杷(大红袍及大五星)的核中提取淀粉,得率分别为23.97%、24.64%(以鲜重计),由此可见,枇杷核淀粉含量较为丰富,可作为淀粉新资源。枇杷核淀粉呈白色或类白色(图1)。经色差分析可知(表1),2种淀粉的亮度(L*)>95,白度(WI)分别为89.95、91.15,表明提取得到的淀粉具有较高的纯度[21]。2种淀粉的a*和b*均为正值,表明以红黄值为主,大五星的红黄值高于大红袍,这可能是蛋白质、色素等共存成分导致的。采用激光衍射粒度分析仪测定枇杷核淀粉的粒度,2种淀粉的粒度基本呈现单峰分布,峰值出现在约10 μm处(图1)。大五星在50~80 μm处出现了一个小峰,表明含有一定比例的较大颗粒淀粉。由表1可知,2种枇杷核淀粉的D[4,3]和D[3,2]分别为11.30、14.10 μm和10.05、11.00 μm,这与同为木本植物的荔枝核淀粉的粒度近似[21]。2种枇杷核淀粉的D50值分别为10.70 μm和12.00 μm,高于之前报道的9.4 μm[4]。此外,大红袍(Span = 0.93)相比于大五星(Span = 1.31)具有更窄的粒度分布。由图2可知,不同粒度的枇杷核淀粉具有不同的形态特征。其中,大淀粉颗粒呈球形或半球形,表面光滑,较小颗粒淀粉呈椭球形或多角形,部分颗粒可观察到向内凹陷的情况,这与先前的报道一致[4]。
表1 枇杷核淀粉的颜色参数及粒度分布
Table 1 Color properties and particle size distribution of loquat kernel starches

注:不同小写字母表示差异显著(P<0.05)(下同)。
指标大红袍大五星L∗96.62±0.07a95.45±0.02ba∗1.17±0.07b2.07±0.04ab∗8.10±0.05b8.84±0.04aWI91.15±0.07a89.85±0.02bD[4,3]/μm11.30±0.17b14.10±0.10aD[3,2]/μm10.05±0.13b11.00±0.20aD10/μm6.77±0.87a6.72±0.10aD50/μm10.70±0.17b12.00±0.20aD90/μm16.77±0.31b22.45±0.25aSpan0.93±0.01a1.31±0.01a
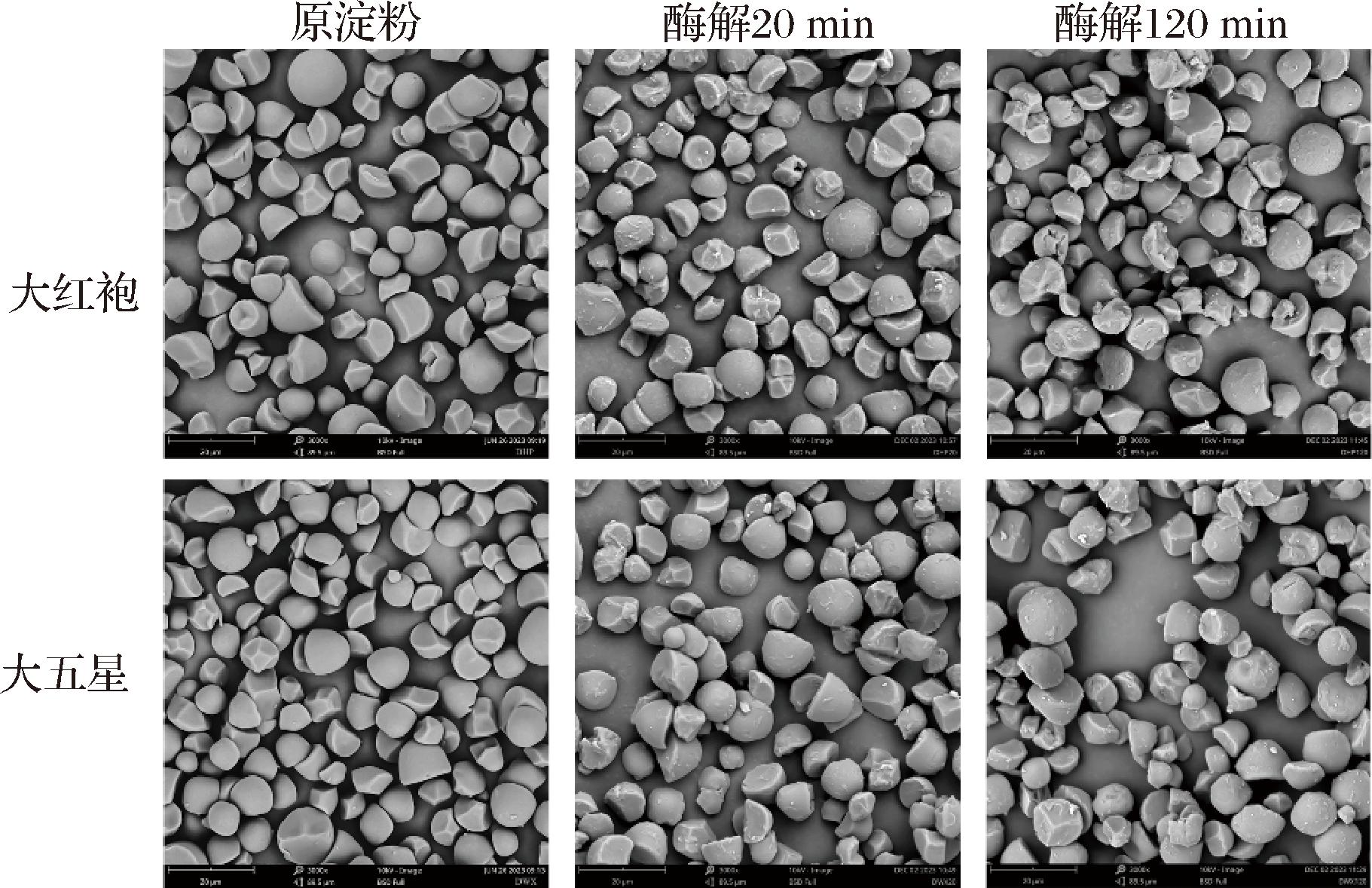
图2 枇杷核淀粉原样及消化20、120 min后的扫描电镜图(放大倍数3 000×)
Fig.2 Scanning electron microscope images of loquat kernel starches during digestion at 3 000× magnification: native starch, digested in mix enzyme solution for 20 min and 120 min
2.2 枇杷核淀粉的化学组成及分子结构
不同产地的枇杷核淀粉的主要化学组成如表2所示。经测定,枇杷核淀粉的水分含量在15%左右,满足GB 31637—2016《食用淀粉》的水分含量要求。2种枇杷核淀粉均含有少量蛋白质和脂质,但大五星的淀粉纯度低于大红袍,这也印证了色差结果中大五星的a*和b*值大于大红袍的情形。COSTA等[7]报道枇杷核淀粉的碳水化合物含量为73.92%~84.42%,同时含1.18%~3.22%的蛋白质以及0.34%~0.94%的脂质。结果之间的差异既与品种有关,也与提取方法有关[6]。研究显示,枇杷核淀粉的直链淀粉含量为6.22%~45.69%[6]。
表2 枇杷核淀粉的基本组成及结构参数
Table 2 Proximate composition and structure parameters of loquat kernel starches

指标大红袍大五星水分/%15.13±0.01a15.06±0.04a淀粉/(%,干基)85.62±1.15a77.05±0.02b蛋白质/(%,干基)0.54±0.04b0.92±0.00a脂质/(%,干基)1.58±0.04a1.49±0.02b直链淀粉/%18.83±0.03a17.62±0.42bhAm,i0.54±0.01a0.55±0.01ahAm,ii0.60±0.03a0.58±0.00aβAm,i/10-45.45±0.07a5.40±0.00aβAm,ii/10-418.05±0.35a18.85±0.50aDB/%2.82±0.00a2.83±0.00a
将枇杷核淀粉充分糊化后进行酶法脱支处理,通过SEC可得到脱支淀粉的链长分布信息,结果如图3所示。通常将聚合度(X)<100的链认定为支链淀粉链(1<X<100),而X>100为直链淀粉链(100<X<10 000)[22]。枇杷核支链淀粉峰呈现第一高峰和第二高峰(肩峰)模式,两峰分别位于X=14和45,2个品种淀粉的曲线几乎重叠在一起(图3-A)。第一个支链淀粉峰对应于支链淀粉的短链部分,即限制于单一结晶(无定形片层)的链;第二个支链淀粉峰(肩峰)对应于支链淀粉的中长链,即跨越2个及以上结晶片层的链。依据直链淀粉峰对应的曲线下面积占整个脱支淀粉峰的曲线下面积的比例,得到大红袍和大五星的直链淀粉含量分别为18.83%和17.62%[23]。进一步,使用公开软件AmyloseCLDfitting(https://github.com/uqhaitengli/AmyloseCLDfitting)对直链淀粉的链长分布进行拟合。该模型涉及淀粉合成酶和淀粉脱支酶,假设2种酶在直链淀粉链长分布的不同区域中的活性不同,则可通过对聚合度不同的2个扩展区域进行拟合得到直链淀粉的拟合参数hAm,i、hAm,ii(区域1、2中淀粉脱支酶和淀粉合成酶的活性之比)和βAm,i和βAm,ii(相关淀粉合成酶在区域1、2中的相对活性)[24]。拟合曲线如图3-B、图3-C所示。基于此,hAm,i和βAm,i分别表示直链淀粉短链部分(X 100~535)的含量和长度,而hAm,ii和βAm,ii分别表示直链淀粉的中长链部分的含量和长度(X 535~10 000)[25]。如表2所示,2种枇杷核淀粉的直链淀粉拟合参数之间无显著性差异(P<0.05)。此外,2种淀粉的分支度分别为2.82%、2.83%。

A-SEC链长分布;B-大红袍直链淀粉链长分布的拟合;C-大五星直链淀粉链长分布的拟合
图3 脱支枇杷核淀粉的SEC链长分布及直链淀粉链长分布的拟合
Fig.3 SEC chain length distribution of debranched loquat kernel starches and the fitted data of amylose chain length distribution
2.3 枇杷核淀粉的晶体结构
如图4所示,在5.6°、15°、17°和23°(2θ)附近有较强的衍射峰,在大约18°(2θ)处有一个肩峰,枇杷核淀粉呈典型的CA型结晶结构,即更接近A型的C型结构[26]。TUROLA BARBI等[8]报道枇杷核淀粉为C型结晶。C型淀粉常见于果实、种子、块茎、根茎以及球茎中,被认为是A型和B型的混合物[27]。2种枇杷核淀粉的相对结晶度存在一定差异(26.98%、28.40%),与先前GUO等[4]的报道(27.4%)接近,但高于KONG等[9]报道的枇杷淀粉相对结晶度17.14%~21.06%。影响淀粉结晶度的因素很多,主要包括直链及支链淀粉的比例、晶体中的有序双螺旋数量、淀粉中水分含量等。有研究显示,淀粉的相对结晶度与直链淀粉含量呈负相关[28]。大红袍枇杷核淀粉的直链淀粉含量更高,这可能造成了该品种淀粉的结晶度较低。

图4 枇杷核淀粉的X-射线衍射图谱
Fig.4 X-ray diffraction pattern of loquat kernel starches
枇杷核淀粉的FTIR图谱如图5-A所示。2种淀粉的吸收峰强度及位置无明显差异。其中,3 300 cm-1处是由葡萄糖残基的—OH基团的伸缩振动引起的宽峰,2 930 cm-1处为葡萄糖残基中—CH2—的不对称伸缩振动特征峰,1 640 cm-1处的峰表示淀粉样品中存在残留的结合水[29]。1 150、1 079和1 000 cm-1处为C—O和C—C键的伸缩振动峰[30]。FTIR图谱1 200~800 cm-1波数范围内的光谱可反映淀粉分子链的有序程度。对原始光谱1 200~800 cm-1波数段进行傅里叶去卷积处理,得到如图5-B所示图谱,其中1 047、1 022、995 cm-1处峰分别对应淀粉分子链的有序结构、无定型及水合结构[21]。1 047 cm-1及1 022 cm-1峰吸光度比值R1 047/1 022用来评价淀粉的短程有序度,而995 cm-1及1 022 cm-1峰的吸光度比值(R995/1 022)反映了水合结构与无定型之间的比例[21]。如表3所示,R1 047/1 022和R995/1 022均是大五星枇杷核淀粉高于大红袍淀粉,这表明前者具有更多的短程有序结构。
表3 枇杷核淀粉的结晶结构及片层结构参数
Table 3 Crystalline structure and lamellar structure parameters of loquat kernel starches

注:RC为相对结晶度。
指标大红袍大五星RC/%26.980±0.24b28.400±0.27aR1 047/1 0220.747±0.006b0.772±0.002aR995/1 0221.193±0.024b1.312±0.002aRg/nm2.079±0.006b2.093±0.007aDs2.528±0.001a2.498±0.009bdBragg/nm9.236±0.019a9.236±0.039a
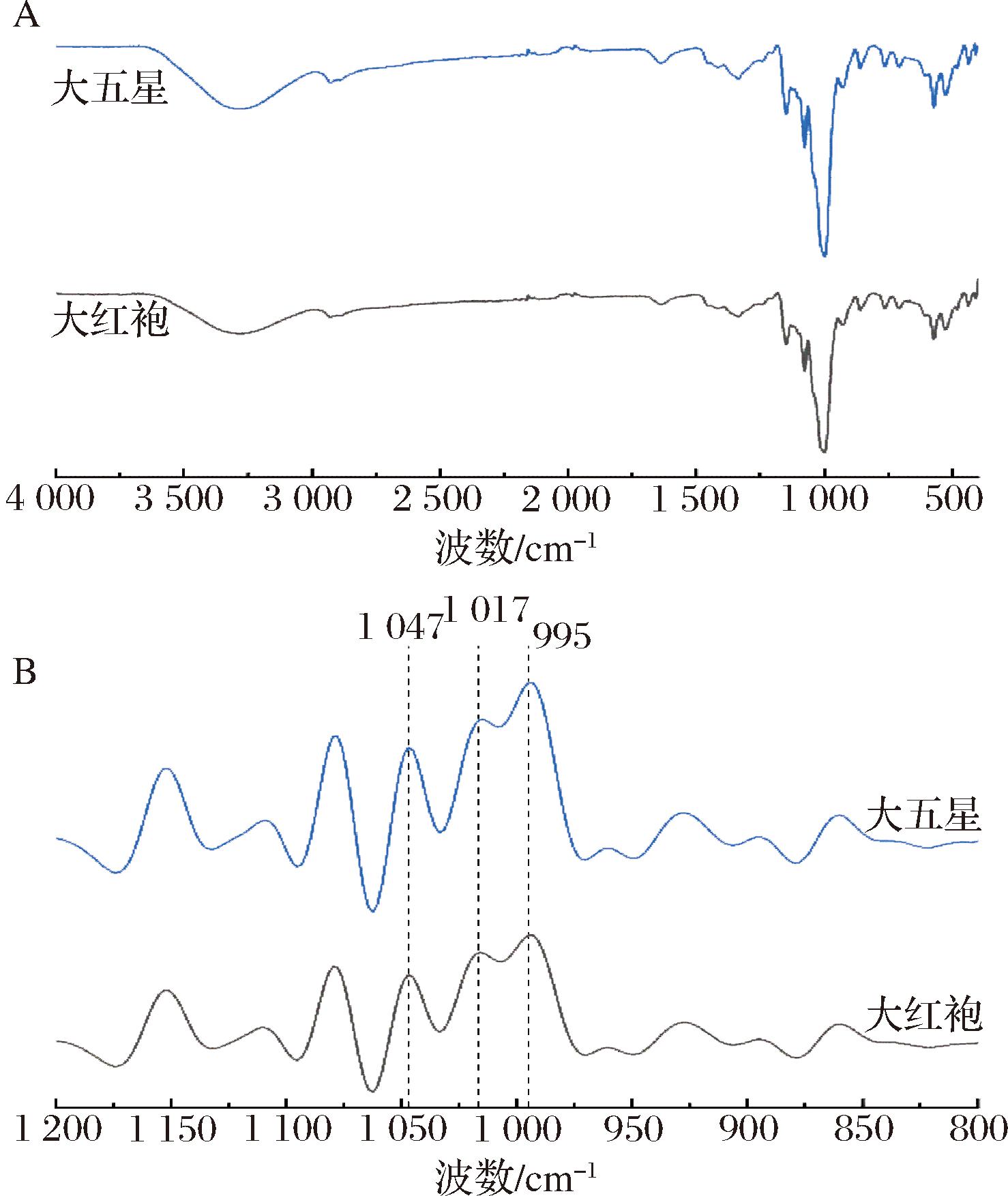
A-FTIR图谱;B-傅里叶去卷积后的FTIR图谱
图5 枇杷核淀粉的FTIR图谱及傅里叶去卷积后的FTIR图谱
Fig.5 FTIR spectra and Fourier deconvoluted FTIR spectra of loquat kernel starches
小角X-射线散射是一种可以在不对淀粉造成物理损伤的前提下研究淀粉片层结构的方法。枇杷核淀粉的一维(1D)散射强度分布如图6-A所示,淀粉样品在0.65 nm-1左右散射矢量处有明显的散射峰。散射峰的位置与淀粉片层中结晶区和无定形区的平均总厚度有关,由Guinier定律![]() 推导出lnI(q)~q2(图6-B),在低q区的斜率α与Rg的关系为
推导出lnI(q)~q2(图6-B),在低q区的斜率α与Rg的关系为![]() 对曲线进行线性拟合,得到直线的斜率后计算回转半径(Rg)。如表3所示,枇杷核淀粉的Rg分别为2.079、2.093 nm。
对曲线进行线性拟合,得到直线的斜率后计算回转半径(Rg)。如表3所示,枇杷核淀粉的Rg分别为2.079、2.093 nm。
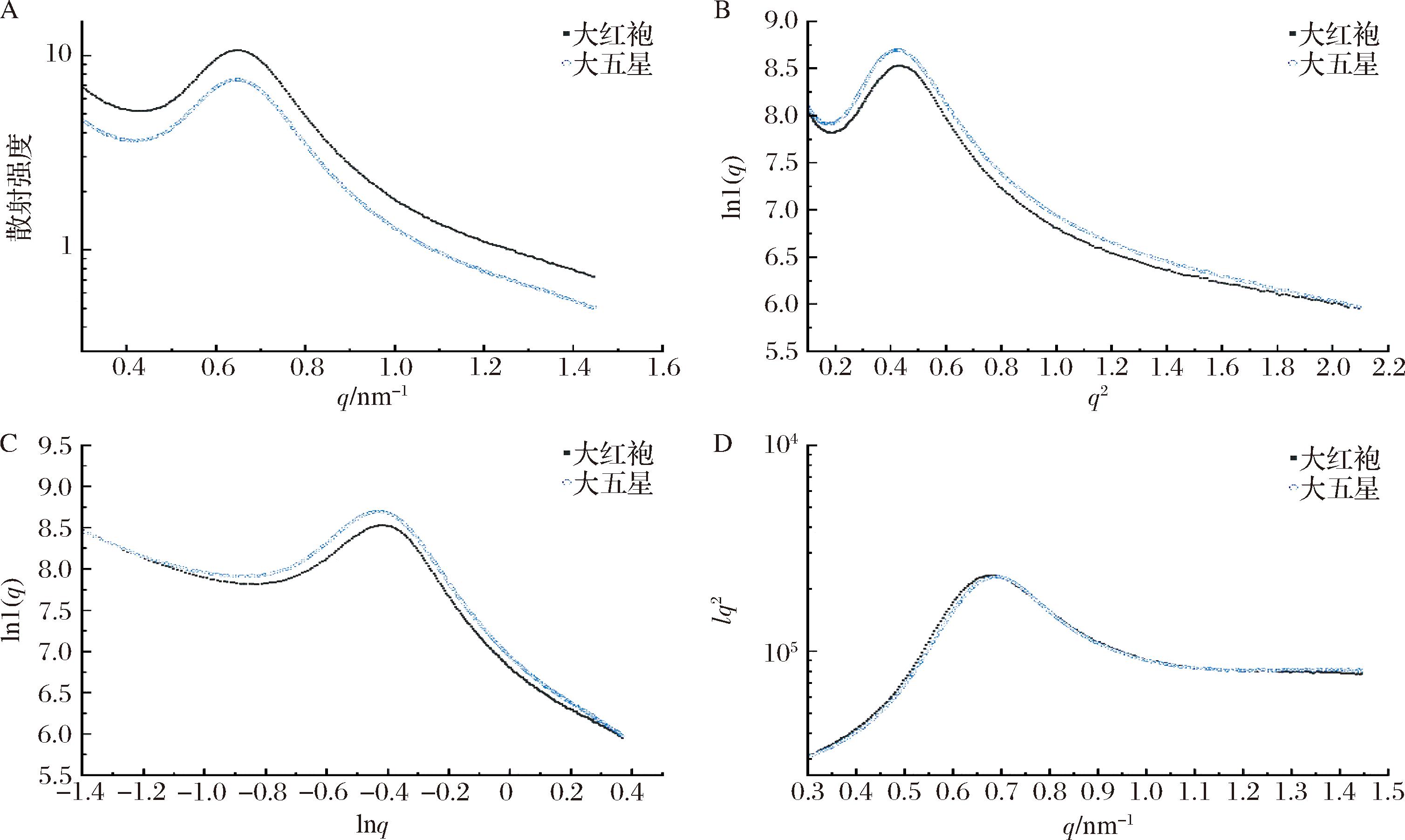
A-一维SAXS 曲线;B-Guinier 图像;C-双对数图像;D-Lorentz修正后的一维图像
图6 枇杷核淀粉的一维SAXS 曲线,Guinier 图像,双对数图像及Lorentz修正后的一维图像
Fig.6 1D SAXS curves, Guinier SAXS plots, double-logarithmic SAXS plots and Lorentz-corrected 1D SAXS profiles of loquat kernel starches
为计算分形维数,将散射体的SAXS强度表达为简单的幂律形式:I(q)=I0q-α(图6-C)。通常,当-3<α<-1时,散射体为质量分形(Dm)且Dm=-α;当-4<α<-3时,可以判断散射是来自表面或界面的反射,此类散射体归类为表面分形(Ds),Ds=6+α。
当Ds=2时表明散射体绝对光滑,反之Ds越大则样品表面越粗糙。研究发现[31],淀粉的Rg与分形维数呈相反的变化趋势。Rg值越大表明淀粉分子排列越松散;α和分形维数在一定程度上可反映散射体的致密程度,质量分形比表面分形具有更致密的结构。通过对ln(q) ~ lnI(q)作图并对图像进行线性拟合,得到斜率α,计算出枇杷核淀粉为表面分形(Ds)。大五星淀粉的Rg及Ds值更大,表明其淀粉片层更加致密,表面更加粗糙。
为计算淀粉片层的厚度,对SAXS曲线进行Lorentz修正,得到I(q2)~q曲线,如图6-D所示。峰值出现在q=0.6~0.7 nm范围内。根据Bragg定律dBragg=2π/q,计算出枇杷核淀粉片层厚度dBragg为9.2 nm。GUO等[4]报道5种果核淀粉(菠萝蜜、龙眼、枇杷、荔枝、芒果)的dBragg为8.6~9.2 nm。
2.4 枇杷核淀粉的溶解性、膨胀性、持油性和热特性
淀粉悬浮液经加热处理,淀粉颗粒吸水膨胀,一些可溶性淀粉组分(主要为直链淀粉)进入水相,淀粉的溶解性反映了这些淀粉组分溶出的程度,淀粉的膨胀性则反映了淀粉颗粒的持水能力[4]。如表4所示,大红袍淀粉具有较大的溶解度和膨胀性(P<0.05),这可能是2个品种的枇杷核淀粉的直链淀粉含量、结晶度及粒度之间的显著性差异造成的。BHAT等[32]研究发现,大米淀粉的膨胀性与其直链淀粉含量呈正相关。有研究表明,同一来源淀粉的粒度越小,膨胀性越大[33]。大红袍的直链淀粉含量较高而粒度较小,其溶解性和膨胀性也相对较高。淀粉的持油性反映淀粉与油脂结合的能力,该指标与淀粉颗粒的粒度、脂质及蛋白质等共存成分、加工测试条件等多种因素有关。研究显示(表4),2种枇杷核淀粉的持油性分别为1.02、1.04 g/g,无显著性差异。有研究显示[32],大米淀粉的持油性为2.45~2.94 g/g,为本研究中枇杷核淀粉的2~3倍。
表4 枇杷核淀粉的溶解性、膨胀性、持油性及热力学参数
Table 4 The physicochemical and thermal parameters of loquat kernel starches
注:ΔT为Tc和To之差。
指标大红袍大五星SOL/%15.58±0.84a13.97±0.29bSP/(g/g)13.66±0.48a10.70±1.12bOBC/(g/g)1.02±0.038a1.04±0.025aTo/ ℃62.56±0.37a64.01±0.19aTp/℃67.66±0.11b69.14±0.08aTc/℃75.24±0.88b76.34±0.47abΔT/℃12.68±1.24a12.32±0.66aΔHg/(J/g)3.17±0.66a3.40±0.56a
枇杷核淀粉的热力学参数如表4所示,2个品种的糊化起始温度(To)和结束温度(Tc)之间无显著差异,而大五星的峰值温度(Tp)高于大红袍的Tp(P<0.05)。这可能与大五星淀粉具有较高的相对结晶度、短程有序度和粒度有关[4,9]。ΔHg表征淀粉晶体熔化所需热焓值,ΔHg值越大说明淀粉颗粒熔化需要消耗的能量越多。与菠萝蜜种子淀粉(7.88~16.57 J/g)相比[18],枇杷核淀粉的ΔHg较小,枇杷核淀粉相对容易糊化,枇杷核淀粉的双螺旋结构的稳定性较弱,淀粉结晶区内氢键被破坏时所需的能量较少。
2.5 枇杷核淀粉的糊化特性
通过设置不同糊化温度(65、75、85、95 ℃),获得不同温度条件下的枇杷核淀粉RVA曲线,如图7所示。在65 ℃时,2种淀粉的RVA曲线呈一条水平线。从热特性结果(表4)看,该温度仅达到了淀粉的起始糊化温度,淀粉颗粒膨胀程度有限,几乎没有黏度。当温度上升到75 ℃,即发生明显的黏度变化。大红袍、大五星2种淀粉的PV分别从42.67 cP上升到3 735.67 cP,从19.67 cP上升到3 695.33 cP,二者无显著性差异(P>0.05),随着温度升高,2种淀粉的PV呈下降趋势,在95 ℃时PV仅为75 ℃时的86.12%和90.29%。同样,随着温度从75 ℃升高到95 ℃,TV和FV均呈显著下降趋势(P<0.05),TV在95 ℃时仅为75 ℃时的56.44%和57.49%,而FV在95 ℃时仅为75 ℃时的78.85%和83.56%。有趣的是, BD随着测试温度的升高而急剧增高,75 ℃时仅为250.33和268.00 cP,而95 ℃时增加到1 255.33和1 345.00 cP。这可能是由于较高温度下淀粉颗粒的解聚加剧,同时可能伴随着淀粉分子降解,从而造成谷值黏度和最终黏度下降,崩解值增加[34]。相比之下,2种淀粉在各温度条件下的糊化特性参数之间基本无显著性差异,仅在95 ℃时大红袍淀粉的PT、PV低于大五星淀粉,而75 ℃时大红袍淀粉的SB高于大五星淀粉。这说明在95 ℃时,大五星淀粉中颗粒完整且充分水化膨胀的比例更高。同时,由于大红袍淀粉的直链淀粉含量较高,因而在75 ℃时回生值较大。

A-大红袍;B-大五星
图7 枇杷核淀粉在不同加热温度下的RVA曲线
Table 7 RVA profiles of loquat kernel starches with varying temperature
2.6 枇杷核淀粉的质构特性
将RVA仪中糊化后的枇杷核淀粉经4 ℃老化得到淀粉凝胶,其质构参数见表5。结果表明,2个品种的淀粉凝胶的硬度、内聚性、胶黏性和回复性均存在显著差异(P<0.05),仅弹性无显著差异。大五星淀粉凝胶的硬度比大红袍淀粉的高出35.03%。尽管有研究指出,直链淀粉含量是决定淀粉凝胶硬度的重要指标,在淀粉凝胶形成过程中,淀粉分子的精细结构及共存成分同样对凝胶性能产生影响[35]。本研究中,大五星淀粉的直链淀粉含量约为大红袍淀粉中直链淀粉含量的94%,但其具有较低的脂质含量和较高的相对结晶度以及短程有序度,这些都有利于淀粉老化和凝胶形成[35]。ZHANG等[36]报道5种菠萝蜜种子淀粉的硬度为529~3 195 g,可见品种对淀粉凝胶硬度有较大影响。内聚性为质构曲线上2次所做正功之比,反映凝胶样品经第1次压缩后对第2次压缩的相对抵抗能力[35]。由表5可知,相比于大五星淀粉,大红袍淀粉凝胶在第1次咀嚼后具有更好的结构保持能力。胶黏性在数值上为硬度和内聚性的乘积,表5结果显示,大五星淀粉凝胶在可吞咽前的咀嚼过程中将消耗更多的能量[35]。回复性反映样品经压缩后恢复原状的能力,相比大五星淀粉,大红袍淀粉的凝胶表现出更好的回复性。
表5 枇杷核淀粉凝胶的质构参数
Table 5 The textural parameters of loquat kernel starch gels
指标大红袍大五星硬度/g404.990±49.24b546.840±54.77a内聚性0.937±0.005a0.922±0.005b弹性/%0.958±0.035a0.961±0.017a胶黏性379.620±47.46b520.600±48.19a回复性0.735±0.005a0.710±0.010b
2.7 枇杷核淀粉的体外消化特性
采用α-淀粉酶和淀粉葡萄糖苷酶,进行体外模拟淀粉消化实验。酶解过程中,在20 min以内被酶解为葡萄糖的淀粉为快消化淀粉(RDS),在20~120 min内被酶解的淀粉为慢消化淀粉(SDS),超过120 min仍未被酶解的淀粉为抗性淀粉(RS)。由表6可知,枇杷核淀粉在天然颗粒状态下,RS为主要组分,占94%以上,RDS和SDS比例分别为1.11%、1.52%和2.41%、3.71%。这表明天然枇杷核淀粉具有较好的抗酶解消化能力。林国荣等[37]报道枇杷核淀粉中RDS、SDS及RS含量分别为9.45%、6.75%和83.8%。KONG等[9]报道5种枇杷核淀粉的RDS、SDS及RS含量分别为9.31%~13.17%、4.10%~5.80%和82.36%~86.40%。图2展示了酶解(20 min、120 min)对枇杷核淀粉颗粒显微结构的影响,发现酶解在不同程度破坏了枇杷核淀粉颗粒的结构。大多数淀粉颗粒失去原本光滑表面,变得粗糙,在一些淀粉颗粒上出现孔洞。研究表明,淀粉葡萄糖苷酶和α-淀粉酶均能侵蚀淀粉颗粒的表面,但α-淀粉酶通过逐渐渗透到颗粒内部,由内向外水解淀粉颗粒,从而形成孔洞[38]。
表6 枇杷核淀粉的体外消化参数 单位:%
Table 6 The in vitro digestion parameters of loquat kernel starches

指标大红袍大五星RDS1.101±0.18a1.52±0.36aSDS2.410±0.07b3.71±0.63aRS96.490±0.25a94.76±0.27b
3 结论
从2个枇杷主栽品种(大红袍、大五星)中提取枇杷核淀粉,提取得率分别为23.97%、24.64%(鲜重),淀粉纯度为77.05%、85.62%(干基),淀粉白度(WI)分别为89.85、91.15。2种枇杷核淀粉的粒度均呈单峰分布,但大五星在50~80 μm处有一个小峰,这使得大五星的淀粉粒度分布(1.31)大于大红袍淀粉(0.93)。大红袍、大五星淀粉的D50分别为10.70 μm、12.00 μm。SEM结果表明,2种枇杷核淀粉的大颗粒呈球形或半球形,表面光滑,较小颗粒淀粉呈椭球形或多角形,这与先前的研究报道一致。SEC结果表明,枇杷核淀粉的直链淀粉含量分别为17.62%、18.83%,分支度分别为2.82%、2.83%,对直链淀粉峰(100<X<10 000)进行链长分布拟合,数据表明,直链淀粉的hAm,i=0.54、0.55,βAm,i=5.40×10-4、5.45×10-4,hAm,ii=0.58、0.60,βAm,ii=18.05×10-4、18.85×10-4,2种枇杷核淀粉的直链淀粉链长分布无显著性差异。枇杷核淀粉为CA型结晶结构,相对结晶度分别为26.98%、28.40%。相比大红袍淀粉,大五星淀粉具有更高的相对结晶度、短程有序度(R1 047/1 022)、回转半径(Rg);2种枇杷核淀粉的片层结构厚度(dBragg)为9.236 nm,均划分为表面分形(Ds)。2种枇杷核淀粉在理化性质方面存在较大差异。相比大五星淀粉,大红袍淀粉具有更大的溶解性和膨胀性(85 ℃),但具有较低的Tp和PV。质构分析结果表明,大五星淀粉的凝胶具有较大的硬度和胶黏性,但具有较小的内聚性和回复性,二者的弹性无显著性差异。此外,天然枇杷核淀粉颗粒具有抗酶解性,RS含量>94%。因此,枇杷核淀粉具有潜在作为抗消化食品配料的可能性,其良好的糊化及凝胶性能使其能够应用于淀粉凝胶食品中。本研究可为枇杷核淀粉作为一类淀粉新资源提供科技依据。
[1] MATHIOT C, PONGE P, GALLARD B, et al.Microalgae starch-based bioplastics:Screening of ten strains and plasticization of unfractionated microalgae by extrusion[J].Carbohydrate Polymers, 2019, 208:142-151.
[2] MIAO W B, WU Z W, JIANG J H, et al.The physicochemical properties of starches isolated from defatted tigernut meals:Effect of extrusion pretreatment[J].Carbohydrate Polymers, 2022, 298:120152.
[3] 谢碧霞, 陈训.中国木本淀粉植物[M].北京:科学出版社, 2008.XIE B X, CHEN X.Woody Starch Plants of China[M].Beijing:Science Press, 2008.
[4] GUO K, LIN L S, FAN X X, et al.Comparison of structural and functional properties of starches from five fruit kernels[J].Food Chemistry, 2018, 257:75-82.
[5] SANTOS G P, MIRANDA B M, DI-MEDEIROS M C B, et al.The potential exploitation of the Malay-red apple (Syzygium malaccense) seed as source of a phosphorylated starch[J].Carbohydrate Research, 2024, 535:109008.
[6] TOSIF M M, BAINS A, SADH P K, et al.Loquat seed starch—Emerging source of non-conventional starch:Structure, properties, and novel applications[J].International Journal of Biological Macromolecules, 2023, 244:125230.
[7] COSTA B P, CARPINÉ D, DA SILVA BAMBIRRA ALVES F E, et al.Thermal, structural, morphological and bioactive characterization of acid and neutral modified loquat (Eriobotrya japonica Lindl.) seed starch and its by-products[J].Journal of Thermal Analysis and Calorimetry, 2022, 147(12):6721-6737.
[8] TUROLA BARBI R C, TEIXEIRA G L, HORNUNG P S, et al.Eriobotrya japonica seed as a new source of starch:Assessment of phenolic compounds, antioxidant activity, thermal, rheological and morphological properties[J].Food Hydrocolloids, 2018, 77:646-658.
[9] KONG X L, YANG W D, ZUO Y M, et al.Characteristics of physicochemical properties, structure and in vitro digestibility of seed starches from five loquat cultivars[J].International Journal of Biological Macromolecules, 2023, 253:126675.
[10] 方修贵, 俞国伟, 曹雪丹, 等.高直链枇杷核淀粉的提取与表征[J].食品研究与开发, 2021, 42(15):84-91.FANG X G, YU G W, CAO X D, et al.Extraction and characterization of high amylose content starch from loquat kernels[J].Food Research and Development, 2021, 42(15):84-91.
[11] 许佳玉, 黄佳瑜, 薛岩伟, 等.枇杷核抗性淀粉制备工艺优化及其性质测定[J].食品安全质量检测学报, 2022, 13(12):4043-4050.XU J Y, HUANG J Y, XUE Y W, et al.Optimization of preparation technology and determination of properties of loquat kernel resistant starch[J].Journal of Food Safety and Quality, 2022, 13(12):4043-4050.
[12] CAO T L, SONG K B.Effects of gum karaya addition on the characteristics of loquat seed starch films containing oregano essential oil[J].Food Hydrocolloids, 2019, 97:105198.
[13] COSTA B P, CARPINÉ D, IKEDA M, et al.Bioactive coatings from non-conventional loquat (Eriobotrya japonica Lindl.) seed starch to extend strawberries shelf-life:An antioxidant packaging[J].Progress in Organic Coatings, 2023, 175:107320.
[14] NIE M Z, PIAO C H, WANG A X, et al.Physicochemical properties and in vitro digestibility of highland barley starch with different extraction methods[J].Carbohydrate Polymers, 2023, 303:120458.
[15] VILAPLANA F, GILBERT R G.Two-dimensional size/branch length distributions of a branched polymer[J].Macromolecules, 2010, 43(17):7321-7329.
[16] CAVE R A, SEABROOK S A, GIDLEY M J, et al.Characterization of starch by size-exclusion chromatography:The limitations imposed by shear scission[J].Biomacromolecules, 2009, 10(8):2245-2253.
[17] LI Z H, WU Z H, MO G, et al.A small-angle X-ray scattering station at Beijing synchrotron radiation facility[J].Instrumentation Science &Technology, 2014, 42(2):128-141.
[18] ZHANG Y J, ZHU K X, HE S Z, et al.Characterizations of high purity starches isolated from five different jackfruit cultivars[J].Food Hydrocolloids, 2016, 52:785-794.
[19] PAES S S, YAKIMETS I, MITCHELL J R.Influence of gelatinization process on functional properties of cassava starch films[J].Food Hydrocolloids, 2008, 22(5):788-797.
[20] CHEN X T, LI X, MAO X H, et al.Study on the effects of different drying methods on physicochemical properties, structure, and in vitro digestibility of Fritillaria thunbergii Miq. (Zhebeimu) flours[J].Food and Bioproducts Processing, 2016, 98:266-274.
[21] MORALES-TREJO F, TRUJILLO-RAMIREZ D, AGUIRRE-MANDUJANO E, et al.Ultrasound-assisted extraction of lychee (Litchi chinensis Sonn.) seed starch:Physicochemical and functional properties[J].Starch-Stärke, 2022, 74(1-2):2100092.
[22] LI H T, DHITAL S, FLANAGAN B M, et al.Amorphous packing of amylose and elongated branches linked to the enzymatic resistance of high-amylose wheat starch granules[J].Carbohydrate Polymers, 2022, 295:119871.
[23] LI C, GONG B, HU Y M, et al.Combined crystalline, lamellar and granular structural insights into in vitro digestion rate of native starches[J].Food Hydrocolloids, 2020, 105:105823.
[24] ZHAO Y T, HENRY R J, GILBERT R G.Starch structure-property relations in Australian wild rices compared to domesticated rices[J].Carbohydrate Polymers, 2021, 271:118412.
[25] NADA S S, ZOU W, LI C, et al.Parameterizing amylose chain-length distributions for biosynthesis-structure-property relations[J].Analytical and Bioanalytical Chemistry, 2017, 409(29):6813-6819.
[26] CORREIA P, CRUZ-LOPES L, BEIRAO-DA-COSTA L.Morphology and structure of chestnut starch isolated by alkali and enzymatic methods[J].Food Hydrocolloids, 2012, 28(2):313-319.
[27] HE W, WEI C X.Progress in C-type starches from different plant sources[J].Food Hydrocolloids, 2017, 73:162-175.
[28] HUONG N T M, HOA P N, HUNG P V.Varying amylose contents affect the structural and physicochemical characteristics of starch in mung bean[J].International Journal of Food Properties, 2021, 24(1):737-748.
[29] FERRAZ C A, FONTES R L S, FONTES-SANT’ANA G C, et al.Extraction, modification, and chemical, thermal and morphological characterization of starch from the agro-industrial residue of mango (Mangifera indica L.) var.Uba[J].Starch-Starke, 2019, 71(1-2):1800023.
[30] CHOUDHARY P, DEVI T B, DAWANGE S P, et al.Valorization of mango by-products:Extraction and characterization of starch from seed kernels[J].Starch-Starke, 2023:2200262.
[31] YANG Z, GU Q F, LAM E, et al.In situ study starch gelatinization under ultra-high hydrostatic pressure using synchrotron SAXS[J].Food Hydrocolloids, 2016, 56:58-61.
[32] BHAT F M, RIAR C S.Effect of amylose, particle size &morphology on the functionality of starches of traditional rice cultivars[J].International Journal of Biological Macromolecules, 2016, 92:637-644.
[33] SINGH N, KAUR L.Morphological, thermal, rheological and retrogradation properties of potato starch fractions varying in granule size[J].Journal of the Science of Food and Agriculture, 2004, 84(10):1241-1252.
[34] LIU S Y, YUAN T Z, WANG X Y, et al.Behaviors of starches evaluated at high heating temperatures using a new model of Rapid Visco Analyzer-RVA 4800[J].Food Hydrocolloids, 2019, 94:217-228.
[35] IRANI M, RAZAVI S M A, ABDEL-AAL E S M, et al.Viscoelastic and textural properties of canary seed starch gels in comparison with wheat starch gel[J].International Journal of Biological Macromolecules, 2019, 124:270-281.
[36] ZHANG Y J, ZHANG Y T, XU F, et al.Molecular structure of starch isolated from jackfruit and its relationship with physicochemical properties[J].Scientific Reports, 2017, 7(1):13423.
[37] 林国荣, 张丽芬, 黄晓玲.微波处理对枇杷核淀粉理化性质和消化性能的影响[J].食品工业科技, 2023, 44(15):55-61.LIN G R, ZHANG L F, HUANG X L.Effects of microwave treatment on the physicochemical and digestive properties of loquat kernel starch[J].Science and Technology of Food Industry, 2023, 44(15):55-61.
[38] LIN L S, HUANG J, ZHAO L X, et al.Effect of granule size on the properties of lotus rhizome C-type starch[J].Carbohydrate Polymers, 2015, 134:448-457.