作为肠道中一种重要的益生菌,双歧杆菌已经被广泛应用于健康食品和药物制剂。其益处包括改善因肠道功能紊乱引起的肠炎性疾病[1]、抑制活性氧水平的提高、有效清除各种自由基、增强宿主的抗氧化能力[2],以及提高机体免疫力[3]。1899年,法国研究学者TISSIER首次分离并发现双歧杆菌[4],并于1984年正式由《伯杰细菌鉴定手册》作为独立的双歧杆菌属进行介绍[5]。直到2012年5月,《伯杰氏手册》第5卷的更新公开面世,双歧杆菌分类学的研究才取得了更为深入的发展[6]。这一系列发现为双歧杆菌的应用和研究提供了坚实的基础。
乳酸菌主要通过二分裂的方式进行生长和发育[7]。乳酸菌的分裂增殖过程可以大致分为B、C、D时期。B时期是指自上次完整分裂后到DNA开始复制的时间,此时菌体会准备足够的营养物质,为下一个时期做好准备;C时期涉及DNA的复制和均分,此时细胞膜尚未分裂,细胞质量是分裂前的2倍;而在D时期,隔膜形成,形成2个子代细胞,并生成新的细胞膜[8-9]。这一生长发育过程的详细描述有助于更全面地理解乳酸菌的细胞生物学特性。
在培养过程中,长双歧杆菌婴儿亚种相较于其他双歧杆菌属生长增殖能力及菌体活性较差,这不利于后期的产业化应用及开发。传统的乳酸菌增殖检测常使用平板计数法,由于受到人员因素的影响较大,检测时间稍长,并且无法准确评估菌株增殖过程中的损伤程度。相较而言,流式细胞术检测速度更快,能够在短时间内对高达百万级别的单细胞进行检测,并且具有较高的灵敏度[10-12]。这使其更能够从单细胞角度全面评估菌体细胞的生理状态[13-14]。本研究以长双歧杆菌婴儿亚种B8762为研究对象,通过荧光探针示踪,运用流式细胞术对分裂过程中的菌体状态进行评估,解析菌株在不同培养条件下的分裂周期的差异,揭示了长双歧杆菌婴儿亚种分裂增殖与菌体活性的内在联系。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
实验菌株为长双歧杆菌婴儿亚种B8762(Bifidobacterium longum subsp. infantis B8762),以下简称B8762。该菌株在改良MRS培养基中进行培养,培养基在121 ℃维持15 min的条件下进行灭菌,培养基初始pH值调整为6.20±0.02,菌株活化培养温度控制在(37±0.5) ℃。
1.1.2 试剂
细菌学蛋白胨、牛肉浸粉,广东环凯微生物科技有限公司;酵母浸粉,安琪酵母股份有限公司;葡萄糖、柠檬酸三铵、无水乙酸钠、氯化钠、磷酸氢二钾,天津市福晨化学试剂有限公司;吐温-80,Amresco公司;硫酸镁,天津市致远化学试剂有限公司;硫酸锰,天津永晟精细化工有限公司;L-半胱氨酸盐酸盐,国药集团化学试剂有限公司;细胞增殖示踪荧光探针(carboxyfluorescein diacetate, succinimidyl ester,CFDASE),Med Chem Express公司;碘化丙啶(propidium iodine,PI)染料,Solarbio公司;SYTO9染料,赛默飞世尔科技公司。
1.2 仪器与设备
ZHJH-C1112C超净工作台,上海智城分析仪器有限公司;SX-700高压蒸汽灭菌,日本 Tomy Digital Biology公司;LIT-700 W生化培养箱,上海一恒科学仪器有限公司;BX-53光学显微镜,日本OLYMPUS公司;DM4000B徕卡显微镜,德国恩斯特·徕茨公司;HWS-18电热恒温水浴锅,上海坤诚科学仪器有限公司;MOFLO ASTRIOS EQ流式细胞仪,贝克曼库尔特商贸(中国)有限公司;FE28 pH计,梅特勒-托利多仪器(上海)有限公司;5310R台式高速冷冻离心机,德国EppendorfAG公司。
1.3 实验方法
1.3.1 培养基的配制
改良MRS液体培养基的配制(g/L):细菌学蛋白胨10,牛肉浸粉8,酵母浸粉4,葡萄糖20,吐温-80 1 mL,磷酸氢二钾2,无水醋酸钠5,柠檬酸三铵2,硫酸镁0.2,硫酸锰0.05,纯化水1 000 mL,L-半胱氨酸盐酸盐1,调节液体培养基初始pH值为6.20±0.02;121 ℃灭菌15 min备用。
改良MRS固体培养基的配制:在改良MRS液体培养基的基础上,添加10 g/L的琼脂。
1.3.2 菌株的活化扩培
将-80 ℃保存的冻存管接入液体培养基中,(37±0.5) ℃ 严格厌氧培养,按照2%(体积分数)进行传代,待传代2次后作为接种液保存备用。
1.4 染料浓度优化及验证
1.4.1 荧光染料的选取
CFDASE是二乙酸荧光素(fluorescein diacetate,FDA)的衍生物,能够穿透细胞膜并进入胞内。该探针本身不具有荧光[15]。一旦进入活细胞内,它会被胞浆中的酯酶催化,生成羧基荧光素琥珀酰亚胺酯,从而在488 nm下激发出绿色荧光。在乳酸菌细胞的分裂增殖过程中,经CFDASE标记的菌体细胞荧光能够均匀分布到2个子代细胞中,使得这种荧光染料能够用于对菌体细胞分裂增殖的定量分析研究[16]。这一技术有望为乳酸菌细胞生物学的深入研究提供有力的工具。
1.4.2 染料最佳浓度优化
分别使用二甲基亚砜对CFDASE粉末进行溶解,配制为不同浓度的稀释液,选取10、20、50、100、200 μmol/L的终浓度梯度进行测试。并按照2%(体积分数)的接种量接种到4代发酵培养液中进行(37±0.5) ℃厌氧培养,并定时取样对发酵过程中的各项参数指标进行测定。根据测定的相关参数,判断最佳的染料使用终浓度。
1.4.3 染料毒性测试
使用未标记的菌体细胞为对照组,不同染料浓度的菌体细胞为测试组,对于发酵过程中的菌株进行定期取样,使用平板计数法对活菌数进行测定,使用固体改良MRS培养基进行培养,(37±0.5) ℃倒置培养(72±0.5) h,单个样品设置3个平行,单位为CFU/mL。以评估发酵全程当中菌株活菌数的动态变化。
1.4.4 染料稳定性测试
对于染料的稳定性进行贮藏实验,以未标记的菌体细胞为对照组,将不同组别的发酵样本贮藏于4 ℃中贮存1 d,贮藏到时间后,使用平板计数法进行菌体可培养活菌数的检测,并使用流式细胞术检测标记菌体的荧光强度,对染料的稳定性进行检测。
1.5 菌体状态的检测
1.5.1 流式细胞术检测菌体分裂周期及菌体活性
采用SYTO9和PI进行菌体细胞的双染。SYTO9在488 nm的激发光下发射绿色荧光,而PI只能穿透损伤的细胞膜,与DNA结合后在561 nm的激发光下发射红色荧光[17]。标记后的菌体细胞经过无菌生理盐水稀释至106~107 CFU/mL后上机检测。收集10 000个events的数据。随后,使用FlowJo 10.9.0进行数据处理。菌体分裂增殖采用CFDASE染料进行标记,并拟合反卷积峰。
1.5.2 平板计数法测定活菌数
使用灭菌后的生理盐水对发酵液进行稀释,稀释到合适倍数后,使用移液器吸取1 mL菌体悬浊液注入培养平皿当中,倒入适量的固体改良MRS培养基,待凝固后,(37±0.5) ℃倒置培养(72±0.5) h,单个样品设置3个平行,单位为CFU/mL。
1.6 数据处理及统计学分析
数据汇总及整理使用Microsoft Excel 2021进行,数理学统计及差异性分析使用IBM SPSS 26进行处理。流式细胞术数据处理使用FlowJo 10.9.0进行处理,并进行荧光强度及峰值拟合,其他图形绘制使用Origin PRO 2023进行绘制,Adobe illustrator进行排版整合。
2 结果与分析
2.1 CFDASE染料最佳浓度优化
CFDASE染料可以用来跟踪分裂增殖的细胞,其溶剂DMSO属于有机溶剂,作为稳定的染色载体使用,但是本身含有部分的弱氧化性,对于菌体的增殖有一部分影响。因此需要对染料使用的浓度进行优化,选取满足分析分裂增殖同时对菌体生长影响最小的染料浓度(表1)。
表1 不同浓度染料的关键点数值![]()
Table 1 The specific growth rate in different ![]()
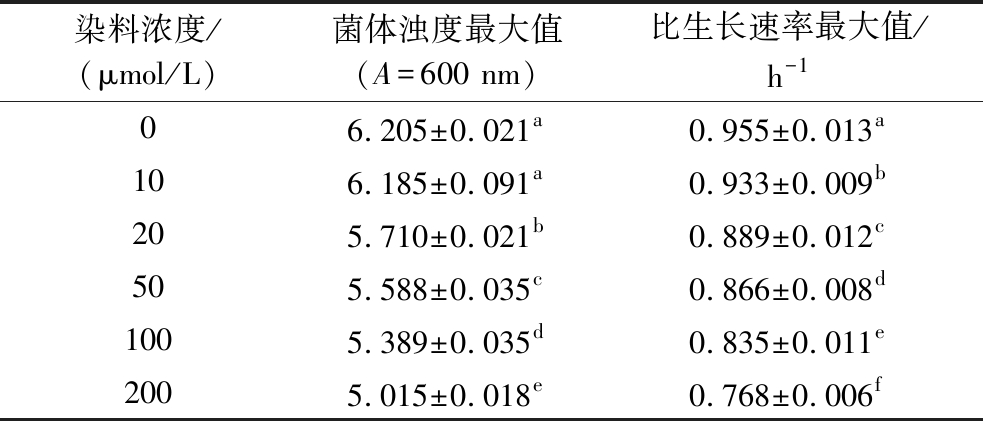
注:不同小写字母代表组间的差异性,P<0.05为差异显著(下同)。
染料浓度/(μmol/L)菌体浊度最大值(A=600 nm)比生长速率最大值/h-106.205±0.021a0.955±0.013a106.185±0.091a0.933±0.009b205.710±0.021b0.889±0.012c505.588±0.035c0.866±0.008d1005.389±0.035d0.835±0.011e2005.015±0.018e0.768±0.006f
如图1-A所示,当染料浓度>10 μmol/L时,菌体的生长速率开始出现下降。20 μmol/L的染料浓度下,最大比生长速率为(0.889±0.012) h-1,与空白对照组(0.955±0.013) h-1相比,存在显著差异(P<0.05)。高浓度的染料显著影响了菌体的生长发育,导致吸光度随着染料浓度的增加而降低。当染料浓度>20 μmol/L时,菌体浊度与最大比生长速率开始显著下降(P<0.05)。如图1-B所示,关键点菌体浊度呈现下降趋势,当染料浓度为10 μmol/L时,尽管相比于对照组菌体浊度略有下降,但二者之间没有显著性差异(P>0.05)。

A-不同染料浓度侵染下的菌体生长曲线;B-不同染料浓度侵染下的关键点菌体吸光度;C-不同染料浓度侵染下菌体pH值变化与乳酸生成曲线;D-不同染料浓度侵染下各时期的菌体活菌数
图1 最佳染料浓度优化
Fig.1 Optimal dye concentration optimization
注:虚线标注为关键点数据,不同小写字母表示差异显著(P<0.05)。
根据图1-C可得,长双歧杆菌婴儿亚种B8762在相同培养液中的pH值变化趋势相似,但经过标记的菌体细胞产酸能力存在差异。随着染料浓度的增加,菌体的产酸能力受到抑制,导致发酵液的pH值相较于未标记菌体较高,差异显著(P<0.05)。
由表2可知,在经标记的菌体细胞中,10 μmol/L染料浓度下的乳酸生成速率最大值为(0.558±0.006) g/(L·h)。相较于未标记菌体,生成速率稍低,但二者终点pH值相近,无明显差异。然而,当染料浓度>20 μmol/L时,乳酸生成速率迅速下降,数值由(0.537±0.017)g/(L·h)降至(0.512±0.021) g/(L·h),差异显著(P<0.05)。同时,pH值变化速率也由(0.226±0.007) ΔpH/h下降至(0.157±0.007) ΔpH/h,差异显著。这表明较高浓度的染料对菌体的综合生长情况具有不同程度的抑制作用。
表2不同浓度染料中的产酸速率![]()
Table 2 Rate of acid production in dyes of different ![]()
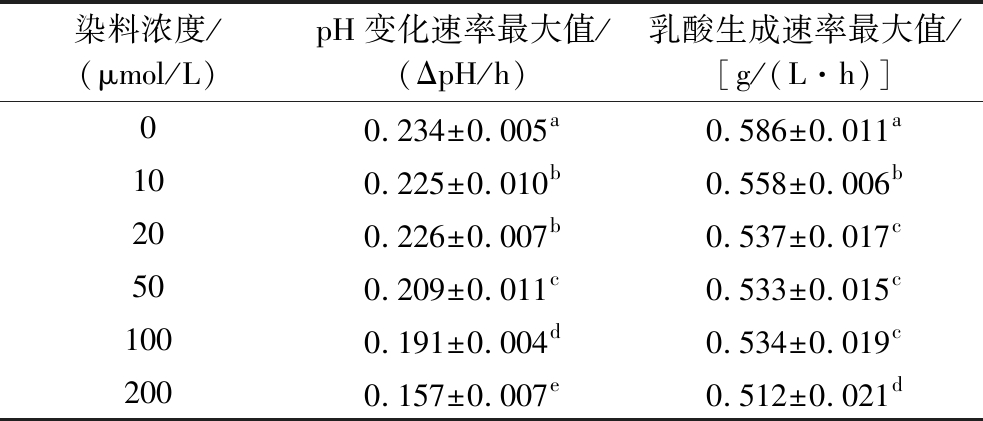
染料浓度/(μmol/L)pH变化速率最大值/(ΔpH/h)乳酸生成速率最大值/[g/(L·h)]00.234±0.005a0.586±0.011a100.225±0.010b0.558±0.006b200.226±0.007b0.537±0.017c500.209±0.011c0.533±0.015c1000.191±0.004d0.534±0.019c2000.157±0.007e0.512±0.021d
对长双歧杆菌婴儿亚种B8762进行活菌计数,并将其置于(37±0.5) ℃的厌氧培养箱中,全程保持避光。根据图1-D可知,菌体细胞的初始活菌数差异不显著(P>0.05)。然而,随着培养时间的延长,在对数生长期初期,不同染料浓度下的可培养活菌数产生显著差异(P<0.05)。当染料浓度>20 μmol/L时,从对数生长期初期开始,活菌数开始降低,相较于未标记菌体,下降比例由20 μmol/L的11.97%增加到200 μmol/L的23.95%。到对数生长期末期,高浓度染料影响菌体生长差异更加显著,200 μmol/L时活菌数相较于未标记菌体下降30.55%。
综上所述,较低浓度10 μmol/L下的染料对于菌体的生长影响小,对菌体细胞培养过程中的抑制作用可以忽略。本研究选择10 μmol/L终浓度的CFDASE染料进行后续实验。
2.2 标记菌体的稳定性测试
荧光染料容易发生荧光淬灭,导致染料在使用过程中失去部分荧光活性,影响染料的稳定性和检测灵敏度,进而导致数据测定的不准确。因此,在使用荧光染料时,需要进行避光处理以维护其稳定性。同时,对标记后的菌体进行贮藏稳定性实验,检测标记后的菌体细胞中荧光染料的稳定性,这对于确保实验数据的准确性至关重要。
由图2可知,在对数初期对菌体细胞进行取样,此时由于绝大多数菌体处于延滞期,尚未开始大规模的分裂增殖。因此,标记菌体与对照组之间在贮藏前后均无明显差异(P>0.05)。随着培养时间的延长,在对数中期开始出现数值波动。此时,未标记菌体活菌数在贮藏前后的降幅为4.32%,而已标记菌体细胞在贮藏后(4 ℃,24 h)的降幅为2.78%。直至对数末期,未标记菌体细胞和标记菌体细胞的降幅分别为3.60%和1.70%。已标记菌体细胞表现出较好的稳定性,其在贮藏过程中的死亡占比相较对照组较少。表明在模拟荧光染料稳定性测试中,荧光染料导致的可培养活菌数的损失在试验要求范围内。为后续研究提供了可靠的数据基础。
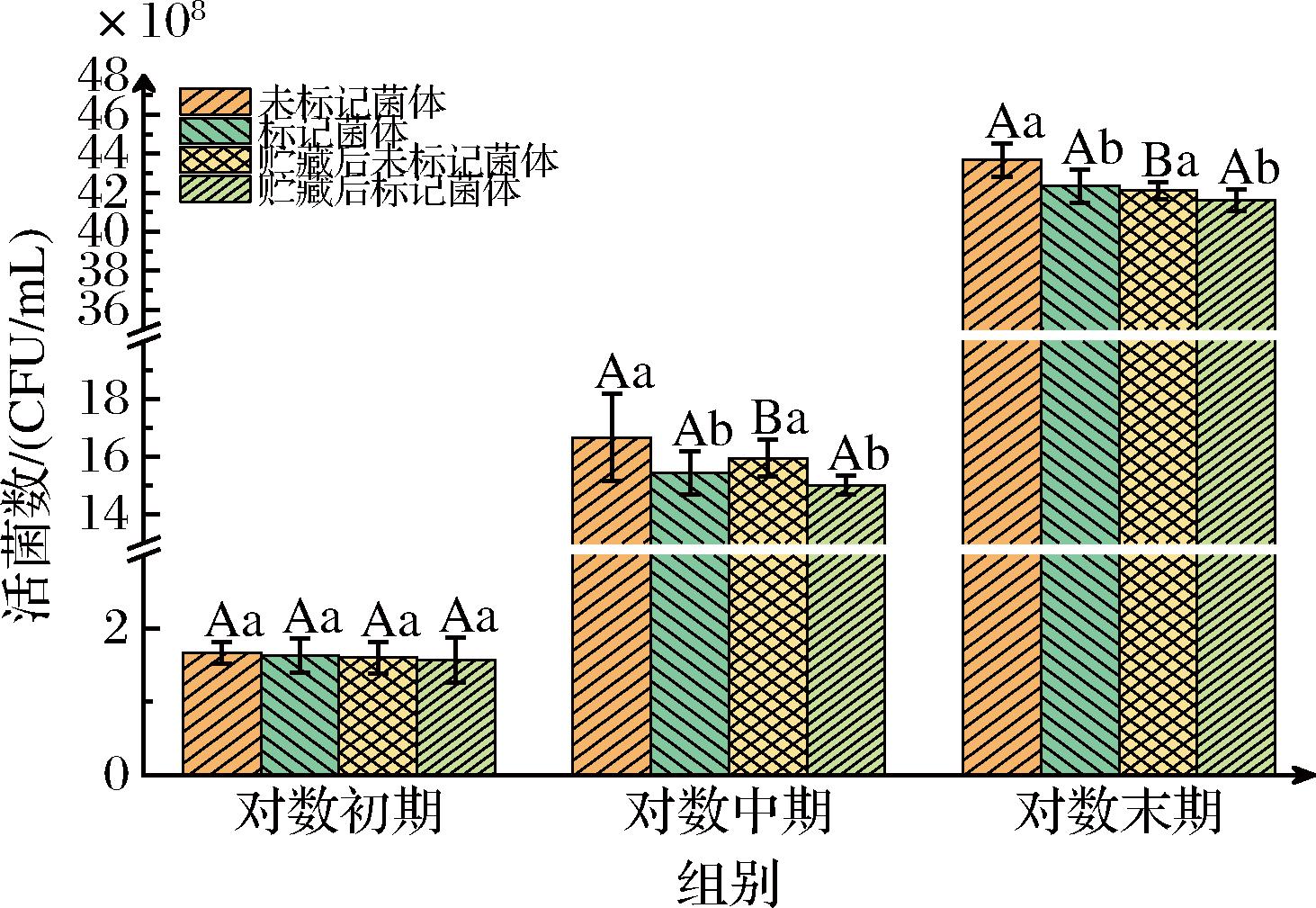
图2 染料标记后稳定性测试
Fig.2 Stability test after dye labeling
注:大写字母表示菌体贮藏前后的差异性,小写字母表示标记菌体与未标记菌体之间的差异性,不同字母之间代表差异显著(P<0.05)。
2.3 流式细胞术检测菌体分裂状态与活性
菌体在不同培养条件下分裂状态存在差异,将菌体上机检测后,对荧光强度进行量化,拟合得到反卷积峰,每个峰代表一个世代群体。即菌体进行了1次的有效分裂。黑色曲线为原始未进行拟合的荧光峰图,拟合后的不同世代峰代表的不同世代的菌体数目,使用绿色峰进行标识,拟合峰的准确性由拟合后的均方根误差值(root mean square error,RMS)进行确定,该值在进行细胞增殖拟合时,应≤0.5。
如图3所示,“0”世代菌群数量>“1”世代菌群,可能是由于染色过程中荧光标记了部分培养基成分,在洗涤过程中有部分残留所致。在实验中反复尝试消除,在测定之前使用预冷的无菌PBS对菌悬液进行洗涤后上机,最大限度的固定菌体所在时期,避免荧光信号的干扰,但仍出现拟合峰与拐点部分不对应的情况,可能是由于上机检测时,各世代菌群存在分裂尚未完全结束的情况。2个培养温度下反卷积峰拟合后RMS值均小于0.5,拟合有效。由图3可知,培养后的菌体荧光强度反卷积峰发生荧光偏移现象,荧光强度逐渐由接近106下降至103左右,表明菌体在进行分裂增殖。2个温度条件下的“0”世代细胞群体占比接近,均检测出6次有效分裂,但各自细胞群体数量存在显著差异。

A-对照组,菌体自身荧光;B-37 ℃培养条件下分裂反卷积峰;C-42 ℃培养条件下分裂反卷积峰
图3 不同温度下菌体分裂反卷积峰拟合
Fig.3 Deconvolution peak fitting of bacterial division at different temperatures
注:RMS值在进行细胞增殖拟合时,应≤0.5;黑色曲线为原始未进行拟合的荧光直方图,绿色峰为经FlowJo 10.0.9细胞增殖平台拟合后的反卷积峰。
利用拟合后的反卷积峰对各世代群体进行量化,如表3所示。未进行分裂的“0”世代菌体细胞数量变少,其余世代反卷积峰逐渐增大,表明不同世代的细胞群体数量在动态变化,分裂持续进行。由此可知,菌体细胞各世代群体细胞分裂过程并不同步,整个群体分布由各个世代菌体细胞不均匀组合而成。2个温度条件下,菌群数量都以“3”、“4”世代为主,但较高温度培养时,由于分裂过程的不同步,菌体分布更趋向于高世代群体,表明该温度下菌体分裂进程更快,高温下“5”、“6”世代的群体数量相较于37 ℃上涨27.84%和142.31%,涨幅明显。
表3 不同温度下各世代菌群占比
Table 3 Proportional distribution of generational bacterial population at different temperatures

注:总细胞群体数<100%是由于数据处理过程中进行圈门及剔除部分细胞碎片导致。
不同世代数37 ℃42 ℃菌群占比/%活菌数/(×108 CFU/mL)菌群占比/%活菌数/(×108 CFU/mL)06.32.46±0.017.12.70±0.0413.91.52±0.044.41.67±0.02216.56.44±0.0211.44.34±0.03323.39.10±0.0224.59.32±0.08427.910.90±0.1122.78.64±0.15515.15.89±0.1319.47.38±0.1362.30.89±0.015.62.13±0.06总和95.339.07±0.2195.138.08±0.31
图4-A为菌体明场下的成像情况;图5-B图为PI单染菌体的荧光散点图分布,上机前对菌体细胞进行破碎处理,人为干扰菌体的膜结构,使其受损,菌体荧光分布主要集中在103~104区域,可得Q1区域为膜结构受损严重区域,几乎没有完整膜结构,PI侵染后的菌体在561 nm下激发出红色荧光(图4-B);图5-C为SYTO9单染菌体的荧光散点图分布,可以看出菌体分布在横坐标为102~103区域,少量菌体散布在菌体自身荧光部分,SYTO9侵染的菌体细胞膜结构完整,未受损伤,染料经膜渗透后与核酸结合,在488 nm 下激发出绿色荧光(图5-C),膜结构完整时PI染料无法进入胞内。可得Q3区域为膜结构完整的菌体分布区域;Q2群体为受损细胞,细胞膜结构开始出现损伤,但仍短暂保留部分菌体活性,2种染料均可侵染,2种荧光染料叠加后激发出黄色荧光;综上所述对菌体进行四分门圈门法,进而判断菌体的膜完整性[17]。

A-菌体明场成像形态;B-PI单染菌体形态;C-SYTO9单染菌体形态;D-PI与SYTO9双染受损菌体形态
图4 不同染料侵染下菌体形态
Fig.4 Bacterial morphology under infection with different dyes

A-对照组;B-PI单染菌体;C-SYTO9单染菌体;D-菌体PI与SYTO9双染
图5 不同染料侵染下菌体散点分布图
Fig.5 Scatter distribution diagram of bacterial cell flow under infection with different dyes
细胞膜是细胞的外部边界,它包裹并保护细胞内的结构和细胞质。细胞膜具有重要的生理功能,其中包括:屏障功能、维持细胞内稳定性和维持胞内外物质转运等功能。当菌体细胞膜完整性受到破坏时,可能会导致细胞内的物质泄漏到外部环境,致使细胞死亡;也可能导致细胞丧失胞内外物质转运或细胞增殖等生理功能。
由图6可知,37 ℃下,膜结构完整的细胞群体占比为95.7%,膜结构受损的细胞群体占比1.7%,42 ℃ 下,膜结构完整的细胞群体占比为92.4%,膜结构受损的细胞群体占比4.57%,较高培养温度下膜结构完整性损失比例增大了168.82%。表明较高温度时,菌体受损伤程度明显加大,膜完整性受温度影响较为敏感。
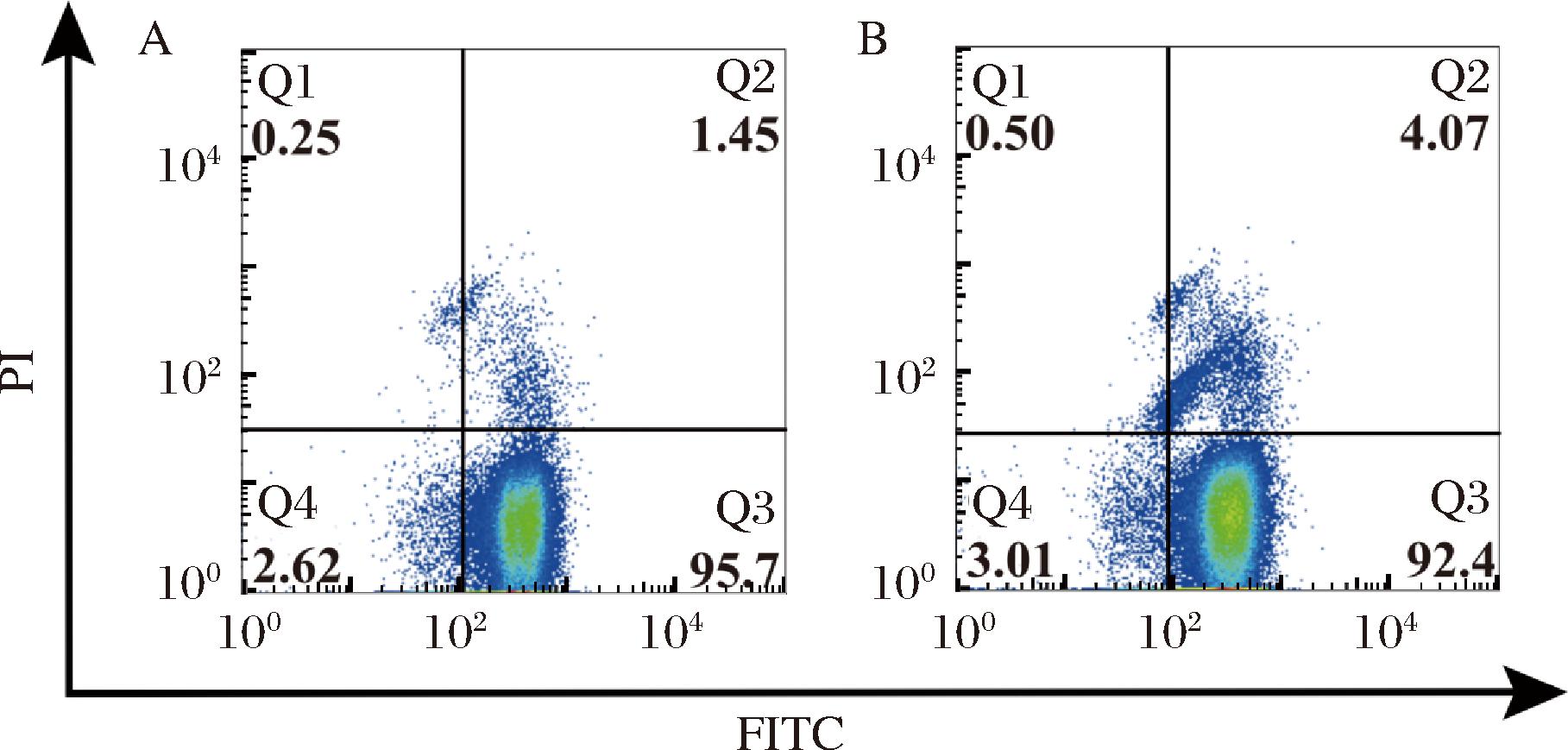
A-37 ℃下菌体膜完整性散点图;B-42 ℃下菌体膜完整性散点图
图6 流式细胞术检测菌体膜完整性
Fig.6 Detection of bacterial membrane integrity by flow cytometry
在不同温度下,菌体增殖分裂状态良好,对应的细胞群体相对稳定。不同世代的细胞群体呈动态变化,表明增殖过程当中的各世代菌体细胞的分裂并不同步。结合流式细胞术对菌体膜完整性的定量分析,较高温度虽然获得了更多的高世代群体分布,但是菌体膜结构完整性损失比例更高。表明菌体分裂过程受温度的影响显著。
3 结论
本试验通过对荧光示踪的染料进行浓度筛选及验证,得到该菌株在10 μmol/L的CFDASE染料侵染下,生长状态良好,且满足分裂过程中荧光强度的测定,较低浓度的染料满足实验要求。通过流式细胞术对该菌株进行分裂周期检测,揭示了乳酸菌在不同世代群体的荧光信号变化,培养过程中,荧光强度逐渐由106下降至103左右,表明菌体在持续分裂。各世代菌体细胞分裂不同步,高温下“5”、“6”世代的群体数量相较于37 ℃上涨27.84%和142.31%,涨幅明显,表明分裂进程受温度的影响显著。较高温度虽能促进菌体细胞的分裂进程,但菌体细胞活性的负面影响也被放大,膜结构完整性损失比例增大了168.82%,菌体活性下降。
因此量化菌体分裂过程中的细胞群体数量及动力学参数,可能会为乳酸菌研究领域带来更多的突破,为其工业应用提供更多可能性。未来,可以通过精细调控培养条件、优化培养基成分等手段,实现对乳酸菌分裂过程的更精准操控,从而提高乳酸菌发酵过程中菌体的活性,实现高活菌数、高活性的乳酸菌制剂开发。
[1] JIAN Y P, ZHANG D, LIU M D, et al.The impact of gut microbiota on radiation-induced enteritis[J].Frontiers in Cellular and Infection microbiology, 2021, 11:586392.
[2] WANG Y, WANG J H, LI H H, et al.Antioxidant effects of Bifidobacterium longum T37a in mice weight loss and aging model induced by D-galactose[J].BMC Microbiology, 2023, 23(1):103.
[3] LAURSEN M F, SAKANAKA M, VON BURG N, et al.Bifidobacterium species associated with breastfeeding produce aromatic lactic acids in the infant gut[J].Nature microbiology, 2021, 6(11):1367-1382.
[4] ![]() G, GUEIMONDE M.The gut microbiota in infants:Focus on Bifidobacterium[J].Microorganisms, 2023, 11(2):537.
G, GUEIMONDE M.The gut microbiota in infants:Focus on Bifidobacterium[J].Microorganisms, 2023, 11(2):537.
[5] 李文均, 陈瑛, 田新朋, 等.《伯杰氏鉴定细菌学手册》和“伯杰氏国际系统微生物学学会”历史回顾、发展现状及未来展望[J].微生物学报, 2023, 63(5):1714-1723.LI W J, CHEN Y, TIAN X P, et al.Bergey’s manual of determinative bacteriology and Bergey’s international society for microbial systematics(BISMiS):Past, present and future[J].Acta Microbiologica Sinica, 2023, 63(5):1714-1723.
[6] GOODFELLOW M, KAMPFER P, BUSSE H J, et al.Bergey’s Manual of Systematic Bacteriology[M].New York:Springer Science Business Media, 2012:33-2028.
[7] CAYRON J, DEDIEU-BERNE A, LESTERLIN C.Bacterial filaments recover by successive and accelerated asymmetric divisions that allow rapid post-stress cell proliferation[J].Molecular Microbiology, 2023, 119(2):237-251.
[8] 李娜. 细长聚球藻PCC 7942中CcdR蛋白调控细胞生长和分裂的分子机制研究[D].济南:山东师范大学, 2023.LI N.Study on the molecular mechanism of CcdR protein regulating cell growth and division in Polycoccus elongatus PCC 7942 [D].Jinan:Shandong Normal University, 2023.
[9] 洪歆怡. 细菌细胞周期与其关键蛋白的单细菌水平多参数定量关系研究[D].厦门:厦门大学, 2020.HONG X Y.Multi-parameter quantitative relationship between bacterial cell cycle and single bacterial levels of key proteins [D].Xiamen:Xiamen University, 2020.
[10] DING Q, MA D L, LIU G Q, et al.Light-powered Escherichia coli cell division for chemical production[J].Nature Communications, 2020, 11(1):2262.
[11] OSELLA M, NUGENT E, COSENTINO LAGOMARSINO M.Concerted control of Escherichia coli cell division[J].Proceedings of the National Academy of Sciences, 2014, 111(9):3431-3435.
[12] GANUSOV V V, PILYUGIN S S, DE BOER R J, et al.Quantifying cell turnover using CFSE data[J].Journal of Immunological Methods, 2005, 298(1-2):183-200.
[13] CHUNG S, KIM S H, SEO Y, et al.Quantitative analysis of cell proliferation by a dye dilution assay:Application to cell lines and cocultures[J].Cytometry Part A, 2017, 91(7):704-712.
[14] LIESCHKE E, WANG Z L, CHANG C, et al.Flow cytometric single cell-based assay to simultaneously detect cell death, cell cycling, DNA content and cell senescence[J].Cell Death &Differentiation, 2022, 29(5):1004-1012.
[15] LYONS A B, BLAKE S J, DOHERTY K V.Flow cytometric analysis of cell division by dilution of CFSE and related dyes[J].Current protocols in cytometry, 2013, 64(1):9.11.1-9.11.12.
[16] CHEN S W, NIU H Y, WU Y F, et al.Influence of lactic acid on cell cycle progressions in Lactobacillus bulgaricus during batch culture[J].Applied Biochemistry and Biotechnology, 2021, 193(3):912-924.
[17] 邓颖. 基于流式细胞术的SYTO 9/PI细菌活性判定方法优化及其机理[D].广州:暨南大学, 2020.DENG Y.Optimization and mechanism of bacterial activity determination method of SYTO 9/PI based on flow cytometry[D].Guangzhou:Jinan University, 2020.