RNA干扰(RNA interference,RNAi)是将与mRNA对应的双链RNA(double-stranded RNA,dsRNA)导入细胞,使mRNA发生特异性的降解,导致其相应的基因沉默的现象[1]。RNAi作为生物机体抵御病毒侵入、抑制转座子活性以及调控基因表达的一种方式,其具有特异性强、高效、稳定等优点[2-4]。专门设计的外源性 dsRNA 传递到细胞可以使靶基因沉默,在害虫防治[5-6]、抑菌[7]、抗病毒[8-9]等多个领域得到应用。
新鲜果蔬在采后易发生酶促褐变,导致商品外观、质量的下降和货架期的缩短,限制了果蔬加工与贮运行业的发展。果蔬酶促褐变主要是氧化酶所引起的,包括多酚氧化酶(polyphenol oxidase,PPO)和过氧化物酶(peroxidase,POD)[10]。目前,控制果蔬酶促褐变的策略大多集中在化学和物理调控PPO的活性上,但缺乏靶向性,且有效性有待提升,果蔬褐变控制需要更多的创新与补充策略。马铃薯(Solanum tuberosum)作为最重要的非谷物粮食作物,在全球粮食作物中排名第4[11]。鲜切褐变作为马铃薯采后品质劣变的一种常见现象,为dsRNA溶液介导的RNAi作为农产品采后品质劣变干预策略提供了理想的评价指标。
目前,dsRNA应用的过程中遇到的瓶颈问题之一是dsRNA的生产成本[12]:化学合成成本高,并且合成错误率随着dsRNA合成长度的增加而增加,不适合大规模生产[13];运用体外合成dsRNA试剂盒,可合成大量高纯度dsRNA,但合成成本较高,使用次数有限,该法普遍应用于实验室研究阶段,不适合dsRNA的商业化应用;体外无细胞系统通过表达dsRNA的元件,并对合成体系调整优化,进行体外合成并纯化dsRNA。目前,GreenLight Biosciences开发了一种大规模的无细胞生产平台,该平台使用内源性细胞RNA来合成所需的dsRNA,能够将dsRNA的合成成本降低至0.50美元/g[14]。利用基因工程微生物发酵表达合成dsRNA也是目前可能规模化应用的方式之一,已在包括大肠杆菌(Escherichia coli)[15-17]、酿酒酵母(Saccharomyces cerevisiae)[18-19]、枯草芽孢杆菌(Bacillus subtilis)[20-22]等多种底盘细胞中构建并得到合成dsRNA的菌株。其中,大肠杆菌HT115(DE3)菌株为 dsRNA 特异的核酸内切酶(RNase Ⅲ)缺陷型菌株,利用带有一对反向T7启动子的L4440载体构建的L4440-Tmafp重组质粒转化HT115(DE3)菌株,通过 IPTG诱导可以实现特异dsRNA的表达,已被广泛应用于RNAi农药的生产[23]。
本研究选择微生物发酵表达合成dsRNA-StPPO,以大肠杆菌RNase Ⅲ缺陷型菌株HT115(DE3)为发酵平台,以L4440载体为骨架构建重组载体,进行马铃薯StPPO编码基因的dsRNA表达与发酵条件优化,将其应用于减缓鲜切马铃薯褐变过程,挖掘dsRNA技术在农产品加工与贮藏领域的应用潜力。
1 材料与方法
1.1 材料与试剂
马铃薯(云薯505),云南省农业科学院经济作物研究所;大肠杆菌(Escherichia coli,DH5α)感受态、大肠杆菌(Escherichia coli HT115,DE3)、L4440,宝生物工程(大连)有限公司。
胰蛋白胨、大豆蛋白胨、酵母浸粉等,北京索莱宝科技有限公司;氨苄青霉素、盐酸四环素等,上海阿拉丁生化科技股份有限公司;Hind Ⅲ(核酸内切酶)、Nhe I(核酸内切酶)、反转录试剂等,宝生物工程(大连)有限公司。
1.2 仪器与设备
Thermocycler PCR仪,ThermoFisher Scientific;回旋式恒温调速摇床,上海欣蕊自动化设备有限公司;细胞破碎仪,广州南方生化医疗仪器有限公司;色差仪,深圳市艾普仪器有限公司。
1.3 培养基
LB培养基(细菌的种子液及发酵培养基)(g/L):胰蛋白胨10.0,酵母浸粉5.0,氯化钠10.0,固体培养基加入琼脂20.0。
1.4 实验方法
1.4.1 马铃薯PPO基因的扩增与回收
1.4.1.1 引物设计
通过美国国家生物技术信息中心(National Center for Biotechnology Information, NCBI)上查找马铃薯PPO基因序列,利用引物设计软件Primer 5.0设计扩增PPO基因片段的引物,上下游引物分别带有Nhe I、Hind Ⅲ酶切位点,构建L4440-StPPO表达载体。引物序列见表1。
表1 引物序列
Table 1 Primer sequence

基因正反向碱基序列(5′-3′)PPO1FRGTCGACGGTATCGATAAGCTTTCTTGTGGTGTTGCCCATGTAATCCACCGGTTCCATGGCTAGCACGGAAAGAAAAGCCACGAGAJPFRGGAACCCTAAAGGGAGCCCCTTGAGTGAGCTGATACCGCTCGPPOFRTCCCTCATACCCCGGTTCATGATCCCTTCTTTTCCCGCCA
1.4.1.2 马铃薯块茎总RNA提取、反转录
取新鲜马铃薯块茎0.2 g,加适量液氮于研钵中研磨,成粉后装入1.5 mL的离心管中,利用RNAiso Plus 提取总RNA。以1 μg总RNA为模板,通过PrimeScriptTM RT reagent Kit with gDNA Eraser试剂盒,反转录合成第一链cDNA模板,-20 ℃保存。
1.4.2 构建L4440-dsRNA-StPPO大肠杆菌表达体系构建
利用上述合成的cDNA模板和PPO1正反引物,使用TaKaRa Ex Taq®扩增靶基因序列片段,并通过ClonExpress II One Step Cloning Kit将扩增序列克隆到L4440载体中并转化到大肠杆菌DH5α感受态细胞中。37 ℃、振荡培养1 h后,将转化产物涂在含有氨苄青霉素(Amp+ 100 μg/mL)LB固体培养基上37 ℃培养过夜。挑取单菌落进行菌落PCR检测,筛选阳性克隆后送至苏州金唯智生物科技有限公司进行测序验证插入载体序列的准确性。提取重组质粒并将其转化于制备E.coli HT115(DE3)感受态细胞中。37 ℃、振荡培养1 h后,将转化产物涂在含有氨苄青霉素(Amp+ 100 μg/mL)和四环素(Tet+ 12.5 μg/mL)的LB固体培养基上,37 ℃培养过夜。采用菌落PCR法筛选阳性菌落。
1.4.3 诱导重组大肠杆菌表达dsRNA-StPPO
从固体培养基上挑取单菌落扩大培养之后以1∶100的比例接种于LB液体培养基(Amp+、Tet+),37 ℃ 180 r/min培养扩增约3.5 h至OD600=0.4,加入异丙基硫代半乳糖苷(isopropyl thiogalactoside,IPTG)溶液至其终浓度为0.4 mmol/L继续振荡培养5 h。
1.4.4 Trizol法提取法dsRNA-StPPO
取1 mL的发酵液于1.5 mL的无酶离心管中,11 102×g离心5 min,弃上清液,加100 μL无菌水复溶菌体,后续方法参照文献中[24]并稍做修改。
1.4.5 半定量法表征dsRNA-StPPO含量
分别吸取不同量的Marker进行琼脂糖凝胶电泳,使得500 bp片段的含量在20、40、60、80 ng,用Image Lab生成电泳图,随后用ImageJ计算电泳条带的灰度值,建立核酸含量和灰度值的关系。
1.4.6 原核表达dsRNA-StPPO条件的优化
以dsRNA产量为考核指标,通过单因素试验,分别对IPTG浓度、诱导时长、酵母浸粉、装瓶量、温度、转速进行优化,各单因素优化条件如表2所示。在单因素试验基础上,以dsRNA产量为响应值,选取酵母浸粉、温度、装瓶量、转速等4个因子进行Box-Behnken试验,对重组大肠杆菌表达dsRNA-StPPO的工艺条件进行优化。
表2 单因素试验设计表
Table 2 Single factor experiment design table
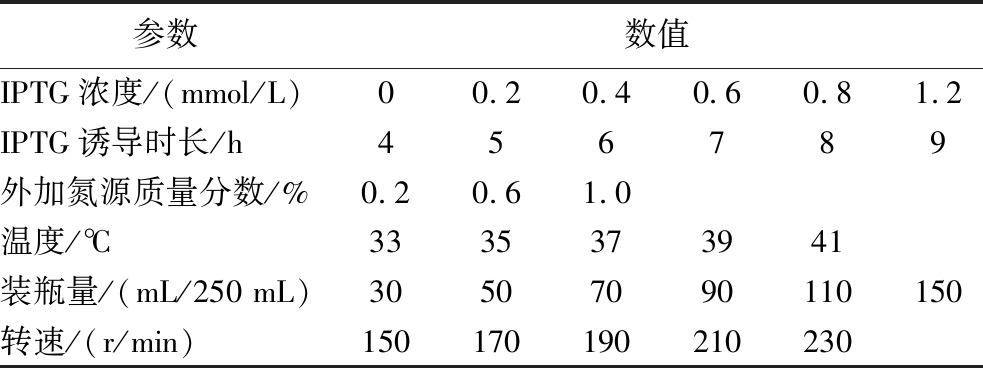
参数数值IPTG浓度/(mmol/L)00.20.40.60.81.2IPTG诱导时长/h456789外加氮源质量分数/%0.20.61.0温度/℃3335373941装瓶量/(mL/250 mL)30507090110150转速/(r/min)150170190210230
1.4.7 应用效果评价
土豆切成厚薄均匀的切片,后浸泡于含dsRNA-StPPO破碎菌液5 min。捞出沥干后放入PE保鲜袋中,4 ℃贮藏。分别于0、12、24、48、72、120 h进行马铃薯色差、PPO酶活力的测定。对照组为空载转化缺陷菌株HT115(DE3)得到的重组菌破碎液,其他操作同实验组一致。
1.4.7.1 实时荧光定量PCR
将反转录得到的cDNA稀释10倍,以马铃薯中StEF-1α作为内参基因,随后实时荧光定量PCR反应液按照下表的体系在冰上进行配置,混匀后分装到荧光定量PCR 8连排管中,如表3所示。
表3 实时荧光定量PCR反应体系
Table 3 Quantitative Real-Time PCR reaction system

试剂使用量/μLTB Green Premix Ex Taqll(Tli RNaseH Plus)10PCR Forward Primer(10 μmol/L)0.8PCR Forward Primer(10 μmol/L)0.8ROX Reference Dye or Dye ll(50×)0.4cDNA溶液2RNase Free dH2O6总计20
在本研究中实时荧光定量PCR的反应程序为:预变性阶段为95 ℃ 30 s;PCR反应(95 ℃ 30 s,60 ℃ 30 s,72 ℃ 1 min)×40循环;熔解曲线分析95 ℃ 15 s,60 ℃ 30 s, 95 ℃ 15 s。生成的熔解曲线用以评估扩增的特异性。
1.4.7.2 色差测定
使用色差仪(威福光电)测定鲜切马铃薯色差值L*、a*、b*值,根据色差仪测定的色差值带入公式(1)、公式(2),可以计算鲜切马铃薯的褐变指数(browning index,BI)。
(1)
(2)
1.4.7.3 PPO酶活力测定
PPO酶活力测定参照RU等[25]的方法测定。测定420 nm处吸光度值,测量过程中每1 min记录一次吸光度值,持续6 min。每个样品重复测量3次。PPO酶活力以U/g(鲜重)表示。
1.5 数据统计分析
利用Minitab 19软件进行Box-Behnken中心实验设计与数据分析;利用SPSS 18软件和Origin 2018进行数据整理分析与作图,数据分析采用ANOVA单因素方差分析与Duncan事后多重比较,P<0.05表示差异显著。
2 结果与分析
2.1 L4440-dsRNA-StPPO载体的构建与dsRNA-StPPO表达
本文利用大肠杆菌(DE3)进行发酵条件实验。如图1所示,根据马铃薯基因中的PPO序列,通过PCR获得355 bp带Hind Ⅲ和Nhe I酶切位点的马铃薯PPO cDNA,通过限制性核酸内切酶Hind Ⅲ和Nhe I,将PPO基因构建进入L4440质粒中。因此合成的dsRNA加上T7启动子与两个酶切位点之间的143 bp,所以目标dsRNA约500 bp。将该重组质粒导入大肠杆菌DH5α中扩增后提取质粒,将重组质粒转化进入大肠杆菌HT115(DE3)菌株中,通过IPTG诱导dsRNA-StPPO表达,生成498 bp的dsRNA-StPPO。

a-dsRNA-StPPO-L4440表达载体构建示意图;b-dsRNA-StPPO诱导表达凝胶电泳图
图1 L4440-dsRNA-StPPO载体的构建与表达
Fig.1 Construction of dsRNA-StPPO-L4440 expression vector and it expression
注:M-DL2000分子质量标记(Takara),其大小分别是2 000、1 000、750、500、250、100;1-空载组;2-不诱导组;3~8-IPTG诱导组。
2.2 操作参数优化
2.2.1 标曲测定
不同含量的dsRNA进行琼脂糖凝胶电泳,随后用ImageJ计算核酸条带灰度值,建立核酸含量和灰度值得关系,如图2所示。灰度值与核酸含量拟合后的线性关系良好,R2值为0.997,可以作为标准曲线对核酸含量和灰度值进行转换。
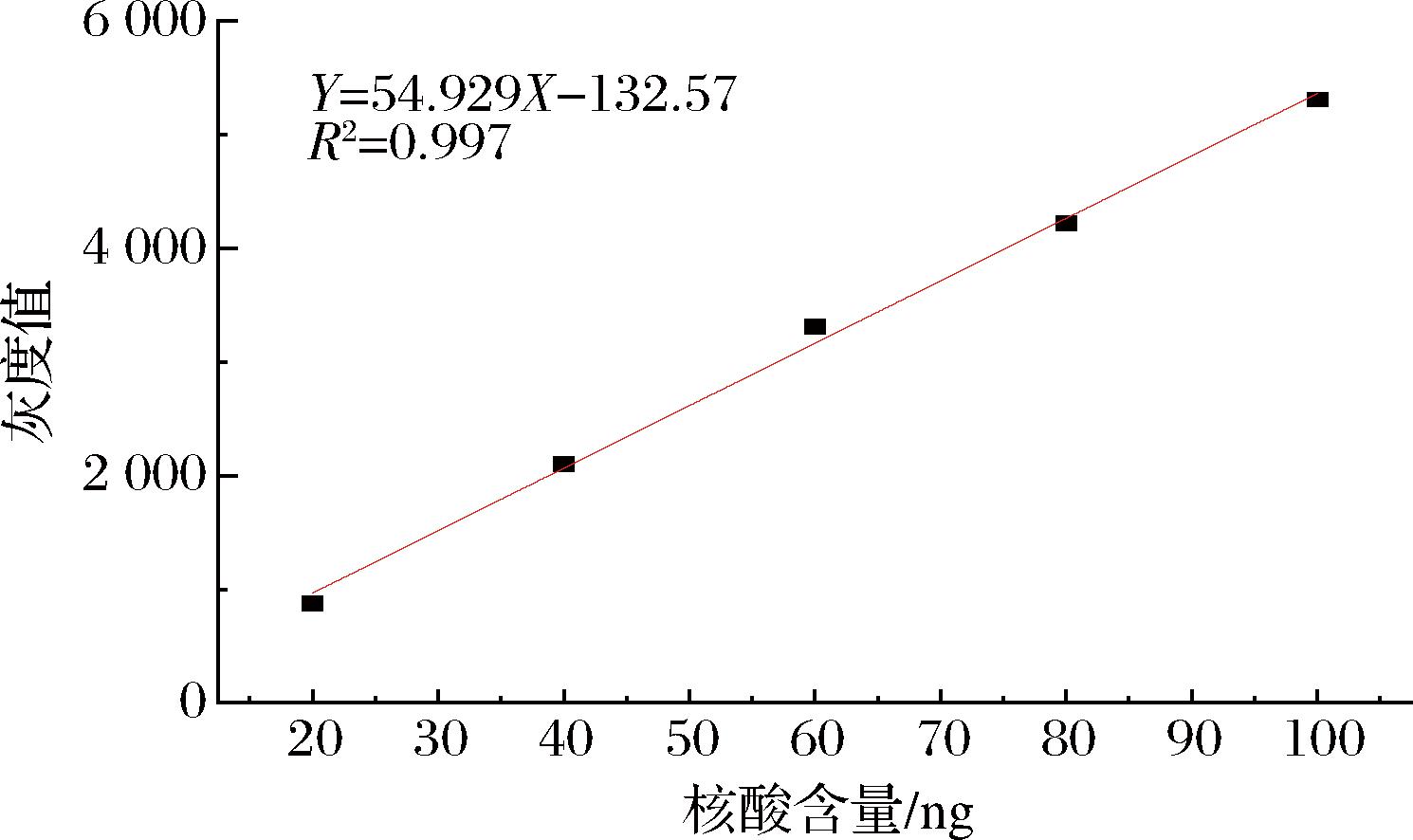
图2 灰度值与核酸含量标准曲线
Fig.2 Standard curve of gray value and nucleic acid content
2.2.2 单因素优化试验
为探究通过大肠杆菌DE3大规模生产dsRNA的最佳条件,进行了单因素试验。结果如图3所示。当IPTG诱导剂浓度为0.6 mmol/L,诱导时间为6 h,外加酵母浸粉0.6%(质量分数),温度为39 ℃,装瓶量为50 mL/250 mL,转速为190 r/min,dsRNA-StPPO的产量最高。

a, b, c-IPTG浓度、诱导时间、外加氮源对原核表达dsRNA-StPPO的影响;d, e, f-温度、装瓶量、转速对原核表达dsRNA-StPPO的影响
图3 不同发酵条件对dsRNA-StPPO产量影响
Fig.3 Effects of different fermentation conditions on dsRNA-StPPO yield
注:不同小写字母代表差异显著(P<0.05),相同代表差异不显著(下同)。
2.2.3 Box-Behnken中心试验
基于单因素优化试验的结果,以酵母浸粉质量分数为0.5%、装瓶量为50 mL/250 mL、温度39 ℃、转速190 r/min的条件为中心点,以原核表达dsRNA-StPPO的含量为响应值进行Box-Behnken试验,具体试验方案及结果如表4所示。
表4 Box-Behnken 试验设计及结果
Table 4 Box-Behnken test design and results
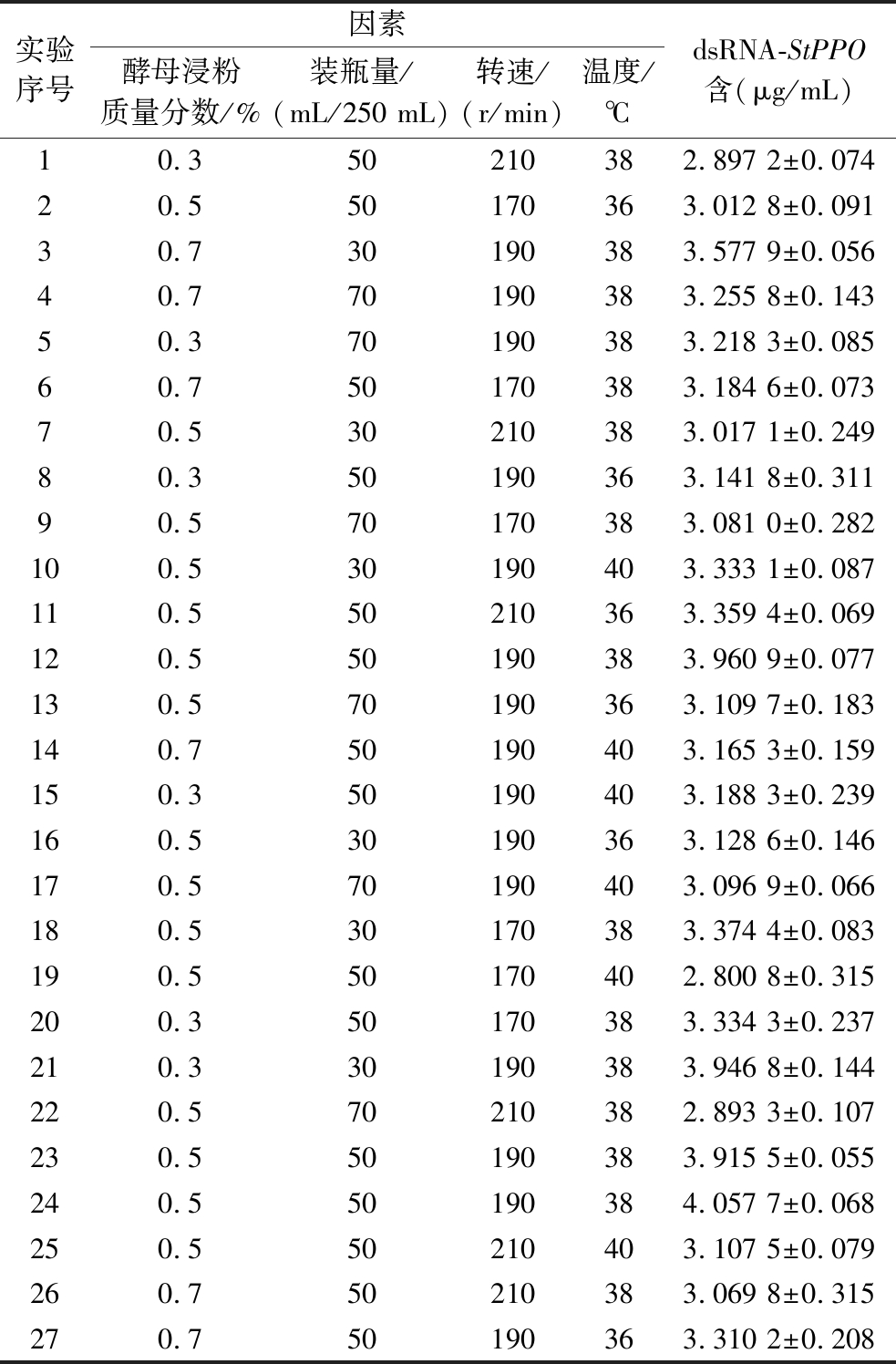
实验序号因素酵母浸粉质量分数/%装瓶量/(mL/250 mL)转速/(r/min)温度/℃dsRNA-StPPO含(μg/mL)10.350210382.897 2±0.07420.550170363.012 8±0.09130.730190383.577 9±0.05640.770190383.255 8±0.14350.370190383.218 3±0.08560.750170383.184 6±0.07370.530210383.017 1±0.24980.350190363.141 8±0.31190.570170383.081 0±0.282100.530190403.333 1±0.087110.550210363.359 4±0.069120.550190383.960 9±0.077130.570190363.109 7±0.183140.750190403.165 3±0.159150.350190403.188 3±0.239160.530190363.128 6±0.146170.570190403.096 9±0.066180.530170383.374 4±0.083190.550170402.800 8±0.315200.350170383.334 3±0.237210.330190383.946 8±0.144220.570210382.893 3±0.107230.550190383.915 5±0.055240.550190384.057 7±0.068250.550210403.107 5±0.079260.750210383.069 8±0.315270.750190363.310 2±0.208
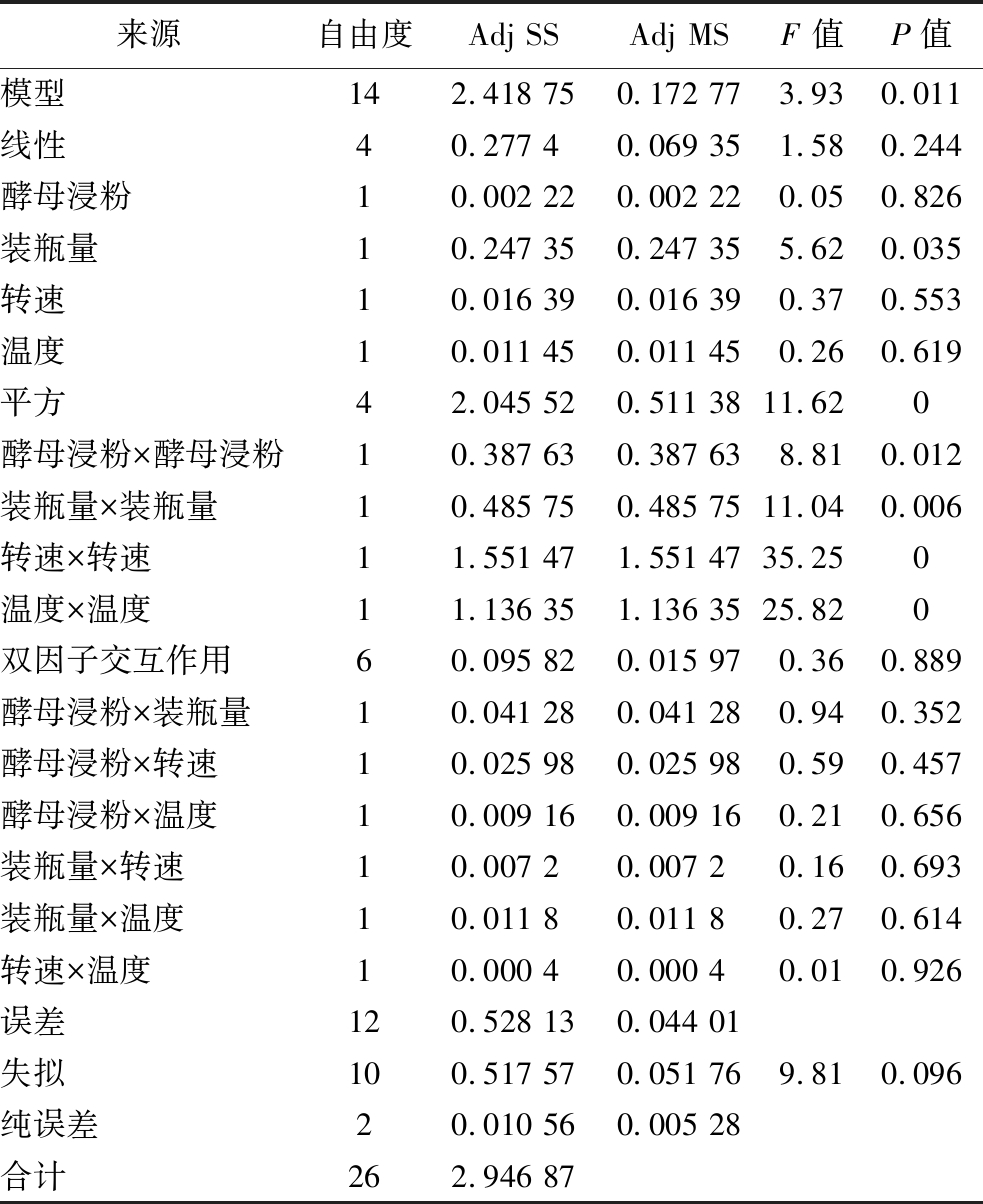
根据中心实验结果建立回归模型并进行方差分析,方差分析表见表5。通过进行完全二次回归拟合,获得响应值Y(原核表达dsRNA-StPPO含量)对酵母浸粉(A)、装瓶量(B)、温度(C)、转速(D)4个因素的二次多项回归方程式为:
表5 Box-Behnken 试验方差分析表
Table 5 Analysis of variance of Box-Behnken test
来源自由度Adj SSAdj MSF 值P值模型142.418 750.172 773.930.011线性40.277 40.069 351.580.244酵母浸粉10.002 220.002 220.050.826装瓶量10.247 350.247 355.620.035转速10.016 390.016 390.370.553温度10.011 450.011 450.260.619平方42.045 520.511 3811.620酵母浸粉×酵母浸粉10.387 630.387 638.810.012装瓶量×装瓶量10.485 750.485 7511.040.006转速×转速11.551 471.551 4735.250温度×温度11.136 351.136 3525.820双因子交互作用60.095 820.015 970.360.889酵母浸粉×装瓶量10.041 280.041 280.940.352酵母浸粉×转速10.025 980.025 980.590.457酵母浸粉×温度10.009 160.009 160.210.656装瓶量×转速10.007 20.007 20.160.693装瓶量×温度10.011 80.011 80.270.614转速×温度10.000 40.000 40.010.926误差120.528 130.044 01失拟100.517 570.051 769.810.096纯误差20.010 560.005 28合计262.946 87
Y=-216.7+6.1A+0.087B+8.93C+0.505D-6.74A2-0.000 754B2-0.115 4C2-0.001 348D2+0.025 4AB-0.120AC+0.020 1AD-0.001 36BC+0.000 106BD-0.000 25CD
由表5可知,回归模型的P=0.011<0.05,模型回归显著,具有可信度,失拟项P=0.096>0.05,失拟检验不显著,说明未知因素对试验结果干扰小,模型选择适当。对Box-Behnken试验回归模型进行可信度分析,决定系数为0.820 8,校正决定系数为 0.611 7,说明预测值与实测值之间具有高度的相关性,上述模型合理可用。一次项装瓶量(B),二次项A2、B2、C2、D2 dsRNA产量影响显著(P<0.05),其余项对dsRNA产量影响不显著(P>0.05)。
利用Minitab19进行响应曲面分析,得到酵母浸粉、装瓶量、温度、转速4个因素两两之间的曲面图和等值线图,如图4所示。等值线图均为椭圆形,有恒定等线响应值。响应面三维图均有稳定点,且为极大值。


a, c, e, g, i, k-dsRNA-StPPO与不同因素相关曲面图;b, d, f, h, j, l-dsRNA-StPPO与不同因素相关等值线图
图4 Box-Behnken试验模型等值线图和响应面三维图
Fig.4 Box-Behnken test model contour map and response surface 3D map
对结果进行二次多元回归拟合处理,得到原核表达dsRNA-StPPO的最优参数,即各因素最优参数为酵母浸粉质量分数0.48%,装瓶量为45 mL/250 mL,温度为39 ℃,转速为189 r/min。预测的原核表达dsRNA-StPPO含量为3.99 μg/mL。对预测结果进行试验验证,实际所得响应值为3.95 μg/mL,该值与模型的预测值基本吻合,与初始优化时原核表达dsRNA-StPPO相比产量有显著提高。
2.4 应用效果评价
2.4.1 dsRNA-StPPO对鲜切马铃薯PPO基因表达量的影响
外源dsRNA处理可以靶向沉默生物体目的基因的表达。通过RT-qPCR技术,我们检测了dsRNA-StPPO溶液处理鲜切马铃薯对靶基因mRNA相对表达量的影响。如图5所示,在贮藏期间,与对照组相比dsRNA-StPPO处理能显著的降低马铃薯24、48 h PPO基因的相对表达量,下调比例分别为72.27%、44.48%,说明原核表达的dsRNA-StPPO对马铃薯的PPO基因起到了瞬时沉默作用,且随着时间延长,对靶基因沉默效果逐渐减弱或消失。

图5 dsRNA-StPPO溶液对鲜切马铃薯靶基因mRNA相对表达量的影响
Fig.5 Effect of dsRNA-StPPO solution on the relative mRNA expression of the target gene in fresh cut potato
注:**表示P<0.01,***表示P<0.001(下同)。
2.4.2 dsRNA-StPPO对马铃薯多酚氧化酶活力的影响
如图6所示,随着贮藏时间的延长鲜切马铃薯PPO酶活力呈现先升高后降低的趋势。在12、24、36、48 h,与对照相比dsRNA-StPPO处理过鲜切马铃薯的多酚氧化酶活力降低,尤其是48 h,对多酚氧化酶活力的抑制作用显著。当用dsRNA-StPPO浸泡马铃薯时,小分子的dsRNA-StPPO能快速的进入马铃薯细胞,在细胞内激发RNAi干扰机制,降低PPO基因表达抑制PPO酶合成,因此在保鲜24、48 h作用显著。
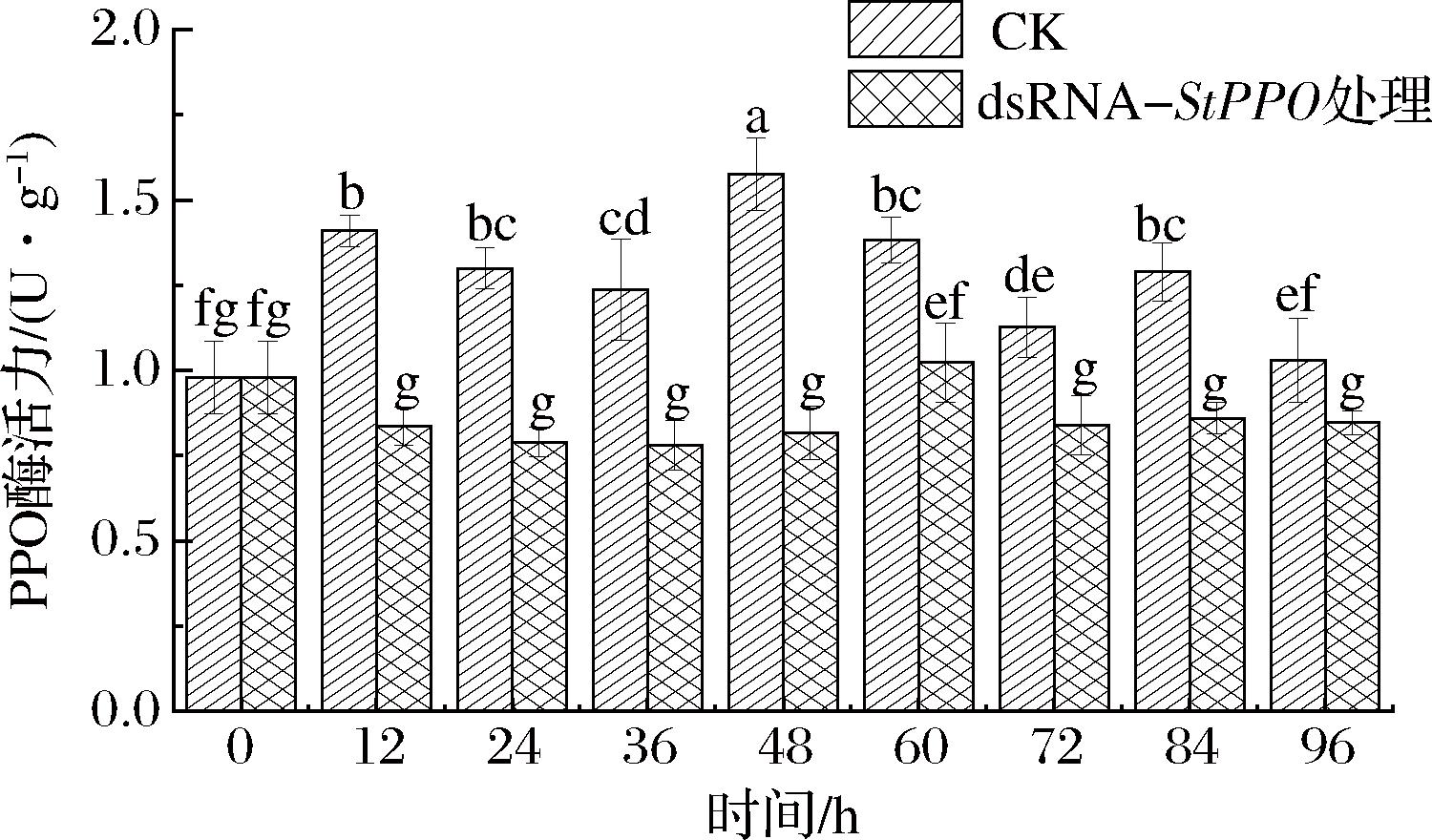
图6 dsRNA-StPPO溶液对马铃薯PPO酶活力的影响
Fig.6 Effect of dsRNA-StPPO solution on activity of potato PPO enzyme
2.4.3 dsRNA-StPPO对马铃薯色差的影响
色泽是消费者判断鲜切果蔬的外观和质量的重要因素,酶促褐变对鲜切马铃薯片颜色产生不良影响。L*值越大,BI值越小,鲜切马铃薯褐变程度越小。如图7-a所示,与对照组相比dsRNA-StPPO处理马铃薯能显著延缓贮藏期间L*值的降低,120 h时的L*值比对照组高3.10。如图7-b、图7-c所示,在整个贮藏期间,鲜切马铃薯的a*值、BI值呈增加的趋势。与对照组相比dsRNA-StPPO处理马铃薯能显著延缓贮藏期间a*值和BI值的增加。此结果表明dsRNA-StPPO处理能延缓马铃薯褐变,减轻褐变的特征。

a, b-马铃薯鲜切片色差L*, a*值;c-马铃薯鲜切片褐变BI值
图7 dsRNA-StPPO处理对马铃薯色差值的影响
Fig.7 Effect of dsRNA-StPPO treatment on chromatic aberration of potato
3 结论
外源dsRNA介导的RNAi作为控制农产品采后品质劣变的新兴策略,具有巨大的应用前景。建立大规模dsRNA生产体系,降低dsRNA生产成本,有利于dsRNA产品的大规模应用。本研究使用大肠杆菌HT115(DE3)表达了马铃薯PPO酶编码基因的dsRNA序列。为了持续大量的产出dsRNA,本研究对发酵过程中影响原核表达的因素如外加氮源、温度、装瓶量、转速等进行了优化。结果表明,IPTG诱导剂浓度为0.6 mmol/L,诱导时间为6 h,外加酵母浸粉0.48%,温度为39 ℃,装瓶量为45 mL/250 mL,转速为189 r/min时,dsRNA的产量最高,达3.95 μg/mL。
目前,基于dsRNA沉默策略在作物保护方面应用广泛,表达dsRNA 抗虫玉米(MON87411)、转基因大豆(MON87705)(拜耳公司)、转基因马铃薯[SPS-ØØE12-8(E12)]等dsRNA转基因作物获得了多个国家的安全证书,但其在农产品采后品质劣变的干预方面研究甚少。本研究结果表明,dsRNA-StPPO处理鲜切马铃薯具有较好的延缓褐变的作用,能显著延缓a*值和BI值的增加和多酚氧化酶活力的增高。本文构建了一种能够稳定表达dsRNA-StPPO的原核表达体系,该体系生产dsRNA-StPPO制成可喷施的液体,实现对马铃薯褐变的控制及延缓。基于dsRNA的RNAi技术具有专一性、高效性,尽管尚未有批准上市的喷洒型dsRNA产品,但作为新兴的控制农产品采后品质劣变的措施,未来会广泛应用于生产中。
[1] 葛海伦. dsRNA和siRNA干扰克氏原螯虾IAG基因的作用研究[D]. 武汉: 华中农业大学, 2022.GE H L. Functional study on RNA interference on IAG gene of Procambarus clarkii by dsRNA and siRN[D]. Wuhan: Huazhong Agricultural University, 2022.
[2] NGUYEN Q, IRITANI A, OHKITA S, et al. A fungal Argonaute interferes with RNA interference[J]. Nucleic Acids Research, 2018, 46(5): 2495-2508.
[3] HUNG Y H, SLOTKIN R K. The initiation of RNA interference (RNAi) in plants[J]. Current Opinion in Plant Biology, 2021, 61: 102014.
[4] 肖达. 赤拟谷盗dsRNA吸收机制及相关基因功能的研究[D]. 北京: 中国农业大学, 2014.XIAO D. The mechanism of double-strand RNA uptake and function of related genes in red flour beetle (Trbolium castancum)[D]. Beijing: China Agricultural University, 2014.
[5] GUO H, LONG G J, LIU X Z, et al. Functional characterization of tyrosine melanin genes in the white-backed planthopper and utilization of a spray-based nanoparticle-wrapped dsRNA technique for pest control[J]. International Journal of Biological Macromolecules, 2023, 230:123123.
[6] LUCENA-LEANDRO V S, ABREU E F A, VIDAL L A, et al. Current scenario of exogenously induced RNAi for Lepidopteran agricultural pest control: From dsRNA design to topical application[J]. International Journal of Molecular Sciences, 2022,23(24):15836.
[7] KOCH A, BIEDENKOPF D, FURCH A, et al. An RNAi-based control of Fusarium graminearum infections through spraying of long dsRNAs involves a plant passage and is controlled by the fungal silencing machinery[J]. PLoS Pathogens, 2016, 12(10):e1005901.
[8] XU X, YU T T, ZHANG D S, et al. Evaluation of the anti-viral efficacy of three different dsRNA nanoparticles against potato virus Y using various delivery methods[J]. Ecotoxicology and Environmental Safety, 2023, 255: 114775.
[9] NIEHL A, SOININEN M, PORANEN M M, et al. Synthetic biology approach for plant protection using dsRNA[J]. Plant Biotechnology Journal, 2018,16(9):1679-1687.
[10] HAMDAN N, LEE C H, WONG S L,et al. Prevention of enzymatic browning by natural extracts and genome-editing: A review on recent progress[J]. Molecules. 2022, 27(3):1101.
[11] ZHANG H, XU F, WU Y, et al. Progress of potato staple food research and industry development in China[J]. Journal of Integrative Agriculture, 2017,16(12):2924-2932.
[12] SILVER K, COOPER A M, ZHU K Y. Strategies for enhancing the efficiency of RNA interference in insects[J]. Pest Management Science, 2021, 77(6):2645-2658.
[13] MU X, GREENWALD E, AHMAD S, et al. An origin of the immunogenicity of in vitro transcribed RNA[J]. Nucleic Acids Research, 2018, 46(10):5239-5249.
[14] HE L, HUANG Y N, TANG X M. RNAi-based pest control: Production, application and the fate of dsRNA[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10:1080576.
[15] DELGADO-MART N J, VELASCO L. An efficient dsRNA constitutive expression system in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2021, 105(16-17):6381-6393.
N J, VELASCO L. An efficient dsRNA constitutive expression system in Escherichia coli[J]. Applied Microbiology and Biotechnology, 2021, 105(16-17):6381-6393.
[16] 马中正, 闫硕, 沈杰. 基于工程菌高效合成靶向昆虫基因的dsRNA的方法[J]. 应用昆虫学报, 2019, 56(2): 342-347.MA Z Z, YAN S, SHEN J. An efficient dsRNA production method based on engineering bacteria for targeted inset genes[J]. Chinese Journal of Applied Entomology, 2019, 56(2): 342-347.
[17] 区晓阳. 具有双保护系统的加强型大肠杆菌工程菌的构建及其应用研究[D]. 广州: 华南理工大学, 2020.QU X Y. Construction and application of a robust Escherichia colistrain with a dual protection system[D]. Guangzhou: South China University of Technology, 2020.
[18] DUMAN-SCHEEL M. Saccharomyces cerevisiae (baker’s yeast) as an interfering RNA expression and delivery system[J]. Current Drug Targets, 2019, 20(9):942-952.
[19] FUKUNAGA R, HAN B W, HUNG J H, et al. Dicer partner proteins tune the length of mature miRNAs in flies and mammals[J]. Cell, 2012, 151(3): 533-546.
[20] RIET J, COSTA FILHO J, DALL′AGNO L, et al. Bacillus subtilis expressing double-strand RNAs (dsRNAs) induces RNA interference mechanism (RNAi) and increases survival of WSSV-challenged Litopenaeus vannamei[J]. Aquaculture, 2021(541): 736834.
[21] 阮思煜. 超声辅助适应性进化诱变体系构建及其在高产多肽芽孢杆菌选育中应用研究[D]. 苏州: 江苏大学, 2021.RUAN S Y. Construction of ultrasound-assisted adaptive evolution mutation system and its application in the breeding of high-yield peptides producing Bacillus[D]. Suzhou: Jiangsu University, 2021.
[22] 王慧. 芽孢杆菌遗传操作体系初建及工程菌株分子改良[D]. 北京: 中国农业科学院, 2016.WANG H. Fundamental establishment of the Bacillus genetic manipulation system and molecular improvement of engineered Bacillus strains[D]. Beijing: Chinese Academy of Agricultural Sciences, 2016.
[23] NI O-S
O-S NCHEZ J, CHEN L H, DE SOUZA J T, et al. Targeted delivery of gene silencing in fungi using genetically engineered bacteria[J]. Journal of Fungi, 2021,7(2):125.
NCHEZ J, CHEN L H, DE SOUZA J T, et al. Targeted delivery of gene silencing in fungi using genetically engineered bacteria[J]. Journal of Fungi, 2021,7(2):125.
[24] WORAWITTAYATADA J, ANGSUJINDA K, SINNUENGNONG R, et al.Simultaneous production of a virus-like particle linked to dsRNA to enhance dsRNA delivery for yellow head virus inhibition[J]. Viruses, 2022, 14(12):2594.
[25] RU X Y, TAO N, FENG Y Y, et al. A novel anti-browning agent 3-mercapto-2-butanol for inhibition of fresh-cut potato browning[J]. Postharvest Biology and Technology, 2020,170: 111324.