豆瓣酱是一种我国传统发酵调味品,因其独特的风味和丰富的营养,在我国的饮食文化中占据重要席位,广泛应用于各类佐餐与调味。传统豆瓣酱生产主要以蚕豆、面粉和盐为原料,主要经过霉菌制曲和加盐水发酵等基本的工艺步骤[1]。在发酵过程中,蚕豆、面粉等原料中的脂肪、蛋白质、淀粉等大分子物质被微生物分解成氨基酸、多肽、脂肪酸、低聚糖和单糖等小分子物质,便于人体的吸收。此外,微生物在生长代谢过程中产生的有机酸、醇类、酯类等多种次级代谢产物赋予了豆瓣酱独特的风味[2]。
酵母在豆瓣酱的发酵过程中起着重要作用,酵母菌能够直接或间接地参与酱醅中的醇类发酵、酸类发酵以及酯化作用等[3],这些反应既可减少酱醅中的不良风味,又可促进豆瓣酱风味更加丰富和柔和。此外,酵母菌的发酵作用对苯乙醇、4-乙基苯酚、2(5)-乙基-4-羟基-5(2)-甲基-3(2H)-呋喃酮[2(5)-ethyl-4-hydroxy-5(2)-methyl-3(2H)-furanone, HEMF]等豆瓣酱特征性风味物质的积累有重要影响[4-6]。研究表明,鲁氏结合酵母作为豆瓣酱发酵的主要酵母,能够形成乙醇、高级醇和4-羟基呋喃酮等物质,对豆瓣酱的风味形成起到重要的作用[7-9],在酱油、豆瓣酱等豆类发酵食品中添加工艺较为成熟、应用较为广泛。在酱醅发酵后期,假丝酵母、球拟酵母等后熟型产香酵母繁殖和发酵开始活跃[10-11]。这些酵母的发酵作用能够有效改善豆瓣酱风味和提高豆瓣酱的品质。目前针对后熟型酵母的研究相对较少,对于豆瓣酱风味的影响也尚不明确。
本研究从自然发酵后期豆瓣酱酱醅中筛选得到一株产香酵母,通过形态观察和分子生物学鉴定后分析其耐盐性和代谢特性。最后,将该菌株应用于豆瓣酱发酵过程中,使用顶空固相微萃取气质联用法对酱醅的风味进行分析,探究菌株强化接种对豆瓣酱发酵的影响。
1 材料与方法
1.1 材料与试剂
1.1.1 实验材料
豆瓣酱酱醅,云南楚雄云泉酱园有限责任公司。
1.1.2 培养基
YPD培养基用于酵母的富集以及培养,主要成分为蛋白胨20 g/L、酵母粉10 g/L、葡萄糖20 g/L,琼脂粉20 g/L(用于固体培养基),115 ℃灭菌15 min。
酱醅模拟培养基[12]:豆瓣酱50 g、蚕豆粉10 g、面粉2.5 g,煮沸煮匀后,用纱布过滤,补水定容至1 L,121 ℃灭菌20 min。
1.1.3 试剂
本实验所用葡萄糖、氯化钠、琼脂粉、乙醇、异丙醇等试剂,国药集团化学试剂有限公司(中国上海);酵母粉、蛋白胨,生工生物工程(上海)股份有限公司;L-2-辛醇标准品,上海麦克林生化科技股份有限公司。
1.1.4 仪器与设备
HVE-50全自动高压蒸汽灭菌锅,日本HIRAYAMA株式会社;BSP-250恒温生化培养箱,上海博迅实业有限公司;UV-2000紫外可见分光光度计,UNICO(上海)仪器有限公司;SPS2001F电子天平,METTLER TOLEDO公司;5804R高速冷冻离心机,德国Eppendorf公司;CX21FS1光学显微镜,奥林巴斯(中国)有限公司;TRACE 1310-ISQ LT单四级杆气相色谱质谱联用仪,美国赛默飞世尔科技公司。
1.2 实验方法
1.2.1 耐盐产香酵母的筛选
1.2.1.1 酱醅微生物分离
将10 g企业提供的自然发酵后期酱醅加入到90 mL无菌生理盐水中,在30 ℃培养箱中振荡30 min,然后梯度稀释涂布在带氨苄青霉素的60 g/L盐度YPD平板上,28 ℃培养2 d,挑选具有明显形态差异的菌落反复进行平板划线分离,得到纯化的单菌落。
1.2.1.2 酵母DNA提取
采用十六烷基三甲基溴化铵法(cetyltrimethyl ammonium bromide,CTAB)[13]对酵母的DNA进行提取,其步骤如下:在破壁管中加入2 mL酵母培养液,12 000 r/min离心2 min后弃上清液,加入约100 mg破壁玻璃珠、800 μL CTAB裂解液和10 μL巯基乙醇,旋涡振荡研磨裂解40 min,取出后12 000 r/min离心5 min,吸取上清液于2 mL离心管中;加入等体积的氯仿-异戊醇(体积比24∶1)混匀,12 000 r/min离心5 min,吸取上层液体于新的2 mL离心管中;加入等体积的异丙醇,颠倒混匀后沉淀1 h,12 000 r/min离心10 min,弃上清液;加入1 mL 70%(体积分数)乙醇,12 000 r/min离心5 min,弃上清液;金属浴60 ℃ 干燥15 min,用50 μL TE Buffer溶解得到DNA,供下一步实验。
1.2.1.3 酵母菌Rep-PCR指纹分类
以所提取的酵母DNA为模板,采用M13引物[14](5′-GAGGGTGGCGGTTCT-3′)进行PCR扩增,PCR扩增体系(25 μL):Taq酶(YEASEN)12.5 μL、ddH2O 6.5 μL、DNA模板2 μL、M13引物(10 μmol/L)4 μL。PCR扩增程序:94 ℃变性3 min,42 ℃退火2 min,72 ℃延伸3 min,94 ℃变性45 s开始循环,42 ℃退火40 s, 72 ℃延伸2 min,35个循环后,72 ℃延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳,凝胶成像仪拍照得到M13指纹图谱,对筛选菌株进行分类。随机选取每类指纹中的3株酵母进行下一步实验。
1.2.1.4 产香酵母菌筛选
将筛选得到的酵母菌接种到酱醅模拟培养基中,采用嗅闻法[6]对其产香能力进行分析,剔除不产香、产香能力弱的菌株,选择具有明显酱香、醇酯香的菌株用于进一步研究。产香能力以“+”表示。
1.2.1.5 菌株鉴定
将活化后的酵母菌在60 g/L盐度YPD平板划线,28 ℃培养48 h,观察记录培养基上单菌落的形态特征。采用美蓝染色对酵母菌的活细胞进行染色,并在显微镜下对其形态进行观察。
以所提取的酵母菌DNA为模板,采用ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)通用引物对酵母菌ITS 区域进行特异性扩增。PCR扩增体系(25 μL):Taq酶(YEASEN)12.5 μL、ddH2O 8.5 μL、DNA模板2 μL、上下游引物(10 μmol/L)各1 μL,PCR扩增程序:98 ℃预变性3 min,98 ℃变性10 s,55 ℃退火15 s,72 ℃延伸60 s,35个循环后,72 ℃延伸10 min。PCR产物用10 g/L琼脂糖凝胶电泳,凝胶成像仪观察结果并成像。PCR产物委托苏州金唯智生物科技有限公司进行测序。将测序结果在NCBI上与GenBank数据库中的菌株进行BLAST比对,使用MEGA 11.0软件构建系统发育树。
1.2.2 菌株代谢特性分析
1.2.2.1 菌株耐盐性
配制40、80、100、120、160、200、240 g/L NaCl浓度的YPD培养基。将产香酵母在YPD培养基中培养24 h至对数生长期,以1%(体积分数)接种量将菌液转接到不同NaCl浓度的YPD液体培养基中,28 ℃培养,每隔6 h测定发酵液OD600值。通过记录和绘制产香酵母菌株在不同盐度条件下的生长曲线,以评价其耐盐能力。
1.2.2.2 菌株生长代谢特性
配制40、80、100、120、160 g/L NaCl质量浓度的酱醅模拟培养基。将产香酵母在YPD培养基中培养24 h至对数生长期,以1%(体积分数)接种量将菌液接种到不同NaCl质量浓度的酱醅模拟培养基中,在28 ℃下培养3 d,按照GB 12456—2021《食品安全国家标准 食品中总酸的测定》和GB 5009.235—2016《食品安全国家标准 食品中氨基酸态氮的测定》对发酵液的总酸、氨基酸态氮含量进行检测,从而对菌株在不同盐度下酱醅模拟环境的代谢能力进行研究。
1.2.2.3 菌株产香能力验证
采用顶空固相微萃取气质联用法(headspace solid phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)对100 g/L盐度酱醅模拟培养基发酵液的挥发性风味物质进行测定。取8 mL发酵液于15 mL气相瓶中,加入2.0 g NaCl混合,同时加入5 μL L-2-辛醇(102.8 mg/L)作为内标。气相色谱质谱条件[15]:采用OV-1701毛细管色谱柱(30 mm×0.25 mm,0.25 μm),样品进样口温度250 ℃,气相色谱柱温起始温度32 ℃,以5 ℃/min升温至180 ℃,再以12 ℃/min升温至240 ℃,保持5 min。载气He,流速0.8 mL/min,不分流。使用EI电离源在70 eV电压下获取挥发性风味化合物的GC-MS色谱图,其结果与NIST谱库和Willey谱库相匹配,确定挥发性风味物的种类,采用匹配度>700的鉴定结果。采用L-2-辛醇作为内标,以其峰面积为对照,定量计算出各挥发性成分在样品中的相对含量[16]。通过对酱醅模拟培养基发酵液的挥发性风味物质进行分析,对产香酵母的产香能力进行验证。
1.2.3 菌株在豆瓣酱发酵过程中的应用
1.2.3.1 豆瓣酱发酵
将蚕豆瓣冼净后,在121 ℃高压条件下蒸煮变性,冷却至室温后将其与小麦粉充分混合(4∶1,质量比);并以106/g接种量接入米曲霉3.042孢子液,在30 ℃下培养3 d后制得成曲。将成曲与200 g/L的盐水按1∶1(质量比)混合后开始发酵,发酵温度为30 ℃。发酵7 d后将活化至对数中后期的埃切假丝酵母Y18菌株接种至酱醅中,接种量为105/g(以酱醅质量计),以未接种酵母菌株的豆瓣酱酱醅为对照,在30 ℃培养箱中继续培养30 d。
1.2.3.2 酱醅理化指标测定
将酱醅样本充分研磨后,精确称取5 g样本用去离子水将其定容至100 mL。其水分、盐度含量分别按照GB 5009.3—2016《食品安全国家标准食品中水分的测定》和GB/T 5009.39—2003《酱油卫生标准的分析方法》进行测定。总酸和氨基酸态氮含量测定方法参照1.2.2.2节。
1.2.3.3 酱醅挥发性风味物质测定
采用顶空微萃取气质联用法对发酵3个月的酱醅进行分析。取2.0 g研磨好的豆瓣酱样本于15 mL气相瓶中,加入2.0 g NaCl、6 mL ddH2O混合,同时加入5 μL L-2-辛醇(102.8 mg/L)作为内标。气相色谱质谱条件参照1.2.2.3节。
1.3 数据处理
使用SPSS 26.0进行数据处理,使用Origin 2023、Excel 2021和GraphPad Prism 8.0软件进行进一步的统计分析和图形处理。
2 结果与分析
2.1 耐盐产香酵母的筛选
2.1.1 酱醅微生物分离
从自然发酵酱醅样本中共分离得到28株酵母菌,多数酵母菌在YPD平板上菌落呈圆形,颜色为白色或乳白色,表面光滑圆润。部分酵母菌落为白色,表面呈褶皱状。
2.1.2 酵母菌Rep-PCR指纹分类
Rep-PCR是一种基于原核与真核生物基因组中特异保守的重复序列的PCR扩增技术,能够应用于原核和真核生物的分类和分型[17]。通过对分离得到的28株酵母菌进行纯培养和基因组DNA的提取,并使用M13引物进行PCR扩增,用10 g/L琼脂糖凝胶电泳得到每株菌的Rep-PCR特征指纹图谱,其结果如图1所示。通过对特征指纹图谱进行分类,可将28株酵母菌分成三类,Y1-Y12、Y15可分为Ⅰ类,Y13、Y14、Y16-Y22可分为Ⅱ类,Y23-Y28可分为Ⅲ类。针对每一类特征指纹图谱,分别随机挑选3株菌,用于下一步实验。
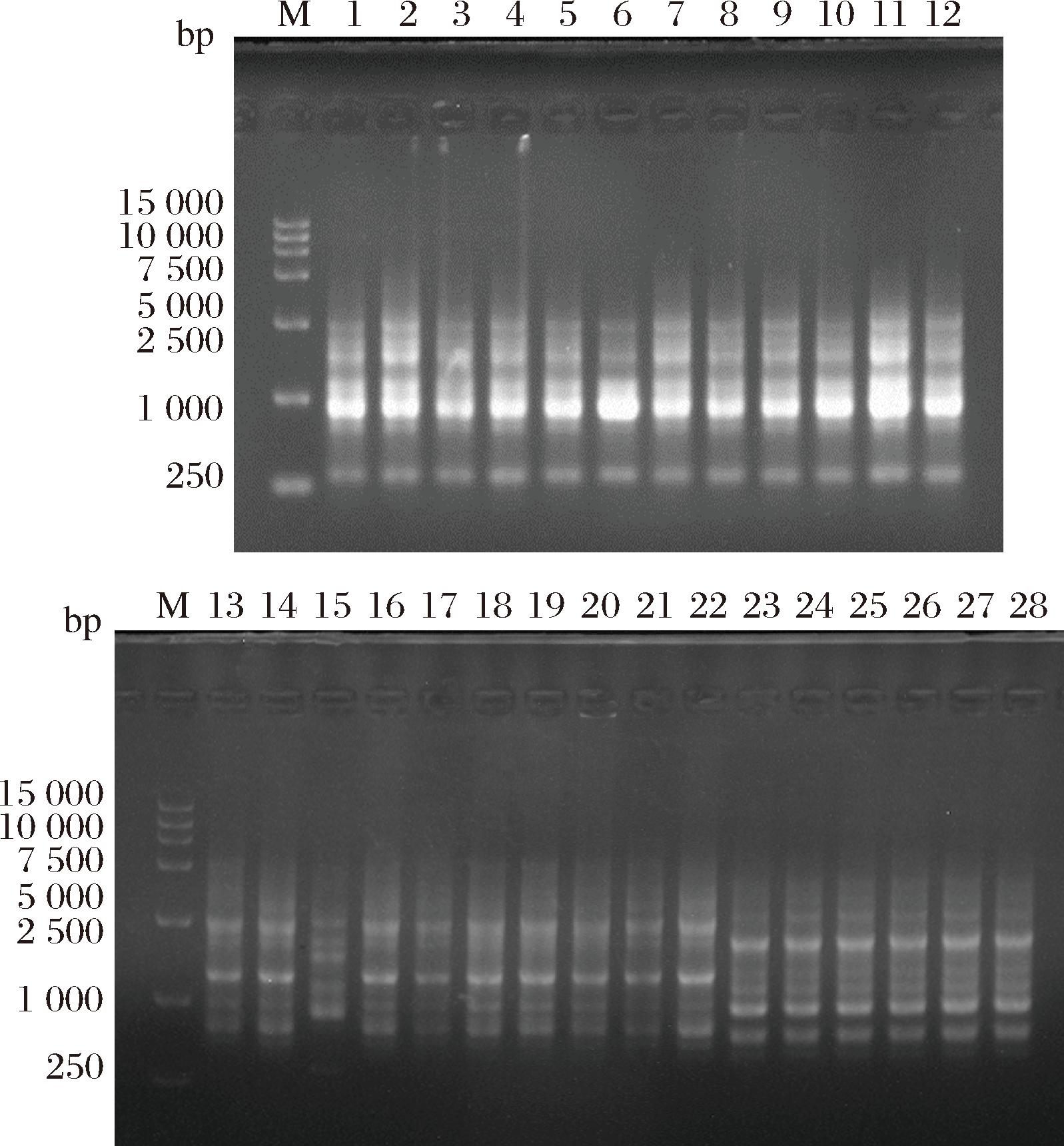
图1 酵母菌Rep-PCR特征指纹图谱
Fig.1 Rep-PCR fingerprint of isolated yeasts
2.1.3 产香酵母菌筛选
针对每一类特征指纹图谱,选择Y1、Y6、Y12、Y13、Y18、Y22、Y23、Y25、Y28等9株酵母菌接种到酱醅模拟培养基中,通过嗅闻法对9株酵母菌的产香能力进行分析,其结果如表1所示,第Ⅰ类菌株无明显香气,第Ⅱ类菌株香气浓郁,有着明显的花香、果香和焦香,第Ⅲ类菌株有着较强的香气,但是香气中混杂不愉悦的风味。最终选择第Ⅱ类的Y13、Y18、Y22三株产香酵母用于下一步研究。
表1 酵母菌种产香能力
Table 1 The fragrance production ability of yeast

注:“-”表示无香气、“+”表示微香“++”表示较香、“+++”表示香气浓郁。
分类菌株号产香能力Y1-ⅠY6-Y12-Y13+++ⅡY18+++Y22+++Y23++ⅢY25++Y28++
2.1.4 菌株鉴定
将产香酵母Y18在YPD划线培养,形成单菌落。如图2-a所示,其菌落呈圆形,表面湿润光滑,不透明,呈乳白色;进一步将培养液进行美蓝染色,通过显微镜(10×100)对其形态进行观察,发现其菌体形态主要呈椭球型,具有明显出芽生殖特征(图2-b)。

a-酵母菌落形态;b-酵母细胞形态
图2 酵母单菌落及细胞形态
Fig.2 Single colony and cell morphology of yeast
对产香酵母Y13、Y18、Y22的ITS区域进行特异性扩增,并进行测序分析,结果表明,3株菌的ITS序列完全相同,为同一种酵母。将菌株Y18的序列在NCBI上进行BLAST比对,并构建系统发育树(图3),结果表明所筛菌株为埃切假丝酵母(Starmerella etchellsii)Y18。
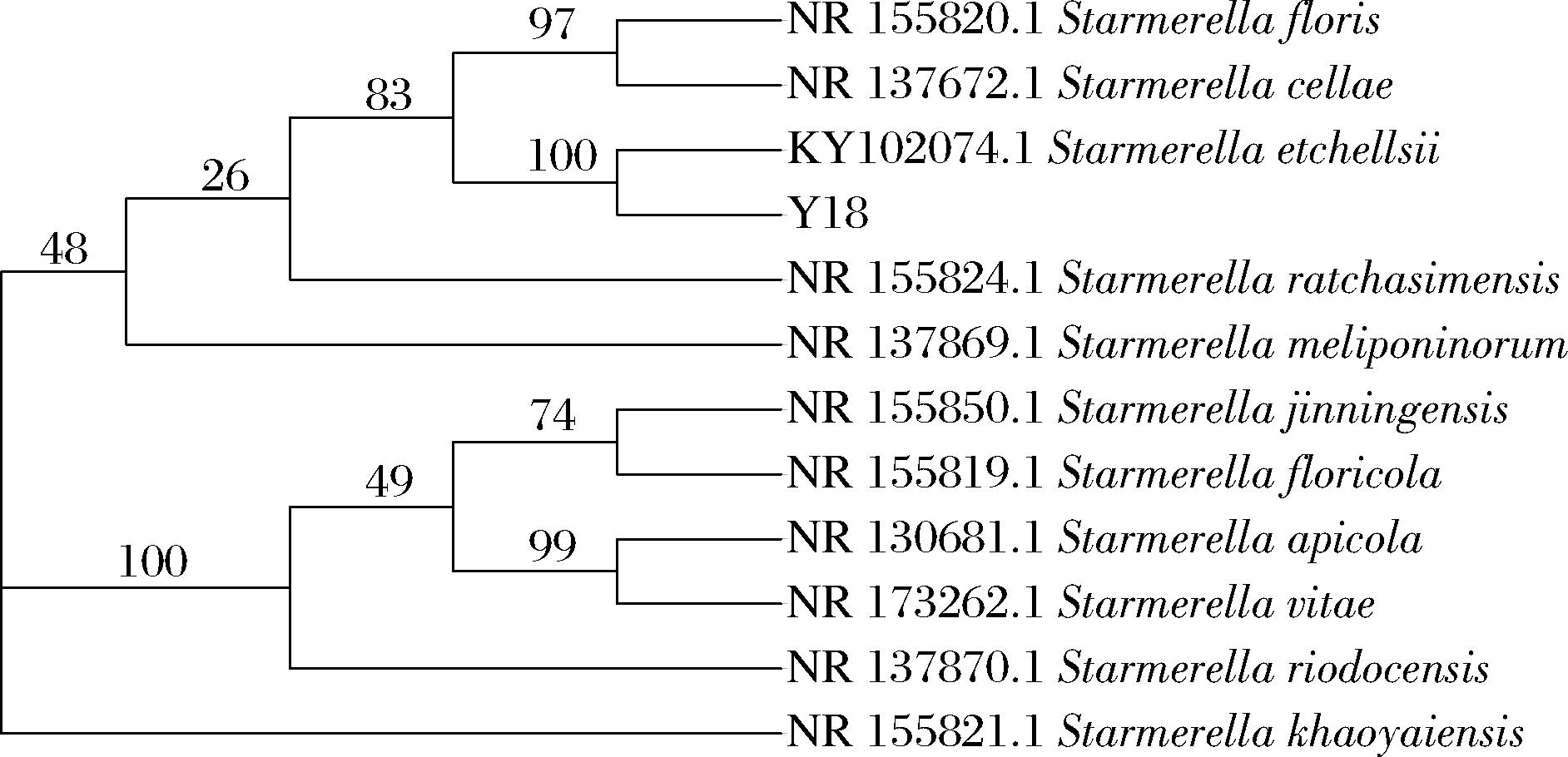
图3 基于ITS测序构建的菌株Y18系统发育树
Fig.3 Phylogenetic tree of strain Y18 constructed based on ITS sequencing
2.2 菌株代谢特性
2.2.1 菌株耐盐性
将埃切假丝酵母Y18接种在不同盐度的YPD培养基中,通过记录和绘制埃切假丝酵母Y18在不同盐度条件下的生长曲线,以评价其耐盐能力。如图4所示,埃切假丝酵母Y18具有良好的耐盐性。该菌株在40~100 g/L盐度下生长曲线没有显著差异,其在达到平衡期时菌液OD600值约为6.0左右。当盐度提升至120~160 g/L,其生长受到一定影响,在达到平衡期时OD600值仍能达到约5.5。在200 g/L盐度下,该菌株的迟滞期有所延长,但是在培养60 h后菌液OD600值达到4.5左右。埃切假丝酵母Y18在240 g/L盐度下的生长情况较差。因此,该菌株能够耐受40~200 g/L盐度。

图4 埃切假丝酵母Y18耐盐性
Fig.4 Salt tolerance of S.etchellsii Y18
2.2.2 菌株生长代谢特性
将埃切假丝酵母Y18接种在不同盐度的酱醅模拟培养基中,发酵3 d后,对发酵液的总酸、氨基酸态氮含量和活菌数进行测定,用于反映埃切假丝酵母Y18在不同盐度下的代谢特性,其结果如图5-a、图5-b所示。埃切假丝酵母Y18能够有效代谢酱醅模拟培养基中的总酸和氨基酸态氮,其中在100 g/L的盐度下代谢总酸和氨基酸态氮最多。通过对培养液进行平板计数,结果如图5-c所示,埃切假丝酵母Y18在100 g/L下活菌数最多。超过100 g/L的盐度,其生长代谢受到明显抑制。以上结果表明,100 g/L盐浓度最有利于埃切假丝酵母Y18的生长代谢。
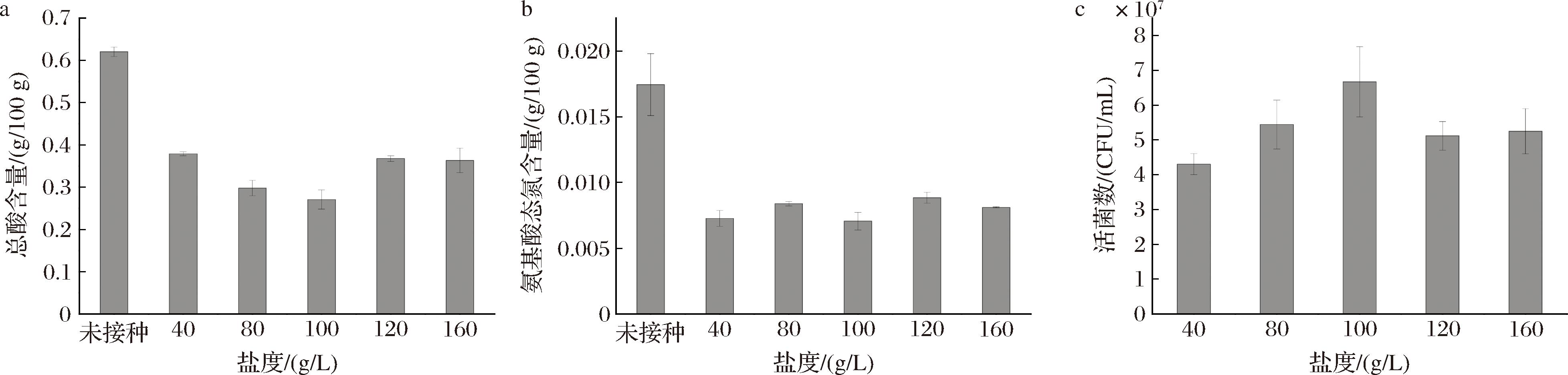
a-总酸;b-氨基酸态氮;c-活菌数
图5 埃切假丝酵母Y18生长代谢特性
Fig.5 Growth and metabolic characteristics of S.etchellsii Y18
2.2.3 菌株产挥发性风味物质能力
对酱醅模拟培养基中的挥发性风味物质种类和含量进行分析。由图6-a可知,除酸类、醛类和酚类物质外,接种了埃切假丝酵母Y18实验组中的醇类、酯类、酮类和其他类风味物质种类均多于对照组。实验组中醇类、酯类、酮类和其他类风味物质分别有6、9、3、12种,而对照组中对应物质种类分别为4、4、2、9种。进一步分析了不同类别挥发性风味物质的含量。从图6-b可以看出,实验组中的7种挥发性风味物质含量均显著高于对照组。接种了埃切假丝酵母Y18实验组中的醇类、酯类、酸类、醛类、酮类、酚类和其他类挥发性风味物质的含量分别为105.64、4.30、17.68、8.87、31.41、14.35、24.11 μg/L,和对照组对应值(1.30、l.27、8.28、6.79、0.42、0.61、3.59 μg/L)相比分别提高了80.45、2.39、1.14、0.31、74.11、22.50、5.71倍。以上结果表明埃切假丝酵母Y18有很好的产挥发性风味物质的能力。
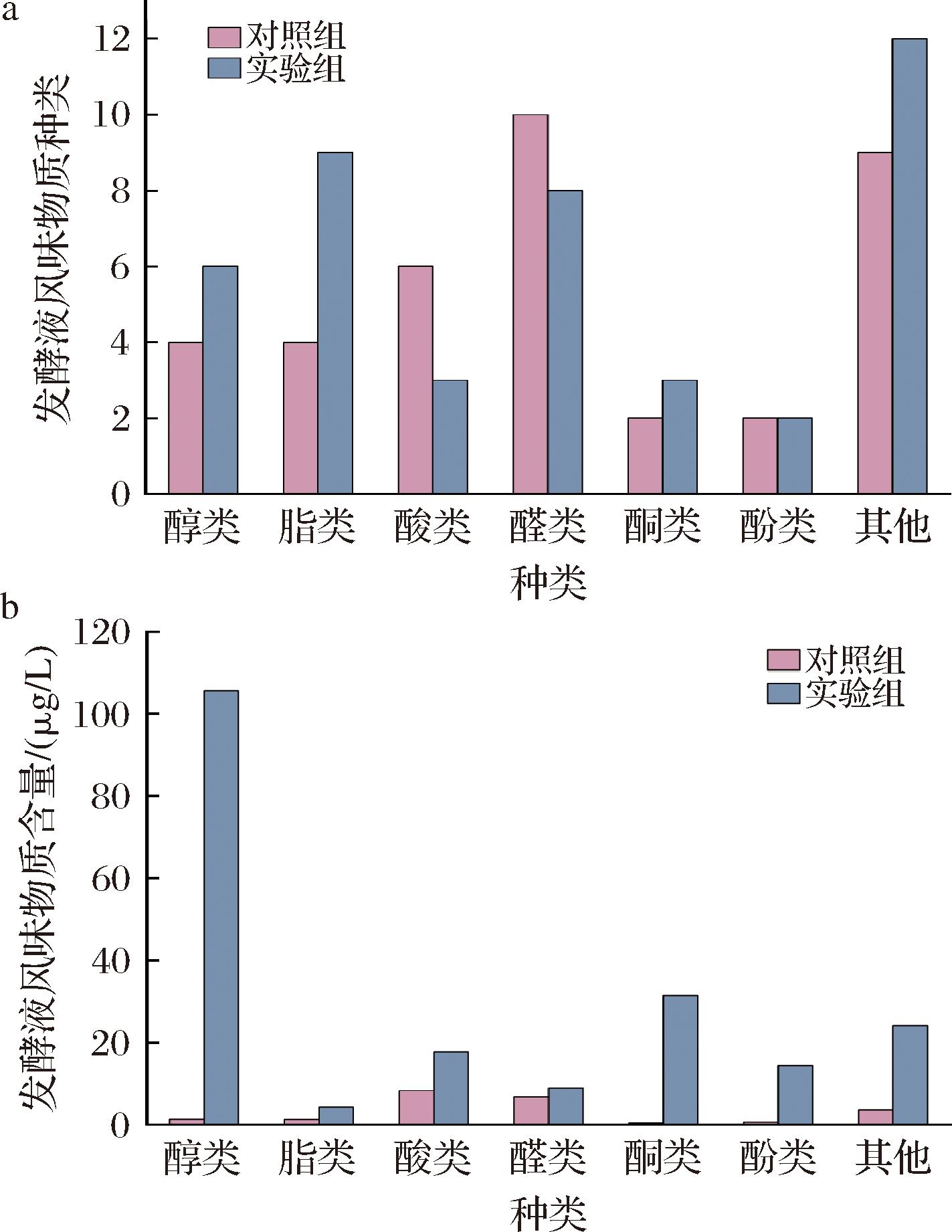
a-挥发性风味物质种类;b-挥发性风味物质含量
图6 发酵液挥发性风味物质种类和含量
Fig.6 Quantities and concentrations of volatile flavor compounds in fermentation broth
2.3 菌株在豆瓣酱发酵过程中的应用
2.3.1 酱醅理化指标测定
对接种埃切假丝酵母Y18菌株豆瓣酱酱醅和未接种酱醅的理化指标进行测定,结果如表2所示。埃切假丝酵母Y18的接种对豆瓣酱酱醅的水分、盐度和氨基酸态氮含量没有显著影响(P>0.05)。此外,接种Y18菌株酱醅的总酸含量和对照组相比有显著的降低(P<0.01)。
表2 接种或不接种埃切假丝酵母 Y18理化指标
Table 2 Physical and chemical indicators of broad bean paste with or without inoculation of S.etchellsii Y18

注:不同小写字母代表差异显著性,a:P>0.05;b:P<0.01。
样品水分/(g/100 g)盐度/(g/100 g)总酸含量/(g/100 g)氨基酸态氮含量/(g/100 g)未接种酱醅56.52±0.4512.74±0.091.21±0.020.43±0.01接种Y18菌株酱醅55.95±0.27a12.86±0.06a1.02±0.01b0.41±0.00a
2.3.2 酱醅挥发性风味物质分析
豆瓣酱发酵30 d后,接种埃切假丝酵母Y18的酱醅较未接种埃切假丝酵母的酱醅风味更加饱满,具有更强的果香和酱香。冯杰[18]研究表明,接种埃切假丝酵母能够显著提高酱油中HEMF的含量,从而使酱油的酱香更加浓郁。使用GC-MS对酱醅中的挥发性风味物质进行分析,接种埃切假丝酵母Y18的酱醅中挥发性化合物的含量和种类与未接种的酱醅有显著差异。
如图7-a所示,在未接种酱醅和接种埃切假丝酵母Y18的酱醅中分别发现了92和106种挥发性物质,其中酯类物质种类有大幅提升,而酸类、醛类、酮类和酚类物质种类有所减少;在此基础上,发现接种埃切假丝酵母Y18酱醅中的酯类和醇类物质的含量和未接种酱醅相比有显著提高(P<0.01)。接种埃切假丝酵母Y18的酱醅中酯类和醇类含量分别达到1 531.91 μg/kg和3 997.20 μg/kg,是未接种酱醅对应值的8.28倍和6.71倍(图7-b)。酯类和醇类物质对豆瓣酱风味的形成具有突出贡献作用,因此接种埃切假丝酵母Y18可以有效改善豆瓣酱的风味。
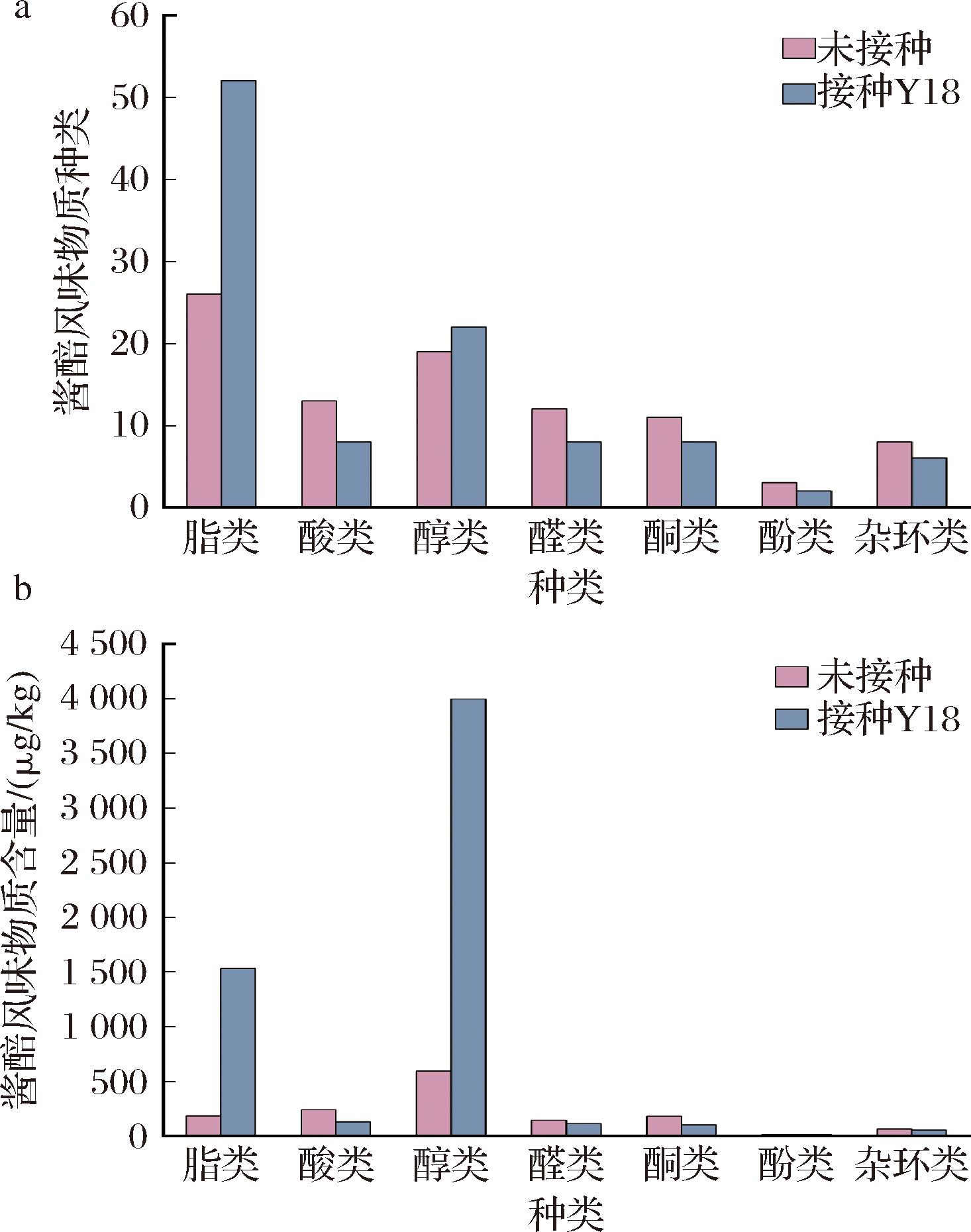
a-挥发性风味物质种类;b-挥发性风味物质含量
图7 接种或不接种埃切假丝酵母Y18酱醅挥发性风味物质种类和含量
Fig.7 Quantities and concentrations of volatile flavor compounds in broad bean paste with or without inoculation of S.etchellsii Y18
对接种埃切假丝酵母Y18酱醅中的挥发性风味物质进行进一步分析。如表3所示,酯类是酱醅中种类最多的挥发性风味物质,主要以棕榈酸乙酯、油酸乙酯、十四酸乙酯和苯乙酸乙酯为主,作为天然鲜水果、花朵中广泛存在的一类风味物质,能够赋予酱醅甜香、奶油香和花果香[19],使酱醅的风味更加柔和协调[18]。其中苯乙酸乙酯是豆瓣酱中的重要风味物质,有显著而甜蜜的玫瑰花香和似蜂蜜气味[20-21],仅在接种埃切假丝酵母Y18酱醅中检出。醇类是酱醅中含量最高的挥发性风味物质,主要以乙醇、苯乙醇和异戊醇为主。乙醇是酵母厌氧发酵的主要代谢产物,能够给酱醅带来酒香,还能作为底物参与醇类发酵和酯化作用,有利于风味物质的积累[22]。苯乙醇天然存在于橙花油,玫瑰油,香叶油等芳香油中,具有柔和、愉快而持久的玫瑰香气[23],是豆瓣酱中重要的风味物质[24],埃切假丝酵母Y18的接种使酱醅中苯乙醇的含量提高了21.44倍。3-甲硫基丙醇是一种酱醅中重要的含硫高级醇,其香气阈值低,低浓度时具有强烈的肉类芬芳香气,能赋予酱醅特有的风味。接种埃切假丝酵母Y18能够显著提高酱醅中3-甲硫基丙醇的含量。杂环类风味物质中的吡嗪类物质低浓度时具有强烈的烘烤香、焦香,是酱醅酱香的重要组成部分[18]。接种埃切假丝酵母Y18能够显著提高酱醅中吡嗪类物质的种类,在其酱醅中新检出了2,3,5-三甲基吡嗪和3,5-二乙基-2-甲基-吡嗪两种香气物质。以上结果表明,埃切假丝酵母Y18的接种能够显著提高苯乙酸乙酯、苯乙醇、3-甲硫基丙醇和2, 3, 5-三甲基吡嗪等酱醅中的重要风味物质含量[25],对豆瓣酱的风味和品质有着显著贡献。
表3 接种或不接种埃切假丝酵母 Y18酱醅挥发性风味物质
Table 3 Volatile flavor compounds in broad bean paste with or without inoculation of S.etchellsii Y18

分类CAS号名称含量/(μg/kg)未接种接种Y18分类CAS号名称含量/(μg/kg)未接种接种Y18酯类628-97-7棕榈酸乙酯8.27±0.52432.68±97.472613-89-0苯丙二酸0.57±0.13-544-35-4油酸乙酯0.15±0.03214.82±59.9醇类64-17-5乙醇145.20±3.631 778.40±228.82124-06-1十四酸乙酯0.81±0.13109.59±19.231960/12/8苯乙醇47.21±1.81 059.58±20.37101-97-3苯乙酸乙酯-106.45±3.18123-51-3异戊醇65.30±5.7882.24±138.5111-62-6油酸乙酯0.74±0.1885.93±85.9378-83-1异丁醇3.25±0.31127.37±22.7228267-29-0十三烷酸乙酯-62.56±9.583391-86-41-辛烯-3-醇188.91±17.5129.41±4.66141-78-6乙酸乙酯-60.98±7.38505-10-23-甲硫基丙醇5.95±0.2828.06±2.11108-64-5异戊酸乙酯54.18±0.8350.14±0.0378-70-6芳樟醇18.71±1.1523.75±0.736114-18-7反油酸乙酯1.05±049.03±49.0319132-06-02,3-丁二醇0.08±0.0812.21±0.2397-62-1异丁酸乙酯17.07±0.7338.50±4.36醇类71-36-3正丁醇-12.90±1.94112-39-0棕榈酸甲酯27.96±0.7432.44±1.24100-51-6苄醇1.26±0.0310.90±0.55129-66-812-甲基十四烷酸甲酯8.36±0.1231.52±0.6118409-17-1反式-2-辛烯-1-醇45.71±5.028.17±1.147452-79-12-甲基丁酸乙酯18.17±0.4330.83±2.6871-23-8丙醇-5.94±0.84
续表3

注:“-”表示未检出。
分类CAS号名称含量/(μg/kg)未接种接种Y18分类CAS号名称含量/(μg/kg)未接种接种Y18106-33-2月桂酸乙酯-25.91±3.74111-87-51-辛醇6.50±1.245.40±0.4106-32-1辛酸乙酯-25.26±0.11111-27-3正己醇8.76±1.063.57±0.9614010-23-2十七酸乙酯-20.00±4.832035-94-1DL-β-乙基苯乙基乙醇-1.12±041114-00-5十五酸乙酯-15.10±3.0971-41-01-戊醇1.60±0.360.81±0.01112-63-0亚油酸甲酯14.27±0.5314.84±0.47143-08-81-壬醇-0.71±0.09106-27-4丁酸异戊酯-13.96±0.483055-94-53-十二烷醇-0.52±0.16110-38-3癸酸乙酯-12.37±2.85111-35-33-乙氧基丙醇-0.47±0111-61-5硬脂酸乙酯-8.96±2.364730-22-76-甲基-2-庚醇0.43±0.020.37±0.211191-41-9亚麻酸乙酯-8.34±3.62627-59-85-甲基-2-环己醇-0.25±0.06105-54-4丁酸乙酯1.25±0.036.76±1.0698-00-0糠醇1.33±0.20.15±0.1193-89-0苯甲酸乙酯-6.64±0.6414852-31-42-十六烷醇1.02±0.3-112-32-3甲酸辛酯5.51±0.516.58±1.52470-82-6桉叶油醇0.46±0.46-103-45-7乙酸苯乙酯-6.40±0.3631087-44-2(R)-(-)-2-戊醇0.07±0.05-27625-35-02-甲基丁酸-3-甲基丁酯0.30±0.014.83±0.2498-55-5alpha-松油醇0.32±0.12-123-92-2乙酸异戊酯0.60±0.024.18±0.66醛类100-52-7苯甲醛46.05±2.4336.3±4.74124-10-7十四酸甲酯3.08±0.213.93±0.00122-78-1苯乙醛28.9±3.2136.19±2.19104-61-0α-戊基-γ-丁内酯3.78±0.73.90±0.98590-86-3异戊醛34.68±3.3222.25±5.36659-70-1异戊酸异戊酯-3.79±0.5996-17-32-甲基丁醛15.80±1.249.10±2.3397-85-8异丁酸异丁酯-3.68±1.0278-84-2异丁醛4.86±0.364.66±0.06123-25-1丁二酸二乙酯-3.25±0.344411-89-62-苯基巴豆醛-2.66±0.08101-41-7苯乙酸甲酯-3.00±0.3718829-55-5(E)-2-庚烯醛2.43±1.21.98±0.035405-41-43-羟基丁酸乙酯10.89±0.892.89±0.312463-77-62-十一烯醛-0.51±0.21103-52-6丁酸苯乙酯-2.60±0.9166-25-1己醛4.72±0.79-103-48-0异丁酸苯乙酯-2.57±1.01124-19-6壬醛3.56±0.08-123-66-0正己酸乙酯-1.86±0.03498-60-23-糠醛0.70±0.01 -24817-51-42-甲基丁酸-2-苯乙酯-1.83±0.04497-03-0(E)-2-甲基-2-丁烯醛1.25±0.01-13327-56-53-甲硫基丙酸乙酯-1.59±0.0928785-06-04-丙基苯甲醛0.13±0.10-酯类106-30-9庚酸乙酯-1.46±0.41998/1/1糠醛0.59±0.23-110-34-9十六酸2-甲基丙酯-1.44±0.31酮类106-68-33-辛酮84.55±3.8860.64±7.842445-67-22-甲基丁酸-2-二甲基丙酯-1.26±0.03513-86-03-羟基-2-丁酮-15.83±2.152445-78-52-甲基丁酸2-甲基丁酯-1.26±0.065878-19-31-甲氧基-2-丙酮-11.76±3.14112-23-2甲酸庚酯-1.10±0.4111-13-7仲辛酮51.41±2.137.68±0.12105-37-3丙酸乙酯0.35±0.211.04±0.134312-99-61-辛烯-3-酮31.14±7.312.25±0.035837-78-5惕各酸乙酯-0.97±0.37590-90-94-羟基-2-丁酮-0.75±0.21628-66-01,3-丙二醇二乙酸酯-0.92±0.21589-63-94-辛酮-0.72±0.42110-19-0乙酸异丁酯-0.64±0.12110-93-0甲基庚烯酮2.26±0.280.36±0.13105-85-1甲酸香草酯-0.55±0.1689-67-8香叶基丙酮2.73±0.73-142-90-5甲基丙烯酸月桂酯-0.45±0.03酮类123-19-34-庚酮3.09±0.14-627-90-7十一酸乙酯-0.31±0.06623-56-3乙基异丁酮0.97±0.03-7619/8/1亚油酸乙酯3.59±0.23-103-79-7苯基丙酮0.93±0.02-55590-83-5戊酸-2-甲基丁酯0.92±0.11-78-93-32-丁酮0.65±0 -556-24-1异戊酸甲酯1.45±0.02-3796-70-1香叶基丙酮2.94±1.24-868-57-52-甲基丁酸甲酯0.80±0.03-1604-28-06-甲基-3,5-戊二烯-2-酮0.59±0.11-2490-49-514-甲基十六烷酸甲酯0.90±0.22-酚类 97-53-0丁香酚11.61±0.5314.03±1.75111-11-5辛酸甲酯0.15±0.15-96-76-42,4-二叔丁基苯酚0.81±0.061.09±0.151731-92-6十七酸甲酯0.48±0.02-1990/5/1愈创木酚0.61±0.12-酸类503-74-2异戊酸148.75±18.76 87.26±7.43杂环类1124-11-42,3,5,6-四甲基吡嗪43.40±2.5530.09±0.3779-31-2异丁酸38.71±3.44 30.59±6.11100-42-5苯乙烯10.57±0.419.45±0.0964-19-7乙酸22.13±2.91 6.43±1.8614667-55-12,3,5-三甲基吡嗪-6.86±0.241883-13-2(±)-3-羟基月桂酸2.27±1.501.62±0.18496-16-22,3-二氢苯并呋喃-3.49±0.42103-82-2苯乙酸1.07±0.240.92±0.0518138-05-13,5-二乙基-2-甲基-吡嗪-2.86±0.05544-63-8肉豆蔻酸2.24±0.700.66±0.663777-69-32-正戊基呋喃3.91±0.091.49±1.491002-84-2正十五酸3.88±0.580.60±0.21123-32-02,5-二甲基吡嗪2.18±0.05-1957/10/3棕榈酸0.85±0.120.51±0.14108-88-3甲苯1.11±0.09-646-07-14-甲基戊酸14.23±0.75 -106-42-3对二甲苯0.13±0.01-565-63-9当归酸2.59±0.10-140-29-4苯乙腈1.44±0.13-142-62-1己酸1.72±0.10-2628-17-34-羟基苯乙烯1.20±0.21-112-05-0壬酸0.94±0.24-
3 结论与展望
本研究从自然发酵酱醅中筛选得到了一株耐盐产香酵母,经形态观察、分子生物学鉴定为埃切假丝酵母。该酵母对高盐环境有着较好的耐受性,能够耐受200 g/L盐度。将埃切假丝酵母Y18接种到酱醅模拟培养基中对其代谢特性进行研究,结果表明,埃切假丝酵母Y18在100 g/L盐度代谢能力最为旺盛,在酱醅模拟培养基中有着很好的产香能力。最后,将埃切假丝酵母Y18应用到豆瓣酱发酵过程中,结果表明,接种埃切假丝酵母能够显著提高酱醅中的挥发性风味物质种类和含量,具有更强的果香和酱香。此外,接种埃切假丝酵母Y18酱醅中重要挥发性风味物质的含量均有显著提高。综上,埃切假丝酵母Y18具有良好的耐盐产香能力,有利于提升酱醅的风味和品质,在豆瓣酱的工业化生产过程中具有潜在的应用价值。
[1] 范智义, 邓维琴, 李恒, 等.传统发酵调味品低盐化的研究进展[J].中国调味品, 2020, 45(7):194-200.FAN Z Y, DENG W Q, LI H, et al.Research progress on the desalination of traditional fermented condiments[J].China Condiment, 2020, 45(7):194-200.
[2] 徐琳娜, 王璋, 许时婴.豆瓣酱后熟过程中氨基酸和风味物质的变化[J].中国调味品, 2006,31(9):21-25.XU L N, WANG Z, XU S Y.Changes of free amino acid and volatile flavor compound in the process of aging of broad bean sauce[J].China Condiment, 2006,31(9):21-25.
[3] SUEZAWA Y, SUZUKI M, MORI H.Genotyping of a miso and soy sauce fermentation yeast, Zygosaccharomyces rouxii, based on sequence analysis of the partial 26S ribosomal RNA gene and two internal transcribed spacers[J].Bioscience Biotechnology and Biochemistry, 2008, 72(9):2452-2455.
[4] LI X, HIRAMOTO K, YOSHIDA M, et al.Identification of 2,5-dimethyl-4-hydroxy-3(2H)-furanone (DMHF) and 4-hydroxy-2(or 5)-ethyl-5(or 2)-methyl-3(2H)-furanone (HEMF) with DNA breaking activity in soy sauce[J].Food and Chemical Toxicology, 1998, 36(4):305-314.
[5] HAUCK T, LANDMANN C, BRÜHLMANN F, et al.Formation of 5-methyl-4-hydroxy-3 2H -furanone in cytosolic extracts obtained from Zygosaccharomyces rouxii[J].Journal of Agricultural and Food Chemistry, 2003, 51(5):1410-1414.
[6] 彭东, 蒋雪薇, 陈幽, 等.高盐稀态酱醪中耐盐生香酵母的筛选及生香特性研究[J].食品与发酵工业, 2020, 46(13):76-84.PENG D, JIANG X W, CHEN Y, et al.Screening and aroma-producing characteristics of salt-tolerant aroma-producing yeasts from high-salt liquid-state Moromi[J].Food and Fermentation Industries, 2020, 46 (13):76-84.
[7] 施庆珊, 陈仪本, 欧阳友生, 等.酱油酿造中的生香酵母及生香过程[J].中国酿造, 2006,25(1):57-60.SHI Q S, CHEN Y B, OUYANG Y S, et al.Flavour development resulted in the derivation of yeasts in soy sauce brewing[J].China Brewing, 2006,25(1):57-60.
[8] 续丹丹, 王文平, 张欣, 等.一株耐盐产香鲁氏接合酵母FA-1的鉴定及其在酱油酿造中的应用[J].中国酿造, 2022, 41(12):31-39.XU D D, WANG W P, ZHANG X, et al.Identification of a salt-tolerant and aroma-producing Zygosaccharomyces rouxii FA-1 and its application in soy sauce fermentation[J].China Brewing, 2022, 41(12):31-39.
[9] SINGRACHA P, NIAMSIRI N, VISESSANGUAN W, et al.Application of lactic acid bacteria and yeasts as starter cultures for reduced-salt soy sauce (moromi) fermentation[J].LWT, 2017, 78:181-188.[10] FENG J, ZHAN X B, WANG D, et al.Identification and analysis of the metabolic functions of a high-salt-tolerant halophilic aromatic yeast Candida etchellsii for soy sauce production[J].World Journal of Microbiology &Biotechnology, 2012, 28(4):1451-1458.
[11] 宋江, 吴婷, 王远亮.浅谈耐盐性酵母菌对传统酿造酱油风味的作用[J].中国酿造, 2012, 31(5):4-7.SONG J, WU T, WANG Y L.Discussion the function of salt-tolerant yeast to the flavor of the naturally fermented soy sauce[J].China Brewing, 2012, 31(5):4-7.
[12] 杨悦. 豆瓣酱降盐工艺的研究[D].无锡:江南大学, 2021.YANG Y.Study on salt reduction technology of bean paste[D].Wuxi:Jiangnan University, 2021.
[13] 吴志红, 汪天虹, 黄卫, 等.简便易行的丝状真菌染色体DNA提取法[J].菌物系统, 2001, 20(4):575-577.WU Z H, WANG T H, HUANG W, et al.A simplified method for chromosome DNA preparation from filamentous fungi[J].Mycosystema, 2001, 20(4):575-577.
[14] DANESI P, FIRACATIVE C, COGLIATI M, et al.Multilocus sequence typing (MLST) and M13 PCR fingerprinting revealed heterogeneity amongst Cryptococcus species obtained from Italian veterinary isolates[J].FEMS Yeast Research, 2014, 14(6):897-909.
[15] WANG Z M, LU Z M, YU Y J, et al.Batch-to-batch uniformity of bacterial community succession and flavor formation in the fermentation of Zhenjiang aromatic vinegar[J].Food Microbiology, 2015, 50:64-69.
[16] 贾云. 蚕豆酱发酵过程微生物群落结构及其功能分析[D].无锡:江南大学, 2021.JIA Y.Microbial community structure and function analysis in broad bean sauce fermentation process[D].Wuxi:Jiangnan University, 2021.
[17] MATSUMOTO M.Distribution analysis of population structures for Rhizoctonia solani AG-1 IA in Japanese paddy field, using rep-PCR assay[J].Archives of Phytopathology and Plant Protection, 2014, 47(9):1082-1088.
[18] 冯杰. 埃切假丝酵母产香机理及其对酱油风味的影响[D].无锡:江南大学, 2012.FENG J.Aroma production mechanism of Candida echizensis and its influence on soy sauce flavor[D].Wuxi:Jiangnan University, 2012.
[19] GAO L H, LIU T, AN X J, et al.Analysis of volatile flavor compounds influencing Chinese-type soy sauces using GC-MS combined with HS-SPME and discrimination with electronic nose[J].Journal of Food Science and Technology, 2017, 54(1):130-143.
[20] KANEKO S, KUMAZAWA K, NISHIMURA O.Studies on the key aroma compounds in raw (unheated) and heated Japanese soy sauce[J].Journal of Agricultural and Food Chemistry, 2013, 61(14):3396-3402.
[21] KANEKO S, KUMAZAWA K, NISHIMURA O.Comparison of key aroma compounds in five different types of Japanese soy sauces by aroma extract dilution analysis (AEDA)[J].Journal of Agricultural and Food Chemistry, 2012, 60(15):3831-3836.
[22] STEINHAUS P, SCHIEBERLE P.Characterization of the key aroma compounds in soy sauce using approaches of molecular sensory science[J].Journal of Agricultural and Food Chemistry, 2007, 55(15):6262-6269.
[23] 丁莉莉, 王昊, 王新宇, 等.日本酱油与中国酱油在不同模拟条件下挥发性呈香物质分析[J].中国酿造, 2019, 38(6):144-151.DING L L, WANG H, WANG X Y, et al.Analysis of volatile aroma substances of Japanese soy sauce and Chinese soy sauce under different simulated conditions[J].China Brewing, 2019, 38(6):144-151.
[24] 邹谋勇, 朱新贵, 刘丹, 等.产2-苯乙醇酵母的鉴定及其在酱油发酵中的应用[J].食品科学, 2019, 40(6):217-222.ZOU M Y, ZHU X G, LIU D, et al.Identification of 2-phenethyl alcohol-producing yeast and its application in soy sauce fermentation[J].Food Science, 2019, 40(6):217-222.
[25] 朱莉, 许长华.酱油关键风味物质及其功能与发酵工艺研究进展[J].食品与发酵工业, 2018, 44(6):287-292.ZHU L, XU C H.Research advances on the key flavor substance of soy sauce and its functions and fermentation technology[J].Food and Fermentation Industries, 2018, 44(6):287-292.