ATP和GTP都属于高能磷酸化合物,它们不仅是RNA和DNA合成的必要组分,同时在细胞能量转移和信号传导途径中扮演关键角色[1-2]。在医学实践中,核苷如A(G)TP的应用已扩展至治疗慢性肝炎、进行性肌肉萎缩、视力减退等疾病[3-4],并在美容和保健领域的需求逐年增长[5]。近年来,核苷类药物的药理学、药学和临床应用得到深入研究,特别是在抗肿瘤和抗病毒领域的进展[6-7]。这为A(G)TP成为新一代临床药物提供了可能性。然而,在实现这一目标的过程中,探究低成本的A(G)TP体外合成方法显得尤为关键。
聚磷酸激酶(polyphosphate kinase,PPK,EC 2.7.4.1)能够催化核苷三磷酸的可逆磷酸化[8]。PPK能够利用成本较低和广泛存在的多聚磷酸(polyP)盐作为磷酸基供体,进行ATP或GTP的合成、再生反应。与其他A(G)TP再生系统(如丙酮酸激酶-磷酸烯醇式丙酮酸系统)相比[9],PPK所需的底物更为经济且稳定,更适用于工业规模生产[10]。聚磷酸激酶对不同核苷底物的催化能力与其家族分布密切相关,目前已表征了两个大的结构不相关的细菌PPK家族:偏好合成聚磷酸的PPK1家族和偏好核苷酸磷酸化的PPK2家族,后者可以有效地实现A(G)TP的体外合成[11]。近期提出了多种分子固定化策略,特别是许多自组装标签已被研发用于触发体内酶的自组装[12]。由于其操作模式的方便性和高效性,基于聚磷酸激酶的酶自组装固定化系统对于A(G)TP的催化合成具有吸引力和前景。
本研究首先根据多聚磷酸激酶家族的分类和对不同底物催化能力,筛选出了属于多聚磷酸激酶第二家族、源自Deinococcus radiodurans的DrPPK2。验证了DrPPK2能同时合成ATP和GTP的活性。随后,对缓冲液的pH值、Mg2+浓度以及催化温度进行了优化,显著提高了其合成A(G)TP的效率,最高转化率超过92%。为了简化催化流程并降低合成成本,通过引入自组装标签CipA,实现了对DrPPK2的自组装固定化。通过离心操作,即可获得较高纯度的蛋白,并能实现酶的重复利用。首次转化率达到90%,且能有效重复催化超过10次。综上所述,本研究为应用聚磷酸激酶低成本催化合成A(G)TP提供了有效的策略,也为在合成生物学和工业生产中A(G)TP再生系统的构建与应用提供了有力的支持。
1 材料与方法
1.1 材料
1.1.1 菌种与质粒
本研究所使用的菌株质粒见表1。
表1 本文所使用的菌株和质粒
Table 1 The strains and plasmids used in this study

菌株与质粒 特点来源E.coli JM109克隆宿主本实验室菌株E.coli BL21(DE3)表达宿主本实验室E.coliDrPPK2E.coli BL21(DE3)/pET28a-drppk2本研究E.coliDrPPK2-CipAE.coli BL21(DE3)/pET28a-drppk2-cipa本研究pET28a(+)表达载体,KanaR本实验室质粒pET28a-drppk2含有drppk2的表达载体,KanaR本研究pET28a-drppk2-cipa含有drppk2-cipa的表达载体,KanaR本研究
1.1.2 实验试剂
酵母粉、蛋白胨,Oxoid公司,GDP、GTP、ADP、ATP(>95%),上海麦克林生化科技有限公司;基因合成、引物合成及测序,金维智生物科技有限公司;质粒回收试剂盒、抗生素、诱导剂,上海生物工程股份有限公司;DNA聚合酶,TaKaRa生物科技有限公司;其他常规试剂,国药集团化学试剂有限公司。
1.1.3 培养基
LB培养基(g/L):蛋白胨10,酵母粉5,NaCl 10,固体培养基另加入1.5%(质量分数)的琼脂粉。
TB培养基(g/L):蛋白胨11.8,酵母粉23.6,K2HPO4 9.4,KH2PO4 2.2,甘油5,pH值7.4左右。
培养基使用时加入终质量浓度50 mg/L的卡那霉素。
1.2 实验方法
1.2.1 质粒的构建
从UniProt查到DrPPK2的蛋白序列信息(https://www.uniprot.org/uniprotkb/Q9RY20/entry),利用反向翻译成DNA序列后,利用网站http://www.detaibio.com/tools/进行密码子优化后,由金维智生物科技有限公司合成,获得质粒pET28a-drppk2。设计引物ZT-F:GTGGATCACAACTTTAGATGGATCG和ZT-R:TAAAAGCTTGCGGCCGCACTCG,用pET28a-drppk2作模板,扩增出含drppk2的线性化载体;设计引物cipa-F:GATCCATCTAAAGTTGTGATCCACGGTTCTATTAATGACATGCATCCTTCTTTAATTAAAG和cipa-R: CTCGAGTGCGGCCGCAAGCTTTTACATAGAGATTTCT ACGCAATTAATGTAATCG,用合成的cipa片段作模板,扩增出片段带同源臂的cipa片段;利用一步克隆酶连接线性化载体和cipa片段,接着对构建好的质粒进行测序确认。
1.2.2 菌株的培养与表达
将保藏在-80 ℃中含目的基因的大肠杆菌取出,划线在含有Kana抗性的LB平板上,在37 ℃的温度下将其在培养箱中过夜培养。接着将培养好的菌落挑选到含有Kana抗性的液体LB培养基中,37 ℃振荡培养10 h。随后,以1%(体积分数)的接种量将培养好的菌液接种到含有Kana抗性的液体TB培养基中,然后在37 ℃的条件下培养至细菌的光密度(OD600值)达到0.8~1.0,添加适量的诱导剂IPTG,放置在相应温度的摇床上继续培养12 h。
1.2.3 ATP和GTP含量的检测
催化完成后,离心收集上清液并通过0.22 μm滤膜过滤。使用HPLC测定ATP和GTP的产生。HPLC检测条件如下:流动相为pH=6.5的20 mmol/L磷酸盐缓冲液,流速为0.8 mL/min,紫外吸收波长为254 nm,柱温30 ℃,液相色谱柱购自赛默飞世尔科技公司Hypersil GOLDTM C18(250 mm×4.6 mm,5 μm),进样量为5 μL[10,13]。
1.2.4 酶活力定义
游离的聚磷激酶DrPPK2的酶活力定义:在30 ℃,pH=7.5的情况下,每分钟生成1 μmol的ATP或GTP所需的酶量[14]。
固定化的聚磷酸激酶DrPPK2的酶活力定义:在30 ℃,pH=7.5的情况下,每分钟生成1 μmol的ATP或GTP所需的生物量,即破壁前细胞湿重。
2 结果与分析
2.1 DrPPK2的分类及酶活力分析
2.1.1 DrPPK2的酶活力分析
聚磷酸激酶PPK2能够利用聚磷酸polyP6作为供体的正向转移实现核苷酸三磷酸酯的末端磷酰残基的磷酸化,其中属于聚磷酸激酶第二家族的三类的DrPPK2(UniProt entry:Q9RY20)具有同时合成ATP和GTP磷酸化的潜能[15],如图1所示。

图1 聚磷酸激酶催化合成ADP和GDP示意图
Fig.1 Schematic diagram of the synthesis of ADP and GDP catalyzed by polyphosphate kinase
将编码DrPPK2的核苷酸序列插入质粒pET28a的酶切位点BamH I和Hind Ⅲ之间,测序正确后转入E.coli BL21(DE3)中进行摇瓶培养表达,收集菌体加入50 mmol/L Tris-HCl(pH=7.5)的缓冲液中破壁,离心去除细胞碎片后获得粗酶液。加入底物聚磷酸(polyP6)和ADP或GDP,在35 ℃条件下反应2 h,用高效液相检测ATP或GTP的产生,如图2所示。从液相色谱中可以看出ATP或GTP均能够生成,证实了DrPPK2同时具有合成ATP和GTP的催化活性。
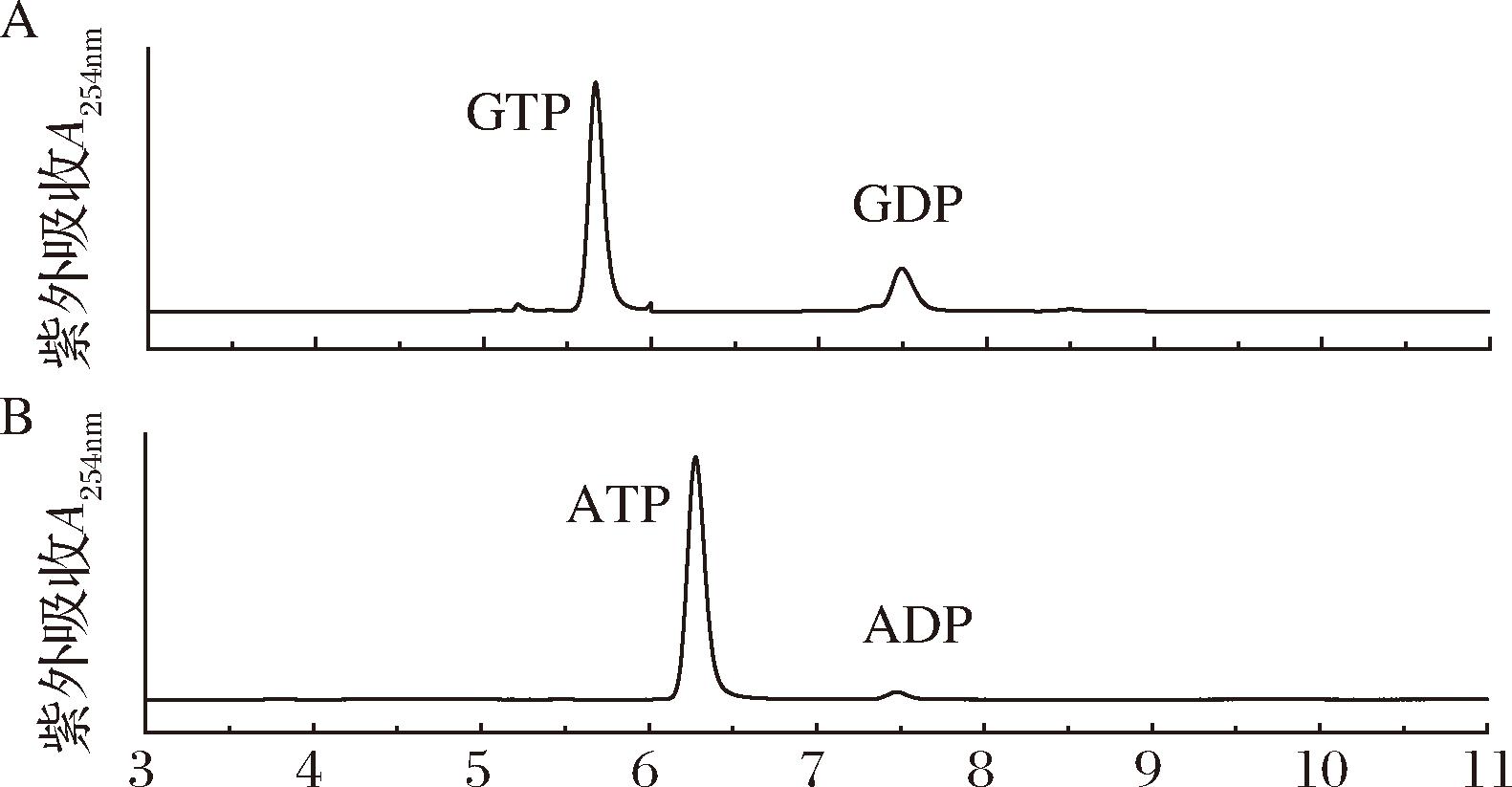
A-GDP;B-ADP
图2 高效液相色谱分析聚磷酸激酶DrPPK2对GDP和ADP的酶活力
Fig.2 HPLC analysis of the enzyme activity of DrPPK2 towards GDP and ADP
2.1.2 DrPPK2的表达优化
为了提高DrPPK2的表达水平,对诱导剂浓度和诱导温度进行优化。首先设置诱导剂浓度IPTG的梯度为0.2、0.5、1.0 mmol/L,培养温度在37 ℃下诱导表达,测定催化底物GDP的活力,如图3所示,确定最佳诱导剂浓度为0.5 mmol/L。接着对诱导温度进行优化,从图中可以看出,随着温度的升高,表达的酶活力逐渐下降,证明一定范围的低温有利于DrPPK2的表达,但是温度过低不利于细胞生长和工业化应用,因此确定最佳诱导温度为25 ℃,酶活力达到18 U/L。

图3 聚磷酸激酶DrPPK2的表达条件优化
Fig.3 Optimization of DrPPK2 expression conditions
2.1.3 DrPPK2的纯化分析及比酶活测定
为了进一步了解DrPPK2的酶学性质,利用Ni-NTA亲和层析对DrPPK2尝试纯化。将破壁获得的粗酶液利用0.22 μm滤膜过滤,使用His Trap HP柱子纯化,并用不同浓度的咪唑洗脱,采用SDS-PAGE分析蛋白纯化情况,如图4-A所示,纯化蛋白清晰单一,说明DrPPK2能够实现有效的纯化。

A-DrPPK2的纯化SDS-PAGE胶图[M-蛋白Marker(下同);1-粗酶液;2~4-纯化酶];B-DrPPK2的比酶活力测定
图4 聚磷酸激酶DrPPK2的纯化及比酶活测定
Fig.4 Purification and specific enzyme activity determination of DrPPK2
将获得的纯化的蛋白脱盐后进行蛋白定量,用纯酶测定分别对于GDP和ADP的比酶活力,添加polyP6作为磷酸供体,其中对GDP和ADP的比酶活力分别是8.0 U/mg和13.0 U/mg,如图4-B所示。说明对比GDP,DrPPK2倾向于磷酸化ADP生成ATP。
2.2 DrPPK2催化合成A(G)TP的体系优化
为了在实际应用中获得较高的底物A(G)DP的转化率,以GTP合成为例,对催化体系中的温度、pH和Mg2+浓度进行优化,如图5所示。初始GDP浓度为10 mmol/L,polyP6为5 mmol/L,Mg2+为5 mmol/L。设置了pH值为6.5、7.0、7.5和8.0梯度的优化条件,结果显示当pH=7.5时转化率最高;优化温度为35 ℃最佳;添加MgCl2提供镁离子,当镁离子浓度为10 mmol/L时转化率达到最高,为92%。
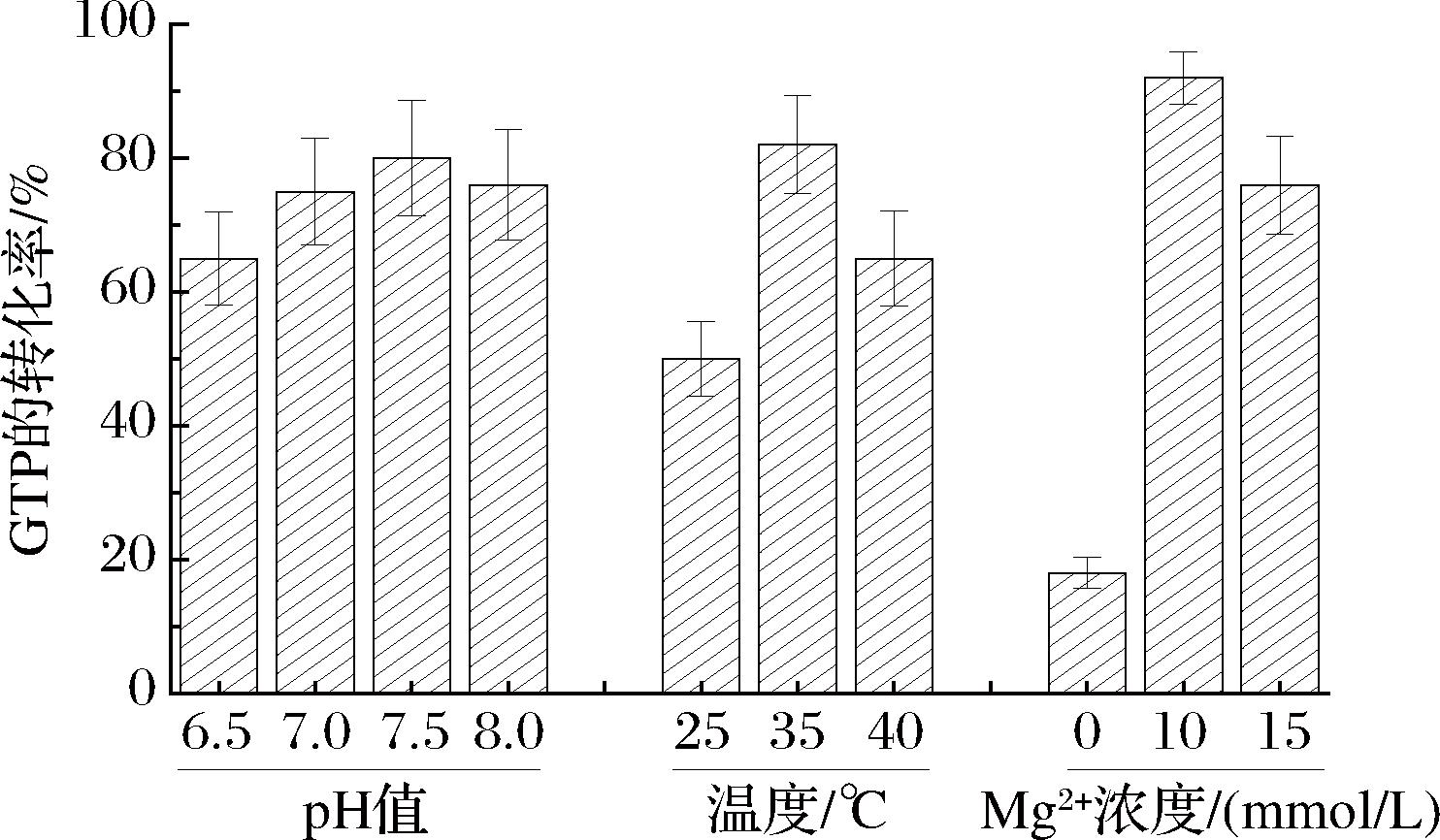
图5 聚磷酸激酶DrPPK2的催化体系优化
Fig.5 Optimization of the catalytic system of polyphosphate kinase DrPPK2
一方面,Mg2+和A(G)TP之间的结合导致足够的构象形成以削弱A(G)TP的末端磷酯键,从而促进磷酸基团的转移,另一方面,Mg2+与聚磷酸激酶结合,参与催化构象的形成,更好地使底物进入酶的活性位点,发生催化反应。当镁离子低于最适浓度时,溶液中的镁离子不足以与底物或酶结合,反应不充分,当镁离子浓度大于最适浓度时,溶液过多的镁离子可能会影响酶与底物的释放,因此优化出合适的镁离子浓度对今后催化放大和工业化是必要的。
2.3 自组装固定化DrPPK2及催化合成体系构建
2.3.1 自组装固定化的DrPPK2
由于游离的酶在催化后难以回收再次利用,尤其某些酶需要在被纯化后使用,极大地造成生产成本的上升。固定化酶技术能够很好地解决这一问题。许多自组装标签已经被开发用于在体内触发酶的自组装[16],形成活性包涵体形式,省去了物理纯化的很多步骤,大大降低了生产成本。CipA作为自组装标签的优越性已经被证实[17],本研究计划通过连接CipA实现DrPPK2自组装固定化和循环催化,降低酶的生产成本。
将含有质粒pET28a-drppk2-cipa的大肠杆菌培养,诱导条件终浓度为0.5 mmol/L的IPTG作为诱导剂,放置在转速为220 r/min,温度为30 ℃的摇床内继续培养12 h。之后利用SDS-PAGE分析蛋白表达情况,如图6-A所示,发现DrPPK2-CipA实现了有效地沉淀,说明自组装标签有效触发了DrPPK2的自组装固定化。进一步对固定化酶活测定后分析,如图6-B所示,包涵体酶均有对GDP和ADP的催化活性,说明成功实现了自组装固定化有活性的DrPPK2。
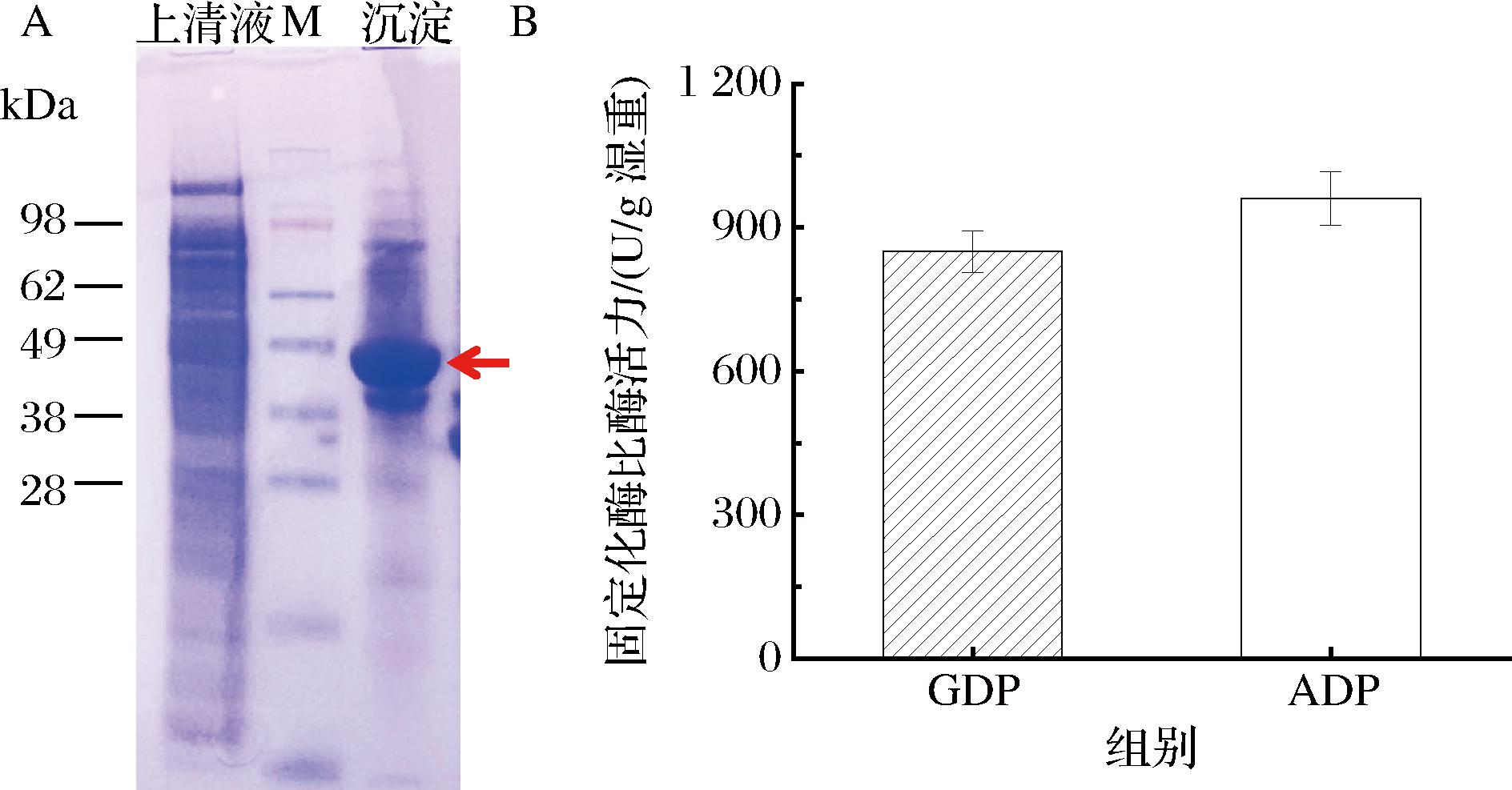
A-固定化DrPPK2-CipA的SDS-PAGE分析胶图;B-DrPPK2-CipA的酶活力测定
图6 自组装固定化的DrPPK2
Fig.6 Self-assembled immobilized DrPPK2
2.3.2 固定化DrPPK2用于催化合成ATP和GTP
上述实验结果表明成功实现了DrPPK2自组装固定化,可用于后续的循环催化。细胞在经过培养并破壁后,即可通过离心、收集、重悬和催化等循环操作步骤(图7-A),实现GTP和ATP的循环催化合成。在分别添加10 mmol/L ADP或GDP底物时,利用重悬的固定化酶颗粒催化,第一轮的转化率分别达到了90%和89%,在重复经过10轮催化后,转化率均大于65%(图7-B),展示了自组装固定化酶催化的操作简便性和固定化酶性能的稳定性,相比较传统的纯化后游离催化,极大的节约了酶的制备成本。

A-固定化酶催化流程图;B-固定化酶催化循环次数测定
图7 固定化DrPPK2的催化流程及循环次数测定
Fig.7 Catalytic process and cycle number determination of immobilized DrPPK2
本研究率先通过自组装固定化手段成功实现了DrPPK2的固定化催化,通过离心即可获得高纯度的聚磷酸激酶,同时实现ATP和GTP的合成,技术具有先进性。在今后的研究中,将主要聚焦到催化体系的放大和提高酶的稳定性,进而提高循环使用次数,并且能够在复杂的催化体系中完成催化,达到规模化应用水平。
3 结论
本研究通过对多聚磷酸激酶(PPK)家族的系统分类和底物催化能力的分析,选用了Deinococcus radiodurans源自第二家族聚磷酸激酶DrPPK2验证了其在体外同时合成ATP和GTP的活性。通过表达条件优化和酶的纯化,提高了蛋白的表达水平并测定了DrPPK2的酶学性质,随后,通过对反应条件的优化,包括缓冲液pH、Mg2+浓度和催化温度的调整,使DrPPK2合成A(G)TP效率显著提升,最高转化率达到了92%以上。不但为体外合成ATP和GTP提供了借鉴,也为复杂酶级联催化反应中A(G)TP再生和其他核苷再生系统的构建提供了参考,尤其是同时含有多种核苷酸的催化应用中[18-19]。
为了降低合成成本和简化催化流程,通过引入了自组装标签CipA,实现了DrPPK2的自组装固定化。通过离心操作,即可获得高纯度的蛋白,成功实现了酶的重复利用,有效使用效率超过10次。证明了自组装固定化的有效性和便捷性,并为A(G)TP的体外合成提供了经济、高效且可持续的方法。本研究的结果表明,基于聚磷酸激酶的酶自组装固定化系统对A(G)TP的催化合成具有吸引力和工业化前景。
总体而言,本研究为多聚磷酸激酶在A(G)TP合成中的应用提供了有效的策略。未来,可以进一步探索多聚磷酸激酶在合成生物学和工业生产中的潜在应用,并优化固定化系统的性能,以推动这一领域的发展。这对于低成本体外合成核苷酸类化合物[20-21],尤其是A(G)TP,具有重要的意义,并为新一代临床药物的研发提供了有力的支持。
[1] REN Y N, LIU Q, LIU H F, et al.Engineering substrate and energy metabolism for living cell production of cytidine-5′-diphosphocholine[J].Biotechnology and Bioengineering, 2020, 117(5):1426-1435.
[2] 胥睿睿. 体外酶法合成3′-磷酸腺苷-5′-磷酰硫酸[D].无锡:江南大学, 2020.XU R R.Enzymatic synthesis of 3′-phosphoadenosine-5′-phosphosulfate in vitro[D].Wuxi:Jiangnan university, 2020.
[3] 高妮妮, 王芳, 廉哲勋.PI3K-Akt-eNOS信号通路在三磷酸腺苷后处理减轻兔心肌缺血再灌注损伤中的作用[J].中国循环杂志, 2014, 29(1):59-63.GAO N N, WANG F, LIAN Z X.ATP post conditioning of PI3K-Akt-eNOS signaling pathway reducing the myocardial ischemia reperfusion injury in experimental rabbits[J].Chinese Circulation Journal, 2014, 29(1):59-63.
[4] 张杨. 微胶囊固定化细胞生物合成胞苷三磷酸[D].杭州:浙江工业大学, 2011.ZHANG Y.Biosynthesis of cytidine triphosphate by microcapsules immobilized yeast cells[D].Hangzhou:Zhejiang University of Technology, 2011.
[5] 陈德康, 吕浩, 何明芳, 等.酵母酶系合成三磷酸鸟苷的研究[J].生物加工过程, 2004,2(3):51-55.CHEN D K, LYU H, HE M F, et al.Optimizing the phosphorylation of GMP to GTP in the presence of beer yeasts[J].Chinese Journal of Bioprocess Engineering, 2004,2(3):51-55.
[6] MEANWELL M, SILVERMAN S M, LEHMANN J, et al.A short de novo synthesis of nucleoside analogs[J].Science, 2020, 369(6504):725-730.
[7] ELFIKY A A.Anti-HCV, nucleotide inhibitors, repurposing against COVID-19[J].Life Sciences, 2020, 248:117477.
[8] NOCEK B, KOCHINYAN S, PROUDFOOT M, et al.Polyphosphate-dependent synthesis of ATP and ADP by the family-2 polyphosphate kinases in bacteria[J].Proceedings of the National Academy of Sciences of the United States of America, 2008, 105(46):17730-17735.
[9] ANDEXER J N, RICHTER M.Emerging enzymes for ATP regeneration in biocatalytic processes[J].Chembiochem, 2015, 16(3):380-386. [10] XU R R, ZHANG W, XI X T, et al.Engineering sulfonate group donor regeneration systems to boost biosynthesis of sulfated compounds[J].Nature Communications, 2023, 14(1):7297.
[11] XU R R, WANG Y, HUANG H, et al.Closed-loop system driven by ADP phosphorylation from pyrophosphate affords equimolar transformation of ATP to 3′-phosphoadenosine-5′-phosphosulfate[J].ACS Catalysis, 2021, 11(16):10 405-10 415.
[12] 汪培林. 3′-磷酸腺苷-5′-磷酰硫酸固定化催化体系的构建与优化[D].无锡:江南大学, 2023.WANG P L.Construction and optimization of an immobilized catalytic system for the biosynthesis of 3′-phosphoadenosine-5′-phosphosulfate[D].Wuxi:Jiangnan University, 2023.
[13] 刘亚, 章超桦, 陆子锋.高效液相色谱法检测水产品中的ATP关联化合物[J].食品与发酵工业, 2010, 36(6):137-141.LIU Y, ZHANG C H, LU Z F.Detection of ATP related compounds of sea food by HPLC[J].Food and Fermentation Industries, 2010, 36(6):137-141.
[14] PARNELL A E, MORDHORST S, KEMPER F, et al.Substrate recognition and mechanism revealed by ligand-bound polyphosphate kinase 2 structures[J].Proceedings of the National Academy of Sciences of the United States of America, 2018, 115(13):3350-3355.
[15] NOCEK B P, KHUSNUTDINOVA A N, RUSZKOWSKI M, et al.Structural insights into substrate selectivity and activity of bacterial polyphosphate kinases[J].ACS Catalysis, 2018, 8(11):10746-10760.
[16] WANG Y, HEERMANN R, JUNG K.CipA and CipB as scaffolds to organize proteins into crystalline inclusions[J].ACS Synthetic Biology, 2017, 6(5):826-836.
[17] WANG P L, XU R R, ZHAO L L, et al.Construction of a protein crystalline inclusion-based enzyme immobilization system for biosynthesis of PAPS from ATP and sulfate[J].ACS Synthetic Biology, 2023, 12(5):1487-1496.
[18] 吴思佳, 李杰, 胡晨龙, 等.固定化尿苷-胞苷激酶和聚磷酸激酶偶联催化制备5′-胞苷酸[J].生物工程学报, 2020, 36(5):1002-1011.WU S J, LI J, HU C L, et al.Concomitant use of immobilized uridine-cytidine kinase and polyphosphate kinase for 5′-cytidine monophosphate production[J].Chinese Journal of Biotechnology.2020, 36(5):1002-1011.
[19] WANG P H, FUJISHIMA K, BERHANU S, et al.A bifunctional polyphosphate kinase driving the regeneration of nucleoside triphosphate and reconstituted cell-free protein synthesis[J].ACS Synthetic Biology, 2020, 9(1):36-42.
[20] 应国清, 石陆娥, 唐振兴.核苷酸类物质的应用研究进展[J].广州食品工业科技, 2004,20(2):126-128;125.YING G Q, SHI L E, TANG Z X.The application of mononucleotides[J].Modern Food Science and Technology, 2004,20(2):126-128;125.
[21] 张国睿, 雷爱祖, 童张法.海藻酸钠明胶协同固定化酵母生产ATP[J].食品与发酵工业, 2008,34(4):16-20;34.ZHANG G R, LEI A Z, TONG Z F.Biosynthesis of adenosine 5′-triphosphate by using sodium alginate-gelatin immobilized yeast cells[J].Food and Fermentation Industries, 2008,34(4):16-20;34.