中国是仅次于美国和巴西的第三大牛肉生产国,2007年以来我国牛肉产量一直维持在600万t以上[1]。牛肉营养价值高,具有高蛋白、低脂肪、营养物质丰富等特点,在国内居民肉类消费中占据重要的地位。随着人们生活水平的提高,牛肉的需求日益增加,提高牛肉的品质成为当前研究的热点之一。影响牛肉品质的因素主要有pH、肉色、嫩度和肌内脂肪含量,而这些因素与肌纤维类型组成密切相关。肌纤维是构成肌肉组织的基本结构单位,根据肌球蛋白重链(myosin heavy chain,MyHC)亚型的不同,肌纤维类型分为4种类型,包括MyHCⅠ(慢速氧化型)、MyHCⅡa(快速氧化型)、MyHCⅡx(中间型)和MyHCⅡb(快速酵解型)[2]。畜禽出生后肌纤维数目基本上不再变化,但肌纤维类型组成会发生改变。因此,改变肌纤维类型的组成是一种改善肉类品质的方法。
近期有研究表明,动物日粮添加多酚类物质和氨基酸可以促进肌纤维类型转化,进而改善肉品质,断奶仔猪日粮添加0.25%的亮氨酸显著提高了背最长肌慢肌表达,降低了快肌表达[3],小鼠日粮添加0.15%的L-茶氨酸促进了骨骼肌纤维由Ⅱ型向Ⅰ型转化[4],育肥猪饲粮中添加200 mg/kg番茄红素可以促进肌纤维类型由快肌转化为慢肌[5]。白藜芦醇(resveratrol,Res)是一种天然多酚,研究表明它可以促进育肥猪、断奶仔猪、母猪和牛肌管细胞肌纤维类型的转化[6-9]。除了一些营养物质的作用,信号通路在调控肌纤维类型转化中也发挥着重要的作用。丝氨酸-苏氨酸蛋白激酶(serine-threonine protein kinase,Akt)/叉头盒蛋白O(forkhead box protein O,FoxO)信号通路是调节肌纤维类型转化的一条重要通路,番茄红素通过Akt/FoxO1信号通路调控小鼠骨骼肌纤维类型由快肌向慢肌转化[10],亮氨酸通过Akt/FoxO1信号通路促进猪肌纤维类型从快肌向慢肌转化[11]。但肉牛日粮中添加白藜芦醇是否影响Akt/FoxO信号通路调控肌纤维类型转化及其机制还不明确。基于此,本研究推测白藜芦醇可能是通过激活Akt/FoxO信号通路,进而促进牛肌纤维类型转化。因此本研究以鲁西黄牛×西门塔尔杂交牛为研究对象,通过测定牛背最长肌和腰大肌肌纤维类型基因表达,研究白藜芦醇对肉牛肌纤维类型的影响;在此基础上,进一步测定Akt/FoxO信号通路相关分子表达,从而明确白藜芦醇调控牛肌纤维转化的可能内在机理。
1 材料与方法
1.1 材料与试剂
选取12头身体状况良好的14月龄鲁西×西门塔尔杂交公牛,随机分为对照组(control)和白藜芦醇组(Res),每组6只。对照组饲喂全混合基础日粮,白藜芦醇组饲喂添加白藜芦醇的全混合日粮(每头牛每天补充5 g,相当于每千克基础日粮中添加450 mg)。
牛成肌细胞,上海一研生物科技有限公司;胰蛋白酶、最低必需培养基(minimum essential medium,MEM)、双抗(青霉素-链霉素)、马血清、噻唑蓝(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、二甲基亚砜(dimethyl sulfoxide,DMSO)、磷酸盐缓冲液(phosphate buffered saline,PBS),北京索莱宝公司;胎牛血清(fetal bovine serum,FBS),以色列Biological Industries公司;白藜芦醇(纯度99.94%,细胞用),美国MedChemexpress生物科技公司;渥曼青霉素(wortmannin),美国Selleck生物科技有限公司;白藜芦醇(纯度98%,动物用),西安瑞盈生物科技有限公司;异丙醇、无水乙醇、甲醇,天津凯通化学试剂公司;RNA-easy Isolation Reagent,南京诺唯赞生物科技股份有限公司;RNase-free ddH2O,康润生物有限公司;SDS-PAGE凝胶制备试剂盒、BCA蛋白定量试剂盒,康为世纪生物科技股份有限公司,Evo M-MLV反转录预混型试剂盒(含去除gDNA试剂,用于qPCR)、SYBR Green Pro Taq HS预混型qPCR试剂盒,湖南艾科瑞生物工程有限公司;PMSF和磷酸酶抑制剂混合物,碧云天生物技术有限公司;牛血清白蛋白,Sigma公司;PVDF膜,Millipore公司;ECL显影液和抗体稀释液,苏州新赛美生物科技有限公司;双色预染蛋白Marker(10~250 kDa),上海雅酶生物科技有限公司;SDS、溴酚蓝、β-巯基乙醇、Tris-base,北京索莱宝科技有限公司;PI3K抗体(1∶1 000,4249S)、Akt抗体(1∶1 000,4691S)、p-Akt(Ser473)抗体(1∶1 000,4060S)、FoxO1抗体(1∶1 000,9454S)、p-FoxO1(Ser256)抗体(1∶1 000,9461S)、FoxO3抗体(1∶1 000,2497S)、p-FoxO3(Ser253)抗体(1∶1 000,9466S),美国Cell Signaling Technology公司;β-Actin抗体(1∶1 000,ab8226)、羊抗兔IgG(1∶5 000,ab6721)、兔抗鼠IgG(1∶5 000,ab6728),英国Abcam公司。
1.2 仪器与设备
JXFSTPRP-Ⅱ冷冻研磨机,上海净信公司;5840R高速冷冻离心机,德国Eppendorf生物公司;3111 CO2培养箱,美国Thermo公司;P330核酸蛋白测定仪,德国Implen公司;BioTek Epoch2酶标仪,美国BioTek公司;CFX 96实时荧光定量PCR仪、ChemiDoc MP凝胶成像仪、T100 PCR仪、1658029电泳仪,美国Bio-Rad公司。
1.3 实验方法
1.3.1 肉牛样品的采集
进行120 d的饲养试验后,所有的牛都按标准的商业程序在商业屠宰场屠宰。屠宰45 min后,从左侧的背最长肌、腰大肌取20 g左右的肉样,液氮冷冻,保存于-80 ℃超低温冰箱中,用于测定mRNA和蛋白的表达量。
1.3.2 细胞培养
将细胞培养于10%(体积分数)FBS和1%(体积分数)双抗的MEM培养基中,置于37 ℃、5%(体积分数)CO2的细胞培养箱中培养,待细胞汇合度达到70%左右时开始传代,进行后续实验。
1.3.3 牛肌管细胞的处理
参照ZHANG等[9]的方法,当细胞汇合度达到70%左右时,按照1×104个/孔布板,用完全培养基培养并将孔板置于37 ℃、5%(体积分数)CO2培养箱中培养,待细胞完全贴壁后,弃掉原来的培养基,用PBS清洗后更换含马血清的分化培养基诱导分化。诱导分化2 d后添加PI3K抑制剂渥曼青霉素(wortmannin)(1 μmol/L)处理细胞24 h后,更换含或者不含白藜芦醇(10 μmol/L)的分化培养基,分化4 d后收集细胞样品用于测定相关指标(n=6)。
1.3.4 基因表达量的测定
1.3.4.1 总RNA的提取和测定
总RNA的提取按照RNA-easy Isolation Reagent说明进行提取,使用核酸蛋白分析仪检测RNA浓度和纯度,所有样品的OD260nm值/OD280nm值都为1.8~2.0。
1.3.4.2 反转录
将提取的总RNA按照Evo M-MLV反转录预混型试剂盒说明进行反转录。首先进行去除基因组DNA反应,反应体系为10 μL:5×g DNA Clean Reaction Mix 2 μL、总RNA 1 μg和无酶无菌水补至10 μL。反应条件为42 ℃ 2 min。去除基因组DNA后,进行反转录反应,反应体系为20 μL:第一步反应液10 μL、5×Evo M-MLV RT Reaction Mix 4 μL和无酶无菌水6 μL。反应条件为37 ℃ 15 min,85 ℃ 5 s。合成的cDNA放置于-20 ℃冰箱保存,用于后续的荧光定量实验。
1.3.4.3 引物序列来源及合成
所有基因引物序列利用NCBI网站和Primer premier 5.0软件设计,由湖南艾科瑞生物工程有限公司合成,引物序列及扩增片段长度见表1。
表1 引物序列
Table 1 Primer sequence list

基因名称引物序列产物大小/bpMyHCIF:ATCGCTGAATCCCAGGTCAA92R:ACCAAGATGTGGCACGGCTAMyHCⅡaF:CACCCTGGAGCAGACAGAGA148R:TCCCTGGATTTGCGTGATGMyHCⅡxF:AGGGCATCGCTGGAACAGAC84R:CAGAAGCTGCACACGCTCACMyHCⅡbF:TTTCCAGACCGTGTCTGCTC96R:GGGATGATGCAGCGTACAAAGPI3KαF:CGGTGAGACTGTGTGGGACTTATC115R:CTGATGGAGTGTGTGGCTGTTPI3KβF:TTGGTGAGGATTCAGTTGGAGTG142R:AAGCAGCCGTAAGGTAGCATCAkt1F:CTCTCTGGGCTACTCAAGAAGGA101R:CACACGATGCTGGCGAAGAATAkt2F:ATACCTTCGTCATTCGCTGTCTG88R:ATCCACTCTTCCCTCTCGTCTGFoxO1F:CTCCCACAGCAATGACGACT100R:CGTCATGATGGGAGAGAGCCFoxO3F:GCAGACCATCCAAGAGAACAAG97R:GCTGAGTGAGTCCGATGTGAGGAPDHF:GATGGTGAAGGTCGGAGTGAAC100R:GTCATTGATGGCGACGATGT
1.3.4.4 实时荧光定量PCR
本实验是采用SYBR Green I嵌合荧光法,以1.3.4.2合成的cDNA为模板,按照SYBR® Green Premix Pro Taq HS qPCR Kit荧光定量试剂盒说明进行荧光定量反应。反应体系为20 μL:2×SYBR® Green Pro Taq HS Premix 10 μL,cDNA模板2 μL,上下游引物各0.4 μL,ddH2O 7.2 μL。反应程序为:95 ℃预变性30 s;95 ℃变性5 s,60 ℃退火30 s,40个循环;65 ℃ 5 s,95 ℃ 0.5C。每个基因设置3个平行,内参基因为甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH),目的基因的相对表达量用2-ΔΔCt进行处理和分析,其中ΔCt=Ct目的基因-Ct内参基因,ΔΔCt=DCt处理组-ΔCt对照组。
1.3.5 蛋白表达量的测定
1.3.5.1 蛋白提取和蛋白定量
取0.5 g肉样,加入5 mL冰冷提取液、苯甲基磺酰氟和磷酸酶抑制剂,研磨仪45 s研磨3次。4 ℃条件下10 000×g离心15 min,离心后的上清液为所提蛋白。取上清液并使用BCA蛋白定量试剂盒测定蛋白浓度。用磷酸盐缓冲液将蛋白质质量浓度调整为10 mg/mL,向所有样品添加等蛋白上样缓冲溶液:100 mmol/L Tris-base,4%(质量分数)SDS,20%(体积分数)甘油,5 mmol/L EDTA,1%(质量分数)溴酚蓝和β-巯基乙醇,95 ℃变性5 min,最终样品蛋白质量浓度为5 mg/mL。
1.3.5.2 Western blot
根据目的蛋白分子质量的大小选择最佳分离范围浓度的分离胶,依次将Marker和蛋白样品打入浓缩胶梳子孔中进行电泳,上样量为5 μL。转印至PVDF膜,室温下用含5%(体积分数)脱脂奶粉的1×TBST缓冲液封闭2 h,其中磷酸化蛋白用含5%(体积分数)牛血清白蛋白的1×TBST缓冲液进行封闭,1×TBST缓冲液洗涤3次,4 ℃一抗孵育过夜。1×TBST缓冲液洗涤3次,室温二抗孵育2 h,1×TBST缓冲液洗涤3次,每张膜滴加700 μL显影液反应2 min,利用凝胶成像仪进行成像,Image Lab导出蛋白条带,Image J量化蛋白表达,并将目标蛋白的相对表达水平标准化为β-肌动蛋白(β-Actin)。
1.4 数据统计分析
利用SPSS 26.0数据分析软件进行统计分析,2组间采用独立样本t检验进行差异显著性分析,多组间采用单因素方差分析(one-way analysis of variance,ANOVA)和最小显著性差异法(least significant difference,LSD)进行多重比较,P<0.05表示差异显著,结果以平均数±标准差表示。采用Origin 2022软件作图。
2 结果与分析
2.1 日粮添加白藜芦醇对肉牛肌纤维类型基因表达的影响
为研究白藜芦醇对肉牛肌纤维类型的影响,采用实时荧光定量PCR检测牛背最长肌和腰大肌肌纤维类型相关基因的表达。结果显示,日粮添加白藜芦醇显著促进牛背最长肌和腰大肌MyHCI的mRNA表达,降低了MyHCⅡa、MyHCⅡx和MyHCⅡb的mRNA表达,表明白藜芦醇促进了肉牛Ⅱ型肌纤维向Ⅰ型肌纤维的转化(表2)。本实验室前期研究发现,日粮添加白藜芦醇提高了牛肉的嫩度,降低了剪切力[12],改善了肉色与保水性[13]。王勇峰等[14]对新疆褐牛不同部位牛肉肌纤维类型及品质进行研究发现,Ⅰ型肌纤维比例越高,Ⅱb型肌纤维所占比例越低,嫩度也就越好。LU等[15]研究中国秦川黄牛和鲁西黄牛肌纤维与肉质的关系时发现,增加I型肌纤维数量可以改善秦川牛和鲁西牛的嫩度。以上研究表明,增加I型肌纤维类型可以提高肉的嫩度,而本研究从肌纤维类型表达角度解释了日粮中添加白藜芦醇对牛肉品质的改善作用。饲粮中添加300和600 mg/kg的白藜芦醇均可以促进猪糖酵解肌纤维向氧化肌纤维的转化[6],母猪饲粮中添加300 mg/kg的白藜芦醇可提高背最长肌MyHCⅠmRNA和蛋白表达量,降低MyHCⅡb mRNA和蛋白表达量[7],饲粮中添加150和300 mg/kg白藜芦醇促进了断奶仔猪Ⅱ型肌纤维向Ⅰ型肌纤维的转化,从而改善猪肉品质[8]。白藜芦醇处理牛肌管细胞促进了氧化型肌纤维的表达[9],本研究结果与以上研究一致。
表2 日粮添加白藜芦醇对肉牛肌肉肌球蛋白重链(MyHC)mRNA相对表达水平的影响
Table 2 Effects of dietary resveratrol supplementation on the relative expression levels of myosin heavy chain (MyHC) mRNA in beef cattle muscle

注:同一行上标不同字母表示差异显著(P<0.05)。
基因部位对照组白藜芦醇组MyHCI背最长肌1.02±0.11b1.71±0.07a腰大肌 1.04±0.19b2.23±0.16aMyHCⅡa背最长肌1.00±0.05a0.67±0.10b腰大肌 1.00±0.05a0.61±0.05bMyHCⅡx背最长肌1.03±0.13a0.46±0.08b腰大肌 1.03±0.14a0.53±0.09bMyHCⅡb背最长肌1.01±0.08a0.63±0.05b腰大肌 1.00±0.32a0.36±0.09a
2.2 日粮添加白藜芦醇对Akt/FoxO信号通路基因表达的影响
Akt是一种丝氨酸/苏氨酸蛋白激酶,它的磷酸化可促进Ⅰ型纤维的形成,并在氧化型肌纤维中表达较高[16]。FoxO蛋白通过转录调节功能激活或抑制下游靶标,控制一系列细胞行为,包括细胞凋亡、细胞周期、细胞分化、细胞增殖、能量代谢和自噬等。在哺乳动物中,FoxO家族的转录因子由4个成员组成:FoxO1、FoxO3、FoxO4和FoxO6。FoxO家族成员中,FoxO1和FoxO3受到广大关注。FoxO1是PI3K/Akt信号通路的下游转录因子之一,并受其通路负调控,被认为是Ⅰ型肌纤维的负调节因子[17]。在对小鼠和斑马鱼骨骼肌的研究中发现,FoxO3与肌纤维类型组成也存在一定的联系[18-19]。
为研究白藜芦醇是否通过激活Akt/FoxO信号通路促进肉牛肌纤维类型转化,采用实时荧光定量PCR对Akt/FoxO通路相关基因进行检测。如图1所示,日粮中添加白藜芦醇的牛背最长肌PI3Kβ和Akt1 mRNA表达量显著上升(P<0.05),FoxO3表达量显著降低(P<0.05)。图2结果显示,日粮添加白藜芦醇显著提高了牛腰大肌PI3Kβ、Akt1和Akt2的mRNA表达量(P<0.05),显著降低了FoxO1和FoxO3的mRNA表达量(P<0.05)。以上结果表明白藜芦醇可能激活了Akt/FoxO信号通路。
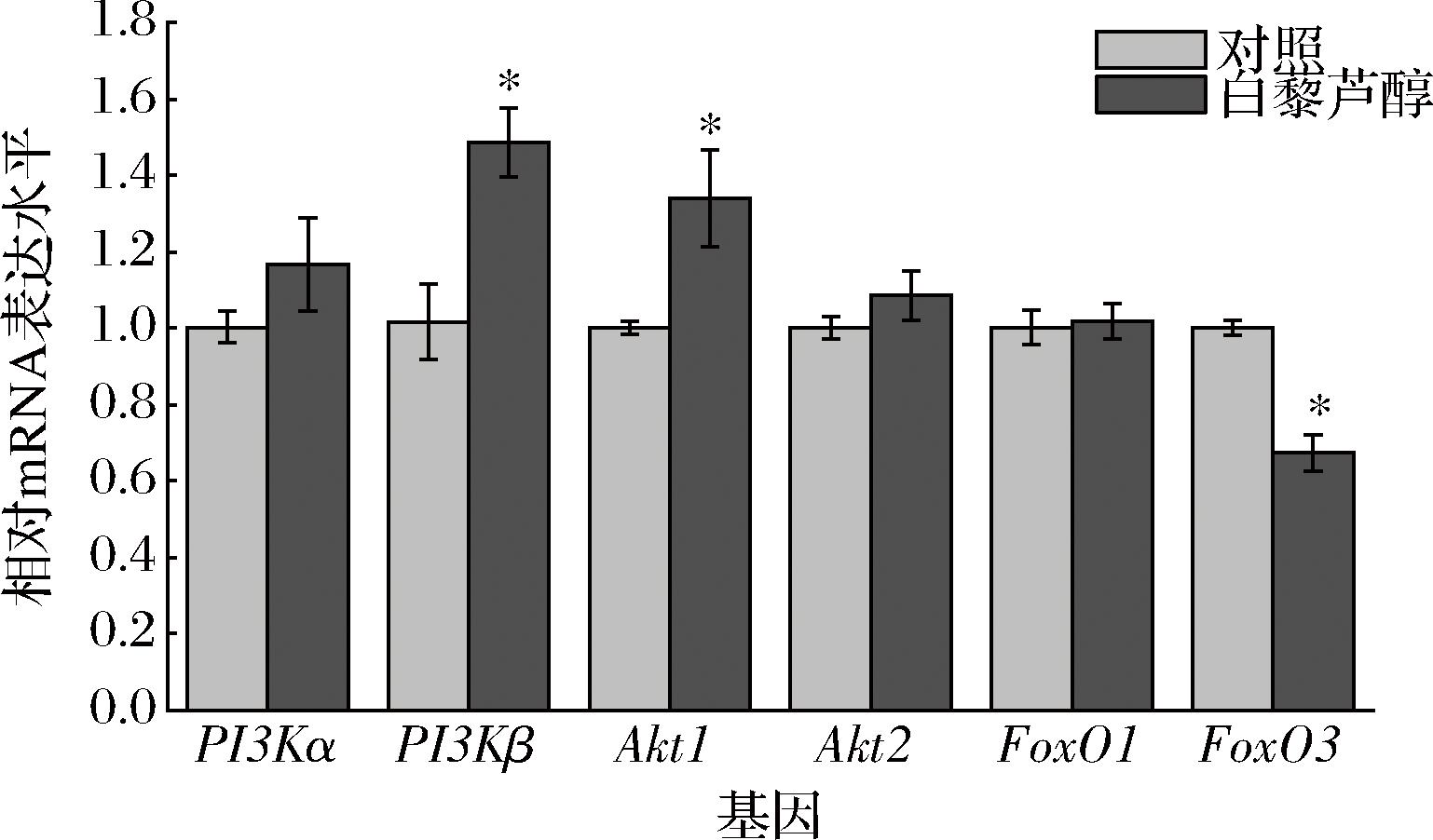
图1 日粮添加白藜芦醇对肉牛背最长肌Akt/FoxO信号通路基因相对表达水平的影响
Fig.1 Effects of dietary resveratrol supplementation on the relative expression levels of Akt/FoxO signaling pathway genes in Longissimus dorsi muscle of beef cattle
注:*表示差异显著(P<0.05)(下同)。
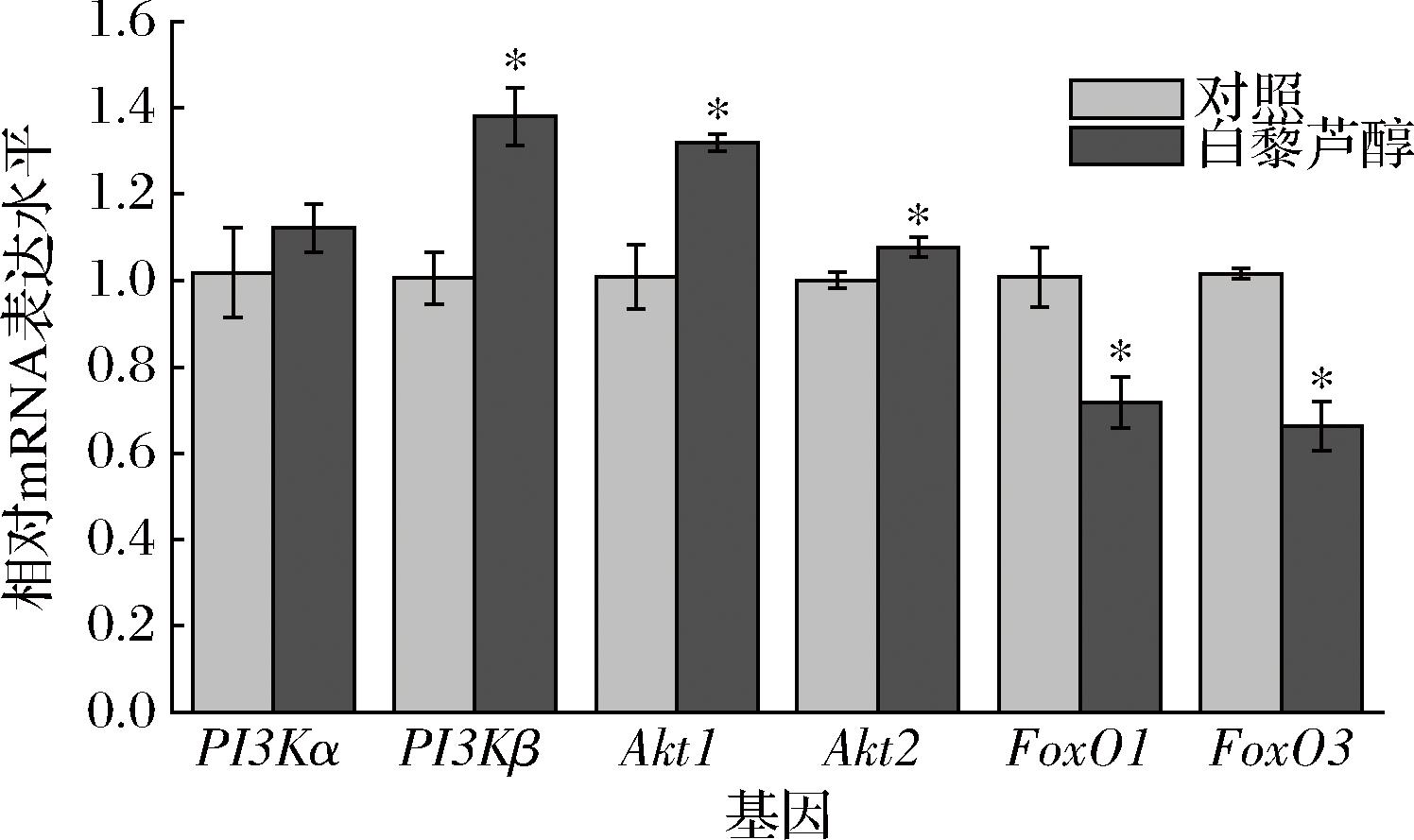
图2 日粮添加白藜芦醇对肉牛腰大肌Akt/FoxO信号通路基因相对表达水平的影响
Fig.2 Effects of dietary resveratrol supplementation on therelative expression levels of Akt/FoxO signaling pathway genes in Psoas major muscle of beef cattle
有研究表明,白藜芦醇激活了小鼠成骨细胞的Akt活力[20],而Akt可以磷酸化FoxO1进而影响其转录活性[21],同时有研究发现白藜芦醇抑制小鼠C2C12细胞FoxO1和小鼠肺组织FoxO3的表达[22-23],表明白藜芦醇可激活Akt/FoxO通路从而抑制FoxO表达,与本研究结果一致。在八眉猪、长白猪和此2种猪杂交猪肌肉组织中检测FoxO1基因的表达发现,FoxO1基因的表达与Ⅰ型肌纤维的含量成反比[24]。史新娥等[25]研究FoxO1在猪成肌细胞肌纤维类型转化的作用中发现,激活FoxO1后,MyHCⅡb和MyHCⅡx表达显著上调,MyHCⅠ和MyHCⅡa表达显著下调。KAMEI等[26]研究发现,过表达FoxO1降低了小鼠骨骼肌中Ⅰ型纤维相关基因的表达和Ⅰ型纤维的数量。有研究发现,有氧运动会显著上调Ⅱa型肌纤维及TNNC1b、TNNT1、NFATC1和MEF2等慢肌标记基因的表达,同时PI3K和Akt1 mRNA水平上升,FoxO3 mRNA水平下降[16],表明有氧运动引起的慢肌纤维表达增加可能是通过PI3K/Akt/FoxO3信号通路。本研究表明,肉牛日粮中添加白藜芦醇影响Akt/FoxO关键信号分子的mRNA表达,与上述研究结果相一致。
2.3 日粮添加白藜芦醇对Akt/FoxO信号通路蛋白表达的影响
FoxO蛋白的翻译后修饰会影响其活性,主要包括磷酸化、乙酰化、泛素化、甲基化和糖基化等,从而影响FoxO蛋白的活性和亚细胞定位[27]。磷酸化是FoxO蛋白最重要的翻译后修饰,可由多种蛋白激酶诱导,不同的酶调节FoxO蛋白上不同位置的磷酸化,以产生不同的生物效应,主要包括Akt、AMPK和SGK1等。FoxO依赖于磷酸化的核/胞质穿梭主要受Akt调控,Akt对FoxO的磷酸化导致FoxO在细胞质中被隔离,无法启动下游与肌纤维类型调控有关的靶基因,进而抑制靶基因的转录[28]。PI3K是Akt的上游调节因子,PI3K/Akt通路的激活会促进FoxO蛋白的磷酸化[17]。
有研究显示,与糖酵解型肌肉相比,p-Akt在氧化型肌肉中的表达水平更高[24]。一般来说,Akt的磷酸化和FoxO1的下调可以诱导肌纤维从快到慢的转变[11],在本研究中,白藜芦醇显著提高了牛背最长肌PI3K(P<0.05)、p-Akt/Akt(P<0.05)和p-FoxO1/FoxO1(P<0.05)的蛋白表达水平(图3),FoxO1的蛋白表达有被抑制的趋势(P>0.05)。日粮中添加白藜芦醇后,显著下调了牛腰大肌FoxO1、FoxO3的蛋白表达水平(P<0.05),显著上调了PI3K(P<0.05)、p-Akt/Akt(P<0.05)、p-FoxO1/FoxO1(P<0.05)和p-FoxO3/FoxO3(P<0.05)蛋白表达水平(图4)。表明白藜芦醇激活了PI3K/Akt通路,使得磷酸化的Akt蛋白及其上游因子PI3K蛋白表达增加,进一步磷酸化FoxO1蛋白,使得细胞核内的FoxO1减少[17],抑制了FoxO1蛋白的表达,从而快肌纤维表达减少和慢肌纤维表达增加。
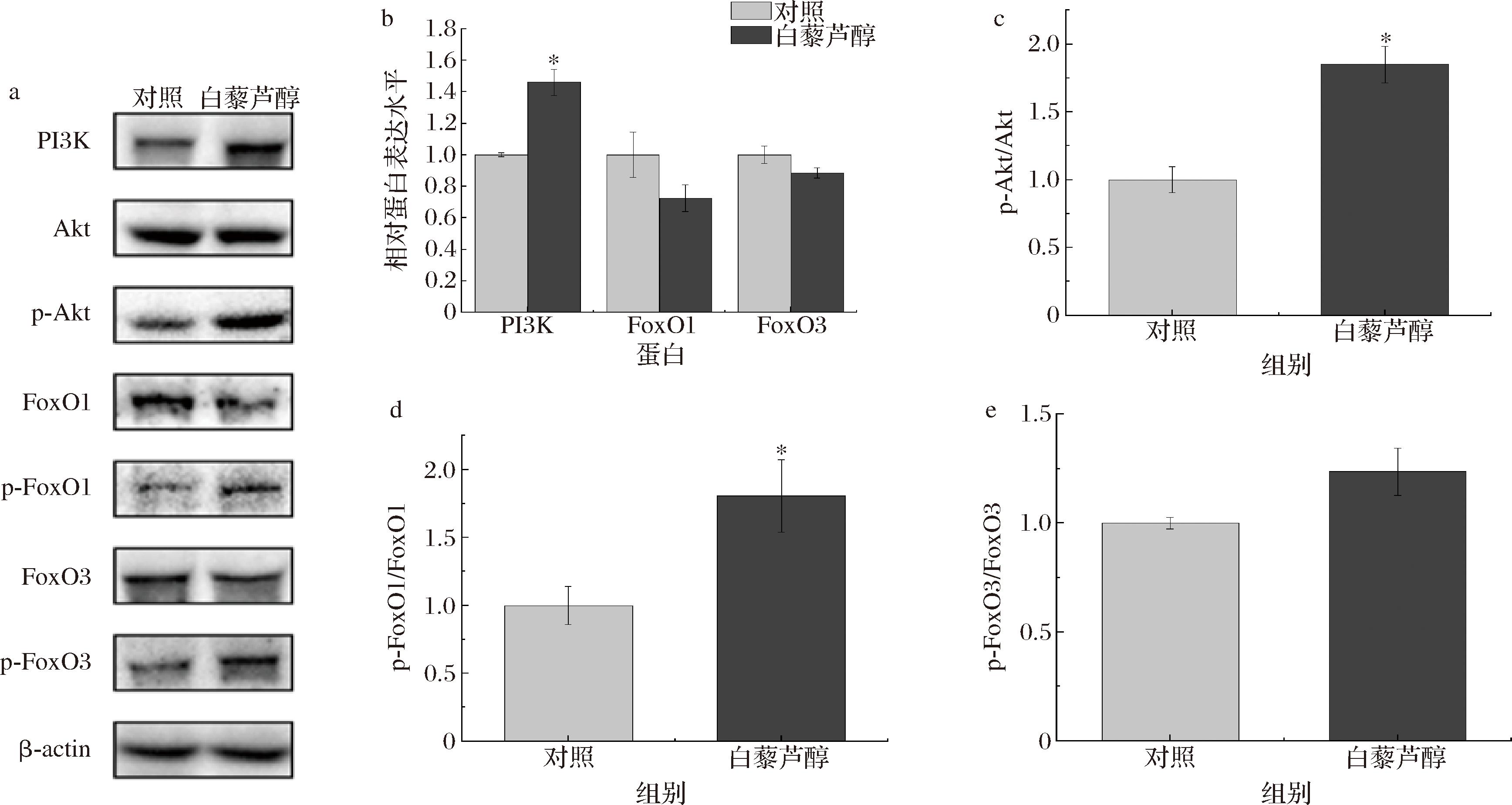
a-肉牛背最长肌Akt/FoxO信号通路蛋白表达免疫印迹图;b-肉牛背最长肌PI3K、FoxO1、FoxO3蛋白表达;c-肉牛背最长肌p-Akt/Akt表达;d-肉牛背最长肌p-FoxO1/FoxO1表达;e-肉牛背最长肌p-FoxO3/FoxO3表达
图3 日粮添加白藜芦醇对肉牛背最长肌Akt/FoxO信号通路调控蛋白表达水平的影响
Fig.3 Effects of dietary resveratrol supplementation on the expression level of Akt/FoxO signaling pathway proteins in Longissimus dorsi muscle of beef cattle

a-肉牛腰大肌Akt/FoxO信号通路蛋白表达免疫印迹图;b-肉牛腰大肌PI3K、FoxO1、FoxO3蛋白表达;c-肉牛腰大肌p-Akt/Akt表达;d-肉牛腰大肌p-FoxO1/FoxO1表达;e-肉牛腰大肌p-FoxO3/FoxO3表达
图4 日粮添加白藜芦醇对肉牛腰大肌Akt/FoxO信号通路蛋白表达水平的影响
Fig.4 Effects of dietary resveratrol supplementation on the expression levels of Akt/FoxO signaling pathway proteins in Psoas major muscle of beef cattle
FoxO3是肌萎缩中重要的调节因子,有研究表明,小鼠C2C12肌管被诱导肌萎缩后,FoxO3的总表达增加,磷酸化的FoxO3显著降低[29]。袁卫林[18]研究发现,小鼠肌肉萎缩模型中Ⅱa型肌纤维显著减少和Ⅱb型肌纤维显著增加,Akt、FoxO3a的磷酸化水平显著降低。烟熏暴露引起了趾长伸肌Ⅰ型肌纤维含量的下降,和Ⅱ型肌纤维含量的增加,且随着烟熏暴露时间的延长,大鼠趾长伸肌中p-Akt/Akt和p-FoxO3a/FoxO3a的相对蛋白表达量呈现总体下降的趋势[30]。在本研究中,肉牛日粮添加白藜芦醇背最长肌中Ⅱb型肌纤维基因的表达显著降低,FoxO3磷酸化水平有上升的趋势,腰大肌中FoxO3磷酸化水平显著升高(P<0.05),与上述研究中Ⅱb型肌纤维和FoxO3关系变化趋势保持一致。
2.4 渥曼青霉素对牛肌管细胞肌纤维类型基因和Akt/FoxO信号通路基因表达的影响
为进一步验证白藜芦醇通过Akt/FoxO通路促进肉牛肌纤维转化,本研究利用PI3K抑制剂渥曼青霉素处理牛肌管细胞,特异性阻断下游Akt/FoxO信号通路。渥曼青霉素对肌纤维类型表达的影响如图5所示,实时荧光定量PCR结果表明,渥曼青霉素显著削弱了白藜芦醇对MyHCⅠ和MyHCⅡa mRNA表达的促进作用(P<0.05),此外,渥曼青霉素显著削弱了白藜芦醇对MyHCⅡx和MyHCⅡb mRNA表达的抑制作用(P<0.05)。如图6所示,白藜芦醇明显促进PI3Kα、PI3Kβ、Akt1和Akt2基因的表达,抑制FoxO1、FoxO3基因的表达,而加入渥曼青霉素处理后可以明显抑制白藜芦醇的上述作用(P<0.05),表明白藜芦醇对Akt/FoxO通路的激活作用被渥曼青霉素减弱。WEN等[10]研究发现,C2C12肌管中加入渥曼青霉素可明显削弱番茄红素对小鼠骨骼肌快肌向慢肌的转化作用,ZHANG等[11]研究发现,渥曼青霉素处理猪肌管细胞削弱了亮氨酸对猪骨骼肌快肌向慢肌转化作用,与本研究结果类似。综上所述,白藜芦醇可通过Akt/FoxO信号通路促进牛肌纤维类型转化。
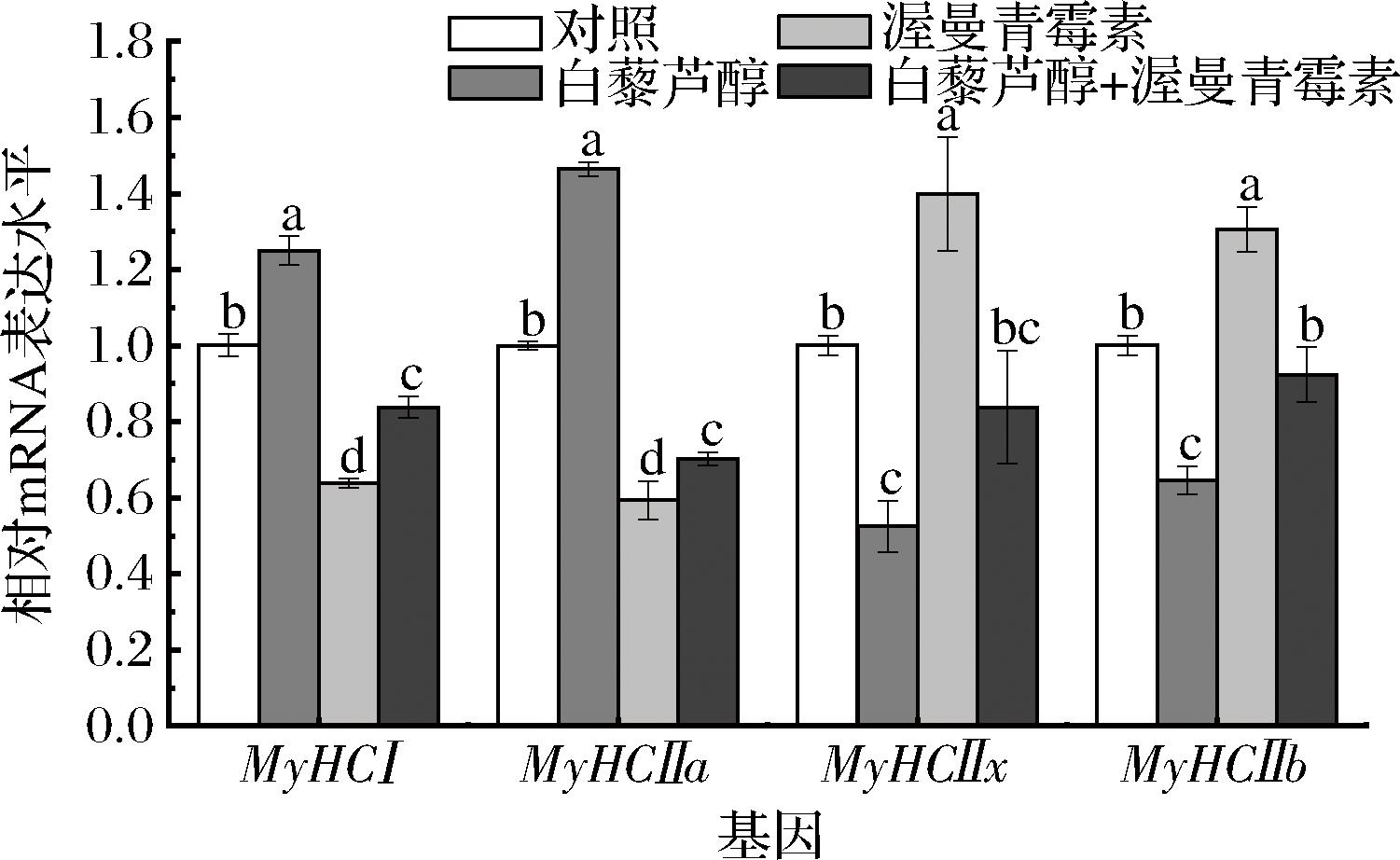
图5 渥曼青霉素对牛肌管细胞MyHC基因相对表达水平的影响
Fig.5 Effects of wortmannin on the relative expression levels of MyHC genes in bovine myotubes
注:不同字母表示差异显著(P<0.05)(下同)。

图6 渥曼青霉素对牛肌管细胞Akt/FoxO信号通路基因相对表达水平的影响
Fig.6 Effects of wortmannin on the relative expression levels of Akt/FoxO signaling pathway genes in bovine myotubes
注:不同小写字母表示差异显著(P<0.05)。
3 结论
肉牛日粮添加白藜芦醇促进了Ⅱ型肌纤维向Ⅰ型肌纤维的转化,白藜芦醇激活了背最长肌和腰大肌PI3K和Akt的mRNA和蛋白表达,提高了Akt、FoxO1和FoxO3蛋白磷酸化水平,降低了FoxO1和FoxO3的mRNA和蛋白表达。表明白藜芦醇激活了Akt/FoxO通路。向牛肌管细胞中添加渥曼青霉素阻断该通路,白藜芦醇对牛肌管细胞肌纤维类型的转化作用被削弱,同时渥曼青霉素使白藜芦醇诱导的PI3K、Akt、FoxO1和FoxO3 mRNA表达水平减弱。因此,白藜芦醇可通过Akt/FoxO通路影响牛肌纤维类型的转化。
[1] 陈来华, 李娟, 王亚辉.中国肉牛产业发展概况分析、存在问题及对策[J].中国食物与营养, 2022, 28(3):5-9.CHEN L H, LI J, WANG Y H.Existing problems analysis and strategy for the development of beef cattle industry in China[J].Food and Nutrition in China, 2022, 28(3):5-9.
[2] PETTE D, STARON R S.Myosin isoforms, muscle fiber types, and transitions[J].Microscopy Research and Technique, 2000, 50(6):500-509.
[3] CHEN X L, XIANG L, HUANG Z Q, et al.Effect of dietary leucine supplementation on skeletal muscle fiber type transformation in weaning piglets[J].Animal Biotechnology, 2022, 33(3):546-554.
[4] CHEN X L, ZHANG M, XUE Y H, et al.Effect of dietary L-theanine supplementation on skeletal muscle fiber type transformation in vivo[J].The Journal of Nutritional Biochemistry, 2022, 99:108859.
[5] WEN W X, CHEN X L, HUANG Z Q, et al.Dietary lycopene supplementation improves meat quality, antioxidant capacity and skeletal muscle fiber type transformation in finishing pigs[J].Animal Nutrition, 2022, 8:256-264.
[6] ZHANG C, LUO J Q, YU B, et al.Dietary resveratrol supplementation improves meat quality of finishing pigs through changing muscle fiber characteristics and antioxidative status[J].Meat Science, 2015, 102:15-21.
[7] MENG Q W, SUN S S, BAI Y S, et al.Effects of dietary resveratrol supplementation in sows on antioxidative status, myofiber characteristic and meat quality of offspring[J].Meat Science, 2020, 167:108176.
[8] ZENG Z Y, CHEN X L, HUANG Z Q, et al.Effects of dietary resveratrol supplementation on growth performance and muscle fiber type transformation in weaned piglets[J].Animal Feed Science and Technology, 2020, 265:114499.
[9] ZHANG J Y, LI J Q, LIU Y G, et al.Effect of resveratrol on skeletal slow-twitch muscle fiber expression via AMPK/PGC-1α signaling pathway in bovine myotubes[J].Meat Science, 2023, 204:109287. [10] WEN W X, CHEN X L, HUANG Z Q, et al.Lycopene promotes a fast-to-slow fiber type transformation through Akt/FoxO1 signaling pathway and miR-22-3p[J].Journal of Functional Foods, 2021, 80:104430.
[11] ZHANG S R, CHEN X L, HUANG Z Q, et al.Leucine promotes porcine myofibre type transformation from fast-twitch to slow-twitch through the protein kinase B (Akt)/forkhead box 1 signalling pathway and microRNA-27a[J].British Journal of Nutrition, 2019, 121(1):1-8.
[12] LI J Q, LIANG R R, MAO Y W, et al.Effect of dietary resveratrol supplementation on muscle fiber types and meat quality in beef cattle[J].Meat Science, 2022, 194:108986.
[13] 崔莹. 肉牛日粮中添加白藜芦醇对高氧气调包装牛肉抗氧化性能及食用品质影响的研究[D]. 泰安: 山东农业大学, 2023.CUI Y. Study on the effect of adding resveratrol to beef cattle diet on antioxidant performance and edible quality of high oxygen modified packaging beef[D]. Taian: Shandong Agricultural University, 2023.
[14] 王勇峰, 丰永红, 万红兵, 等.新疆褐牛不同部位牛肉肌纤维类型及品质差异研究[J].食品工业科技, 2018, 39(6):19-24;37.WANG Y F, FENG Y H, WAN H B, et al.Study on the difference of muscle fiber types and quality in different parts of Xinjiang brown cattle[J].Science and Technology of Food Industry, 2018, 39(6):19-24;37.
[15] LU X, YANG Y Y, ZHANG Y M, et al.The relationship between myofiber characteristics and meat quality of Chinese Qinchuan and Luxi cattle[J].Animal Bioscience, 2021, 34(4):743-750.
[16] TURINSKY J, DAMRAU-ABNEY A.Akt kinases and 2-deoxyglucose uptake in rat skeletal muscles in vivo:Study with insulin and exercise[J].The American Journal of Physiology, 1999, 276(1):R277-R282.
[17] LI X X, LIU H H, WANG H H, et al.Follistatin could promote the proliferation of duck primary myoblasts by activating PI3K/Akt/mTOR signalling[J].Bioscience Reports, 2014, 34(5):e00143.
[18] 袁卫林. 设计并递送工程化环状RNA circmiR-29b用于防治多种因素诱导的肌肉萎缩[D].上海:上海大学, 2022.YUAN W L.Design and delivery of engineered circular RNA circmiR-29b for the treatment of muscle atrophy induced by multiple factors[D].Shanghai:Shanghai University, 2022.
[19] 戴毅臻. 有氧运动对成年雄性斑马鱼骨骼肌的影响及作用机制研究[D].长沙:湖南师范大学, 2021.DAI Y Z.Effect of aerobic exercise on skeletal muscle of adult male zebrafish and its mechanism[D].Changsha:Hunan Normal University, 2021.
[20] XUAN Y, WANG J, ZHANG X H, et al.Resveratrol attenuates high glucose-induced osteoblast dysfunction via AKT/GSK3β/FYN-mediated NRF2 activation[J].Frontiers in Pharmacology, 2022, 13:862618.
[21] RUSSELL S J, SCHNEIDER M F.Alternative signaling pathways from IGF1 or insulin to AKT activation and FOXO1 nuclear efflux in adult skeletal muscle fibers[J].Journal of Biological Chemistry, 2020, 295(45):15292-15306.
[22] WANG D T, YIN Y, YANG Y J, et al.Resveratrol prevents TNF-α-induced muscle atrophy via regulation of Akt/mTOR/FoxO1 signaling in C2C12 myotubes[J].International Immunopharmacology, 2014, 19(2):206-213.
[23] SINGH N, NAGAR E, GAUTAM A, et al.Resveratrol mitigates miR-212-3p mediated progression of diesel exhaust-induced pulmonary fibrosis by regulating SIRT1/FoxO3[J].Science of The Total Environment, 2023, 902:166063.
[24] 杨燕军, 庞卫军, 白亮, 等.八眉猪、长白猪及长×八杂交猪肌肉组织中FoxO1基因的表达[J].遗传, 2008,30(2):185-189.YANG Y J, PANG W J, BAI L, et al.Expression of FoxO1 mRNA in muscle tissue of Bamei, Landrace and Landrace×Bamei[J].Hereditas, 2008,30(2):185-189.
[25] 史新娥, 庞卫军, 张辉, 等.FoxO1在猪成肌细胞增殖分化及肌纤维类型转化中的作用及机理研究[C].第四届中国畜牧科技论坛论文集.重庆:中国农业出版社, 2009:5.SHI X E, PANG W J, ZHANG H, et al.Study on the role of FoxO1 on myoblast proliferation and differentiation and the transformation of muscle fiber type in porcine[C].Proceedings of the 4th China Animal Husbandry Science and Technology Forum.Chongqing:China Agriculture Press, 2009:5.
[26] KAMEI Y, MIURA S, SUZUKI M, et al.Skeletal muscle FOXO1 (FKHR) transgenic mice have less skeletal muscle mass, down-regulated type I (slow twitch/red muscle) fiber genes, and impaired glycemic control[J].Journal of Biological Chemistry, 2004, 279(39):41114-41123.
[27] WANG Z Y, YU T H, HUANG P.Post-translational modifications of FOXO family proteins (Review)[J].Molecular Medicine Reports, 2016, 14(6):4931-4941.
[28] XU M, CHEN X L, CHEN D W, et al.FoxO1:A novel insight into its molecular mechanisms in the regulation of skeletal muscle differentiation and fiber type specification[J].Oncotarget, 2017, 8(6):10662-10674.
[29] ULLA A, UCHIDA T, MIKI Y, et al.Morin attenuates dexamethasone-mediated oxidative stress and atrophy in mouse C2C12 skeletal myotubes[J].Archives of Biochemistry and Biophysics, 2021, 704:108873.
[30] 章雨微. 不同烟熏暴露强度对大鼠膈肌和骨骼肌萎缩以及纤维类型转变的影响及机制研究[D].上海:上海交通大学, 2019.ZHANG Y W.Effects and mechanism investigation of cigarette smoke exposure of various intensity ranks on muscle atrophy cand fiber type shift in rat diaphragm and skeletal muscles[D].Shanghai:Shanghai Jiao Tong University, 2019.