蜂蜜是蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,经充分酿造而成的天然甜物质[1]。蜂蜜中富含果糖、葡萄糖(约占75%),还含有氨基酸、维生素、矿物质、酶类和酚类化合物等多种营养物质[2]。在各种化学成分协同作用下,蜂蜜具有抑菌、抗氧化、调节胃肠道、提高免疫力、抗炎等功效[3]。蜂蜜作为一种口味独特,营养保健价值均较高的天然健康食品,一直深受国内外消费者青睐。
蜂蜜中大约含有0.1%~0.5%蛋白质,蛋白质作为除水分和糖外的第三大组分,是蜂蜜中重要的生物活性组分[4]。AFROZ等[5]报道蜂蜜中蛋白质具有多种生物功能,如转化酶能延缓衰老、促进消化吸收,葡萄糖氧化酶可以抑制病菌生长、促进伤口愈合。蜂蜜成分复杂,因此鉴别蜂蜜中蛋白质组成是一项有挑战性的工作。在众多研究手段中,凝胶蛋白组学(gel-baesd proteomics)和非凝胶蛋白组学(gel-free proteomics)是目前蜂蜜蛋白质领域研究较为常用的2种技术,前者先将蜂蜜蛋白采用一维、二维凝胶电泳技术进行分离,再通过质谱设备对目标蛋白条带或点进行定性和定量研究;后者则直接将蛋白质酶解成肽段混合物,经色谱分离后再利用质谱设备对蜂蜜全蛋白质组进行分析,2种技术在研究蜂蜜蛋白质组成时具有一定互补性[6-8]。GIROLAMO等[6]利用SDS-PAGE结合线性离子肼质谱分析栗子、洋槐、向日葵、桉树和橙子蜂蜜蛋白质,从主要电泳条带中鉴定到蜂王浆主蛋白1~5、防御素-1、α-葡萄糖苷酶和甘油醛-3-磷酸脱氢酶8种蛋白,对蜂蜜蛋白质组成较前人研究有了进一步认识。ERBAN等[7]采用静电场轨道肼-线性离子肼质谱从西班牙向日葵、苹果、金合欢等13种蜂蜜中鉴定到71个蜂源蛋白,其中防御素-1、葡萄糖脱氢酶亚型、丝氨酸蛋白酶等具有抗菌作用,扩展了对蜂蜜抗菌特性的认知。BONG等[8]则通过四极杆飞行时间质谱分析了新西兰麦卢卡蜂蜜蛋白质,鉴定到17个植物源和50个蜂源蛋白,其中来自于GDSL酯酶/脂酶、干旱相关蛋白和1个未表征蛋白的12条肽段可作为鉴别麦卢卡蜂蜜真伪的潜在标志物。蛋白质是一种相对稳定存在于蜂蜜中的内源大分子物质,研究蜂蜜蛋白对进一步完善蜂蜜成分认识,深度探究蜂蜜生理活性,寻找可靠特征标志成分,鉴别蜂蜜真伪具有重要作用。
枣花蜜是中国四大名蜜之一,呈琥珀色,味道甘甜,口感浓郁,具有独特的中性pH,且富含没食子酸、原儿茶酸、香草酸等酚类物质,抗菌抗氧化效果显著,是深受消费者欢迎的一种大宗特色单花种蜂蜜。然而针对枣花蜜蛋白质组成的研究却鲜有报道,我们前期联合SDS-PAGE及四级杆-轨道肼质谱发现19 kDa附近蛋白电泳条带可作为枣花蜜潜在的特征标志物,但对枣花蜜中蛋白质的整体研究较少[9-10]。
本文以中国特色枣花蜜为研究对象,基于凝胶和非凝胶蛋白质组学技术全面分析枣花蜜的蛋白质组成,比较2种组学技术对枣花蜜中蜂源和植物源蛋白质鉴定的影响和差异,并通过GO功能注释分析枣花蜜蛋白质承担的主要功能和作用。研究将为探究枣花蜜蛋白质生物活性成分和筛寻枣花蜜特征蛋白质标志物奠定理论依据。
1 材料与方法
1.1 材料与试剂
9种枣花蜜均为采用意大利蜜蜂(Apis mellifera ligustica)于枣树盛花期采集枣花花蜜并经酿造成熟的蜂蜜样品。具体分别采自陕西佳县(2022年)、陕西清涧(2022年)、陕西佳县(2020年)、陕西大荔(2020年)、陕西吴堡(2019年)、新疆吐鲁番(2019年)、河南洛阳(2019年)、山西临县(2019年)、山东曲阜(2019年)。所有蜂蜜从蜂场采集,运至实验室后于4 ℃保存待用。
低分子质量蛋白质Marker(14.4~97.4 kDa),北京索莱宝科技有限公司;考马斯亮蓝G-250和R-250、丙烯酰胺、N,N-亚甲叉双丙烯酰胺、十二烷基硫酸钠、三羟甲基甲烷、甘氨酸、三氯乙酸(trichloroacetic acid,TCA)、NH4HCO3,西安科昊生物工程有限公司;TCEP缓冲液,美国Simga Aldrich公司;8 mol/L尿素裂解液、二硫苏糖醇(dithiothreitol,DTT)、碘乙酰胺(iodoacetamide,IAM)、胰蛋白酶(质谱测序级),美国Promega公司;乙腈(色谱级)、甲酸(色谱级),美国Thermo Fisher Scientific公司;C18固相萃取柱(3 mL,500 mg),美国Supelco公司。
1.2 仪器与设备
HH-S4电热恒温水浴锅,北京科伟永兴仪器有限公司;TGL-16G高速冷冻离心机,上海安亭科学仪器厂;722G可见分光光度计,上海仪电分析仪器有限公司;DYCZ-24双垂直蛋白电泳仪,北京六一仪器厂;CV100-DNA真空离心浓缩仪,北京吉艾母科技有限公司;FD-1冷冻干燥机,西安予辉仪器有限公司;RIGOL L-3000高效液相色谱系统,北京普源精电科技有限公司;tims TOF HT质谱仪,德国Bruker公司;Orbitrap Fusion Lumos Hybrid质谱仪,美国Thermo Fisher Scientific公司。
1.3 实验方法
1.3.1 枣花蜜蛋白质含量测定
参考周娟[11]方法,采用考马斯亮蓝法测定枣花蜜蛋白质含量。
1.3.2 枣花蜜蛋白质SDS-PAGE分析
参考CHEVALLET等[12]方法对枣花蜜蛋白质进行SDS-PAGE分析。
1.3.3 枣花蜜的凝胶蛋白质组学分析
对于枣花蜜SDS-PAGE考染条带,切取40~120 kDa 和19 kDa处高丰度蛋白条带为馏分1,其余部分条带为馏分2,分别进行酶切、上机。将条带切成1 mm×1 mm×1 mm小块,加脱色液(含50%乙腈的NH4HCO3溶液)脱至无色;弃脱色液,加入乙腈脱水后真空干燥;向干燥胶块加入适量DTT和IAM进行处理,胰蛋白酶(40 mmol/L NH4HCO3溶液溶解)浸没胶条,37 ℃下恒温16 h,加入50 μL萃取液(含5%TCA的67%乙腈溶液),重复萃取1次,合并萃取液,用C18SPE柱除盐后冷冻干燥。
将枣花蜜肽段混合物溶于10 μL 0.1%甲酸水溶液,4 ℃下14 000 r/min离心20 min,取上清液400 ng样品上机分析。采用nano-HPLC tims TOF HT MS进行分析。样本检测条件如下:色谱柱:EASY-Spray column C18反相分析柱(15 cm×75 μm,3 μm,100 Å);柱温60 ℃;流动相:A相:0.1%甲酸水溶液,B相:0.1%甲酸-80%乙腈溶液,梯度洗脱程序:0~17 min,3.5%~32% B;17~18 min,32%~95% B;18~19 min,95%~100% B;流速300 nL/min。质谱分析扫描采用Captive Spray离子源,正离子模式,DDA模式采集数据,扫描范围m/z 100~1 700,一级质谱分辨率60 000(1 222 m/z),TIMS隧道累积时间100 ms,毛细管电压1.6 kV,迁移率0.6~1.6 cm2/V,总循环时间1.1 s,进行10个PASEF循环,生成质谱检测原始数据(RAW文件)。
使用FragPipe软件对RAW文件进行搜库。数据库来源于Uniprot网站,分别为蜜蜂库(2023年11月6日下载,https://www.uniprot.org/taxonomy/7459,41 200条序列)和枣树库(2023年11月6日下载,https://www.uniprot.org/taxonomy/326968,58 980条序列)。具体搜库参数:最大母离子质量偏差15 ppm;最大子离子质量偏差0.02 Da;可变修饰为N端乙酰化(N-acetyl)、甲硫氨酸残基化[oxidation(M)];固定化修饰为半胱氨酸氨基甲酰化[carbamidomethyl(C)];胰蛋白酶;最大裂解丢失为2。
1.3.4 枣花蜜的非凝胶蛋白质组学分析
称取适量枣花蜜样品,溶于等体积TCEP缓冲液(10 mmol/L,pH=8.0)中裂解,超声60 s(3 s on、3 s off)。在99 ℃下加热5 min后恢复室温,14 000 r/min下离心10 min,收集上清液,加入适量DTT和IAM进行处理,用胰蛋白酶(40 mmol/L NH4HCO3溶液溶解)酶切,37 ℃下恒温16 h。向肽段混合物中加入10 μL 10%甲酸终止酶解,12 000 r/min离心5 min,收集上清液,C18SPE柱除盐后冷冻干燥得到肽段混合物。
用0.1%甲酸水溶液溶解肽段混合物,4 ℃下14 000 r/min离心20 min,取上清液1 μg样品上机分析。采用HPLC Quadrupole-Orbitrap MS进行分析。样本检测条件如下:色谱柱:Dr Maisch GmbH ReproSil-Pur C18反相分析柱(30 cm×75 μm,1.9 μm,120 Å);柱温30 ℃;流动相:A相:0.1%甲酸水溶液,B相:0.1%甲酸-80%乙腈溶液,梯度洗脱程序:0~125 min,4%~15% B;125~140 min,15%~30% B;140~141 min,30%~50% B;141~150 min,50%~100% B;流速600 nL/min。质谱分析选取正离子模式,DDA模式采集数据,扫描范围m/z 300~1 400,喷雾电压2 000 V,毛细管温度320 ℃。MS1自动增益控制(automatic gain control,AGC)目标值为3×106,最大离子注入时间80 ms;MS2 AGC目标值5×104,最大离子注入时间20 ms。
使用Mascot软件进行搜库,数据库与搜库参数同1.3.3节。
1.3.5 生物信息学分析
使用Uniprot网站的BLAST工具(https://www.uniprot.org/blast)对枣花蜜植物源蛋白进行分析,筛选潜在的枣花蜜特征蛋白标志物。使用Gene Ontology数据库(https://www.geneontology.org/)对鉴定到的枣花蜜蛋白质进行GO功能注释分析,包括生物学过程(biology process,BP)、分子功能(molecular function,MF)以及细胞组分(cellular component,CC)三部分。
1.4 数据分析
使用SPSS 26.0软件对数据进行显著性分析,数据以“平均值±标准”偏差表示,且P<0.05表示差异显著。
2 结果与分析
2.1 不同来源枣花蜜蛋白质含量与SDS-PAGE分析
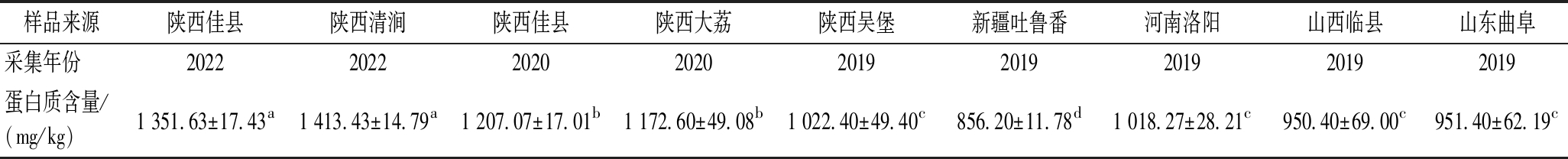
对不同来源枣花蜜蛋白质含量进行测定,结果如表1所示。9种枣花蜜的蛋白质含量在856.20~1 413.43 mg/kg,其中2022年陕西清涧枣花蜜蛋白质含量最高(1 413.43 mg/kg),而2019年新疆吐鲁番枣花蜜蛋白质含量最低(856.20 mg/kg),采集年份和地域差异会对枣花蜜中蛋白质含量造成一定影响。
表1 不同来源枣花蜜的蛋白质含量
Table 1 The protein content in different jujube honey samples
注:同一行具有不同上标字母数据之间代表存在显著差异(P<0.05)。
样品来源陕西佳县陕西清涧陕西佳县陕西大荔陕西吴堡新疆吐鲁番河南洛阳山西临县山东曲阜采集年份202220222020202020192019201920192019蛋白质含量/(mg/kg)1 351.63±17.43a1 413.43±14.79a1 207.07±17.01b1 172.60±49.08b1 022.40±49.40c856.20±11.78d1 018.27±28.21c950.40±69.00c951.40±62.19c
图1所示的是不同来源枣花蜜蛋白质SDS-PAGE分析,所有枣花蜜在电泳图谱中呈现相似的蛋白质组成,主要分布于43~120 kDa。文献报道,蜂蜜中鉴定到主要蛋白包括蜂王浆主蛋白、α-葡萄糖苷酶、葡萄糖氧化酶、α-淀粉酶、葡萄糖神经酰胺酶、转铁蛋白等蜂源蛋白质,分子质量均在50~120 kDa[13-14]。此外,值得注意的是,枣花蜜在19 kDa附近存在一条高丰度蛋白条带,前期研究表明该条带在其他植物源蜂蜜中并不明显,因此可将其作为枣花蜜的特征标志成分,质谱鉴定结果显示该条带主要由2种蜂源蛋白Uncharacterized protein(蛋白ID:tr|A0A088AC16)、MRJP-1水解片段(蛋白ID:sp|O18330)和一种枣源蛋白Metalloendoproteinase-1(蛋白基因号:Zj.jz016003045)组成[10]。

M-Maker;泳道1~9-分别为来自陕西佳县(2022年)、陕西清涧(2022年)、陕西吴堡(2019年)、新疆吐鲁番(2019年)、河南洛阳(2019年)、山西临县(2019年)、山东曲阜(2019年)、陕西大荔(2020年)、陕西佳县(2020年)的枣花蜜样品
图1 不同来源枣花蜜蛋白质SDS-PAGE电泳图
Fig.1 The SDS-PAGE profiles of jujube honey protein from different origin
2.2 基于凝胶与非凝胶蛋白质组学技术的枣花蜜蛋白质鉴定数量比较
蜂蜜蛋白质一般来源于蜜蜂在酿蜜过程中不断吞吐释放的自身分泌物或来源于蜜源植物的花蜜、花粉或渗出物[15]。为全面探究枣花蜜蛋白质组成,采用凝胶与非凝胶2种蛋白质组学技术对枣花蜜蛋白质组进行鉴定分析,结果如图2所示。通过凝胶蛋白质组学技术从枣花蜜中共鉴定到565个蛋白质,包括150个蜂源蛋白质和415个植物源蛋白质;而利用非凝胶蛋白质组学技术从枣花蜜中共鉴定到416个蛋白质,包括118个蜂源蛋白质和298个植物源蛋白质,其中有52个蜂源蛋白和118个植物源蛋白为2种组学技术共同鉴定。2种组学技术鉴定到的枣花蜜蛋白质数量存在明显差异,这应该与蜂蜜蛋白前处理方式及质谱设备不同等因素有关。凝胶蛋白质组学将枣花蜜蛋白分为高丰度(43.0~120.0 kDa和19 kDa电泳条带)和低丰度2个馏分再分别进行质谱检测,可有效减弱前者对后者的掩盖作用,并且采用的tims TOF HT MS质谱设备增加了离子淌度分离,在灵敏度、分辨率、扫描速度等方面均有所提升,有利于提高蛋白鉴定数量;而非凝胶蛋白组学鉴定则采用Quadrupole-Orbitrap MS进行分析,它属于静电场轨道肼质谱,可用于复杂样品基质中微量组分检测。无论如何,采用2种组学技术鉴定到蛋白数量远高于单一组学技术,这说明两者具有较强互补性,能显著提升枣花蜜蛋白质鉴定效率。
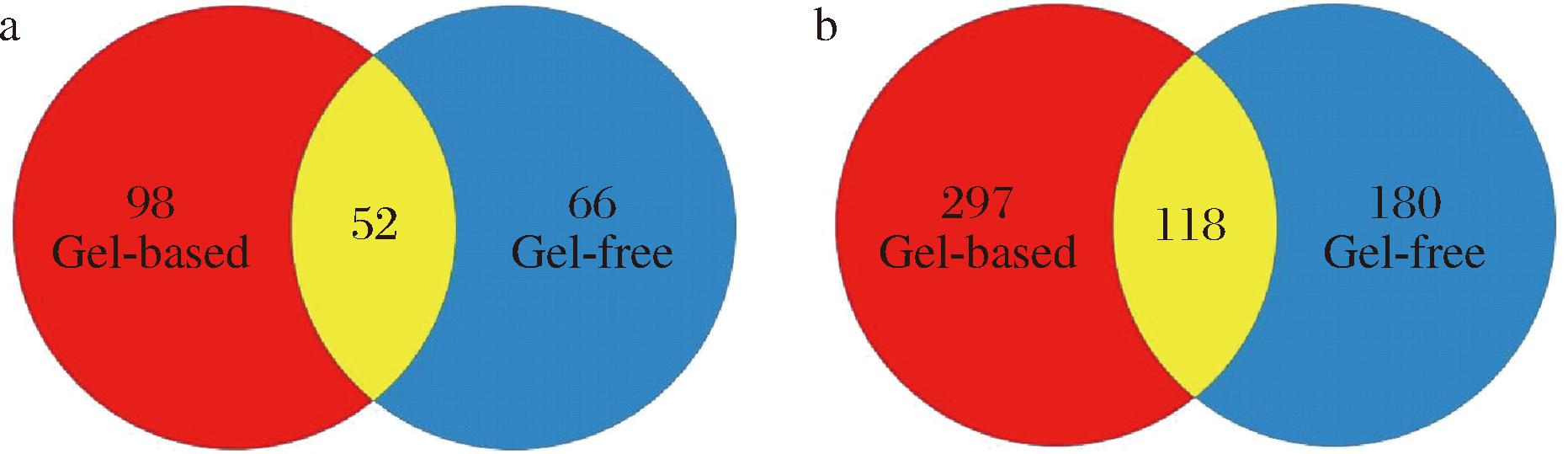
a-蜜蜂来源蛋白;b-植物来源蛋白,重叠部分为2种组学技术共同鉴定蛋白数量
图2 基于凝胶与非凝胶蛋白质组学的枣花蜜蛋白质鉴定数量比较
Fig.2 Comparison of protein number in jujube honey identified by both gel-based and gel-free proteomics
由图2可知,凝胶蛋白质组学鉴定到的植物源蛋白质数量(297个)明显高于非凝胶蛋白质组学(180个)。HAN等[16]同样发现蜂王浆蛋白质经一维凝胶电泳分离后再进行质谱分析鉴定到的蛋白质数目(37个)明显高于酶解样品直接质谱检测(22个),其认为与直接酶解鉴定过程中蜂王浆主蛋白的高丰度肽段影响了低丰度肽段信号有关。因此,本研究采用的凝胶蛋白质组学分析手段在鉴定枣花蜜低丰度蛋白有着明显突出优势,尤其是含量较低的植物源蛋白组分。
2.3 枣花蜜中蜜蜂来源蛋白质鉴定结果分析
在枣花蜜中共鉴定到216个蜜蜂来源蛋白,包括蜂王浆主蛋白(MRJP-1~7、MRJP-9~10)、咽下腺酶(α-葡萄糖苷酶、葡萄糖氧化酶和α-淀粉酶)、蜂毒蛋白(毒液丝氨酸蛋白酶34 X1亚型、磷脂酶A1、几丁质酶样蛋白Idgf4 X2亚型)、结构蛋白(肌动蛋白clone 403样、微管蛋白α链、微管蛋白β链)、代谢酶(葡萄糖神经酰胺酶、ATP合成酶β亚基、ATP合成酶α亚基)、热休克蛋白、延伸因子等蛋白,这些蛋白在相关研究中已被报道存在于不同种类蜂蜜中[17-18]。蜜蜂在蜂蜜酿造成熟过程中会不断将自身咽下腺分泌的各种蛋白及酶类混合进采集到的花蜜中,这构成了蜂蜜蛋白质的主要成分[19],蜜蜂体表在酿蜜过程中接触到蜂蜜,也会引入部分蛋白,如蜂毒蛋白、代谢酶等[8]。
值得注意的是,本研究在枣花蜜中新鉴定到24种蜂源蛋白,除葡萄糖-甲醇-胆碱氧化还原酶N端结构域蛋白(glucose-methanol-choline oxidoreductase N-terminal domain-containing protein)外,其他均通过不同组学技术被发现(表2)。对于这些新鉴定蜂源蛋白,12种蛋白属于酶类,包括4种连接酶:乙酰辅酶A羧化酶(acetyl-CoA carboxylase)、丙酮酸羧化酶(pyruvate carboxylase)、苯丙氨酸-tRNA连接酶β亚基(phenylalanine--tRNA ligase beta subunit)、泛素激活酶E1(E1 ubiquitin-activating enzyme),3种氧化还原酶:葡萄糖-甲醇-胆碱氧化还原酶N端结构域蛋白(glucose-methanol-choline oxidoreductase N-terminal domain-containing protein)、琥珀酸脱氢酶(succinate dehydrogenase)、线粒体琥珀酸脱氢酶[泛醌]铁硫亚基(succinate dehydrogenase [ubiquinone] iron-sulfur subunit, mitochondrial),2种转移酶:整合素连接激酶蛋白(peptidase S1 domain-containing protein)、半胱氨酸蛋白酶CG12163 X2亚型(cysteine proteinase CG12163 isoform X2),1种裂解酶:谷氨酸脱羧酶(glutamate decarboxylase)。此外,还包括4种调节蛋白,参与蛋白质合成:内质网驻留蛋白29(endoplasmic reticulum resident protein 29)、内质网驻留蛋白(endoplasmic reticulum resident protein);参与脂质运输:尼曼-皮克病C2型(Niemann-Pick disease type C2),参与免疫调节:Ig样结构域蛋白(Ig-like domain-containing protein);5种结合蛋白:MAGUK p55 亚族成员6 X1亚型(MAGUK p55 subfamily member 6 isoform X1)、几丁质结合2型结构域蛋白(chitin-binding type-2 domain-containing protein)、核联蛋白-2(nucleobindin-2)、β-catenin-interacting-ICAT结构域蛋白(beta-catenin-interacting ICAT domain-containing protein)、核仁蛋白(nucleolar protein)和3种功能未知蛋白:聚糖核心蛋白(aggrecan core protein)、DUF4789结构域蛋白(DUF4789 domain-containing protein)、肿瘤蛋白p53诱导蛋白13(tumor protein p53-inducible protein 13)。其中,琥珀酸脱氢酶存在于蜜蜂线粒体内膜,能催化琥珀酸氧化,并参与线粒体中电子传递,负责将电子从琥珀酸转移到泛醌(辅酶Q)[20]。内质网驻留蛋白是一种在生物体内广泛表达的蛋白,参与蜜蜂内质网发生的蛋白质分泌与成熟过程[21]。
表2 枣花蜜中首次鉴定到的蜂源蛋白质
Table 2 Bee-derived protein firstly identified in jujube honey
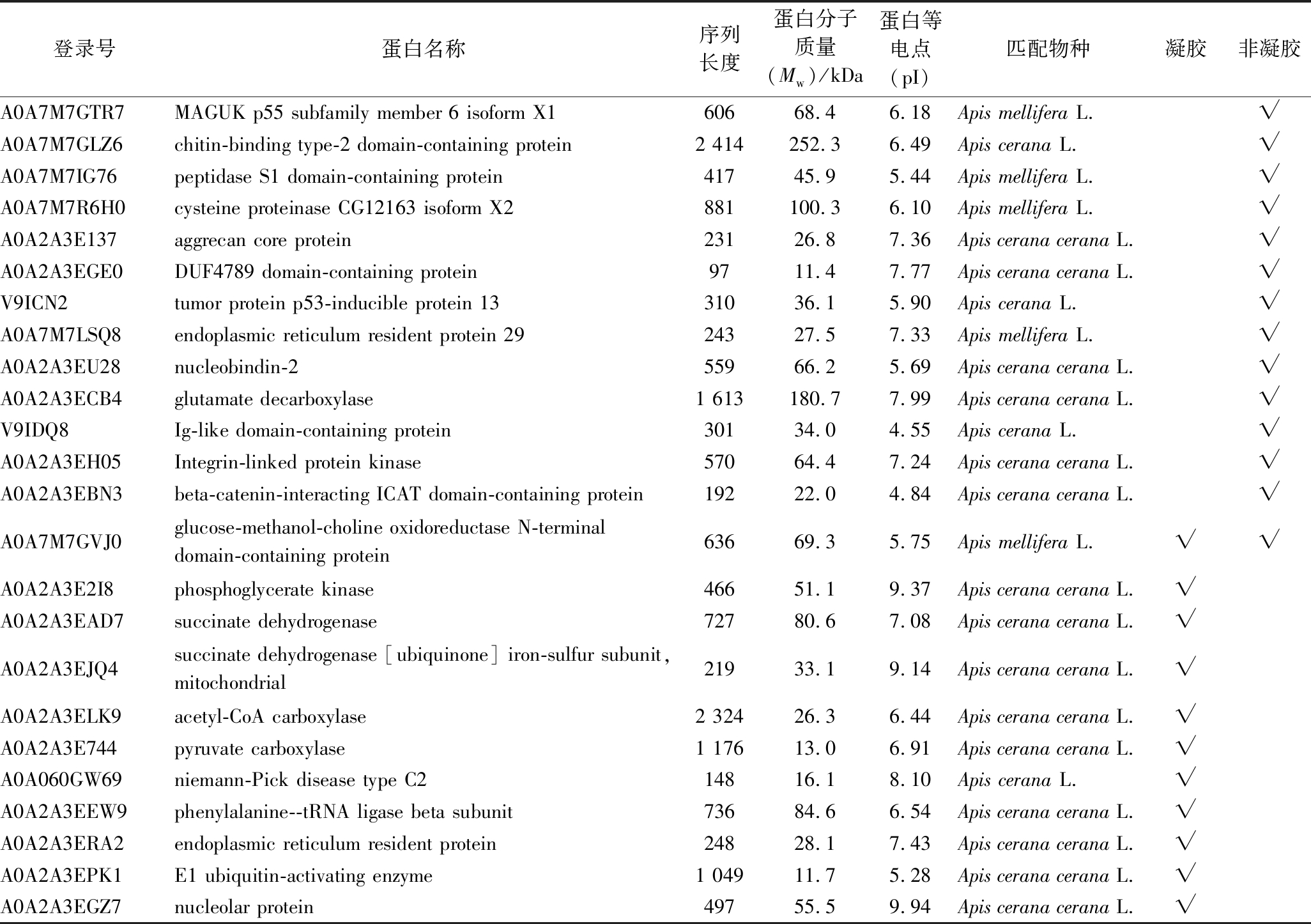
注:gel-based为凝胶蛋白组学鉴定结果,gel-free为非凝胶蛋白组学鉴定结果,√说明鉴定到该蛋白(下同)。
登录号蛋白名称序列长度蛋白分子质量(Mw)/kDa蛋白等电点(pI)匹配物种凝胶非凝胶A0A7M7GTR7MAGUK p55 subfamily member 6 isoform X160668.46.18Apis mellifera L.√A0A7M7GLZ6chitin-binding type-2 domain-containing protein2 414252.36.49Apis cerana L.√A0A7M7IG76peptidase S1 domain-containing protein41745.95.44Apis mellifera L.√A0A7M7R6H0cysteine proteinase CG12163 isoform X2881100.36.10Apis mellifera L.√A0A2A3E137aggrecan core protein23126.87.36Apis cerana cerana L.√A0A2A3EGE0DUF4789 domain-containing protein9711.47.77Apis cerana cerana L.√V9ICN2tumor protein p53-inducible protein 1331036.15.90Apis cerana L.√A0A7M7LSQ8endoplasmic reticulum resident protein 2924327.57.33Apis mellifera L.√A0A2A3EU28nucleobindin-255966.25.69Apis cerana cerana L.√A0A2A3ECB4glutamate decarboxylase1 613180.77.99Apis cerana cerana L.√V9IDQ8Ig-like domain-containing protein30134.04.55Apis cerana L.√A0A2A3EH05Integrin-linked protein kinase57064.47.24Apis cerana cerana L.√A0A2A3EBN3beta-catenin-interacting ICAT domain-containing protein19222.04.84Apis cerana cerana L.√A0A7M7GVJ0glucose-methanol-choline oxidoreductase N-terminaldomain-containing protein63669.35.75Apis mellifera L.√√A0A2A3E2I8phosphoglycerate kinase46651.19.37Apis cerana cerana L.√A0A2A3EAD7succinate dehydrogenase72780.67.08Apis cerana cerana L.√A0A2A3EJQ4succinate dehydrogenase [ubiquinone] iron-sulfur subunit,mitochondrial21933.19.14Apis cerana cerana L.√A0A2A3ELK9acetyl-CoA carboxylase2 32426.36.44Apis cerana cerana L.√A0A2A3E744pyruvate carboxylase1 17613.06.91Apis cerana cerana L.√A0A060GW69niemann-Pick disease type C214816.18.10Apis cerana L.√A0A2A3EEW9phenylalanine--tRNA ligase beta subunit73684.66.54Apis cerana cerana L.√A0A2A3ERA2endoplasmic reticulum resident protein24828.17.43Apis cerana cerana L.√A0A2A3EPK1E1 ubiquitin-activating enzyme1 04911.75.28Apis cerana cerana L.√A0A2A3EGZ7nucleolar protein49755.59.94Apis cerana cerana L.√
2.4 枣花蜜中植物来源蛋白质鉴定结果分析
在枣花蜜中共鉴定到595个植物源蛋白,其中胺氧化酶(amine oxidase)、金属内切蛋白酶2-MMP样(metalloendoproteinase 2-MMP-like)、类枯草菌素蛋白酶SBT1.7(subtilisin-like protease SBT1.7)、纤连蛋白Ⅲ型结构域蛋白(fibronectin type III-like domain-containing protein)、类成束阿拉伯半乳聚糖蛋白1(fasciclin-like arabinogalactan protein 1)等蛋白相对丰度较高,且在2种组学技术中均被鉴定到。胺氧化酶是一种催化多种生物胺氧化的酶,能影响植物细胞壁硬度从而调控植物生长和发育,并能促进花粉管伸长[22-23]。金属内切蛋白酶是一种含锌内肽酶,参与植物细胞外区域发生的蛋白水解过程,并能促进植物开花过程[24]。类成束阿拉伯半乳聚糖蛋白是阿拉伯半乳糖蛋白(arabinogalactan-proteins,AGPs)的一个亚类,主要存在于植物细胞壁和质膜,参与植物细胞壁形成、植物授粉和胚胎形成等过程[25]。这些蛋白参与植物的生长发育以及花粉管发育、植物开花等过程,可能在枣树植物花朵部位表达量较高,经蜜蜂采集花粉、花蜜并酿造成熟后仍能较好地保存在枣花蜜中。
枣花蜜是一种商品价值较高的中国特色蜂蜜品种,受利益因素驱使,枣花蜜掺假现象时有发生,寻找特征标志物对枣花蜜真实性溯源及掺假鉴别意义重大。蛋白质作为蜂蜜中相对稳定的内源性大分子,是一种理想的溯源标志物。我们对基于2种蛋白质组学技术鉴定到的丰度排名各前20枣植物源蛋白质进行BLAST分析,发现有11种蛋白质在油菜、洋槐、荔枝、荆条、荞麦、椴树、枇杷、龙眼、罗布麻、紫云英常见蜜源植物中不存在,因此可将其作为枣花蜜潜在的植物源特征蛋白标志物(表3)。在这些潜在标志蛋白中,有7种蛋白质属于酶类,包括金属内切蛋白酶2-MMP样(metalloendoproteinase 2-MMP-like)、糖苷水解酶19家族催化结构域蛋白(glycoside hydrolase family 19 catalytic domain-containing protein)、木葡聚糖内切葡聚糖酶/水解酶(xyloglucan endotransglucosylase/hydrolase)、可能的葡聚糖-1,3-β-葡萄糖苷酶AX2亚型(probable glucan-1,3-beta-glucosidase A isoform X2)、ADP/ATP移位酶(ADP/ATP translocase)、(R)-扁桃腈裂解酶[(R)-mandelonitrile lyase]、L-抗坏血酸氧化酶同源蛋白(L-ascorbate oxidase homolog),2种调节蛋白:解毒蛋白质(protein DETOXIFICATION)、延伸因子1-α(elongation factor 1-alpha),1种结构蛋白:肌动蛋白-1(actin-1)以及1种功能未知蛋白:FAS1结构域蛋白(FAS1 domain-containing protein)。
表3 枣花蜜中潜在的植物源特征蛋白标志物
Table 3 Potential floral protein maker in jujube honey

注:表中所列蛋白来自基于凝胶和非凝胶蛋白质组学技术鉴定到的丰度排名前20名枣植物源蛋白。
登录号蛋白名称序列长度蛋白分子质量(Mw)/kDa蛋白等电点(pI)匹配物种凝胶非凝胶A0A6P3ZHR5metalloendoproteinase 2-MMP-like32135.57.32Ziziphus jujuba L.√√A0A978VUG4FAS1 domain-containing protein42745.75.99Ziziphus jujuba var.spinosa L.√A0A978UCS4protein DETOXIFICATION82186.47.37Ziziphus jujuba var.spinosa L.√A0A978 W6I8glycoside hydrolase family 19 catalytic domain-containing protein23125.45.66Ziziphus jujuba var.spinosa L.√A0A978VYE1xyloglucan endotransglucosylase/hydrolase29232.45.67Ziziphus jujuba var.spinosa L.√A0A6P3ZGH0elongation factor 1-alpha44749.49.56Ziziphus jujuba L.√A0A6P4A8T4probable glucan-1,3-beta-glucosidase A isoform X250056.36.02Ziziphus jujuba L.√√A0A6P3ZDY2ADP/ATP translocase39242.710.29Ziziphus jujuba L.√A0A6P3YW27(R)-mandelonitrile lyase52257.16.91Ziziphus jujuba L.√√A0A6P3ZFX2actin-137741.75.29Ziziphus jujuba L.√A0A6P3ZW41L-ascorbate oxidase homolog54160.27.35Ziziphus jujuba L.√√
2.5 枣花蜜蛋白质GO功能注释分析
对基于2种蛋白质组学技术鉴定到的216个枣花蜜蜂源蛋白进行GO功能注释分析,结果如图3-a所示:87个蛋白匹配到64种生物学过程,包括碳水化合物代谢(13,14.9%)、蛋白质水解(11,12.6%)、糖酵解途径(6,6.9%)、鞘脂代谢(5,5.7%)、翻译过程(5,5.7%)、磷酸化作用(4,4.6%)、三羧酸循环(4,4.6%)、铁离子运输(4,4.6%)等;134个蛋白匹配到100种分子功能,包括ATP结合(19,14.2%)、黄素腺嘌呤二核苷酸结合(8,6.0%)、三磷酸鸟苷结合(7,5.2%)、三磷酸鸟苷酶活性(7,5.2%)、核糖体结构组分(6,4.5%)、水解糖苷键活性(6,4.5%)、RNA结合(5,3.7%)、氧化还原供体CH—OH基团活性(5,3.7%)、ATP依赖性折叠伴侣蛋白(5,3.7%)、羧酸酯水解酶活性(4,3.0%)、葡萄糖神经酰胺酶活性(4,3.0%)、磷脂酶A1活性(4,3.0%)、氧化还原酶活性(4,3.0%)等;76个蛋白分布在33类细胞组分,包括细胞外区域(25,32.9%)、细胞膜(12,15.8%)、细胞质(7,9.2%)、细胞核(5,6.6%)等。图3-b所示是枣花蜜中鉴定到的595个植物源蛋白质GO功能注释分析:353个蛋白匹配到139种生物学过程,包括碳水化合物代谢(87,24.6%)、蛋白质水解(47,13.3%)、磷酸化作用(20,5.7%)、细胞壁组建(16,4.5%)、翻译过程(14,4.0%)、糖酵解途径(10,2.8%)等;503个蛋白对应到202种分子功能,包括ATP结合(59,11.7%)、水解O-糖基化合物活性(47,9.3%)、金属离子结合(25,5.0%)、丝氨酸型内肽酶活性(19,3.8%)、三磷酸鸟苷结合(19,3.8%)、铜离子结合(19,3.8%)、葡聚糖内切-1,3-β-D-葡萄糖苷酶活性(19,3.8%)、天冬氨酸型内肽酶活性(16,3.2%)、氧化还原酶活性(15,3.0%)、三磷酸鸟苷酶活性(14,2.8%)、核糖体结构组分(14,2.8%)、ATP水解酶活性(12,2.4%)、碳水化合物结合(11,2.2%)、ATP依赖性折叠伴侣蛋白(11,2.2%)、黄素腺嘌呤二核苷酸结合(10,2.0%)等;238个蛋白分布于50类细胞组分,包括细胞膜(81,34.0%)、细胞外区域(33,13.9%)、细胞质(17,7.1%)、细胞核(13,5.5%)、核糖体(6,2.5%)等。
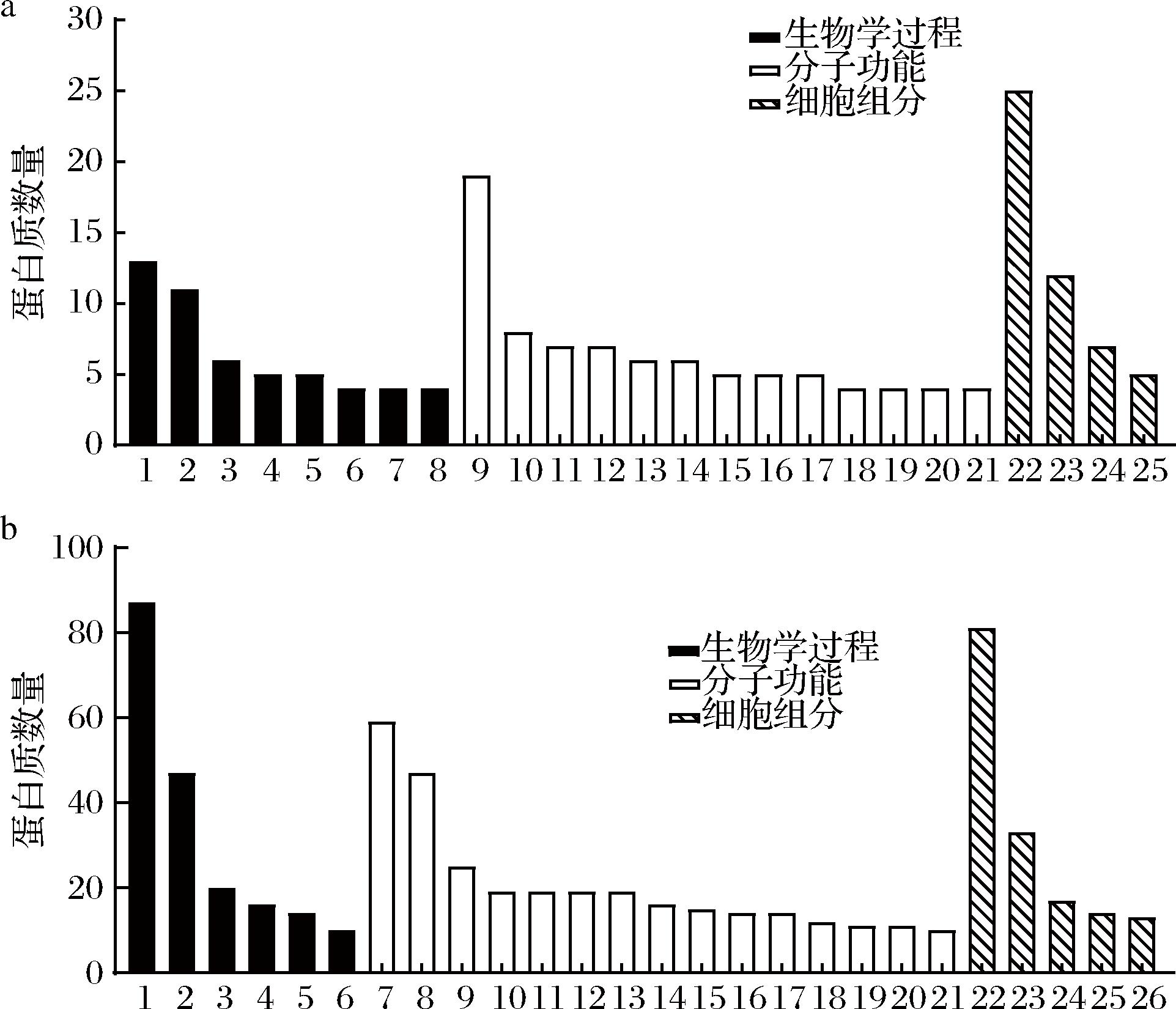
a-蜜蜂来源蛋白质;b-植物来源蛋白质
图3 枣花蜜蛋白质GO功能注释分析
Fig.3 GO functional analysis of jujube honey protein
注:图a中,1:碳水化合物代谢,2:蛋白质水解,3:糖酵解途径,4:鞘脂代谢,5:翻译过程,6:磷酸化作用,7:三羧酸循环,8:铁离子运输,9:ATP结合,10:黄素腺嘌呤二核苷酸结合,11:三磷酸鸟苷结合,12:三磷酸鸟苷酶活性,13:核糖体结构组分,14:水解糖苷键活性,15:RNA结合,16:氧化还原供体CH-OH基团活性,17:ATP依赖性折叠伴侣蛋白,18:羧酸酯水解酶活性,19:葡萄糖神经酰胺酶活性,20:磷脂酶A1活性,21:氧化还原酶活性,22:细胞外区域,23:细胞膜,24:细胞质,25:细胞核;图b中,1:碳水化合物代谢,2:蛋白质水解,3:磷酸化作用,4:细胞壁组建,5:翻译过程,6:糖酵解途径,7:ATP结合,8:水解O-糖基化合物活性,9:金属离子结合,10:丝氨酸型内肽酶活性,11:三磷酸鸟苷结合,12:铜离子结合,13:葡聚糖内切-1,3-β-D-葡萄糖苷酶活性,14:天冬氨酸型内肽酶活性,15:氧化还原酶活性,16:三磷酸鸟苷酶活性,17:核糖体结构组分,18:ATP水解酶活性,19:碳水化合物结合,20:ATP依赖性折叠伴侣蛋白,21:黄素腺嘌呤二核苷酸结合,22:细胞膜,23:细胞外区域,24:细胞质,25:细胞核,26:核糖体。
3 结论
本文采用凝胶和非凝胶2种蛋白质组学技术对枣花蜜蛋白质进行了全面鉴定分析,从中共发现216个蜜蜂来源蛋白,595个枣植物来源蛋白。2种组学技术具有较强互补性,能显著提升枣花蜜中蛋白质的鉴定数量。其中,24种蜂源蛋白首次在枣花蜜中鉴定到,包括MAGUK p55亚族成员6 X1亚型(MAGUK p55 subfamily member 6 isoform X1)、几丁质结合2型结构域蛋白(chitin-binding type-2 domain-containing protein)、肽酶S1结构域蛋白(peptidase S1 domain-containing protein)等;借助BLAST分析工具对植物源蛋白进行筛选,金属内切蛋白酶2-MMP样(metalloendoproteinase 2-MMP-like)、FAS1结构域蛋白(FAS1 domain-containing protein)、解毒蛋白质(protein DETOXIFICATION)等高丰度蛋白质可作为枣花蜜潜在的植物源蛋白标志物。对枣花蜜蛋白进行GO功能注释分析,发现鉴定到的蜂源和植物源蛋白主要参与碳水化合物代谢、蛋白质水解等生物学过程,涉及ATP结合、黄素腺嘌呤二核苷酸结合等分子功能。本文首次完成对枣花蜜全蛋白质组进行鉴定与分析,为研究枣花蜜中的蛋白质生物活性组分及筛选特征蛋白标志物提供了理论依据。
[1] OLAS B.Honey and its phenolic compounds as an effective natural medicine for cardiovascular diseases in humans[J].Nutrients, 2020, 12(2):283.
[2] KADRI S M, ZALUSKI R, DE OLIVEIRA O R.Nutritional and mineral contents of honey extracted by centrifugation and pressed processes[J].Food Chemistry, 2017, 218:237-241.
[3] BOGDANOV S, JURENDIC T, SIEBER R, et al.Honey for nutrition and health:A review[J].Journal of the American College of Nutrition, 2008, 27(6):677-689.
[4] 岳锦萍, 徐雨欣, 范佳慧, 等.蜂蜜的主要成分及其鉴别技术[J].食品安全质量检测学报, 2018, 9(19):5138-5145.YUE J P, XU Y X, FAN J H, et al.Main components of honey and its identification technology[J].Journal of Food Safety &Quality, 2018, 9(19):5138-5145.
[5] AFROZ R, TANVIR E M, ZHENG W, et al.Molecular pharmacology of honey[J].Journal of Clinical and Experimental Pharmacology, 2016, 6(3):1-13.
[6] GIROLAMO D F, D’AMATO A, RIGHETTI P G.Assessment of the floral origin of honey via proteomic tools[J].Journal of Proteomics, 2012, 75(12):3688-3693.
[7] ERBAN T, SHCHERBACHENKO E, TALACKO P, et al.The unique protein composition of honey revealed by comprehensive proteomic analysis:Allergens, venom-like proteins, antibacterial properties, royal jelly proteins, serine proteases, and their inhibitors[J].Journal of Natural Products, 2019, 82(5):1217-1226.
[8] BONG J, MIDDLEDITCH M J, LOOMES K M, et al.Proteomic analysis of honey.Identification of unique peptide markers for authentication of NZ mānuka (Leptospermum scoparium) honey[J].Food Chemistry, 2021, 350:128442.
[9] 张颖, 张光艳, 王宇翔, 等.不同花源蜂蜜蛋白质组分及提取方法的比较[J].食品与发酵工业, 2019, 45(14):91-96.ZHANG Y, ZHANG G Y, WANG Y X, et al.Comparison of protein composition and extraction methods between honey from different floral origins[J].Food and Fermentation Industries, 2019, 45(14):91-96.
[10] ZHANG Y, WANG Y X, ZHAO H A, et al.Characterization of novel protein component as marker for floral origin of jujube (Ziziphus jujuba Mill.) honey[J].Journal of Agricultural and Food Chemistry, 2019, 67(44):12255-12263.
[11] 周娟. 枣花蜜理化指标及抗氧化活性研究[D].西安:西北大学, 2013.ZHOU J. Study on physical and chemical indexes and antioxidant activity of jujube nectar[D]. Xi’an: Northwest University, 2013.
[12] CHEVALLET M, LUCHE S, RABILLOUD T.Silver staining of proteins in polyacrylamide gels[J].Nature Protocols, 2006, 1(4):1 852-1 858.
[13] ![]() D, et al.Proteomic analysis of pollen and blossom honey from rape seed Brassica napus L.[J].Journal of Apicultural Science, 2017, 61(1):73-92.
D, et al.Proteomic analysis of pollen and blossom honey from rape seed Brassica napus L.[J].Journal of Apicultural Science, 2017, 61(1):73-92.
[14] BORUTINSKAITE V, TREIGYTE G, ![]() V, et al.Proteomic identification and enzymatic activity of buckwheat (Fagopyrum esculentum) honey based on different assays[J].Journal of Food and Nutrition Research, 2018, 57(1):57-69.
V, et al.Proteomic identification and enzymatic activity of buckwheat (Fagopyrum esculentum) honey based on different assays[J].Journal of Food and Nutrition Research, 2018, 57(1):57-69.
[15] BARONI M V, CHIABRANDO G A, COSTA C, et al.Assessment of the floral origin of honey by SDS-PAGE immunoblot techniques[J].Journal of Agricultural and Food Chemistry, 2002, 50(6):1362-1367.
[16] HAN B, LI C X, ZHANG L, et al.Novel royal jelly proteins identified by gel-based and gel-free proteomics[J].Journal of Agricultural and Food Chemistry, 2011, 59(18):10346-10355.
[17] ZHENG Y F, WU M C, CHIEN H J, et al.Honey proteomic signatures for the identification of honey adulterated with syrup, producing country, and nectar source using SWATH-MS approach[J].Food Chemistry, 2021, 354:129590.
[18] ERBAN T, SHCHERBACHENKO E, TALACKO P, et al.Honey proteome of the bumblebee Bombus terrestris:Similarities, differences, and exceptionality compared to honey bee honey as signatures of eusociality evolution[J].Apidologie, 2022, 53(1):1-15.
[19] ![]() V, KAUPINIS A,
V, KAUPINIS A, ![]() K, et al.Characteristics of honey bee physiological proteins extracted from faba bean (Vicia faba L.) honey[J].Journal of Apicultural Research, 2023, 62(5):1250-1261.
K, et al.Characteristics of honey bee physiological proteins extracted from faba bean (Vicia faba L.) honey[J].Journal of Apicultural Research, 2023, 62(5):1250-1261.
[20] GORBACHEVA T M, SYROMYATNICOV M Y, POPOV V N, et al.Characteristics of functioning of succinate dehydrogenase from flight muscles of the bumblebee Bombus terrestris (L.)[J].Biology Bulletin, 2013, 40(5):429-434.
[21] PEIREN N, DE GRAAF D C, VANROBAEYS F, et al.Proteomic analysis of the honey bee worker venom gland focusing on the mechanisms of protection against tissue damage[J].Toxicon, 2008, 52(1):72-83.
[22] KONSTANTINOS P A, IMENE T, PANAGIOTIS M N, et al.ABA-dependent amine oxidases-derived H2O2 affects stomata conductance[J].Plant Signaling &Behavior, 2010, 5(9):1153-1156.
[23] CONA A, REA G, ANGELINI R, et al.Functions of amine oxidases in plant development and defence[J].Trends in Plant Science, 2006, 11(2):80-88.
[24] MARINO G, FUNK C.Matrix metalloproteinases in plants:A brief overview[J].Physiologia Plantarum, 2012, 145(1):196-202.
[25] ZANG L, ZHENG T C, CHU Y G, et al.Genome-Wide analysis of the fasciclin-like arabinogalactan protein gene family reveals differential expression patterns, localization, and salt stress response in Populus[J].Frontiers in Plant Science, 2015, 6(12):1140.