亚麻籽饼作为食品加工中的副产物,主要用于饲料生产,其利用价值较低,而亚麻籽饼中含有40%~45%的膳食纤维,其中30%为可溶性膳食纤维(soluble dietary fiber, SDF)[1],与燕麦等高SDF食物中含量相当。SDF具有调节肠道、促进维生素和矿物质吸收等作用,但是目前关于从亚麻籽饼中提取SDF的相关报道较少。有关研究表明,不同的提取方法可能会改变SDF的组分和结构特征,从而影响SDF的提取率[2]。在SDF的提取过程中,超声处理可导致植物细胞壁空化,这将影响碳水化合物聚合物的结构和形态,导致其组分更好地溶解。另外,酶解能使木质素、纤维素、半纤维素在细胞壁中形成化学键断裂,这些方法都可能影响SDF的微观结构和组成[3-4]。MOCZKOWSKA等[5]采用酶法在55 ℃下超声辅助,从亚麻籽中提取SDF,SDF的提取率为(68.90±0.50)%。然而,目前没有关于超声联合去除蛋白和淀粉先后顺序对改善亚麻籽饼SDF提取率的影响研究。构建高效率提取SDF的最佳工艺体系在对亚麻籽饼的深层次和高值化精深加工利用来说意义重大。
本研究首先探明了亚麻籽饼是由多糖网络结构包裹着蛋白质颗粒的基本组分分布特点,基于此,通过单因素试验和响应面试验得到高效率提取SDF的最佳工艺条件,以期为亚麻籽饼SDF的制备提供方法参考,旨在挖掘更符合工业化生产的亚麻籽饼SDF。
1 材料与方法
1.1 材料与试剂
1.1.1 原料
亚麻籽,昆明望回美电子商务有限公司。
1.1.2 主要试剂
HCl,洛阳化学试剂厂;95%(体积分数)乙醇,天津市天力化学试剂有限公司;α-淀粉酶,上海麦克林生化科技有限公司;荧光白,北京酷来搏科技有限公司;异硫氰酸荧光素,上海源叶生物科技有限公司;罗丹明,天津市科密欧化学试剂有限公司。
1.2 仪器与设备
BSA224S-CW分析天平,德国Sartorius公司;DHG-9240A电热恒温鼓风干燥箱,上海精宏试验设备有限公司;BCD-237TGEM冰箱,合肥美的电冰箱有限公司;FW-100高速万能粉碎机,北京市永光明医疗仪器有限公司;Sorvall BIOFUGE Stratos全能台式高速离心机,美国Thermo Fisher公司;2013C004-31 pH计,上海仪电科学仪器股份有限公司;WQF-510超声细胞破碎仪,宁波新芝生物科技有限技术公司;HH-4J恒温数显磁力搅拌水浴锅、HT7700扫描电子显微镜,日立HITACHI有限公司;UV-2700i紫外可见分光光度计,岛津仪器有限公司;FV3000激光共聚焦显微镜,奥林巴斯公司;K1160全自动凯氏定氮仪,济南海能仪器股份有限公司;LGJ-25冷冻干燥机,北京四环科学仪器有限公司。
1.3 实验方法
1.3.1 亚麻籽饼制取工艺
如图1所示,首先对亚麻籽进行预榨,脱除大部分油脂,后将预榨后的亚麻籽饼进行粉碎,利用石油醚浸出进一步脱除油脂,将残余石油醚旋转蒸发后制得亚麻籽饼。

图1 亚麻籽饼的压榨工艺流程
Fig.1 Pressing process of flaxseed cake
1.3.2 亚麻籽饼的微观形貌分析
亚麻籽饼SDF的扫描电镜分析:把少量的亚麻籽饼 SDF用导电的双面胶水均匀地铺在一个金属样台上,然后对其进行真空镀金,在低真空模式下放入扫描电子显微镜中,对喷雾干燥后的亚麻籽饼SDF的微观形貌进行观察。
亚麻籽饼SDF的激光共聚焦显微镜分析:将亚麻籽饼粉按照1∶50 (g∶mL) 的比例与去离子水混合,吸取1 mL溶液与5 μL FITC染液,5 μL荧光白染液,5 μL罗丹明染液进行混匀染色。使用移液枪吸取10 μL 染色后的样品于载玻片上,盖上盖玻片避免气泡产生和溶液溢出,通过激光共聚焦显微镜观察并记录图像。
1.3.3 亚麻籽饼基本成分的测定
蛋白质含量的测定:参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中的凯氏定氮法。
脂肪含量的测定:参照GB 5009.6—2016《食品安全国家标准 食品中脂肪的测定》中索氏抽提法。
灰分的测定:参照GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》中规定的550 ℃烘烤法。
水分的测定:参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》中的直接烘干法。
膳食纤维、SDF、不溶性膳食纤维的测定方法:参照 GB 5009.88—2023《食品安全国家标准 食品中膳食纤维的测定》中所列的酶重法。
碳水化合物测定方法:参考苯酚-硫酸法进行测定[6]。用去离子水配制0.1 mg/mL亚麻籽饼粉溶液,向1.0 mL该溶液中加入0.5 mL 6%的苯酚和2.5 mL 浓硫酸,在管中混合均匀后,将其于室温下进行反应。在490 nm下测定了样品的吸光度,用标准曲线y=0.909x+0.026 4,R2=0.997 9计算多糖的含量。按照公式(1)计算试样中多糖的含量:
多糖含量![]()
(1)
式中:c,试样溶液中多糖的质量浓度, mg/mL;0.1,样品溶液的质量浓度,mg/mL。
1.3.4 亚麻籽饼SDF提取方法
1.3.4.1 酸沉蛋白-酶解淀粉法
按照一定料液比向亚麻籽饼中加入蒸馏水,用氢氧化钠调节体系pH值为9.5,充分搅拌1 h后,将体系离心(12 000×g,15 min),取上清液调节pH值为3.5,离心(12 000×g,15 min)后继续取上清液,向上清液中加入α-淀粉酶,充分酶解后加入4倍体积4 ℃预冷的95%乙醇,充分混匀后静置48 h,离心(12 000×g,15 min)取沉淀,将沉淀冻干即得亚麻籽饼SDF。具体流程为:
原料→碱溶酸沉提取蛋白→上清液→α-淀粉酶除淀粉→95%乙醇沉淀得SDF
1.3.4.2 热变性蛋白-酶解淀粉法
按照一定料液比向亚麻籽饼中加入蒸馏水,用氢氧化钠调节体系pH值为9.5,充分搅拌1 h后,将体系离心(12 000×g,15 min),取上清液调节pH值为3.5,接着将溶液放置100 ℃沸水浴中,彻底去除蛋白质。离心(12 000×g,15 min)后继续取上清液,向上清液中加入α-淀粉酶,充分酶解后加入4倍体积4 ℃预冷的95%乙醇,充分混匀后静置48 h,离心(12 000×g,15 min)取沉淀,将沉淀冻干即得亚麻籽饼SDF。具体流程如下:
原料→碱提→pH 3.5+沸水浴除蛋白→上清液→α-淀粉酶除淀粉→95%乙醇沉淀得SDF
1.3.4.3 酶解淀粉-热变性蛋白法
按照一定料液比向亚麻籽饼中加入蒸馏水,用氢氧化钠调节体系pH值为9.5,充分搅拌1 h后,将体系离心(12 000×g,15 min),离心后向上清液中加入α-淀粉酶,再将上清液pH值调至3.5,接着将溶液放置100 ℃沸水浴中,彻底去除蛋白质。离心(12 000×g,15 min)后继续取上清液,加入4倍体积4 ℃预冷的95%乙醇,充分混匀后静置48 h,离心(12 000×g,15 min)取沉淀,将沉淀冻干即得亚麻籽饼SDF。具体流程如下:
原料→碱提→α-淀粉酶除淀粉→pH 3.5+沸水浴除蛋白→上清液→95%乙醇沉淀得SDF
1.3.4.4 超声辅助-酸沉蛋白-酶解淀粉法
按照一定料液比向亚麻籽饼中加入蒸馏水,用氢氧化钠调节体系pH值为9.5,充分搅拌1 h后在超声波细胞破碎仪中进行超声处理。将体系离心(12 000×g,15 min),取上清液调节pH值为3.5,离心(12 000×g,15 min)后继续取上清液,向上清液中加入α-淀粉酶,充分酶解后加入4倍体积4 ℃预冷的95%乙醇,充分混匀后静置48 h,离心(12 000×g,15 min)取沉淀,将沉淀冻干即得亚麻籽饼SDF。具体流程如下:
原料→碱溶+超声+酸沉提取蛋白→α-淀粉酶除淀粉→95%乙醇沉淀得SDF
1.3.5 提取率计算公式
利用MOCZKOWSKA等[5]方法,称量计算不同提取方法处理后的亚麻籽饼SDF的提取率。亚麻籽饼SDF的提取率计算如公式(2)所示:
SDF提取率![]()
(2)
式中:M1,从脱脂饼中提取和冷冻干燥后获得的SDF粉末的质量,g;M0,用于提取的脱脂饼的质量,g。
1.3.6 单因素试验设计
在超声时间为15 min,超声功率100 W,加酶量为0.3%(体积分数),酶解时间1 h的条件下,探究料液比(1∶10、1∶15、1∶20、1∶25、1∶30,g∶mL)对亚麻籽饼SDF提取率的影响;在料液比1∶20,超声功率100 W,加酶量为0.3%(体积分数),酶解时间1 h的条件下探究超声时间(15、20、25、30、35 min)对亚麻籽饼SDF提取率的影响;在料液比1∶20,超声时间25 min,加酶量为0.3%(体积分数),酶解时间1 h的条件下探究超声功率(100、150、200、250、300 W)对亚麻籽饼SDF提取率的影响;在料液比1∶20,超声时间25 min,超声功率200 W,酶解时间1 h的条件下,探究加酶量(0.3%、0.6%、0.9%、1.2%、1.5%,体积分数)对亚麻籽饼SDF提取率的影响;在料液比1∶20,超声时间25 min,超声功率200 W,加酶量为0.9%的条件下探究酶解时间(1、2、3、4、5 h)对亚麻籽饼SDF提取率的影响。
1.3.7 响应面优化试验
以亚麻籽饼中 SDF提取率为评价指标,进行了单因素试验,选用料液比(A)、超声时间(B)、加酶量(C)的最佳区间水平,设计响应面优化试验,以期得出超声辅助酶法提取亚麻籽饼SDF的最佳工艺。响应面试验因素水平详见表1。
表1 响应面试验因素水平表
Table 1 Level of response surface test factors

水平因素A(料液比,g∶mL)B(超声时间)/minC(加酶量,体积分数)/%-11∶15200.601∶20250.911∶25301.2
1.3.8 亚麻籽饼SDF的单糖组成测定
在清洁的柱层析中,称量出适量的多糖,添加1 mL 三氟乙酸(trifluoroacetic acid,TFA)酸液,在121 ℃ 下进行2 h的加热。通入氮气,使其干燥。加入99.99%的甲醇洗涤,然后进行吹干,反复洗涤2~3 次。添加无菌水使其溶解,然后转移到色谱瓶中进行测定。
采用DionexTM CarboPacTM PA20(3.0 mm×150 mm,10 μm)液相色谱柱;进样量为5 μL。流动相A(H2O),流动相B(0.1 mol/L NaOH),流动相C(0.1 mol/L NaOH,0.2 mol/L NaAc),流速0.5 mL/min;柱温为30 ℃;洗脱梯度:0 min,V(A相)∶V(B相)∶V(C相)=95∶5∶0;26 min,V(A相)∶V(B相)∶V(C相)=85∶5∶10;42 min,V(A相)∶V(B相)∶V(C相)=85∶5∶10; 42.1 min,V(A相)∶V(B相)∶V(C相)=60∶0∶40;52 min,V(A相)∶V(B相)∶V(C相)=60∶40∶0;52.1 min,V(A相)∶V(B相)∶V(C相)=95∶5∶0;60 min,V(A相)∶V(B相)∶V(C相)=95∶5∶0。
1.3.9 亚麻籽饼SDF的分子质量测定
参考张岱玉[7]的方法,采用高效液相色谱法测定SDF的相对分子质量。
a)色谱条件
仪器:UltiMate3000高效液相色谱仪;色谱柱:使用 OhpakSB-805HQ (8.0 mm×300 mm)及OhpakSB-803HQ (8.0 mm×300 mm)串联;示差检测器:OptilabT-rEX (怀雅特技术公司);激光光散射检测器:DAWN HELEOS-Ⅱ(怀雅特技术公司);流动相A(0.02% NaN3,0.1 mol/L NaNO3);柱温45 ℃、进样量100 μL、流速0.6 mL/min、洗脱梯度:等度75 min。
b)样品的配制
将样品溶解在NaNO3水溶液(含0.02% NaN3, 质量分数)中,最终质量浓度为1 mg/mL,并通过孔径为0.45 μm的过滤器过滤后上机检测。
1.3.10 亚麻籽饼SDF的微观结构测定
同1.3.2节亚麻籽饼SDF的扫描电镜分析。
1.4 数据统计与处理
利用 SPSS 20.0对试验数据进行方差分析,利用 Duncan方法对试验数据进行统计学处理(P<0.05)。利用 Origin Pro 2021软件对试验结果进行绘制。
2 结果与分析
2.1 亚麻籽饼的微观形貌分析
本研究选用的原料为经过冷榨处理的亚麻籽饼粉。图2分别展示了不同放大倍数下亚麻籽饼粉的扫描电镜图,亚麻籽饼原料呈现不规则颗粒状,在颗粒表面可观测到网络包裹颗粒的微观形貌。为进一步探究亚麻籽饼中各组分间的存在状态,将原料经特定染色后得到激光共聚焦结果如图3所示,得出亚麻籽饼主要是由多糖网络结构包裹着蛋白质颗粒而存在的,关于亚麻籽饼原料所具有的这一特征,目前研究结果中尚未明晰。这一结果也为后续不同提取方法的探究过程提供了一定参考。

A-放大倍数为300×;B-放大倍数为1 000×
图2 亚麻籽饼的微观形貌图
Fig.2 Microscopic morphology of flaxseed cake
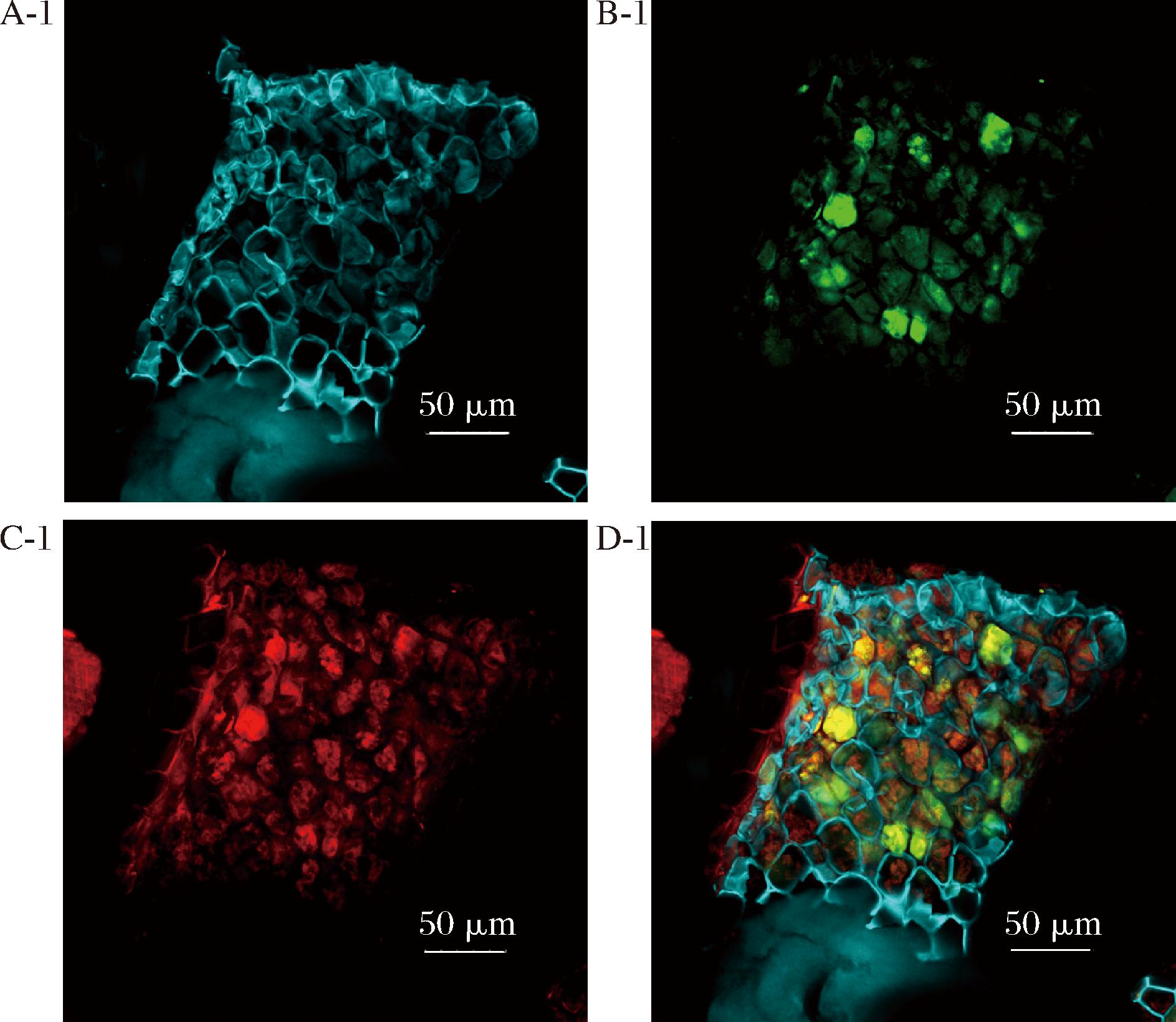
A-1-膳食纤维染色图;B-1-蛋白染色图(异硫氰酸染色剂); C-1-蛋白染色图(罗丹明染色剂);D-1-复合染色图
图3 亚麻籽饼原料激光共聚焦显微镜图
Fig.3 Laser confocal microscope image of flaxseed cake raw material
2.2 亚麻籽饼基本成分的测定
本试验所用亚麻籽饼粉的基本成分及含量如表2、表3所示。亚麻籽饼中膳食纤维含量最多,为38.35%,即该原料可用作提取膳食纤维的高潜力原材料。SDF是影响原料生理活性的主要因素之一,由结果可以看到,亚麻籽饼粉中 SDF 含量为14.99%。因此,最大限度将亚麻籽饼中的SDF 提取出来具有重要意义。此外亚麻籽饼的总膳食纤维含量高达38.35%,而在其他常规植物及油料作物中,如豆渣中膳食纤维含量仅为28%[7]。麦麸膳食纤维含量约为40%[8],油茶粕膳食纤维含量约为30%[9]。在当前亚麻籽饼膳食纤维的相关研究中,李可[10]用酶解法所得亚麻籽粕中总膳食纤维提取率为68.12%,MOCZKOWSKA等[5]用超声辅助酶解法提取的SDF为(68.90±0.50)%,姚思含等[11]用酶辅助三相分离法提取亚麻籽胶,提取率为31.62%~35.61%。
表2 亚麻籽饼原料组成分析 单位:%
Table 2 Composition analysis of flaxseed cake raw materials
原料蛋白质脂肪灰分水分膳食纤维碳水化合物亚麻籽饼36.59±0.181.91±0.053.97±0.029.28±0.0938.35±0.2110.21±0.13
表3 亚麻籽饼原料膳食纤维组成分析 单位:%
Table 3 Analysis of dietary fiber composition of flaxseed cake raw materials
原料膳食纤维SDF不可溶性膳食纤维亚麻籽饼38.35±0.2114.99±0.0723.36±0.14
基本成分测定结果表明亚麻籽饼中的膳食纤维含量与大宗油料作物的膳食纤维含量相接近甚至更高,且与已开发的亚麻籽饼相比,该样品中含有较高的SDF,是一种优异的膳食纤维来源。此外,亚麻籽饼中包含的蛋白质含量约为36%,也是一种具有良好蛋白质资源的原料,所以在后续提取方法探究中也考虑到将优质蛋白质保留下来再提取SDF,更符合目前对副产物高值化利用和绿色可持续发展的需求。
2.3 提取方法对亚麻籽饼SDF提取率的影响
为了探究酸沉蛋白-酶解淀粉法、热变性蛋白-酶解淀粉法、酶解淀粉-热变性蛋白法以及超声辅助-酸沉蛋白-酶解淀粉法4种方法来提取亚麻籽饼SDF的有效性,采用重量法对4种方法处理后的亚麻籽饼SDF进行测定,结果如图4所示。
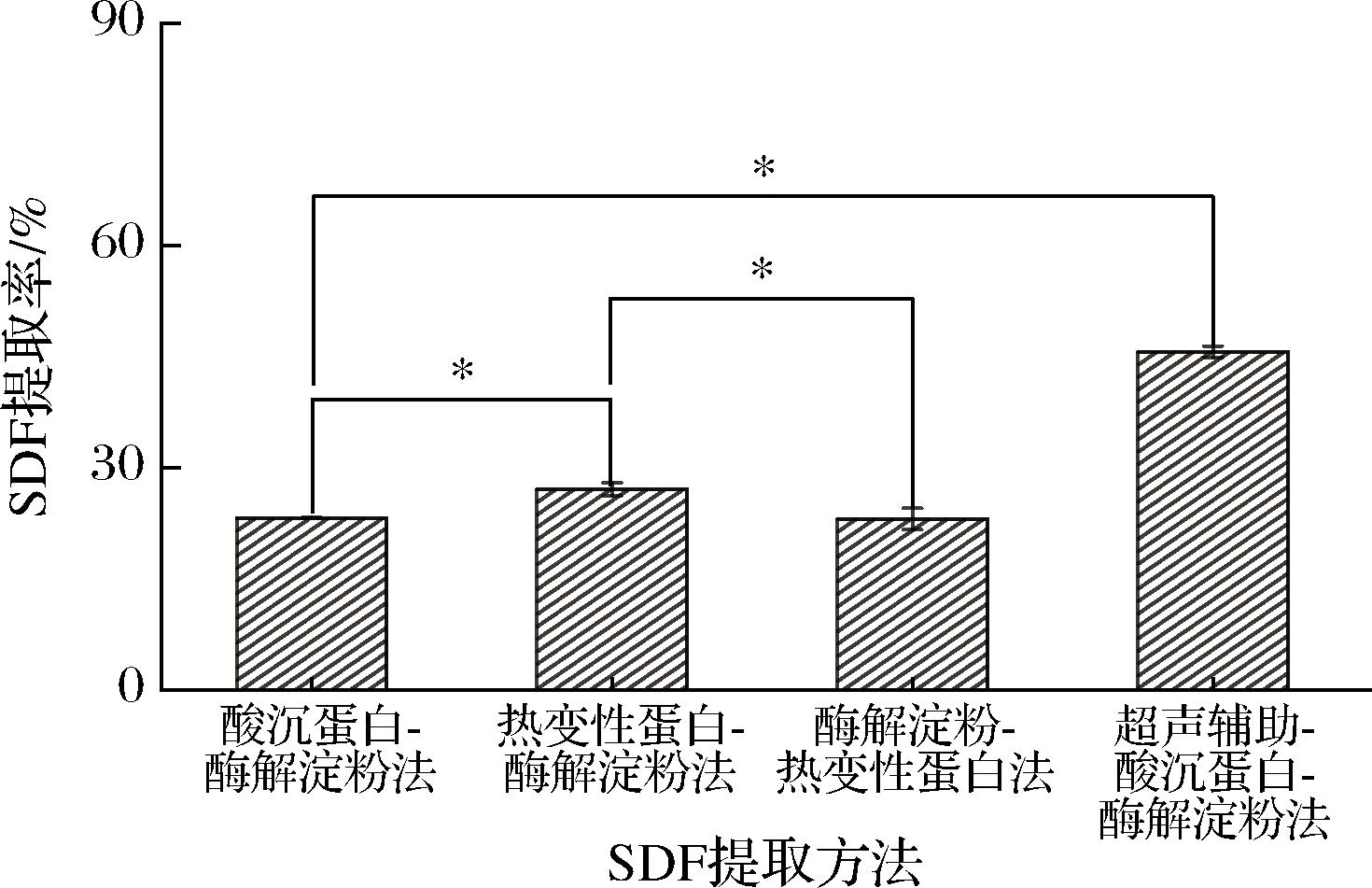
图4 不同提取方法对SDF提取率的影响
Fig.4 Influence of different extraction methods on SDF extraction rate confocal microscope image
注:“*”代表差异显著(P<0.05)。
通过对比酸沉蛋白-酶解淀粉法和热变性蛋白-酶解淀粉法来提取SDF,酸沉蛋白-酶解淀粉法提取率为23.22%,热变性蛋白-酶解淀粉法提取率为27.08%,2种方法呈现显著性差异,产生差异的原因可能是碱溶酸沉将蛋白质取出的过程中带走了一部分SDF,而沸水浴除蛋白质的话,对于蛋白的去除来说更为彻底,所以热变性蛋白-酶解淀粉法的提取率更高一些。
通过对比热变性蛋白-酶解淀粉法和酶解淀粉-热变性蛋白法来提取SDF,热变性蛋白-酶解淀粉法提取率为27.08%,酶解淀粉-热变性蛋白法提取率为23.08%,2种方法呈现显著性差异,产生差异的原因可能是,采用酶解淀粉-热变性蛋白法的工艺是先用淀粉酶除去淀粉,再用酸沉除去蛋白质。图3结果显示,由于多糖网络结构中包裹着蛋白质颗粒,淀粉高温糊化阻止酸沉蛋白反应的进行,同时蛋白质受热后凝固,阻止了淀粉酶对淀粉的去除,不利于SDF的提取。而热变性蛋白-酶解淀粉法提取亚麻籽饼SDF的工艺是先用沸水浴除蛋白,后用α-淀粉酶除淀粉的工艺,从而能使酸以较快速度渗透到多糖网络中,更完全地沉降了蛋白质,故用热变性蛋白-酶解淀粉法的工艺提取率较高,李鹏飞等[12]在其提取方法对比中也有相关研究。
由于亚麻籽饼中也含有较多蛋白质,研究者希望在保留蛋白质的基础上,更好地将SDF从亚麻籽饼中提取出来,所以在酸沉蛋白-酶解淀粉法的基础上加入超声辅助进行亚麻籽饼SDF的提取[13]。如图所示,超声辅助-酸沉蛋白-酶解淀粉法对亚麻籽饼SDF提取率达到45.63%, 显著优于酸沉蛋白-酶解淀粉法。
2.4 单因素试验
经过对比可知,超声辅助-酸沉蛋白-酶解淀粉法对亚麻籽饼SDF的提取率均显著优于酸沉蛋白-酶解淀粉法、热变性蛋白-酶解淀粉法、酶解淀粉-热变性蛋白法。因此,选择酸沉蛋白-酶解淀粉法进行单因素试验,选取料液比、超声时间、超声功率、加酶量、酶解时间5个单因素来探究其对亚麻籽饼SDF提取率的影响,为响应面优化试验提供一定的参考。
在亚麻籽饼SDF的提取过程中,料液比对亚麻籽饼SDF提取率的影响如图5-A所示。随着料液比的升高,亚麻籽饼SDF 的提取率呈现先升高后下降的趋势。料液比会影响亚麻籽饼与提取液的接触面积,当料液比较小时,亚麻籽饼中的 SDF 与提取液难以充分接触,从而影响提取效率[14]。在料液比自 1∶10 增加至 1∶20的过程中,样品粉同提取液充分接触,反应越来越充分,SDF 提取率随之升高。当料液比达到 1∶20之后,碱液及酶液和底物已经充分接触,SDF 提取率最高,为 43.53%,此时底物中的大部分 SDF 已被提取,继续增加料液比对于 SDF 的提取率影响不大。当料液比过大时,反应底物和酶液及碱液的浓度减小,各反应物质分子之间的作用力减弱,使提取反应的效率降低;同时,提取液的体积越大,后续用于醇沉处理所需的 95%乙醇溶液越多,造成试剂的浪费。因此,综合考虑提取效率和成本,料液比以1∶20为宜。
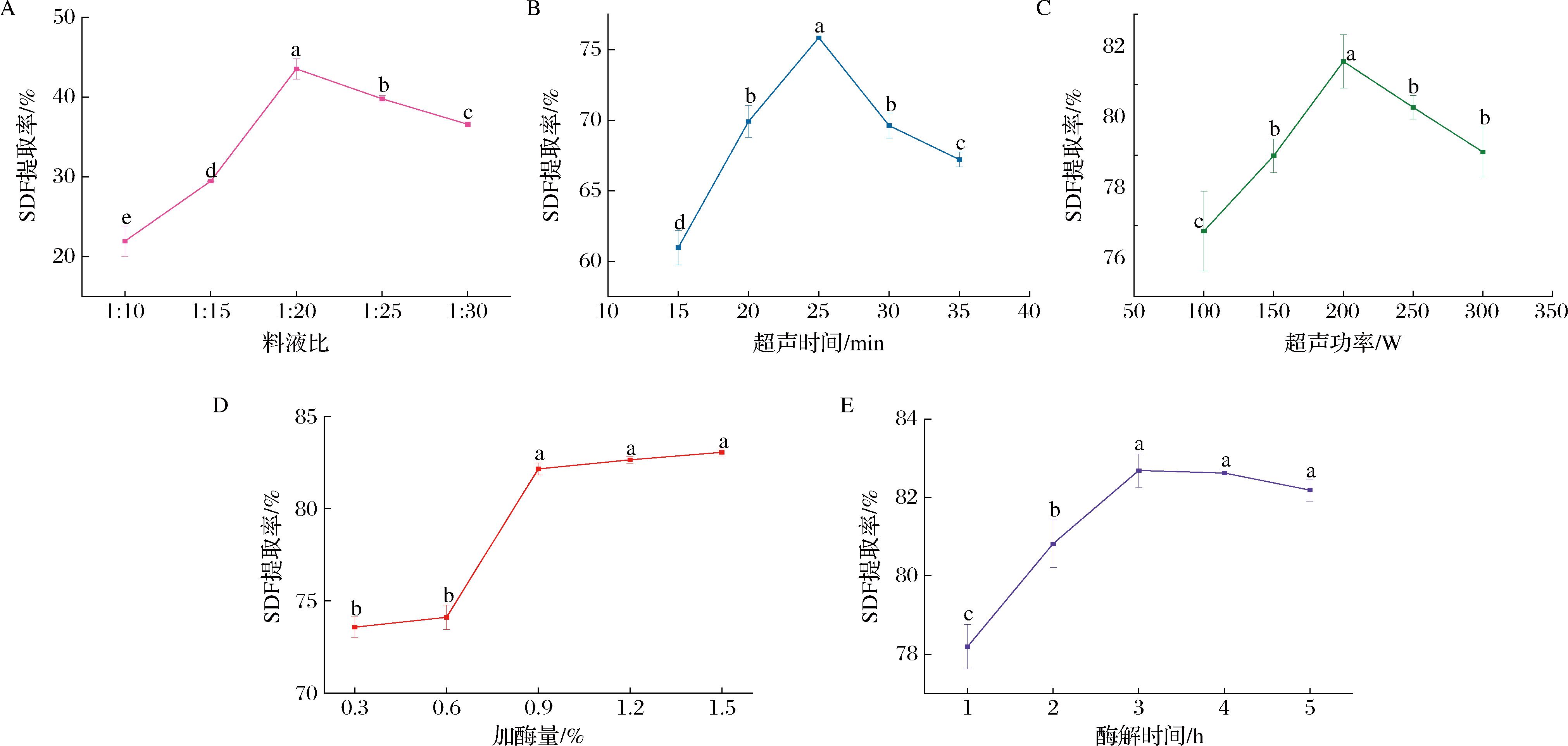
A-料液比;B-超声时间;C-超声功率;D-加酶量;E-酶解时间
图5 因素变化对亚麻籽饼SDF提取率的影响
Fig.5 Effects of different factors on SDF extraction rate of flaxseed cake
注:不同小写字母代表差异显著(P<0.05)。
如图5-B所示,随着超声时间从15 min延长到25 min,SDF的提取率从60.98%显著上升到75.85%(P<0.05),并且在超声时间25 min时达到最大值,之后随着时间的延长,提取率呈逐渐下降的趋势。分析其原因,可能是时间短,超声波对细胞壁的破坏较小,亚麻籽饼SDF释放得较少,随着时间的延长,超声波产生的空化作用增强,促进了物质的释放[15]。然而提取时间过长,提取率反而下降,一方面是由于随着时间的延长,遭到破坏的细胞壁等不溶性物质悬浮在水中,使溶剂的渗透性下降,另一方面是由于超声波的机械作用使多糖部分降解。
如图5-C所示,超声功率从100 W增加到200 W的过程中,提取率从76.85%增加到81.66%(P<0.05),在200 W时达到最大值。当超声功率超过200 W时,提取率反而呈下降趋势。分析其原因,可能是超声波功率过高,会产生较大的空化作用,对亚麻籽饼的结构造成破坏,导致大部分多糖降解,提取率下降。
如图5-D所示,酶添加量对亚麻籽饼SDF的提取率有较大影响,当酶添加量为0.3%~1.5%时,SDF提取率为73.58%~83.06%。随酶添加量的增加不断升高,这是由于酶含量过低,导致底物酶解不够充分,而适量的酶添加量能加快酶解速率,使淀粉酶解更为彻底。在加酶量为0.9%~1.5%,随着加酶量的增加,SDF提取率并没有显著性升高,且考虑到试验成本,即在酶添加量为0.9%时达到相对最大值,为82.16%,这与马凤等[16]利用酶解提取梨渣中SDF的研究规律一致。
如图5-E所示,亚麻籽饼SDF提取率在1~5 h随时间延长先上升后下降,在3 h时,提取率最高,为82.69%,在3 h之后提取率下降缓慢。这可能是由于在酶解的早期阶段,酶解时间短,由于酶与底物的作用不够充分,导致 SDF的提取率不高,当酶解时间延长后,相应地会增加酶与底物接触,导致酶解彻底,从而提高SDF含量。但是当酶解时间超过最适时间后,底物浓度不断下降,SDF含量越来越多,反而会在一定程度上抑制反应进行[17]。同时酶解时间越长,越易使纤维素和半纤维素等不溶性膳食纤维过度水解,部分SDF裂解或被氢离子水解,转化为分子聚合度更低的单糖,影响醇沉效果,进而降低SDF提取率[18-19],故酶解时间为3 h提取效果最佳。
2.5 响应面优化试验
通过单因素试验,确定了料液比、超声波时间和加酶量等影响因素来进行响应面优化试验,进一步优化亚麻籽饼SDF提取的工艺条件,具体试验条件见表4、表5,试验结果如图7所示。利用多元回归方程的软件拟合,得到回归方程模型为:
Y=103.98-0.03A+1.51B+0.28C+1.18AB+4.17AC+0.100BC-5.43A2-1.13B2-1.68C2
表4 响应面试验设计及结果
Table 4 Response surface test design and results
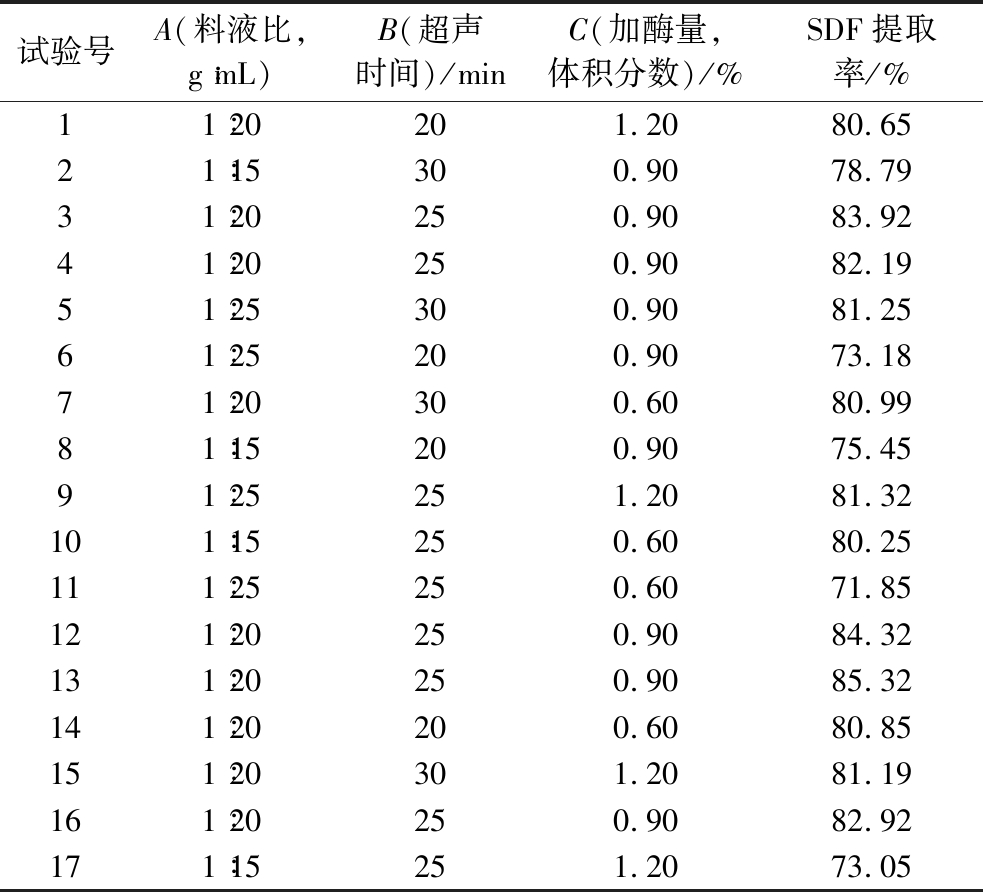
试验号A(料液比,g∶mL)B(超声时间)/minC(加酶量,体积分数)/%SDF提取率/%11∶20201.2080.6521∶15300.9078.7931∶20250.9083.9241∶20250.9082.1951∶25300.9081.2561∶25200.9073.1871∶20300.6080.9981∶15200.9075.4591∶25251.2081.32101∶15250.6080.25111∶25250.6071.85121∶20250.9084.32131∶20250.9085.32141∶20200.6080.85151∶20301.2081.19161∶20250.9082.92171∶15251.2073.05
表5 回归模型及方差分析结果
Table 5 Regression model and analysis of variance results
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
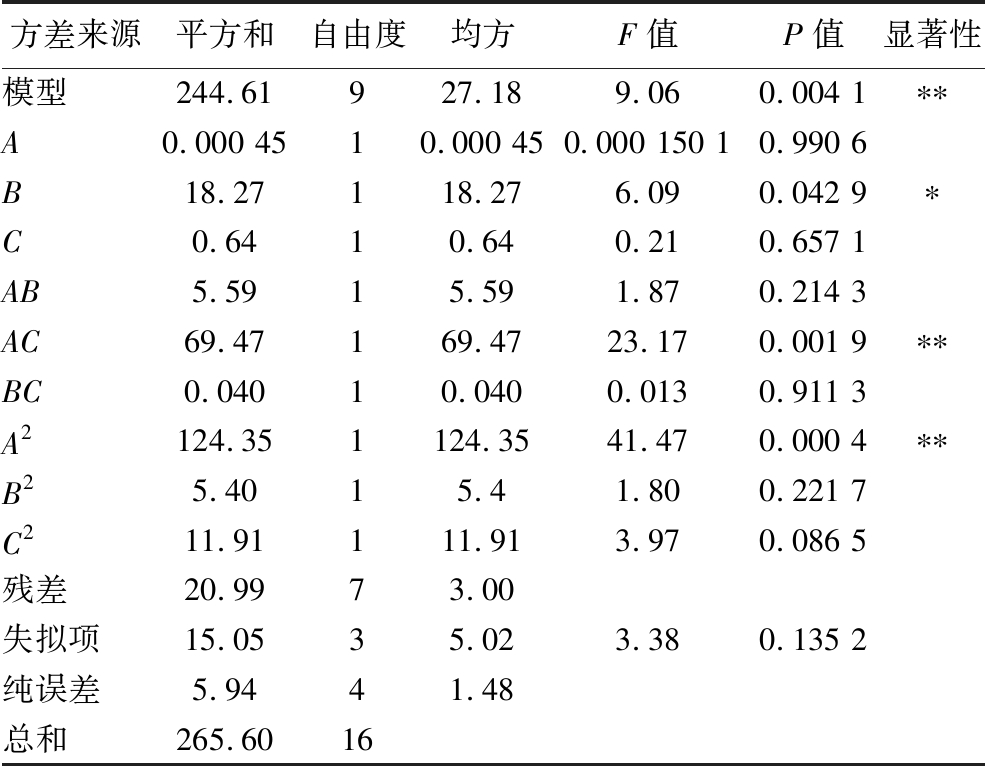
方差来源平方和自由度均方F值P值显著性模型244.61927.189.060.004 1∗∗A0.000 4510.000 450.000 150 10.990 6B18.27118.276.090.042 9∗C0.6410.640.210.657 1AB5.5915.591.870.214 3AC69.47169.4723.170.001 9∗∗BC0.04010.0400.0130.911 3A2124.351124.3541.470.000 4∗∗B25.4015.41.800.221 7C211.91111.913.970.086 5残差20.9973.00失拟项15.0535.023.380.135 2纯误差5.9441.48总和265.6016
结果显示,模型的P值为0.004 1,失拟项为0.135 2>0.05,可以说明此模型极其显著,与实际数据的吻合度很高,所以对SDF提取率的结果预测是可靠的。此外,模型的相关系数R2为0.921 0,相关系数越高说明模型与数据间存在强烈的相关性,反映出模型的拟合效果较好,并且试验误差保持在合理范围内。Adj-R2为0.819 4,说明回归方程可以较好地拟合参数的变化,这进一步证实了该模型在解释工艺过程中的有效性。综上所述,利用该回归模型优化提取工艺可获得较好的结果。
在试验范围内,根据F值比较不同自变量对提取率的影响[20]。根据试验结果,考虑到各个自变量对提取率的不同影响值,确定3个自变量的影响大小顺序,即超声时间>加酶量>料液比,超声时间对亚麻籽饼SDF提取率的影响最为显著。交互项AC的P值<0.05,交互项AB、BC的P值均大于0.05,表明料液比与加酶量之间的交互作用显著,而其余因素间交互作用均不显著。
2.6 交互作用对提取率的影响分析
为了清楚地显示各因子之间的交互作用对提取率的影响,根据所建的回归模型,画出了对应的响应面图。如图6所示,响应面曲线的斜率是对各工艺参数的敏感程度,曲线斜率越大,说明各工艺参数的变化对提取速率的影响越大;响应曲面曲线的斜率越小,说明环境变化对提取率的影响就越小。从图6图像上的变化可以看到,每个因素两两结合均为凸面,在平面投影均是圆形,可以说明随因变量之间交互作用的增强,SDF提取率先上升后下降,中间存在极值,结果与回归方程模型相符。
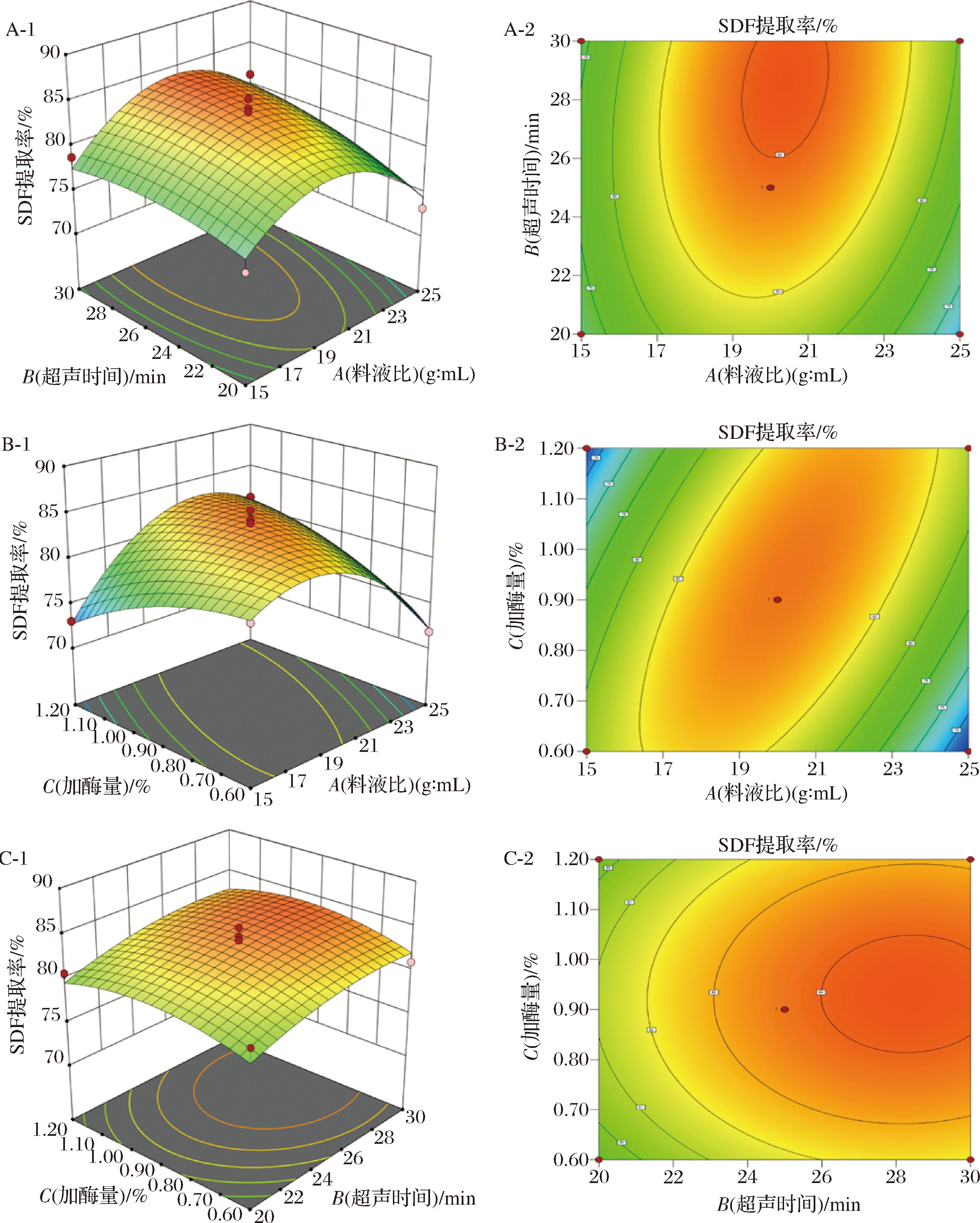
A-1、A-2-料液比和超声时间对提取率影响的响应面和等高线图;B-1、B-2-料液比和加酶量对提取率影响的响应面和等高线图;C-1、C-2-加酶量和超声时间对提取率影响的响应面和等高线图
图6 因变量之间交互作用对亚麻籽饼SDF提取率的影响
Fig.6 Influence of interaction between dependent variables on SDF extraction rate of flaxseed cake
2.7 最佳提取工艺条件的验证
回归模型预测的最佳提取工艺为:料液比1∶20、超声时间30.23 min、加酶量0.92%,在此条件下,回归分析模型预测出最佳的提取率为84.86%。同时,考虑到试验条件,对预测的提取工艺参数进行调整,调整后在料液比为1∶20、超声时间30 min、加酶量0.9%条件下进行3次重复试验,取平均数得到SDF提取率为(80.85±4.07)%,表明预测值与实际值吻合,表明该拟合模型对亚麻籽饼SDF的提取结果预测的可靠性。
2.8 亚麻籽饼SDF的单糖组成分析
SDF样品的单糖组成如图7所示。在亚麻籽饼SDF中发现7种单糖,包括Gal-UA、Fuc、Rha、Ara、Gal、Glc、Xly。由检测结果可知,SDF中含有(12.63±2.3)%的半乳糖醛酸、(6.47±0.4)%的岩藻糖、(22.81±1.2)%的鼠李糖、(10.57±0.6)%的阿拉伯糖、(20.57±0.2)%的半乳糖、(16.97±0.7)%的葡萄糖、(26.60±0.3)%的木糖。其中,鼠李糖、阿拉伯糖、半乳糖醛酸和半乳糖是果胶中的主要单糖,且这4种单糖占主要组成部分,可以推断SDF的主要成分是果胶[21]。木糖和半乳糖是半纤维素的典型组分[22],结果表明,提取的SDF中含有少量的半纤维素。鼠李糖和糖醛酸被认为广泛存在于植物细胞壁中[23], 且与细胞的氧化耐受性密切相关[24]。其中,鼠李糖、岩藻糖、半乳糖醛酸和半乳糖总和占较大比例,可见亚麻籽饼SDF主要是由酸性杂多糖组成[25]。
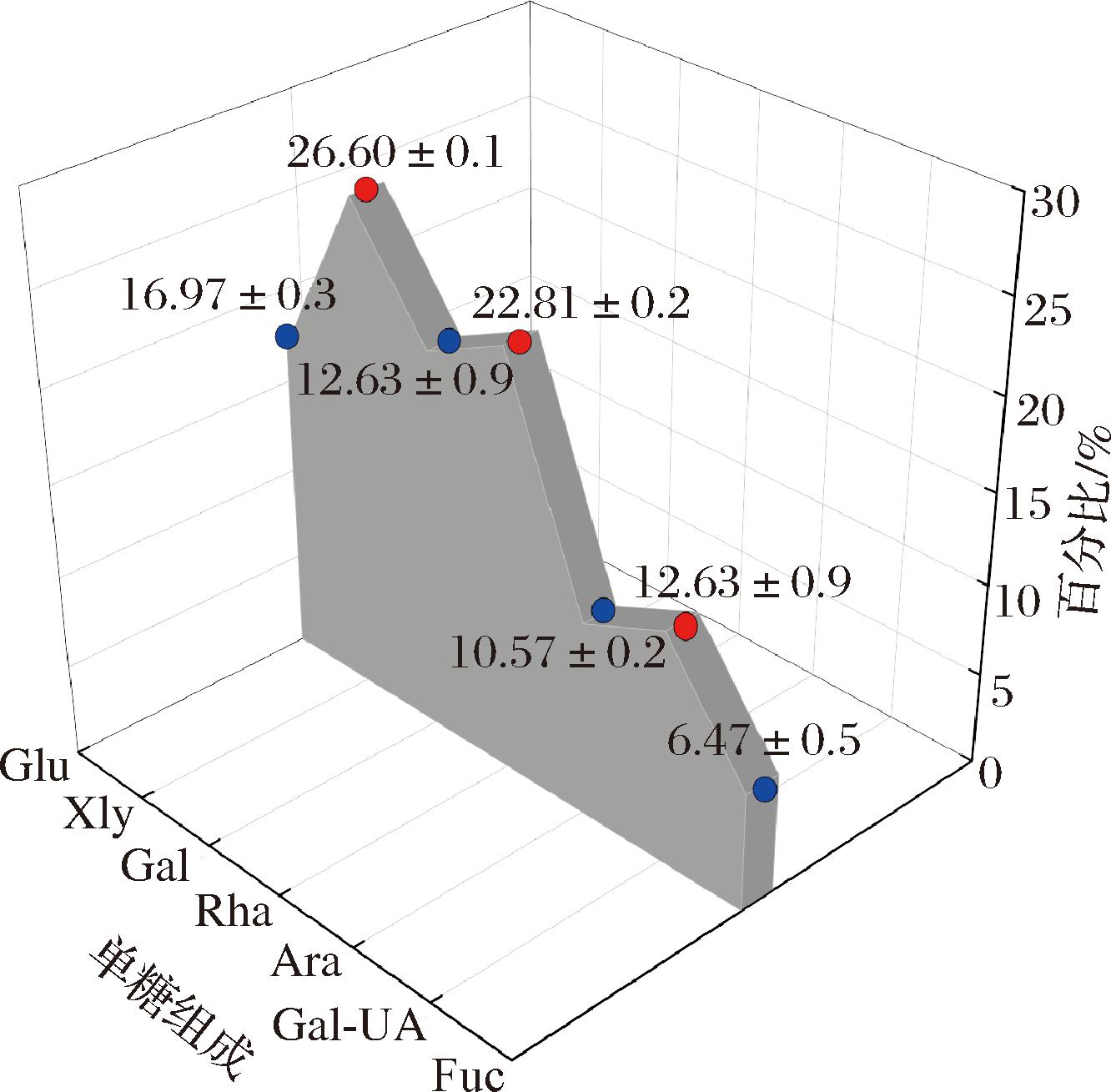
图7 亚麻籽饼SDF的单糖组成分布图
Fig.7 Monosaccharide composition distribution of flaxseed cake SDF
2.9 亚麻籽饼SDF的分子质量分布
如图8-A所示,用黑色线条表示多角度激光散射信号(单位是V),被散射光的强度与物质分子大小、分子质量大小成正比;虚线代表示差信号(单位是RIU),柱后出液折射率的改变对响应值的影响变化,与物质的类型、浓度和分子质量均有关[26];红线是用2个信号对分子质量的拟合[27]。如图所示,出峰时间为19.6 min,重均分子质量(Mw)为531.691 kDa,Z均分子质量(Mz)为1 493.566 kDa,数均分子质量(Mn)35.053 kDa。通过比较多分散指数(polydispersity index,PDI)可以定量确定多糖的分布,其定义为 Mw/Mn,PDI越大,分子质量分布越集中[28]。SDF的PDI为15.168。如若分子质量分布均匀且集中,将大大提高其应用效果,更易转变为水凝胶且在酸性乳液系统中抑制蛋白析出的稳定性[7]。
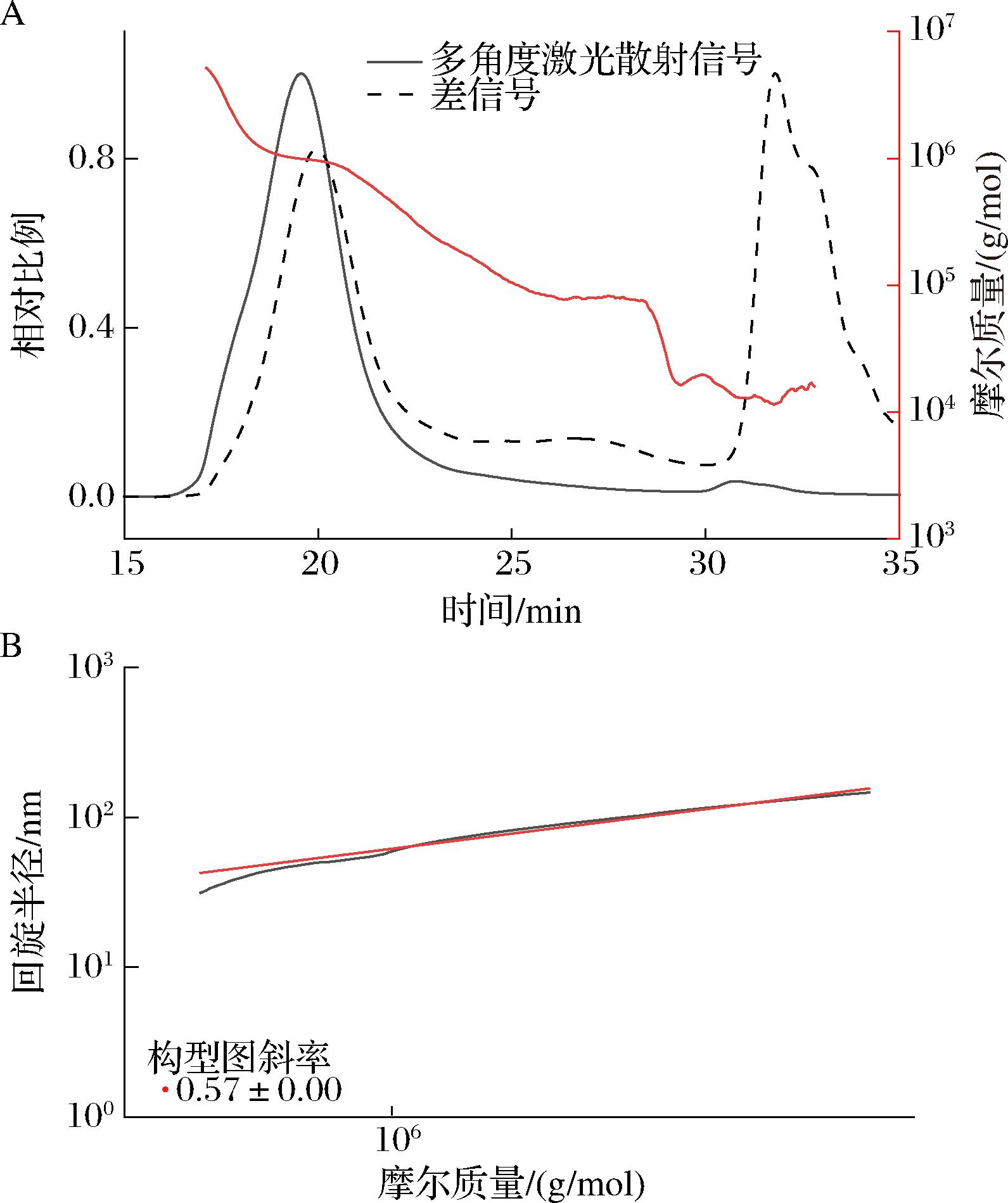
A-分子质量分布曲线;B-分子构型图
图8 亚麻籽饼SDF分子质量分布及构型
Fig.8 Absolute molecular weight analysis of SDF in flaxseed cake
亚麻籽饼SDF在水分散液中的分子构象如图8-B所示,图中是高分子的平均分子质量与其均方旋转半径(S2)之间的关系获得关于多糖分子构象的信息。Mw与S2之间存在着明显的线性关系,通过拟合可得到其斜率k为0.58,当k<0.77时,为球状构象[29]。因此推测亚麻籽饼SDF是以无规则卷曲球状构象存在于溶液中。
2.10 亚麻籽饼SDF的微观形貌分析
SDF的微观结构影响着其功能特性。在不同放大倍数下观察到2种SDF的微观形貌,如图9所示。市售小麦SDF表面呈现疏松多孔的微观形貌,在相同放大倍数下观察到,市售小麦SDF的颗粒比亚麻籽饼SDF的更大。亚麻籽饼SDF颗粒更为密集且相比于小麦SDF来说表面小颗粒较多,这种微观结构特征的主要原因可能是超声波对多糖聚集体的破坏及降解,导致 SDF的结构疏松且较为粗糙,在WANG等[30]、YAN等[31]的研究报道中也观察到类似的现象。亚麻籽饼SDF的这种微观形貌特点,使其与其他物质接触时表面积相对较大,这意味着SDF与油或水结合时,可能具有比市售小麦SDF更好的持水和持油能力[32]。

A-1-亚麻籽饼SDF,放大倍数为600×;A-2-亚麻籽饼SDF,放大倍数为2 400×;B-1-市售小麦SDF,放大倍数为600×;B-2-市售小麦SDF,放大倍数为2 400×
图9 不同样品SDF的微观形貌分析
Fig.9 Microscopic morphology analysis of SDF from different samples
3 结论
明晰亚麻籽饼中各组分间的存在状态是选择适当方法提高亚麻籽饼SDF提取率的重要前提。本研究首次明确了亚麻籽饼原料是由多糖网络结构包裹着蛋白质颗粒而存在的基本组分分布规律,基于此,通过对比酸沉蛋白-酶解淀粉法、热变性蛋白-酶解淀粉法、酶解淀粉-热变性蛋白法、超声辅助-酸沉蛋白-酶解淀粉法4种提取方法对亚麻籽饼SDF提取效果的影响,构建了高效的超声辅助-酸沉蛋白-酶解淀粉法用于亚麻籽饼SDF的提取。且以料液比、超声时间、超声功率、酶解时间、加酶量为自变量,通过单因素和响应面试验得到在亚麻籽饼中利用超声辅助-酸沉蛋白-酶解淀粉法提取SDF的最优工艺条件:料液比1∶20(g∶mL)、超声时间30 min、超声功率200 W、加酶量为0.9%、酶解时间3 h,此条件下亚麻籽饼SDF提取率为85.32%。另外,本研究也从微观形貌、单糖组成、分子质量分布等方面对亚麻籽饼SDF进行了结构表征,考虑后期可从其他结构层面进行深入探讨,为其功能特性的研究提供更多的理论支撑。
[1] TROWELL H.The development of the concept of dietary fiber in human nutrition[J].The American Journal of Clinical Nutrition, 1978, 31(10 Suppl):S3-S11.
[2] ZHANG M Y, LIAO A M, THAKUR K, et al.Modification of wheat bran insoluble dietary fiber with carboxymethylation, complex enzymatic hydrolysis and ultrafine comminution[J].Food Chemistry, 2019, 297:124983.
[3] BAGHERIAN H,ZOKAEE ASHTIANI F, FOULADITAJAR A, et al.Comparisons between conventional, microwave- and ultrasound-assisted methods for extraction of pectin from grapefruit[J].Chemical Engineering and Processing:Process Intensification, 2011, 50(11-12):1237-1243.
[4] SANTALA O, KIRAN A, SOZER N, et al.Enzymatic modification and particle size reduction of wheat bran improves the mechanical properties and structure of bran-enriched expanded extrudates[J].Journal of Cereal Science, 2014, 60(2):448-456.
[5] MOCZKOWSKA M, KARP S, NIU Y G, et al.Enzymatic, enzymatic-ultrasonic and alkaline extraction of soluble dietary fibre from flaxseed—A physicochemical approach[J].Food Hydrocolloids, 2019, 90:105-112.
[6] 陈清泰. 微藻中油脂的高效分离及萃余物加氢液化研究[D]. 东营: 中国石油大学(华东), 2019.CHEN Q T. Study on efficient separation of oil from microalgae and hydroliquefaction of extracts[D]. Dongying: China University of Petroleum (Huadong), 2019.
[7] 张岱玉. 豆渣中果胶类多糖和膳食纤维的制备及其性能研究[D]. 广州: 华南理工大学, 2022.ZHANG D Y. Study on preparation and properties ofpectin polysaccharide and diet fiber from soybean dregs[D]. Guangzhou: South China University of Technology, 2022.
[8] 武利霞. 麦麸水溶性膳食纤维的制备、功能特性及其在饼干中的应用研究[D]. 镇江: 江苏大学, 2020.WU L X. Study on preparation, functional characteristics and application of water-soluble dietary fiber from wheat bran in biscuits[D]. Zhenjiang: Jiangsu University, 2020.
[9] 杨超然. 油茶粕可溶性膳食纤维发酵改性菌株筛选及改性纤维功能活性探究[D]. 南昌: 南昌大学, 2023.YANG C R. Screening of fermentation modified strains of soluble dietary fiber from Camellia oleifera meal and exploration of functional activity of modified fiber[D]. Nanchang: Nanchang University, 2023.
[10] 李可. 亚麻籽粕膳食纤维的提取工艺研究[D]. 乌鲁木齐: 新疆农业大学, 2013.LI K. Study on extraction technology of dietary fiber from flaxseed meal[D]. Urumqi: Xinjiang Agricultural University, 2013.
[11] 姚思含, 廖敏和, 康佳欣, 等.酶辅助三相分离法同时提取亚麻籽油、亚麻籽蛋白和亚麻籽胶工艺优化[J].中国油脂, 2022, 47(3):11-17.YAO S H, LIAO M H, KANG J X, et al.Optimization of simultaneous extraction of oil, protein and gum from flaxseed by enzyme-assisted three phase partitioning[J].China Oils and Fats, 2022, 47(3):11-17.
[12] 李鹏飞, 陆红佳, 任志远.不同方法提取麦麸膳食纤维的比较研究[J].现代农业科学, 2009, 16(6):7-9.LI P F, LU H J, REN Z Y.Comparative study on different methods of wheat bran dietary fiber yield[J].Modern Agricultural Sciences, 2009, 16(6):7-9.
[13] GAN J P, HUANG Z Y, YU Q A, et al.Microwave assisted extraction with three modifications on structural and functional properties of soluble dietary fibers from grapefruit peel[J].Food Hydrocolloids, 2020, 101:105549.
[14] 包怡红, 冯雁波.响应面试验优化红松松仁膳食纤维制备工艺及其理化性质分析[J].食品科学, 2016, 37(14):11-17.BAO Y H, FENG Y B.Dietary fiber from pine kernel meal:Optimization of extraction process by response surface methodology and physicochemical properties[J].Food Science, 2016, 37(14):11-17.
[15] 任雪娇. 亚麻籽胶超声辅助提取条件优化及其热稳定性研究[J].食品工业, 2023, 44(3):5-9.REN X J.Optimization of ultrasound-assisted extraction of flaxseed gum and study on its thermal stability[J].The Food Industry, 2023, 44(3):5-9.
[16] 马凤, 张振宇, 陈启苗, 等.梨渣可溶性膳食纤维提取工艺优化及功能特性分析[J].现代食品科技, 2024, 40(3):229-238.MA F, ZHANG Z Y, CHEN Q M, et al.Extraction process optimization and analysis of functional characteristics of soluble dietary fibers of pear pomace[J].Modern Food Science and Technology, 2024, 40(3):229-238.
[17] 张世仙, 从凯龙, 曾启华, 等.酶法提取茅台酒糟中水溶性膳食纤维的工艺研究[J].中国酿造, 2012, 31(3):97-100.ZHANG S X, CONG K L, ZENG Q H, et al.Extraction technology of water-soluble dietary fiber from Moutai vinasse by enzymatic extraction[J].China Brewing, 2012, 31(3):97-100.
[18] 韩林, 吴应梅, 汪开拓, 等.火棘果水溶性膳食纤维酶法制备工艺及单糖成分和物化性质研究[J].食品工业科技, 2015, 36(17):215-219.AN L, WU Y M, WANG K T, et al.Study on the monosaccharide compositions, physico- properties and preparation technology of soluble dietary fiber by enzymatic method from Pyracantha fortuneana[J].Science and Technology of Food Industry, 2015, 36(17):215-219.
[19] 杭瑜瑜, 于淑池, 王和飞.响应曲面法优化百香果皮可溶性膳食纤维的制备工艺及其理化性质研究[J].中国食品添加剂, 2021, 32(9):79-89.HANG Y Y, YU S C, WANG H F.Soluble dietary fiber extraction from passion fruit peel by response surface method and its physicochemical properties[J].China Food Additives, 2021, 32(9):79-89.
[20] QI Y Q, LIU G Y, ZHANG Z, et al.Optimization of green extraction process of Cinnamomum camphora fruit dye and its performance by response surface methodology[J].BioResources, 2023, 18(3):4916-4934.
[21] ALBA K, OFFIAH V, LAWS A P, et al.Baobab polysaccharides from fruits and leaves[J].Food Hydrocolloids, 2020, 106:105874.
[22] FENG Z Q, DOU W, ALAXI S, et al.Modified soluble dietary fiber from black bean coats with its rheological and bile acid binding properties[J].Food Hydrocolloids, 2017, 62:94-101.
[23] JIANG N, DILLON F M, SILVA A, et al.Rhamnose in plants - from biosynthesis to diverse functions[J].Plant Science, 2021, 302:110687.
[24] 栾翠荣, 温南华, 李致瑜, 等.马尾藻多糖超声波辅助提取、结构表征及抗氧化活性研究[J].食品与发酵工业, 2025,51(7): 259-267.LUAN C R, WEN N H, LI Z Y, et al.Ultrasonic-assisted extraction, structural characterization, and antioxidant activityof Sargassum polysaccharide[J].Food and Fermentation Industries, 2025,51(7): 259-267.
[25] HIGA F A, NICKERSON M T.Plant protein-carbohydrate conjugates:A review of their production, functionality and nutritional attributes[J].Food Reviews International, 2023, 39(2):750-771.
[26] WANG L, ZHANG B, XIAO J, et al.Physicochemical, functional, and biological properties of water-soluble polysaccharides from Rosa roxburghii Tratt fruit[J].Food Chemistry, 2018, 249:127-135.
[27] SALVADOR L D, SUGANUMA T, KITAHARA K, et al.Monosaccharide composition of sweetpotato fiber and cell wall polysaccharides from sweetpotato, cassava, and potato analyzed by the high-performance anion exchange chromatography with pulsed amperometric detection method[J].Journal of Agricultural and Food Chemistry, 2000, 48(8):3448-3454.
[28] ZHU M Q, HUANG R M, WEN P, et al.Structural characterization and immunological activity of pectin polysaccharide from kiwano (Cucumis metuliferus) peels[J].Carbohydrate Polymers, 2021, 254:117371.
[29] JI R, ZHANG X L, LIU C H, et al.Effects of extraction methods on the structure and functional properties of soluble dietary fiber from blue honeysuckle (Lonicera caerulea L.) berry[J].Food Chemistry, 2024, 431:137135.
[30] WANG L, XU H G, YUAN F, et al.Preparation and physicochemical properties of soluble dietary fiber from orange peel assisted by steam explosion and dilute acid soaking[J].Food Chemistry, 2015, 185:90-98.
[31] YAN X G, YE R, CHEN Y.Blasting extrusion processing:The increase of soluble dietary fiber content and extraction of soluble-fiber polysaccharides from wheat bran[J].Food Chemistry, 2015, 180:106-115.
[32] 王梦阳.香蕉皮膳食纤维的理化性质及其降血糖效果的研究[D].合肥:合肥工业大学, 2022.WANG M Y.Study on physicochemical properties and hypoglycemic effect of banana peel dietary fiber[D].Hefei:Hefei University of Technology, 2022.