致病性大肠杆菌(pathogenic Escherichia coli)能够在人体内引起多种症状,是消化道细菌感染的最主要病原菌[1]。食源性和水源性大肠杆菌是感染的主要途径[2]。按致病作用分类,致病性大肠杆菌主要分为肠出血性大肠杆菌(enterohemorrhagic E.coli,EHEC)、肠致病性大肠杆菌(enteropathogenic E.coli,EPEC)、产肠毒素大肠杆菌(enterotoxigenic E.coli,ETEC)、肠道侵袭性大肠杆菌(enteric invasive E.coli,EIEC)和肠聚集性大肠杆菌(enteroaggregative E.coli,EAEC),主要引起腹泻等肠道疾病[3]。此外致病性大肠杆菌还会造成尿路感染病并造成多种并发症,定植于膀胱会引起膀胱炎,也可以通过输尿管进入肾脏,导致肾盂肾炎[4]。迄今为止,致病性大肠杆菌造成了严重的公共卫生问题,并且在发展中国家引起了数次致命的爆发[5]。更加严重的是,致病性大肠杆菌的抗生素耐药性正在上升,在目前世界卫生组织列出的12种抗生素耐药性“重点病原体”中排名第三[6]。因此寻找致病性大肠杆菌的抑制剂,从食品等源头解决大肠杆菌感染这一卫生问题十分有必要。
甘草(Glycyrrhiza uralensis)是我国传统大宗药材,早在原卫生部2002年的《既是食品又是药品的物品名单》就被列为药食同源原料。甘草在食品加工中有非常广泛的应用前景,不仅可以作为增甜剂和增香剂[7],还有研究表明甘草提取物可以作为抑菌剂添加到牛奶中[8]。甘草主要含有黄酮类、三萜皂苷类、香豆素类、氨基酸类以及挥发油类等成分[9],其中甘草黄酮对常见致病菌如大肠杆菌、金黄色葡萄球菌和铜绿假单胞菌等均有良好的抑菌效果[10]。黄酮类化合物可以破坏细菌细胞壁及细胞膜的完整性,导致膜的电子传递、营养吸收、细胞核内核苷酸合成及ATP活性功能障碍从而抑制细菌繁殖[11]。甘草黄酮提取液对金黄色葡萄球菌、大肠杆菌、枯草芽孢杆菌及黑曲霉和青霉均具有明显的抑菌活性,最小抑菌浓度分别为0.062 5、0.031 3、0.062 5、0.150 0、0.250 0 mg/mL[12]。甘草醇提液抑菌机制为破坏菌体细胞膜,使内容物外漏,提取液进入细胞后还可以通过破坏大分子物质结构或抑制蛋白的合成,扰乱菌体细胞正常的代谢和生理活动以达到抑菌效果[13]。由此可见,对甘草中的活性成分进行详细研究有望将其应用于抑菌剂的开发,对降低致病性大肠杆菌的感染风险具有现实意义。
网络药理学运用生物分子网络的方法分析药物“多组分、多靶点、多途径”与疾病相互作用,通过系统研究药物-疾病网络可以直观地分析相关疾病、化合物、靶点、途径和其他因素的相互关系,更好地解释它们的物质基础和作用原理[14],有利于中药药效成分的筛选及机制探究[15]。本研究将通过网络药理学和分子对接初步探究甘草活性成分抑制大肠杆菌的机制,并且根据抑制5种致病性大肠杆菌的关键靶点,结合分子对接结果分析甘草抑制致病性大肠杆菌的主要活性成分并通过体外抑菌实验进行验证,为探究甘草抑制大肠杆菌的机制及发掘甘草中抑制致病性大肠杆菌的关键成分提供理论与实验基础。
1 材料与方法
1.1 材料与试剂
5种致病性大肠杆菌(EHEC、EPEC、ETEC、EIEC、EAEC),南京中医药大学医学院;柚皮素,上海源叶生物科技有限公司;异芒柄花素,成都普思生物科技股份有限公司;3″-甲氧基光甘草定,北京精华耀邦医药科技公司;BeyoPureTM LB肉汤培养基预混粉末,上海碧云天生物技术股份有限公司;二甲基亚砜(dimethyl sulfoxide,DMSO),上海麦克林生化科技股份有限公司。
1.2 仪器与设备
GR85DA大容量灭菌锅,致微(厦门)仪器有限公司;SPX-150BⅢ生化培养箱,天津市泰斯特仪器有限公司;MSC-ADVANTAGE生物安全柜,赛默飞世尔科技公司;SuPerMax 3000FA多功能酶标仪,上海闪谱生物科技有限公司。
1.3 实验方法
1.3.1 甘草-大肠杆菌抑菌-成分-靶点网络构建
通过TCMSP数据库筛选甘草活性成分和靶点,以口服利用度(oral bioavailability,OB)≥30%和类药性(drug-likeness,DL)≥0.18为条件筛选活性成分[16]。采用PubChem和Chemical book在线化合物查询网站核对活性成分的名称是否与CAS号对应,尤其是TCMSP数据库中出现一个化合物对应多个CAS号时。通过UniPort数据库获取活性成分对应的靶点的Uniport ID和gene ID。以“Inhibiting E.coli”为关键词,通过Genecards数据库和OMIM数据库获取大肠杆菌抑菌靶点的gene ID并去重。通过jvenn在线平台[17]绘制Venn图获取甘草活性成分对应靶点与抑制大肠杆菌相关靶点的交集靶点。获得符合条件的甘草活性成分对应靶点与抑制大肠杆菌相关靶点的交集靶点后,使用Cytoscape 3.10.1软件构建“甘草-抑菌-成分-靶点”可视化网络图。
1.3.2 蛋白互作网络(protein-protein interaction,PPI)构建
将甘草与大肠杆菌抑菌交集靶点导入String在线分析平台中“Multiple protein”栏,设定物种“Homo Sapiens”、将最低相互作用阈值(minimum required interaction score)设置为“medium confidence 0.400”构建PPI,下载数据后导入Cytoscape 3.10.1软件进行拓扑分析,按degree值排序筛选甘草活性成分抑制大肠杆菌的关键靶点。
1.3.3 GO功能和KEGG通路富集分析
将交集靶点输入至Metascape在线分析平台,以P≤0.01为前提进行GO分析和KEGG通路分析。使用微生信在线绘图平台,根据GO富集分析前10条绘制富集数量统计柱状图,选取KEGG富集分析前20条信号通路绘制富集显著性气泡图[18]。
1.3.4 致病性大肠杆菌抑菌靶点发掘
分别以“Inhibiting EHEC”、“Inhibiting EPEC”、“Inhibiting ETEC”、“Inhibiting EIEC”和“Inhibiting EAEC”为关键词在Genecards数据库和OMIM数据库搜索抑制5种致病性大肠杆菌的关键靶点,通过jvenn在线平台绘制5元交集Venn图,获取抑制5种致病性大肠杆菌的共同靶点。
1.3.5 分子对接
选取PPI网络中degree值>20的靶点,在AlphaFold数据库中根据Uniprot ID查找对应的蛋白并下载pdb格式的3D结构文件。在Chemical book或Pubchem下载抑菌度值>10活性成分的结构式并通过Chem 3D转化为pdb格式文件。使用AutodockTools 1.5.7软件对蛋白质进行除去水分子和加氢等操作,将处理后的蛋白质结构和活性成分结构在AutodockTools 1.5.7软件中进行分子对接。对接结果的结合能越小代表活性成分与靶点间亲和力越强,结合能<0 kcal/mol代表蛋白质与小分子能自发结合,<-5 kcal/mol表明结合良好。通过热图直观显示关键活性成分与大肠杆菌抑菌靶点的结合能。
根据1.3.4节中筛选出的抑制致病性大肠杆菌关键靶点以及PPI中degree值前5的抑制大肠杆菌的靶点,挑选出抑制致病性大肠杆菌的最主要靶点。选择与每个靶点结合能前4低的活性成分通过PyMol 2.4程序构建可视化分子对接结果。本研究使用的所有数据库及分析平台见表1。
表1 本研究使用的数据库及分析平台
Table 1 Databases and analysis platforms used in this study
数据库及平台网址TCMSPhttps://old.tcmsp-e.com/index.phpChemical bookhttps://www.chemicalbook.com/ProductIndex.aspxPubchemhttps://pubchem.ncbi.nlm.nih.gov/GeneCcardshttps://www.genecards.org/OMIMhttps://www.ncbi.nlm.nih.gov/omim/AlphaFoldhttps://alphafold.com/Metascapehttps://metascape.org/gp/Stringhttps://cn.string-db.org/微生信https://www.bioinformatics.com.cn/
1.3.6 最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)测定
采用二倍稀释法测定关键抑菌成分的抑菌活性。吸取LB培养基100 μL至96孔细胞培养板第1列,再分别加入柚皮素、异芒柄花素和3″-甲氧基光甘草定药物溶液,使初始质量浓度为10 μg/mL。共获得9个浓度梯度,最小质量浓度为0.039 μg/mL。向每个孔中加入100 μL对数生长期的菌液,浓度约为105 CFU/mL。阳性对照仅含培养基和菌液,阴性对照仅含培养基。37 ℃培养24 h后测定OD600,抑菌率80%的药物浓度作为MIC判读相应药物的MIC值,抑菌率的计算如公式(1)所示:
抑菌率![]()
(1)
将MIC、2MIC、4MIC孔内液体均匀涂布于LB平板,以无菌落生长的浓度作为MBC。
2 结果与分析
2.1 甘草-大肠杆菌抑菌-成分-靶点网络图的构建
TCMSP数据库共筛选出86个符合条件的活性成分,共对应了213个靶点。通过GeneCards和OMIM在线数据库以“Inhibiting E.coli”为关键词搜索抑制大肠杆菌的相关靶点,去重后共获得1 598个靶点。活性成分靶点与抑菌靶点取交集后得到93个交集靶点(图1)。利用Cytoscape 3.10.0软件构建“甘草-大肠杆菌抑菌-成分-靶点”的可视化网络图(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.041716)。作用靶点越多的活性成分抑菌度值越高,其中槲皮素(69)、山柰酚(30)、柚皮素(18)、芒柄花素(16)、7-甲氧基-2-甲基异黄酮(16)、异鼠李素(14)和甘草查尔酮A(14)的对应的相关靶点数目位于前列。表2显示了所有抑菌度值≥10的活性成分。
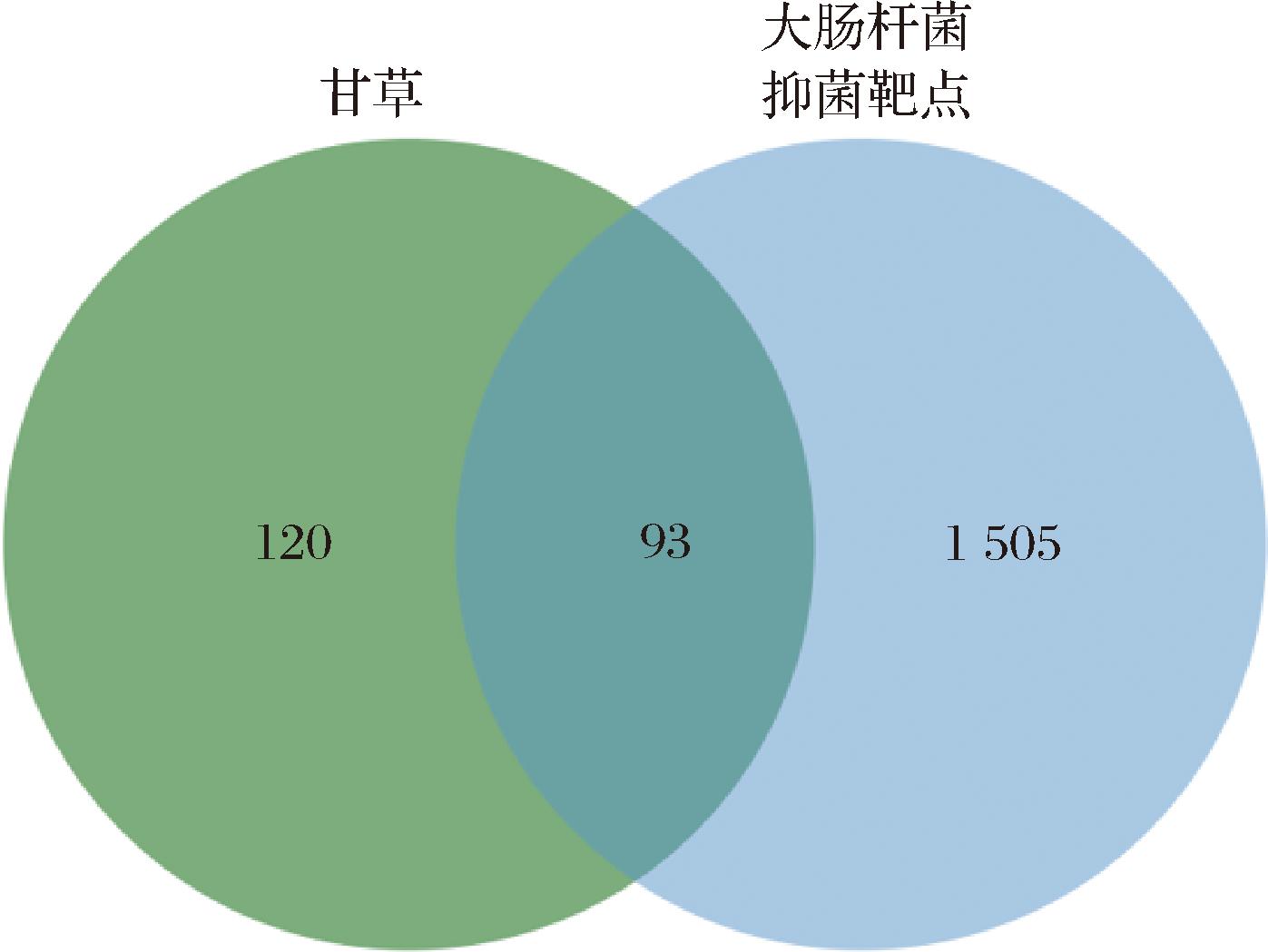
图1 甘草-抑制大肠杆菌靶点Venn图
Fig.1 Venn diagram of G.uralensis-inhibiting E.coli targets
表2 抑菌度值>10的活性成分
Table 2 Active ingredients with antibacterial degree>10
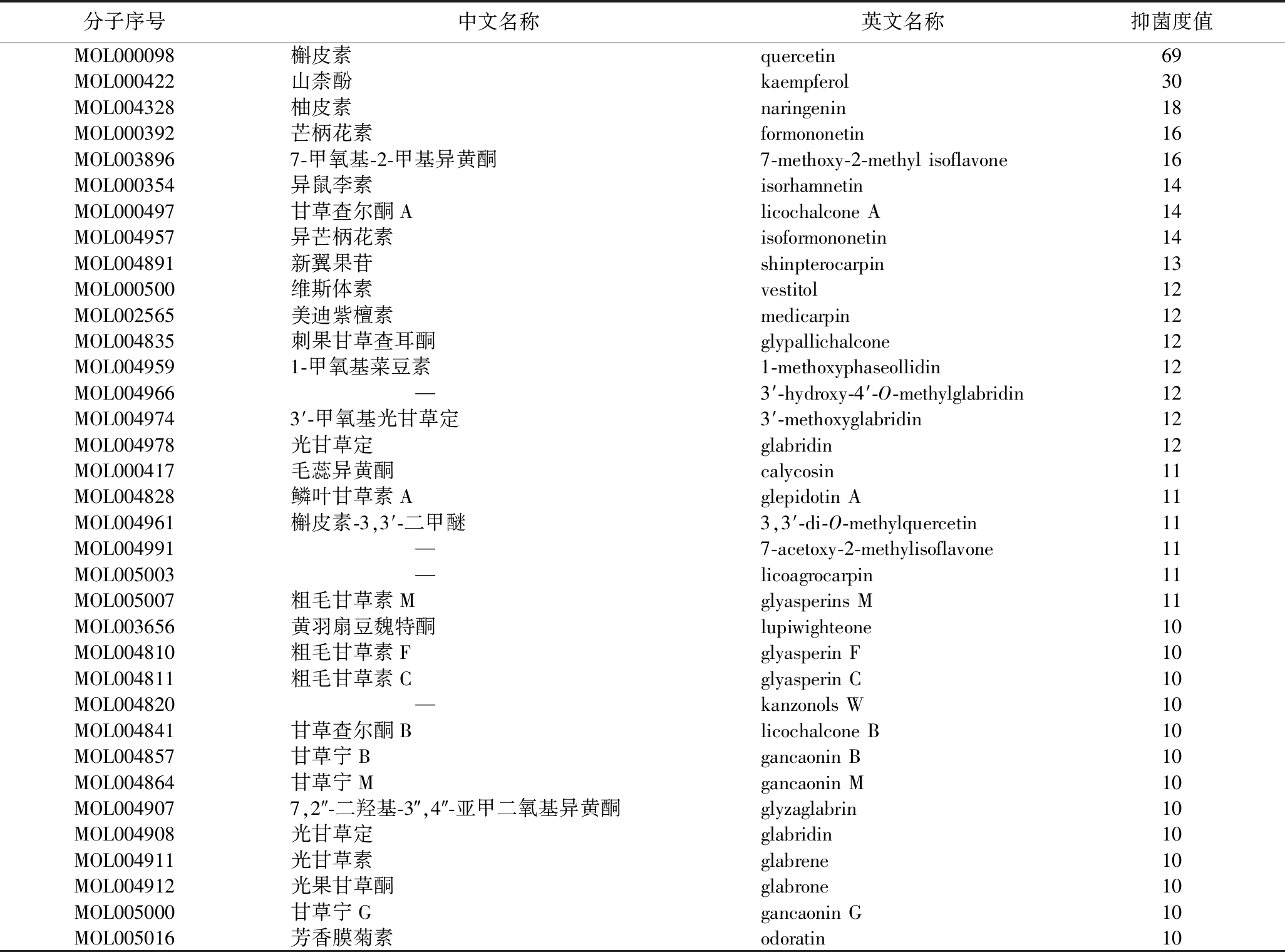
注:“—”表示暂无中文注释。
分子序号中文名称英文名称抑菌度值MOL000098槲皮素quercetin69MOL000422山柰酚kaempferol30MOL004328柚皮素naringenin18MOL000392芒柄花素formononetin16MOL0038967-甲氧基-2-甲基异黄酮7-methoxy-2-methyl isoflavone16MOL000354异鼠李素isorhamnetin14MOL000497甘草查尔酮Alicochalcone A14MOL004957异芒柄花素isoformononetin14MOL004891新翼果苷shinpterocarpin13MOL000500维斯体素vestitol12MOL002565美迪紫檀素medicarpin12MOL004835刺果甘草查耳酮glypallichalcone12MOL0049591-甲氧基菜豆素1-methoxyphaseollidin12MOL004966—3′-hydroxy-4′-O-methylglabridin12MOL0049743′-甲氧基光甘草定3′-methoxyglabridin12MOL004978光甘草定glabridin12MOL000417毛蕊异黄酮calycosin11MOL004828鳞叶甘草素Aglepidotin A11MOL004961槲皮素-3,3′-二甲醚3,3′-di-O-methylquercetin11MOL004991—7-acetoxy-2-methylisoflavone11MOL005003—licoagrocarpin11MOL005007粗毛甘草素Mglyasperins M11MOL003656黄羽扇豆魏特酮lupiwighteone10MOL004810粗毛甘草素Fglyasperin F10MOL004811粗毛甘草素Cglyasperin C10MOL004820—kanzonols W10MOL004841甘草查尔酮Blicochalcone B10MOL004857甘草宁Bgancaonin B10MOL004864甘草宁Mgancaonin M10MOL0049077,2″-二羟基-3″,4″-亚甲二氧基异黄酮glyzaglabrin10MOL004908光甘草定glabridin10MOL004911光甘草素glabrene10MOL004912光果甘草酮glabrone10MOL005000甘草宁Ggancaonin G10MOL005016芳香膜菊素odoratin10
2.2 甘草抑制大肠杆菌关键靶点
为进一步确认甘草活性成分抑制大肠杆菌的关键作用靶点,将93个交集靶点输入String数据库进行分析,构建甘草抑菌活性成分对应靶点的PPI(附图2,https://doi.org/10.13995/j.cnki.11-1802/ts.041716)。靶点以圆圈表示,靶点面积越大且绿色越深,degree值越大。最终获得1 561条靶点间连接键,degree值大于平均值的关键作用靶点有45个,其中degree值排前5的靶点分别为TNF(74)、IL6(73)、TP53(72)、JUN(72)、STAT3(71),这些靶蛋白位于网络中核心位置,预示其可能在甘草抑制大肠杆菌的过程中发挥重要作用。
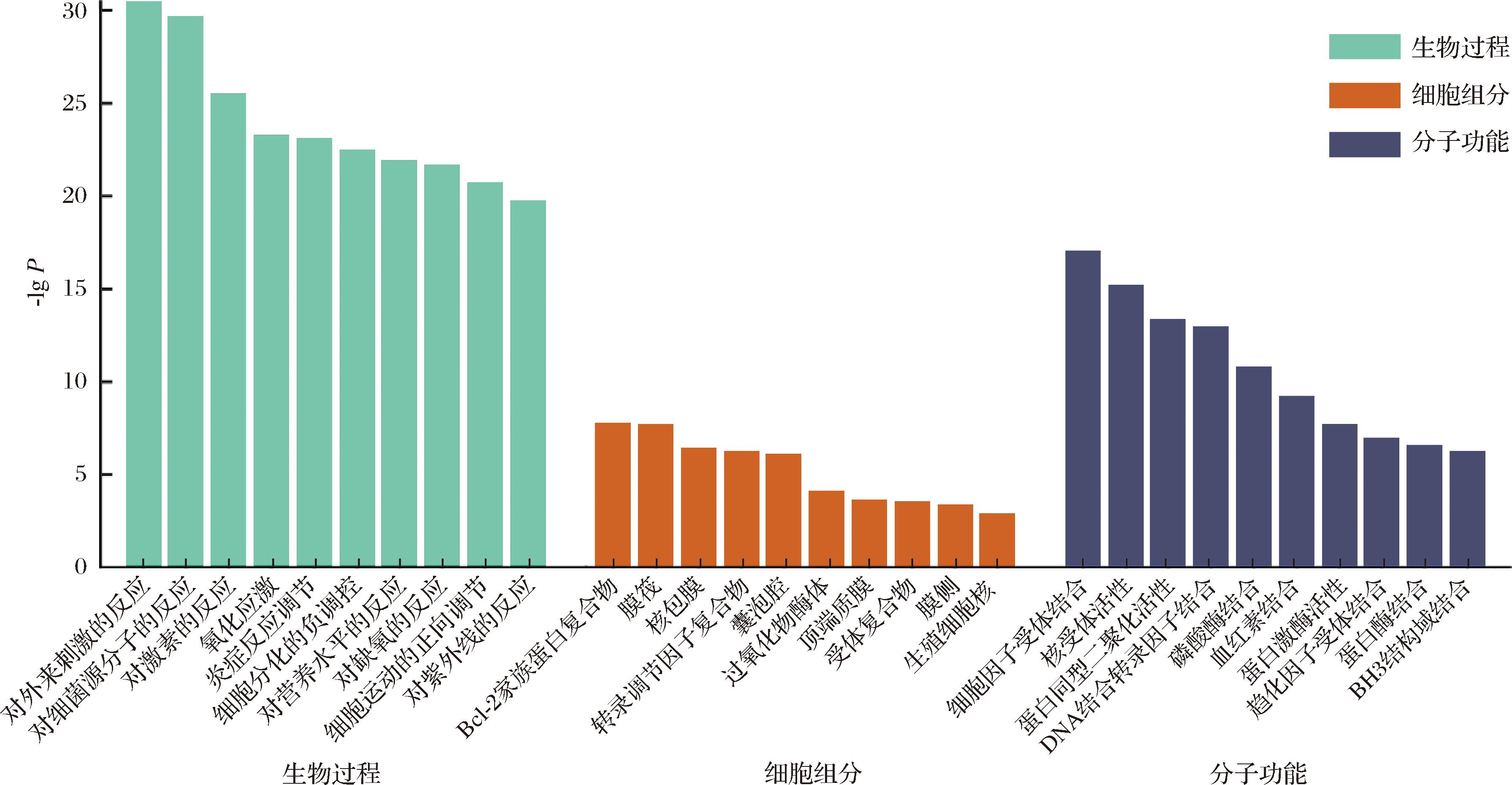
图2 甘草活性成分潜在靶点GO功能富集分析
Fig.2 GO function enrichment analysis of potential targets from active ingredients of G.uralensis
2.3 关键靶点功能与通路的富集分析
采用Metascape在线分析平台对93个关键靶点进行生物学过程(biological process,BP)、细胞组成(cellular component,CC)和分子功能(molecular function,MF)3部分的GO富集分析与KEGG通路富集分析。由图2可知,BP包含对外来刺激的反应、对细菌源分子的反应、对激素的反应、氧化应激、炎症反应的调节、细胞分化的负调控等;CC包括Bcl-2家族蛋白复合物、膜筏、核包膜、转录调节因子复合物、囊泡腔、过氧化物酶体等;MF涵盖了细胞因子受体结合、核受体活性、蛋白同型二聚化活性、DNA结合转录因子结合、磷酸酶结合、血红素结合等。由图3可知KEGG通路富集共得到癌症通路、脂质和动脉粥样硬化、化学致癌作用-受体激活、胰腺癌、利什曼病、NF-κB信号通路、EGFR酪氨酸激酶抑制剂耐药性、松弛素信号通路、细胞衰老、膀胱癌等通路。以上结果说明了甘草活性成分通过多条通路实现对大肠杆菌的抑制作用。
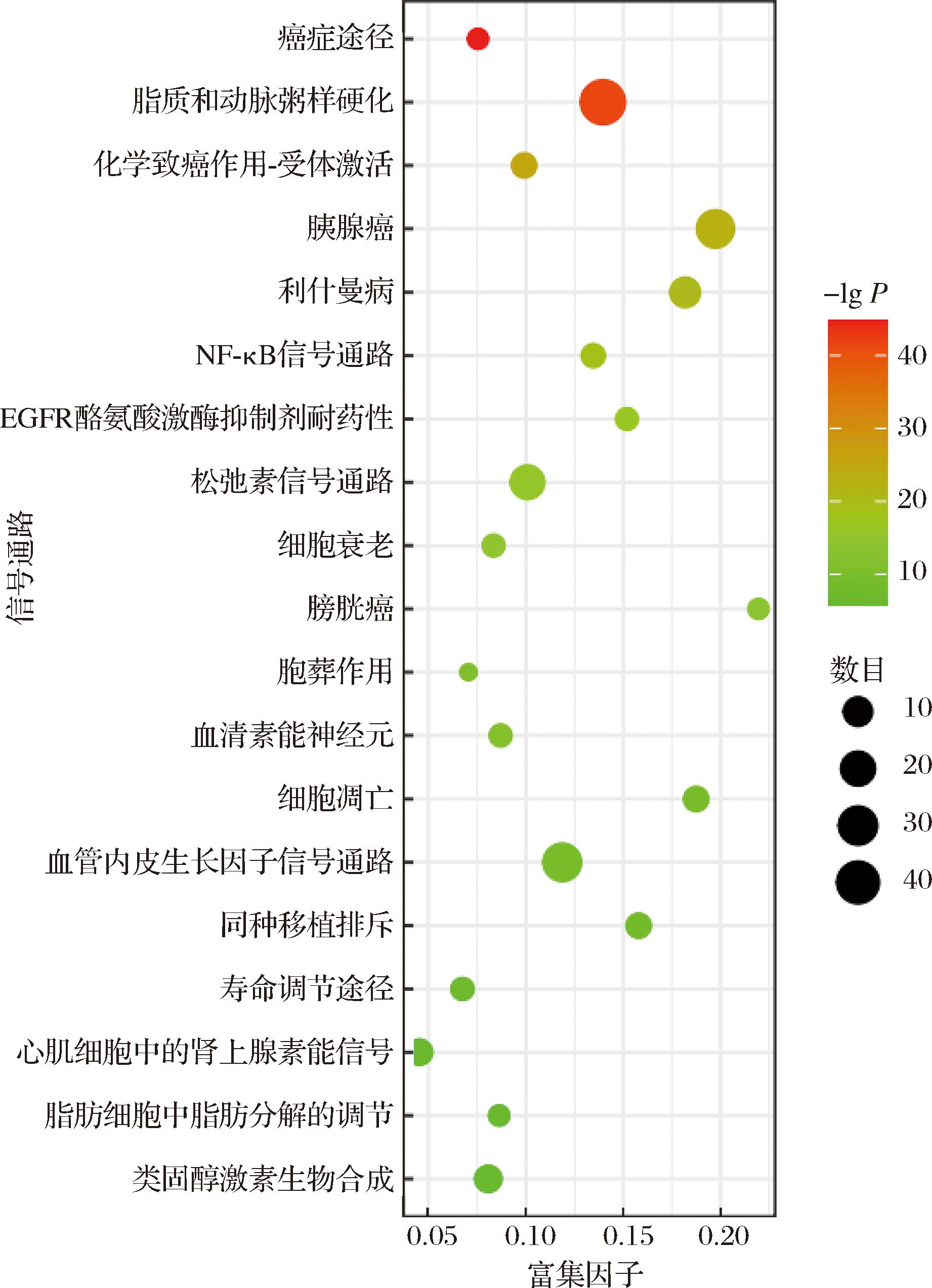
图3 甘草活性成分潜在靶点KEGG通路分析
Fig.3 KEGG pathway analysis of potential targets from active ingredients of G.uralensis
2.4 致病性大肠杆菌关键靶点发掘
抑制5种主要致病性大肠杆菌靶点的交集Venn图如图4所示。其中5个子集的共同交集靶点共有1个,为TP53,4个子集的共同交集靶点共有7个,分别为IL6、STAT3、AKT1、MAPK1、CXCL8、MAPK8和IL10。上述靶点出现在4个及以上致病性大肠杆菌的抑制作用中,说明与这些靶点亲合度高的活性成分可能为主要致病性大肠杆菌的关键成分。结合甘草活性成分对抑制大肠杆菌靶点PPI图degree值前5的靶点(TNF、IL6、TP53、JUN、STAT3),表明了IL6、TP53和STAT3可能是抑制致病性大肠杆菌的最主要的靶点。
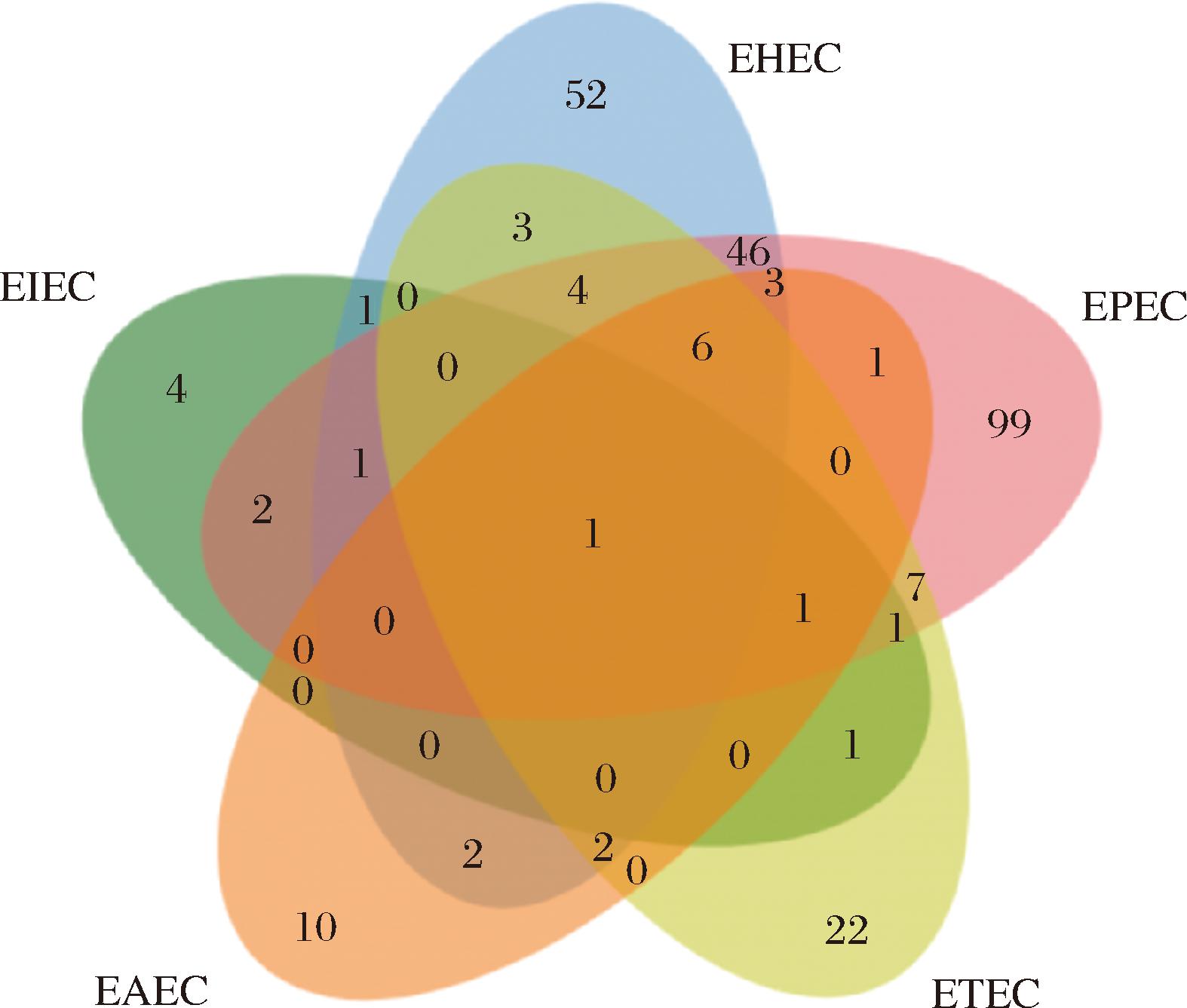
图4 抑制EHEC、EPEC、ETEC、EAEC和EIEC的交集靶点
Fig.4 Intersection targets of inhibiting EHEC, EPEC, ETEC, EAEC, and EIEC
2.5 分子对接验证及致病性大肠杆菌关键抑菌成分-靶点可视化
采用AutoDockTools-1.5.7软件将“甘草-大肠杆菌抑菌-成分-靶点”通路中筛选出的抑菌度值>10的活性成分及PPI图degree值>20的靶点进行分子对接,得到各活性成分与靶点的结合能。通常认为结合能<0,配体和受体就能自发结合,并且结合能越低表示受体与配体间亲和力越强。对接结果显示大多数活性成分与靶蛋白间结合能均小于-2 kcal/mol,表明均能自发结合。甘草活性成分与大肠杆菌抑菌靶点对接热图如图5所示。
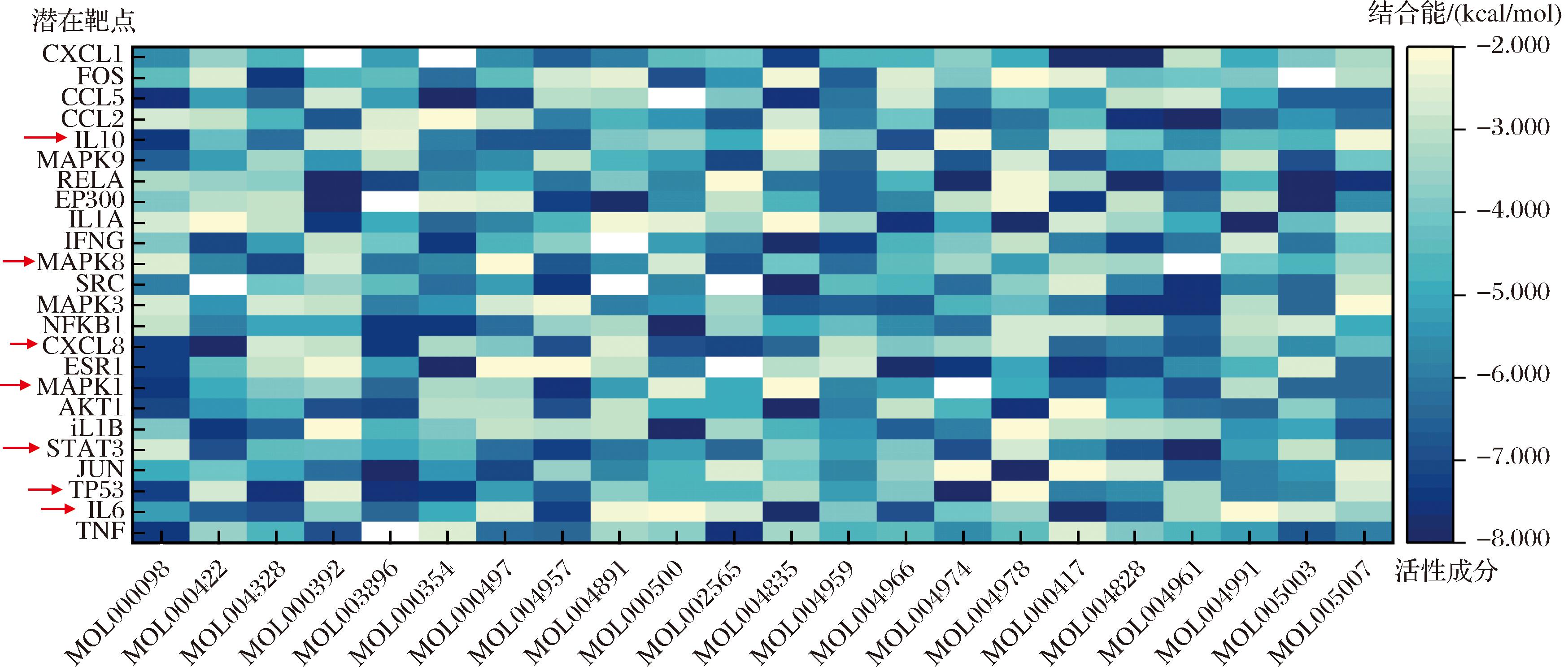
图5 甘草关键成分与关键靶点结合能热图
Fig.5 Heat map of binding energy between key targets combining with key active ingredients in G.uralensis
在图5中标注了5种致病性大肠杆菌抑菌靶点的交集中≥4的共同抑菌靶点(以红色箭头标注),其中PPI中degree值>5的关键靶点分别为IL6、TP53和STAT3。选择与以上3个靶点结合能排行前4低的活性成分进行可视化处理。如图6所示,与IL6亲和力最高的为山柰酚、柚皮素、异芒柄花素和刺果甘草查尔酮,与TP53结合能最低的4个活性成分为柚皮素、7-甲氧基-2-甲基异黄酮、异鼠李素和3″-甲氧基光甘草定,柚皮素、异芒柄花素、3″-甲氧基光甘草定和槲皮素-3,3′-二甲醚与STAT3的结合能最低。与致病性大肠杆菌关键抑菌靶点结合能高的活性成分以黄酮类化合物为主,其中柚皮素、异芒柄花素和3″-甲氧基光甘草定与多个关键靶点结合能均较低,可能为抑菌关键成分。

a-山柰酚、柚皮素、异芒柄花素、刺果甘草查尔酮与IL6;b-柚皮素、7-甲氧基-2-甲基异黄酮、异鼠李素、3″-甲氧基光甘草定与TP53; c-柚皮素、异芒柄花素、3″-甲氧基光甘草定、槲皮素-3,3′-二甲醚与STAT3
图6 关键活性成分-关键靶点的分子对接模拟
Fig.6 Molecular docking simulation of key active ingredients-key targets
2.6 关键活性成分MIC和MBC验证
表3显示了分子对接筛选出的关键活性成对5种致病性大肠杆菌的MIC和MBC。柚皮素、异芒柄花素和3″-甲氧基光甘草定的MIC分别为0.16~0.31、0.62~1.25、0.07~0.16 μg/mL,MBC分别为0.16~0.62、1.25~2.50、0.16~0.31 μg/mL,3″-甲氧基光甘草定的抑菌效果最好,其次是柚皮素和异芒柄花素。体外抑菌试验结果表明3″-甲氧基光甘草定是甘草中抑制致病性大肠杆菌的关键活性成分,为从甘草中发掘治疗大肠杆菌病的活性成分提供了基础。
表3 关键活性成分对致病性大肠杆菌的MIC和MBC 单位:μg/mL
Table 3 MIC and MBC of key active ingredients against pathogenic E.coli
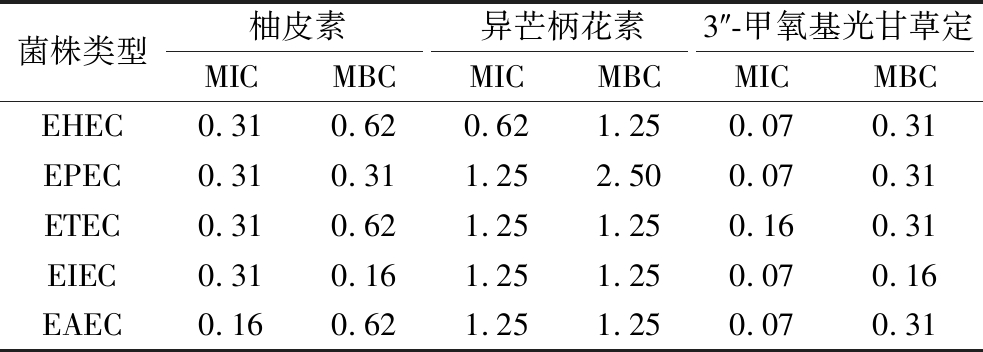
菌株类型柚皮素异芒柄花素3″-甲氧基光甘草定MICMBCMICMBCMICMBCEHEC0.310.620.621.250.070.31EPEC0.310.311.252.500.070.31ETEC0.310.621.251.250.160.31EIEC0.310.161.251.250.070.16EAEC0.160.621.251.250.070.31
3 结论与讨论
甘草中含有多种活性成分,其中黄酮类化合物是其主要抗菌活性成分[19]。本研究通过网络药理学及分子对接验证筛选出的柚皮素、异芒柄花素和3″-甲氧基光甘草定3个关键活性成分均为黄酮及其衍生化合物。柚皮素可以特异性抑制沙门氏菌致毒力岛1中的24个基因,下调17个与鞭毛和运动有关的基因达到抑菌作用[20]。通过纳米银颗粒偶联修饰柚皮素对大肠杆菌和铜绿假单胞菌的抑菌作用增加了4.5~13.6倍[21]。关于异芒柄花素和3″-甲氧基光甘草定的抑菌研究较少,两者均为异黄酮类化合物。同为异黄酮类的芒柄花素具有较高的抗菌活性,是新型抗感染药物的潜在来源[22]。光甘草定对幽门螺旋杆菌具有显著的抑制作用[23]。此外,光甘草定对革兰氏阳性菌的抑菌效果强于对革兰氏阴性菌,对结核分枝杆菌、金黄色葡萄球菌、粪肠球菌和大肠杆菌的抑制效果较好[24]。以上结果表明异黄酮类化合物抑菌潜力良好。本研究筛选出的异芒柄花素和3″-甲氧基光甘草定也对致病性大肠杆菌显示出了较好的抑制效果。柚皮素、异芒柄花素和3″-甲氧基光甘草定的MIC分别为0.16~0.31、0.62~1.25、0.07~0.16 μg/mL,MBC分别为0.16~0.62、1.25~2.50、0.16~0.31 μg/mL。
大肠杆菌在常规条件下并不会引发疾病,但是某些特定血清型的大肠杆菌具有很强的致病性,对婴儿而言尤其危险[25]。致病性大肠杆菌可以引起一系列并发症,轻中度感染者出现腹痛、腹泻、血便以及出血性结肠炎等症状,重者导致死亡[26]。不同的致病性大肠杆菌菌株表现出一系列毒力因子和基因,诱发人类疾病。致病性大肠杆菌与宿主组织的黏附是细菌定殖的第一步,这一过程通常由黏合素如菌毛和鞭毛介导,例如,I型纤毛、P型缘毛和S型缘毛等黏附因子可增强上皮细胞的定植[27]。此外,研究表明肠聚集性大肠杆菌还可以通过Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)将致毒因素直接注入靶细胞中导致一系列病变[28]。为了探索对各类致病性大肠杆菌均有较好抑制效果的活性成分,本研究搜索了抑制EHEC、EPEC、ETEC、EIEC和EAEC 5种主要致病性大肠杆菌共同的靶点,并且通过分子对接确定了柚皮素、异芒柄花素和3″-甲氧基光甘草定与多个关键抑菌靶点的结合能均较低,同时通过体外抑菌试验证明了3″-甲氧基光甘草定的抑菌效果最好。
在PPI分析中,degree值较高的靶点分别为TNF、IL6、AKT1、IL1B、STAT3。在多项研究中表明活性成分在抑菌的过程中这些靶点发挥了关键作用。黄酮类化合物在受牙龈卟啉单胞菌脂多糖刺激的人牙龈成纤维细胞中具有抑制TNF、IL-1β、IL-6、IL-8等炎症介质产生的潜力[29],同时不同浓度的黄酮对牙龈卟啉单胞菌生物膜造成明显的不连续损伤,且随着浓度的增加,其严重程度也会增加,这表明了黄酮不仅对致病菌有直接抑制作用,还可以降低炎症因子的表达缓解致病菌损伤[30]。在其他抑菌研究中,多种靶点包括STAT3、NRF2、ROS和COX2在姜黄素发挥药效的过程中显示出了关键作用[31]。AKT1作为一种蛋白激酶B,不仅参与调控γδ T细胞的发育,还参与γδ T细胞的功能调控,使得其对细菌病原体的感染反应迅速[32]。分子对接结果表明清肝利胆汤中毛地黄黄酮、柚皮素、川陈皮素等特征性黄酮组分与GAPDH、AKT1、TNF、TP53和IL6结合能较低,灌肠治疗后细胞过程及肠道菌群代谢功能发生了特征性变化,包括大肠杆菌生物膜形成功能、霍乱弧菌生物膜合成功能等过程[33]。以上研究结论表明本研究中筛选出的与IL6、AKT1和STAT3等靶点亲合度较高的柚皮素、异芒柄花素、3″-甲氧基光甘草定可能参与多靶点抑菌过程,是关键抑菌成分。GO富集分析中,BP包含了外来刺激的反应、对细菌源分子的反应、对激素的反应等,这对理解甘草活性成分在抑制致病性大肠杆菌过程中生物体的生理功能和疾病发生机制十分重要。KEGG通路富集显示甘草活性成分主要通过癌症通路、脂质和动脉粥样硬化、化学致癌作用-受体激活、胰腺癌、利什曼病等通路发挥对致病性大肠杆菌的抑制作用。以上结果表明,甘草中活性成分通过多途径多靶点发挥对大肠杆菌的抑制作用。
综上所述,本研究通过网络药理学和分子对接探索了甘草活性成分抑制大肠杆菌的主要机制,并且探索出甘草中抑制5种主要致病性大肠杆菌的关键活性成分为柚皮素、异芒柄花素和3″-甲氧基光甘草定等黄酮类化合物,通过体外抑菌试验验证了3″-甲氧基光甘草定的抑菌效果最好,为后续深入发掘甘草中活性成分对致病性大肠杆菌以及其他致病菌的作用提供了基础。
[1] RILEY L W. Distinguishing pathovars from nonpathovars: Escherichia coli[J]. Microbiology Spectrum, 2020, 8(4). DOI: 10.1128/microbiolspec.AME-0014-2020.
[2] 黄远斌, 张淑红, 杨广珠, 等. 一株新现食源性多重耐药非典型肠致病大肠杆菌特征分析[J]. 现代食品科技, 2024, 40(6):268-278.HUANG Y B, ZHANG S H, YANG G Z, et al. Characteristics of an emerging food-borne multidrug-resistant atypical enteropathogenic Escherichia coli strain[J]. Modern Food Science and Technology, 2024, 40(6):268-278.
[3] SHEIKH A, FLECKENSTEIN J M. Interactions of pathogenic Escherichia coli with CEACAMs[J]. Frontiers in Immunology, 2023, 14:1120331.
[4] ALEGBELEYE O O, SANT’ANA A S. Pathogen subtyping tools for risk assessment and management of produce-borne outbreaks[J]. Current Opinion in Food Science, 2020, 32:83-89.
[5] PAKBIN B, BRÜCK W M, ROSSEN J W A. Virulence factors of enteric pathogenic Escherichia coli: A review[J]. International Journal of Molecular Sciences, 2021, 22(18):9922.
[6] DENAMUR E, CLERMONT O, BONACORSI S, et al. The population genetics of pathogenic Escherichia coli[J]. Nature Reviews Microbiology, 2021, 19(1):37-54.
[7] 陈国宝, 张家蓉. 甘草制品在食品中的应用[J]. 食品安全导刊, 2023(16):190-192.CHEN G B, ZHANG J R. Application of licorice products in food[J]. China Food Safety Magazine, 2023(16):190-192.
[8] AL-TURKI A I, EL-ZINEY M G, ABDEL-SALAM A M. Chemical and anti-bacterial characterization of aqueous extracts of oregano, marjoram, sage and licorice and their application in milk and labneh[J]. Journal of Food, Agriculture and Environment, 2008, 6(1).
[9] WANG Z X, XU H Y, HU Y, et al. Topical drug delivery of licorice flavonoids and their structure-affinity relationship with the porcine skin[J]. Journal of Drug Delivery Science and Technology, 2024, 91:105251.
[10] 王彩君, 翟宇. 甘草的生物功能及其在畜禽生产中的应用[J]. 饲料研究, 2023, 46(8):135-139.WANG C J, ZHAI Y. Biological function of licorice and its application in livestock and poultry production[J]. Feed Research, 2023, 46(8):135-139.
[11] SONG L Y, HU X, REN X M, et al. Antibacterial modes of herbal flavonoids combat resistant bacteria[J]. Frontiers in Pharmacology, 2022, 13:873374.
[12] 曾超珍, 刘志祥, 吴耀辉, 等. 超声波提取甘草黄酮及其抑菌活性研究[J]. 时珍国医国药, 2007, 18(10):2402-2403.ZENG C Z, LIU Z X, WU Y H, et al. Studies on flavonoids extraction by ultrasonic technology from Glycyrrhiza and their bacteriostatic activity[J]. Lishizhen Medicine and Materia Medica Research, 2007, 18(10):2402-2403.
[13] 樊铭聪, 孙元军, 李文香, 等. 天然植物提取液抑菌效果筛选及机理研究[J]. 中国食品学报, 2015, 15(9):180-185.FAN M C, SUN Y J, LI W X, et al. Screening of antibacterial effect and mechanism research of natural plant extracts[J]. Journal of Chinese Institute of Food Science and Technology, 2015, 15(9):180-185.
[14] TAN Y Y, LIU Y Y, ZHAI Y Y, et al. Investigating the potential mechanism of Huazhi Rougan granules against alcoholic liver disease by network pharmacology and experiment[J]. World Journal of Traditional Chinese Medicine, 2024, 10(2):191-203.
[15] OH K K, ADNAN M, CHO D H. A network pharmacology analysis on drug-like compounds from Ganoderma lucidum for alleviation of atherosclerosis[J]. Journal of Food Biochemistry, 2021, 45(9): e13906.
[16] 郭世纪, 何成洪, 刘政, 等. 基于网络药理学和分子对接探讨苹果多酚对铜绿假单胞菌的抑制作用[J]. 食品与发酵工业, 2025, 51(11):65-74.GUO S J, HE C H, LIU Z, et al. Inhibitory effect of apple polyphenols on Pseudomonas aeruginosa based on network pharmacology and molecular docking[J]. Food and Fermentation Industries, 2025, 51(11):65-74.
[17] BARDOU P, MARIETTE J, ESCUDIÉ F, et al. Jvenn: An interactive Venn diagram viewer[J]. BMC Bioinformatics, 2014, 15(1):293.
[18] TANG D D, CHEN M J, HUANG X H, et al. SRplot: A free online platform for data visualization and graphing[J]. PLoS One, 2023, 18(11): e0294236.
[19] CHANG S Y, YUN C K, YANG B Q, et al. Comprehensive reutilization of Glycyrrhiza uralensis residue by extrusion-biological pretreatment for coproduction of flavonoids, cellulase, and ethanol[J]. Bioresource Technology, 2024, 406:131002.
[20] PATEL K, SINGH G K, PATEL D K. A review on pharmacological and analytical aspects of naringenin[J]. Chinese Journal of Integrative Medicine, 2018, 24(7):551-560.
[21] SALUNKHE J D, MOHITE B V, PATIL S V. Naringenin biosynthesis and fabrication of naringenin mediated nano silver conjugate for antimicrobial potential[J]. Natural Product Research, 2023, 37(18):3184-3190.
[22] 李姗茜, 伍桂贤, 刘玉玲, 等. 芒柄花素药理作用及机制的研究进展[J]. 中国现代中药, 2024, 26(9):1608-1617.LI S Q, WU G X, LIU Y L, et al. Research progress on pharmacological effects and mechanisms of formononetin[J]. Modern Chinese Medicine, 2024, 26(9):1608-1617.
[23] 赵全民, 于录, 邓旭明, 等. 中药单体化合物光甘草定的体外抗菌活性研究[J]. 中国预防兽医学报, 2010, 32(3):225-227.ZHAO Q M, YU L, DENG X M, et al. Antimycobacterial and antibacterial activity of glabridin from Glycyrrhiza uralensis Flsch in vitro[J]. Chinese Journal of Preventive Veterinary Medicine, 2010, 32(3):225-227.
[24] SINGH V, PAL A, DAROKAR M P. A polyphenolic flavonoid glabridin: Oxidative stress response in multidrug-resistant Staphylococcus aureus[J]. Free Radical Biology and Medicine, 2015, 87:48-57.
[25] 熊长辉, 杨梦, 刘晓青, 等. 一次食物中毒相关的侵袭性大肠杆菌分子分型分析[J]. 中国人兽共患病学报, 2015, 31(8):747-750.XIONG C H, YANG M, LIU X Q, et al. Genotype identification and laboratory examination of EIEC from a case of food contamination[J]. Chinese Journal of Zoonoses, 2015, 31(8):747-750.
[26] 王岱, 汤岩松, 李云鹤, 等. 肠出血性大肠杆菌疫苗的开发和展望[J]. 厦门大学学报(自然科学版), 2024, 63(3):387-395; 466.WANG D, TANG Y S, LI Y H, et al. Development and prospects of enterohemorrhagic Escherichia coli vaccine[J]. Journal of Xiamen University (Natural Science), 2024, 63(3):387-395; 466.
[27] CAZZOLA H, LEMAIRE L, ACKET S, et al. The impact of plasma membrane lipid composition on flagellum-mediated adhesion of enterohemorrhagic Escherichia coli[J]. mSphere, 2020, 5(5): e00702-20.
[28] TAILLEFER B, GIRAUD J F, CASCALES E. No fitness cost entailed by type VI secretion system synthesis, assembly, contraction, or disassembly in enteroaggregative Escherichia coli[J]. Journal of Bacteriology, 2023, 205(12): e0035723.
[29] HE Z Y, ZHANG X, SONG Z C, et al. Quercetin inhibits virulence properties of Porphyromas gingivalis in periodontal disease[J]. Scientific Reports, 2020, 10:18313.
[30] SEHMISCH S, UFFENORDE J, MAEHLMEYER S, et al. Evaluation of bone quality and quantity in osteoporotic mice-The effects of genistein and equol[J]. Phytomedicine, 2010, 17(6):424-430.
[31] KUNNUMAKKARA A B, BORDOLOI D, PADMAVATHI G, et al. Curcumin, the golden nutraceutical: Multitargeting for multiple chronic diseases[J]. British Journal of Pharmacology, 2017, 174(11):1325-1348.
[32] GUERAU-DE-ARELLANO M, PIEDRA-QUINTERO Z L, TSICHLIS P N. Akt isoforms in the immune system[J]. Frontiers in Immunology, 2022, 13:990874.
[33] 张丽丽. 清肠利肝方保留灌肠对肝硬化患者肠道菌群影响的临床及机制研究[D]. 北京: 中国中医科学院, 2023.ZHANG L L. Clinical and mechanism study on the effect of Qingchang ligan decoction retention enema on intestinal flora in patients with cirrhosis[D]. Beijing: China Academy of Chinese Medical Sciences, 2023.