柑橘在世界范围内广泛种植,具有重要的经济价值和营养价值。目前,通过早、中、晚熟柑橘品种的搭配种植基本实现了我国鲜食柑橘的周年供给。但受温度、光照等气候条件影响[1-2],早熟柑橘品系,如重庆地区早熟蜜橘往往存在果皮果肉不同步成熟的特点,晚熟柑橘中,夏橙也常在最佳食用成熟度时出现明显的果皮返青问题,沃柑同样易在成熟后期出现着色变浅等问题,而果皮颜色常被作为判断鲜食柑橘成熟度和新鲜度的指标。因此,明确这几类鲜食柑橘果实着色特性的内在机理,对实现其色泽的有效调控具有重要的意义。
光照条件是影响柑橘果实色泽最关键的外部因素之一。研究结果表明,光质和光强对柑橘果实的着色均有重要影响[3]。MA等[4]和GONG等[5]研究发现,红光通过上调类胡萝卜素生物合成相关基因表达从而提高了采后温州蜜柑(Citrus unshiu Marc.)果实中β-隐黄质的含量,从而促进果实转色;红光还通过上调叶绿素降解相关基因表达促进金柑(Fortunella crassifolia swingle)果实转色;YUAN等[6]发现蓝光照射促进乙烯褪绿柑橘果实的叶绿素和类胡萝卜素代谢使果实着色更深、更快,同时伴随着类胡萝卜素的积累和叶绿素的降解。目前,关于光照改善柑橘果实着色机理的研究主要集中在对果实叶绿素降解和类胡萝卜素合成方面的研究,对相关机理的深入探讨不足。
转录调控是控制果实外观性状的重要因素。转录因子(transcription factors,TFs)作为关键调节因子,通过识别靶基因启动子中特定的顺式调控元件来控制转录的起始,从而调控基因的表达[7]。G-box(核心序列为CACGTG)是一种重要的光响应元件,广泛分布于植物基因的启动子区域,通常通过与bHLH转录因子结合,调控光响应基因的表达。G-box在光形态建成中起关键作用,例如HY5和PIF等bHLH或bZIP类转录因子通过结合G-box激活与光合、叶绿素合成及光周期相关的基因表达。此外,G-box也参与非生物胁迫(如盐胁迫、干旱胁迫)响应基因的调控,显著影响植物对不利环境的耐受性。在代谢调控方面,G-box存在于次生代谢产物(如类胡萝卜素和黄酮类化合物)合成相关基因的启动子中,调控其代谢途径。相关研究表明,G-box是植物基因表达调控网络的重要节点,其功能在光信号转导和次生代谢等领域尤为突出[8-11]。
bHLH作为植物转录因子中最大的家族之一,广泛参与植物生长发育、非生物胁迫及代谢网络响应的调控。ZHU等[12]发现在番茄中过表达SlPRE2促进了幼苗发育中的形态发生,果皮中叶绿素和类胡萝卜素积累减少;SANAGI等[13]发现AtFBH4转录因子是拟南芥中氮响应性开花的关键调节因子;ZHAO等[14]发现MdbHLH130通过调节烟草气孔关闭和活性氧(reactive oxygen species,ROS)清除作为水分胁迫反应的正调节因子;ZHANG等[15]发现PIF5在拟南芥中通过与叶绿素降解相关基因SGR、NYC1和ORE1启动子部分G-box结合,激活这些基因的表达,进而促进叶绿素降解;WANG等[16]发现CcbHLH66在蜜橘中通过激活叶绿素降解相关基因RCCR和NYC的表达来促进柑橘果实着色;LIU等[11]发现CcbHLH35在蜜橘中激活了叶绿素降解途径中的4个关键基因CcChlase1、CcNYC1、CcPAO、CcRCCR和类胡萝卜素生物合成途径中的3个关键基因CcPSY1、CcBCH2、CcNCED5的表达,从而加速柑橘果实着色。
本研究筛选到1个在红光照射下可能会影响蜜橘果皮转色的转录因子CcbHLH130。对其进行了生物信息学分析,并通过在柑橘果实和烟草叶片中瞬时过表达,研究了CcbHLH130在调控蜜橘果皮转色方面的功能,以期为更好地理解果实成熟过程中颜色转变的转录调控机理提供理论参考,也为开发新的“柑橘褪绿技术”提供思路。
1 材料与方法
1.1 材料与试剂
1.1.1 植物材料
实验以早熟蜜橘及本氏烟草(Nicotiana benthamiana)为试材。早熟蜜橘采自重庆市鸡公山金竹林,第一批采收于果实盛花后170 d,采收的果实立即运回实验室。本氏烟草由实验室种植所得,种植条件参照刘倩等[17]。
1.1.2 载体和感受态细胞
pCAMBIA2300-GFP、pEAQ-BD、pCAMBIA2300载体均来自实验室保存载体。EHA105感受态细胞,重庆伍佰生物技术有限公司;感受态DH5α,生工生物工程(上海)股份有限公司。
1.1.3 主要试剂
Tryptone胰蛋白胨、Yeast Extract酵母粉、琼脂糖Agarose、2.5% GLu固定液,重庆择物生物科技有限公司;SYBR Green Pro Taq HS预混型qPCR试剂盒、SteadyPure快速RNA提取试剂盒、Evo M-MLV Reverse Transcription Premix Kit试剂盒,湖南艾科瑞生物工程有限公司;甲醇、甲基叔丁基醚,贵州铂锶钛化工产品有限公司;丙酮,重庆市钛新化工有限公司;Dual Luciferase Reporter Gene Assay Kit双荧光素酶报告基因检测试剂盒,翌圣生物科技股份有限公司;SanPrep柱式质粒DNA小量抽提试剂盒,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
S1000 PCR仪、CFX384 Touch PCR仪,美国Bio-Rad公司;Basic-P基础电泳仪,中国莫纳生物公司;LSM780激光共聚焦显微镜,德国卡尔蔡司公司;LC-20A高效液相色谱仪,日本岛津公司;SYNERGY H1酶标仪,美国Biotek公司;CR-400色差仪,日本柯尼卡美能达公司;HT7800透射电子显微镜,日本日立公司。
1.3 实验方法
1.3.1 材料处理
将果实分为对照组和红光处理组,每组100个果实,对照组果实于黑暗中贮藏7 d,红光处理组采用连续红光(661 nm,2 616 Lux红色LED光)对蜜橘果实照射7 d,果蒂向上放置,温度25 ℃,湿度95%。贮藏第0、2、5、7 d时,随机选取15个果实的果蒂部位处约1 cm宽的果皮,切碎后液氮冷冻,并在-80 ℃冰箱保存。第二批果实采收于同一果园,同一条件,用作瞬时过表达材料。
1.3.2 RNA提取、cDNA合成和定量聚合酶链式反应(quantitative real-time polymerase chain reaction,qPCR)
总RNA的提取使用上述艾科瑞公司RNA提取试剂盒进行,使用艾科瑞公司反转录试剂盒将RNA转化为cDNA。qPCR按照刘倩等[17]方法进行。
1.3.3 高通量测序和分析
贮藏第0、2、5天的蜜橘果皮的RNA由广州基迪奥生物科技有限公司进行RNA-Seq分析。使用DESeq2软件[18]对各组间差异基因进行检测,以log2(Fold Change)>1和P<0.01作为筛选差异基因的指标。
1.3.4 基因克隆和生物信息学分析
蜜橘CcbHLH130的CDS序列来自Citrus clementina数据库,以蜜橘果皮为材料,PCR扩增CcbHLH130全长CDS,PCR按照刘倩等[17]方法进行,引物见表1。拟南芥bHLH家族推测蛋白序列来自tair数据库。利用1 000次引导重复和MEGAX中的邻接法进行系统发生进化树分析,利用DNAMAN进行多序列比对。
表1 本研究所有引物序列
Table 1 All primer sequences in this study

实验名称 引物名称 引物序列实时荧光定量PCRACTIN-FTGGATTCTGGTGATGGTGTGACTIN-RTGGATTCTGGTGATGGTGTGCcbHLH130-FACCTTTTCTGTAAATGGGGTCTCcbHLH130-RAGCCAGTGAAACATTACAGGTA全长扩增CcbHLH130-FATGGATTCAAGTACTAATCATAATTCcbHLH130-RTCAAACAATTTGATTCTCGAC亚细胞定位分析2300GFP-FATGACGCACAATCCCACTATC2300GFP-RAGATGAACTTCAGGGTCAGCCcbHLH130-GFP-Fcaatttactattctagggtacc ATGGATTCAAGTACTAATCATAATTCcbHLH130-GFP-Fgtatgggtatctagactgcag TCAAACAATTTGATTCTCGAC转录激活活性分析pBD-FTATGCCTCTAACATTGAGACpBD-RCTGCTAAACAGGAGCTCACACcbHLH130-pBD-Ftcgccgaccggtaggcct ATGGATTCAAGTACTAATCATAATTCcbHLH130-pBD-Raaccagagttaaaggcct TCAAACAATTTGATTCTCGAC瞬时转化实验2300-FATGACGCACAATCCCACTATC2300-RAAGCGTAATCTGGAACGTCACcbHLH130-2300-Fcaatttactattctagggtacc ATGGATTCAAGTACTAATCATAATTCcbHLH130-2300-Rgtatgggtatctagactgcag TCAAACAATTTGATTCTCGAC
1.3.5 亚细胞定位分析
将CcbHLH130的CDS(不包括终止密码子)插入pCAMBIA2300-GFP载体。将空缺载体(用作对照)和融合构建体分别转化至EHA105。将农杆菌溶液注入烟草叶片,感染48 h后,使用激光共聚焦显微镜观察亚细胞定位图像。
1.3.6 转录激活检测
按照张暄等[19]方法,在烟草叶片中进行转录激活活性检测。将CcbHLH130 CDS连接到pEAQ-BD载体中,生成重组载体pEAQ-BD-CcbHLH130。随后,分别用融合构建体pEAQ-BD-CcbHLH130、阴性对照(pEAQ)和阳性对照(pEAQ-BD-VP16)作为效应子,带有TATA-box的GAL4-LUC和REN的双荧光报告载体作为报告子,二者以9∶1混合转染至烟草叶片,培养48 h后使用双荧光素酶测定试剂盒进行LUC/REN比率测定。
1.3.7 CcbHLH130在烟草叶片及蜜橘果皮中瞬时转化
将CcbHLH130 CDS克隆到pCAMBIA2300载体中,构建CcbHLH130-pCAMBIA2300载体。瞬时转化过程按照WANG等[20]指出的方法进行。将构建好的CcbHLH130-pCAMBIA2300载体转化至农杆菌后用孵育液(0.05 mmol/L 2-吗啉乙磺酸、2 mmol/L Na3PO4·12H2O、5 g/L葡萄糖和0.1 mmol/L乙酰丁香酮)重悬,将悬浮液OD600值调至约0.6。注射后,果实在温度为24 ℃、相对湿度为90%、完全黑暗的环境中贮藏5 d。在注射后第0、1、2、3天对注射点周围的果皮进行取样。烟草瞬时过表达方法同果实瞬时过表达方法。
1.3.8 果皮色差值测定
使用色差仪对每个果实的注射孔位置的果皮进行颜色测定,并以CIE色彩空间坐标(L*、a*和b*)记录。
1.3.9 叶绿素和类胡萝卜素及其代谢物的提取与测定
蜜橘果皮中叶绿素和类胡萝卜素的提取根据GE等[21]方法进行。将1 g果皮样品在液氮中研磨,用10 mL 0.1 g/L 2,6-二叔丁基甲基苯酚(butylated hydroxytoluene,BHT)-丙酮溶解,然后在4 ℃下以7 000×g离心3次,每次10 min。使用酶标仪在470、645、662 nm波长下测量色素提取物的吸光度并计算各含量。
叶绿素代谢物含量的分析参照DAS等[22]的方法进行,采用的色谱柱为C18色谱柱(250 mm×4.6 mm);果皮类胡萝卜素总代谢物含量采用YUAN等[6]的方法进行测定,采用的色谱柱为YMC-C30色谱柱(250 mm×4.6 mm)。
1.3.10 透射电子显微镜(transmission electron microscope,TEM)样本制备及观察
TEM的取样参照DENG等[23]的方法。取蜜橘果实注射孔周围的果皮(2 mm×1 mm)在2.5%(体积分数)戊二醛电镜固定液中固定,避光4 ℃存放。包埋切片交由武汉赛维尔生物科技有限公司,使用TEM进行观察。
1.4 数据处理
所有数据通过IBM SPSS Statistics 27使用Student’s t检验进行统计分析,设置3个以上平行,以*表示P<0.05,**表示P<0.01,***表示P<0.001为差异有统计学意义并使用GraphPad Prism 8.0进行绘图。
2 结果与分析
2.1 红光照射对蜜橘果皮CcbHLH130表达量的影响
红光照射处理蜜橘果实表观结果表明,红光可以加速蜜橘果皮转色(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.041516,后同)。根据差异基因表达量|log2(Fold Change)|>1,P<0.01,差异倍数大于2倍,以及fpkm值相对较大,进一步分析了红光照射处理蜜橘果实转录组数据,发现多个bHLH家族转录因子在红光照射处理后显著变化(附图2)。本文重点关注了其中一个可能参与蜜橘红光褪绿调控的转录因子CcbHLH130。相对表达量分析结果表明,红光照射处理第2天和第5天时,红光处理蜜橘果皮中CcbHLH130表达量显著上调(P<0.05)(图1)。
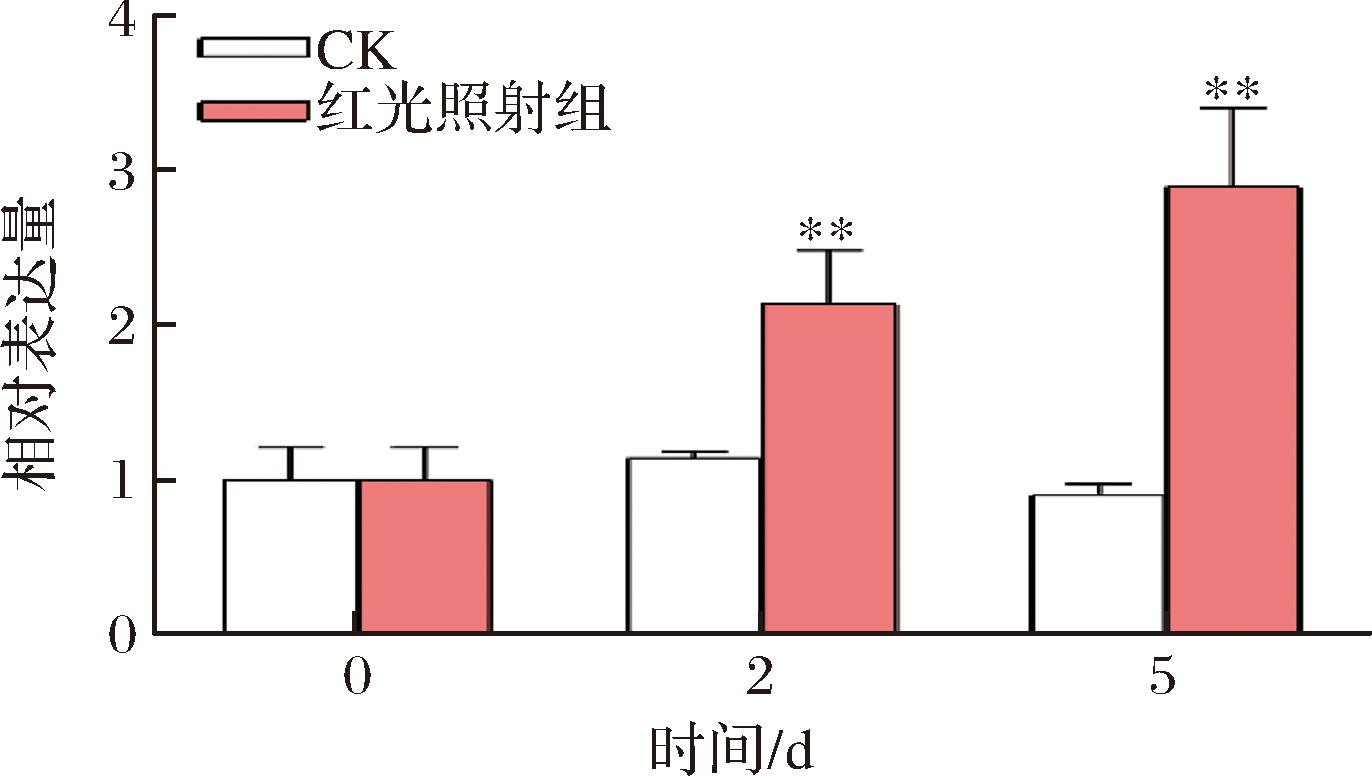
图1 红光照射对蜜橘果皮CcbHLH130相对表达量的影响
Fig.1 Effect of red LED light irradiation on the relative expression of CcbHLH130 in mandarin fruit peels
注:**表示P<0.01。

a-CcbHLH130全长基因电泳图;b-CcbHLH130系统发育进化树;c-CcbHLH130氨基酸序列比对
图2 CcbHLH130基因克隆、系统发育进化树构建和氨基酸序列比对
Fig.2 CcbHLH130 gene cloning, phylogenetic evolutionary tree construction, and amino acid sequence comparison
2.2 CcbHLH130生物信息学分析
以蜜橘果皮为材料,利用Snapgene设计特异性引物,PCR扩增CcbHLH130基因编码区序列(CDS),对目的片段连接至载体后的融合载体进行测序分析。结果显示,扩增片段序列与CcbHLH130基因一致(不含终止密码子),编码序列为1 089 bp,CcbHLH130 CDS全长基因克隆电泳图如图2-a所示。
为了进行亲缘关系分析,将CcbHLH130与拟南芥AtFBH4、AtCFL1、AtAKS2等15个蛋白序列进行系统发育进化比对,其中CcbHLH130与AtFBH4具有高度亲缘关系(图2-b)。CcbHLH130编码1个39.86 kDa的蛋白,由363个氨基酸组成,等电点为9.3。与拟南芥AtFBH4、AtCFL1和AtAKS2氨基酸序列进行同源比对(图2-c),结果表明,CcbHLH130存在高度保守HLH-like结构域,与上述3个拟南芥的氨基酸序列在HLH区域表现出高度的相似性,这表明它们可能具有相同的DNA结合基序,与特定的目标DNA识别密切相关。
2.3 CcbHLH130亚细胞定位分析
为了研究CcbHLH130的亚细胞定位,在烟草叶片中瞬时表达了CcbHLH130-pCAMBIA2300-GFP融合蛋白。如图3所示,pCAMBIA2300-GFP和mCherry核标记信号表现出广泛的重叠。结果表明,烟草mCherry核标记与CcbHLH130-pCAMBIA2300-GFP融合蛋白共定位,CcbHLH130蛋白定位于细胞核,为核定位蛋白。

图3 CcbHLH130亚细胞定位
Fig.3 Subcellular localization of CcbHLH130
2.4 CcbHLH130转录激活活性分析
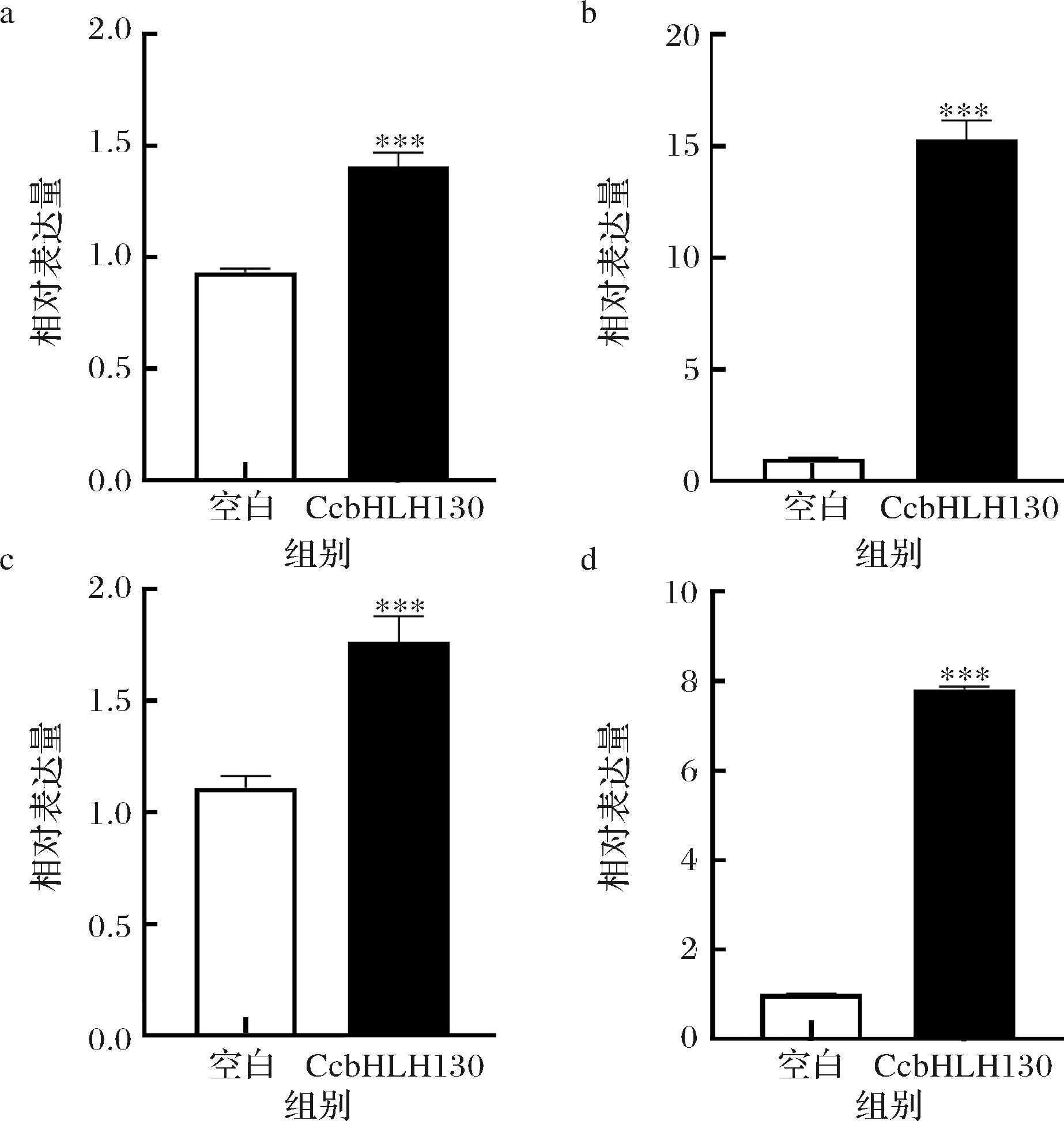
为了确定CcbHLH130是否具有转录激活或转录抑制活性,利用烟草自激活实验在烟草叶片中表达pEAQ-BD-CcbHLH130进行验证。pEAQ-BD-CcbHLH130和阳性对照pEAQ-BD-VP16以及阴性对照pEAQ-BD作为效应子,TATA作为报告子,进行双荧光素酶实验,相对LUC/REN比值表明pEAQ-BD-CcbHLH130和阳性对照pEAQ-BD-VP16显著激活(P<0.05),而阴性对照pEAQ-BD不被激活,表明,CcbHLH130具有转录激活因子的功能(图4)。
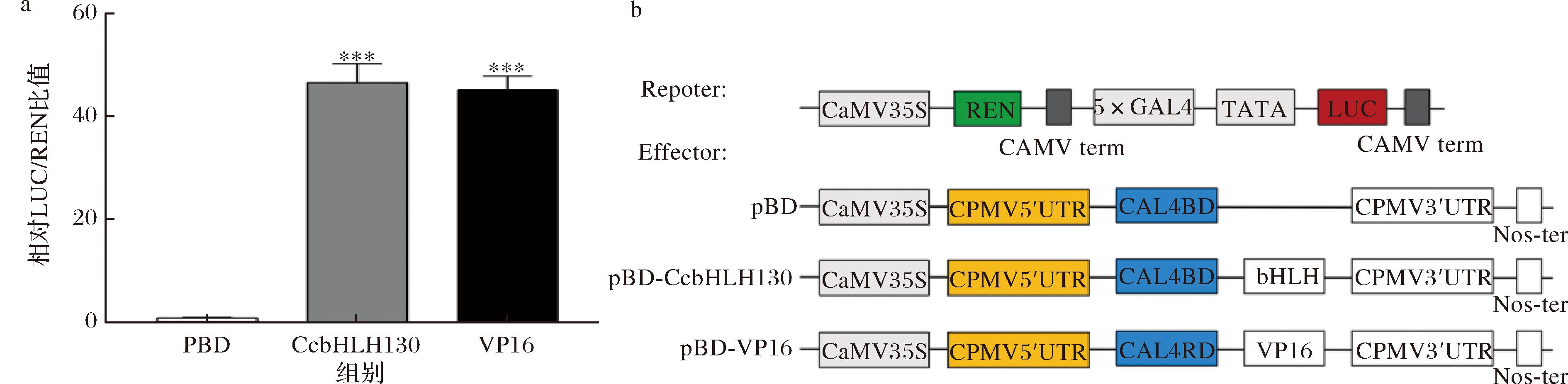
图4 CcbHLH130烟草自激活分析
Fig.4 Analysis of transcriptional activation activity of CcbHLH130 in tobacco
注:***表示P<0.001(下同)。
2.5 CcbHLH130启动子顺式作用元件分析
利用plantcare对CcbHLH130启动子中主要的顺式作用元件进行预测分析,可视化结果如图5所示,其中CcbHLH130启动子中含有光响应元件(TCT-motif、Sp1、C-box、GT1-motif、G-Box、Box 4、GATA-motif、chs-CMA1a)、厌氧诱导响应元件(ARE、GC-motif)、茉莉酸甲酯响应元件(CGTCA-motif和TGACG-motif)、水杨酸响应元件(TCA-element)、辅酶反应元件(AuxRE)、脱落酸响应元件(ABRE)、低温响应元件(LRT)、锌代谢调节响应元件(O2-site)、赤霉素响应元件(P-box)等元件,这些元件多数参与植物的生长发育与成熟衰老,表明转录因子CcbHLH130可能会在调控蜜橘的生长发育和成熟衰老方面起重要作用。
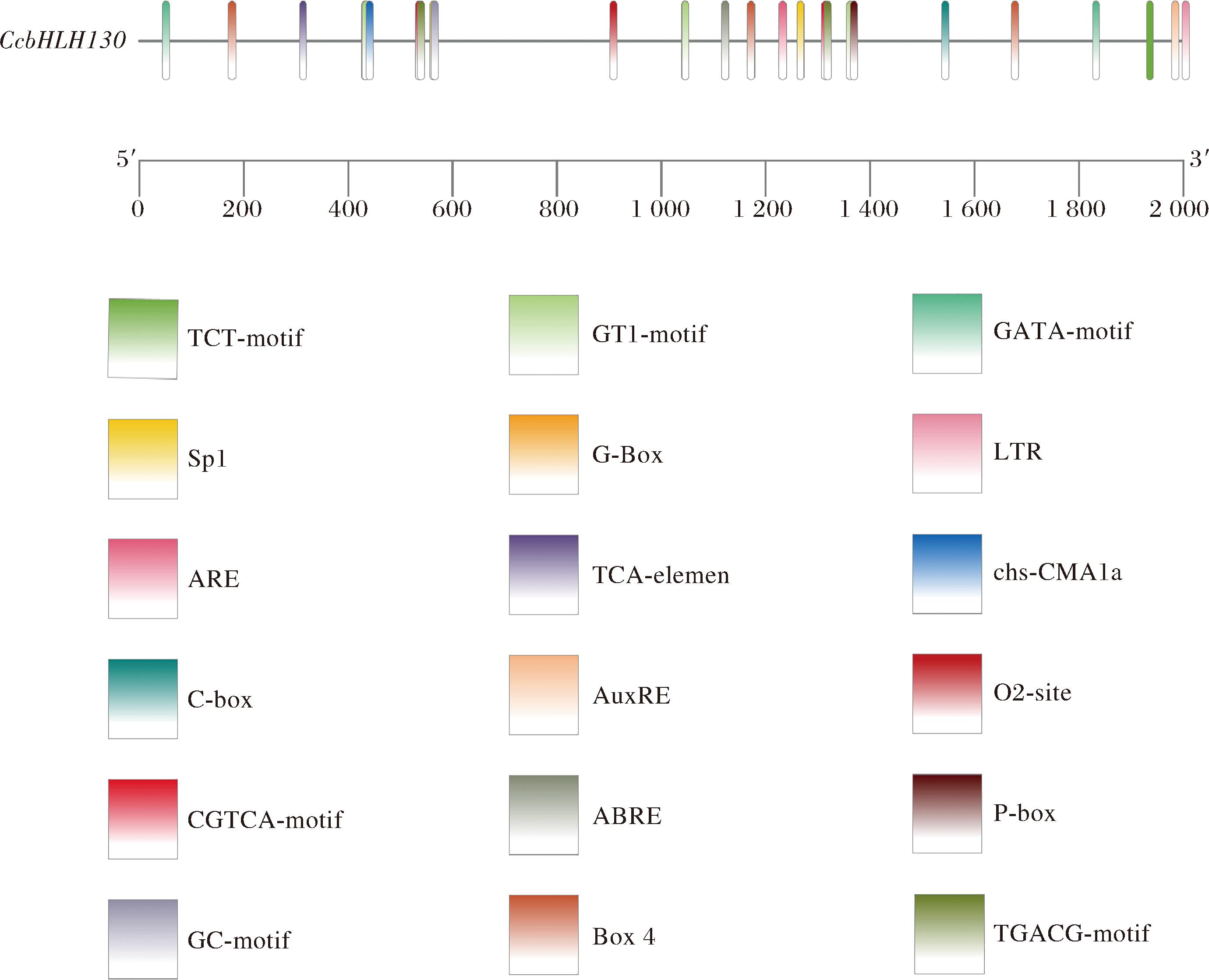
图5 CcbHLH130启动子顺式作用元件分析
Fig.5 CcbHLH130 promoter cis-acting progenitor analysis
2.6 转录因子CcbHLH130对烟草及蜜橘果实色泽的调控作用
2.6.1 转录因子CcbHLH130对烟草色泽的调控作用
为了评估转录因子CcbHLH130在色泽调控方面的功能,进行了烟草瞬时转化实验。将含有pCAMBIA2300-CcbHLH130或pCAMBIA2300(作为对照)载体的农杆菌导入烟草叶片。注射融合载体后烟草叶片在2 d时后明显黄化,然而注射空载的烟草叶片无明显表型(图6-a),同时对烟草叶片叶绿素a、叶绿素b及代谢物进行分析发现,叶绿素a、叶绿素b及代谢物均呈下降趋势(图6-b),其中,叶绿素a、脱植基叶绿素b含量显著下降(P<0.05),叶绿素a、脱植基叶绿素含量b较对照组分别下降了24.23%和45.90%,因此推测CcbHLH130可能会促进叶绿素降解。
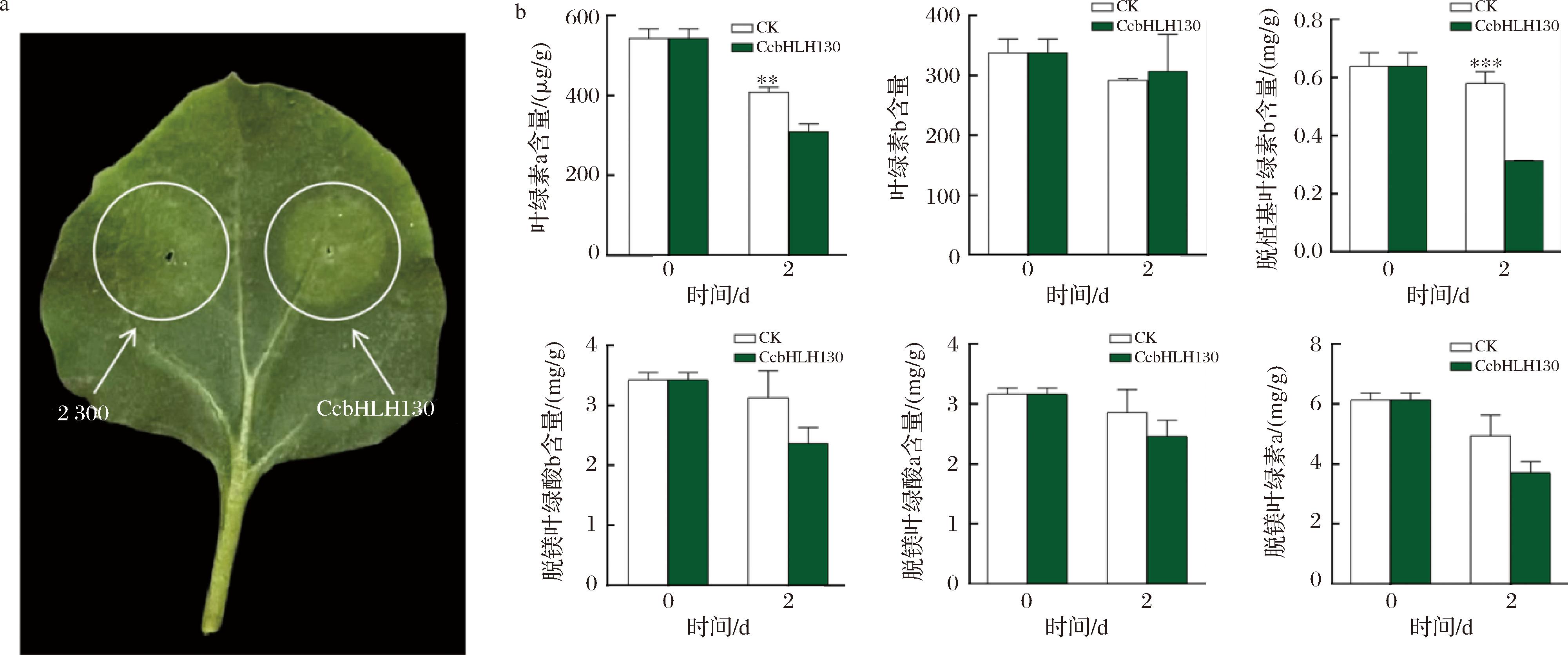
a-瞬时转化CcbHLH130后烟草叶片外观;b-烟草叶绿素a、叶绿素b以及代谢物含量
图6 烟草瞬时转化CcbHLH130叶片外观及叶绿素a、叶绿素b以和代谢物含量变化
Fig.6 Changes in leaf appearance and chlorophyll a, chlorophyll b, and metabolite content in tobacco transiently transformed CcbHLH130
2.6.2 转录因子CcbHLH130对蜜橘果皮色泽的调控作用
为探究转录因子CcbHLH130与柑橘果皮色素代谢的关系,进行了蜜橘果实瞬时转化实验,将pCAMBIA2300-CcbHLH130融合过表达载体注射到柑橘果皮中,以pCAMBIA2300为对照,瞬时转化CcbHLH130。pCAMBIA2300-CcbHLH130注射周围的区域第3天开始变黄,第5天明显变黄,而对照组仍是绿色(图7-a)。为了确定CcbHLH130的表达,进行了qPCR验证,结果显示CcbHLH130在瞬时转化第1天相对表达量是第0天的34倍(图7-b),说明其过表达。随后,对注射孔周围区域色差值进行测定,结果如图7-c显示,瞬转部位果皮L*值和b*值均显著升高(P<0.05)。对蜜橘果皮色素检测结果也表明,与对照相比,瞬时转化CcbHLH130显著降低了渗透部位周围果皮中叶绿素a、叶绿素b、脱植基叶绿素b、脱植基叶绿素a、脱镁叶绿酸b、脱镁叶绿酸a、脱镁叶绿素a的含量(P<0.05),分别较对照降低了53.42%、30.85%、45.20%、58.87%、45.81%、43.28%和78.29%(图7-d)。而2组果实中,紫黄质、玉米黄素、叶黄素含量均无显著差异(图7-e)。以上结果表明,转录因子CcbHLH130可能主要参与调控蜜橘果实中叶绿素的代谢,通过调控叶绿素降解进而促进蜜橘果皮转色。
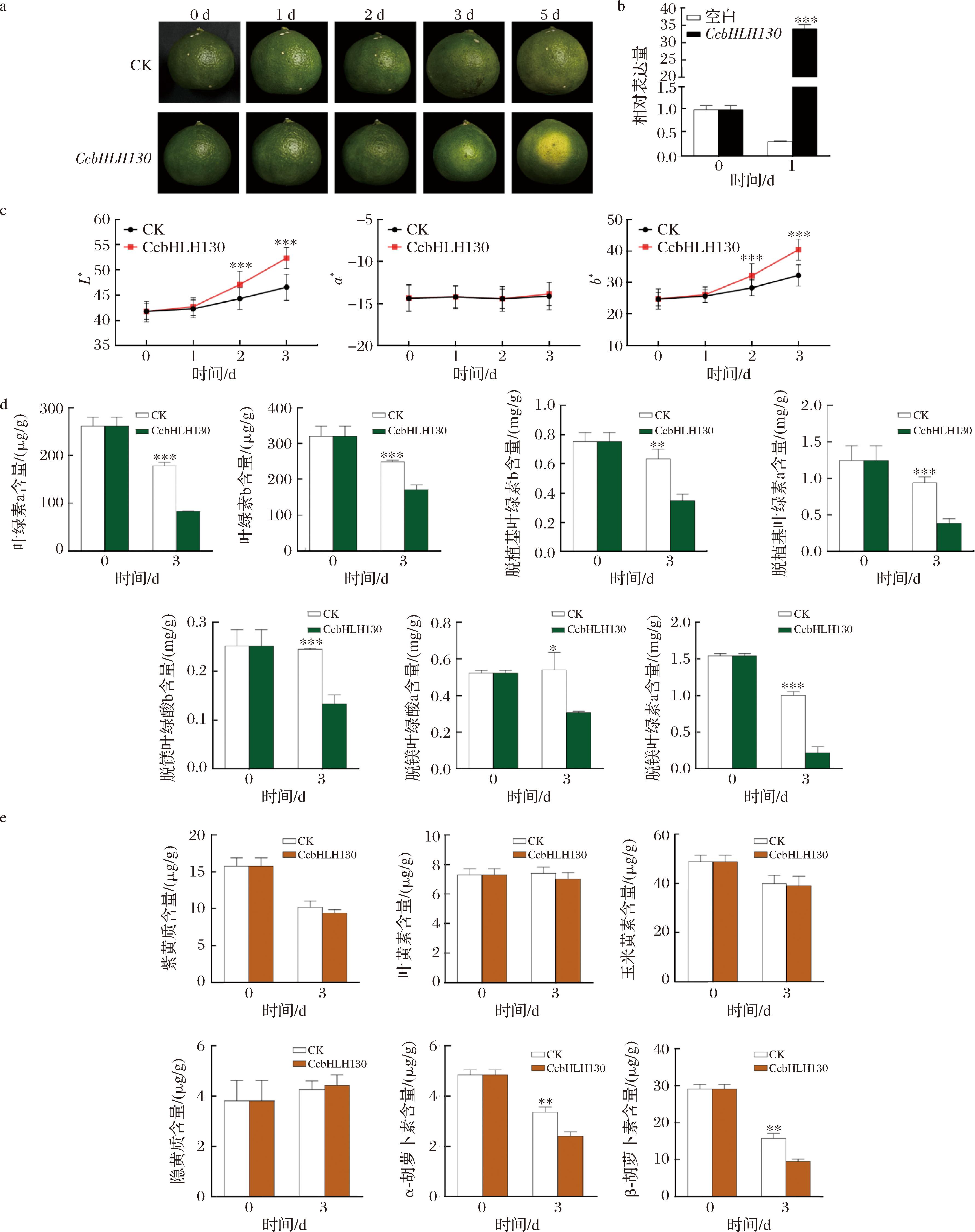
a-瞬时转化CcbHLH130后蜜橘果皮外观;b-瞬时转化后蜜橘果皮中CcbHLH130相对表达量;c-蜜橘果皮色差值; d-蜜橘果皮叶绿素a、b及其代谢物含量;e-蜜橘类胡萝卜素代谢物含量
图7 蜜橘瞬时转化CcbHLH130后果皮外观,果皮中CcbHLH130相对表达量,果皮色差值,果皮叶绿素a、叶绿素b及其代谢物含量和胡萝卜素代谢物含量变化
Fig.7 Appearance of peel after transient conversion of CcbHLH130 in mandarin fruit, relative expression of CcbHLH130 in the peel, peel color difference values, and changes in the content of chlorophylls a and chlorophylls b and their metabolites and the content of carotenoid metabolites in the peel
注:*表示P<0.05。
2.6.3 CcbHLH130对蜜橘果皮中质体超微结构影响
果皮质体的超微结构变化如图8所示。第0天时蜜橘果皮叶绿体结构呈细长椭圆形,清晰完整,其中类囊体作为叶绿素存在的场所,排列规则,基粒片层清晰可见,垛叠类囊体数目较多;形成了典型的基粒结构,此时果皮外观呈现绿色。第3天时对照组蜜橘果皮有色体形状开始变化,由原来的细长椭圆形发展为不规则椭圆形,类囊体结构开始解体,片层结构开始模糊,此时,类囊体系统逐渐变得紊乱,说明伴随果皮色泽由绿转黄,叶绿体开始向有色体分化;第3天时瞬时转化CcbHLH130组蜜橘果皮有色体形状更为不规则,类囊体大量解体为丝状,形成一些无序结构,并出现一些散乱排布的小颗粒状结构,质间空间变大,质体膜部分模糊即说明叶绿体正在分化为有色体,果皮外观变黄。
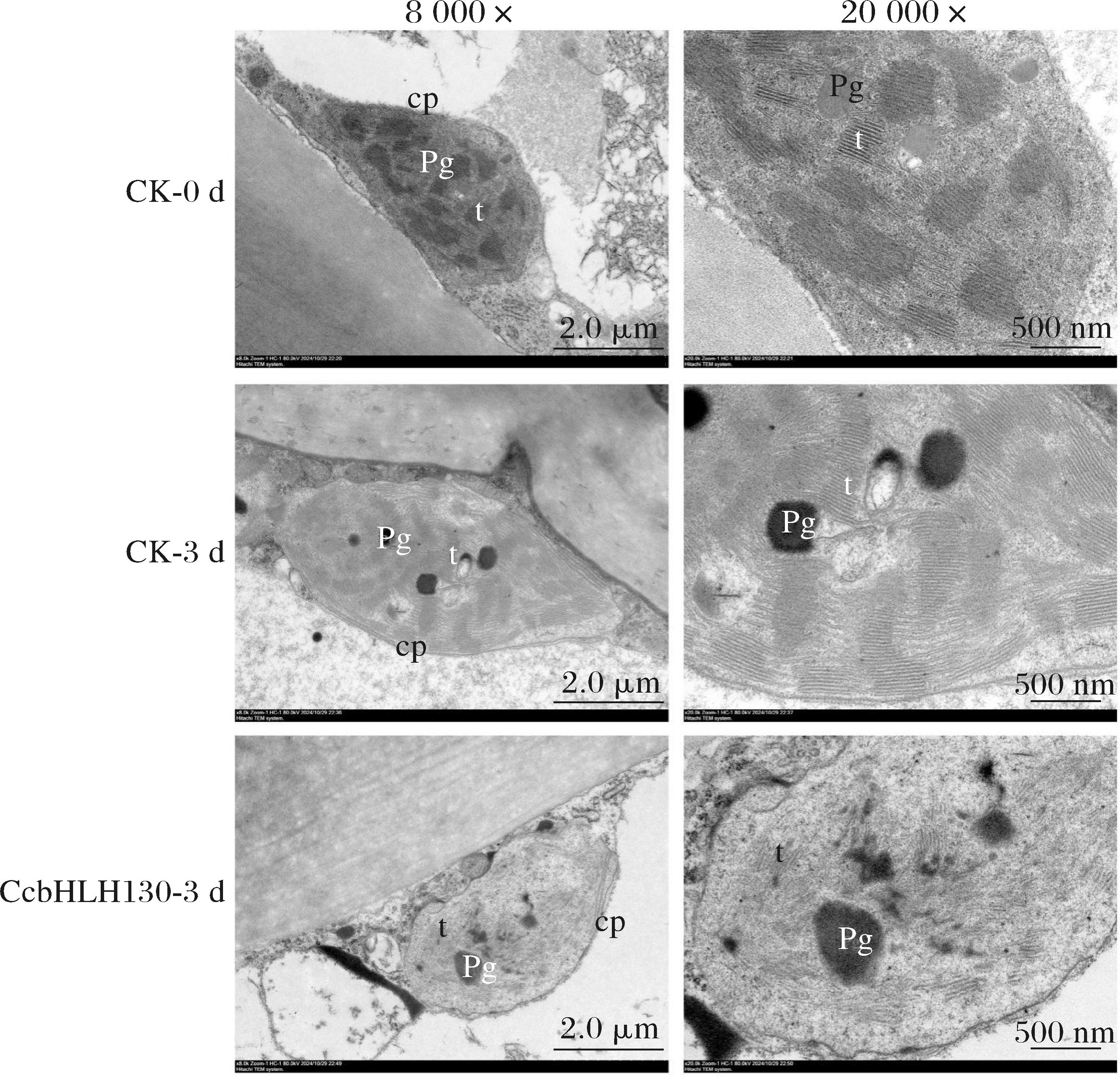
cp-叶绿体;Pg-质体小球;t-类囊体。
图8 蜜橘转色过程中质体形态
Fig.8 Plastid morphology during mandarin fruit color transitions
2.6.4 转录因子CcbHLH130对叶绿素降解相关结构基因表达的影响
利用qPCR对瞬时转化蜜橘果皮中与叶绿素降解相关的结构基因的表达进行了分析。结果如图9所示,CcbHLH130瞬时转化第2天显著升高了叶绿素降解途径相关基因CcNYC1,CcChlase1-2,CcHCAR,CcRCCR的表达(P<0.05),综合以上结果,说明瞬时转化CcbHLH130调控了叶绿素降解途径中关键基因CcNYC1、CcChlase1-2、CcHCAR和CcRCCR的表达,从而直接促进蜜橘果皮叶绿素的降解,加速蜜橘果皮转色。
a-CcNYC1;b-CcChlase1-2;c-CcHCAR;d-CcRCCR
图9 叶绿素降解相关基因相对表达量
Fig.9 Relative expression of chlorophyll degradation-related genes
3 结论与讨论
重庆地区早熟蜜橘着色不均对其品质和市场价值产生负面影响,因此了解果皮着色的内在机制对于提高蜜橘的外观质量和市场竞争力至关重要。本研究通过对红光处理蜜橘的转录组数据分析鉴定出CcbHLH130转录因子,其表达在红光照射过程中显著上调。然而,CcbHLH130在果皮着色过程中的功能仍不清楚。
研究表明,光信号通过调控转录因子的表达或活性,深刻影响植物的次生代谢和色素积累过程。红光作为一种关键的环境信号,可以通过光受体激活一系列下游信号转导途径,从而调控与色素代谢相关的基因表达[24]。例如红光激活拟南芥phyB和SPA1进而促进光形态建成[25]。本研究推测红光信号可能通过调节CcbHLH130的表达或活性,间接调控果实色泽变化过程。
叶绿素降解是许多水果中发生的常见过程,传统上作为指示水果成熟的标志物[26]。其降解对于水果作物的着色至关重要,一般经由多步骤途径分解,使果皮颜色发生变化,从而展现果实成熟的状态[27]。在柑橘黄化过程中,叶绿素a、叶绿素b、脱植基叶绿素b、脱植基叶绿素a、脱镁叶绿酸b、脱镁叶绿酸a和脱镁叶绿素a的含量的变化均直接或间接地推动了果实褪绿和黄化的过程。其中叶绿素a和叶绿素b是与黄化最相关的指标,叶绿素a是植物主要的光合色素,其快速降解显著影响柑橘果皮褪绿,是黄化初期阶段的主要驱动力。叶绿素b作为辅助光捕获色素,其降解速率较慢,但在黄化后期显著加速,为果皮颜色的黄色显现提供了重要贡献。各代谢产物是叶绿素降解过程中产生的重要中间产物,其含量在黄化过程中逐渐下降,表明这些中间产物被进一步转化或降解。同时,各代谢产物含量低,其变化对果实表观颜色的直接贡献较小,但在叶绿素代谢平衡中发挥了重要的中间作用[28]。
在过去几十年的研究中,已经阐明了几种叶绿素降解酶,如脱镁叶绿酸α加氧酶[29]和叶绿素酶[30]。编码这些降解酶的基因过表达促进了果实成熟和叶片衰老过程中叶绿素的分解,在这些机制中,基因的转录调控在响应环境和内源信号的叶绿素降解中起着至关重要的作用。许多转录因子都会直接或间接参与叶绿素降解调控,如bHLH家族SlPRE2通过促进叶绿素相关基因GOLDEN 2-LIKE和RbcS表达的降低,使番茄果实果皮叶绿素积累减少[12];CrMYB33在柑橘果实中的表达干扰导致叶绿素降解速率减慢,相反,CrMYB33在番茄中的过表达增强叶绿素降解[31];CitERF13直接结合CitPPH启动子进而促进烟草叶片中叶绿素的快速降解[32]等。与这些研究结果类似,本研究发现,转录因子CcbHLH130可调控蜜橘果皮叶绿素代谢,在烟草叶片瞬时转化CcbHLH130 2 d后,烟草叶片出现明显的黄化现象,叶绿素a及脱植基叶绿素b的含量显著低于对照果实;在蜜橘果皮瞬时转化CcbHLH130 3 d后,果皮变黄,叶绿素及其代谢物含量明显低于对照组;同时果皮中叶绿素降解相关基因CcNYC1、CcChlase1-2、CcHCAR和CcRCCR明显上调表达。
综上所述,本研究鉴定到一个在红光照射加速蜜橘转色过程中发挥重要作用的bHLH转录因子CcbHLH130,它通过诱导蜜橘果皮中与叶绿素降解有关的基因的表达来加速蜜橘果实转色,但该转录因子并没有促进果皮中类胡萝卜素代谢物的积累,因此本文推测它可能主要通过促进叶绿素的降解来促进蜜橘果实转色。上述结果为进一步研究柑橘果实采后着色提供了理论参考,并加强了对bHLH转录因子家族功能的研究。
[1] RODRIGO M J, ALQUÉZAR B, AL S E, et al.Biochemical bases and molecular regulation of pigmentation in the peel of citrus fruit[J].Scientia Horticulturae, 2013,163:46-62.
S E, et al.Biochemical bases and molecular regulation of pigmentation in the peel of citrus fruit[J].Scientia Horticulturae, 2013,163:46-62.
[2] PORRAS I, BROTONS J M, CONESA A, et al.Influence of temperature and net radiation on the natural degreening process of grapefruit (Citrus paradisi Macf.) cultivars Rio Red and Star Ruby[J].Scientia Horticulturae, 2014,173:45-53.
[3] TAO J, ZHANG S L, AN X M, et al.Effects of light on carotenoid biosynthesis and color formation of citrus fruit peel[J].Ying Yong Sheng Tai Xue Bao, 2003,14(11):1833-1836.
[4] MA G, ZHANG L C, KATO M, et al.Effect of blue and red LED light irradiation on β-cryptoxanthin accumulation in the flavedo of Citrus fruits[J].Journal of Agricultural and Food Chemistry, 2012,60(1):197-201.
[5] GONG J L, YANG H B, XU Y N, et al.Differential regulation of red light- and ethephon-induced degreening in postharvest kumquat fruit[J].Postharvest Biology and Technology, 2023,198:112264.
[6] YUAN Z Y, DENG L L, YIN B F, et al.Effects of blue LED light irradiation on pigment metabolism of ethephon-degreened mandarin fruit[J].Postharvest Biology and Technology, 2017,134:45-54.
[7] LU Y X, SHEN X C, LI Y C, et al.Regulation of chlorophyll and carotenoid metabolism in Citrus fruit[J].Horticultural Plant Journal, 2025,11(3): 951-962.
[8] JIAO Y L, LAU O S, DENG X W.Light-regulated transcriptional networks in higher plants[J].Nature Reviews Genetics, 2007,8(3):217-230.
[9] TOLEDO-ORTIZ G, HUQ E, QUAIL P H.The Arabidopsis basic/helix-loop-helix transcription factor family[J].The Plant Cell, 2003,15(8):1749-1770.
[10] MENKENS A E, SCHINDLER U, CASHMORE A R.The G-box:A ubiquitous regulatory DNA element in plants bound by the GBF family of bZIP proteins[J].Trends in Biochemical Sciences, 1995, 20(12):506-510.
[11] LIU Q, DENG S F, LIU L, et al.The chlorophyll and carotenoid metabolism in postharvest mandarin fruit peels is co-regulated by transcription factor CcbHLH35[J].Postharvest Biology and Technology, 2024,216:113030.
[12] ZHU Z G, CHEN G P, GUO X H, et al.Overexpression of SlPRE2, an atypical bHLH transcription factor, affects plant morphology and fruit pigment accumulation in tomato[J].Scientific Reports, 2017,7:5786.
[13] SANAGI M, AOYAMA S, KUBO A, et al. Low nitrogen conditions accelerate flowering by modulating the phosphorylation state of FLOWERING BHLH 4 in Arabidopsis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2021, 118(19): e2022942118.
[14] ZHAO Q, FAN Z H, QIU L N, et al.MdbHLH130, an apple bHLH transcription factor, confers water stress resistance by regulating stomatal closure and ROS homeostasis in transgenic tobacco[J].Frontiers in Plant Science, 2020,11:543696.
[15] ZHANG Y Q, LIU Z J, CHEN Y D, et al.Phytochrome-interacting factor 5 (PIF5) positively regulates dark-induced senescence and chlorophyll degradation in Arabidopsis[J].Plant Science, 2015,237:57-68.
[16] WANG H L, LIU Q, DENG S F, et al.Transcription factor CcbHLH66 regulates mandarin fruit coloration via modulating the expression of chlorophyll degradation related genes CcRCCR and CcNYC[J].Postharvest Biology and Technology, 2024,218:113188.
[17] 刘倩, 邓淑芳, 刘玲, 等.转录因子CcbHLH107调控蜜橘果实转色的功能分析[J].食品科学, 2024,45(15):194-204.LIU Q, DENG S F, LIU L, et al.Functional analysis of the transcription factor CcbHLH107 regulating the color change of mandarin fruit[J].Food Science, 2024,45(15):194-204.
[18] LOVE M I, HUBER W, ANDERS S.Moderated estimation of fold change and dispersion for RNA-seq data with DESeq2[J].Genome Biology, 2014,15(12):550.
[19] 张暄, 陈鸥, 王文军, 等.ZjERF098鉴定及其提高冬枣黑斑病抗病性的效果研究[J].食品与发酵工业, 2025, 51(1):55-63.ZHANG X, CHEN O, WANG W J, et al.Identification of ZjERF098 and investigation of its enhancing effect on winter jujube resistance to black spot rot[J].Food and Fermentation Industries, 2025, 51(1):55-63.
[20] WANG W J, LI T, CHEN J L, et al.A self-regulated transcription factor CsWRKY33 enhances resistance of Citrus fruit to Penicillium digitatum[J].Postharvest Biology and Technology, 2023,198:112267.
[21] GE X X, CAO T T, YI L H, et al.Low and high storage temperature inhibited the coloration of mandarin fruit (Citrus unshiu Marc.) with different mechanism[J].Journal of the Science of Food and Agriculture, 2022, 102(15):6930-6941.
[22] DAS A, GUYER L, HÖRTENSTEINER S. Chlorophyll and Chlorophyll Catabolite Analysis by HPLC[M]. New York, NY: Springer New York, 2018:223-235.
[23] DENG L L, YUAN Z Y, XIE J, et al.Sensitivity to ethephon degreening treatment is altered by blue LED light irradiation in mandarin fruit[J].Journal of Agricultural and Food Chemistry, 2017,65(30):6158-6168.
[24] QUAIL P H.Photosensory perception and signalling in plant cells:New paradigms?[J].Current Opinion in Cell Biology, 2002,14(2):180-188.
[25] LU X D, ZHOU C M, XU P B, et al.Red-light-dependent interaction of phyB with SPA1 promotes COP1-SPA1 dissociation and photomorphogenic development in Arabidopsis[J].Molecular Plant, 2015,8(3):467-478.
[26] LU S W, ZHANG M W, ZHUGE Y X, et al.VvERF17 mediates chlorophyll degradation by transcriptional activation of chlorophyll catabolic genes in grape berry skin[J].Environmental and Experimental Botany, 2022,193:104678.
[27] JIBRAN R, SULLIVAN K L, CROWHURST R, et al.Staying green postharvest:How three mutations in the Arabidopsis chlorophyll b reductase gene NYC1 delay degreening by distinct mechanisms[J].Journal of Experimental Botany, 2015,66(21):6849-6862.
[28] HÖRTENSTEINER S, MATILE P.12 - How Leaves Turn Yellow:Catabolism of Chlorophyll[M].NOODÉN L D.Plant Cell Death Processes.San Diego:Academic Press, 2004:189-202.
[29] AUBRY S, FANKHAUSER N, OVINNIKOV S, et al.Pheophorbide a may regulate jasmonate signaling during dark-induced senescence[J].Plant Physiology, 2020,182(2):776-791.
[30] HARPAZ-SAAD S, AZOULAY T, ARAZI T, et al.Chlorophyllase is a rate-limiting enzyme in chlorophyll catabolism and is posttranslationally regulated[J].The Plant Cell, 2007,19(3):1007-1022.
[31] TIAN S L, YANG Y Y, FANG B, et al.The CrMYB33 transcription factor positively coordinate the regulation of both carotenoid accumulation and chlorophyll degradation in the peel of Citrus fruit[J].Plant Physiology and Biochemistry, 2024,209:108540.
[32] YIN X R, XIE X L, XIA X J, et al.Involvement of an ethylene response factor in chlorophyll degradation during Citrus fruit degreening[J].The Plant Journal, 2016,86(5):403-412.