酱香型白酒,作为中国三大白酒香型之一,因其独特的香气和复杂的风味广受消费者青睐,在中国酒类市场中占据核心地位[1]。酱香型白酒主要采用高粱为原材料,通过多轮蒸煮、发酵和蒸馏的复杂工艺精制而成。据不完全统计,每年产生约1亿t酒糟,因其大量堆积造成资源浪费和环境负担[2]。酒糟中的粗蛋白含量高达26.0%~31.7%(质量分数),常作为蛋白源添加到饲料中[3]。然而,由于酒糟中纤维类物质含量高,导致蛋白质难以降解而未能被有效利用[4]。因此,如何实现酒糟的高值化利用,减少环境污染并提升其经济价值,仍是一个待解决的难题。
通过酶解提高酒糟中的高粱醇溶性蛋白利用率是一个可行方案。在底物水解过程中所使用的酶类型在决定水解产物性质方面起着关键作用。因酶在底物特异性、活性部位及催化机制方面具有差异性,其水解产物的氨基酸组成、肽链长度和分子质量分布有所不同。例如CASTRO-J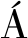 COME等[5]发现,胰蛋白酶会优先裂解疏水性氨基酸(如亮氨酸、苯丙氨酸)附近的肽键,测得其酶解获得的多肽具有血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性和降血糖活性,但抗氧化活性较弱。XU等[6]使用中性蛋白酶水解高粱醇溶性蛋白得到的多肽,在自由基清除能力、金属离子螯合能力、还原能力和氧自由基吸收能力等方面具有较强的活性。ALASHI等[7]发现,碱性蛋白酶通过裂解碱性氨基酸(如赖氨酸、精氨酸)附近的肽键,可生成具抗氧化应激能力的活性成分。因此,由于酶的底物特异性,在多肽链上的裂解位置不同,从而形成独特的氨基酸组成、肽链长度、分子质量和结构特征,这些因素最终决定了水解产物的生物活性。所以,选择合适的酶种类和优化酶解条件,对获得具有特定生物活性的水解产物至关重要。
COME等[5]发现,胰蛋白酶会优先裂解疏水性氨基酸(如亮氨酸、苯丙氨酸)附近的肽键,测得其酶解获得的多肽具有血管紧张素转化酶(angiotensin converting enzyme,ACE)抑制活性和降血糖活性,但抗氧化活性较弱。XU等[6]使用中性蛋白酶水解高粱醇溶性蛋白得到的多肽,在自由基清除能力、金属离子螯合能力、还原能力和氧自由基吸收能力等方面具有较强的活性。ALASHI等[7]发现,碱性蛋白酶通过裂解碱性氨基酸(如赖氨酸、精氨酸)附近的肽键,可生成具抗氧化应激能力的活性成分。因此,由于酶的底物特异性,在多肽链上的裂解位置不同,从而形成独特的氨基酸组成、肽链长度、分子质量和结构特征,这些因素最终决定了水解产物的生物活性。所以,选择合适的酶种类和优化酶解条件,对获得具有特定生物活性的水解产物至关重要。
蛋白质降解所产生的多肽具有多种生物活性,但由于其在机体利用过程中容易被酶分解,导致其难以到达特定位置发挥生物活性[8]。目前已有研究者利用生物相容性与低毒性的脂质体,开发多肽递送载体,用于治疗内分泌疾病的肽,如胰岛素[9]。然而,脂质体在口服条件下并不稳定,容易受到温度、pH和贮存条件的影响。也有研究表明,多肽与脂质体结合能够克服胃肠道结构组织和生理功能有关的实质性障碍[10]。因此,本研究利用纳米脂质体包埋技术制备酒糟纳米肽,并进一步分析其结构特征、抗氧化、胃肠液消化稳定等性质。
1 材料与方法
1.1 材料与试剂
酒糟为湘窖酒业有限公司车间第八轮发酵后的酱香型白酒糟;无水乙醇、碱性蛋白酶、木瓜蛋白酶、胰蛋白酶、胃蛋白酶,北京索莱宝有限公司;谷胱甘肽、磷酸二氢钠、磷酸氢二钠十二水合物、焦亚硫酸钠、卵磷脂、胆固醇,上海麦克林试剂有限公司;其他化学品和试剂均为分析级,国药化学试剂公司。
1.2 仪器与设备
SHZ循环真空水泵,中国长沙肯基科技发展有限公司;UV-2600紫外分光光度仪,日本岛津有限公司;SCI-VS漩涡混合仪,美国赛洛捷克公司;Scientz-10 N冷冻干燥机,中国宁波新芝生物科技股份有限公司;PowerPac HC电泳仪,Bio-Rad Laboratories公司;Zetasizer Nano ZS90纳米粒度电位仪,英国马尔文帕纳科公司;F-7000荧光分光光度计、HT7700透射电子显微镜,日本日立公司;Nicolet iS5傅里叶红外光谱仪,中国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 酒糟醇溶性蛋白的提取
酒糟至烘干机40 ℃低温烘干24 h,过筛分离酒糟和谷壳,根据DB13/T 1098—2009《饲料中蛋白质的测定》使用凯氏定氮仪测定总氮含量为6.93%~7.29%(质量分数,氮对蛋白质的转化系数为6.25)。酒糟醇溶性蛋白提取根据候梦媛等[11]的方法稍作更改,取脱壳酒糟20 g,溶解于提取液含有0.5%(质量分数)焦亚硫酸钠、0.35%(质量分数)氢氧化钠的70%(体积分数)乙醇溶液,按料液比1∶10(g∶mL)与酒糟混合,70 ℃搅拌提取1 h,室温下3 500×g离心10 min,重复3次,收集上清液;用水将上清液的乙醇浓度稀释至40%(体积分数),至-20 ℃静置24 h以上,3 500×g离心10 min,收集沉淀,冻干;正己烷脱脂,重复3次,即得酒糟醇溶蛋白(distiller’s grain prolamin,DGP)。冷冻干燥成粉末,称量,-20 ℃保存备用。
1.3.2 酒糟肽的制备及其工艺优化
参照LIU等[12]方法,取适量上述所得酒糟醇溶蛋白溶于水中,按2%(质量分数)分别加入蛋白酶(胰蛋白酶、木瓜蛋白酶、碱性蛋白酶),根据制造商手册将其调至各蛋白酶最适pH值(胰蛋白酶为7.5、木瓜蛋白酶为6.0、碱性蛋白酶为8.5),并在最适温度(胰蛋白酶为35 ℃、木瓜蛋白酶为50 ℃、碱性蛋白酶为50 ℃)下进行酶解。酶解产物用100 kDa和3 kDa 超滤膜依次进行超滤,最后收集<3 kDa的滤出液。冷冻干燥成粉末,-20 ℃保存备用。
利用SDS-PAGE分析酒糟蛋白的降解情况。样品(100 mg/mL)SDS化后,各吸取10 μL分别点样于聚丙烯酰胺凝胶孔中,凝胶为5 g/L堆叠凝胶和150 g/L分离凝胶。电泳仪工作电压为120 V,当指示剂染料到达距离凝胶下端1 cm处时停止电泳。
根据SDS-PAGE结果选择最适酶对酒糟进行酶解,分别在酶解温度(50、55、60、65、70 ℃)、酶解时间(2、2.5、3、3.5、4 h)、酶添加量(0.1%、0.5%、1%、1.5%、2%,质量分数)条件下进行单因素试验。基于单因素试验结果,酒糟肽的制备工艺采用响应面实验进行优化,以酶解温度、酶解时间和酶添加量为3个因素,每个因素设置3个水平。以多肽浓度(Y)作为响应值,建立数学模型,利用Design Expert 13.0软件建立Box-Behnken实验设计,并对结果进行分析。
1.3.3 酒糟肽的抗氧化活性测定
参照本实验室之前建立方法稍作修改[13],测定DPPH自由基清除能力。将500 μL样品与500 μL 0.2 mmol/L DPPH自由基(以体积分数为95%乙醇溶解制成)混合,室温下避光反应30 min,在517 nm处测定吸光度。所有数据均以3次重复分析的“平均值±标准差”表示。DPPH自由基清除率计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:Abssample,样品在DPPH自由基存在下的吸光度;Abscontrol,95%乙醇(体积分数)在DPPH自由基存在下的吸光度;Absblank,样品在不含DPPH自由基时的吸光度。以谷胱甘肽为阳性对照。
参照本实验室之前建立方法[13],测定ABTS阳离子自由基清除能力。制备ABTS阳离子自由基原液(含7 mmol/L ABTS和2.45 mmol/L过硫酸钾),避光保存14 h。将ABTS阳离子自由基原液与过硫酸钾(0.5 mmol/L,pH 7.4)混合,使其在734 nm处吸光度为0.70±0.05,即得ABTS阳离子自由基工作液。取200 μL样品与3 mL ABTS阳离子自由基工作液避光反应6 min,测定734 nm处吸光度。所有数据均以3次重复分析的“平均值±标准差”表示。ABTS阳离子自由基清除率计算如公式(2)所示:
ATBS阳离子自由基清除率![]()
(2)
式中:Abss,200 μL样品与3 mL ABTS阳离子自由基工作液的吸光度;Abs0,200 μL缓冲液与3 mL ABTS阳离子自由基工作液的吸光度。以谷胱甘肽为阳性对照。
1.3.4 酒糟纳米肽的制备及其表征
采用薄膜乳化超声法制备纳米肽[14],将80 mg卵磷脂、胆固醇按料液比为10∶1(g∶mL),溶解于10 mL纯水制备成空载脂相。在1 000 r/min下60 ℃搅拌3 min,使用探针超声器在20 kHz下超声5 min后,获得的样品立即在冰浴中冷却,持续搅拌以固化脂质颗粒,制得空载脂质体。以不同质量比0%、0.625%、1.25%、2.5%、5%(质量分数)在空白脂相中分别加入酒糟肽溶液。然后按照上述相同方法制备成酒糟纳米肽。
包埋率(encapsulation efficiency,EE)的测定,根据刘梦哲等[15]方法稍作修改,将纳米颗粒在10 000×g离心10 min,以去除未包封的沉淀。采用紫外-可见分光光度计在280 nm处测定,标准曲线为(R2=0.999)。通过计算被包封的样品(上清液)与最初加入到脂质体溶液中的样品的百分比来确定EE。
使用Zetasizer Nano ZS90仪器测量脂质体的Z-均粒径、多分散性指数(polydispersity index,PDI)和Zeta电位进行酒糟纳米肽进行表征。用超纯水将样品稀释30倍获得分散体,用微电泳测定Zeta电位。
1.3.5 傅立叶红外光谱分析
利用傅里叶变换红外光谱(fourier transform infrared spectroscopy,FTIR)分析酒糟纳米肽的结构特征。将空白脂质体和酒糟纳米肽冻干粉分别与溴化钾混合,制成颗粒,使用Fisher Scientific Nicolet iS5光谱仪进行测量,波数为500~4 000 cm-1,分辨率为4 cm-1。
1.3.6 荧光光谱分析
根据RUZZA等[16]方法,利用样品的内源荧光(色氨酸)评估其对磷脂囊泡的亲和力。采用荧光分光光度计,在激发波长为280 nm,发射波长为300~500 nm的条件下,测定含有4、2、1、0.5 mg/mL样品溶液在pH 7.0下不同反应时间的荧光光谱,当标记的肽处于更疏水的环境中时,荧光素的发射会猝灭。利用荧光猝灭法通过内源荧光信号的变化分析酒糟纳米肽与脂质体的结合情况。
1.3.7 透射电子显微镜观察
酒糟纳米肽在-20 ℃下保存下,使用透射电子显微镜进行形态学观察。首先将一滴样品分散体滴在200目铜网上,在室温下风干。然后用2%(体积分数)磷钨酸对样品进行阴性染色,并在80 kV电压下进行分析。
1.3.8 模拟体外胃肠道消化
在HUANG等[14]的研究基础上稍作修改,分析样品在模拟胃肠道条件下的物理稳定性。将1 mL样品依次与9 mL模拟胃液(simulated gastric fluid,SGF,pH值为2,加入1 mg/mL胃蛋白酶)混合,在-37 ℃下孵育2 h,与9 mL模拟肠液(simulated intestinal fluid,SIF,pH值为7.5,加入10 mg/mL胰蛋白酶)混合,在37 ℃下再孵育4 h,测定游离多肽浓度。如1.3.4节计算被包封的样品(上清液)与最初加入到脂质体溶液中的样品的百分比来确定释放率,以空载脂质体为对照。
2 结果与分析
2.1 酒糟肽的制备工艺优化
酒糟醇溶性蛋白分子质量为17~33 kDa,成分主要由高粱α-醇溶性蛋白和β-醇溶性蛋白组成[11]。以酶添加量1%(质量分数)分别加入碱性蛋白酶、木瓜蛋白酶、胰蛋白酶3种蛋白酶,对酒糟醇溶蛋白(200 mg/mL)进行酶解。SDS-PAGE分析结果如图1-a所示,碱性蛋白酶对醇溶蛋白的水解效果最为明显,而使用木瓜蛋白酶、胰蛋白酶后仍见17~33 kDa蛋白条带,说明木瓜蛋白酶、胰蛋白酶未能有效降解酒糟醇溶性蛋白。因此,后续以碱性蛋白酶制备酒糟肽。
M-Maker;C-酒糟醇溶性蛋白(200 mg/mL);泳道1-碱性蛋白酶酶解产物;泳道2-木瓜蛋白酶酶解产物;泳道3-胰蛋白酶酶解产物。a-SDS-PAGE结果;b-单因素试验结果:温度;c-单因素试验结果:酶添加量;d-单因素试验结果:时间
图1 酒糟蛋白的酶解效果分析
Fig.1 Analysis on enzymatic hydrolysis effect of distiller’s grains protein
单因素试验结果见图1-b~图1~d,在酶解温度为60 ℃时,多肽含量最高为(14.50±0.45) mg/mL;在酶解时间3 h时,多肽含量最高为(12.12±0.06) mg/mL;酶添加量为1%(质量分数)时,多肽含量最高为(17.28±0.22) mg/mL。
在单因素试验基础上设定因素水平进行响应面优化,通过响应面分析结果得到最优酶解方案条件为:酶解温度为60.21 ℃,酶解时间为3.02 h,酶添加量为1.87%(质量分数),考虑到实际可操作性,将其修正为:酶解温度为60 ℃,酶解时间为3 h,酶添加量为1.87%(质量分数)。在最优条件下制备酒糟肽,多肽浓度的理论预测值为18.54 mg/mL,实际值为18.59 mg/mL,说明此模型拟合可靠。回归模型的方差分析如表1所示,回归方程的模型P=0.000 2,F=25.60,说明模型差异性显著;模型失拟性(P=0.123 1)不显著,代表不确定因素对实验的干扰较小;R2=0.970 5,说明该模型能够解释97.05%的响应值变化,回归模型较理想,拟合度较高,可使用该模型对酒糟醇溶蛋白酶解工艺进行预测和分析。根据F值大小可以判断A、B、C 3个因素对蛋白肽浓度的影响,由大到小的顺序依次为:C(酶添加量)>B(酶解时间)>A(酶解温度)。相较于LIU等[12]的酒糟肽制备方法,本研究提前进行了酒糟蛋白提取,将大分子多糖与蛋白进行了分离。而LIU等[12]的方法则额外添加纤维素酶或淀粉酶进行预处理,且后续通过树脂纯化及活性炭脱色制备酒糟多肽。此外,本研究提取的多肽含量为18.59 mg/mL,高于LIU等[12](4.1 mg/mL)。因此,本研究所采用的酒糟肽制备方法具有工艺简单、收率高等优势。
表1 响应面实验结果及方差分析
Table 1 Experimental results and variance analysis of response surface

运行次数时间/h温度/℃酶添加量/%质量浓度/(mg/mL)响应变量平方和设计因子均方F值P值(Prob>F)12.555116.278模型22.2592.4725.600.000 222.565116.546A-温度0.001 810.001 80.018 60.895 333.555117.19143.565116.669B-时间0.081 410.081 40.842 90.389 153550.515.91663650.515.606C-酶添加量2.0912.0921.640.002 373551.516.791AB0.156 010.156 01.620.244 383651.517.475AC0.247 010.247 02.560.153 892.5600.515.569BC0.031 210.031 20.322 50.587 8103.5600.515.278A21.4711.4715.240.005 9112.5601.516.065B26.8816.8871.26<0.000 1123.5601.516.127C29.5119.5198.42<0.000 113360118.671残差0.676 170.096 614360118.435失拟性0.494 030.164 73.620.123 115360118.848净误差0.182 140.045 516360118.327总回归22.931617360118.423R2=0.970 5
2.2 酒糟肽的抗氧化活性
由表2可知,酒糟肽DPPH自由基清除能力(IC50)为0.28 mg/mL,显著高于谷胱甘肽;酒糟肽的ABTS阳离子自由基清除能力与谷胱甘肽相差不大。有研究表明,多肽的自由基清除能力与分子质量密切相关,例如AGRAWAL等[17]发现3 kDa以下多肽的DPPH自由基清除率明显高于未经过超滤的水解产物,因为分子质量较小的多肽具有更多暴露的氨基酸侧链,可以更高效地与自由基反应,转化为稳定的分子。而且经碱性蛋白酶水解酒糟醇溶性蛋白使低分子质量多肽富含疏水性和芳香性氨基酸(如Tyr、Phe和Leu),这些氨基酸具有较强的电子转移能力,从而提高抗氧化能力。因此,使用碱性蛋白酶制备的酒糟肽具有较强的抗氧化活性,通过清除自由基,阻断或终止细胞内的自由基链反应,从而保护细胞免受氧化损伤。
表2 酒糟肽抗氧化活性分析
Table 2 Antioxidant activity analysis of distiller’s grains peptide

注:不同小写字母代表差异显著性(P<0.05)(下同)。
样品IC50值/(mg/mL)DPPH自由基ABTS阳离子自由基谷胱甘肽0.76±0.32a0.99±0.22a酒糟肽 0.28±0.10b1.11±0.20a
2.3 酒糟纳米肽的结构表征
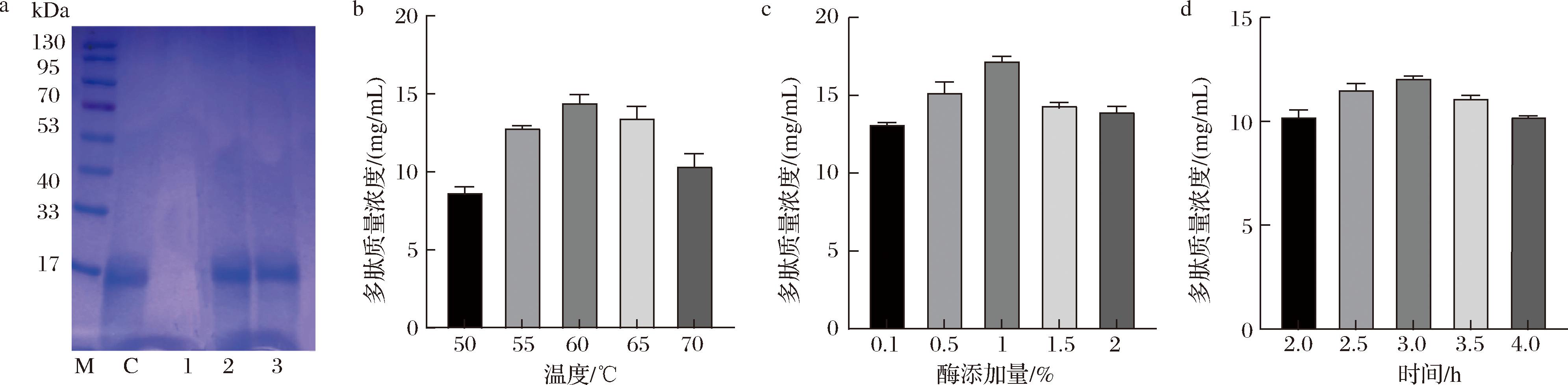
由表3可知,当酒糟多肽质量浓度增加至2 mg/mL时,Z-均粒径开始下降而PDI升高,Zeta电位绝对值升高。随着酒糟多肽质量浓度继续增加到4 mg/mL时,Z-均粒径明显上升而PDI出现明显下降。这可能是由于较高浓度的酒糟多肽增加了超声过程中的黏度,导致颗粒变大。虽然多肽质量浓度为0.5 mg/mL和1 mg/mL制备的脂质体表现较为稳定,但EE较低,随着多肽浓度增大,出现颗粒增大的趋势。因此,选择2 mg/mL酒糟肽质量浓度制备酒糟纳米肽较为理想。
表3 酒糟纳米肽的Z-均粒径、PDI、Zeta电位和EE测定
Table 3 Determination of Z-average diameter, PDI, Zeta potential, and EE of nanopeptides from distiller’s grains
注:“-”表示无数据。
样品名多肽添加量/(mg/mL)Z-均粒径/nmPDIZeta电位/mVEE/%空载脂质体0124.57±0.45e0.24±0.01d-17.90±1.11b-0.5146.73±1.43d0.29±0.03cd-17.27±0.47ab75.33±9.87c酒糟肽 1169.50±2.78c0.35±0.01ab-16.30±0.78a70.67±4.32b2155.80±1.92b0.39±0.02a-17.33±0.21ab96.67±4.26a4229.57±1.84a0.33±0.02bc-19.73±1.10c96.50±1.43a
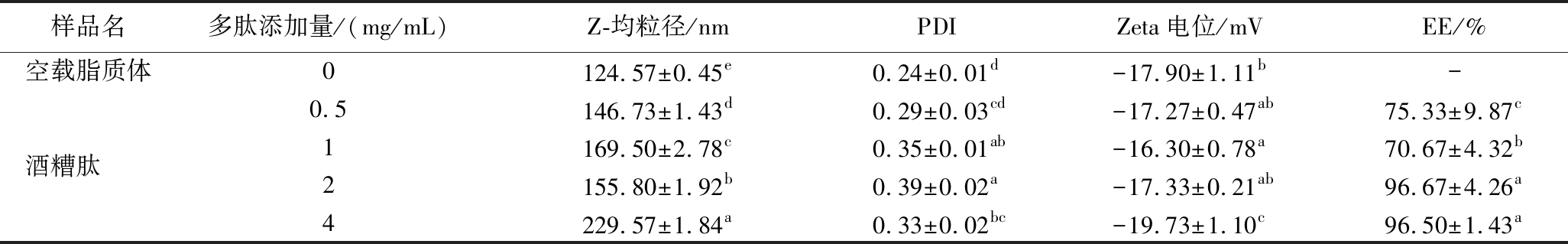
由冻干后的FT-IR光谱(图2-a)可知,酒糟纳米肽在1 743、1 464和1 240 cm-1处具有吸收峰,揭示了多肽与脂质体膜之间的相互作用。1 743 cm-1的吸收峰表明脂质中C![]() O的伸缩振动,这一峰位的变化可能暗示多肽通过静电作用或氢键与脂质结合[18]。1 464 cm-1的峰位通常与脂肪酸链的C—H变形振动相关,可能表明多肽的嵌入影响了脂质体的膜结构[19]。1 240 cm-1的吸收峰则属于P
O的伸缩振动,这一峰位的变化可能暗示多肽通过静电作用或氢键与脂质结合[18]。1 464 cm-1的峰位通常与脂肪酸链的C—H变形振动相关,可能表明多肽的嵌入影响了脂质体的膜结构[19]。1 240 cm-1的吸收峰则属于P![]() O或C—O—C的振动,表明脂质体的磷脂成分在多肽嵌入后发生了电子分布的变化[20]。
O或C—O—C的振动,表明脂质体的磷脂成分在多肽嵌入后发生了电子分布的变化[20]。
a-傅里叶红外光谱对比图;b-不同添加量酒糟肽脂质体荧光光谱;c-酒糟纳米肽透射电子显微镜结果
图2 酒糟纳米肽的结构表征
Fig.2 Structural characterization of nanopeptides from distiller’s grains
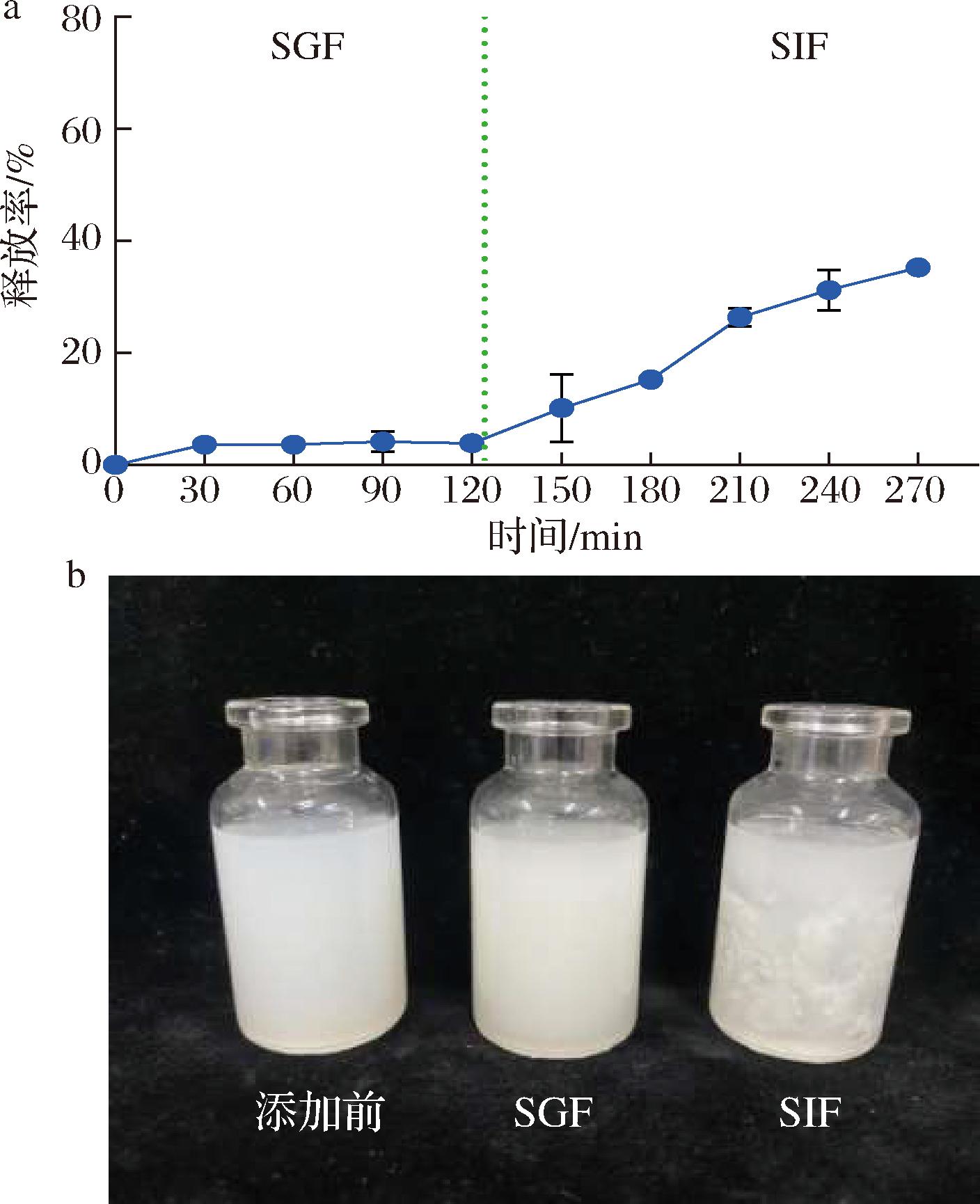
a-酒糟肽脂质体累计释放图;b-不同消化阶段脂质体外观图
图3 酒糟肽脂质体的体外消化与释放过程
Fig.3 In vitro digestion and release process of distiller’s grain nanopeptides
荧光光谱结果进一步证明了酒糟肽与脂质体结合(图2-b)。随着酒糟肽浓度的增加,以色氨酸作为内源性的荧光强度逐渐增高,表明酒糟肽与磷脂的相互作用随着浓度的升高而增强。这一结果表明,酒糟肽可能通过疏水性相互作用与磷脂膜发生结合,且浓度较高的酒糟肽更易嵌入到磷脂体膜中,从而增强其与膜的亲和力[21]。此外,荧光强度的增加进一步体现酒糟肽在疏水环境中与磷脂的结合,从而影响脂质体膜的结构与稳定性。
从透射电子显微镜图像可以看出(图2-c),酒糟纳米肽主要呈现均匀分布的颗粒状形态,其颗粒尺寸为150~200 nm,这与光散射法测得的颗粒尺寸相符(表3),表明所制备的酒糟纳米肽具有良好的尺寸控制,颗粒较为均一。此外,图中还显示了一些非球形的纳米颗粒,这可能是由于在冷却过程中液滴部分聚并所致[22]。非球形颗粒的形成进一步支持了酒糟肽与脂质体的结合机制,在冷却和结构重组过程中,酒糟肽可能通过静电相互作用和疏水性结合进入脂质体膜中,从而影响了颗粒的形态。结合图2-a结果,可以推测酒糟肽与脂质体之间的结合方式可能涉及酰胺键和C![]() O基团的相互作用。此外,图2-c揭示了脂质体表面的一些结构特征,暗示酒糟肽在脂质体膜中的分布方式。因此,这些形态学特征进一步说明酒糟肽在脂质体系统中的稳定包封特性。
O基团的相互作用。此外,图2-c揭示了脂质体表面的一些结构特征,暗示酒糟肽在脂质体膜中的分布方式。因此,这些形态学特征进一步说明酒糟肽在脂质体系统中的稳定包封特性。
2.4 酒糟纳米肽的胃肠道消化稳定性
图3-a结果表明,在胃消化液中孵育2 h内酒糟纳米肽释放缓慢,表明脂质体可以抵抗低pH胃酸的破坏。在肠消化液中均有明显的释放,尤其是前90 min有爆发性释放,随后缓慢释放,经4 h胃肠道消化后,酒糟纳米肽的累积释放率达到(35.20±0.08)%。总体来说,酒糟纳米肽在SIF中的释放率明显高于SGF。经肠道消化后出现大量絮状沉淀,且上清液变成清澈呈浅色,表明大量酒糟肽从脂质体中释放出来(图3-b)。这一观察结果与文献相符[23],在低pH时,酒糟肽通过改变脂质体电子分布,增加脂质体的抗聚集和稳定性,以及空间位阻。在SIF中孵育4 h后,可能是因为脂质体表面多肽的水解,导致脂质体的聚集且出现白色絮状沉淀。因此,酒糟纳米肽表现出在胃肠道环境中良好的pH稳定性和控制释放特性。在胃消化液中其结构能够有效保护酒糟肽免受胃酸的破坏,而在肠消化液中酒糟肽从脂质体快速释放,能进一步被肠上皮细胞吸收而保证其生物利用度。
3 结论
为制备酒糟纳米肽并探究其稳定性和生物活性,本研究通过响应面优化了酒糟醇溶性蛋白的酶解工艺,在酶解温度60 ℃,酶解时间3 h,酶添加量1.87%(质量分数)的条件下,获得了酒糟多肽质量浓度为18.59 mg/mL的最高产率。在酒糟纳米肽制备过程中,酒糟肽的浓度对粒径、PDI和Zeta电位的影响显著,在质量浓度2 mg/mL条件下所制备的酒糟肽尺寸均一且稳定性较高。FTIR光谱和荧光光谱表明,酒糟肽通过静电相互作用和疏水性结合嵌入脂质体膜,与磷脂分子形成稳定的复合结构。透射电子显微镜图像进一步验证了脂质体颗粒的均匀性和结构完整性。此外,酒糟肽表现出较强的抗氧化能力,其中DPPH自由基清除能力显著高于谷胱甘肽,证明了其在抗氧化领域的潜在应用价值。在体外胃肠道消化实验中,酒糟纳米肽在胃消化液中表现出良好的稳定性,在肠消化液中快速释放,累积释放率达到(35.20±0.8)%。因此,本研究证实了酒糟纳米肽制备的可行性及其在抗氧化、控制释放等方面的潜在应用价值,为酒糟多肽递送系统的开发及功能性食品的深度研究提供了理论基础和技术支持。
[1] LIU K S.Chemical composition of distillers grains, a review[J].Journal of Agricultural and Food Chemistry, 2011, 59(5):1508-1526.
[2] DUAN J W, YANG S Q, LI H H, et al.Why the key aroma compound of soy sauce aroma type Baijiu has not been revealed yet?[J].LWT, 2022, 154:112735.
[3] LIU Y Z, LIU S P, HUANG C H, et al.Chinese Baijiu distiller’s grains resourcing:Current progress and future prospects[J].Resources, Conservation and Recycling, 2022, 176:105900.
[4] TRUJILLO A I, BRUNI M, CHILIBROSTE P.Nutrient content and nutrient availability of sorghum wet distiller’s grain in comparison with the parental grain for ruminants[J].Journal of the Science of Food and Agriculture, 2017, 97(8):2353-2357.
[5] CASTRO-J COME T P, ALC
COME T P, ALC NTARA-QUINTANA L E, TOVAR-PÉREZ E G.Optimization of sorghum kafirin extraction conditions and identification of potential bioactive peptides[J].BioResearch Open Access, 2020, 9(1):198-208.
NTARA-QUINTANA L E, TOVAR-PÉREZ E G.Optimization of sorghum kafirin extraction conditions and identification of potential bioactive peptides[J].BioResearch Open Access, 2020, 9(1):198-208.
[6] XU S W, SHEN Y T, CHEN G J, et al.Antioxidant characteristics and identification of peptides from sorghum kafirin hydrolysates[J].Journal of Food Science, 2019, 84(8):2065-2076.
[7] ALASHI A M, BLANCHARD C L, MAILER R J, et al.Antioxidant properties of Australian canola meal protein hydrolysates[J].Food Chemistry, 2014, 146:500-506.
[8] DRUCKER D J.Advances in oral peptide therapeutics[J].Nature Reviews Drug Discovery, 2020, 19(4):277-289.
[9] SHEN W L, MATSUI T.Current knowledge of intestinal absorption of bioactive peptides[J].Food &Function, 2017, 8(12):4306-4314.
[10] SEMENOVA M, ANTIPOVA A, MARTIROSOVA E, et al.Essential contributions of food hydrocolloids and phospholipid liposomes to the formation of carriers for controlled delivery of biologically active substances via the gastrointestinal tract[J].Food Hydrocolloids, 2021, 120:106890.
[11] 侯梦媛, 范文来, 徐岩.白酒酒糟中醇溶蛋白的提取及性质比较[J].食品与发酵工业, 2020, 46(19):99-103.HOU M Y, FAN W L, XU Y.Extraction and characterization comparison of prolamin from wet and dried distiller’s grains of Baijiu[J].Food and Fermentation Industries, 2020, 46(19):99 -103.
[12] LIU X G, CHANG R, ZHOU Z L, et al.Conversion of Baijiu distillers’ grains to functional peptides:Process optimization and antioxidant activity evaluation[J].Journal of Functional Foods, 2023, 108:105722.
[13] ZHAO Y H, LIU X Y, ZHANG S J, et al.Identification and free radical scavenging activity of oligopeptides from mixed-distillate fermented Baijiu grains and soy sauce residue[J].Metabolites, 2024, 14(6):298.
[14] HUANG S S, HE J B, CAO L, et al.Improved physicochemical properties of curcumin-loaded solid lipid nanoparticles stabilized by sodium caseinate-lactose Maillard conjugate[J].Journal of Agricultural and Food Chemistry, 2020, 68(26):7072-7081.
[15] 刘梦哲, 韩康佳, 王文博, 等.6’-O-咖啡酰熊果苷脂质体的制备工艺优化及其活性研究[J].食品工业科技, 2025,46(13):207-217.LIU M Z, HAN K J, WANG W B, et al.Optimization of the preparation process of 6′-O-caffeoylarbutin liposomes and its activity[J]. Science and Technology of Food Industry, 2025,46(13):207-217.
[16] RUZZA P, BIONDI B, MARCHIANI A, et al.Cell-penetrating peptides:A comparative study on lipid affinity and cargo delivery properties[J].Pharmaceuticals, 2010, 3(4):1045-1062.
[17] AGRAWAL H, JOSHI R, GUPTA M.Isolation and characterisation of enzymatic hydrolysed peptides with antioxidant activities from green tender sorghum[J].LWT, 2017, 84:608-616.
[18] ISELE J, SAKMAR T P, SIEBERT F.Rhodopsin activation affects the environment of specific neighboring phospholipids:An FTIR spectroscopic study[J].Biophysical Journal, 2000, 79(6):3063-3071.
[19] 王妮,孙庆泽,姜宏,等.斑节对虾黄嘌呤氧化酶抑制肽包埋脂质体的制备、表征及性质评价[J/OL].食品工业科技,2025.https://doi.org/10.13386/j.issn1002-0306.2024080109. WANG N, SUN Q Z, JIANG H, et al.Preparation, characterization, and property evaluation of liposomes embedded with xanthine oxidase Inhibitory peptide derived from Penaeus monodon[J/OL].Food Industry Technology, 2025.https://doi.org/10.13386/j.issn1002-0306.2024080109.
[20] DROZDZ A, MATUSIAK K, SETKOWICZ Z, et al.FTIR microspectroscopy revealed biochemical changes in liver and kidneys as a result of exposure to low dose of iron oxide nanoparticles[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy, 2020, 236:118355.
[21] CRONE N, MINNEE D, KROS A, et al.Peptide-mediated liposome fusion:The effect of anchor positioning[J].International Journal of Molecular Sciences,2018, 19(1):211.
[22] LIU G, ZHONG Q X.Thermal aggregation properties of whey protein glycated with various saccharides[J].Food Hydrocolloids, 2013, 32(1):87-96.
[23] LUND M N, RAY C A.Control of Maillard reactions in foods:Strategies and chemical mechanisms[J].Journal of Agricultural and Food Chemistry, 2017, 65(23):4537-4552.