近年来,凝胶相关食品因其高含水量、低热量、诱人的味道和增强饱腹感的特性而越来越受欢迎。多糖和蛋白质因其无毒、生物可降解性、资源丰富以及良好的增稠和胶凝能力而被广泛采用为制作水凝胶食品的基质[1]。不同网络结构的水凝胶凭借其独特性能,在食品的增稠、稳定、保鲜、营养包埋缓释以及改善口感质地等方面均有广泛应用。燕麦12S球蛋白与大豆11S球蛋白的结构类似,因此,燕麦蛋白(oat protein isolate,OPI)具有充当胶凝剂的潜力[2]。在有关燕麦蛋白热诱导凝胶的研究中,NIETO-NIETO等[3]通过添加少量菊粉大大提高了热诱导燕麦蛋白凝胶的强度,以及糊精或卡拉胶产生的相分离改善了燕麦蛋白的热凝胶化[4],DU等[5]通过调节卡拉胶的浓度来调节热诱导燕麦蛋白-卡拉胶偶联凝胶的机械强度。与热制致胶相比,冷致凝胶在包埋递送等方面更具有优势。冷致凝胶通常是在室温下添加合适的凝固剂交联形成,包括转谷氨酰胺酶交联、葡萄糖酸内酯酸诱导以及盐离子交联,其中最便捷的方法是加入缓慢水解的葡萄糖酸内酯。本课题组先前的研究表明,在pH 8下预加热可使燕麦蛋白分子从六聚体解离为单体,这些高反应性的单体和亚基充当凝胶构建块并提供丰富的交联位点,最后,通过使用葡萄糖酸内酯(glucono-delta-lactone, GDL)逐渐降低pH使蛋白质分子进一步聚集,可以形成具有良好机械性能的聚合物样凝胶微结构[6]。尽管单独的燕麦蛋白可以生成具有一定机械强度的凝胶,但结构单一,机械性能有限,从而限制了燕麦蛋白在食品工业中的应用。
海藻酸钠(sodium alginate,SA)是一种由(1→ 4)连接的β-d-甘露糖醛酸和α-l-古洛糖醛酸组成的多糖[7]。目前,海藻酸钠已广泛用于与蛋白质混合凝胶体系的构建,LI等[8]发现海藻酸钠浓度可以改变酪蛋白凝胶结构并提高其冻融稳定性,YANG等[9]研究发现适量的海藻酸钠浓度增强了大豆分离蛋白-海藻酸钠乳液凝胶的致密性。海藻酸钠凝胶可调控性强,与其他多糖或蛋白复合时,可以调控多糖或蛋白凝胶结构和凝胶特性,因此海藻酸钠是一种用来提高凝胶理化性质和调节凝胶结构的良好选择[10]。
目前,以燕麦蛋白-海藻酸钠混合物构建冷致凝胶的相关研究尚缺乏系统性,海藻酸钠对燕麦蛋白凝胶的影响及机理尚不清楚。因此,本研究探讨了SA对燕麦蛋白分散体在不同pH水平下的凝聚相行为的影响,从而为分析复合物的凝胶行为奠定了基础。进一步分析了不同SA和GDL含量下酸诱导OPI凝胶的物理质地、微观结构和构象变化,结合流变学及相互作用力,系统地阐述了酸诱导OPI-SA凝胶的形成机制,为燕麦蛋白在食品生产中的应用奠定了基础。
1 材料与方法
1.1 材料与试剂
燕麦粒(粗蛋白质含量20%)购自十月稻田。OPI是通过碱溶酸沉技术从脱脂燕麦中提取的,纯度为89.05%。SA、GDL,元业生物科技有限公司(中国上海),无需进一步处理即可使用。
1.2 仪器与设备
Synergy HTX多功能酶标仪,美国伯腾公司;BeNano 90 Zeta纳米粒度及Zeta电位分析仪,英国马尔文帕纳科公司;TA.TOUCH质构仪,赛诚电子科技有限公司;MARS 60旋转流变仪,德国哈克公司;SU3800扫描电子显微镜,日本Hitachi公司;LSM-980激光共聚焦显微镜,德国卡尔蔡司公司;IS50傅里叶变换分光光度计,日本岛津公司。
1.3 实验方法
1.3.1 OPI的提取
燕麦粒磨粉,用正己烷对燕麦粉进行脱脂。将脱脂的燕麦粉以1∶10(g∶mL)的料液比溶于蒸馏水中,用1 mol/L NaOH溶液调节至pH 9.5,混合搅拌2 h。4 ℃下4 000 r/min离心15 min以收集上清液。用1 mol/L HCl将上清液的pH值调节至4.5以沉淀溶解的蛋白质。溶液在4 ℃下以4 000 r/min离心15 min。收集沉淀,并使用1 mol/L NaOH溶液将pH值调节至7.0。通过冷冻干燥获得OPI粉末。
1.3.2 OPI-SA凝胶的制备
OPI粉末溶于蒸馏水,并在室温下搅拌过夜,得到OPI悬浮液。用1 mol/L NaOH将OPI悬浮液的pH值调节至8,将悬浮液密封在玻璃瓶中放在115 ℃下加热15 min使其变性,冷却至室温。SA溶于水,搅拌过夜,使其完全水合。将OPI分散体、不同体积海藻酸钠分散体和蒸馏水混合以获得混合溶液。每组保持70 g/L的蛋白质浓度,而SA质量浓度为0、0.5、1、1.5 g/L。随后,4种混合溶液中的每一种分别加入3种不同量的GDL粉末5%、10%、20%(质量分数,基于蛋白质含量)。在4 ℃下酸化12 h后,共获得12组凝胶。不同复合凝胶的组成如表1所示。
表1 不同复合凝胶的组成
Table 1 The composition of different composite gels
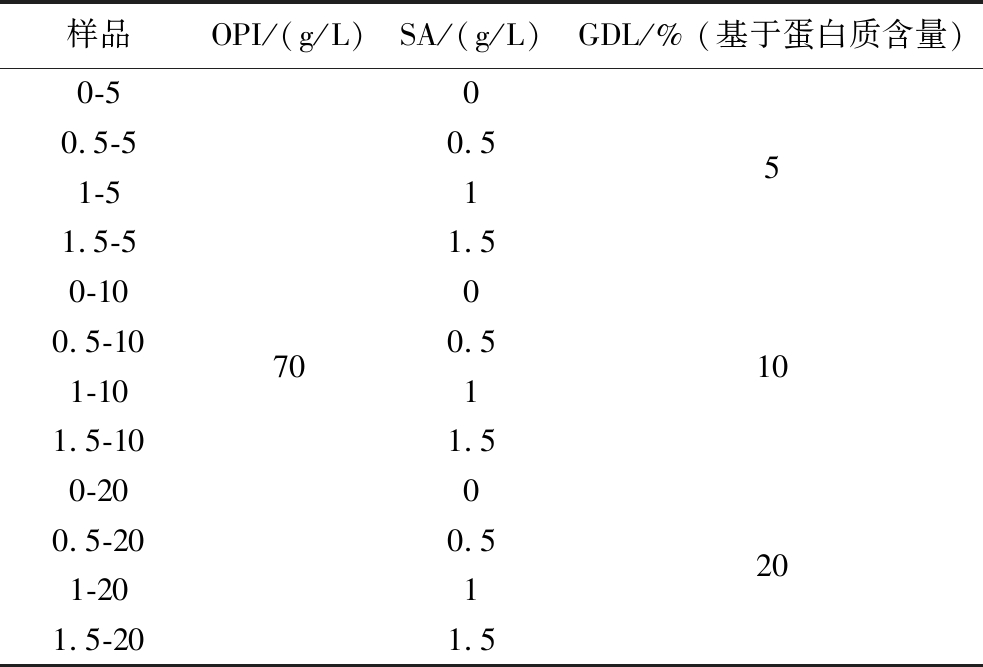
样品OPI/(g/L)SA/(g/L)GDL/% (基于蛋白质含量)0-500.5-50.551-511.5-51.50-1000.5-10700.5101-1011.5-101.50-2000.5-200.5201-2011.5-201.5
1.3.3 凝胶pH值的测定
加入GDL后,在凝胶形成过程中,用pH计每隔1 h测定凝胶的pH,直至pH不再下降即为凝胶最终pH值。
1.3.4 Zeta电位和浊度测量
将混合物稀释至蛋白质量浓度1 mg/mL,并用1 mol/L的HCl和NaOH调节混合物的pH值至2~8,使用多功能酶标仪在600 nm处测量混合物的吸光度,使用纳米粒度及Zeta电位分析仪分别测定不同海藻酸钠浓度在不同pH下的电位。
1.3.5 凝胶强度的测定
参照LI等[11]的方法,使用 P/50 探头,设置探头测前速度1 mm/s、测试速度为1 mm/s、测试后速度为1 mm/s,触发力5 g,压缩比为50%,在室温(约25 ℃)下对每个样品进行了一式3份的质构分析实验。
1.3.6 流变学特性分析
参照CHEN等[12]的方法。平行板的间隙设定为1 mm,在0.1~10 Hz进行动态频率扫描分析,温度25 ℃,应变值设定为1%(在线性黏弹区域内),记录了储能模量(G′)、损耗模量(G″)随频率的变化。
1.3.7 扫描电镜分析
先将样品进行冻干处理,冻干后取大小一致的样品,用喷金仪喷金后,再置于扫描电子显微镜观察样品的微观形态。
1.3.8 激光共聚焦显微镜观察
参考REN等[13]的方法。在凝胶化之前,将罗丹明B溶液(2 g/L)与蛋白质溶液(90 g/L)按1∶50体积比混合。根据1.3.2节的方法使用染色的蛋白制备凝胶。通过激光共聚焦显微镜观察冷固化凝胶,激发波长设置为543 nm,并记录560~630 nm的发射荧光。
1.3.9 傅里叶变换红外光谱分析
将冻干的凝胶样品(1 mg)与干燥的KBr(150 mg)混合,将其均匀研磨并压成薄片。傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)是在400~4 000 cm-1累计扫描64次,分辨率为4 cm-1,温度25 ℃,以空气为采集背景。使用Peakfit 4.12软件分析蛋白质二级结构的组成和含量。
1.3.10 凝胶中化学力的测定
参考WANG等[14]的方法。将复合凝胶(0.1 g)分别分散在5 mL 5种溶液中:溶剂S1为蒸馏水;溶剂S2为 Tris-甘氨酸(0.086 mol/L Tris-0.09 mol/L甘氨酸-4 mmol/L-Na2EDTA,pH=8.0);溶剂S3为0.5%(体积分数)SDS;溶剂S4为8 mol/L尿素;溶剂S5为 2%(体积分数)β-巯基乙醇。将混合物在25 ℃水浴中孵育20 min,然后以4 500 r/min离心10 min。通过考马斯亮蓝法(使用牛血清白蛋白作为标准品)测定上清液中蛋白质的浓度。通过各溶液中蛋白质溶解度的差值计算化学相互作用力含量,静电相互作用=S2中蛋白质溶解度-S1中蛋白质溶解度;疏水相互作用=S3中蛋白质溶解度-S2中蛋白质溶解度;氢键=S4中蛋白质溶解度-S3中蛋白质溶解度;二硫键含量=S5中蛋白质溶解度-S4中蛋白质溶解度。
1.4 数据处理
所有实验重复3次,使用SPSS 27软件进行显著性差异分析,用Origin 2018进行图表绘制,数据表示为“平均值±标准差”。
2 结果与分析
2.1 凝胶的外观和pH值
不同SA、GDL含量OPI凝胶的外观如图1所示,所有OPI和OPI-SA凝胶组中,均能形成精细的自支撑凝胶结构。与单一OPI凝胶相比,OPI-SA复合凝胶胶体无裂痕,表面更光滑细腻,表明SA显著增强了OPI凝胶的结构,在任何GDL条件下,添加0.1%SA的凝胶最光滑而无塌陷,因此SA添加0.1%时凝胶最坚固。与5%和20%GDL的凝胶相比,添加10%GDL结构更加稳固,因此凝胶具有更强的硬度。在酸诱导凝胶中,凝胶的颜色与最终pH值有关,GDL逐渐解离并转化为葡萄糖酸,此时溶液pH以缓慢速率降低,减少了蛋白质分子之间的静电排斥,导致蛋白质聚集和连接,形成典型的不透明凝胶结构[15]。随着GDL添加量从5%增加到20%,凝胶的最终pH降低至OPI等电点以下,凝胶外观从浅棕色变为乳白色。而相同GDL条件下,SA浓度高的凝胶颜色更深。GDL对凝胶性能的影响主要是由于它对聚合物体系pH值的影响,因此有必要了解凝胶的pH值。

图1 不同SA、GDL含量OPI-SA凝胶的外观
Fig.1 The appearance of OPI-SA gel with different SA and GDL content
凝胶最终的pH值由体系中SA和GDL含量共同决定,结果如图2所示,pH随GDL含量的升高而降低。GDL质量分数为5%、10%、20%(基于蛋白质含量)的OPI凝胶,最终pH值分别为6.01(高于OPI等电点4.6)、4.71(接近OPI等电点)、4.03(低于OPI等电点)。添加相同质量分数GDL的OPI-SA复合凝胶最终pH随SA含量增加而轻微增加,这是因为生物聚合物浓度较高的溶液酸化过程中需要更大量的GDL以达到相同的pH值,SA含量增加会阻碍凝胶体系pH的降低[16],因此,在较高SA含量下,凝胶达到相同的pH值需要更大量的GDL。
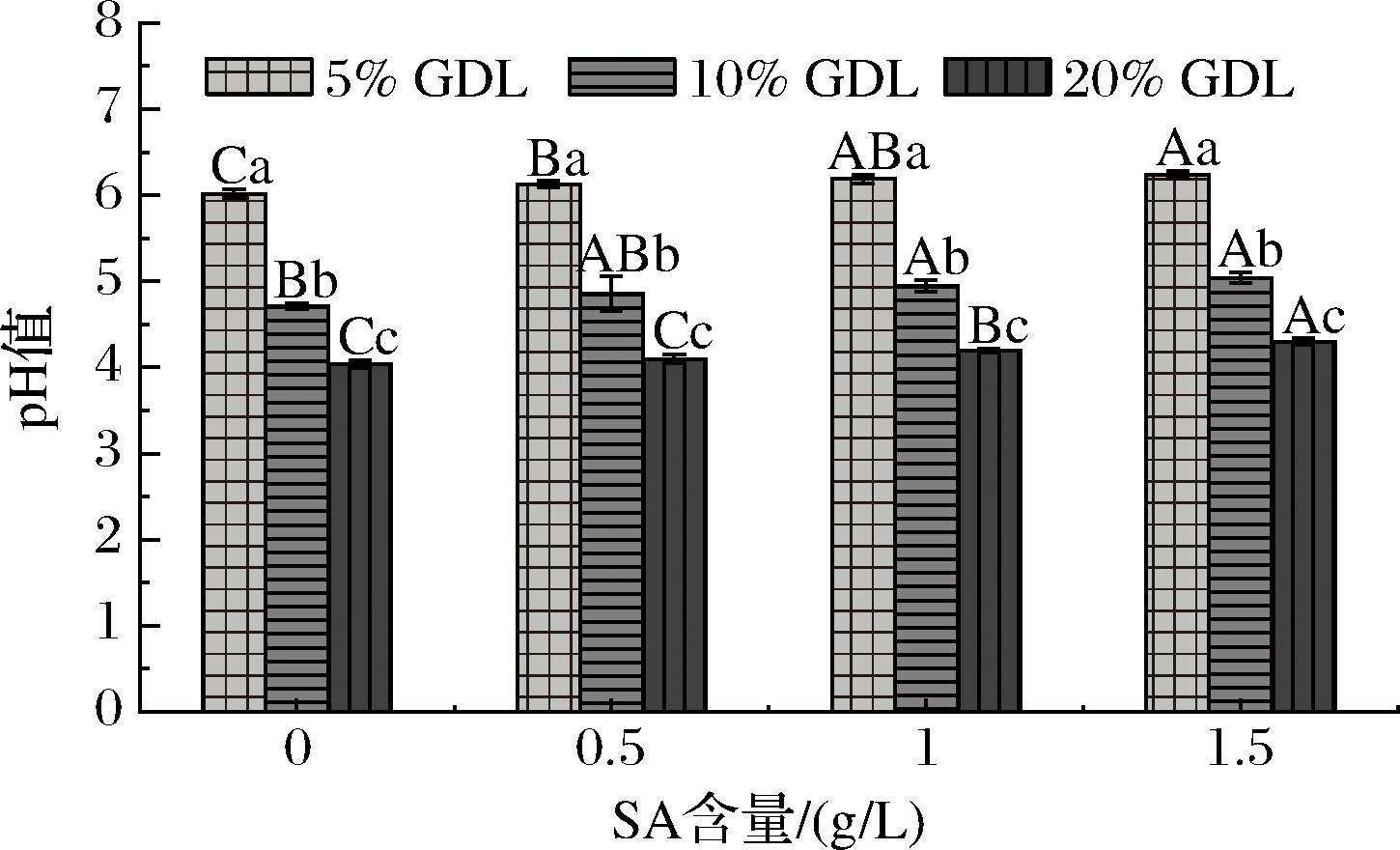
图2 不同SA、GDL含量 OPI-SA 凝胶的pH值
Fig.2 The pH value of OPI-SA gels with different SA and GDL content
注:大写字母表示不同SA含量间的显著性差异,小写字母表示不同GDL含量间的显著性差异 (P<0.05)(下同)。
2.2 OPI-SA复合物在不同pH环境中的凝聚相行为
浊度变化反映了溶液中聚集体浓度和大小的变化,可作为蛋白质与多糖聚集和凝结过程的可靠指标。OPI-SA复合物的浊度如图3-a所示。SA溶液的浊度最低,且不随pH值的变化而发生显著变化,因此图中未显示。OPI与OPI-SA的浊度都在pH 4~5(GDL添加量为10%)达到最大,因为在燕麦蛋白等电点附近,蛋白溶解度降低,溶液浊度增加。当pH<4.6(燕麦蛋白等电点)(GDL含量为20%)时,随着pH值逐渐远离其等电点,OPI聚集体逐渐分解并缓慢悬浮在水中,溶液浊度降低。然而,与OPI溶液相比,OPI-SA溶液的浊度降低尤为明显,这是由于SA分子的存在诱导了OPI的加速沉降。当pH<4.6时,带负电荷的SA和带正电荷的OPI通过静电相互作用迅速形成可溶性静电复合物,混合溶液快速澄清,导致OPI-SA溶液的浊度迅速降低,这与YAN等[17]研究结果一致。当pH>4.6(GDL含量为5%)时,随着pH升高,一方面,巨大的静电排斥可以防止OPI-SA颗粒沉降,溶解度增高,浊度降低;另一方面,加入适量的海藻酸钠可改善蛋白质在水中的分散性并降低分散体的浑浊度。总体而言,酸化过程中OPI-SA发生了从可溶性聚合物体系向不溶性凝聚物体系的转变,且随着SA比例的增加,聚集速率加快[18]。
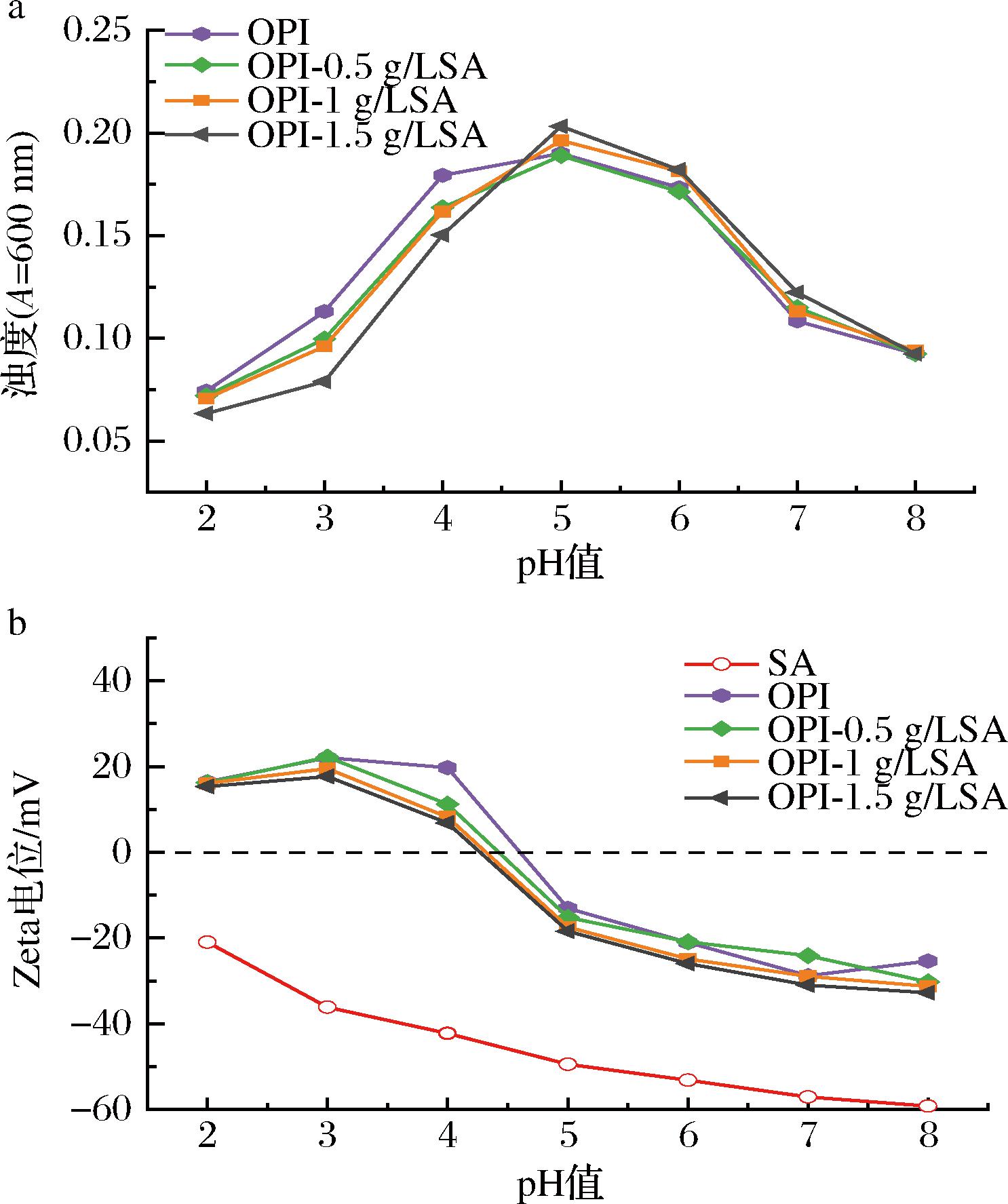
a-OPI-SA溶液浊度;b-OPI-SA溶液Zeta电位
图3 pH值对不同 SA 含量下OPI-SA溶液浊度和 Zeta电位的影响
Fig.3 Effect of pH on the turbidity and Zeta potential of OPI-SA solutions at various SA contents
如图3-b所示,随着pH值从8降到2,SA的电位从-59.2 mV上升到-20.96 mV,SA是阴离子多糖,因此在2~8的pH区间始终携带负电荷,随着pH降低,SA带电荷数减少,这是由在强酸性条件下糖醛酸中所含的羧基的质子化(—COO—到—COOH)引起的[19]。pH<等电点时,OPI溶液带正电荷;pH>等电点时,OPI溶液带负电荷。具有不同质量比的OPI-SA混合物在单个OPI和OPI溶液之间表现出中间Zeta电位,与OPI溶液相似,这是因为混合物中仍以高浓度的OPI为主,随着SA含量增加,曲线左移,SA可以中和一部分正电荷,这使得混合物的Zeta电位下降,表明复合凝胶中存在静电相互作用,这与SOUZA等[20]研究结果类似。
2.3 凝胶强度分析
复合凝胶的硬度如图4所示。随着SA含量从0%增加到0.1%,混合凝胶具有更高的硬度,与单独的OPI凝胶相比,硬度由116.58 g增加到226.25 g,这可能是OPI和SA之间发生相互作用的结果,形成了更强的凝胶网络结构,这表明添加多糖是一种增强燕麦蛋白凝胶强度的可行途径。然而,随着SA含量进一步增加到1.5 g/L,硬度降低115.04 g,甚至低于纯OPI凝胶。这是由于混合凝胶的凝胶强度通常是相分离与相互作用竞争的结果[21],低浓度海藻酸钠的添加增强了凝胶强度,而高浓度的海藻酸钠通过诱导相分离而降低凝胶强度,大量SA对OPI网络连续性的影响,最终影响了OPI分子之间的相互作用[22]。
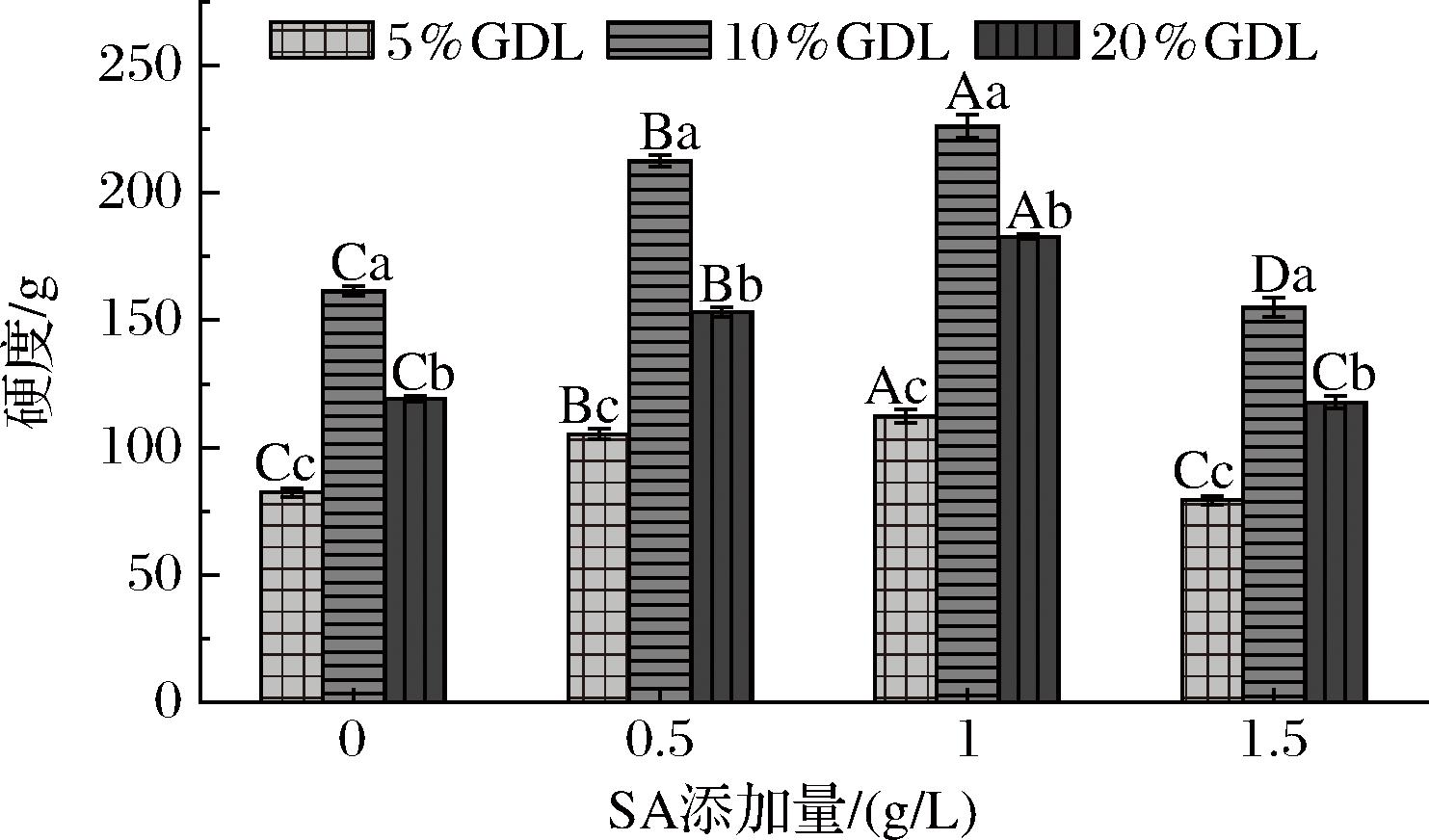
图4 不同SA和GDL添加量对OPI-SA凝胶硬度的影响
Fig.4 Effects of different SA and GDL additions on hardness of OPI-SA gels
当GDL含量从5%增加到10%时,凝胶的最终pH从6左右下降到4.8左右,接近燕麦蛋白等电点,燕麦蛋白负电荷减少,分子间斥力减小,燕麦蛋白分子与海藻酸钠之间的静电排斥作用减弱,而氢键和疏水作用增强,导致OPI和SA形成非共价复合物,最终提高了凝胶的硬度,这与YANG等[23]研究结果一致。然而GDL含量为20%时,凝胶的最终pH值4左右,低于燕麦蛋白等电点,燕麦蛋白携带正电荷,燕麦蛋白和糖之间存在静电吸引,凝胶强度增加,然而由于燕麦蛋白浓度高,富含燕麦蛋白的连续相由于存在较高的静电排斥而表现出较低程度的聚集,因此凝胶强度低于在等电点附近的凝胶。
2.4 凝胶流变学特性分析
储能模量(G′)和损耗模量(G″)表示凝胶的弹性和黏度,通过频率扫描对G′和G″的振幅来测量蛋白凝胶网络的交联程度。如图5-a~图5-c所示,所有样品均G′>G″,表明凝胶以弹性行为为主[24]。所有G′均随频率的增加而增加,表现出频率依赖性。低浓度SA的加入增加了复合凝胶的G′和G″,从而提高了OPI-SA的网络强度和机械性能,并增加了凝胶硬度。在不同的SA浓度中,最大的G′出现在SA添加量为添加量1 g/L处,表明多糖/蛋白质相互作用形成了更强大、更紧密的分子间网络[25],这一现象的可能原因是OPI与SA之间的静电、疏水和氢键相互作用随着SA添加量的增加而增加,当添加量超过1.5 g/L时则显示出相反的效果。在相同SA添加量下,10%GDL添加量的G′均高于其他GDL添加量,添加10%GDL时,凝胶最终pH接近等电点,这与质构结果一致。LI等[25]研究不同GDL添加量对酪蛋白-结冷胶凝胶的影响,结果显示,凝胶强度在接近等电点的pH水平下凝胶表现出最佳性能。
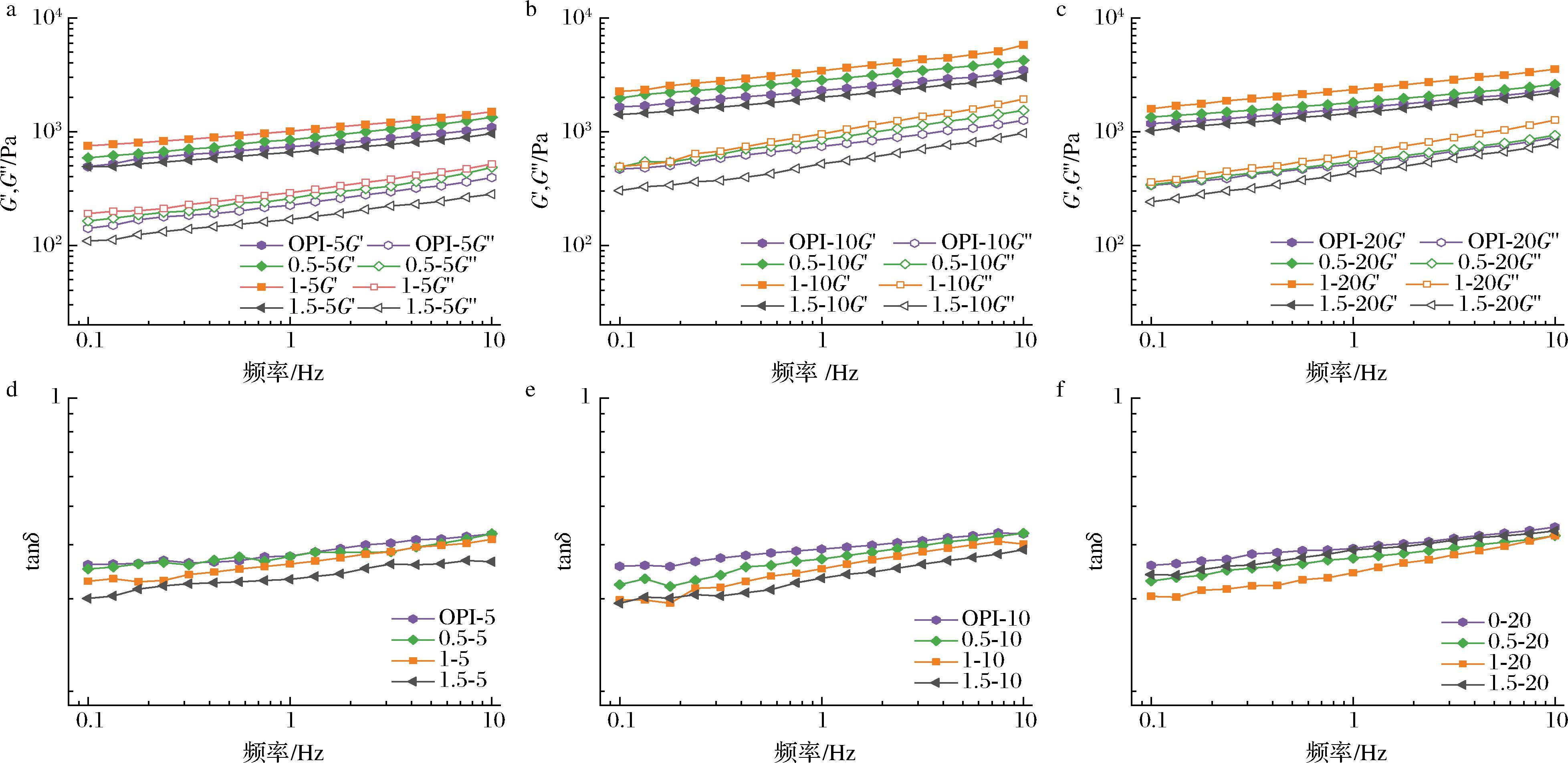
a-5% GDL凝胶的G′和G″;b-10% GDL凝胶的G′和G″;c-20% GDL凝胶的G′和G″; d-5% GDL凝胶的tanδ;e-10% GDL凝胶的tanδ; f-20% GDL凝胶的tanδ
图5 不同SA和GDL添加量对 OPI-SA 凝胶G′、G″和tanδ的影响
Fig.5 Effect of different SA and GDL additions on G′, G″, and tanδ of OPI-SA gels
如图5-d~图5-f所示,所有样品的tanδ(G″/G′)值均在小于1的范围内,表明所有样品均具有固体弹性。同时,OPI-SA复合凝胶的tanδ与SA的添加量呈负相关,表明SA可以提高OPI-SA复合凝胶的弹性[26]。该观察结果与GDL添加量为20%时的凝胶样品不一致,可能是添加1.5 g/L SA时导致凝胶网络中黏性组分升高。
2.5 凝胶微观结构分析
不同SA与GDL添加量OPI凝胶的扫描电镜结果见图6,OPI凝胶的微观结构与OPI-SA凝胶的微观结构有明显区别。在GDL含量为5%~10%时,无SA添加的OPI凝胶呈现出聚集的蛋白质颗粒状或片状结构,添加少量SA时,凝胶结构发生了显著的变化,少量SA添加的凝胶显示出均匀的多孔网状结构,并随着SA添加量的增加,孔径增加,凝胶壁轻微增厚,可能是SA附着在蛋白质附近,导致蛋白质骨架增厚,而当SA添加量到达1.5 g/L时,凝胶网络结构变得无序,少量丝状结构浮于凝胶壁表面,这可以用燕麦蛋白和海藻酸钠相不相容来解释,少量的海藻酸钠通过氢键和疏水相互作用与燕麦蛋白相互作用,但过量的海藻酸钠与燕麦蛋白会出现相分离现象。这与LI等[8]研究海藻酸钠对酸诱导酪蛋白凝胶结构的结果一致。在GDL添加量为20%时,SA含量增加导致更致密的凝胶结构,这种现象是由于带负电荷的SA通过静电相互作用与OPI形成耦合网络,从而填充凝胶网络内的孔并导致更致密,更紧凑的结构[27]。
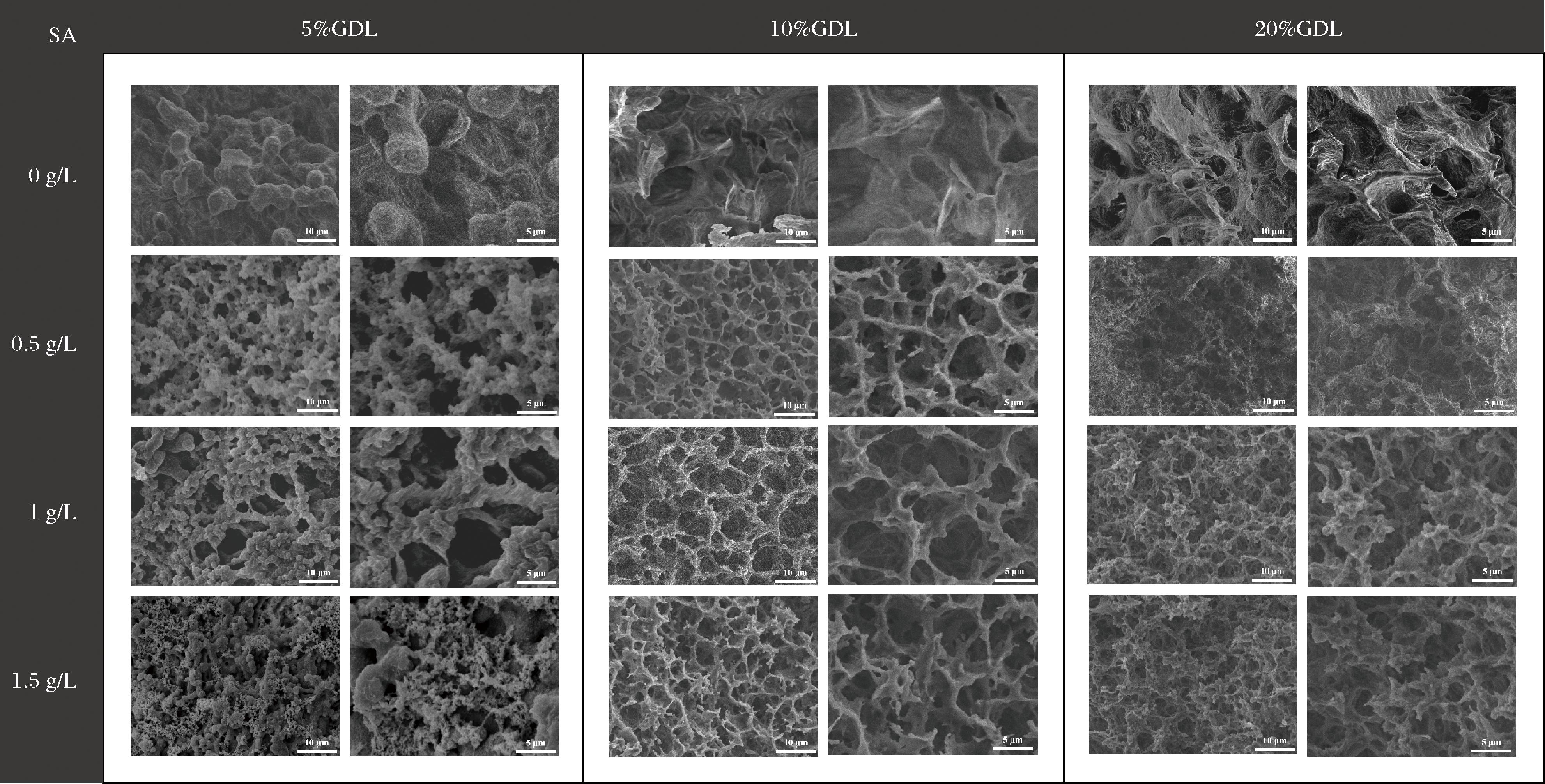
图6 不同SA和GDL添加量对OPI-SA凝胶微观结构的影响
Fig.6 Effect of different SA and GDL additions on the microstructure of OPI-SA gels
不同GDL添加量的OPI-SA凝胶也表现出不同的微观结构,当GDL添加量为5%时,最终凝胶pH小于燕麦蛋白等电点,水解产生的葡萄糖酸不足以使所有蛋白聚集形成具有三维网络结构的凝胶,因此三维网络结构和聚集的球状蛋白颗粒并存。在用10%和20%GDL制备凝胶时,凝胶最终pH约等于燕麦蛋白等电点或小于燕麦蛋白等电点,其中OPI逐渐获得的正电荷允许除了疏水相互作用之外还通过静电相互作用和氢键与SA相互作用,建立了具有改善的凝胶硬度的三维网络结构和紧密耦合的微观结构[23]。
2.6 激光共聚焦显微镜观察
不同样品的激光共聚焦图像如图7所示。图7中的燕麦蛋白被罗丹明B染成红色,红色区域代表存在于酸诱导的蛋白质凝胶网络结构中的蛋白质骨架,而黑色区域表示蛋白质骨架和所添加的SA之间的孔。通过激光共聚焦显微镜的结果更清楚地看到,0.5、1 g/L的SA使OPI均匀且紧密地分布,而1.5 g/L 的SA使凝胶松散并破坏了凝胶网络的连续性。在1.5 g/L SA下,出现较大的黑色孔洞,部分网络变成颗粒状,这可能是由于过量多糖浓度下的相分离导致的蛋白质聚集,导致凝胶体系的不均一性和不连贯性,这也是1.5 g/L SA下凝胶强度下降的原因[28]。此外,随着pH降低到低于OPI的等电点,OPI和SA含有相反的电荷,这促进了2种聚合物之间的静电相互作用,这可能是添加20%GDL时形成紧凑聚集网络结构的原因。
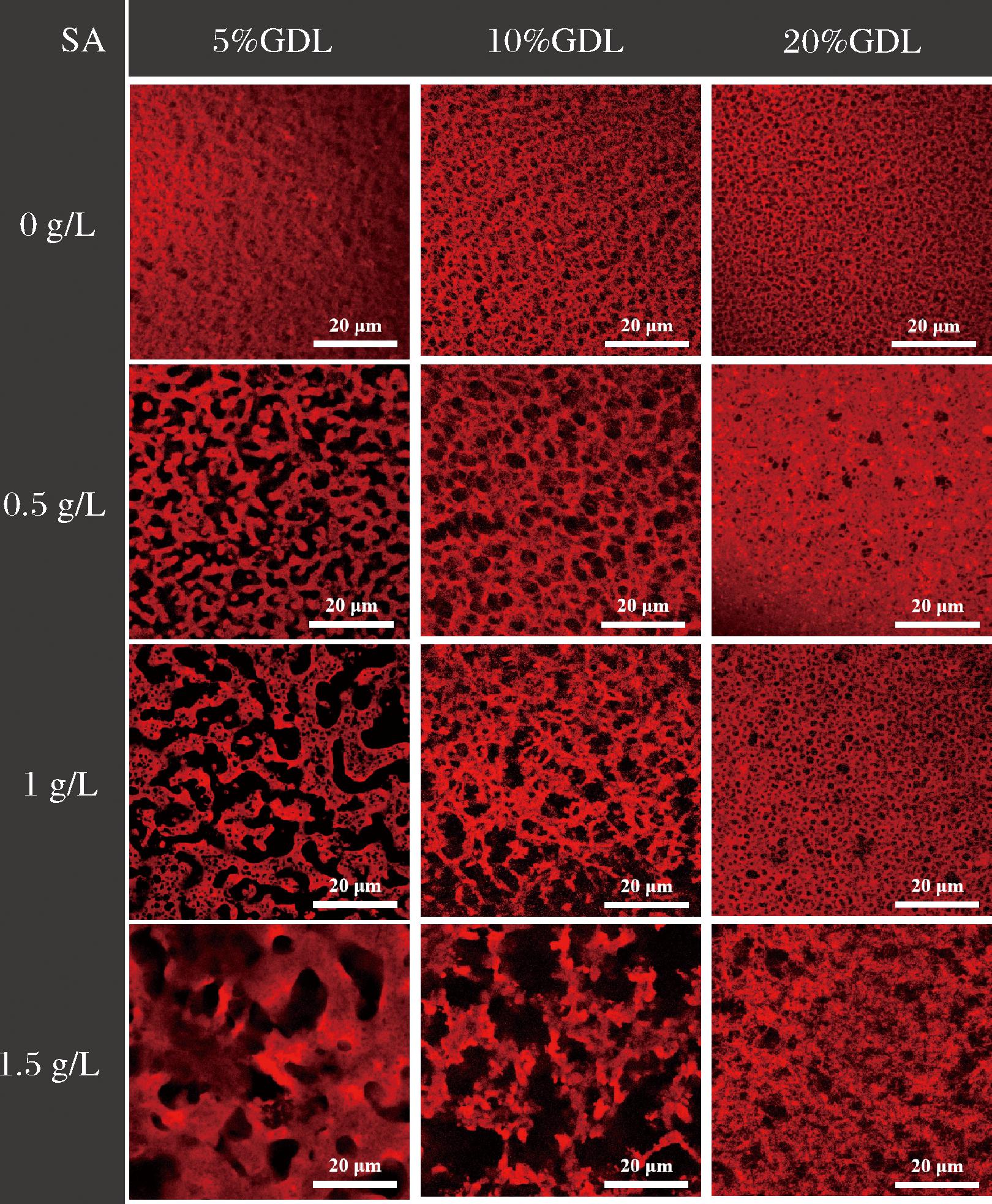
图7 不同SA和GDL添加量下OPI-SA凝胶的激光共聚焦显微图像
Fig.7 CLSM morphology of OPI-SA gels at different SA and GDL additions
2.7 凝胶的红外光谱分析
SA的掺入和GDL的变化不会导致新的吸收峰的出现,这表明OPI-SA复合凝胶中没有新形成的官能团,OPI和SA是非共价键结合。一般来说,酰胺A带(3 200~3 400 cm-1,N—H和O—H伸缩振动),2 925 cm-1附近的振动表示疏水C—H的延伸,1 654 cm-1附近的吸收峰是酰胺I带(1 700~1 600 cm-1,C—O伸缩振动),1 535 cm-1附近的吸收峰是酰胺Ⅱ带(1 600~1 500 cm-1,C—N伸缩振动和N—H弯曲振动)[30]。
如图8-a~图8-c所示,随着SA添加量增加,酰胺A带发生蓝移且峰的强度增加,这意味着随着多糖的添加,凝胶分子间氢键增强[30]。此外,在2 900~3 000 cm-1附近存在C—H伸缩振动,随着SA添加量增加,峰强度增强,且GDL添加量为10%与20%的峰强度显著高于5%时的峰强度,表明GDL和SA促进了复合凝胶分子间的疏水相互作用。与单独的OPI凝胶相比,OPI-SA凝胶的酰胺Ⅰ和Ⅱ谱带向更高的波数方向移动,这一现象表明,SA的羧酸基团(—COO—)和OPI的氨基![]() 之间可能存在静电相互作用[31]。
之间可能存在静电相互作用[31]。
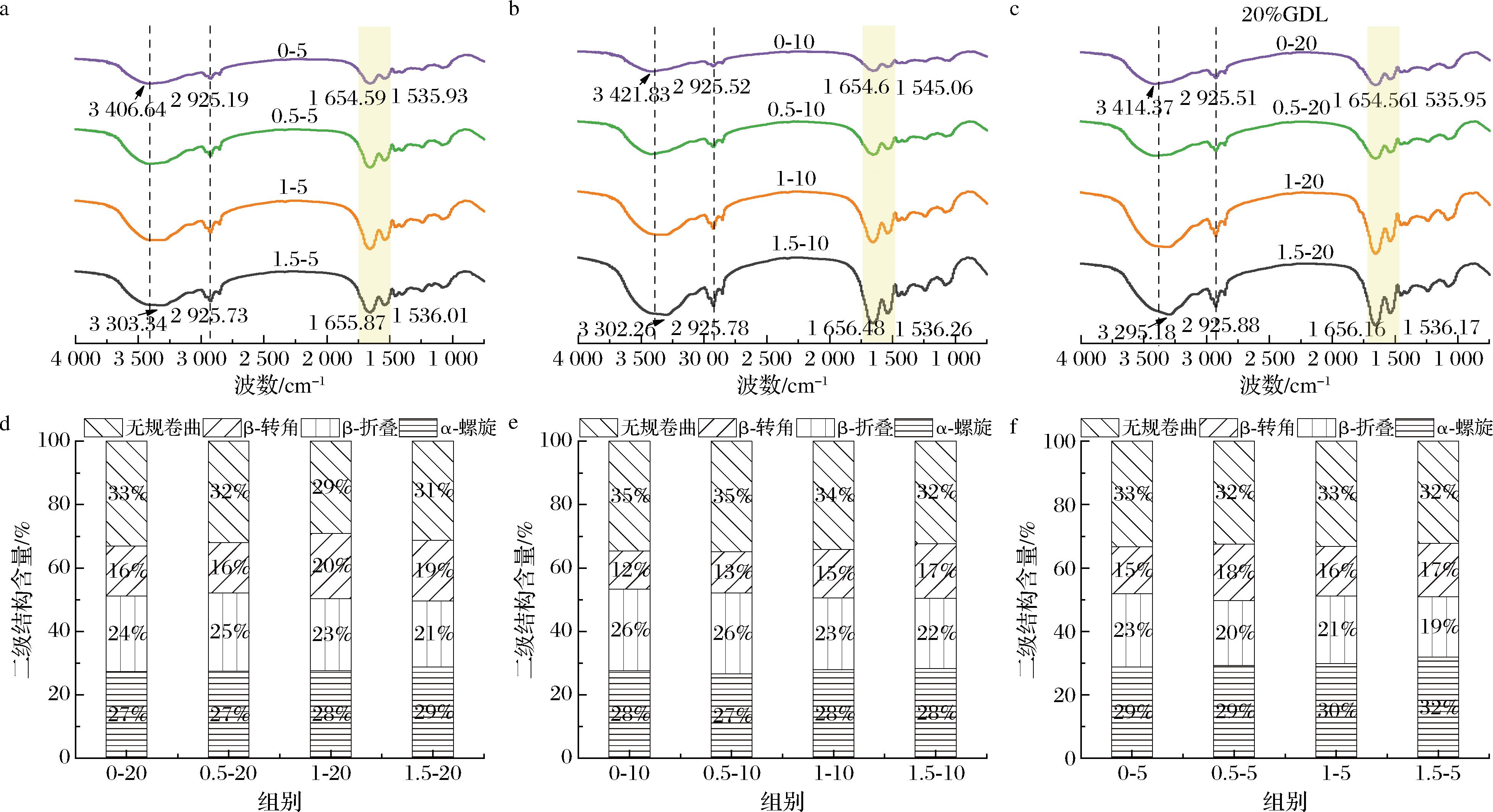
a-5% GDL凝胶的红外光谱;b-10% GDL凝胶的红外光谱;c-20% GDL凝胶的红外光谱;d-5% GDL凝胶的二级结构含量; e-10% GDL凝胶的二级结构含量;f-20% GDL凝胶的二级结构含量
图8 OPI-SA 凝胶的傅立叶变换红外光谱及其二级结构含量
Fig.8 FT-IR spectra of OPI-SA gels and their corresponding secondary structure fraction
使用Peakfit v 4.12软件,通过在1 600~1 700 cm-1范围内拟合,计算蛋白质二级结构的变化。如图8-d~图8-f所示,随着SA的添加,α-螺旋含量轻微增加,无规卷曲含量下降,这归因于SA的添加,在形成聚合物间三维网络的过程中,蛋白质二级结构更加有序,蛋白质和多糖混合物的凝胶通常会增加α-螺旋和β-折叠的比例[32]。其中10%GDL凝胶的β-折叠比例高于另外2组凝胶,β-折叠通常与凝胶硬度存在正相关性[33],这与质构结果一致。凝胶中蛋白质的二级结构没有显著变化,这一观察结果可以归因于蛋白质二级结构的稳定性,其主要由氢键维持。
2.8 凝胶中相互作用力的测定
为了进一步分析凝胶中的作用力,测定了凝胶在5种类型的溶剂中的溶解度,结果如图9所示。凝胶中作用力为疏水相互作用>氢键>静电相互作用>二硫键,这表明疏水相互作用和氢键是冷固性凝胶结构的主要作用力,这与SHEN等[34]研究GDL诱导的牛血清白蛋白-阿拉伯木聚糖凝胶中相互作用力的结果一致。蛋白质加热变性会导致蛋白结构展开,疏水基团暴露,疏水相互作用促进疏水基团再聚合,加入SA后,SA会与暴露的疏水残基发生疏水相互作用,疏水相互作用增加。此外,作为一种亲水性多糖,SA竞争性地削弱了蛋白质-水的相互作用,从而增强了蛋白质的疏水环境,并增加了蛋白质分子之间的疏水相互作用。SA的加入引入大量羟基,SA与OPI之间形成了氢键,凝胶体系中氢键增强。凝胶中静电相互作用与二硫键有限,这与FTIR结果一致。
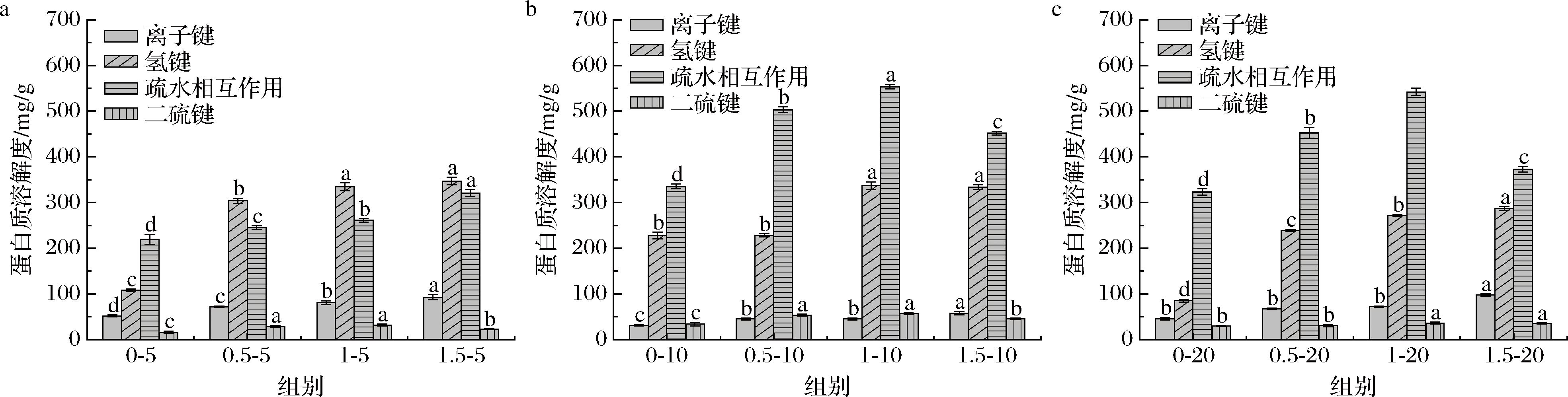
a-5% GDL凝胶中的分子间作用力;b-10% GDL凝胶中的分子间作用力;c-20% GDL凝胶中的分子间作用力
图9 不同SA含量和GDL含量下OPI-SA凝胶中的分子间作用力
Fig.9 Intermolecular forces in OPI-SA gels at various SA contents and GDL contents
注:图中不同字母表示不同SA含量间的显著性差异(P<0.05)。
随着GDL含量从5%增加到10%,凝胶的pH值从6.1降低到4.8,OPI所带的负电荷减少,OPI之间的静电斥力减弱,静电排斥力的降低促进了蛋白质表面游离SH—基团的键合,并促进了二硫键的产生。
同时,疏水相互作用也增加,可能归因于pH值的降低,在等电点附近聚集体之间的排斥力降低,聚集体通过疏水相互作用进一步交联。在用20% GDL形成凝胶的情况下,凝胶最终pH值为4.1,低于OPI的等电点,其中OPI携带大量的正电荷,这些正电荷可以吸引SA的相反电荷,导致在复合凝胶中的静电相互作用增强[35]。
2.9 凝胶形成机理
图10总结了具有不同微观结构的冷固型OPI-SA凝胶的形成机制。燕麦蛋白在pH 8条件下加热处理后,六聚体解离成单体,活性基团暴露。单独的OPI在GDL的缓慢酸化下,OPI颗粒相互吸引,形成典型的颗粒聚集状结构,加入SA会与OPI暴露的疏水基团发生疏水性互作用,并且引入大量羟基形成氢键,从而改变凝胶的颗粒聚集结构,形成支撑三维网络结构,有助于凝胶强度提高,当SA添加量超过1 g/L时,SA与OPI之间由于相分离阻碍OPI的连续网络,凝胶强度有所下降。SA作为一种带负电荷的多糖,在GDL缓慢酸化下,OPI与SA之间发生静电相互作用,在5% GDL下(pH值为6.1),OPI与SA都负电荷,凝胶速度缓慢,SA从OPI-SA复合物中分离出来形成小颗粒,三维网络与小颗粒并存,不利于强凝胶的形成。当添加10% GDL(pH值为4.8)时,减少的负电荷不仅使凝胶中静电斥力减弱,氢键和疏水相互作用增强,还使凝胶的形成速度快于相分离速度,因此凝胶形成均匀的三维网络结构,显著提高了凝胶强度。当GDL含量增加到20%(pH值为4.1)时,2种聚合物带相反电荷,OPI与SA之间会发生静电吸引形成致密的偶联凝胶网络结构,也提高了凝胶的硬度。
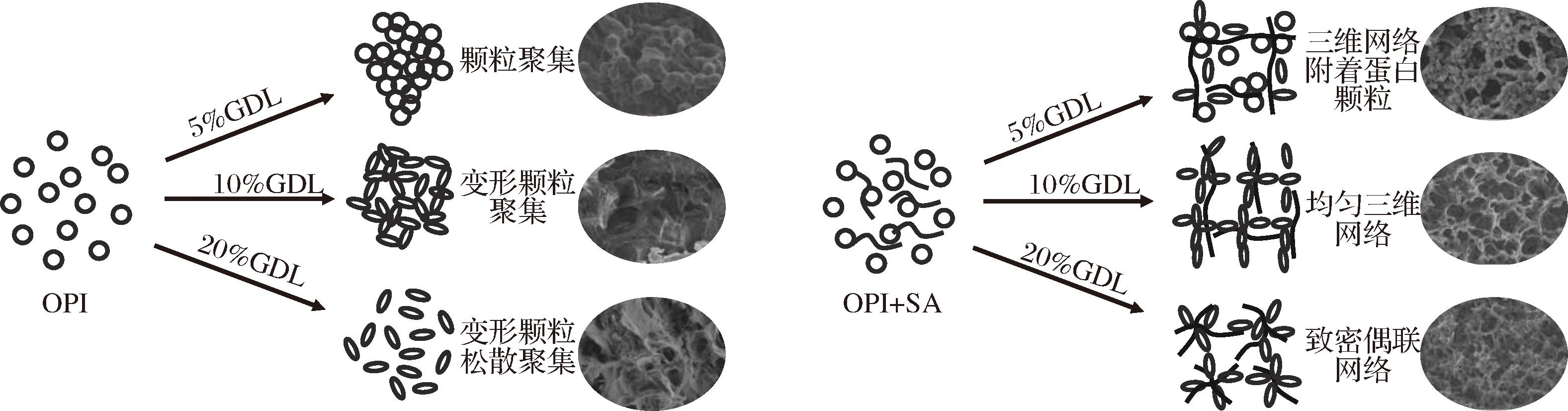
图10 酸诱导OPI-SA凝胶的形成机制
Fig.10 The formation mechanism of acid-induced OPI-SA gel
3 结论
研究表明,SA和GDL能显著调节酸诱导的OPI的凝胶性质和凝胶结构。在SA含量低于1 g/L时,OPI与SA可以通过氢键和疏水相互作用促进分子交联,有助于凝胶形成稳定的三维网络结构,从而增加酸诱导OPI-SA凝胶的强度,当SA含量超过1 g/L时,2种聚合物由于相分离凝胶强度下降。不同GDL含量可以通过调节2种聚合物静电作用来调节凝胶结构,对于添加5% GDL的凝胶,凝胶的最终pH值为6.1,2种聚合物均带负电,由于静电斥力导致明显相分离,不利于高机械强度凝胶的形成。当添加10% GDL时,凝胶的最终pH值为4.8,降低的pH使燕麦蛋白电荷数减少,静电斥力减小,形成相对均匀的凝胶结构。当GDL添加量为20%时,凝胶的最终的pH值为4.1,燕麦蛋白和海藻酸钠之间会发生静电吸引,形成更致密的凝胶网络。总体而言,SA和GDL可以调节酸诱导的OPI凝胶的微观结构,从而形成不同凝胶特性的酸诱导燕麦蛋白凝胶,为燕麦蛋白在食品中的多样化应用提供了理论依据。
[1] LIU Y H, DONG L Z, LI Y, et al.Soy protein isolate-Citrus pectin composite hydrogels induced by TGase and ultrasonic treatment:Potential targeted delivery system for probiotics[J].Food Hydrocolloids, 2023,143:108901.
[2] NIETO-NIETO T V, WANG Y X, OZIMEK L, et al.Effects of partial hydrolysis on structure and gelling properties of oat globular proteins[J].Food Research International, 2014,55:418-425.
[3] NIETO-NIETO T V, WANG Y X, OZIMEK L, et al.Inulin at low concentrations significantly improves the gelling properties of oat protein—A molecular mechanism study[J].Food Hydrocolloids, 2015,50:116-127.
[4] NIETO NIETO T V, WANG Y X, OZIMEK L, et al.Improved thermal gelation of oat protein with the formation of controlled phase-separated networks using dextrin and carrageenan polysaccharides[J].Food Research International, 2016,82:95-103.
[5] DU L Y, MENG Z.Carrageenan-induced conjugated oat protein isolate microgel particles as structure modulators in fat analogues and their digestion behaviors[J].Journal of Colloid and Interface Science, 2024,674:663-676.
[6] YANG C, WANG Y X, CHEN L Y.Fabrication, characterization and controlled release properties of oat protein gels with percolating structure induced by cold gelation[J].Food Hydrocolloids, 2017,62:21-34.
[7] LIAO P L, DAI S C, LIAN Z T, et al.The layered encapsulation of vitamin B2 and β-carotene in multilayer alginate/chitosan gel microspheres:Improving the bioaccessibility of vitamin B2 and β-carotene[J].Foods, 2021,11(1):20.
[8] LI A Q, GUO C, LI X F, et al.Gelation mechanism and physical properties of glucono-δ-lactone induced alginate sodium/casein composite gels[J].Food Hydrocolloids, 2021,118:106775.
[9] YANG S, LIAN Z T, CHENG L, et al.Insight into succinylated modified soy protein isolate-sodium alginate emulsion gels:Structural properties, interactions and quercetin release behavior[J].Food Hydrocolloids, 2024,151:109857.
[10] LI A Q, GONG T, YANG X, et al.Interpenetrating network gels with tunable physical properties:Glucono-δ-lactone induced gelation of mixed Alg/gellan Sol systems[J].International Journal of Biological Macromolecules, 2020,151:257-267.
[11] LI J X, AMIN K, FU H L, et al.Structure, physicochemical and functional properties of plant-based SPI films from different soybean varieties deficient in β-conglycinin subunits[J].Food Packaging and Shelf Life, 2023,38:101101.
[12] CHEN K W, ZHAO L X, BAO H Y, et al.Formation and characterization of cold-set whey protein gels induced by L-ascorbic acid/calcium for their encapsulation and release[J].Food Bioscience, 2024,62:105191.
[13] REN Y M, SHEN X, YANG X Y, et al.Analysis of the effect of Lactobacillus exopolysaccharide on the rheological properties of fermented soybean protein gel:Using acid-induced soybean protein as the model[J].Food Hydrocolloids, 2025,159:110662.
[14] WANG W J, SHEN M Y, JIANG L, et al.Influence of Mesona blumes polysaccharide on the gel properties and microstructure of acid-induced soy protein isolate gels[J].Food Chemistry, 2020,313:126125.
[15] LI Z H, GE G L, YANG J J, et al.Glucono-δ-lactone induced Auricularia auricula polysaccharide-casein composite gels for curcumin loading and delivery[J].International Journal of Biological Macromolecules, 2024,282(Pt1):136777.
[16] YAMAMOTO F, CUNHA R L.Acid gelation of gellan:Effect of final pH and heat treatment conditions[J].Carbohydrate Polymers, 2007,68(3):517-527.
[17] YAN X J, BAI X Q, LIU X B, et al.Enhanced functional properties of pea protein isolate microgel particles modified with sodium alginate:Mixtures and conjugates[J].Food Chemistry, 2024,441:138358.
[18] LI C H, DAI T T, JIANG D Y, et al.Modulation of acid-induced pea protein gels by gellan gum and glucono-δ-lactone:Rheological and microstructural insights[J].Food Research International, 2024,195:114988.
[19] NIU F G, DONG Y T, SHEN F, et al.Phase separation behavior and structural analysis of ovalbumin-gum arabic complex coacervation[J].Food Hydrocolloids, 2015,43:1-7.
[20] SOUZA C J F, GARCIA-ROJAS E E.Interpolymeric complexing between egg white proteins and xanthan gum:Effect of salt and protein/polysaccharide ratio[J].Food Hydrocolloids, 2017,66:268-275.
[21] NICOLAI T.Gelation of food protein-protein mixtures[J].Advances in Colloid and Interface Science, 2019,270:147-164.
[22] YANG X, LI A Q, LI X X, et al.An overview of classifications, properties of food polysaccharides and their links to applications in improving food textures[J].Trends in Food Science &Technology, 2020,102:1-15.
[23] YANG C, WANG X, HU H Y, et al.Cold-set oat protein isolate--gellan gum binary gels with various microstructures:Fabrication, characterization, formation mechanism, and controlled release properties[J].Food Hydrocolloids, 2022,131:107818.
[24] LEE J, WI G, CHOI M J.The rheological properties and stability of gelled emulsions applying to κ-carrageenan and methyl cellulose as an animal fat replacement[J].Food Hydrocolloids, 2023,136:108243.
[25] YU J, WANG X Y, LI D, et al.Development of soy protein isolate emulsion gels as extrusion-based 3D food printing inks:Effect of polysaccharides incorporation[J].Food Hydrocolloids, 2022,131:107824.
[26] LIU Y X, ZHANG Y C, DONG F J, et al.Preparation and application of glucono-δ-lactone-induced gel of transglutaminase cross-linked black bean protein isolate-whey protein isolate:Effect of ultrasound pretreatment[J].Ultrasonics Sonochemistry, 2025,112:107152.
[27] VAN DEN BERG L, ROSENBERG Y, VAN BOEKEL M A J S, et al.Microstructural features of composite whey protein/polysaccharide gels characterized at different length scales[J].Food Hydrocolloids, 2009,23(5):1288-1298.
[28] LIU M Y, SHAN S, GAO X, et al.The effect of sweet tea polysaccharide on the physicochemical and structural properties of whey protein isolate gels[J].International Journal of Biological Macromolecules, 2023,240:124344.
[29] WANG M, FU Y Y, CHEN G W, et al.Fabrication and characterization of carboxymethyl chitosan and tea polyphenols coating on zein nanoparticles to encapsulate β-carotene by anti-solvent precipitation method[J].Food Hydrocolloids, 2018,77:577-587.
[30] ALAVI F, EMAM-DJOMEH Z, YARMAND M S, et al.Cold gelation of curcumin loaded whey protein aggregates mixed with k-carrageenan:Impact of gel microstructure on the gastrointestinal fate of curcumin[J].Food Hydrocolloids, 2018,85:267-280.
[31] HU C, XIONG H G.Structure, interfacial adsorption and emulsifying properties of potato protein isolate modified by chitosan[J].Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2022,638:128314.
[32] CHEN J X, DENG T Y, WANG C, et al.Effect of hydrocolloids on gel properties and protein secondary structure of silver carp surimi[J].Journal of the Science of Food and Agriculture, 2020,100(5):2252-2260.
[33] XING H R, LIU X G, HU Y F, et al.Effect of Lycium barbarum polysaccharides on heat-induced gelation of soy protein isolate[J].Food Hydrocolloids, 2024,147:109323.
[34] SHEN R H, YANG X, LIU M Y, et al.Preparation of bovine serum albumin-arabinoxylan cold-set gels by glucono-δ-lactone and salt ions double induction[J].International Journal of Biological Macromolecules, 2024,277(Pt 1):133596.
[35] ZHANG Q, SUN P, XU Z J, et al.Chitin nanocrystals as natural gel modifier for yielding stronger acid-induced soy protein isolate gel[J].Carbohydrate Polymers, 2024,323:121446.