近年来,4-乙烯基愈创木酚(4-vinylguaiacol,4-VG)的生物生产因其广泛的应用价值和高经济潜力而备受关注。4-VG是一种由阿魏酸(ferulic acid,FA)脱羧生成的芳香化合物,具有独特的丁香香味,在食品、化妆品、药物及化工等领域需求旺盛,其商业价值显著,价格是FA的40倍,因此成为高价值的精细化工原料[1-4]。传统上,4-VG主要通过化学合成生产,这种方法依赖金属催化剂并需在高温高压等苛刻条件下进行,这不仅对产品安全性构成威胁,还引发了环境污染问题[5-6]。为解决这些问题,研究者们探索了利用微生物和酶催化的生物合成方法,这种途径操作条件温和且更环保,逐渐成为化学合成的替代选择。已有研究利用微生物通过FA生成4-VG的报道,如枯草芽孢杆菌(Bacillus subtilis)、芦苇曲霉(Aspergillus luchuensis)、解淀粉芽孢杆菌(Bacillus amyloliquefaciens)、肺炎克雷伯菌(Klebsiella pneumoniae)等[7-10]。
尽管4-VG和FA具有巨大的商业价值,但其生产过程中高浓度底物和产物对微生物和酶具有毒性,成为限制高效生产的主要瓶颈[11-12]。为此,研究者提出了两相体系(two phase system,TPS)作为创新解决方案,该方法通过将反应物和产物分配在水相和有机相之间,缓解毒性问题并提高产量[13]。例如,胡宏飞[14]使用耐有机溶剂的地衣芽孢杆菌来源的酚酸脱羧酶(phenolic acid decarboxylase,PAD),在TPS中实现了高效转化,生产出375 mmol/L(56.3 g/L)的4-VG,摩尔转化率达75%。随后,CHEN等[15]进一步优化工艺,结合流加工艺和高细胞密度培养,在5 L生物反应器中实现了865.2 mmol/L(129.9 g/L)的4-VG生产,摩尔转化率达85.6%。此外,LI等[16]通过分子筛连接肽固定化酶技术,在5 L生物反应器中实现的4-VG滴度高达295.8 g/L,产率达22.8 g/(L·h)。
细胞表面展示活性酶技术作为传统酶固定化的替代方案逐渐受到关注,与传统的细胞内或细胞外表达系统相比,细胞表面展示策略脱颖而出,无需酶纯化[17],克服了底物转运限制,并表现出增强的活性、稳定性和选择性[18-19]。与噬菌体或细菌表面显示不同,酵母表面展示系统具有明显的优势,包括其细胞体积大、易于培养和遗传操作、较高的表达水平、更稳定的结合界面、对展示蛋白有较强的适应性[20]。因此本研究利用萎缩芽孢杆菌来源的PAD基因在酿酒酵母(Saccharomyces cerevisiae)表面展示,同时在毕赤酵母(Pichia pastoris)中分泌表达,比较了2种酶的酶学性质,并且对比了两者在不同浓度底物、产物和有机溶剂存在下的耐受性,随后将表面展示酶应用于5L生物反应器中生产4-VG,以测试其可行性。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与质粒
克隆宿主大肠杆菌(Escherichia coli)JM109、表达菌株毕赤酵母GS115、表达载体pPIC9K、表达菌株酿酒酵母EBY100、表达载体pYD1均由本实验室保藏。本实验中使用的PAD基因来源于萎缩芽孢杆菌(GenBank登录号AKL86192.1),引物由苏州金唯智生物有限公司合成,如表1所示。
表1 本研究使用的引物
Table 1 Primers used in this study
1.1.2 试剂与原料
甲醇、乙腈,Sigma公司;蛋白胨、酵母粉、D-葡萄糖、阿魏酸(ferulic acid,FA)、甲苯、十二烷、环己烷、正辛醇、正庚烷,国药试剂有限公司;一抗抗Flag-tag小鼠单克隆抗体,Abbkine公司;异硫氰酸荧光素-缀合的山羊抗小鼠抗体,Earthox公司;酵母感受态细胞制备试剂盒、CloneExpress无缝克隆试剂盒,生工生物(上海)股份有限公司;半乳糖、酸水解酪蛋白,上海麦克林生化科技有限公司;酵母基础氮源(yeast nitrogen base,YNB),北京酷来搏科技有限公司;通用型DNA纯化回收试剂盒、质粒提取试剂盒,天根生化科技(北京)有限公司。
1.1.3 培养基
YPD液体培养基(g/L):蛋白胨20、酵母粉10、葡萄糖20;YNB-CAA培养基(YNB-casamino acids medium)(g/L):YNB 6.7、葡萄糖或半乳糖20、酸水解酪蛋白5;基础葡萄糖固体平板(minimal dextrose, MD)(g/L):YNB 6.7、亮氨酸0.1、葡萄糖20、琼脂糖20;LB培养基(g/L):蛋白胨10、酵母粉5、氯化钠10;BMGY培养基(buffered glycerol-complex medium)(g/L):酵母粉10、蛋白胨20、100 mmol/L pH值为6.0的磷酸钾缓冲液、YNB 13.4、生物素4×10-4、甘油10。BMMY培养基(buffered methanol-complex medium)(g/L):酵母粉10、蛋白胨20、100 mmol/L pH值为6.0的磷酸钾缓冲液、YNB 13.4、生物素4×10-4、甲醇10。
1.2 仪器与设备
TCS SP8激光共聚焦显微镜,德国徕卡公司;1260 Infinity 安捷伦高效液相色谱,美国安捷伦科技有限公司;TC-96/G/H(b)C PCR仪,杭州博日科技有限公司;Thermo高速冷冻离心机,赛默飞世尔科技;MicroPulser 电转仪,美国Bio-Rad公司;SPX-250B-Z恒温培养箱,上海博讯实业有限公司;EPS300蛋白制胶与电泳系统,上海天能科技有限公司;HZQ-2QA摇床,苏州威尔实验用品有限公司;Chemidoc凝胶成像仪,美国Bio-Rad公司;EL20(K) pH计,瑞士Mettler Toledo;SW-CJ-VS1超净工作台,无锡易纯净化设备有限公司。
1.3 实验方法
1.3.1 质粒构建与蛋白表达
PAD基因来自萎缩芽孢杆菌,由GENEWIZ(China)合成,设计引物在靶基因两端添加同源臂,通过一步克隆技术将带有标签的目的基因整合到线性化的质粒中。其中表面层示酚酸脱羧酶(SD-Bapad)的构建是将Bapad基因插入到Aga2p的C末端的一个阅读框中,之间用多聚甘氨酸丝氨酸接肽(Gly-Ser linker)连接,并在Bapad基因末尾加上Flag标签用于检测其正确表达。
将构建的表达质粒转化到克隆菌株JM109中。将重组体涂布在含有100 μg/mL氨苄青霉素的LB固体平板上。挑取单菌落进行PCR验证,验证成功后提取质粒。将经正确验证的质粒转化至酿酒酵母EBY 100和毕赤酵母GS115,其中质粒pPIC9K-Bapad通过用酶Sac Ⅰ单次消化而线性化。从MD平板上挑取毕赤酵母GS115的单菌落,并在YPD中于30 ℃下在200 r/min摇床中培养24 h。然后,以2%接种量将培养物接种到BMGY中,在30 ℃下以200 r/min振荡培养24 h,再以1%接种量将培养物接种到BMMY中,每隔24 h向最终培养物中加入1%(体积分数)甲醇,并在28 ℃下诱导4 d。将酿酒酵母EBY100在含有2%(体积分数)葡萄糖的YNB-CAA培养基中于30 ℃下孵育过夜,以220 r/min振摇。将酵母培养物以4 000 r/min离心5 min,并将细胞沉淀重悬于2%(体积分数)半乳糖YNB-CAA溶液中。将OD600nm值调整为1,并在20 ℃下诱导培养物48 h。
1.3.2 重组蛋白的表达验证
宿主GS115在经甲醇诱导96 h后,10 000 r/min,5 min离心收集上清液,使用Ni-NTA通过亲和层析纯化粗酶。使用SDS-PAGE估计纯化Bapad的酶纯度和分子质量。
宿主EBY100在经半乳糖诱导48 h后,5 000 r/min,5 min离心收集细胞,经PBS缓冲液洗涤3遍,用免疫荧光法检测PAD的定位。将洗涤后的全细胞重悬于补充有1 mg/mL牛血清白蛋白(bovine serum albumin,BSA)的PBS缓冲液(pH 7.4)中,并用一抗抗Flag-tag小鼠单克隆抗体(1∶500,体积比)在4 ℃下过夜处理。随后,再经PBS洗涤3遍,将全细胞在黑暗中暴露于异硫氰酸荧光素(fluorescein isothiocyanate,FITC)-缀合的山羊抗小鼠第二抗体(1∶500)1 h,最后用PBS洗涤3次。调整至合适浓度,将1滴细胞悬液加到载玻片上,用于激光共聚焦显微镜分析[21]。以相同的方式,将导入空载质粒的EBY100全细胞的免疫标记物用作对照。
1.3.3 PAD活性检测
标准试验混合物含有0.8 mL Na2HPO4-柠檬酸缓冲液(先分别配制0.2 mol/L的Na2HPO4 及0.1 mol/L的柠檬酸溶液各500 mL,再将柠檬酸溶液缓慢加入Na2HPO4溶液中,并同时不断搅拌测定pH,当pH值达到6.0时停止加入,混匀即可),0.1 mL 50 mmol/L FA和0.1 mL粗酶溶液(SD-Bapad质量浓度为0.2 g/mL,游离酶浓度为0.28 mg/mL),置于10 mL带螺旋盖(聚四氟乙烯密封件)的玻璃瓶中。将反应混合物在37 ℃下孵育20 min,然后加入2 mL甲醇终止反应。通过HPLC对形成的产物进行定量,HPLC 方法与DENG等[22]相同。使用BRANFORD方法[23],以BSA作为标准品,进行蛋白质含量测定。1单位酶活性定义为每分钟产生1 μmoL 4-乙烯基衍生物所需的酶,按照公式(1)计算PAD活性:
PAD活性![]()
(1)
式中:V1表示加入的酶溶液的量,mL;X 表示由标准曲线计算的 4-乙烯基愈创木酚的含量,mmol/L;V2表示酶反应体系的终体积,mL;t表示酶的反应时间,min;C表示蛋白质的质量浓度,mg/mL。
以4-VG标准品的浓度为横坐标,以峰面积为纵坐标,对各浓度的峰面积进行线性回归分析,绘制标准曲线。
1.3.4 酶学性质
在10 mL密封盖瓶中确定了催化的最佳温度和pH。混合物由0.1 mL含有50 mmol/L阿魏酸钠溶液,0.8 mL Na2HPO4-柠檬酸缓冲液和0.1 mL酶溶液组成。温度为25、30、35、40、45、50、55、60 ℃,pH 3.0~10.0。以最高酶活性为100%。
在上述标准测定条件下,通过测量酶在20~60 ℃无底物条件下预孵育1 h后的残留活性,测定热稳定性。通过测量酶在通用缓冲液(50 mmol/L H3PO4、50 mmol/L CH3COOH和50 mmol/L H3BO3,使用0.2 mol/L NaOH将pH值调节至3.0~10.0)中孵育1 h后的残留活性,测定pH稳定性。以未处理酶活性为100%。
1.3.5 底物、产物及有机溶剂与产物联合抑制
为了确定底物或产物对游离酶和SD-Bapad活性的抑制,分别将FA(5、10、25、50、100、200、300、400、500 mmol/L)或4-VG(1、5、10、20、40、60、80 mmol/L)与游离酶或SD-Bapad在标准测定条件下反应5 min测量相对酶活性,分别以产生最多的4-VG浓度为100%和不加产物的对照组产生的4-VG浓度为100%。
为了确定残留有机溶剂和溶解在水相中的4-VG的联合毒性,将Na2HPO4-柠檬酸缓冲液,100 g/L(666.7 mmol/L)的4-VG和等体积的不同有机溶剂在37 ℃和200 r/min下处理48 h。随后,除去有机溶剂,并在10 000 r/min离心10 min后收集饱和缓冲液。如上所述,在标准测定条件下反应5 min,使用饱和缓冲液测定游离酶和SD-Bapad的活性。将用4-VG和有机溶剂预饱和之前的缓冲液中的活性定义为100%来计算相对酶活性。
1.3.6 有机溶剂对SD-Bapad活性及稳定性的影响
有机溶剂对SD-Bapad活性的影响通过在37 ℃、200 r/min以及占50%总体积分数的各种有机溶剂条件下,在标准测定体系测量活性(20 min)来检测。为了评价SD-Bapad对各种有机溶剂的稳定性,将定量的酶与占20%、30%、50%(体积分数)的各种有机溶剂,在37 ℃、200 r/min条件下振荡1 h和12 h,之后在标准测定条件下测量表面展示酶的残留活性,以不加有机溶剂处理的酶活性为100%。
1.3.7 SD-Bapad全胞催化的有机溶剂筛选
为了筛选对双相反应有利的有机溶剂,在双相体系中使用不同的有机溶剂进行全细胞催化2 h和6 h。将Na2HPO4-柠檬酸缓冲液中的FA浓度增加至200 mmol/L,通过HPLC测定产生的4-VG的浓度,以转化率最高的有机溶剂作为最终选择。
1.3.8 SD-Bapad重复利用性研究
在以甲苯为有机溶剂的条件下,首先测定双相反应的最适温度和最适pH。为了测试SD-Bapad的可重复使用性,在两相体系中使用3 mL甲苯作为有机相和3 mL Na2HPO4-柠檬酸缓冲液(pH 7.0)作为水相进行催化反应,在30 ℃和200 r/min下振荡反应6 h。水相分别含有200 mmol/L FA和0.8 g湿重酿酒酵母。反应后,通过离心分离从反应溶液中回收酵母,并用相同的Na2HPO4-柠檬酸缓冲液洗涤3次,然后再用于下一批次。该过程进行6个循环,通过HPLC检测水相和有机相中生成的4-VG的含量。
1.3.9 5L生物反应器中全细胞催化法生产4-VG
在含有1 L水相(pH 6.5 Na2HPO4-柠檬酸缓冲液)和1 L 甲苯的两相系统中进行4-VG的生产。在这种系统中,水相最初含有200 mmol/L FA 和10 g(湿重)酿酒酵母,在30 ℃下以150 r/min的搅拌速度进行全细胞催化。一旦pH值由于FA的消耗而增加到7.5,就将FA间歇地进料到反应混合物中,之后停止进料直到pH值下降到6.5。在全细胞催化过程中,体系中的pH值保持在7.0±0.5。
2 结果与分析
2.1 表达及验证
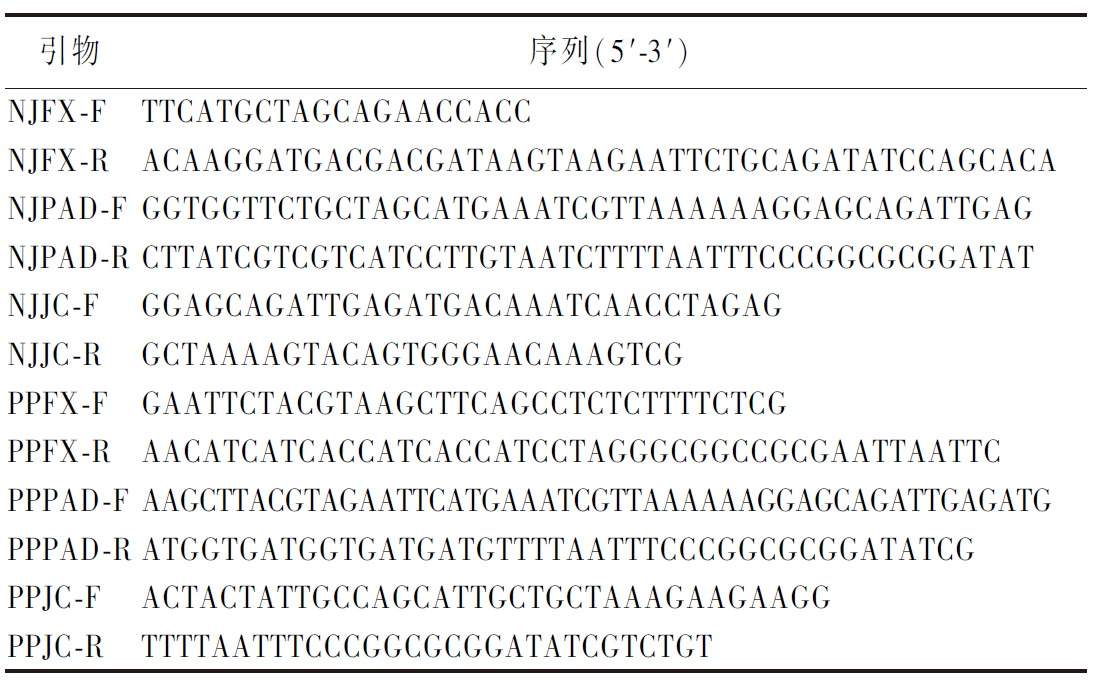
Bapad在异源宿主EBY100中表达经过免疫荧光反应后用激光共聚焦显微镜观察荧光,明场、暗场、叠加场证明目的蛋白已正确表达于细胞表面(图1)。
a-酿酒酵母EBY100表达质粒pYD1-Bapad质粒图谱; b-酿酒酵母菌株与pYD 1-Bapad和pYD 1质粒的融合, 在激光共聚焦显微镜下使用anti-Flag标签抗体和FITC缀合的 抗小鼠IgG抗体进行荧光检测以进行鉴定
图1 pYD1-Bapad质粒构建图谱和激光共聚焦显微镜 显示荧光照片
Fig.1 Fluorescence photographs of pYD1-Bapad plasmid construction and laser confocal microscopy
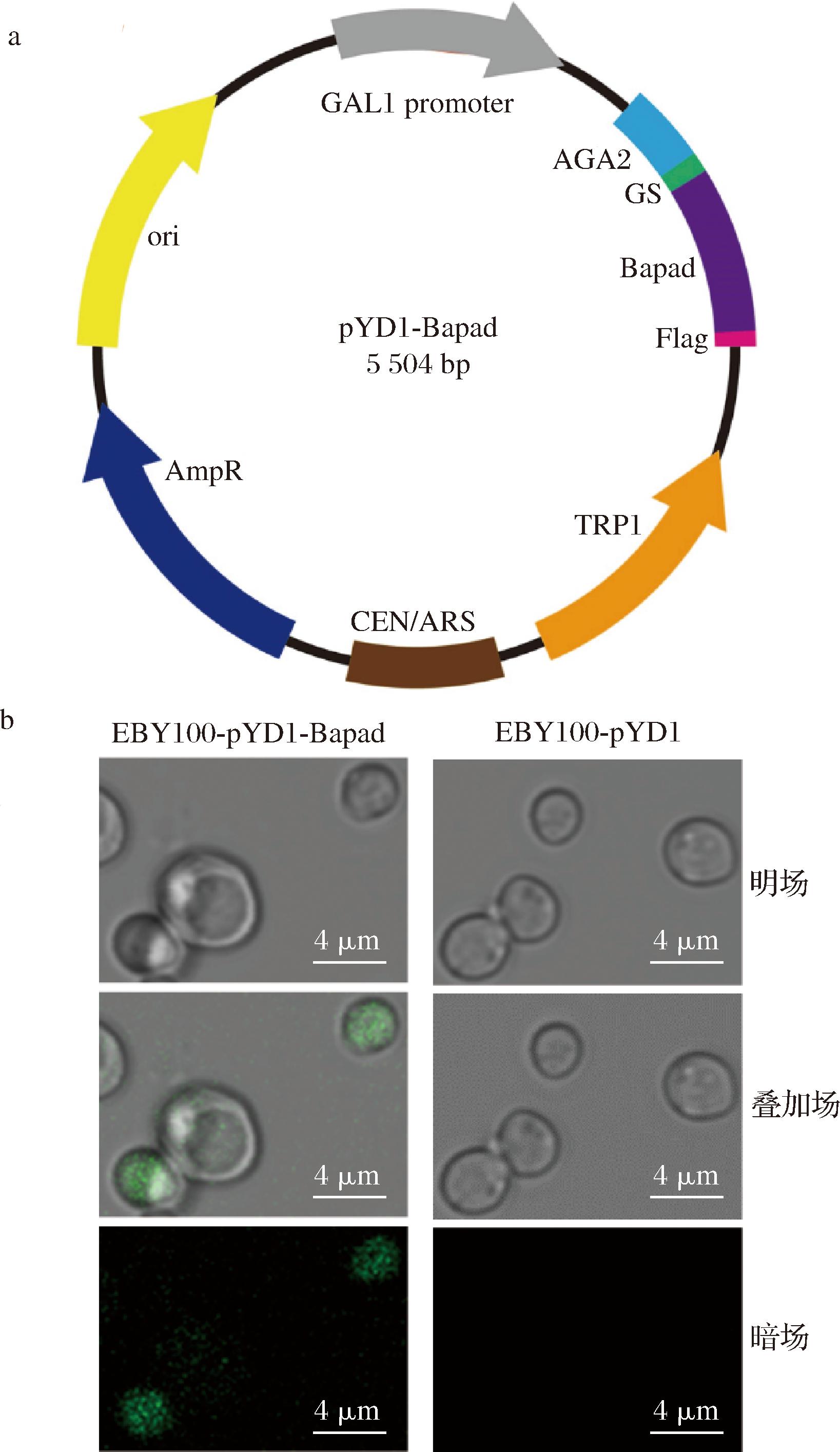
Bapad在异源宿主GS115中表达,用Ni-NTA凝胶柱亲和纯化带有 6×His标签的重组Bapad。在SDS-PAGE分析中,纯化的Bapad显示分子质量约为22.7 kDa的单一条带,与理论大小一致(图2)。
M-Maker;1-纯化后蛋白;2-培养基上清液;3-空载质粒对照。 a-毕赤酵母GS115表达质粒pPIC9K-Bapad质粒构建图谱; b-游离Bapad表达与纯化
图2 pPIC9K-Bapad质粒构建与Bapad蛋白表达与纯化
Fig.2 Construction of pPIC9K-Bapad plasmid and expression and purification of Bapad protein
2.2 酶学性质分析
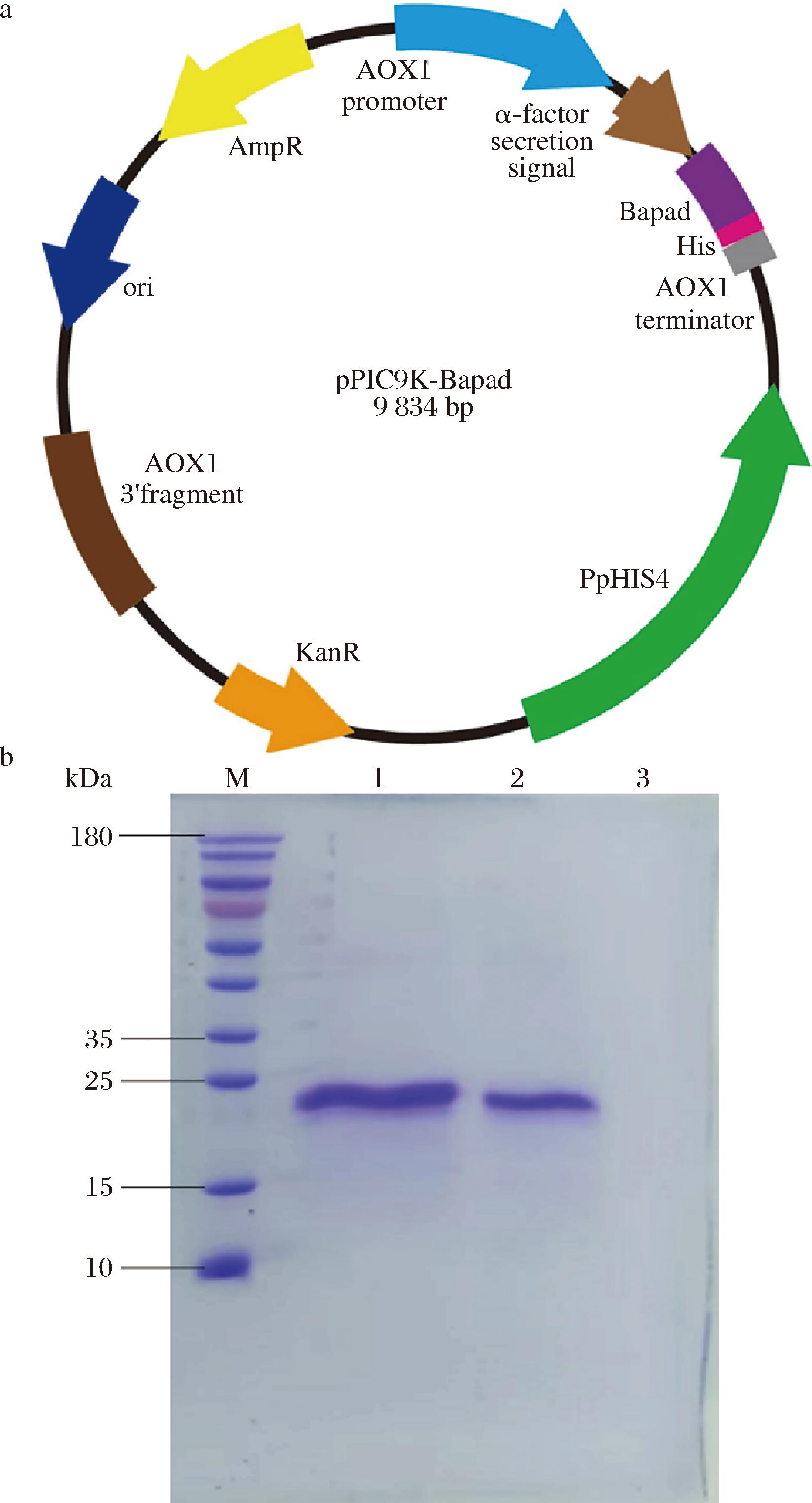
由图3-a、图3-c可知SD-Bapad最适温度为45 ℃,最适pH值为6,游离酶的最适温度为50℃,最适pH值为5。由图3-b、图3-d可知,SD-Bapad在45~60 ℃时具有更高的温度耐受性,在酸性和碱性条件下耐受性突出,在pH 3~10条件下相对酶活性均保持65%以上,而游离酶在极端pH条件下则失活。过去研究发现,酵母表面展示酶通常对极端pH和高温具有更稳定的特性[24],这一点得到了本文的证实,并且高热稳定性和良好的耐酸碱性使其更适合工业化生产。
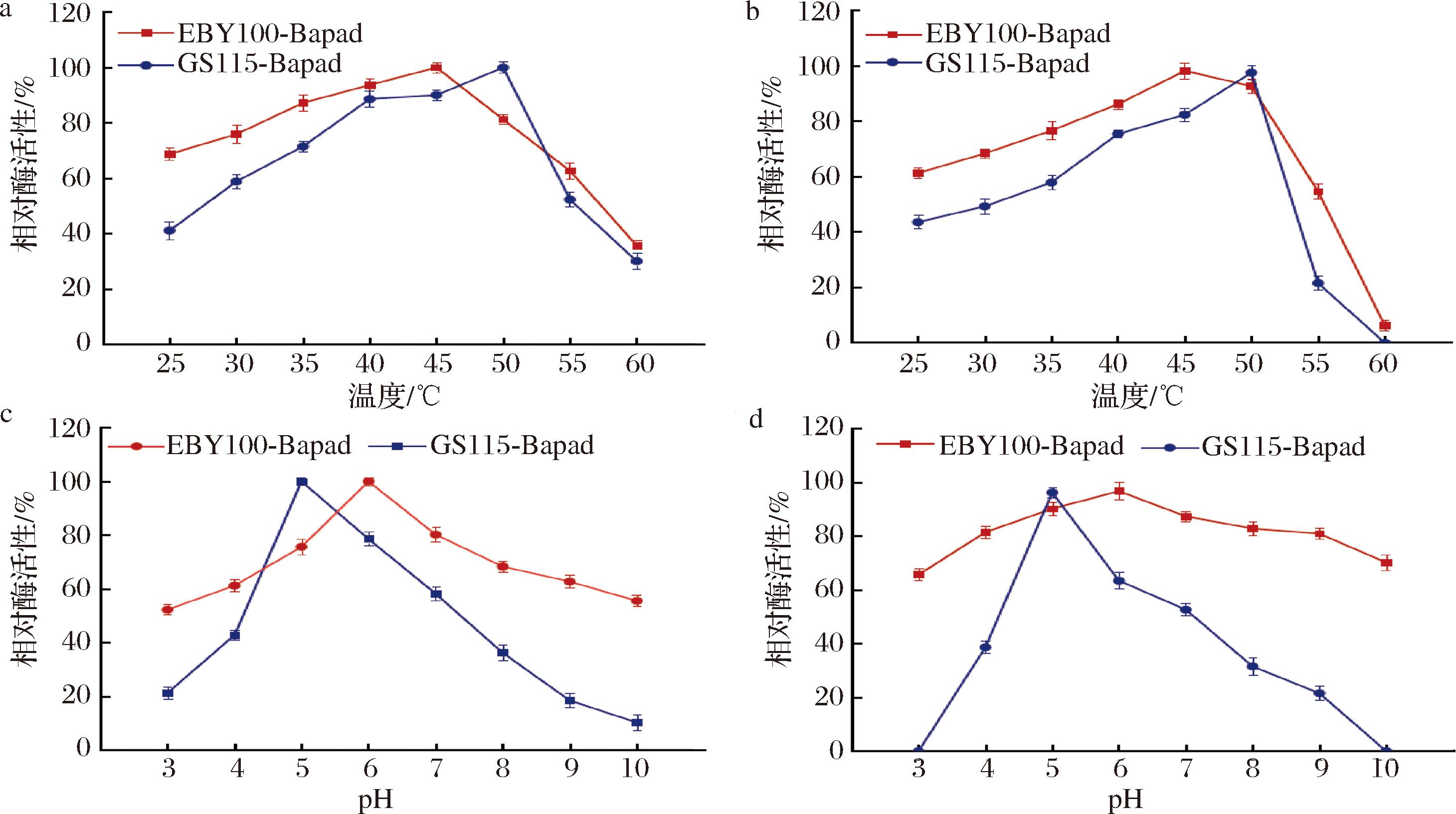
a-最适反应温度;b-温度耐受性;c-最适pH;d-pH耐受性
图3 SD-Bapad与游离Bapad酶学性质
Fig.3 Enzymatic properties of SD-Bapad and free Bapad
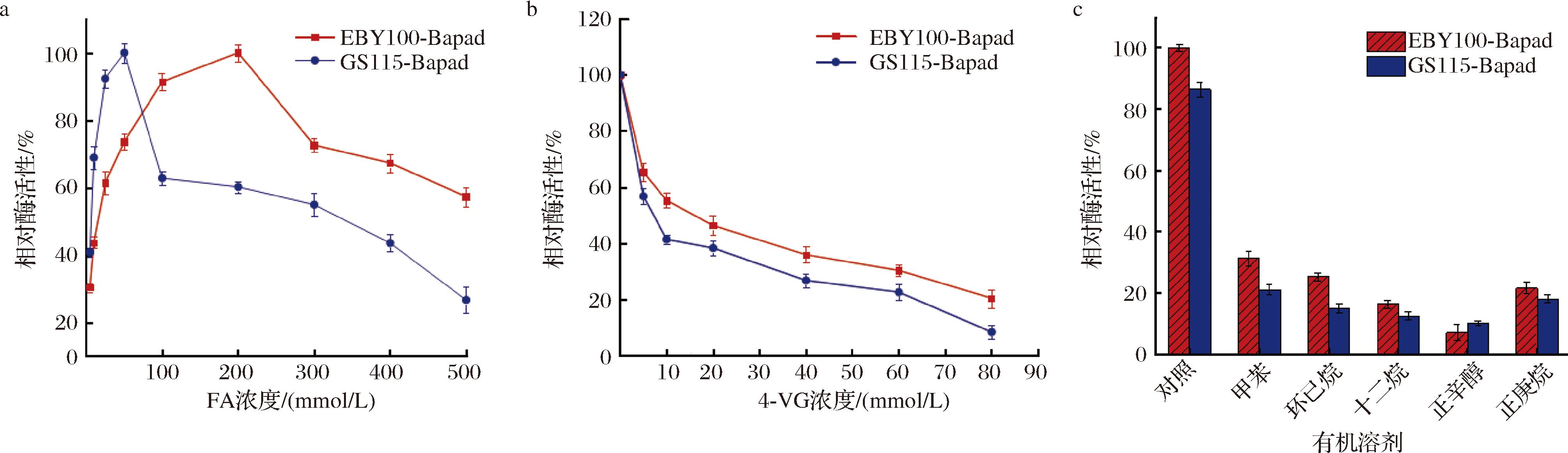
a-底物抑制影响;b-产物抑制影响;c-有机溶剂与产物联用影响
图4 高浓度底物,产物及有机溶剂与产物联用影响
Fig.4 Effect of high concentration of substrates, products, and organic solvents combined with products
2.3 底物,产物及有机溶剂与产物联用抑制
如图4所示,游离酶在底物浓度5~50 mmol/L时酶活性迅速上升,但是在50 mmol/L之后不断下降,而SD-Bapad在底物浓度200 mmol/L之内相对酶活性一直在上升,之后缓慢下降。在不同的产物浓度下2种酶活性均不断下降,最终游离酶稳定在8%,而表面展示酶稳定在20%,说明产物对2种酶都具有极大毒性,但是总体来说表面展示酶对高浓度底物和产物的耐受性高于游离酶。
留在水相中的有机溶剂和产物对于酶活性依然有很大影响,其中有机溶剂为甲苯时抑制作用最小,而其他有机溶剂均造成了极大的抑制作用,尤其是正辛醇,说明在高浓度产物下甲苯更有利于游离酶和表面展示酶对FA的催化。
2.4 有机溶剂对SD-Bapad活性和稳定性影响
通过在标准条件的基础上加上1 mL不同有机溶剂来测定不同有机溶剂对酶活性的影响(有机溶剂的选择LI等[25]的研究),如图5所示,除了正辛醇对酶活性有极大的抑制作用,抑制率为77%,其余有机溶剂均有激活作用。其中甲苯的激活效果最好,其次是环己烷、正庚烷、十二烷。
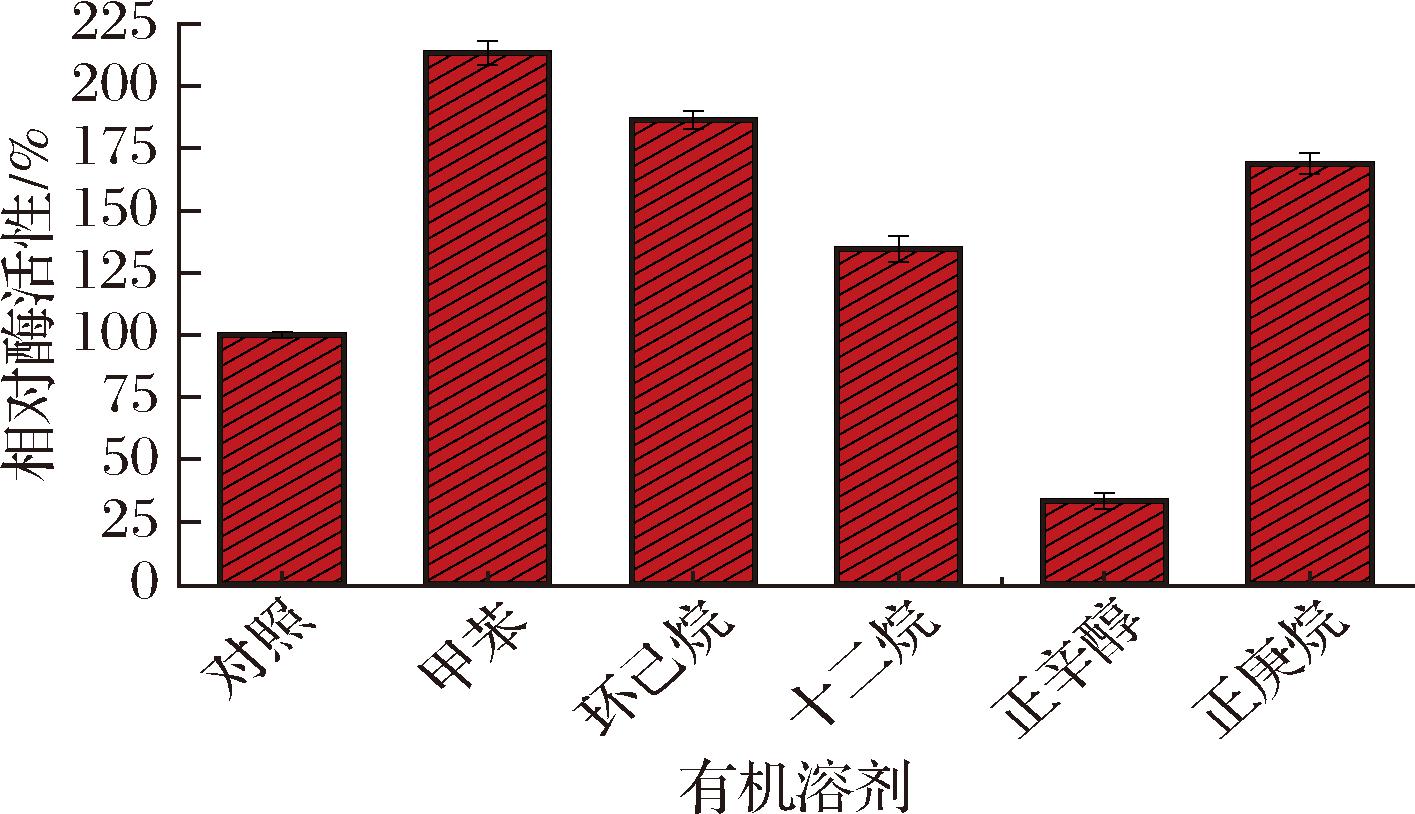
图5 有机溶剂对SD-Bapad的酶活性影响
Fig.5 Effect of organic solvents on the enzyme activity of SD-Bapad
不同有机溶剂对SD-Bapad稳定性影响如表2所示,在37 ℃条件下将表面展示酶与各种有机溶剂一起孵育1 h,除了正辛醇对其酶活性造成极大的损失外,其余所选有机溶剂均使其超过了初始活性的110%以上,在相同温度下与各种有机溶剂孵育12 h,除了正辛醇几乎使表面展示酶失活,其余所选有机溶剂均使其初始酶活性保留超过了80%。这些观察结果表明SD-Bapad表现出高有机溶剂耐受性。
表2 各种有机溶剂对SD-Bapad稳定性的影响
Table 2 Effects of various organic solutions on the stability of SD-Bapad
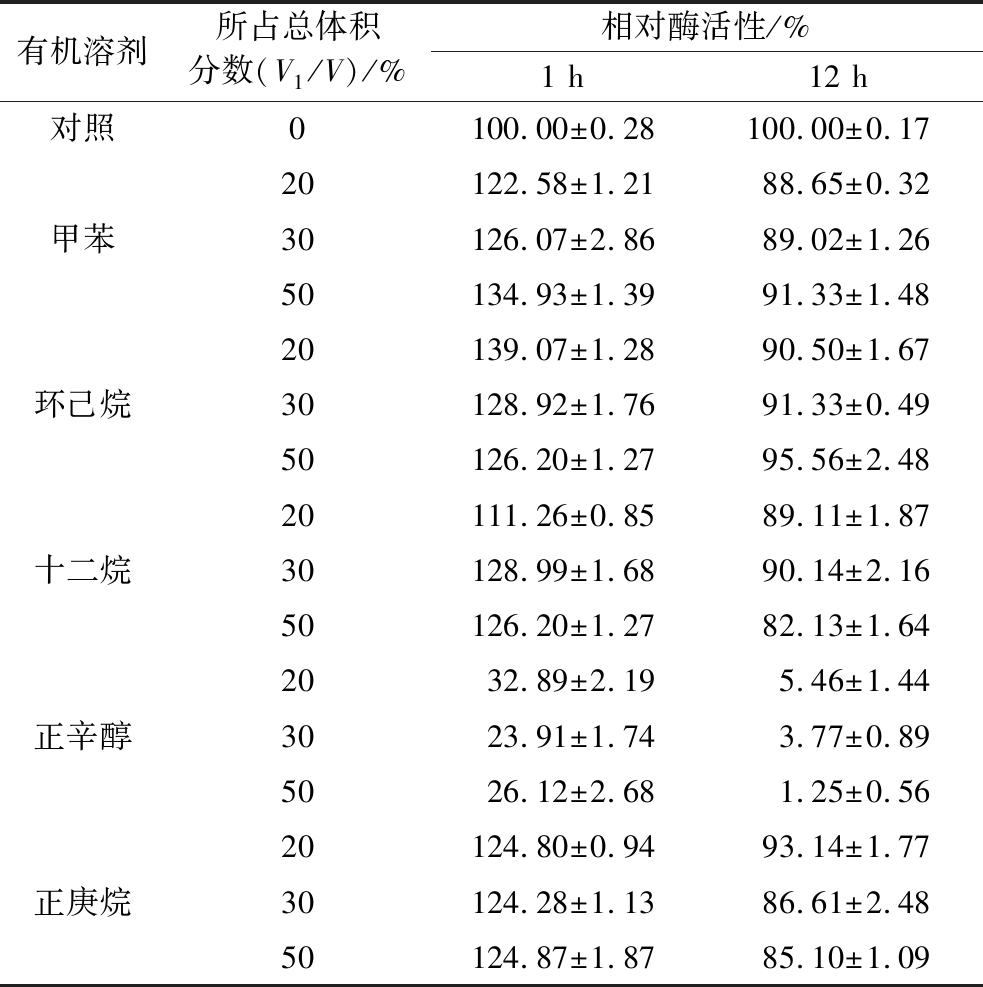
注:V1指有机溶剂体积,V指溶液总体积。
有机溶剂所占总体积分数(V1/V)/%相对酶活性/%1 h12 h对照0100.00±0.28100.00±0.1720122.58±1.2188.65±0.32甲苯30126.07±2.8689.02±1.2650134.93±1.3991.33±1.4820139.07±1.2890.50±1.67环己烷30128.92±1.7691.33±0.4950126.20±1.2795.56±2.4820111.26±0.8589.11±1.87十二烷30128.99±1.6890.14±2.1650126.20±1.2782.13±1.642032.89±2.195.46±1.44正辛醇3023.91±1.743.77±0.895026.12±2.681.25±0.5620124.80±0.9493.14±1.77正庚烷30124.28±1.1386.61±2.4850124.87±1.8785.10±1.09
2.5 双相反应有机溶剂的筛选
在进行反应前首先测量了双相反应的最适条件,如图6所示,最适温度为30 ℃,最适pH值为7.0。在包含200 mmol/L FA的Na2HPO4-柠檬酸缓冲液和不同有机溶剂的两相系统中反应2 h和6 h用于两相反应的溶剂筛选。最适条件下有机溶剂为甲苯时反应6 h后,4-VG的摩尔转化率最高为89%,其次是环己烷,其转化率为81%,因此选择甲苯为最适有机溶剂。
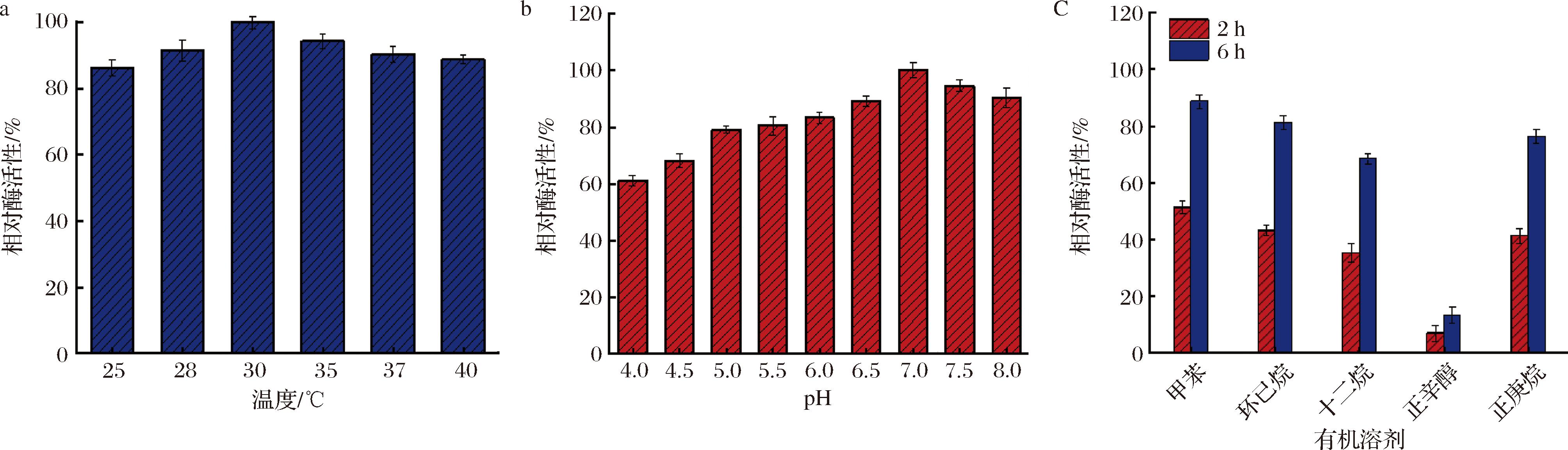
a-双相反应最适pH;b-双相反应最适温度;c-在含有200 mmol/L FA和不同有机溶剂的两相反应体系中,全细胞催化2 h和6 h的相对酶活性
图6 最适条件下SD-Bapad进行双相反应效果
Fig.6 Effect of biphasic reaction of SD-Bapad under optimal conditions
2.6 SD-Bapad重复利用性研究
可重复利用性是评估其在连续生产中的可行性的重要特性[26],将SD-Bapad在200 mmol/L底物FA的条件下每次反应6 h,测定相对酶活性。如图7所示,在第1、2、3、4、5、6次重复利用后,相对酶活性依次下降了1.3%、3.8%、13%、19.5%、24.7%、27%。最终相对酶活性保持在63%以上,表明SD-Bapad在苛刻的反应条件下具有优异的可重复利用性。
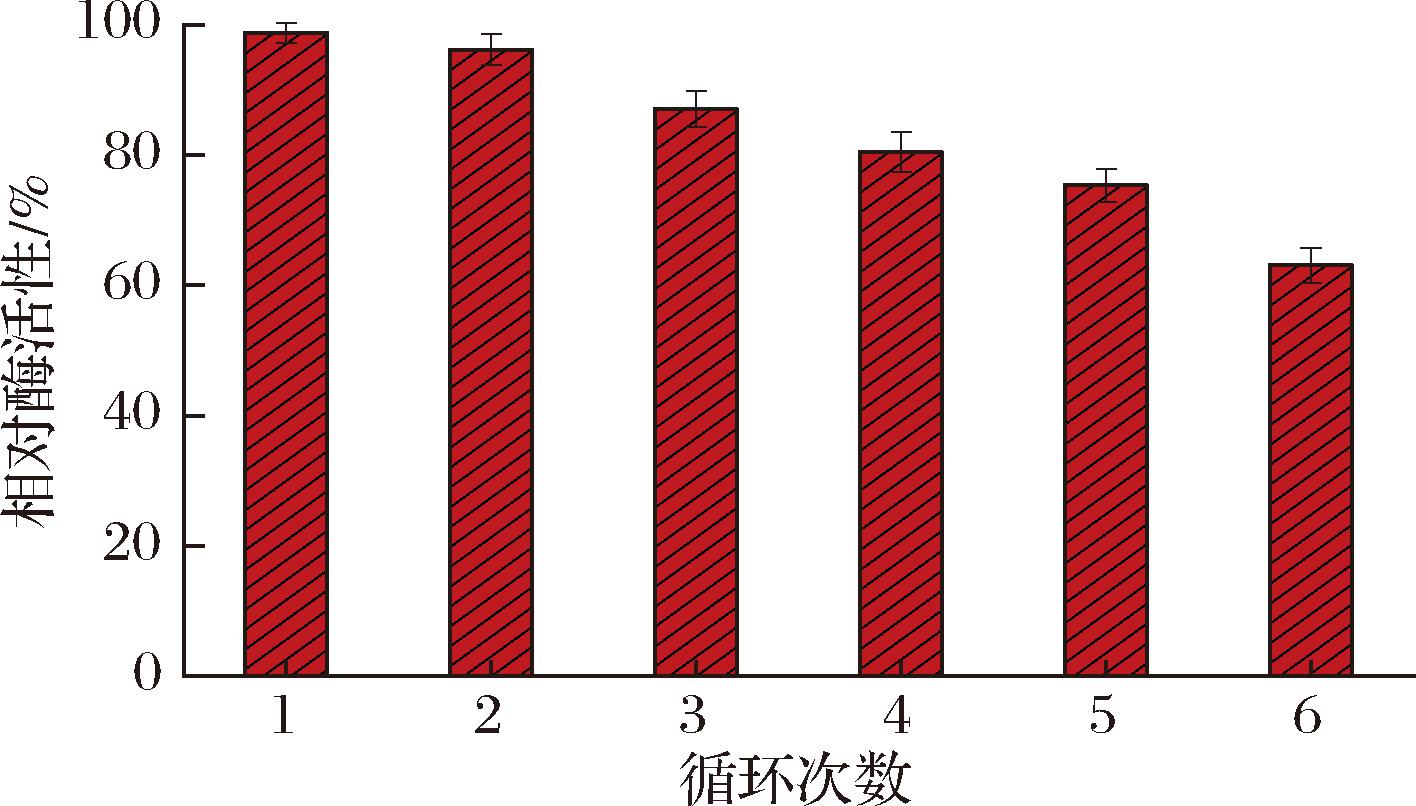
图7 SD-Bapad在200 mmol/L底物FA条件下的可重复利用性
Fig.7 Reusability of SD-Bapad at 200 mmol/L substrate FA
2.7 5L生物反应器放大反应制备4-VG
在5 L生物反应系统中,如图8所示,4-VG在前6 h内快速积累,并且在20 h内从240 g/L(1 235 mmol/L)的FA获得约157.4 g/L(1 047.9 mmol/L)的4-VG。在该反应中,摩尔转化率和生产率分别达到84.8%和7.9 g/(L·h)。
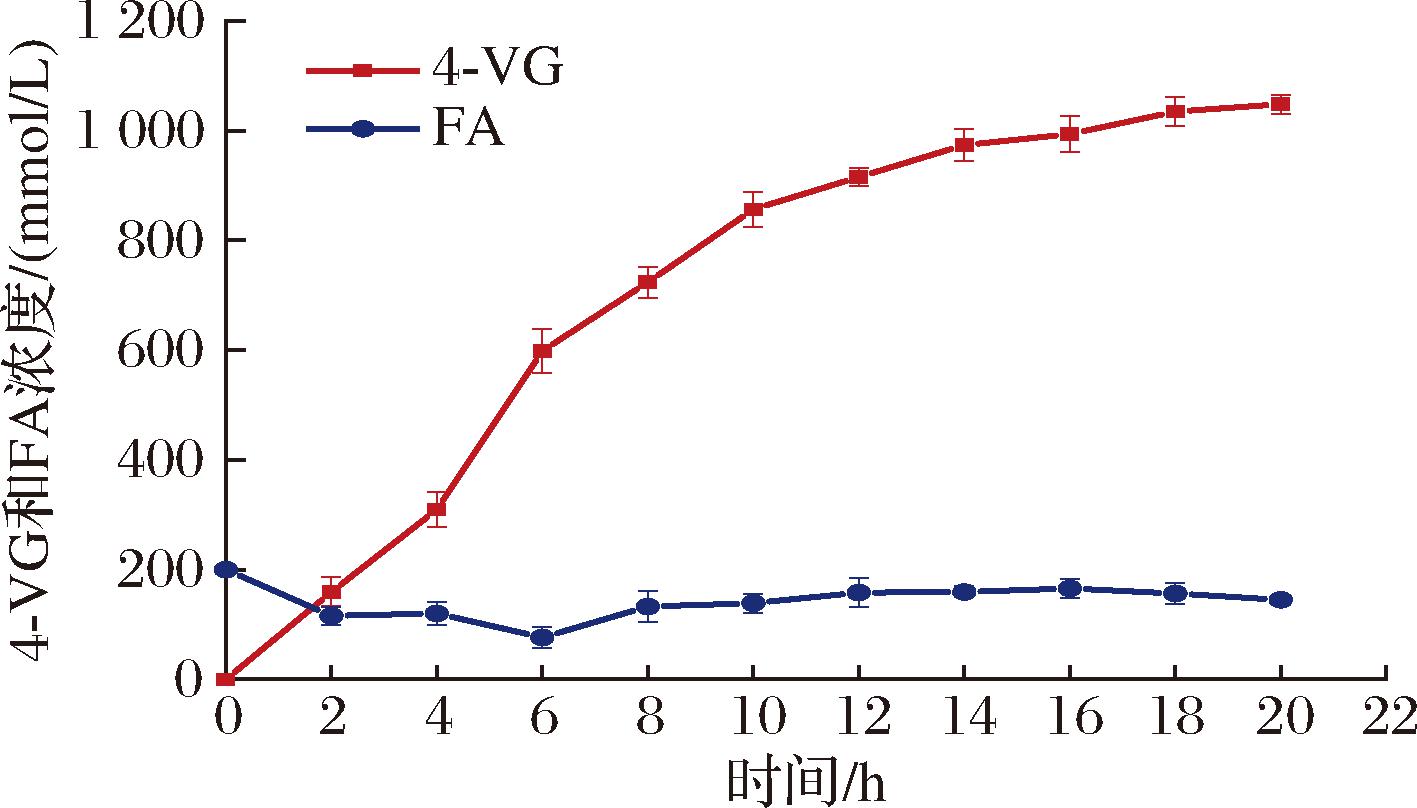
图8 在5 L生物反应器中,在甲苯/水两相系统中通过 SD-Bapad从FA生物生产4-VG
Fig.8 Bioproduction of 4-VG from FA by SD-Bapad in a toluene/water two-phase system in a 5 L bioreactor
3 结论
本实验将萎缩芽孢杆菌中的PAD表达在了酿酒酵母表面,从而构建了一种新型的全细胞催化剂SD-Bapad,可重复利用,减少纯化回收的操作和成本。同时将该基因在毕赤酵母中分泌表达,将2种酶的pH、温度耐受性、有机溶剂耐受性、底物、产物耐受性做了对比,发现SD-Bapad均拥有更加优秀且全面的性质,最终SD-Bapad在5 L发酵罐中以不断补料的方式在20 h内积累了约157.4 g的4-VG。酿酒酵母表面展示酚酸脱羧酶生产4-VG方便高效,有望成为生物法生产4-VG的新途径。
[1] LOMASCOLO A, ODINOT E, VILLENEUVE P, et al.Challenges and advances in biotechnological approaches for the synthesis of canolol and other vinylphenols from biobased p-hydroxycinnamic acids:A review[J].Biotechnology for Biofuels and Bioproducts, 2023, 16(1):173.
[2] TANG X Y, WU S S, HUA X, et al.Ferulic acid triggering a co-production of 4-vinyl guaiacol and fumaric acid from lignocellulose-based carbon source by Rhizopus oryzae[J].Food Chemistry, 2024, 461:140799.
[3] DETERING T, MUNDRY K, BERGER R G.Generation of 4-vinylguaiacol through a novel high-affinity ferulic acid decarboxylase to obtain smoke flavours without carcinogenic contaminants[J].PLoS One, 2020, 15(12):e0244290.
[4] 崔云前, 曹小红, 王春玲,等.发酵行业4-乙烯基愈创木酚和4-乙基愈创木酚研究进展[J].中国酿造, 2009(4):14-7.CUI Y Q, CAO X H, WANG C L, et al. Research progress of 4-Vinylguaiacol and 4-Ethylguaiacol in fermentation industry[J].China Brewing, 2009, 28(4):14-17.
[5] BEN-BASSAT A, BREINIG S, CRUM G A, et al.Preparation of 4-vinylphenol using pHCA decarboxylase in a two-solvent medium[J].Organic Process Research &Development, 2007, 11(2):278-285.
[6] BERNINI R, MINCIONE E, BARONTINI M, et al.Obtaining 4-vinylphenols by decarboxylation of natural 4-hydroxycinnamic acids under microwave irradiation[J].Tetrahedron, 2007, 63(39):9663-9667.
[7] KOTCHAPLAI P, NINRAT J, MAHIPANT G, et al.Involvement of cytochrome P450 in organic-solvent tolerant Bacillus subtilis GRSW1-B1 in vanillin production via ferulic acid metabolism[J].Fermentation, 2022, 8(10):508.
[8] MAEDA M, MOTOSOKO M, TOKASHIKI T, et al.Phenolic acid decarboxylase of Aspergillus luchuensis plays a crucial role in 4-vinylguaiacol production during awamori brewing[J].Journal of Bioscience and Bioengineering, 2020, 130(4):352-359.
[9] KITAOKA N, NOMURA T, OGITA S, et al.Bioproduction of 4-vinylphenol and 4-vinylguaiacol β-primeverosides using transformed bamboo cells expressing bacterial phenolic acid decarboxylase[J].Applied Biochemistry and Biotechnology, 2021, 193(7):2061-2075.
[10] DOS SANTOS M B C, SCARPASSA J A, MONTEIRO D A, et al.Evaluation of the tolerance and biotransformation of ferulic acid by Klebsiella pneumoniae TD 4.7[J].Brazilian Journal of Microbiology, 2021, 52(3):1181-1190.
[11] JUNG D H, CHOI W, CHOI K Y, et al.Bioconversion of p-coumaric acid to p-hydroxystyrene using phenolic acid decarboxylase from B.amyloliquefaciens in biphasic reaction system[J].Applied Microbiology and Biotechnology, 2013, 97(4):1501-1511.
[12] LICANDRO-SERAUT H, ROUSSEL C, PERPETUINI G, et al.Sensitivity to vinyl phenol derivatives produced by phenolic acid decarboxylase activity in Escherichia coli and several food-borne Gram-negative species[J].Applied Microbiology and Biotechnology, 2013, 97(17):7853-7864.
[13] YANG J Z, WANG S Z, LORRAIN M J, et al.Bioproduction of lauryl lactone and 4-vinyl guaiacol as value-added chemicals in two-phase biotransformation systems[J].Applied Microbiology and Biotechnology, 2009, 84(5):867-876.
[14] 胡宏飞.有机溶剂耐受性酚酸脱羧酶及其在生产4-乙烯基酚类物质上的应用 [D].南京:南京林业大学, 2015.HU H F.Organic solvent tolerant phenolic acid decarboxylase and its application in the production of 4-vinylphenols [D].Nanjing:Nanjing Forestry University, 2015.
[15] CHEN Y H, LI L L, LONG L K, et al.High cell-density cultivation of phenolic acid decarboxylase-expressing Escherichia coli and 4-vinylguaiacol bioproduction from ferulic acid by whole-cell catalysis[J].Journal of Chemical Technology &Biotechnology, 2018, 93(8):2415-2421.
[16] LI L L, LONG L K, DING S J.Direct affinity-immobilized phenolic acid decarboxylase by a linker peptide on zeolite for efficient bioconversion of ferulic acid into 4-vinylguaiacol[J].ACS Sustainable Chemistry &Engineering, 2020, 8(39):14732-14742.
[17] KONDO A, UEDA M.Yeast cell-surface display:Applications of molecular display[J].Applied Microbiology and Biotechnology, 2004, 64(1):28-40.
[18] YANG X Y, TANG H T, SONG M H, et al.Development of novel surface display platforms for anchoring heterologous proteins in Saccharomyces cerevisiae[J].Microbial Cell Factories, 2019, 18(1):85.
[19] HE Z H, YANG X S, TIAN X, et al.Yeast cell surface engineering of a nicotinamide riboside kinase for the production of β-nicotinamide mononucleotide via whole- cell catalysis[J].ACS Synthetic Biology, 2022, 11(10):3451-3459.
[20] LI Y B, WANG X, ZHOU N Y, et al.Yeast surface display technology:Mechanisms, applications, and perspectives.[J].Biotechnology Advances, 2024, 76:108422.
[21] XU L, XIAO X, WANG F, et al.Surface-displayed thermostable Candida rugosa lipase 1 for docosahexaenoic acid enrichment[J].Applied Biochemistry and Biotechnology, 2020, 190(1):218-231.
[22] DENG H L, GU Q Y, YU X B, et al.Surface-displayed phenolic acid decarboxylase for increased vinylphenolic pyranoanthocyanins in blueberry wine[J].Current Research in Food Science, 2024, 8:100730.
[23] BRADFORD M M.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding[J].Analytical Biochemistry, 1976, 72(1-2):248-254.
[24] YE M Q, YE Y Q, DU Z J, et al.Cell-surface engineering of yeasts for whole-cell biocatalysts[J].Bioprocess and Biosystems Engineering, 2021, 44(6):1003-1019.
[25] LI L L, LONG L K, DING S J.Bioproduction of high-concentration 4-vinylguaiacol using whole-cell catalysis harboring an organic solvent-tolerant phenolic acid decarboxylase from Bacillus atrophaeus[J].Frontiers in Microbiology 2019, 10:1798.
[26] ZHOU J L, HARINDINTWALI J D, YANG W H, et al.Engineering of a chitosanase fused to a carbohydrate-binding module for continuous production of desirable chitooligosaccharides[J].Carbohydrate Polymers, 2021, 273:118609.