核桃又名胡桃,是世界四大坚果之一,营养价值十分丰富。我国核桃种植历史十分悠久,分布广泛,其种植面积和产量位于世界之首,被广泛开发利用[1-2]。核桃仁含有丰富的脂肪和蛋白质,以及微量的维生素E、多酚等其他营养物质,其中不饱和脂肪酸占脂肪的90%以上[3]。因核桃油具有抗炎、抗肿瘤、抗氧化、免疫调节、神经保护等诸多功能,对核桃油的相关研究逐渐成为热点[4]。然而由于在加工运输过程中受到高温、强光等因素影响,容易产生含氧三酰基甘油、游离脂肪酸等物质,导致核桃油出现刺激性气味及变色的现象,影响核桃油品质,缩短货架期,造成一定的经济损失,同时摄入氧化产物对人体健康产生不良影响[5-6]。不仅如此,随着核桃油的生产越来越多,其副产物核桃粕越来越受到广泛关注,因其具有丰富的蛋白质,主要包括清蛋白、球蛋白、醇蛋白和谷蛋白,且消化率和净蛋白比值较高,对人体利用价值较高[7],所以越来越多研究者聚焦于核桃蛋白生产利用和功能特性。包括但不仅限于通过采取不同的技术以核桃粕(蛋白)为原料制备并分离纯化具有抗氧化[8]、降血脂[9]和改善学习和记忆功能障碍[10]等功能的核桃肽。
目前国内外主要采用添加合成抗氧化剂的方法延长油脂的贮存期,提高其经济价值,但由于其在使用过程中存在安全隐患,许多国家对其添加量都有所限制[11]。因此近年来,许多含有天然抗氧化剂的植物、植物提取物和植物副产物的抗氧化活性得到了广泛的研究,同时也有些学者聚焦于将多肽、多酚等物质添加到油脂中,研究其对油脂氧化稳定性的影响[12-13]。
本研究利用中性蛋白酶水解核桃粕蛋白制备抗氧化肽,将核桃粕多肽添加到核桃油中,使用Schaal烘箱法60 ℃加速氧化12 d,通过油脂理化性质以及风味物质,研究核桃粨抗氧化肽对油脂加速贮藏过程的影响,并通过过氧化值建立数学模型预测其货架期。以期为缓解核桃油氧化提供参考和借鉴。
1 材料与方法
1.1 材料与试剂
去皮核桃仁,三只松鼠股份有限公司。
主要试剂:胰蛋白酶(4 000 U/g)、中性蛋白酶(200 000 U/g)、碱性蛋白酶(200 000 U/g)、木瓜蛋白酶(100 000 U/g)、风味蛋白酶(30 000 U/g),食品级蛋白酶制剂,南宁东恒华道生物科技有限公司;2,2-联苯基-1-苦基肼基,上海麦克林生化科技股份有限公司;石油醚、乙醚、NaOH、HCl、甲醇、异丙醇、醋酸、异辛烷、三氯甲烷等,分析纯,上海国药;改良型Bradford蛋白浓度测定试剂盒,生工生物工程(上海)股份有限公司。
1.2 仪器与设备
HH-11-2水浴锅,常州诺基仪器有限公司;RE-52AA旋转蒸发仪,上海亚荣生化仪器厂;SHZ-D(III)循环水式多用真空泵,河南省予华仪器有限公司;Velocity 18R冷冻离心机,上海莱睿科学仪器有限公司;Labconco冷冻干燥机,美国LABCONCO公司;Millipore Amicon®超滤杯,默克化工技术(上海)有限公司;1510型酶标仪,赛默飞世尔科技(上海)仪器有限公司;MGF-92408电热恒温鼓风干燥箱,上海牧朗仪器制造有限公司;UV-5500PC紫外可见光分光光度计、V-5000可见光分光光度,上海元析仪器有限公司;G.A.S.FlavourSpec®气相离子迁移谱联用仪,海能未来技术集团股份有限公司。
1.3 实验方法
1.3.1 核桃抗氧化肽的制备与测定
1.3.1.1 核桃抗氧化肽的制备
参考张丽娜[14]的方法并做修改,在底物浓度20 g/L、加酶量3%(质量分数)和酶解时间2 h的条件下结合5种蛋白酶各自的最适温度和最适pH(木瓜蛋白酶55 ℃、pH 7.0;碱性蛋白酶40 ℃、pH 10.0;胰蛋白酶40 ℃、pH 8.0;中性蛋白酶40 ℃、pH 7.0;风味蛋白酶45 ℃、pH 7.5)进行水解,水解完成后100 ℃水浴15 min灭酶终止反应,8 000 r/min离心20 min,收集上清液过0.22 μm滤膜,通过DPPH自由基清除率和还原力测定酶解液的抗氧化活性筛选酶的种类。
将中性蛋白酶酶解后的上清液过0.22 μm滤膜后再进行超滤(30、5、3、1 kDa)处理并收集各种超滤膜过滤后的溶液,冻干后-20 ℃保存。
1.3.1.2 DPPH自由基清除率的测定
参考刘恩岐等[15]的方法,略作修改。在96孔酶标板中,加入1 mg/mL多肽溶液(或酶解液)和0.2 mg/mL的DPPH甲醇溶液各100 μL,应用Bio Tek酶标仪振荡30 s,常温避光放置20 min,于517 nm波长处测定其吸光度。DPPH自由基清除率的计算如公式(1)所示:
DPPH自由基清除率![]()
(1)
式中:A1为多肽溶液和DPPH甲醇溶液的吸光度;A0为多肽溶液和甲醇的空白吸光度;A2为DPPH甲醇溶液和去离子水的吸光度。
1.3.1.3 还原力的测定
参考LIN等[16]描述的方法略作修改。将冻干粉配制成1 mg/mL后取1 mL(或1 mL酶解液)和2 mL 0.2 mol/L PBS(pH 6.6)、2 mL 10 g/L铁氰化钾溶液混匀后在50 ℃水浴20 min。然后加入2 mL 100 g/L的三氯乙酸溶液,在2 000 r/min条件下离心10 min后取上清液2 mL,再加入2 mL去离子水、0.5 mL 1 g/L三氯化铁溶液混匀静置10 min,于700 nm测吸光度。以样品吸光度和阳性对照吸光度的比值来判断还原力的强弱。
上述抗氧化测定试验均以1 mg/mL还原型谷胱甘肽作为阳性对照,每个样品测定3次。
1.3.2 核桃油的制备与测定
1.3.2.1 核桃油的制备
将去皮核桃仁粉碎,然后采用冷溶剂萃取法,用石油醚以1∶5(g∶mL)的料液比在室温下静置12 h,抽滤后在45 ℃条件下使用旋转蒸发仪去除石油醚,获得油脂。将制备出的核桃油加入0.2 g/kg多肽粉混匀后,在60 ℃避光贮藏12 d,每3 d取一次样,并以不添加任何物质的核桃油为对照组,采用Schaal烘箱加速法于(60±2) ℃对核桃油进行加速贮藏实验。
1.3.2.2 油脂的过氧化值(peroxide value,POV)、酸价(acid value,AV)、茴香胺值(P-anisidine value,P-AV)、共轭二烯值(conjugated diene value,CDV)的测定过氧化值参照GB 5009.227—2023《食品安全国家标准 食品中过氧化值的测定》;酸价参照GB 5009.229—2016《食品安全国家标准 食品中酸价的测定》;茴香胺值参照GB/T 24304—2024《动植物油脂 茴香胺值的测定》;共轭二烯值参照GB/T 22500—2024《动植物油脂 紫外吸光度的测定》,每个样品测定3次。
1.3.2.3 GC-IMS测定条件
参考孟新涛等[17]的测定方法略作修改。样品处理及测定条件:取5 mL核桃油样品于10 mL顶空进样瓶中,用FlavourSpec®气相离子迁移谱联用仪进行测试,80 ℃孵育10 min后进样,进样针温度为85 ℃,孵化振动转速为500 r/min;进样量为2 mL,不分流模式进样。GC-IMS条件:色谱柱温度45 ℃;载气/飘移气为高纯氮气(≥99.999%),色谱运行时间25 min。载气程序设置:初始流速为2.00 mL/min,保持2 min后在8 min内连续增至15.00 mL/min,10~15 min内线性增至50.00 mL/min,接着在20 min内线性增至100.00 mL/min,截止25 min时流速增至150 mL/min。
1.4 数据处理与分析
每个样品设置3组平行实验进行测定,实验数据Microsoft Excel 2018、SPSS 26.0处理分析,通过Origin 2019作图。采用GC-IMS自带的LAV(laboratory analytical viewer)分析软件和插件(Reporter插件、Gallery Plot插件)对样品进行分析,以及采用GC-IMS Library Search软件内置的NIST和IMS数据库进行挥发性成分的定性分析。
2 结果与分析
2.1 核桃抗氧化肽的制备
已有研究表明抗氧化肽的制备工艺以及抗氧化肽分子质量与核桃多肽的理化性质有关[7]。因此首先选取了5种蛋白酶(木瓜蛋白酶、碱性蛋白酶、胰蛋白酶、中性蛋白酶、风味蛋白酶)对制备好的核桃蛋白粉进行酶解,在此基础上,采用4种不同分子质量大小的过滤膜进行抗氧化肽的优化筛选。由图1-a可以看出,5种蛋白酶其酶解液中性蛋白酶水解后得到的上清液DPPH自由基清除率最高,胰酶次之,还原力则相反,但两者差距不大,因此选择中性蛋白酶进行后续实验。将中性蛋白酶酶解后的上清液,分别通过不同孔径的超滤膜并测定其理化指标,由图1-b可知,在多肽质量浓度为1 mg/mL时,小于3 kDa的多肽DPPH自由基清除率(28.49%)、还原力(15.63%)均高于其他酶解液,但多肽得率略低于小于30 kDa和小于5 kDa。综合而言,最终选择中性蛋白酶酶解后,酶解液小于3 kDa的组分冻干进行后续试验。
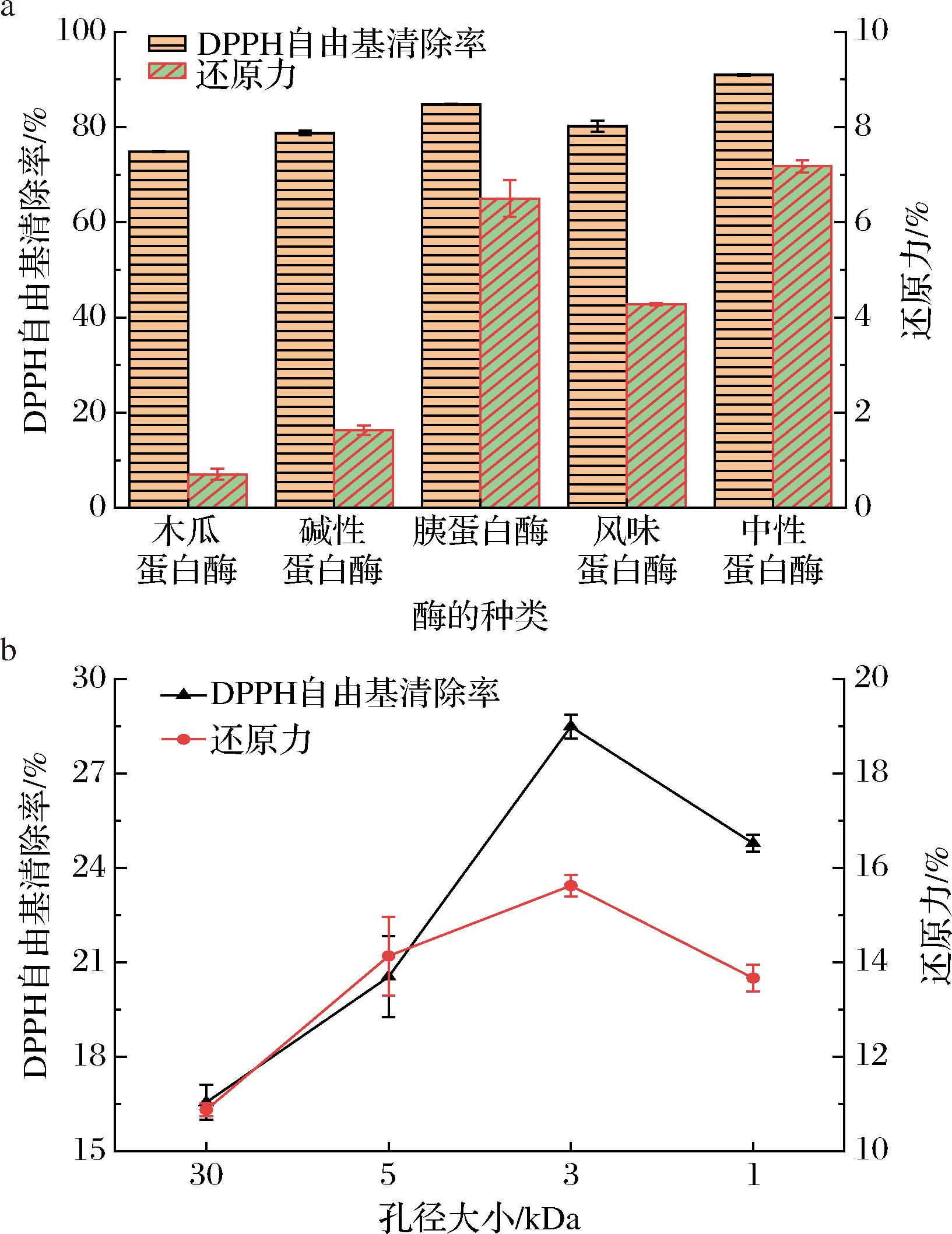
a-不同种类蛋白酶的酶解液抗氧化活性测定;b-不同孔径多肽的抗氧化活性测定
图1 抗氧化肽组分筛选
Fig.1 Screening of antioxidant peptide fractions
考虑到实际应用成本以及GB 2760—2024《食品安全国家标准 食品添加剂使用标准》,选择小于3 kDa、添加量为0.2 g/kg(多肽粉/核桃油)的多肽粉添加到核桃油中用于后续的实验研究。
2.2 核桃粕抗氧化肽对核桃油稳定性的影响
POV、AV、P-AV和CDV均是评价油脂品质的指标,其数值越高,代表油脂氧化程度越大、油脂品质越低。其中POV是表示油脂和脂肪酸等被氧化程度的一种指标,AV是衡量游离脂肪酸含量多少的标准,P-AV一般表示食品油脂中醛类物质的含量,CDV可以表示油脂中环状二聚物的含量。由图2-a和图2-c可以看出,POV和P-AV之间的相同之处在于初始阶段氧化作用在比较慢或者大致不变的速率下进行,随着时间的延长,油脂氧化加深,POV和P-AV越来越大,后期氧化速率是前期的数倍。AV和CDV的具有一样的变化趋势,前6 天出现波动,从第6天开始其氧化速率也在不断增加,但AV的变化没有CDV的明显。在贮藏相同时间内4个氧化指标均随着时间的延长而增加,但其数值样品组均低于对照组,尤其是在12 d时对照组的数值远高于样品组,其中对照组POV高达0.61 g/100 g,远超于GB 2716—2018《食品安全国家标准 植物油》规定的0.25 g/100 g,而样品组仅有0.15 g/100 g,由此可以看出添加抗氧化肽能够减少油脂过氧化物的产生并降低氧化反应速率。由于本实验的样品置于同一容器内,因此本研究的实验结果可能会被剩余样品与空气接触面积逐渐变大所影响[18]。
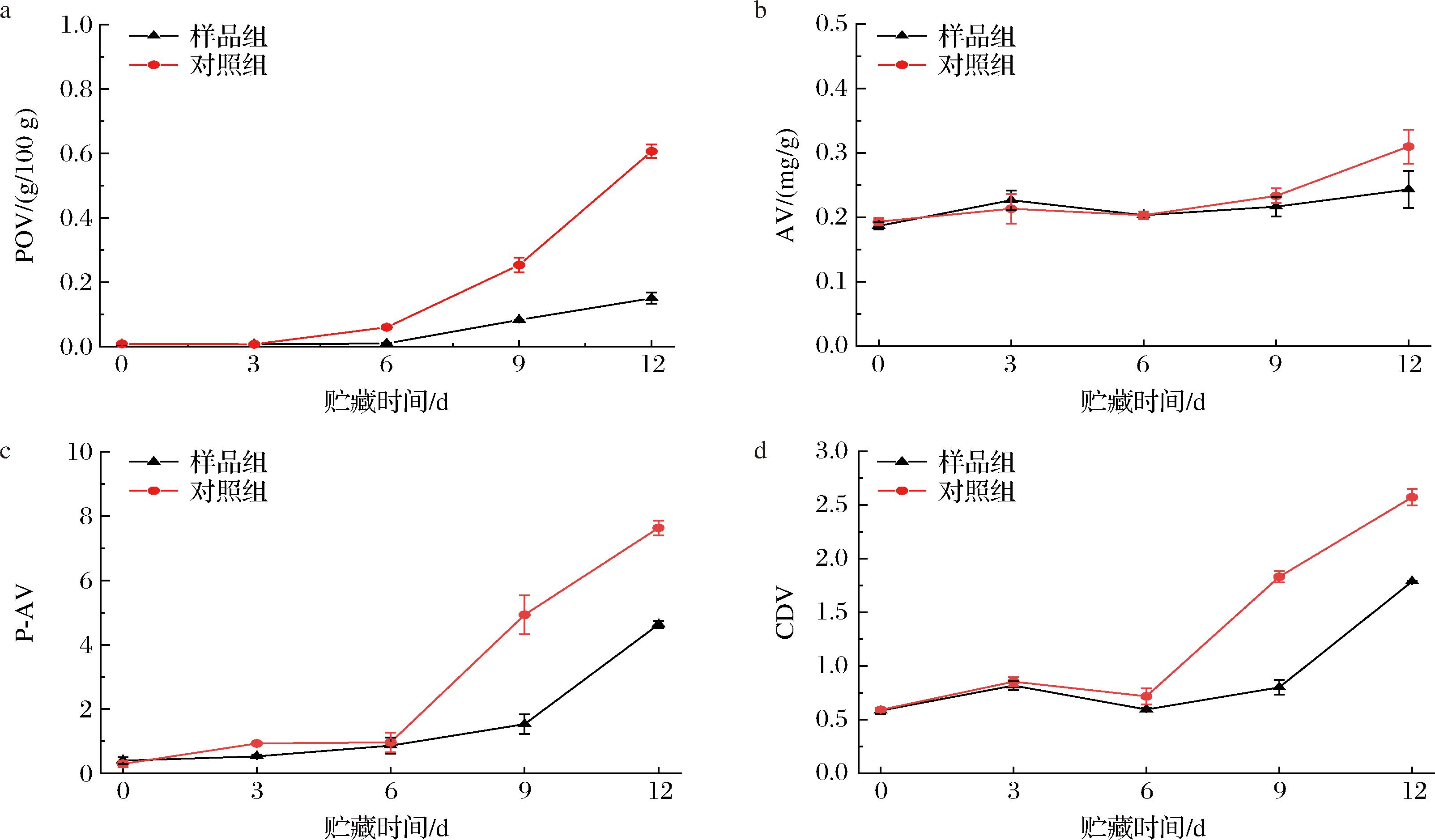
a-POV;b-AV;c-P-AV;d-CDV
图2 加速贮藏期间核桃油的氧化指标变化
Fig.2 Walnut oil oxidation index changes during accelerated storage
2.3 核桃粕抗氧化肽对核桃油挥发性成分的影响
2.3.1 核桃油挥发性成分定性分析
气相色谱-离子迁移谱(gas chromatography-ion migration spectrometry,GC-IMS)分析技术目前已广泛应用于食品安全、质量检测、风味分析等领域,其优势在于集合了GC高效分离检测痕量气体和IMS快速响应表征化学离子[19]。通过GC-IMS对核桃油进行挥发性成分检测,共识别出48种风味化合物,其中包含10种酯类、10种酮类、7种醛类、8种醇类、2种酸类、7种烯烃类、2种硫化物以及2种杂环类化合物,如附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.041898,下同)所示。
酯类物质可由脂质分解或酸类、醇类酯化反应或美拉德反应生成,多呈甜香味、果味、脂香味,是油脂中香气的主要来源[16]。本研究中由于抗氧化肽的添加,部分具有果香味的乙酸甲酯、乙酸乙酯、乙酸异丁酯在贮藏前期含量较高;在贮藏过程中由于脂肪酸氧化程度加深,导致酯类物质的含量逐渐增多,样品组的含量普遍低于对照组,尤其是在第12天时,两者的差异明显。从上述情况可以看出抗氧化肽的添加可以减慢某些酯类化合物的生成速率,影响油脂的风味。
酮类物质的风味阈值相较于醛类物质较高,主要来源于油脂氧化[20]。本研究中贮藏前期具有辛辣、刺激性气味的2-戊酮D含量最多,随着时间的延长到贮藏中后期其他具有宜人气味的物质(如6-甲基-5-庚烯-2-酮)渐渐占主体地位,并且由于抗氧化肽的添加使样品组具有刺激性气味的物质(如2,3-丁二酮)增加速度低于对照组。因此,抗氧化肽能够通过延缓油脂氧化抑制酮类物质的生成,进而改善油脂的风味,使其具有宜人气味。
醛类物质的挥发性较强,绝大多数来源于不饱和脂肪酸的降解,能够赋予油脂果香、清香、脂香等气味[21]。由附表1可知大部分醛类物质的含量随着贮藏时间的延长而出现波动,但总体是增加的,其中样品组具有果香味的2-甲基戊醛M,在第12天时其含量为对照组的2倍;具有刺激性气味的物质如2-甲基-2-戊烯醛、(E)-2-戊烯醛D,样品组的含量在贮藏后期均低于对照组。这说明抗氧化肽能够影响油脂中醛类物质的生成速率,不仅可以促进醛类物质中宜人气味的生成,还能抑制刺激性气味的产生。
醇类物质主要来源于脂肪氧化降解,部分酯类物质和水解为醇类化合物,具有酒香、果香、青草香、醇香等气味,并与其他挥发性成分产生辅助和增强作用[22]。由附表1可以看出,本研究中检测出的醇类物质含量与其他种类物质相比是最高的。带有果香、奶香的2,3-丁二醇在贮藏同一时间,样品组的含量普遍高于对照组;具有刺激性气味的异戊烯醇在加速贮藏过程中样品组和对照组均有所增加,但在相同时间内样品组含量低于对照组。因此,抗氧化肽的添加,能够对油脂中醇类物质的含量起到一定的调节作用。
酸类物质、杂环类物质以及硫化物,其种类在油脂的风味成分中占比较少,烯烃类物质种类较多,但大多数是令人不愉快的气味(如松香、脂香和刺激性气味等)。总体来说,这几类物质在同一时间内样品组的含量大多数低于对照组,且差异明显,尤其是在第12天时由于油脂氧化程度的增加,对照组中物质的含量急剧增加,如具有洋葱气味的二甲基三硫醚和具有脂香的β-月桂烯等。
2.3.2 核桃油GC-IMS指纹图谱分析和主成分分析
经GC-IMS测定后获得的核桃油挥发性成分指纹图谱如图3所示。主成分分析(principal component analysis,PCA)结果如图4所示。指纹图谱可以清晰地呈现出一个样品的完整挥发性有机物信息以及样品之间挥发性有机物的差异。图中每一列色块的明暗程度以及面积大小代表挥发性物质在每一个样品中的峰值强度的大小;每一行则代表一个样品中所选取的全部信号峰[23]。由图3可以看出,在贮藏过程中第0、3、6、9天样品组和对照组的成分变化趋势几乎一致,到第12天时样品组和对照组差异明显,这说明了抗氧化肽的添加对贮藏前期的油脂风味影响较小,贮藏时间越久,影响越深远。
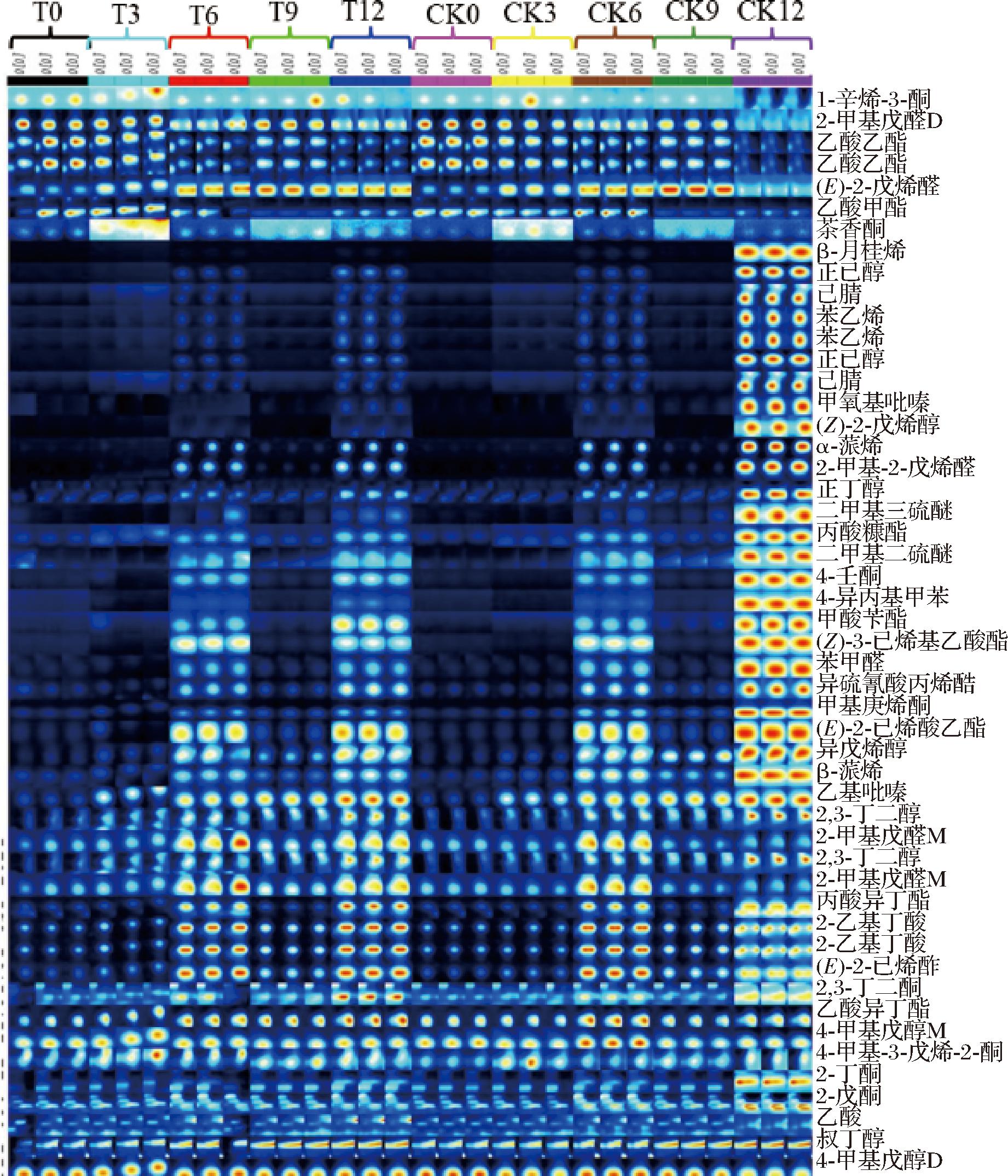
图3 加速贮藏过程中核桃油挥发性成分指纹图谱
Fig.3 Fingerprints of volatile components of walnut oil during accelerated storage
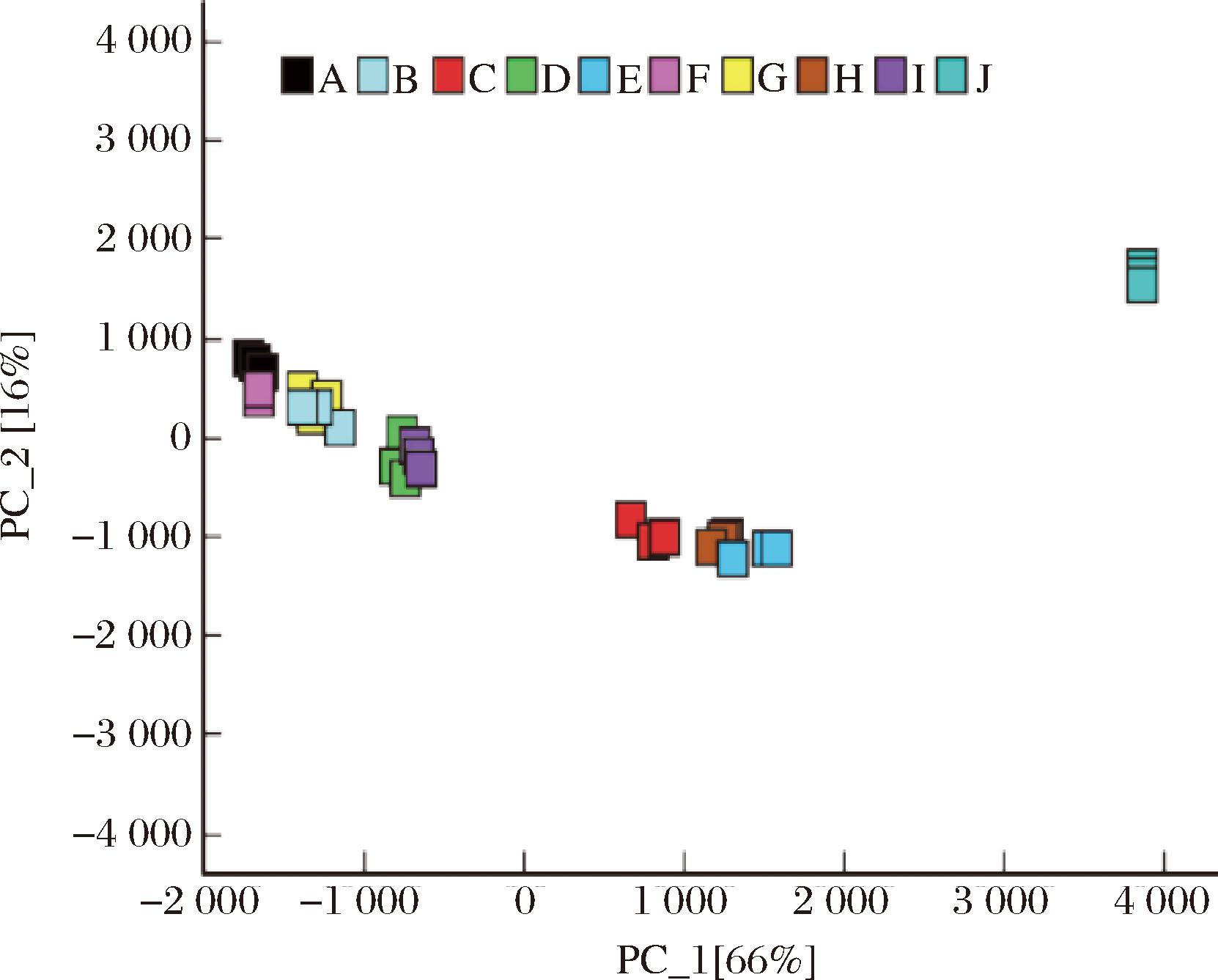
图4 加速贮藏过程中核桃油主成分分析图
Fig.4 Principal component analysis of the walnut oil during the accelerated storage process
注:T0:样品组第0天;T3:样品组第3天;T6:样品组第6天; T9:样品组第9天;T12:样品组第12天;CK0:对照组第0天; CK3:对照组第3天;CK6:对照组第6天;CK9:对照组第9天; CK12:对照组第12天(下同)。
PCA可以简化实验数据,并根据不同样本中主成分因子的贡献率来评估样本之间的规律性和差异[24]。由图4可知,A(T0)、B(T3)、F(CK0)和G(CK3)挥发性成分相近;C(T6)、E(T12)和H(CK6)挥发性成分相近;D(T9)与I(CK9)挥发性成分相近;J(CK12)与其他贮藏阶段的油脂均有明显差异。这与指纹图谱的结果具有一致性,表明抗氧化肽对核桃油初始风味影响较小,随着贮藏时间的延长,抗氧化肽能够延缓油脂氧化,进而影响风味物质的产生。通过指纹图谱结合PCA可以看出:PC1(主成分1)和PC2(主成分2)分别为66%和16%,累计差异贡献率为82%。
综上所述,通过GC-IMS测定结果分析核桃油中的风味物质,可以看出本实验中具有果香味的风味化合物种类最多,其次是带有刺激性气味的化合物,并且由于油脂的氧化程度加深,许多物质的含量随着时间的延长而增加,尤其是在第12天时,样品组各类物质的含量大部分远低于对照组。表明了抗氧化肽的添加对油脂的风味起到了一定的积极作用,对改善油脂风味有重要作用,进一步印证了抗氧化肽能够延缓油脂氧化,提升油脂品质。
2.4 货架期预测
对核桃油加速贮藏过程中测得的过氧化值进行拟合,结果如图5所示。样品组:Y=0.000 260 265X2.617 48,R2=0.972 62;对照组:Y=0.000 165 61X3.189 17,R2=0.998 35;R2均大于0.9,表明拟合相关性及拟合精度较好。根据GB 2716—2018《食品安全国家标准 植物油》过氧化值的最高标准[0.25 g/100 g(以脂肪计)],进行货架期预测,结果表明,在60 ℃下对照组和样品组的最长贮存时间分别为13.8 d和9.3 d,经验证,过氧化值的实测值与预测值在误差±10%范围以内,因此可通过过氧化值的变化预测60 ℃下核桃油的货架期。前期研究报道表明环境温度与贮藏周期存在一定的关联性,油脂在60 ℃贮藏1 d约等同于25 ℃的11.3 d[25]。因此基于上述拟合结果,计算得出样品组和对照组在25 ℃的环境温度中可以分别贮藏155.9 d和105.1 d,即样品组的货架期比对照组延长了50.8 d(48.3%)。由于在实际贮藏环境中,油脂氧化还受到的其他环境条件影响(如光照、氧气和湿度等),因此后续实验可以选用其他因素作为变量,探究不同因素或不同因素相互作用对抗氧化肽与油脂之间关系的影响。
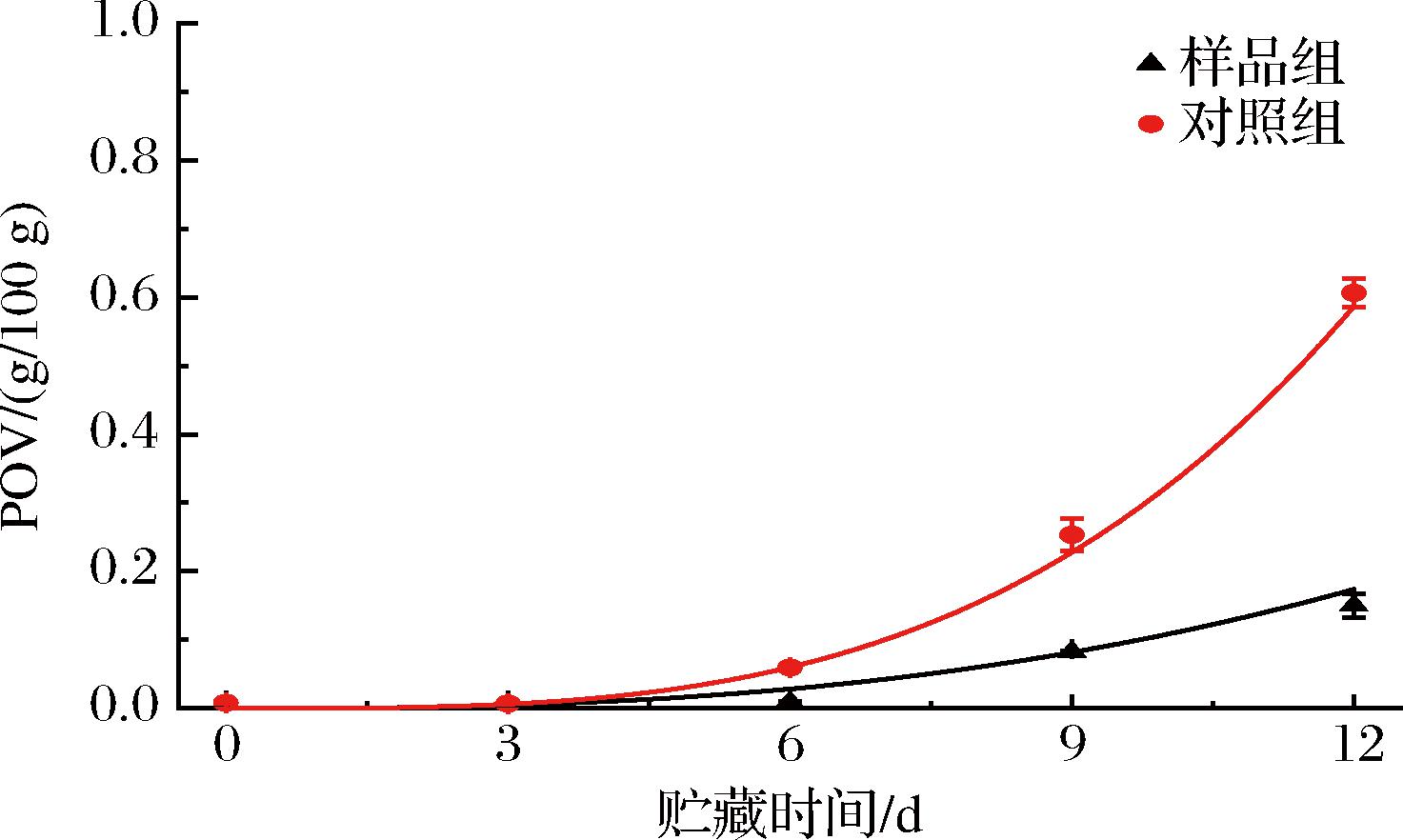
图5 核桃油货架期预测
Fig.5 Predicted shelf-life of walnut oil
3 结论与讨论
天然抗氧化剂作为一种绿色、健康、安全的食品添加剂之一,目前在油脂加工以及贮藏工艺中扮演着越来越重要的角色。本文通过优化5种蛋白酶和4种超滤膜制备不同分子质量的核桃蛋白酶解液,筛选出中性蛋白酶酶解后分子质量小于3 kDa酶解液抗氧化活性最强。随后对添加0.2 g/kg多肽粉的核桃油进行60 ℃加速贮藏,测定其在加速贮藏过程中POV、AV、P-AV和CDV的变化。结果表明样品组在加速贮藏的整个过程中4个氧化指标均低于对照组。此外,GC-IMS进一步揭示并分析了加速贮藏期间油脂挥发性成分的差异,共识别出48种风味化合物,且不同样品中挥发性成分的类型和相对含量差异明显,PC1和PC2的累计差异贡献率为82%。从总体上看,由于风味物质的形成依靠脂肪酸的氧化,样品组的含量普遍低于对照组,具有刺激性气味的挥发性物质(如异硫氰酸烯丙酯、己腈和二甲基三硫醚等)得到了有效抑制,尤其是在贮藏第12天。最后以过氧化值建立数学模型,预测油脂在25 ℃下的货架期可增加48.3%。
本研究通过测定核桃油在加速贮藏期间理化指标和风味成分的变化,均可以看出核桃抗氧化肽的添加,在不同程度上影响了醛、酮、酸、酯类等物质的动态变化过程,对延缓油脂氧化以及风味改善起到了积极作用。本研究结果为探究坚果类抗氧化肽对坚果油脂贮藏以及抗氧化策略,提供了理论依据和技术参考。
[1] 马雅鸽, 张希, 杨婧娟, 等. 核桃饼粕蛋白提取、多肽制备条件优化及其酶解液的抗氧化性研究[J]. 食品工业科技, 2020, 41(11):151-157.MA Y G, ZHANG X, YANG J J, et al. Study on protein extraction, polypeptide preparation and antioxidant activity of walnut pulp hydrolysate[J]. Science and Technology of Food Industry, 2020, 41(11):151-157.
[2] LIU D D, GUO Y T, MA H L. Production, bioactivities and bioavailability of bioactive peptides derived from walnut origin by-products: A review[J]. Critical Reviews in Food Science and Nutrition, 2023, 63(26):8032-8047.
[3] 刘梁, 张煜, 方晓璞, 等. 不同抗氧化剂对核桃油氧化稳定性和预测货架期的影响[J]. 中国油脂, 2023, 48(2):55-57; 97.LIU L, ZHANG Y, FANG X P, et al. Effects of different antioxidants on oxidative stability and predicted shelf life of walnut oil[J]. China Oils and Fats, 2023, 48(2):55-57; 97.
[4] SONG H Y, CONG Z F, WANG C L, et al. Research progress on Walnut oil: Bioactive compounds, health benefits, extraction methods, and medicinal uses[J]. Journal of Food Biochemistry, 2022, 46(12): e14504.
[5] LU C, NING D L, YU Y X, et al. Exploring the oxidative rancidity mechanism of walnut oil during storage based on lipidomics[J]. LWT, 2025, 215:117217.
[6] GURSUL S, KARABULUT I, DURMAZ G. Antioxidant efficacy of thymol and carvacrol in microencapsulated walnut oil triacylglycerols[J]. Food Chemistry, 2019, 278:805-810.
[7] 吕名蕊, 史宣明, 张骊, 等. 核桃多肽功能特性及制备工艺研究进展[J]. 中国油脂, 2013, 38(5):34-38.LYU M R, SHI X M, ZHANG L, et al. Progress on functional properties and preparation of walnut polypeptides[J]. China Oils and Fats, 2013, 38(5):34-38.
[8] MOGHADAM M, SALAMI M, MOHAMMADIAN M, et al. Physicochemical and bio-functional properties of walnut proteins as affected by trypsin-mediated hydrolysis[J]. Food Bioscience, 2020, 36:100611.
[9] YANG X Y, ZHONG D Y, WANG G L, et al. Effect of walnut meal peptides on hyperlipidemia and hepatic lipid metabolism in rats fed a high-fat diet[J]. Nutrients, 2021, 13(5): 1410.
[10] 刘丹丹. 核桃蛋白的抗氧化与降血压活性评价及酶解必要性研究[D]. 镇江: 江苏大学, 2020.LIU D D. Antioxidant and antihypertensive activities evaluation and the enzymatic hydrolysis necessity of walnut protein[D]. Zhenjiang: Jiangsu University, 2020.
[11] BAKKALBA
 E. Oxidative stability of enriched walnut oil with phenolic extracts from walnut press-cake under accelerated oxidation conditions and the effect of ultrasound treatment[J]. Journal of Food Measurement and Characterization, 2019, 13(1):43-50.
E. Oxidative stability of enriched walnut oil with phenolic extracts from walnut press-cake under accelerated oxidation conditions and the effect of ultrasound treatment[J]. Journal of Food Measurement and Characterization, 2019, 13(1):43-50.
[12] 杜伊晗, 王书语, 向燕, 等. 核桃内源性多酚的体外抗氧化能力及对核桃油氧化稳定性的影响[J]. 中国油脂, 2024, 49(5):88-94; 143.DU Y H, WANG S Y, XIANG Y, et al. In vitro antioxidant capacity of endogenous walnut polyphenols and their effects on the oxidation stability of walnut oil[J]. China Oils and Fats, 2024, 49(5):88-94; 143.
[13] JIE Y, ZHAO H F, ZHANG B L. The role of an acidic peptide in controlling the oxidation process of walnut oil[J]. Foods, 2019, 8(10):499.
[14] 张丽娜. 核桃蛋白水解物的抗氧化性及其二肽基肽酶Ⅳ抑制活性研究[D]. 无锡: 江南大学, 2020.ZHANG L N. Study on antioxidant activity and dipeptidyl peptidase-IV inhibitory activity of walnut protein hydrolysates[D]. Wuxi: Jiangnan University, 2020.
[15] 刘恩岐, 李华, 巫永华, 等. 黑豆肽的抗氧化活性与缓解体力疲劳作用[J]. 食品科学, 2013, 34(11):273-277.LIU E Q, LI H, WU Y H, et al. Antioxidant capacity and fatigue-relieving function of black soybean peptides[J]. Food Science, 2013, 34(11):273-277.
[16] LIN S Y, GUO Y, YOU Q, et al. Preparation of antioxidant peptide from egg white protein and improvement of its activities assisted by high-intensity pulsed electric field[J]. Journal of the Science of Food and Agriculture, 2012, 92(7):1554-1561.
[17] 孟新涛, 潘俨, 邹淑萍, 等. 不同储藏条件下鲜牛肉特征风味动态变化分析[J]. 食品工业科技, 2021, 42(15):289-298.MENG X T, PAN Y, ZOU S P, et al. Characterization of volatile component changes in fresh beef during storage under different storage conditions[J]. Science and Technology of Food Industry, 2021, 42(15):289-298.
[18] 周晔, 裴东. 核桃油品质及贮藏稳定性的影响因素探讨[J]. 中国油脂, 2016, 41(1):60-63.ZHOU Y, PEI D. Influence factors of quality and storage stability of walnut oil[J]. China Oils and Fats, 2016, 41(1):60-63.
[19] 任凌云, 任芳, 董斌, 等. 基于气相色谱-离子迁移谱法分析花生油中挥发性风味成分[J]. 食品安全质量检测学报, 2022, 13(18):5813-5820.REN L Y, REN F, DONG B, et al. Analysis of volatile flavor compounds in peanut oil based on gas chromatography-ion mobility spectrometry[J]. Journal of Food Safety &Quality, 2022, 13(18):5813-5820.
[20] DENG J K, ZHAO H B, QI B, et al. Volatile characterization of crude and refined walnut oils from aqueous enzymatic extraction by GC-IMS and GC-MS[J]. Arabian Journal of Chemistry, 2024, 17(1):105404.
[21] 邓淑君, 杨国燕, 刘佳杰, 等. 不同工艺制取油莎豆油的品质与风味分析[J]. 中国食品学报, 2024, 24(9):443-456.DENG S J, YANG G Y, LIU J J, et al. Quality and flavor analysis of Cyperus esculentus soybean oil prepared by different processes[J]. Journal of Chinese Institute of Food Science and Technology, 2024, 24(9):443-456.
[22] 杨永兴, 孟新涛, 许铭强, 等. 基于GC-IMS技术分析不同提取方式对辣椒籽油挥发性成分的影响[J]. 食品研究与开发, 2023, 44(6):184-192.YANG Y X, MENG X T, XU M Q, et al. Effects of different extraction methods on the volatile components of pepper seed oil by GC-IMS[J]. Food Research and Development, 2023, 44(6):184-192.
[23] SURI K, SINGH B, KAUR A. Impact of microwave roasting on physicochemical properties, Maillard reaction products, antioxidant activity and oxidative stability of Nigella seed (Nigella sativa L.) oil[J]. Food Chemistry, 2022, 368:130777.
[24] LIU B X, YANG Y, REN L K, et al. HS-GC-IMS and PCA to characterize the volatile flavor compounds in three sweet cherry cultivars and their wines in China[J]. Molecules, 2022, 27(24):9056.
[25] 王芳梅, 张鑫, 谷盼盼, 等. 新疆打瓜籽油氧化稳定性的研究及货架期预测[J]. 食品与发酵工业, 2019, 45(5):164-169.WANG F M, ZHANG X, GU P P, et al. Study on oxidative stability of Xinjiang seeding-watermelon seeds oil and its shelf-life prediction[J]. Food and Fermentation Industries, 2019, 45(5):164-169.