核桃营养丰富,目前以榨油为主,副产物核桃粕以饲料为主,利用率低[1]。核桃粕中蛋白质含量丰富,若能高效利用可大幅提升核桃粕的经济价值,推动核桃产业绿色可持续发展。核桃分离蛋白(walnut protein isolate,WalPI)氨基酸种类多,开发潜力大。但WalPI水溶性差、乳化能力弱等原因限制了其在食品工业中的应用,因此对WalPI改性具有重要意义。近年来,通过对WalPI改性以提升其作为食品乳化剂及药物递送系统的应用得到了广泛关注。YAN等[2]利用磷酸化后的WalPI制备Pickering乳液,该乳液在WalPI等电点时稳定性得到提升,相分离减少。ASADI等[3]采用电喷雾法制备WalPI纳米颗粒并封装姜黄素,结果表明,姜黄素在胃中的释放被限制,小肠吸收率增加,能有效改善姜黄素的生物利用度及抗氧化活性。
蛋白质具备灵活的可塑性,能根据所处环境和蛋白质间相互作用调整三维构象[4],发挥乳化、凝胶、起泡等功能并适应不同酸碱、冷热环境[5]。蛋白质改性是通过各种手段修饰蛋白质分子的侧链基团,改变空间结构,进而改变理化性质和功能特性[6]。蛋白质常见改性方法有酶法、超声波、基因工程、化学改性等。传统改性方法具有能耗高,操作繁琐,化学试剂残留等缺点,而低温等离子体(cold plasma,CP)处理作为一种新型的加工技术,因其强度温和,能有效避免处理过程温度过高而造成的材料变性[7],处理效率高,环境友好[8],近年来已被广泛应用在食品加工领域,在蛋白领域亦是如此。如JI等[9]发现CP中的电子、离子、自由基等高能粒子通过轰击花生蛋白表面,蚀刻蛋白质提供更多反应位点且使蛋白质结构展开,引入活性基团修饰蛋白质。QU等[10]以CP处理结合有机酸改性豌豆分离蛋白,提高了其溶解度和泡沫稳定性。于娇娇[11]用CP协同高速剪切处理糖基化花生蛋白,其水合特性及稳定Pickering乳液的能力得到了改善。因此可推测,CP处理可改善WalPI功能特性,以实现其高值化利用,具有一定的商业化应用前景。
海藻酸钠(sodium alginate,SA)是从褐藻细胞壁中分离出来的天然阴离子多糖[12]。SA因其高黏性在食品加工中常被用作增稠剂和凝胶剂[13]。许多研究将SA与蛋白质结合以改善其功能特性。SA的加入能够提高乳清分离蛋白在酸性环境的稳定性,减小乳清分离蛋白的沉淀概率[14];牛血清蛋白和SA通过氢键和静电作用形成更稳定的构象,提升了牛血清蛋白的热稳定性[15]。此外,SA可通过共价和非共价相互作用吸附在大菱鲆肌原纤维蛋白表面,增强体系的空间位阻,提高大菱鲆肌原纤维蛋白的稳定性[16]。因此,SA修饰蛋白质具有良好潜力,有望改善WalPI的功能特性,提升其稳定Pickering乳液的能力。
基于此,本研究采用CP处理和SA修饰对WalPI进行物理及化学双重改性,探究不同CP处理电压对WalPI-SA结构、表面疏水性、接枝度、褐变度及热稳定性的影响,明晰CP对WalPI-SA性质的影响,旨在为提高WalPI作为乳化剂及药物递送系统的应用提供技术支撑和科学依据。
1 材料与方法
1.1 材料与试剂
核桃,购自云南大理漾濞家华有限公司。
SA(AR,98%),上海麦克林生化科技有限公司;SDS-PAGE凝胶快速配制试剂盒,上海源叶生物科技有限公司;溴化钾(色谱纯),北京索莱宝科技有限公司;其他试剂均为分析纯。
1.2 仪器与设备
SuPerMax 3000FL型多功能酶标仪,上海闪谱生物科技有限公司;90Plus PALS粒度及Zeta电位分析仪,美国布鲁克海文仪器公司;FD5-3真空冷冻干燥机,金西盟(北京)仪器有限公司;UV-2700紫外可见分光光度计、IR Prestige-21傅里叶变红外光谱仪,日本岛津仪器有限公司;TESCAN MIRA场发射扫描电镜,捷克TESCAN;DYCZ-24DN型电泳仪,北京六一生物科技有限公司;DSC204型差示扫描量热仪,德国Netzsch公司;CTP-2000KP调制脉冲等离子电源、CP-150离子体实验反应器,南京苏曼等离子科技有限公司。
1.3 实验方法
1.3.1 WalPI-SA溶液的制备
参考LIU等[17]的方法制备WalPI,略作修改。脱脂核桃粉按1∶20(g∶mL)加入蒸馏水,用NaOH溶液(0.1 mol/L)调pH至11.0,室温磁力搅拌3 h(200 r/min),8 000 r/min离心10 min,取上清液。用HCl溶液(0.1 mol/L)调pH至4.5,8 000 r/min离心10 min,收集沉淀后与蒸馏水以1∶2(g∶mL)混合,调pH至中性,透析,真空冷冻干燥,得WalPI。
取5 g WalPI和2 g SA共溶于1 L(0.1 mol/L,pH=7.0)PBS,室温磁力搅拌3 h(200 r/min),4 ℃过夜水合,得WalPI-SA溶液。WalPI与SA比例的选择经过预实验得到,此比例下WalPI的综合性能优良。
1.3.2 CP处理WalPI-SA溶液
过夜水合WalPI-SA溶液搅拌30 min(200 r/min)后,取WalPI-SA溶液100 mL置于反应皿(120 mm×120 mm×20 mm)进行CP处理。控制液面与上极板间距(6±2) mm,处理时间60 s,电流(1.0±0.2) A,同时进行磁力搅拌(200 r/min),分析CP处理电压0、60、70、80、90、100 V对WalPI-SA的影响,处理结束后样品进行真空冷冻干燥,收集样品密封保存。对应样品分别命名为WalPI-SA、WalPI-SA-60、WalPI-SA-70、WalPI-SA-80、WalPI-SA-90、WalPI-SA-100。
1.3.3 SDS-PAGE测定
参照CHEN等[18]的方法进行测定。分别制备体积分数为12%的浓缩胶和5%的分离胶,样品用PBS(0.1 mol/L,pH=7)稀释至5 mg/mL,取10 μL样品溶液与40 μL上样缓冲液混匀上样,电泳时初始电压为80 V,待上样缓冲液中的溴酚蓝指示剂到达分离胶时,将电压调为120 V。当上样缓冲液中溴酚蓝指示剂跑至分离胶底部时,结束电泳,用考马斯亮蓝染色液进行染色,再用脱色液进行脱色处理。
1.3.4 傅立叶变换红外光谱(Flourier transform infrared spectroscopy,FTIR)测定
称取2 mg样品和200 mg溴化钾置于研钵中充分研磨后压片,参数设置:分辨率4 cm-1,扫描32次,扫描波数4 000~400 cm-1。
1.3.5 紫外吸收光谱测定
用PBS(0.1 mol/L,pH=7)配制质量浓度为0.2 mg/mL的样品溶液,紫外可见分光光度计扫描波长200~400 nm。
1.3.6 荧光光谱测定
参照黄子林[19]的方法,略作修改。将样品溶于PBS(0.1 mol/L,pH=7)中,配制质量浓度为0.2 mg/mL 的样品溶液。用酶标仪进行荧光光谱扫描,参数设置:狭缝宽5 nm,激发波长290 nm,发射波长300~450 nm。
1.3.7 扫描电子显微镜(scanning electron microscope,SEM)观察
将样品均匀分散在导电胶上,进行表面喷金处理,用SEM在5 000倍下观察样品表面形貌,参数设置:加速电压10 keV,工作距离(8.5±0.5) mm。
1.3.8 粒径、Zeta电位测定
参照HUANG等[20]的方法进行测定。将样品用PBS(0.1 mol/L,pH 7)稀释成质量浓度0.5 mg/mL的溶液,超声处理5 min,参数设置:介质折射率1.33,平衡时间3 min。
1.3.9 热稳定性测定
取约3 mg样品置于铝坩埚中,用空铝坩埚作为空白对照,参数设置:升温速率10 ℃/min,温度为30~180 ℃,吹扫气流速20 mL/min。
1.3.10 接枝度、褐变度测定
参照ERTUGRUL等[21]的邻苯二甲醛法测定WalPI-SA接枝度。用体积分数为95%乙醇配制40 g/L的邻苯二甲醛溶液,与50 mL无水四硼酸钠溶液、100 μL b-巯基乙醇、5 mL质量浓度为200 g/L的SDS溶液混合,定容至100 mL,样品用PBS(0.1 mol/L,pH=7)配制成质量浓度为5 mg/mL的溶液。取上述配好的试剂3 mL与样品溶液1 mL混匀,避光反应2 min后在波长340 nm处测定吸光度,相同条件下用赖氨酸溶液作标准曲线。接枝度按公式(1)计算:
接枝度![]()
(1)
式中:C0和Ct分别代表体系中反应前和反应后体系中游离氨基的含量,mol/L。
参照PIRESTANI等[22]的方法测定WalPI-SA褐变度,样品用PBS(0.1 mol/L,pH=7)稀释成1 mg/mL,波长420 nm处的吸光度表示褐变度。
1.3.11 表面疏水性测定
参照吕思伊[23]的荧光探针法,略作修改。将样品用PBS(0.1 mol/L,pH=7)分别稀释成梯度为0.2、0.4、0.6、0.8、1.0 mg/mL的溶液,并用PBS(0.1 mol/L,pH=7)将8-苯胺-1-萘磺酸(8-anilino-1-naphtalene sulfonic acid,ANS)稀释成8.0 mmol/L。取10 μL ANS溶液与2 mL样品溶液混匀,避光反应30 min后,用酶标仪进行测试,其中激发波长380 nm,发射波长460 nm,狭缝宽5 nm。将样品浓度作为横坐标,荧光强度作为纵坐标绘图,曲线初始斜率即为表面疏水性。
1.4 数据处理
实验进行3次重复,利用SPSS 26对数据进行显著性差异分析,用Origin 2022进行绘图。
2 结果与分析
2.1 SDS-PAGE分析
SDS-PAGE是表征蛋白质亚基变化情况的有效手段。由图1可见,WalPI主要包含谷蛋白、球蛋白、清蛋白、醇溶蛋白,分子质量集中在12~67 kDa[24]。WalPI-SA相比WalPI条带位置没有发生明显改变,且在凝胶泳道顶端没有新条带的出现,表明SA的加入不会生成大分子质量物质。经CP处理的WalPI-SA条带颜色略微变浅,原因是WalPI的亚基参与了WalPI与SA的结合,显色基团数量减少[25]。CP处理WalPI-SA过程中产生的活性氧等氧化型基团使蛋白质亚基分解,也会导致条带颜色减弱。
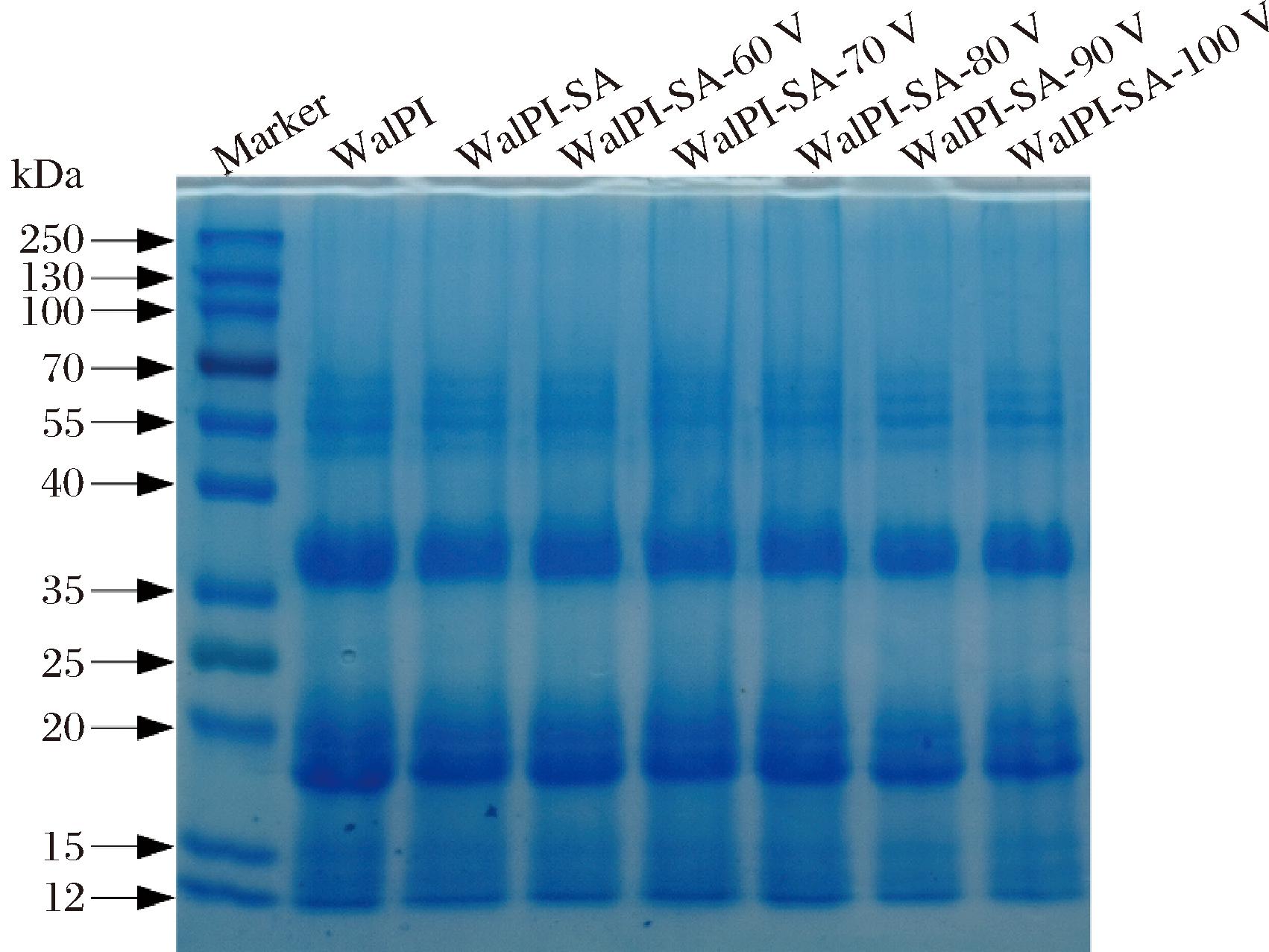
图1 不同CP处理电压对WalPI-SA SDS-PAGE的影响
Fig.1 Effect of different CP treatment voltages on WalPI-SA SDS-PAGE
2.2 FTIR分析
FTIR常被用于分析物质的化学结构及基团。图2中酰胺Ⅰ带(1 700~1 600 cm-1)、酰胺Ⅱ带(1 600~1 500 cm-1)、酰胺A带(3 500~3 100 cm-1)、酰胺B带(3 000~2 800 cm-1)是分析蛋白质结构重要的谱带[26]。WalPI在酰胺Ⅰ带的特征吸收峰由C![]() O键伸缩振动引起。WalPI-SA峰强减弱,原因为SA的加入增强了WalPI-SA的空间位阻,导致C
O键伸缩振动引起。WalPI-SA峰强减弱,原因为SA的加入增强了WalPI-SA的空间位阻,导致C![]() O键的振动能级跃迁几率减弱[27]。经CP处理的WalPI-SA特征峰蓝移,归因于CP处理改变了WalPI-SA的构象,迫使C
O键的振动能级跃迁几率减弱[27]。经CP处理的WalPI-SA特征峰蓝移,归因于CP处理改变了WalPI-SA的构象,迫使C![]() O键的振动频率增大,红外吸收峰向高波数方向偏移[28]。WalPI和WalPI-SA在酰胺Ⅱ带的特征吸收峰由N—H键伸缩振动引起,与WalPI相比,经CP处理的WalPI-SA吸收峰强度增加,是因为CP处理使复合物结构展开,N—H键振动能级跃迁几率增强,吸收峰强度增大。酰胺A带的特征吸收峰由O—H键伸缩振动引起,与WalPI相比,经CP处理的WalPI-SA特征吸收峰红移且峰形变宽,原因是CP处理促进WalPI与SA间氢键的形成[29],WalPI-SA分子的伸缩振动频率降低,峰位向低波数方向移动。酰胺B带的特征吸收峰由—CH3/—CH2伸缩振动引起,相比于WalPI,WalPI-SA在此谱带吸收强度增强,可能的原因是CP处理使—CH3/—CH2所处环境的极性增强,—CH3/—CH2的偶极矩变化增大,使红外吸收强度增加。
O键的振动频率增大,红外吸收峰向高波数方向偏移[28]。WalPI和WalPI-SA在酰胺Ⅱ带的特征吸收峰由N—H键伸缩振动引起,与WalPI相比,经CP处理的WalPI-SA吸收峰强度增加,是因为CP处理使复合物结构展开,N—H键振动能级跃迁几率增强,吸收峰强度增大。酰胺A带的特征吸收峰由O—H键伸缩振动引起,与WalPI相比,经CP处理的WalPI-SA特征吸收峰红移且峰形变宽,原因是CP处理促进WalPI与SA间氢键的形成[29],WalPI-SA分子的伸缩振动频率降低,峰位向低波数方向移动。酰胺B带的特征吸收峰由—CH3/—CH2伸缩振动引起,相比于WalPI,WalPI-SA在此谱带吸收强度增强,可能的原因是CP处理使—CH3/—CH2所处环境的极性增强,—CH3/—CH2的偶极矩变化增大,使红外吸收强度增加。
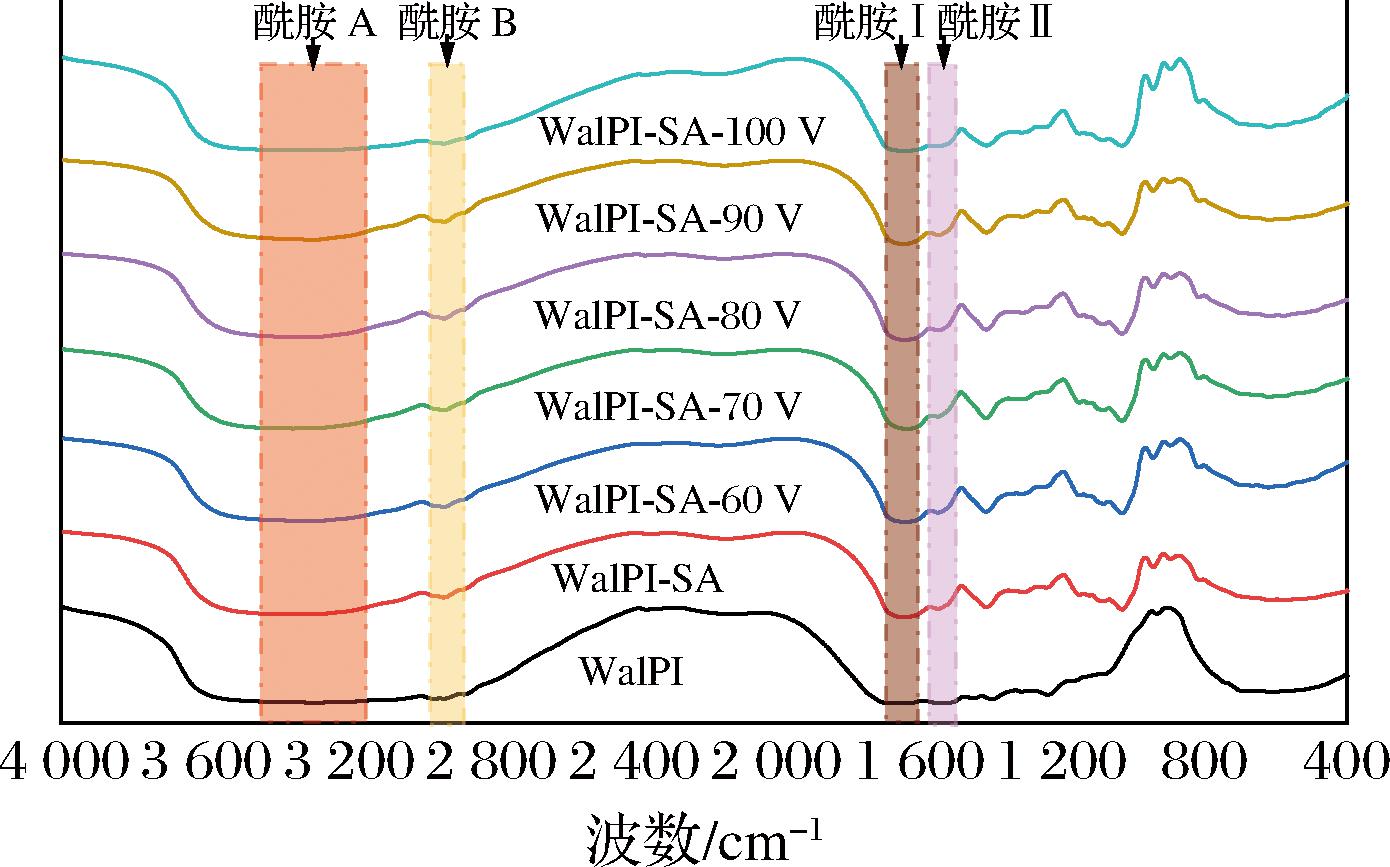
图2 不同CP处理电压对WalPI-SA FTIR的影响
Fig.2 Effect of different CP treatment voltages on WalPI-SA FTIR
2.3 紫外吸收光谱分析
蛋白质三级结构构象的改变可用紫外吸收光谱的变化表征。由图3可见,WalPI及不同CP处理电压WalPI-SA的紫外特征吸收峰集中在280~300 nm,由WalPI的色氨酸和酪氨酸引起[30]。与WalPI相比,WalPI-SA紫外吸收强度减弱。原因为SA的引入改变了WalPI的空间结构,减少了色氨酸和酪氨酸的暴露。杜晓倩[31]研究大豆分离蛋白-葡聚糖聚合物的紫外可见吸收光谱时也发现了类似现象。WalPI-SA紫外吸收强度随着CP处理电压的增加呈先增大后减小的趋势,其中WalPI-SA-80V紫外吸收强度达到最大,原因是CP处理有助于WalPI三级结构的展开,分子构象发生变化,色氨酸、酪氨酸暴露。与此同时,CP处理也会使紫外吸收峰红移(由288 nm移至295 nm),原因是CP处理将氨基酸残基暴露在WalPI表面,体系的极性增加。但CP处理电压超过80 V时WalPI多肽主链中肽键断裂和氨基酸侧链修饰[32],导致分子间交联聚集,造成色氨酸和酪氨酸被掩埋。
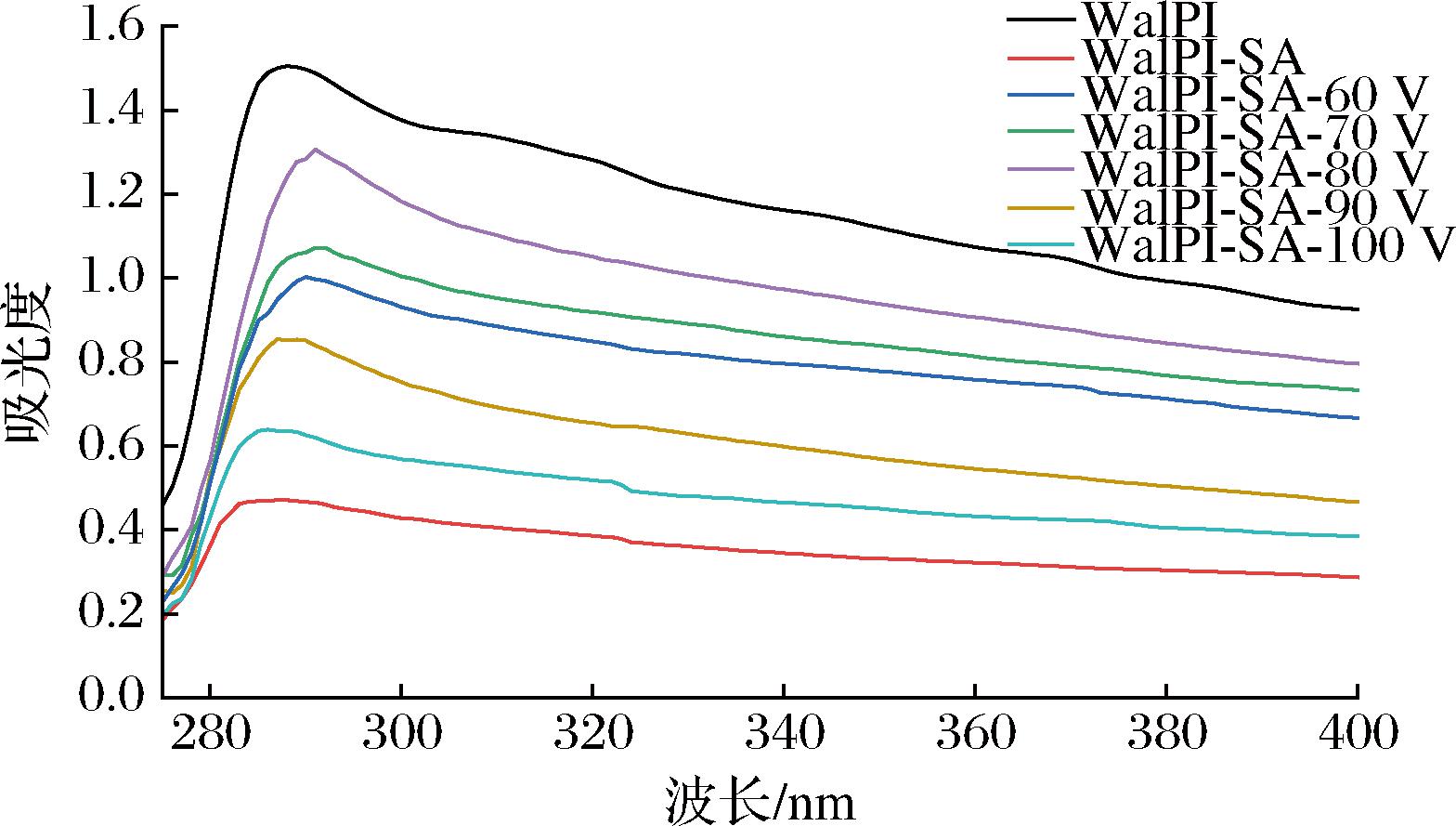
图3 不同CP处理电压对WalPI-SA紫外吸收光谱的影响
Fig.3 Effect of different CP treatment voltages on WalPI-SA UV absorption spectra
2.4 荧光光谱分析
蛋白质的内源荧光主要由酪氨酸、色氨酸和苯丙氨酸等芳香族氨基酸产生,这些氨基酸的荧光产生对蛋白质分子结构及环境极性敏感,可反映蛋白质三级结构的变化。由图4可见,WalPI及WalPI-SA在340 nm 左右出现荧光峰。与WalPI对比,WalPI-SA发生荧光猝灭,归因于SA与WalPI相互作用形成复合物,芳香族氨基酸被掩埋于内部,荧光强度降低。刘郁琪等[33]在大豆多糖与酪蛋白的酶促糖基化对酪蛋白性能影响研究中得到类似结论。经CP处理的WalPI-SA荧光强度随着处理电压的增加呈先上升后下降的趋势,原因是CP处理过程中荧光基团与水分子间形成氢键[34],荧光基团所处环境极性增强,荧光强度增加。同时,伴随着荧光吸收峰略微红移,原因是CP处理会电离气相中的水蒸气产生![]() 等酸性基团,酸性基团的增加使体系的pH降低,改变了WalPI-SA分子间疏水相互作用和其他作用力,分子构象发生改变[32]。但CP处理电压超过80 V时会导致荧光基团所处环境温度上升,降低荧光量子率,造成荧光强度下降[35]。
等酸性基团,酸性基团的增加使体系的pH降低,改变了WalPI-SA分子间疏水相互作用和其他作用力,分子构象发生改变[32]。但CP处理电压超过80 V时会导致荧光基团所处环境温度上升,降低荧光量子率,造成荧光强度下降[35]。
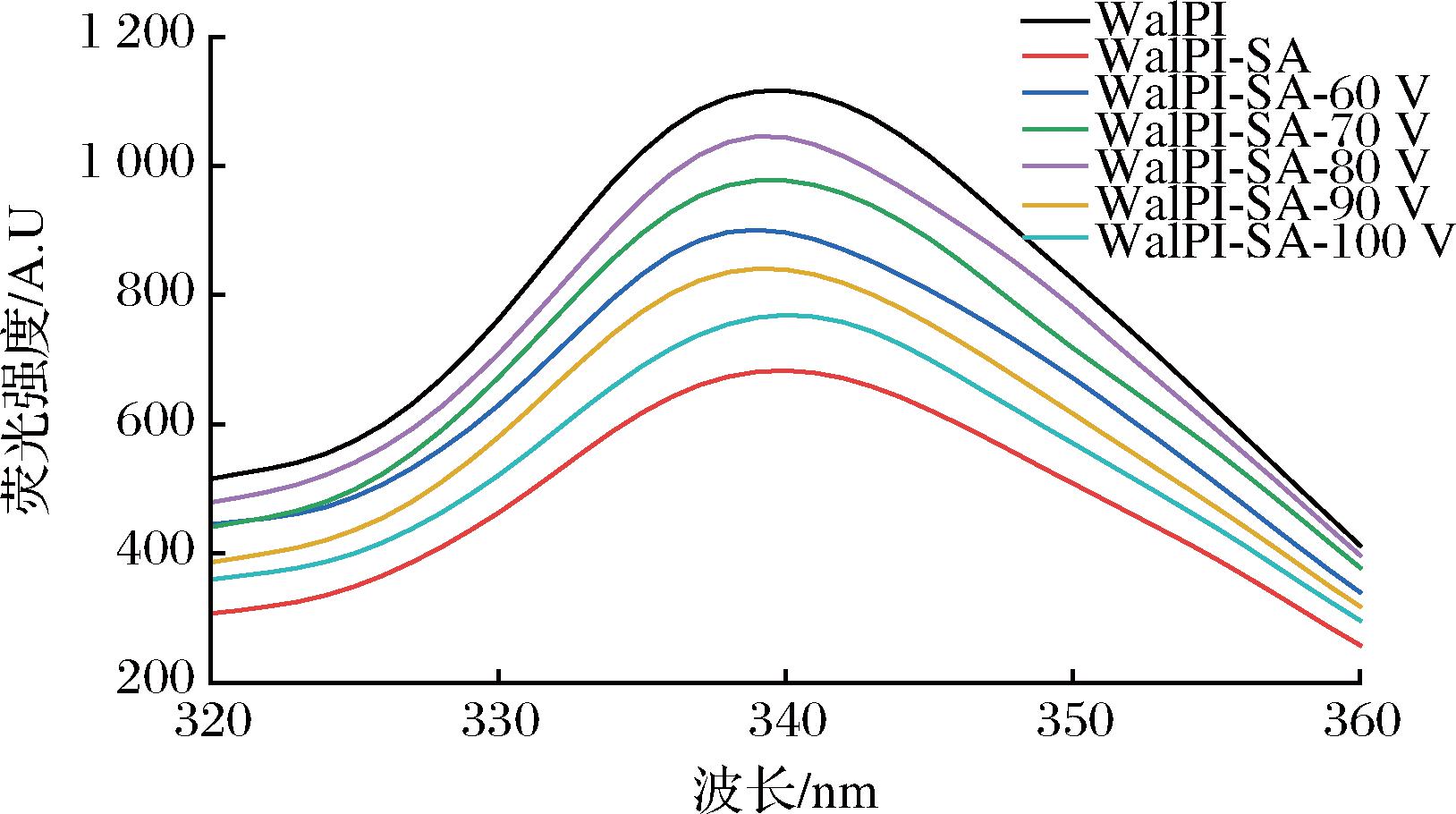
图4 不同CP处理电压对WalPI-SA荧光光谱的影响
Fig.4 Effect of different CP treatment voltages on WalPI-SA fluorescence spectra
2.5 SEM观察
SEM常用于分析物质表面微观结构,图5为不同CP处理电压对WalPI-SA的表面微观结构的影响。由图5可见,WalPI表面光滑,颗粒紧密堆积;与WalPI相比,SA与WalPI相互作用并黏附在表面,增加了WalPI-SA表面粗糙度。DURSUN等[36]研究蛋白质类型、反应时间及温度对蛋白质-多糖结合的影响时也观察到类似现象。CP处理后,WalPI-SA表面出现孔洞,孔隙增大,原因是CP处理过程中产生的粒子轰击WalPI-SA表面,对表面进行修饰,造成表面疏松多孔[37],提供更多反应位点,吸附性能增加;同时,CP处理使WalPI-SA结构松散,表面积增加。但当CP处理电压超过80 V时,WalPI-SA的表面形貌发生聚集,原因是CP处理对WalPI-SA修饰过度,维持体系空间结构的范德华力、氢键及静电相互作用遭到破坏,WalPI-SA的表面微观结构发生变化。

a-WalPI;b-WalPI-SA;c-WalPI-SA 60 V;d-WalPI-SA 70 V;e-WalPI-SA 80 V;f-WalPI-SA 90 V;g-WalPI-SA 100 V
图5 不同CP处理电压对WalPI-SA表面微观结构的影响
Fig.5 Effect of different CP treatment voltage on the WalPI-SA surface microstructure
2.6 粒径、多分散系数及Zeta电位
粒径分布常用于分析蛋白质的聚集情况。多分散系数是溶液中颗粒分散性的指标,多分散系数小于0.4时可认为颗粒的分散性良好[38]。Zeta电位用于表征体系中颗粒的稳定性,Zeta电位绝对值越大,则体系越稳定。由图6-A可见,WalPI及不同CP处理电压的WalPI-SA粒径分布均呈单峰分布。由表1可见,SA的加入使WalPI的粒径从905.63 nm显著减小(P<0.05)至857.74 nm。原因是SA的加入使体系空间位阻增大,有效防止了WalPI-SA颗粒间聚集,颗粒间的分散性增加,多分散系数降低。随着CP处理电压的增加,WalPI-SA 粒径发生显著变化(P<0.05)呈先减小后增大的趋势,WalPI-SA-80粒径达到最小值524.09 nm,相比WalPI-SA显著降低38.9%(P<0.05),且Zeta电位绝对值较高,说明颗粒分散性良好,趋于稳定状态。原因是CP处理使WalPI-SA表面带电氨基酸数量增多,表面电荷增加,产生的静电斥力抑制了颗粒间的聚集[19];当CP处理电压超过80 V时,WalPI-SA聚集形成大颗粒。由图6-B可见,SA的加入WalPI的电位绝对值有所增大,是因为SA加入后WalPI表面带电基团被覆盖,与周围水相的静电相互作用减弱[39],电位绝对值增大。CP处理WalPI-SA电位的变化趋势与粒径相同,WalPI-SA-80的Zeta电位绝对值达到最大30.86 mV,说明CP处理可增加WalPI-SA表面电荷,使电位绝对值增加,体系的稳定性增强。
表1 不同CP处理电压对WalPI-SA的平均粒径、 多分散系数及Zeta电位的影响
Table 1 Effect of different CP treatment voltages on WalPI-SA mean particle size, polydispersity coefficient and Zeta potential
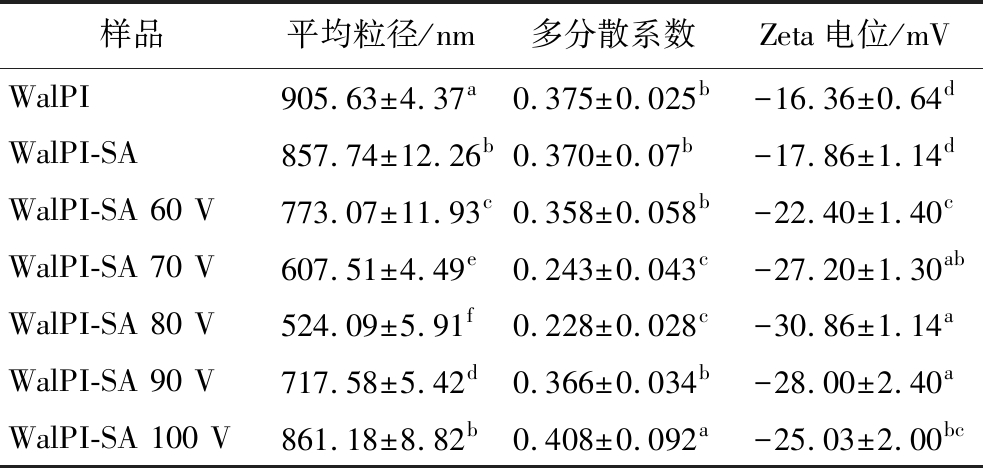
注:同一列中不同小写字母表示差异显著(P<0.05),有相同字母表示无显著性差异(P>0.05)。
样品平均粒径/nm多分散系数Zeta电位/mVWalPI905.63±4.37a0.375±0.025b-16.36±0.64dWalPI-SA857.74±12.26b0.370±0.07b-17.86±1.14dWalPI-SA 60 V773.07±11.93c0.358±0.058b-22.40±1.40cWalPI-SA 70 V607.51±4.49e0.243±0.043c-27.20±1.30abWalPI-SA 80 V524.09±5.91f0.228±0.028c-30.86±1.14aWalPI-SA 90 V717.58±5.42d0.366±0.034b-28.00±2.40aWalPI-SA 100 V861.18±8.82b0.408±0.092a-25.03±2.00bc
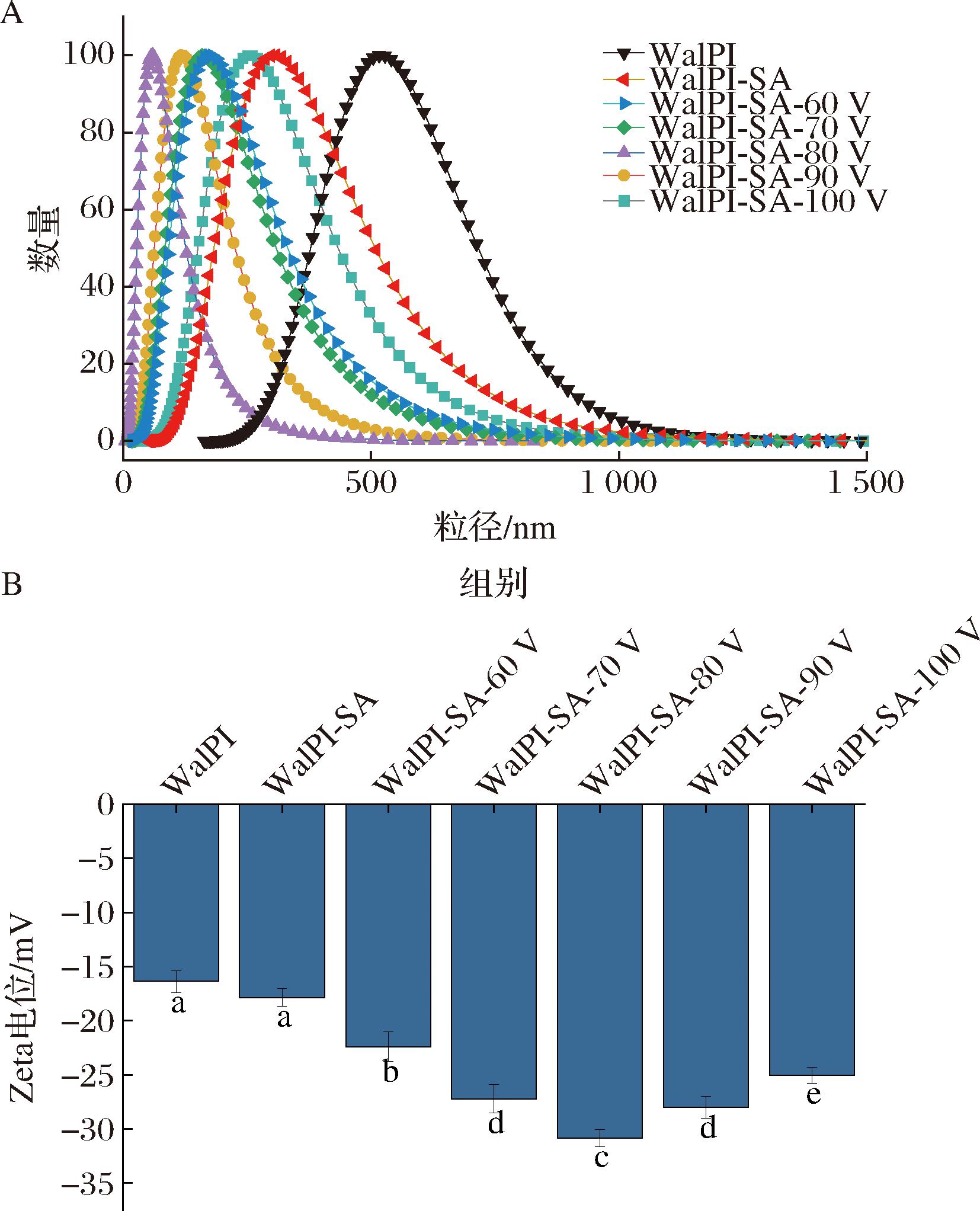
A-粒径分布;B-Zeta电位
图6 不同CP处理电压对WalPI-SA的粒径分布和Zeta电位的影响
Fig.6 Effect of different CP treatment voltages on WalPI-SA particle size distribution and Zeta potential
注:不同字母表示差异显著(P<0.05),有相同字母表示无显著性差异(P>0.05)(下同)。
2.7 热稳定性分析
差示扫描量热曲线可用于反映蛋白质的热稳定性,熔融温度(Tm)和焓变(ΔH)分别代表蛋白质由天然状态解旋为无规则状态时的温度和所需的能量。Tm值和ΔH值越大,代表蛋白质热稳定性越好。维持蛋白质结构的作用力主要有氢键、静电相互作用、范德华力,Tm和ΔH的改变可反映蛋白质空间结构的变化。由图7可见,WalPI及不同CP处理电压WalPI-SA的DSC曲线均出现了典型的热变性峰,相应峰值对应的温度及峰面积分别代表Tm和ΔH。WalPI的Tm和ΔH值分别为61.12 ℃和64.88 J/g, SA的加入使WalPI-SA Tm和ΔH值分别提高了7.51 ℃和7.98 J/g,热稳定性提高。原因是SA的加入增强体系中的氢键作用力和静电相互作用,使体系的三维结构更稳定,破坏WalPI-SA空间结构所需能量越高,罗洲[40]研究了4种糖对牛乳铁蛋白热稳定性的影响时得到类似结论。随着CP处理电压的增加,WalPI-SA的DSC曲线热变性峰面积增加,对应峰值向右偏移。CP处理后WalPI-SA的Tm值增加至72.79~80.04 ℃,ΔH值增加至82.63~124.7 J/g,热稳定性得到提升,其中WalPI-SA-80热稳定性最好(Tm=80.04 ℃,ΔH=124.7 J/g)。原因是CP处理促进了WalPI与SA的相互作用,SA结合于WalPI表面,WalPI-SA空间作用力增强,热稳定性更好;同时,CP处理后WalPI二级结构有序性增加[11],解旋WalPI所需能量越高。而当CP处理电压超过80 V时,高能粒子轰击使维持WalPI-SA结构稳定的氢键及静电相互作用被破坏,分子间相互作用减弱,造成WalPI-SA结构不稳定,热稳定性降低[41]。
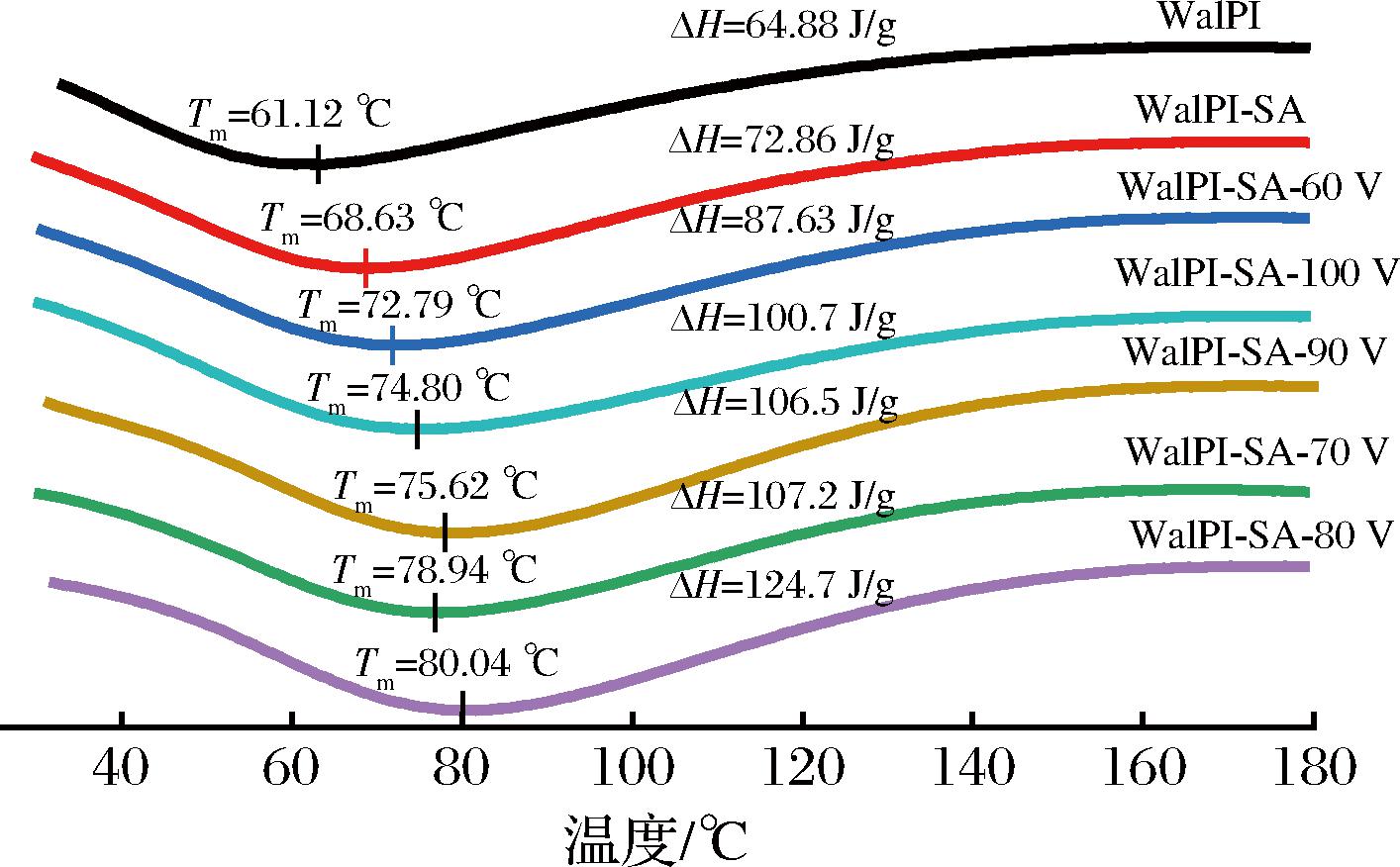
图7 不同CP处理电压对WalPI-SA热稳定性的影响
Fig.7 Effect of different CP treatment voltages on WalPI-SA thermal stability
2.8 CP处理电压对WalPI-SA接枝度和褐变度的影响
WalPI的氨基和SA的羰基接枝发生糖基化反应。接枝程度可用游离氨基酸的数量表示,游离氨基酸数量的下降,代表接枝度上升[42]。由图8可见,WalPI-SA-80V相比WalPI-SA接枝度和褐变度分别从4.56%、0.203显著提升(P<0.05)至24.63%、0.566。随着CP处理电压的增加,WalPI-SA结构疏松,暴露出的氨基酸数量增加,有利于和SA发生接枝反应,并在WalPI-SA-80V时达到最大。但CP处理电压过高,会造成WalPI的聚集,导致接枝度下降。接枝反应伴随着褐变的发生,由图8可知褐变度与接枝度的变化趋势相同,褐变度与糖基化最终阶段产物呈正相关,且在420 nm处有较强吸收值。适当的CP处理电压能促进糖基化反应向最终阶段靠近。糖基化后的产物类黑精会提升物质的抗氧化性,提升WalPI-SA的抗氧化性能。
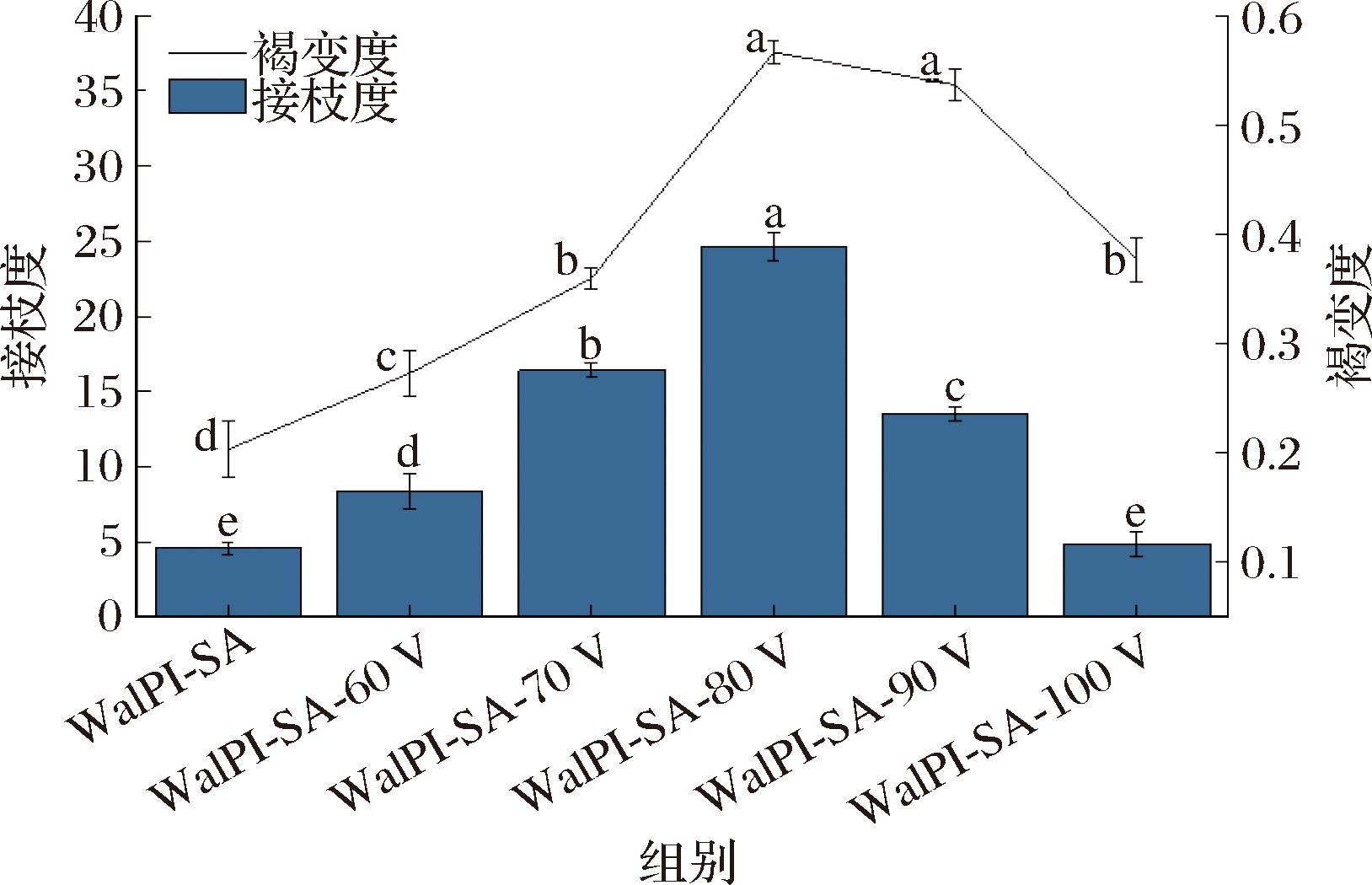
图8 不同CP处理电压对WalPI-SA接枝度和褐变度的影响
Fig.8 Effect of different CP treatment voltages on WalPI-SA grafting degree and browning degree
2.9 CP处理电压对WalPI-SA表面疏水性的影响
表面疏水性可用于表征蛋白质分子表面疏水基团数量的变化。由图9可见,与WalPI相比,WalPI-SA的表面疏水性降低9.5%,SA的加入能显著(P<0.05)降低WalPI表面疏水性。是因为SA吸附在WalPI表面,WalPI表面疏水基团被掩埋,且SA的加入会使糖链上大量亲水基团羟基引入WalPI表面,造成WalPI表面疏水性下降。随着CP处理电压的增加,WalPI-SA表面疏水性呈先减小后增大的趋势,其中WalPI-SA-80V达到最小值2 503,是因为CP处理能促进WalPI与SA的相互作用,使SA的亲水基团更多的结合到WalPI表面,WalPI-SA表面疏水性降低[43]。但当CP处理电压超过80 V时会使WalPI 交联聚集,活性位点减少不利于SA吸附于WalPI表面,造成WalPI-SA表面疏水性增加。上述研究结果与CP处理对WalPI-SA接枝度及褐变度的变化一致。因此,适当CP处理电压有利于改善WalPI-SA的表面疏水性,这对WalPI-SA的水合作用有积极意义。
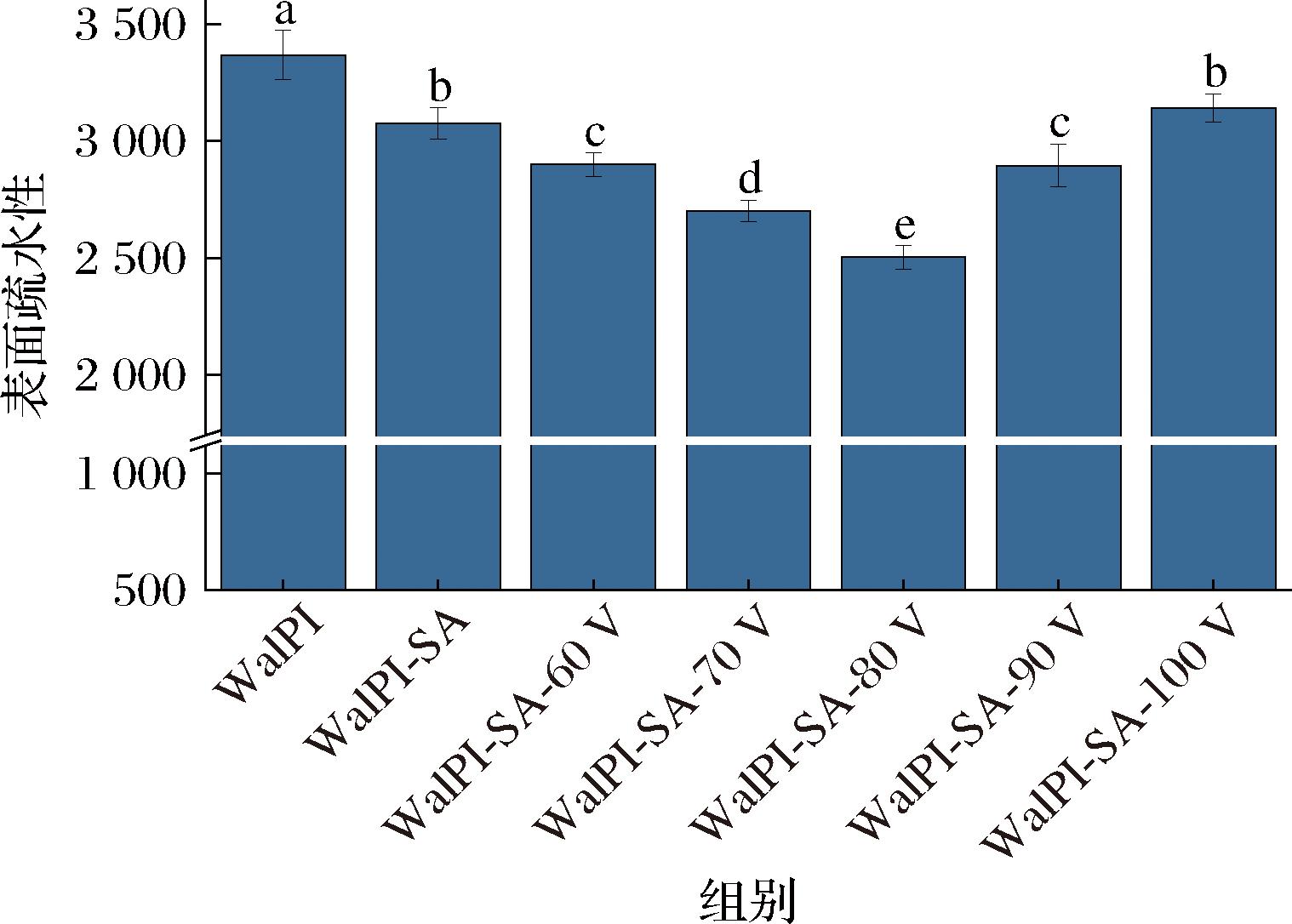
图9 不同CP处理电压对WalPI-SA表面疏水性的影响
Fig.9 Effect of different CP treatment voltages on WalPI-SA surface hydrophobicity
3 结论
本实验探究了不同CP处理电压对WalPI与SA相互作用及产物性能的影响。得出结论:经CP处理的WalPI-SA解聚重排,WalPI的二三级结构发生变化;处理后的WalPI-SA表面电荷增多,增加了静电相互作用,WalPI-SA分子间的排斥力增加,降低了分子间聚集,提升了体系的稳定性;CP处理产生的高能粒子轰击WalPI表面会提供更多反应位点,加速糖基化进程,增加WalPI和SA的作用程度,WalPI-SA的热稳定性增强;CP处理会诱导SA糖链上亲水基团结合到WalPI表面,降低WalPI-SA的疏水相互作用。本研究为CP处理对WalPI及SA相互作用的影响提供了科学依据,并进一步阐明了CP处理潜在的作用机制,同时也为改善WalPI性能提供了新思路,但对于CP作用的机理仍待进一步探索。
[1] 耿树香, 宁德鲁, 贺娜, 等.云南铁核桃及‘云新’核桃油脂抗氧化研究[J].西南林业大学学报(自然科学), 2019, 39(4):61-68. GENG S X, NING D L, HE N, et al.Study on antioxidant activity of ‘Yunxin’ walnut oil and Juglans sigillata oil[J].Journal of Southwest Forestry University, 2019, 39(4):61-68.
[2] YAN C J, ZHOU Z.Solubility and emulsifying properties of phosphorylated walnut protein isolate extracted by sodium trimetaphosphate[J].LWT, 2021, 143:111117.
[3] ASADI M, SALAMI M, HAJIKHANI M, et al.Electrospray production of curcumin-walnut protein nanoparticles[J].Food Biophysics, 2021, 16(1):15-26.
[4] SHARMA S, SINGH R R.Cold plasma treatment of dairy proteins in relation to functionality enhancement[J].Trends in Food Science &Technology, 2020, 102:30-36.
[5] ZHANG R, ZHANG J W, ZOU B W, et al.Mild alkalinity preheating treatment regulates the heat and ionic strength co-tolerance of whey protein aggregates[J].Food Research International, 2024, 193:114845.
[6] ÇAK1R-FULLER E.Enhanced heat stability of high protein emulsion systems provided by microparticulated whey proteins[J].Food Hydrocolloids, 2015, 47:41-50.
[7] HARIKRISHNA S, ANIL P P, SHAMS R, et al.Cold plasma as an emerging nonthermal technology for food processing:A comprehensive review[J].Journal of Agriculture and Food Research, 2023,14:100747.
[8] LIAO X Y, CULLEN P J, MUHAMMAD A I, et al.Cold plasma-based hurdle interventions:New strategies for improving food safety[J].Food Engineering Reviews, 2020, 12(3):321-332.
[9] JI H, TANG X J, LI L, et al.Improved physicochemical properties of peanut protein isolate glycated by atmospheric pressure cold plasma (ACP) treatment[J].Food Hydrocolloids, 2020, 109:106124.
[10] QU Z H, CHEN G Y, WANG J K, et al.Preparation, structure evaluation, and improvement in foaming characteristics of fibrotic pea protein isolate by cold plasma synergistic organic acid treatment[J].Food Hydrocolloids, 2023, 134:108057.
[11] 于娇娇. 高温花生蛋白的低温等离子体结构修饰及物性研究[D].天津:天津科技大学, 2022.YU J J.Study on structural modification and physicochemical properties of high-temperature peanut protein by cold plasma[D].Tianjin:Tianjin University of Science and Technology, 2022.
[12] CERCIELLO A, DEL GAUDIO P, GRANATA V, et al.Synergistic effect of divalent cations in improving technological properties of cross-linked alginate beads[J].International Journal of Biological Macromolecules, 2017, 101:100-106.
[13] 付明泽, 张亿, 彭小伟, 等.海藻酸钠改善热诱导青稞蛋白凝胶的特性与机制研究[J].食品与发酵工业, 2025,51(13):218-225. FU M Z, ZHANG Y, PENG X W, et al.Study on the properties and mechanism of sodium alginate improving heat-induced highland barley protein gel[J].Food and Fermentation Industries, 2025,51(13):218-225.
[14] LIU X Y, QIN X L, WANG Y H, et al.Physicochemical properties and formation mechanism of whey protein isolate-sodium alginate complexes:Experimental and computational study[J].Food Hydrocolloids, 2022, 131:107786.
[15] XU X, HAN Q Q, SHI J J, et al.Structural, thermal and rheological characterization of bovine serum albumin binding with sodium alginate[J].Journal of Molecular Liquids, 2020, 299:112123.
[16] ZHAO N, ZOU H N, SUN S, et al.The interaction between sodium alginate and myofibrillar proteins:The rheological and emulsifying properties of their mixture[J].International Journal of Biological Macromolecules, 2020, 161:1545-1551.
[17] LIU J N, ZHANG H X, SUN X, et al.Development and characterization of Pickering emulsion stabilized by walnut protein isolate nanoparticles[J].Molecules, 2023, 28(14):5434.
[18] CHEN Y, YAO M Y, YANG T Y, et al.Changes in structure and emulsifying properties of coconut globulin after the atmospheric pressure cold plasma treatment[J].Food Hydrocolloids, 2023, 136:108289.
[19] 黄子林. 核桃多酚对核桃蛋白结构和性质的影响[D].无锡:江南大学, 2022.HUANG Z L.Study on the effect of walnut pehnolic compounds on structure and properties of walnut protein[D].Wuxi:Jiangnan University, 2022.
[20] HUANG K, SHI J R, LI M Y, et al.Intervention of microwave irradiation on structure and quality characteristics of quinoa protein aggregates[J].Food Hydrocolloids, 2022, 130:107677.
[21] ERTUGRUL U, NAMLI S, TAS O, et al.Pea protein properties are altered following glycation by microwave heating[J].LWT, 2021, 150:111939.
[22] PIRESTANI S, NASIRPOUR A, KERAMAT J, et al.Preparation of chemically modified canola protein isolate with gum Arabic by means of Maillard reaction under wet-heating conditions[J].Carbohydrate Polymers, 2017, 155:201-207.
[23] 吕思伊. 超声辅助提取核桃蛋白理化性质分析及其乳液体外消化研究[D].武汉:华中农业大学, 2020.LYU S Y.Physicochemical property analysis and emulsions in vitro digestion of walnut proteins from ultra sonic-assisted extraction[D].Wuhan:Huazhong Agricultural University, 2020.
[24] ZHANG M X, CAI S B, WANG O, et al.A comprehensive review on walnut protein:Extraction, modification, functional properties and its potential applications[J].Journal of Agriculture and Food Research, 2024, 16:101141.
[25] NYAISABA B M, MIAO W H, HATAB S, et al.Effects of cold atmospheric plasma on squid proteases and gel properties of protein concentrate from squid (Argentinus Ilex) mantle[J].Food Chemistry, 2019, 291:68-76.
[26] 梁吉虹. 基于桑叶蛋白运载的β-胡萝卜素Pickering乳液制备及生物利用率的研究[D].南昌:南昌大学, 2023.LIANG J H.Study on preparation and bioavailability of β-carotene Pickering emulsion delivered by mulberry leaf protein[D].Nanchang:Nanchang University, 2023.
[27] YAN M Y, AN X S, JIANG Z C, et al.Effects of cross-linking with EDC/NHS and genipin on characterizations of self-assembled fibrillar gel prepared from tilapia collagen and alginate[J].Polymer Degradation and Stability, 2022, 200:109929.
[28] 赵舒頔, 孙晓培, 张继翔, 等.改性玉米纤维胶-大豆分离蛋白共价复合物乳化特性的研究[J].食品与发酵工业, 2025,51(6):42-49.ZHAO S D, SUN X P, ZHANG J X, et al.Study on emulsifying properties of modified corn fiber gum-soy protein isolate conjugate[J].Food and Fermentation Industries, 2025,51(6):42-49.
[29] ZEINALI M, SOLTANIZADEH N.Improving the textural and functional properties of soy protein isolate using dielectric barrier discharge (DBD) plasma-assisted pH-shifting[J].Innovative Food Science &Emerging Technologies, 2024, 94:103657.
[30] ROUT S, SRIVASTAV P P.Modification of soy protein isolate and pea protein isolate by high voltage dielectric barrier discharge (DBD) atmospheric cold plasma:Comparative study on structural, rheological and techno-functional characteristics[J].Food Chemistry, 2024, 447:138914.
[31] 杜晓倩. 大豆分离蛋白-葡聚糖聚合物构建槲皮素乳液基运载体系[D].哈尔滨:东北农业大学, 2022.DU X Q.Construction of emulsion delivery systems loaded quercetin with soybean protein isolate-dextran complexes[D].Harbin:Northeast Agricultural University, 2022.
[32] WANG P, WANG Y W, DU J, et al.Effect of cold plasma treatment of sunflower seed protein modification on its structural and functional properties and its mechanism[J].Food Hydrocolloids, 2024, 155:110175.
[33] 刘郁琪, 覃小丽, 阚建全, 等.酪蛋白与可溶性大豆多糖的酶促糖基化产物制备及其性能分析[J].食品科学, 2020, 41(19):74-82.LIU Y Q, QIN X L, KAN J Q, et al.Preparation and properties of enzymatic glycosylation products of casein with soluble soybean polysaccharide[J].Food Science, 2020, 41(19):74-82.
[34] ALABI O O, ANNOR G A, AMONSOU E O.Effect of cold plasma-activated water on the physicochemical and functional properties of Bambara groundnut globulin[J].Food Structure, 2023, 36:100321.
[35] 胡志和, 程凯丽, 鲁丁强, 等.超高压处理引发乳糖酶活力变化与荧光强度变化的关系[J].食品科学, 2022, 43(1):111-118.HU Z H, CHEN K L, LU D Q, et al.Relationship between changes in the activity and fluorescence intensity of lactase induced by ultrahigh pressure treatment[J].Food Science, 2022, 43(1):111-118.
[36] DURSUN CAPAR T, YALCIN H.Protein/polysaccharide conjugation via Maillard reactions in an aqueous media:Impact of protein type, reaction time and temperature[J].LWT, 2021, 152:112252.
[37] ABARGHOEI M, GOLI M, SHAHI S.Investigation of cold atmospheric plasma effects on functional and physicochemical properties of wheat germ protein isolate[J].LWT, 2023, 177:114585.
[38] 任杰, 卢知浩, 吴晗硕, 等.大豆分离蛋白-姜黄素纳米颗粒制备工艺优化、结构表征和稳定性分析[J].中国食品学报, 2024, 24(9):256-267.REN J, LU Z H, WU H S, et al.Process optimisation, structural characterisation and stability analysis of soybean isolate protein-curcumin nanoparticle preparation[J].Journal of Chinese Institute of Food Science and Technology.2024, 24(9):256-267.
[39] 王梓郡, 刘慧慧, 麻志刚, 等.糖基化β-伴大豆球蛋白负载提高姜黄素抗氧化及缓释特性[J].食品科学, 2023, 44(8):23-29.WANG Z J, LIU H H, MA Z G, et al.Enhanced antioxidant activity and sustained-release property of curcumin encapsulated in glycated soy β-conglycinin nanoparticles[J].Food Science, 2023, 44(8):23-29.
[40] 罗洲. 糖基化修饰对牛乳铁蛋白结构和功能特性的影响研究[D].成都:成都大学, 2024.LUO Z.The impact of glycosylation modification on the structure and functional properties of bovine lactoferrin[D].Chengdu:Chengdu University, 2024.
[41] SHARAFODIN H, SOLTANIZADEH N, BARAHIMI M S.Conjugation of soy protein isolate with carboxymethyl cellulose through dielectric barrier discharge (DBD) plasma[J].Food Chemistry, 2023, 407:135059.
[42] DONG S, GAO A, XU H, et al.Effects of dielectric barrier discharges (DBD) cold plasma treatment on physicochemical and structural properties of zein powders[J].Food and Bioprocess Technology, 2017, 10(13):434-444.
[43] JIANG Y H, CHENG J H, SUN D W.Effects of plasma chemistry on the interfacial performance of protein and polysaccharide in emulsion[J].Trends in Food Science &Technology, 2020, 98:129-139.