食品包装是食品供应链的重要组成部分,可减少食物在贮运过程中因变质导致的食物浪费[1]。传统塑料食品包装重复利用率低,80%不可再生和降解,造成严重环境污染[2]。活性包装膜的可持续性和良好生物可降解性使其在食品保鲜领域被广泛应用[3]。壳聚糖(chitosan,CS)是天然高分子甲壳素的脱乙酰化产物,具有优异的成膜性、抗菌性和可设计性,且可生物降解、生物相容性好,是绿色包装的理想材料[4-5]。CS可单独作为基质形成薄膜,但其力学性能较差,抗菌和抗氧化作用有限,包装食品时不能很好地维持食品质量以延长食品保质期[6]。研究者添加天然活性成分到CS膜,如抗菌物质、精油、蛋白质、多糖和多酚等以增强薄膜的力学、抗菌、抗氧化、阻隔等性能,获得结构和性能更佳的复合包装膜[7]。
乳酸菌来源广泛,是一般公认安全(Generally Recognized as Safe,GRAS)的生物制剂,对细菌、真菌均有抑制作用,且乳酸菌及其次级代谢产物制剂还能保持食品感官品质且代谢物无害[8]。无细胞上清液(cell-free supernatant,CFS)是含微生物次级代谢物及其生长培养基残留营养物质的液体。乳酸菌次级代谢产物含有机酸、过氧化氢、细菌素和蛋白质类短肽等多种抗菌成分[9],其抗菌能力强、安全无毒,被广泛用作抗菌材料。此外,乳酸菌次级代谢产物的胞外多糖可降低主体水分流失、维持食品营养物质,是良好的生物保鲜剂[10]。已有研究将乳酸菌CFS用于抑制全蛋液[11]、辣椒[12]、番茄酱[13]和碎牛肉[14]中的腐败菌,结果表明CFS对其均有抑制作用,同时对食物感官无影响。因此,可将CFS融入成膜基材生产抗菌包装膜,乳酸菌次级代谢产物与CS复合可缓解代谢产物易降解和抑菌稳定性差的问题,确保其抗菌效果。目前鲜见CFS和壳聚糖复合膜的制备及性能研究。
基于此,本研究以CS为基材,根据不同体积比例的CS、CFS制备复合保鲜液,研究其抗菌、抗氧化性,并用流延法制备成活性包装膜,采用扫描电镜(scanning electron microscope,SEM)、差示扫描量热仪(differential scanning calorimeter,DSC)、傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、X射线衍射(X-ray diffraction,XRD)对复合膜进行表征,并分析其机械性、阻隔性等性质,以期为CFS在活性包装膜的应用提供参考。
1 材料与方法
1.1 材料与试剂
大肠杆菌、金黄色葡萄球菌、铜绿假单胞菌、植物乳植杆菌,实验室自保藏;MRS培养基,广东环凯科技有限公司;CS(脱乙酰度≥95%),上海麦克林生化科技有限公司;DPPH、ABTS(HPLC≥98%),合肥巴斯夫生物科技有限公司;甘油,广东光华科技股份有限公司;冰醋酸,天津风船化学试剂科技有限公司。
1.2 仪器与设备
FJ200-SH数显高速分散均质机,上海沪析实业有限公司;HSP-80B恒温恒湿箱,上海坤天实验室仪器有限公司;101-2AB电热鼓风干燥箱,天津市泰斯特仪器有限公司;UTM5105电子万能试验机,珠海市三思泰捷电气设备有限公司;32CHQF1030数显千分规,德清盛泰芯电子科技有限公司;IRPrestige-21傅里叶红外光谱仪,日本Shimadu公司;UV-2600紫外-可见分光光度计,日本岛津公司;ZEISS GeminiSEM 300扫描电镜,德国Carl Zeiss公司;DSC204F1热差分析仪,德国Netzch公司;Ultima IV型X射线衍射仪,日本理学Rigaku公司。
1.3 实验方法
1.3.1 复合膜的制备
CFS制备:植物乳植杆菌解冻接种于MRS液体培养基,37 ℃培养48 h,离心(4 ℃,8 000 r/min,10 min)去上清液,用质量分数0.85%的无菌生理盐水调整乳酸菌悬液至107 CFU/mL。将菌悬液以体积分数2%的接种量接种至MRS液体培养基,37 ℃培养48 h,离心(4 ℃,8 000 r/min,10 min)取上清液,0.22 μm 水系微孔滤膜过滤,滤液即为CFS。
将CS溶于乙酸溶液(1.0%,体积分数),配制质量分数为2.0%的CS溶液,再将甘油以体积分数0.5%的添加量加入CS溶液。固定CS溶液15.0 mL,分别加入0、1.5、3.0、4.5、6.0、7.5 mL CFS,即体积比为15∶0、10∶1、10∶2、10∶3、10∶4、10∶5,200 r/min磁力搅拌30 min,7 000 r/min高速分散3.0 min,450 W超声30 min,静置1 h消泡得复合保鲜液。将复合保鲜液倒入直径9 cm聚四氟乙烯皿,流延均匀后45 ℃烘箱干燥48 h得复合膜(CK、CF10∶1、CF10∶2、CF10∶3、CF10∶4、CF10∶5)。膜样品置于恒温恒湿培养箱(25 ℃、相对湿度50%)平衡48 h备用。经预实验发现,比例持续增加,复合膜的成膜性差,因此比例选取10∶0~10∶5为研究对象。
1.3.2 复合保鲜液的抗菌效果
研究表明乳酸菌的CFS对热处理不敏感,在酸性条件下有较好的稳定性[15]。本试验CFS能均匀分散于膜中,且干燥膜的温度较低,成膜前后对膜基质无影响,因此为方便测试选用1.3.1节制备的复合保鲜液进行抗菌和抗氧化试验。
配制LB固体、液体培养基,取金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌悬液接种于液体培养基,培养24 h,离心(4 ℃,8 000 r/min,10 min),用质量分数0.85%的无菌生理盐水调整细菌悬液至107 CFU/mL。取100 μL菌液涂布于LB琼脂平板,将直径6 mm滤纸片(已于保鲜液中浸泡1 h)贴在培养基表面,37 ℃培养24 h,测定其抑菌圈直径。
1.3.3 复合保鲜液的抗氧化效果
参考王嘉康等[16]的方法测定DPPH自由基清除率。配制0.1 mmol/L DPPH溶液,避光贮存。将2.0 mL保鲜液和等体积DPPH溶液混匀为样品组(A1),以2.0 mL 保鲜液和等体积无水乙醇混匀为对照组(A2),以2.0 mL DPPH溶液和等体积无水乙醇混匀为空白组(A0)。室温避光反应30 min,517 nm处测定吸光值。DPPH自由基清除率按公式(1)计算:
DPPH自由基清除率![]()
(1)
式中:A0为空白组吸光度;A1为样品吸光度;A2为对照组吸光度。
参考ZHOU等[17]的方法测定ABTS阳离子自由基清除率,并略作修改。ABTS(7 mmol/L)和过硫酸钾(140 mmol/L)等体积混合,室温避光反应16 h,无水乙醇稀释至734 nm处吸光度0.70±0.02,为ABTS工作液。将2.0 mL保鲜液和等体积ABTS溶液混匀为样品组(A4),以2.0 mL保鲜液和等体积无水乙醇混匀为对照组(A5),以2.0 mL ABTS溶液和等体积无水乙醇混匀为空白组(A3)。室温避光反应6.0 min,734 nm处测定吸光值。ABTS阳离子自由基清除率按公式(2)计算:
ABTS阳离子自由基清除率![]()
(2)
式中:A3为空白组吸光度;A4为样品吸光度;A5为对照组吸光度。
1.3.4 复合膜的阻隔性能测定
1.3.4.1 紫外屏蔽性能
参考JIANG等[18]的方法。将膜裁剪成40 mm×10 mm的矩形紧贴比色皿一侧,空白比色皿为对照,用紫外-可见分光光度计测定300~800 nm处膜的透光率。
1.3.4.2 水蒸气透过率(water vapor permeability,WVP)
采用拟杯子法[19]测定膜的WVP。取3.0 g CaCl2于40 mm×25 mm称量皿中,用膜密封,置于相对湿度50%和25 ℃的恒温恒湿箱,每7 d称重1次,记录质量变化。WVP按公式(3)计算:
(3)
式中:WVP,待测膜水蒸气透过率,g·mm/(m2·d·kPa);Δm1,CaCl2吸收水蒸气的质量,g;d,薄膜的厚度,mm;S,薄膜的面积,1.26×10-3 m2;T1,测试周期,d;Δp,薄膜内外水蒸气分压差,kPa。
1.3.4.3 二氧化碳透过率(CO2 permeability,QCO2)
采用强碱吸收法[20]测定膜的QCO2。取3.0 g KOH于40 mm×25 mm称量皿中,用膜密封,置于相对湿度50%和25 ℃的恒温恒湿箱,每7 d称重1次,记录质量变化。QCO2按公式(4)计算:
(4)
式中:QCO2,待测膜二氧化碳透过率,mg/(cm2·d);Δm2,KOH吸收CO2质量,mg;S,薄膜的有效面积,1.26×10-3 m2;T2,测试周期,d。
1.3.5 复合膜的水分含量和水溶性测定
1.3.5.1 水分含量(water content,WC)
参考ZHAO等[21]的方法测定膜的WC。将膜裁剪成20 mm×20 mm的正方形(m3),置于恒重的称量皿,105 ℃干燥至恒重,冷却后称重(m4)。WC按公式(5)计算:
(5)
1.3.5.2 水溶性(water solubility,WS)
参考SREEKANTH等[22]的方法测定膜的WS。将膜裁剪成20 mm×20 mm的正方形,在60 ℃的热风干燥箱干燥24 h,记录初始质量(m5),将样品在30 mL 蒸馏水中浸泡24 h,取出样品并在100 ℃下干燥24 h,以测量最终干重(m6)。WS按公式(6)计算:
(6)
1.3.6 复合膜的机械性能测定
参考YU等[23]的方法。将膜裁剪成60 mm×20 mm的长条状,用电子万能试验机以20 mm/min的拉伸速度测定膜的拉伸强度(tensile strength,TS)和断裂伸长率(elongation at break,EB)。膜的厚度随机选取5个点测量,结果取平均值。TS、EB值分别按公式(7)、公式(8)计算:
(7)
式中:F,膜断裂时最大负荷,N;b,膜宽度,mm;d,膜厚度,mm。
(8)
式中:L0,膜的初始长度,mm;L,膜断裂时的长度,mm。
1.3.7 复合膜的表征
1.3.7.1 微观结构
采用SEM在500倍下观察膜的微观结构。截面进行液氮脆断,样品喷金。
1.3.7.2 热稳定性测定
采用DSC测膜的热稳定性。取5~10 mg样品于坩锅中,N2氛围下(流速20 mL/min),空坩埚为对照,测试温度40~200 ℃,升温速度10 ℃/min。
1.3.7.3 FTIR
采用FTIR测膜的红外图谱。测定波数为4 000~500 cm-1,参数:分辨率为4 cm-1,扫描次数为32次。
1.3.7.4 结晶度测定
采用XRD测膜的晶体结构。以Cu-Kα靶射线为辐射源,扫描速度5 °/min,2θ为5~40°。
1.4 数据处理
每个样品重复测量3次,采用IBM SPSS Statistics 2分析数据,Origin 2018进行绘图。
2 结果与分析
2.1 复合保鲜液的抗菌效果
金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌是食品工业中重要的食源性致病菌,会在食品表面和食品接触设备上形成生物膜引起食物腐烂[24]。复合膜的抗菌效果通过保鲜液对细菌产生的抑菌圈大小所反映,结果如图1所示。随CFS添加比例增大,复合保鲜液对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌的抑菌圈直径均显著增大(P<0.05)。当CS和CFS复配比为10∶5时抑菌圈直径达最大,与对照组相比,其对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌的抑菌圈直径分别增大111.22%、113.92%、94.20%。这表明CFS中的乳酸菌代谢产物具有良好的抗菌效果。WANG等[11]用植物乳植杆菌CFS抑制蛋液腐败菌,其抗菌效果好,且呈剂量依赖,与本研究结果相似。因此,CFS用于食品抗菌包装有较大开发潜力。
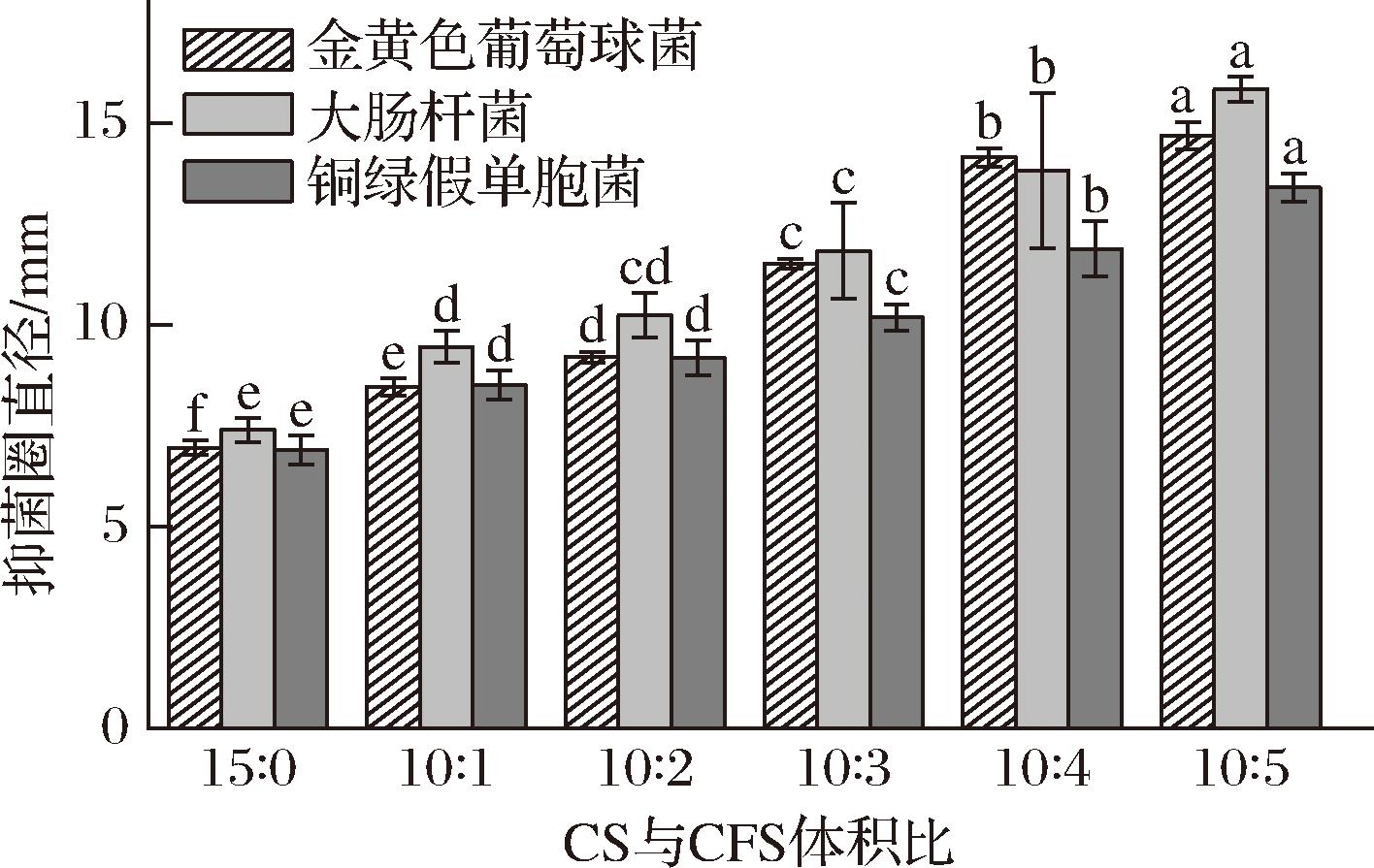
图1 复合保鲜液的抗菌效果
Fig.1 Antibacterial effect of composite preservative solution
注:同一指标,不同小写字母表示组间的差异显著(P<0.05)(下同)。
2.2 复合保鲜液的抗氧化效果
采用DPPH自由基、ABTS阳离子自由基清除法测定复合保鲜液的抗氧化能力,结果如图2所示。CS保鲜液对DPPH自由基、ABTS阳离子自由基清除率分别为42.77%和38.16%,均低于复合保鲜液的抗氧化能力,CFS的加入显著增强了复合保鲜液的抗氧化性(P<0.05)。当CS、CFS以10∶5复配时对DPPH自由基、ABTS阳离子自由基清除率分别比CS保鲜液提高120.86%和141.72%,此时CFS添加量最大。复合保鲜液中可能含大量有机酸、细菌素和蛋白质类短肽等次级代谢产物使其抗氧化性最强。LAOPHONGPHIT等[25]对4株乳酸菌益生性进行评价,发现所有菌株的抗氧化活性均在CFS中表现出最高水平,其中副干酪乳酪菌发酵的芒果浆中抗氧化剂脯氨酸水平提高了377.28倍,出现了新的二肽和三肽,这表明它们向生长培养基中释放的水溶性生物活性化合物具有较强抗氧化性。结果表明CFS具有良好的抗氧化效果,可作为延长食品贮藏期,保证食品质量的抗氧化剂。
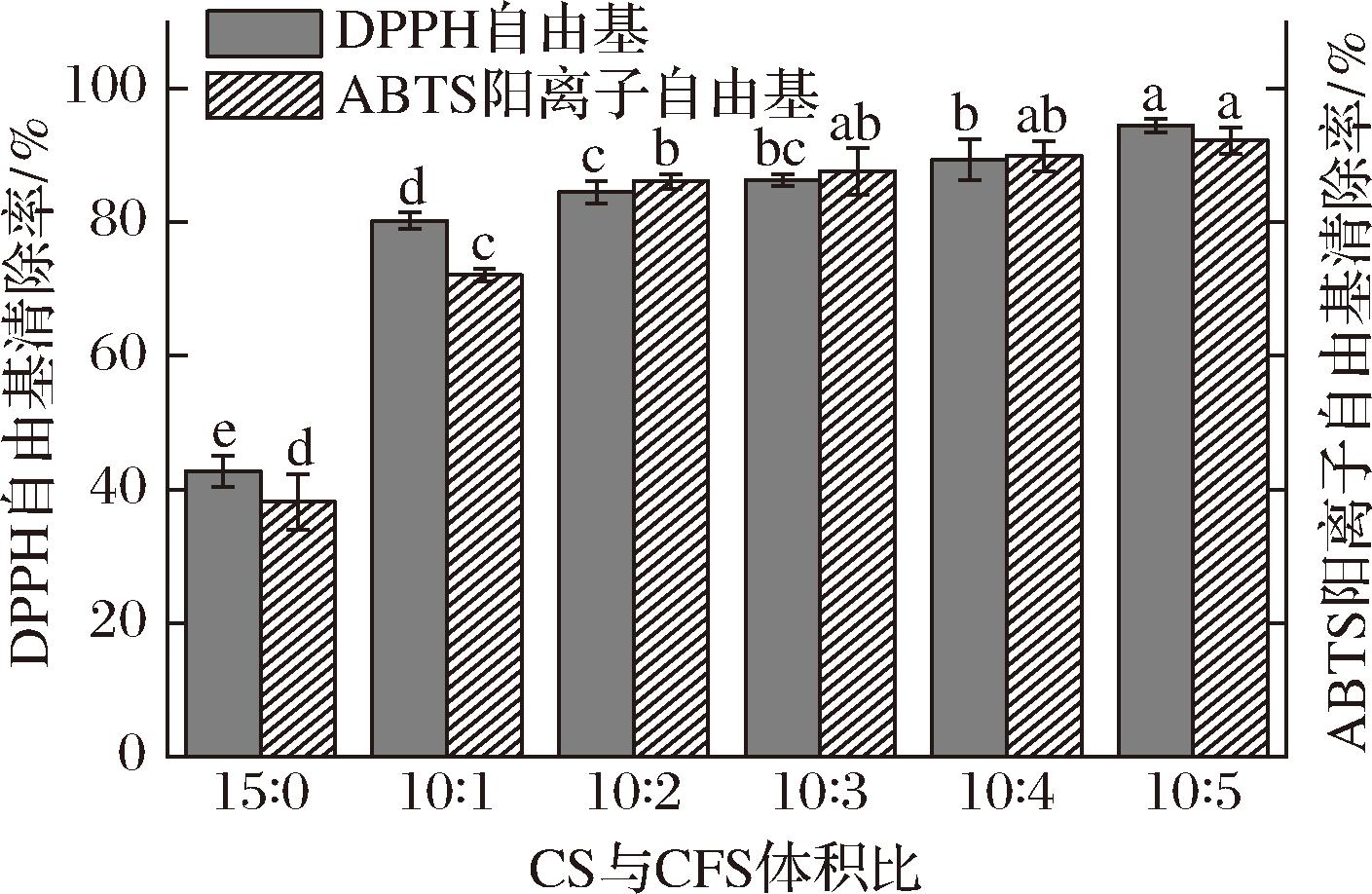
图2 复合保鲜液的抗氧化效果
Fig.2 Antioxidant effect of composite preservative solution
2.3 复合膜的光学特性
强光作用下食物中营养和生物活性物质易被分解氧化,导致食品变色、变质和营养流失。因此,食品包装膜对光的阻隔性在贮运中具有重要作用[26]。图3 显示了300~800 nm波长内紫外光和可见光的透射情况。复合膜的阻光性优于CK膜,随着CFS添加比例增大,复合膜透光率逐渐降低,其中CF10∶5复合膜的透光率最低。原因为CFS是乳酸菌在MRS肉汤中培养后产生代谢物的一种棕色液体,均匀分散于复合膜使光线被阻挡,特别是在高浓度CFS的复合膜中。结果表明,CFS的加入改善了复合膜的遮光性能,能潜在地使食品免受紫外线损害,在贮运过程中能保持包装食品的色泽、营养、风味等。
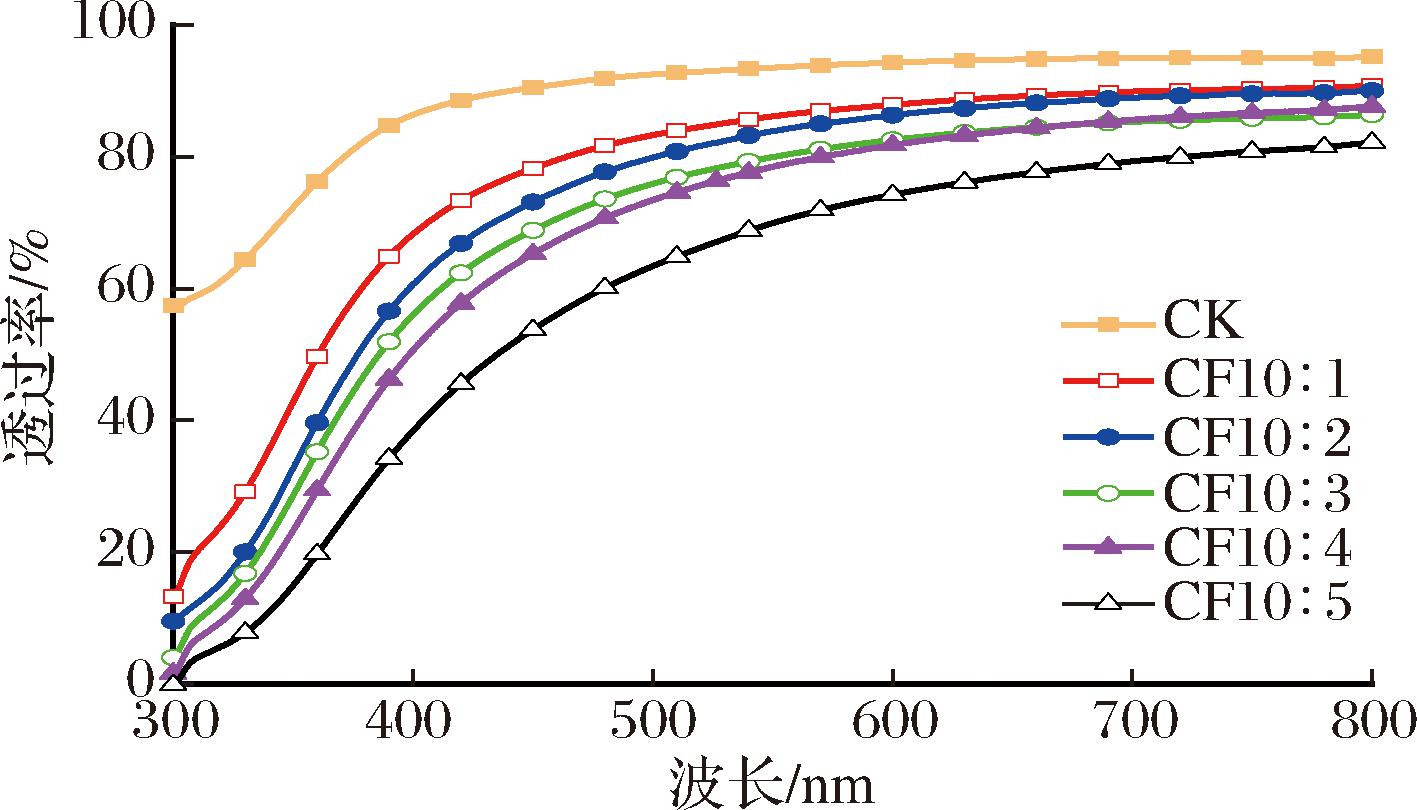
图3 复合膜的透光性
Fig.3 Light transmittance of composite films
2.4 复合膜的WVP和QCO2分析
WVP和QCO2是衡量食品包装材料应用潜力的重要指标,良好的气体阻隔性能有效防止包装食品因吸潮、氧化等因素引起的营养流失或质量下降。此外,薄膜的厚度也会影响其阻隔性能。由表1可知,随着CFS比例增大,复合膜的厚度逐渐增大(0.062~0.099 mm),WVP值升高[21.256~30.126 g·mm/(m2·d·kPa)],CFS的加入使成膜液流动性增强、成膜难度增大、水分子通道增加,使其WVP值增大[27]。而QCO2值变化不显著(P>0.05),从52.411 mg/(cm2·d)降低至51.005 mg/(cm2·d)。
表1 CK膜、CF复合膜的基本性质
Table 1 Basic properties of CK film and CF composite film
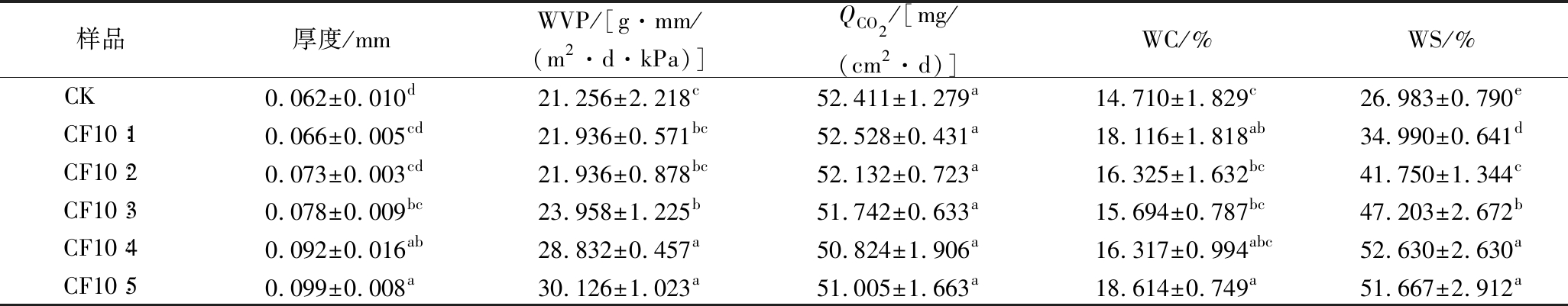
注:同一列中不同字母表示差异显著(P<0.05)。
样品厚度/mmWVP/[g·mm/(m2·d·kPa)]QCO2/[mg/(cm2·d)]WC/%WS/%CK 0.062±0.010d21.256±2.218c52.411±1.279a14.710±1.829c26.983±0.790eCF10∶10.066±0.005cd21.936±0.571bc52.528±0.431a18.116±1.818ab34.990±0.641dCF10∶20.073±0.003cd21.936±0.878bc52.132±0.723a16.325±1.632bc41.750±1.344cCF10∶30.078±0.009bc23.958±1.225b51.742±0.633a15.694±0.787bc47.203±2.672bCF10∶40.092±0.016ab28.832±0.457a50.824±1.906a16.317±0.994abc52.630±2.630aCF10∶50.099±0.008a30.126±1.023a51.005±1.663a18.614±0.749a51.667±2.912a
2.5 复合膜的WC和WS分析
所有膜的WC为14.710%~18.614%。随着CFS添加比例增大,WC整体呈上升趋势,复合膜中CF10∶3水分含量最低(15.694%),略高于CK膜(14.710%),但整体无显著性差异(P>0.05),可能与薄膜基质中CS、甘油和CFS的吸湿性相关[28]。WS是薄膜的重要特性,影响其耐水性。CK膜的WS显著低于复合膜(P<0.05),其中CF10∶5复合膜WS最大(51.667%)。随着CFS添加比例增大复合膜的WS增大,是因为CS中氨基和CFS的基团间存在相互作用,且CFS加入促进了水分子在薄膜基质中扩散,从而增加了复合膜的水溶性。
2.6 复合膜的机械性能
优异的机械性能是食品包装膜在加工、运输、贮存和销售过程中耐久性和抗应力性的体现,反映包装膜在保护食品时的物理完整性。图4为不同复合膜的TS和EB图。随CFS添加比例增大,复合膜TS和EB均有改善,呈先升高后降低的趋势,其中CF10∶3复合膜的TS和EB最高,分别为(13.91±0.89) MPa和(77.83±1.51)%,与CK膜相比,显著提高了36.77%和70.94%(P<0.05),说明此时CS和CFS分子间形成了相对适度的分子间作用力。随CFS的添加,CFS在聚合物中均匀分散,CS和CFS间产生较强的相互作用,增强了膜的交联和塑化作用,同时有效增强了复合膜的力学性能。然而,高剂量的CFS在膜中发生了部分聚集使其分散性下降,其构建的体系缺乏一定的稳定性,导致复合膜致密性降低,TS和EB下降[29]。
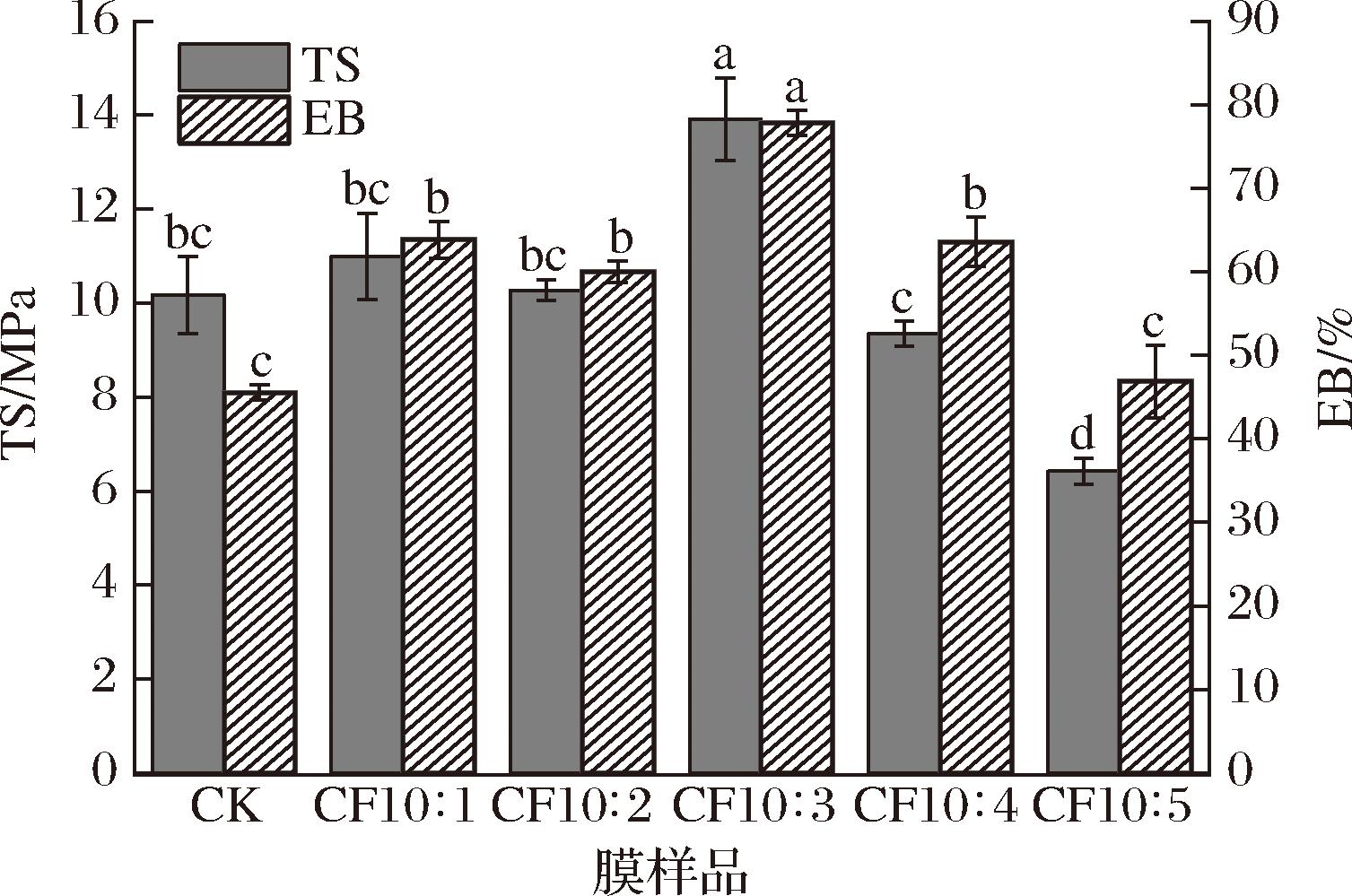
图4 复合膜的TS和EB
Fig.4 TS and EB of composite films
2.7 复合膜的微观结构
如膜宏观图(图5A1~图5F1)所示,CK膜无色透明,加入CFS后,复合膜的颜色变成棕色。从不同薄膜的宏观图观察到,薄膜具有良好外观。复合膜的表面(图5A2~图5F2)略显粗糙,尤其CFS含量较大时,膜整体粗糙度上升。这可能是膜基质间不规则聚集概率增大,导致溶解性下降[30]。因此应选择适当比例来添加CFS,当CFS添加比例大于10∶3时分散性下降,膜致密的分子结构被破坏,这与TS和EB的结果一致。复合膜横截面图(图5A3~图5F3)显示,除CF10∶5复合膜外,其他膜的横截面光滑、连续、均匀,呈现良好的分散性。

A1~F1-复合膜宏观图;A2~F2-复合膜表面微观结构图;A3~F3-复合膜截面微观结构图
图5 复合膜的结构图
Fig.5 Microstructure of composite films
注:A~F依次为CK膜、CF10∶1、CF10∶2、CF10∶3、CF10∶4、CF10∶5复合膜。
2.8 复合膜热稳定性
通过DSC分析复合膜的热稳定性,可进一步研究CS和CFS间的作用力。如图6所示,所有膜样品均只观察到单一吸热峰,表明各膜组分间有良好的相容性。CF10∶1、CF10∶2、CF10∶3、CF10∶4、CF10∶5组对应熔融温度分别为121.69、123.91、125.28、122.71、122.11 ℃。加入CFS后复合膜熔融温度均大于CK膜(117.75 ℃),复合膜热稳定性均被提高,说明CS和CFS在成膜的过程中分子间发生了相互作用,这些力增加了交联密度。其中CF10∶3复合膜的熔融温度最高,热稳定性也最好,这可能是CFS中的多种活性物质有力地维系了膜基质间的稳定结构,形成更加紧密的网络结构,增强了薄膜中的分子间作用力,并限制了分子链间的流动性[31]。CS、CFS复配比大于10∶3时熔融温度降低,是由于大量CFS的加入改变了其与膜基质间的聚合物网络结构和聚合物间相容性,导致CFS在膜基质间的分散性减弱,热稳定性降低。
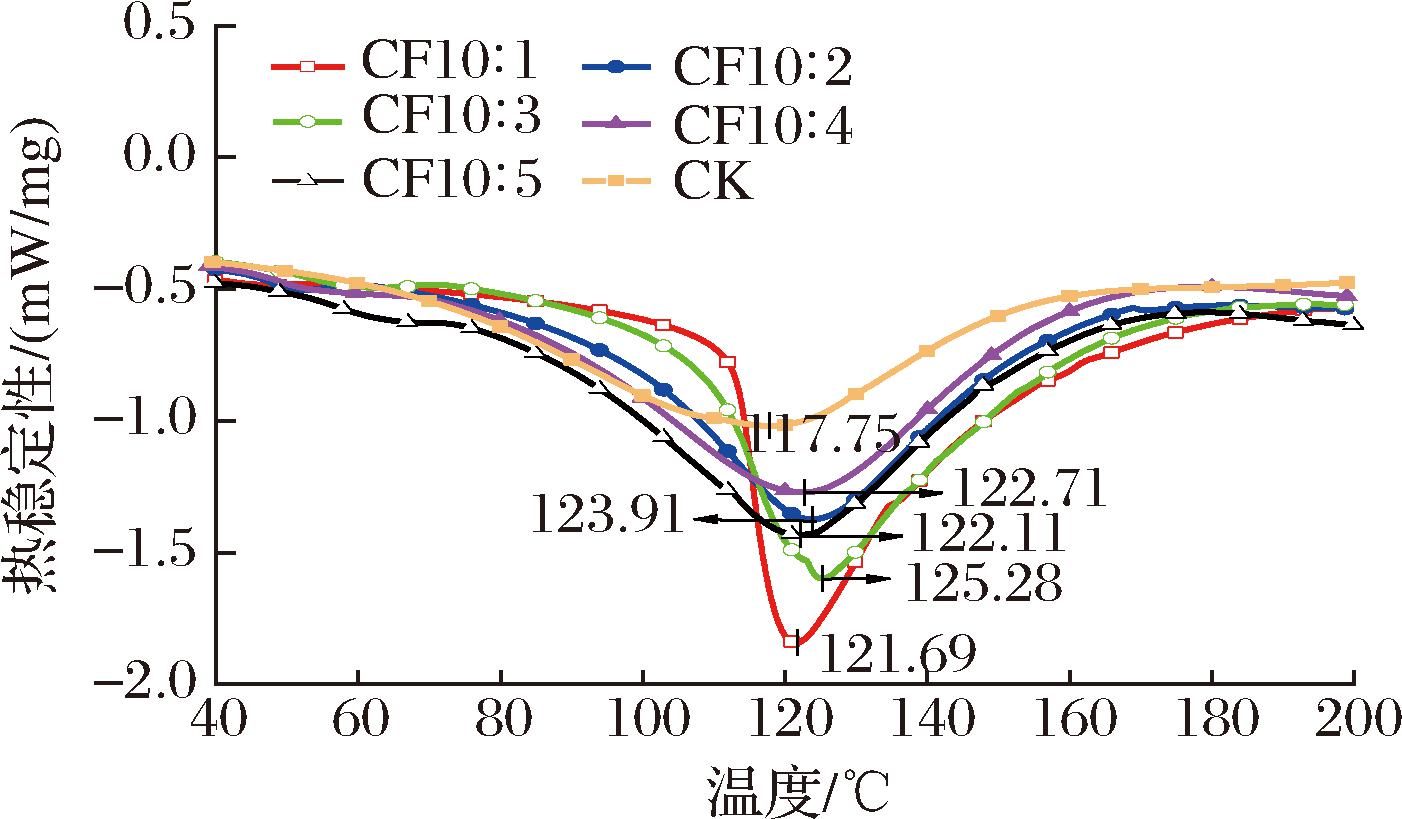
图6 复合膜的热稳定性
Fig.6 Thermal stability of composite films
2.9 复合膜的FTIR
FTIR可用于表征复合膜结构测试中不同成分基质成膜后材料特征基团的变化,分析添加不同比例的CFS对复合膜分子间相互作用力和二级结构的影响。如图7所示,FTIR光谱中3 258 cm-1左右的宽峰为O—H和N—H的拉伸振动,2 941 cm-1处吸收峰为C—H的拉伸振动,1 647 cm-1处吸收峰为乙酰基(酰胺Ⅰ)的C![]() O非对称拉伸振动,1 547 cm-1和1 410 cm-1吸收峰由N—H弯曲振动(酰胺Ⅱ)引起[32]。其中N—H弯曲振动(1 547 cm-1)向更高波数(1 577 cm-1)移动,表明CS的氨基和CFS的羟基之间存在相互作用。1 157 cm-1和1 022 cm-1处吸收峰与糖结构和糖苷键的C
O非对称拉伸振动,1 547 cm-1和1 410 cm-1吸收峰由N—H弯曲振动(酰胺Ⅱ)引起[32]。其中N—H弯曲振动(1 547 cm-1)向更高波数(1 577 cm-1)移动,表明CS的氨基和CFS的羟基之间存在相互作用。1 157 cm-1和1 022 cm-1处吸收峰与糖结构和糖苷键的C![]() O和O—H伸展有关,是由CS或甘油引起的。此处复合膜吸收峰强弱不同是因为膜基质间的氢键作用,导致O—H吸收峰强弱不同,表明CS、CFS分子之间存在相互作用。此外,几乎所有复合膜的特征峰与CK膜相似,仅表现出峰强变化及特征峰之间有轻微偏移,说明其二级结构并未发生明显变化,复合膜制备过程中没有产生新的化学键,氢键是形成分子间主要的相互作用力,有利于复配体系增容和保持良好的相容性。上述结果表明,CS与CFS能通过分子间作用力更好地结合在一起。
O和O—H伸展有关,是由CS或甘油引起的。此处复合膜吸收峰强弱不同是因为膜基质间的氢键作用,导致O—H吸收峰强弱不同,表明CS、CFS分子之间存在相互作用。此外,几乎所有复合膜的特征峰与CK膜相似,仅表现出峰强变化及特征峰之间有轻微偏移,说明其二级结构并未发生明显变化,复合膜制备过程中没有产生新的化学键,氢键是形成分子间主要的相互作用力,有利于复配体系增容和保持良好的相容性。上述结果表明,CS与CFS能通过分子间作用力更好地结合在一起。
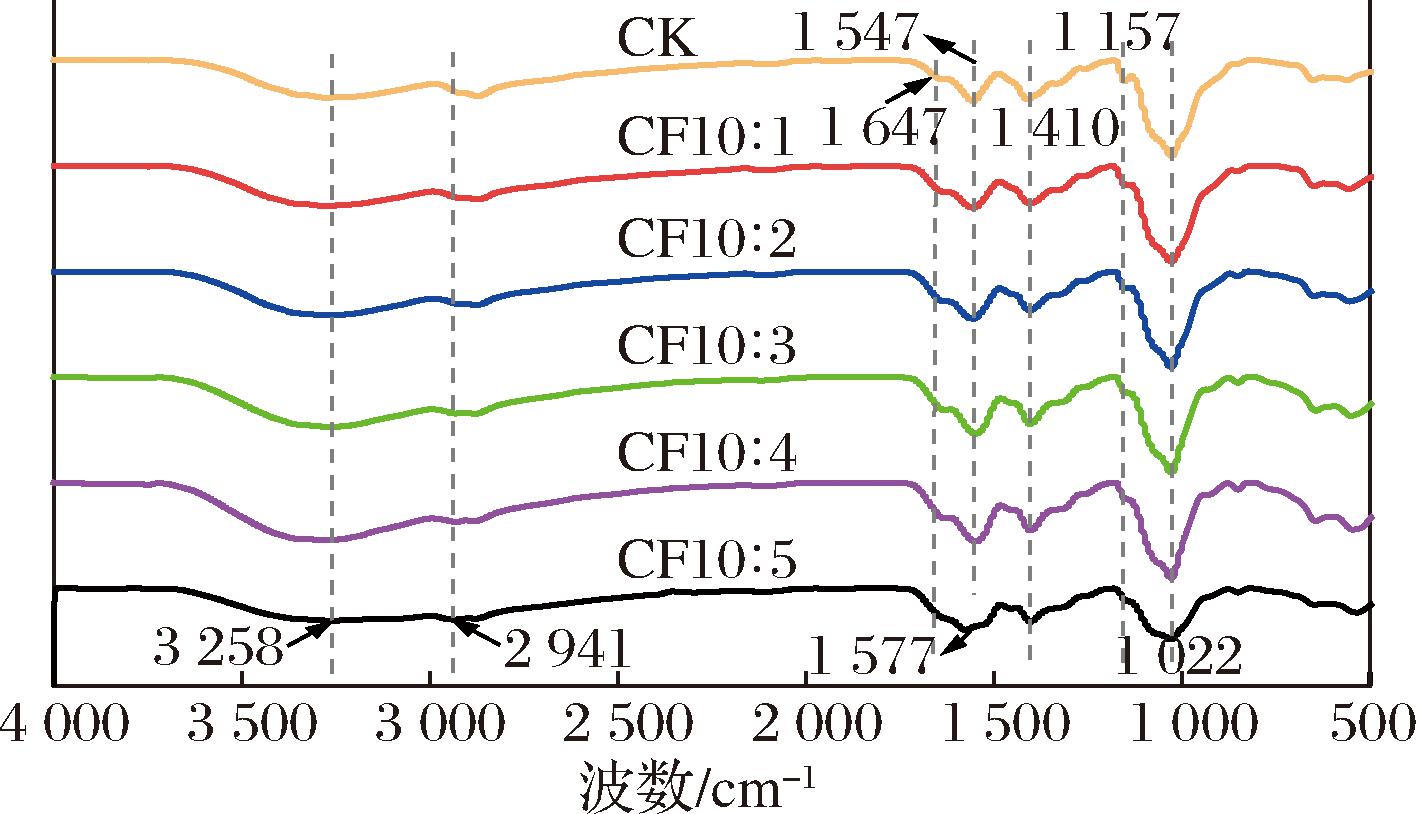
图7 复合膜的红外光谱图
Fig.7 FTIR spectra of composite films
2.10 复合膜的XRD
复合膜的XRD揭示了CS和CFS对复合膜晶体结构的影响(图8)。样品衍射峰越尖锐结晶度越高,反之。CK膜在2θ为15.34°和20.79°处均出现特征衍射峰,这是由于CS大分子的规整性较好,比较容易形成结晶结构。添加CFS的复合膜出现了新衍射峰(2θ=5.98°、11.27°、17.98°),改变了CS的原始晶体域,分子重排并产生氢键相互作用。随着CFS添加比例增大,复合膜在15.34°处的弱衍射峰逐渐消失,在20.79°处的特征衍射峰强度明显减弱,峰形变宽,表明薄膜转变为无规则非晶聚合物交联薄膜[33]。原因为CS和CFS之间的物理相互作用限制了分子链的运动,并抑制了结晶过程,导致晶体结构减少,同时峰强降低会使机械和物理性能发生变化。
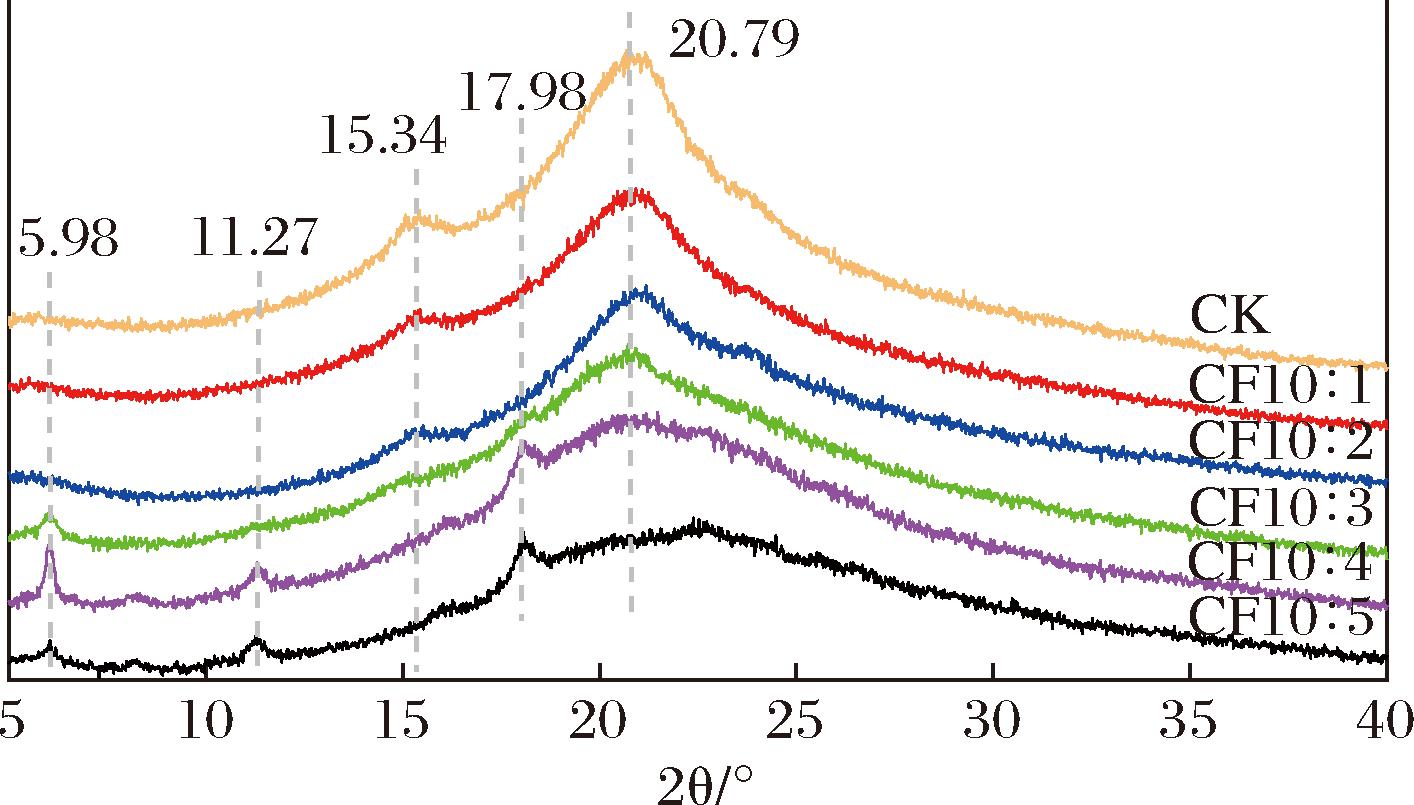
图8 复合膜的XRD图
Fig.8 XRD spectra of composite films
3 结论
本文以不同比例的CS、CFS共混制备复合保鲜液,研究其抗菌、抗氧化效果,发现随CFS比例增大,复合保鲜液对金黄色葡萄球菌、大肠杆菌、铜绿假单胞菌的抗菌效果和对DPPH自由基、ABTS阳离子自由基清除能力显著增强(P<0.05)。采用流延法制备不同比例的CS、CFS复合包装膜发现,随着CFS比例增大,复合膜光阻隔性能增强,其厚度、水蒸气透过率、溶解性、水分含量增加,CO2透过率降低。CFS的加入改善了复合膜的拉伸强度、韧性和热稳定性,其中CF10∶3复合膜的机械性能和热稳定性最好,与CK膜相比,其EB和TS显著提高了36.77%和70.94%(P<0.05),熔融温度达125.28 ℃。SEM、DSC、FTIR、XRD分析表明CFS的加入并未改变其化学结构,膜基质间形成氢键相互作用,复合膜具有良好的相容性,结构致密,热稳定性较好。以上结果表明CFS可作为具有良好抗菌、抗氧化的生物活性包装膜材料,为食品防腐、保鲜提供参考。
[1] TRAJKOVSKA PETKOSK A A, DANILOSKI D, D’CUNHA N M, et al.Edible packaging:Sustainable solutions and novel trends in food packaging[J].Food Research International, 2021, 140:109981.
[2] ![]() N, DJISALOV M,
N, DJISALOV M, ![]() K, et al.Antimicrobial nanoparticles and biodegradable polymer composites for active food packaging applications[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(3):2428-2454.
K, et al.Antimicrobial nanoparticles and biodegradable polymer composites for active food packaging applications[J].Comprehensive Reviews in Food Science and Food Safety, 2021, 20(3):2428-2454.
[3] ROY S, RHIM J W.Fabrication of chitosan-based functional nanocomposite films:Effect of quercetin-loaded chitosan nanoparticles[J].Food Hydrocolloids, 2021, 121:107065.
[4] JIN J, LUO B D, XUAN S M, et al.Degradable chitosan-based bioplastic packaging:Design, preparation and applications[J].International Journal of Biological Macromolecules, 2024, 266:131253.
[5] LI H Y, LIU M Z, HAN S Y, et al.Edible chitosan-based Pickering emulsion coatings:Preparation, characteristics, and application in strawberry preservation[J].International Journal of Biological Macromolecules, 2024, 264:130672.
[6] ZHAO J, WANG Y, LI J B, et al.Preparation of chitosan/Enoki mushroom foot polysaccharide composite cling film and its application in blueberry preservation[J].International Journal of Biological Macromolecules, 2023, 246:125567.
[7] CHANG L Y, XU L J, YANG Z W, et al.Antibacterial and antioxidative biogenic films for room-temperature strawberry preservation[J].Food Chemistry, 2023, 405:134893.
[8] 胡光耀. 抑制葡萄采后真菌乳酸菌的筛选及其保鲜应用[D].长沙:湖南农业大学, 2019.HU G Y.Screening and fresh-keeping application of fungal lactic acid bacteria after grape harvest[D].Changsha:Hunan Agricultural University, 2019.
[9] BUCEKOVA M, JARDEKOVA L, JURICOVA V, et al.Antibacterial activity of different blossom honeys:New findings[J].Molecules, 2019, 24(8):1573.
[10] JAWANDA I K, SAHOTA P P, MODI R.Lactic acid bacteria and their metabolites as a biopreservative in fresh produce[J].International Journal of Food and Fermentation Technology, 2020, 10(1):1-13.
[11] WANG J, SU Y J, GU L P, et al.The inhibition of cell-free supernatants of several lactic acid bacteria on the selected psychrophilic spoilage bacteria in liquid whole egg[J].Food Control, 2020(prepublish):107753.
[12] HUANG J L, SUN R L, CAO X, et al.Preservation effect of Lactobacillus plantarum O2 fermentation supernatant on postharvest pepper and its induced resistance to Phytophthora capsici[J].Plant Physiology and Biochemistry, 2023, 204:108098.
[13] GEORGE-OKAFOR U, OZOANI U, TASIE F, et al.The efficacy of cell-free supernatants from Lactobacillus plantarum Cs and Lactobacillus acidophilus ATCC 314 for the preservation of home-processed tomato-paste[J].Scientific African, 2020, 8:e00395.
[14] SHAFIPOUR YORDSHAHI A, MORADI M, TAJIK H, et al.Design and preparation of antimicrobial meat wrapping nanopaper with bacterial cellulose and postbiotics of lactic acid bacteria[J].International Journal of Food Microbiology, 2020, 321:108561.
[15] LIU W X, WANG J J, XIAO X K, et al.Antimicrobial effects and metabolomics analysis of cell-free supernatant produced by Pediococcus acidilactici LWX 401 isolated from Yunnan traditional pickles[J].LWT, 2024, 191:115626.
[16] 王嘉康, 唐浩国, 陈静, 等.壳聚糖-水飞蓟素复合保鲜涂膜的制备及其在猪肉保鲜中的应用[J].食品与发酵工业, 2024, 50 (23):202-208.WANG J K, TANG H G, CHEN J, et al.Preparation of chitosan-silymarin composite coating and its application in pork preservation[J].Food and Fermentation Industries, 2024, 50 (23):202-208.
[17] ZHOU X Y, LIU X L, WANG Q, et al.Antimicrobial and antioxidant films formed by bacterial cellulose, chitosan and tea polyphenol-shelf life extension of grass carp[J].Food Packaging and Shelf Life, 2022, 33:100866.
[18] JIANG G Y, HE K W, CHEN M R, et al.Improvement of mechanical and bioactive properties of chitosan films plasticized with novel thymol-based deep eutectic solvents[J].Food Hydrocolloids, 2025, 158:110480.
[19] ZHAO G Y, ZHOU C Y, FAN F Y.Preparation and properties of soy protein isolate/cotton-nanocrystalline cellulose films[J].International Journal of Polymer Science, 2021, 2021:5518136.
[20] 孙雪, 李新萍, 陈成, 等.改性甘蔗渣微晶纤维素特性及其对明胶膜性能的影响[J].食品与发酵工业, 2023, 49 (13):183-190. SUN X, LI X P, CHEN C, et al.Preparation and properties of modified bagasse microcrystalline cellulose/gelatin membrane[J].Food and Fermentation Industries, 2023, 49 (13):183-190.
[21] ZHAO R N, CHEN J, YU S F, et al.Active chitosan/gum Arabic-based emulsion films reinforced with thyme oil encapsulating blood orange anthocyanins:Improving multi-functionality[J].Food Hydrocolloids, 2023, 134:108094.
[22] SREEKANTH K, SHARATH K P, MIDHUN DOMINIC C D, et al.Microbial load reduction in stored raw beef meat using chitosan/starch-based active packaging films incorporated with cellulose nanofibers and cinnamon essential oil[J].Meat Science, 2024, 216:109552.
[23] YU H P, ZHOU Q, HE D, et al.Enhanced mechanical and functional properties of chitosan/polyvinyl alcohol/hydroxypropyl methylcellulose/alizarin composite film by incorporating cinnamon essential oil and tea polyphenols[J].International Journal of Biological Macromolecules, 2023, 253:126859.
[24] ZHANG L M, YU D W, GU Y L, et al.Green halochromic smart and active packaging materials based on chitosan film loading nanoparticles:Functionality, physicochemical properties and application[J].Food Hydrocolloids, 2024, 150:109667.
[25] LAOPHONGPHIT A, WICHIANSRI S, SIRIPORNADULSIL S, et al.Enhancing the nutritional value and functional properties of mango pulp via lactic acid bacteria fermentation[J].LWT, 2024, 197:115878.
[26] ZHANG A H, HAN Y, ZHOU Z J.Characterization of citric acid crosslinked chitosan/gelatin composite film with enterocin CHQS and red cabbage pigment[J].Food Hydrocolloids, 2023, 135:108144.
[27] YU K B, ZHOU L, HUANG H R, et al.The improvement of water barrier property in gelatin/carboxymethyl cellulose composite film by electrostatic interaction regulation and its application in strawberry preservation[J].Food Chemistry, 2024, 450:139352.
[28] 董俊丽, 余达威, 张利铭, 等.茶多酚对壳聚糖/肉桂醛复合膜性能及鱼肉保鲜效果比较[J].现代食品科技, 2024, 40(7):89-98.DONG J L, YU D W, ZHANG L M, et al.Effects of tea polyphenols on properties and fish preservation performance of chitosan/cinnamaldehyde composite films[J] Modern Food Science and Technology, 2024, 40(7):89-98.
[29] 闫如玉,聂圆,李梅,等.大豆油基硫醚多元醇/乙基纤维素超分子复合膜的制备与性能研究[J].西南林业大学学报(自然科学), 2024, 44 (6):158-167.YAN R Y, NIE Y, LI M, et al.Preparation and properties of soybean oil-based thioether polyol/ethylcellulose supramolecular composite films[J].Journal of Southwest Forestry University(Natural Sciences), 2024, 44 (6):158-167.
[30] GASTI T, DIXIT S, HIREMANI V D, et al.Chitosan/pullulan based films incorporated with clove essential oil loaded chitosan-ZnO hybrid nanoparticles for active food packaging[J].Carbohydrate Polymers, 2022, 277:118866.
[31] YUAN X, ZHOU Y J, WANG Y D, et al.Fabrication of Schiff-base crosslinked films modified dialdehyde starch with excellent UV-blocking and antibacterial properties for fruit preservation[J].Carbohydrate Polymers, 2024, 326:121619.
[32] LIANG F Y, LIU C S, GENG J W, et al.Chitosan-fucoidan encapsulating cinnamaldehyde composite coating films:Preparation, pH-responsive release, antibacterial activity and preservation for Litchi[J].Carbohydrate Polymers, 2024, 333:121968.
[33] DANG X G, DU Y M, WANG X C.Engineering eco-friendly and biodegradable biomass-based multifunctional antibacterial packaging films for sustainable food preservation[J].Food Chemistry, 2024, 439:138119.