氨基酸作为蛋白质的基石,人体内含有超过20种不同类型的氨基酸。一旦这些氨基酸发生细微的变动,蛋白质的构造将发生显著的转变,进一步影响人体各个器官的正常功能[1]。在众多氨基酸中,谷氨酰胺因其独特的生理作用和广泛的分布而备受关注。谷氨酰胺在人体中广泛分布于骨骼肌和血液之中,是一种含量极为丰富的游离非必需氨基酸,它不仅是氮元素的重要运输者和提供者,还在维护人体内部环境的稳定中发挥着不可或缺的作用[2]。谷氨酰胺不仅因其高含量和广泛应用而备受瞩目,分子质量达到146.15 Da,还因含量高和多功能性在营养学和医学领域具有显著地位,是一种极具特色的营养要素[3]。研究表明,谷氨酰胺可以大大增强超氧化物歧化酶和过氧化氢酶的功效,能够进一步增强机体的整体抗氧化能力,对于维护细胞健康、抵御氧化应激等方面发挥着至关重要的作用[4]。此外,谷氨酰胺不仅在增强肠上皮细胞的屏障功能方面发挥重要作用,还能促进结肠和小肠黏膜细胞的合成,从而有效抵御肠道毒素和细菌的侵袭[5]。然而,谷氨酰胺因具备较低的溶解度特性,在水溶液中易于发生水解反应,且在高温环境下倾向于转化为潜在的有毒化合物,这些固有的化学性质显著制约了其在各领域内的应用前景。谷氨酰胺肽不仅解决了谷氨酰胺溶解度低和稳定性差的难题[6-8],而且其内部的酰胺基相较于游离谷氨酰胺的酰胺基,表现出了更高的稳定性[9]。SATO等[10]从小麦谷蛋白水解物中鉴定出一种肝保护肽——PyroGlu-Leu,并通过大鼠肝炎模型实验发现PyroGlu-Leu可减轻肝炎,进而推测PyroGlu-Leu具有保肝作用。SUZUKI等[11]经过大鼠肝脏病理实验的组织学和免疫组织化学分析,发现小麦面筋水解物具有保护肝脏、防止病变的作用,其中主要成分是PyroGlu-Leu。以上研究表明功能物质本身的结构和特点会直接影响其生理功能,因此本研究对谷氨酰胺肽中的特征肽段pEQ和LQ的生物活性进行探究。经过系统的理化成分分析,本文探讨了谷氨酰胺肽消化稳定性,并建立了酒精损伤模型,探究谷氨酰胺肽对酒精损伤的GES-1细胞修复的作用,从而为将其应用于食品工业提供有力的理论支持。
1 材料与方法
1.1 材料与试剂
小麦蛋白粉(谷朊粉),冠县新瑞实业有限公司;中性蛋白酶(≥1 600 AU/g)、碱性蛋白酶(≥400 000 DU/g),杜邦丹尼斯克公司;DPPH、Fluorescein(荧光指示剂)、偶氮二异丁脒盐酸盐、分子质量标准品、胃蛋白酶(≥250 units/mg),美国Sigma公司;胰蛋白酶(≥250 NFU/mg),美国Solarbio公司;乙腈(色谱纯),美国Fisher公司;人胃黏膜上皮细胞GES-1细胞,上海冠导生物工程有限公司;肽段pEQ、LQ(纯度≥98%)由湖北强耀生物科技有限公司合成;DMEM(Dulbecco’s modified eagle medium)高糖培养基,Hyclone公司;胎牛血清,GIBCO公司;青霉素链霉素溶液、CCK-8检测试剂盒、活性氧(reactive oxygen species,ROS)检测试剂盒,碧云天生物技术有限公司;乳酸脱氢酶(lactate dehydrogenase,LDH)检测试剂盒、丙二醛(malondialdehyde,MDA)检测试剂盒、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒、谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px)检测试剂盒、谷胱甘肽(glutathione,GSH)检测试剂,南京建成生物工程研究所;其他分析纯试剂,北京化工厂。
1.2 仪器与设备
HH-501超级恒温水浴锅,常州国宇仪器制造有限公司;DHG-9075A电热恒温鼓风干燥箱,北京陆希科技有限公司;Spectra MR多功能酶标仪,美国Dynex;LC-20A高效液相色谱仪,日本SHIMADZU公司;SI-114电子天平,美国Denver Instrument公司;生物安全柜,新加坡ESCO公司;细胞培养箱,Thermo Fisher Scientific公司;Biosciences AccuriC6流式细胞仪,美国BD公司。
1.3 实验方法
1.3.1 谷氨酰胺肽的制备
通过中性和碱性蛋白酶对小麦蛋白粉(谷朊粉)进行水解。400 g谷朊粉经蒸馏水溶解并定容至4 L,以片碱或盐酸调节pH后,于52 ℃酶解5 h。酶解后,溶液经100 ℃灭活、冷却、离心分离,上清液经陶瓷膜过滤及浓缩处理,最终通过喷雾干燥法制备成谷氨酰胺肽粉末。
1.3.2 基础理化成分及氨基酸组成测定
蛋白质含量的检测按GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》执行;水分含量测定严格依据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》执行;灰分的测定遵循GB 5009.4—2016《食品安全国家标准 食品中灰分的测定》的规定;此外,对于谷氨酰胺肽的氨基酸组成分析,采用GB 5009.124—2016《食品安全国家标准 食品中氨基酸的测定》中的方法,并借助氨基酸分析仪进行深入分析。
1.3.3 分子质量分布测定
采用高效液相色谱法检测谷氨酰胺肽的分子质量分布[12]。
1.3.4 谷氨酰胺二肽高效液相色谱测定
使用高效液相色谱法测定谷氨酰胺肽的特征肽段pEQ与LQ的含量:色谱柱:Shim-pack GIST C18-AQ(5 μm,4.6 mm×250 mm)岛津上海实验器材有限公司;流动相:A为水(0.1%磷酸,体积分数);流动相:B为80%乙腈(0.1%磷酸,体积分数);色谱柱温度控制为40 ℃,流体速率为0.5 mL/min,泵的起始浓度为5%(体积分数)。采用50 μL的进样量,并采用梯度洗脱技术:开始时流动相为5%比例的B相,在30 min时流动相为89%的A相和11%的B相,在32 min时,A相的比例降低到0%,B相增加到100%;45 min时,A相升至95%,B相降至5%,流动相回到初始条件,进行下一个样品的分析。
1.3.5 体外模拟胃肠道消化实验
1.3.5.1 体外模拟胃液消化实验
将5.0 g谷氨酰胺肽与0.2 g NaCl溶于去离子水,用HCl溶液调pH值至2.0模拟胃液。加0.05 g胃蛋白酶,在37 ℃消化2 h,加热灭活酶后调pH值至7.5并定容100 mL。设空白对照,检测消化前后样品分子质量与特征肽段变化[13-15]。
1.3.5.2 体外模拟肠液消化实验
将5.0 g谷氨酰胺肽与0.68 g KH2PO4溶于去离子水,NaOH溶液调pH值至7.5,加热至37 ℃后加0.05 g胰蛋白酶消化4 h。消化毕,沸水浴灭活胰蛋白酶,冷却定容至100 mL。设空白组不加胰蛋白酶,对比检测消化前后样品的分子质量与特征肽段变化[13-15]。
1.3.6 细胞培养
将GES-1细胞置于特定的DMEM高糖培养基中,该培养基含有10%(体积分数)的胎牛血清(fetal bovine serum, FBS)和1%(体积分数)的青霉素/链霉素双抗(其中青霉素浓度为100 U/mL,链霉素质量浓度为100 μg/mL)。随后,将这些细胞置于模拟人体内部环境的细胞培养箱中,保持37 ℃的温度和5%(体积分数)的二氧化碳浓度,以促进细胞的正常生长。当细胞培养达到约80%的融合度时,用2.5 g/L的胰蛋白酶来进行消化,以便分离细胞进行后续的传代培养过程。
1.3.7 细胞毒性实验
参考并改进李明亮等[16]的研究,将GES-1细胞接种于96孔板培养24 h后,加入含不同样品(pEQ、LQ、谷氨酰胺肽)的全培养基,设置多浓度梯度。每浓度设6复孔。再培养24 h后加CCK-8试剂,37 ℃孵育1.5 h。使用酶标仪在450 nm的特定波长下测量了各孔的吸光度值。通过比较不同样品、不同浓度下细胞的吸光度值,评估样品对GES-1细胞的毒性作用。
1.3.8 酒精损伤细胞模型建立
细胞按照1×104个/mL的细胞密度接种细胞培养24 h,加入含有酒精的完全培养基,体积分数为0%~7%,以1%递增,设置6个重复孔以确保准确性。连续培养12 h后,向每个孔中加入10 μL的CCK-8试剂,在37 ℃的培养箱中继续培养1.5 h,使得CCK-8试剂能够与细胞充分反应。使用酶标仪在450 nm的特定波长下测量了各孔的吸光度值。最后,收集细胞培养的上清液,并利用LDH检测试剂盒测量其中LDH活力。
1.3.9 谷氨酰胺肽及pEQ、LQ对细胞活力的影响
基于上述细胞损伤模型,将细胞试验分为3组,即空白组(仅使用培养基)、模型组(4%体积分数乙醇处理)和实验组(在细胞被4%乙醇处理损伤后加入含有谷氨酰胺肽和pEQ、LQ的培养基)。将不同质量浓度的谷氨酰胺肽(200、800 μg/mL)和pEQ、LQ(30、60 μg/mL)加入到经4%乙醇处理的GES-1细胞中孵育12 h,孵育结束后用CCK-8法检测细胞活力。
1.3.10 细胞损伤与ROS含量检测
以5×105个/mL的细胞密度均匀地注射入6孔板,在经过24 h的培养后,除了对照组及模拟组,其他组的细胞均接受谷氨酰胺肽及特征肽段pEQ和LQ的预处理,继续培养24 h,预处理完成后,除了对照组之外,所有的组别都根据预定的酒精浓度进行12 h的处理培养后,通过ROS荧光探针对细胞进行标记,并将其收集起来。接着,通过流式细胞仪计数,各组别的细胞浓度被精确地调整到了相同的水平。然后在96孔黑板上接种,用荧光酶标仪检测细胞荧光强度,以激发/发射波长488/525 nm为条件。
1.3.11 细胞氧化应激检测
细胞按照5×105个/mL的密度接种到6孔板中,按上述的相同方法处理,处理后用放射免疫沉淀实验(radio immunoprecipitation assay,RIPA)裂解液(放射免疫共沉淀法测定)进行裂解处理,以释放细胞内成分,通过离心收集上清液。对上清液行了全面的生化分析,检测了其中MDA的含量、SOD活力,以及GSH和GSH-Px的含量。评估细胞在特定处理条件下的氧化应激状态及抗氧化能力。
1.4 数据分析
通过应用Origin 2021统计软件将所有的实验结果转换为“平均值±标准差”的形式呈现,为确保准确度,每个实验至少进行3次,运用Tukey’s算法来评估不同样本之间的差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 谷氨酰胺肽的基础理化指标及氨基酸组成分析
在谷氨酰胺肽中,其总蛋白质含量显著,比例高达95.84%(质量分数),谷氨酰胺的比例占26.3%(质量分数),而其他成分的含量则相对较低。具体来说,水分占2.72%(质量分数),灰分占2.31%(质量分数)。表明,谷氨酰胺肽富含高质量的蛋白质,因此,它被视为一种优质的蛋白质来源。
由表1可知,谷氨酰胺肽含有17种氨基酸,其中7种为人体必需氨基酸,2种为半必需氨基酸(组氨酸、精氨酸)。在总氨基酸(total amino acid,TAA)中,必需氨基酸的比例为21.56%(质量分数),而在非必需氨基酸(non-essential amino acid,NEAA)中,EAA的比例为78.44%(质量分数)。谷氨酰胺肽的氨基酸结构十分丰富,其中谷氨酸的比例更为突出,所占比例最高。研究表明,谷氨酰胺不仅可提供人体必需的营养,并且在修复胃肠黏膜组织、促进蛋白合成以及防止肌肉分解等方面扮演着重要作用[17]。
表1 谷氨酰胺肽的氨基酸组成 单位:g/100 g
Table 1 Amino acid composition of glutamine peptides
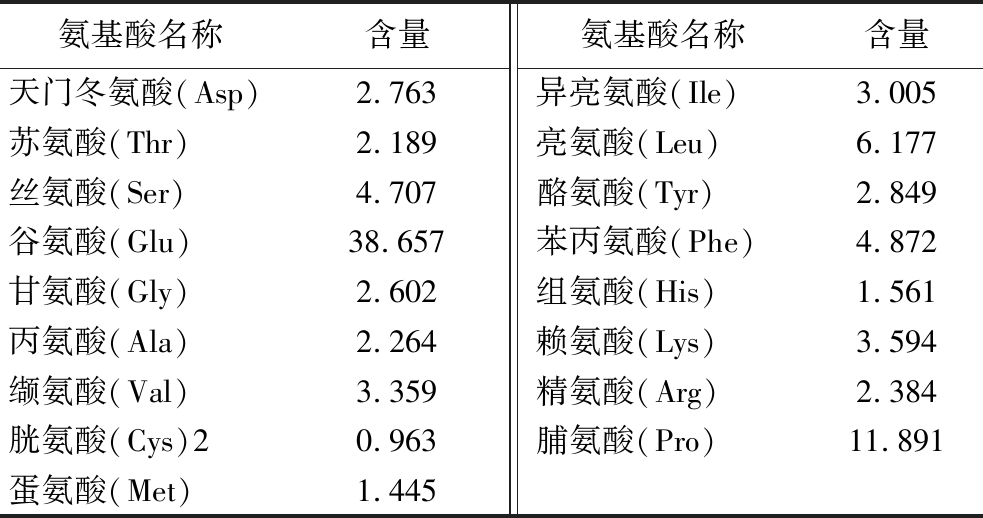
氨基酸名称含量氨基酸名称含量天门冬氨酸(Asp)2.763 异亮氨酸(Ile)3.005 苏氨酸(Thr)2.189 亮氨酸(Leu)6.177 丝氨酸(Ser)4.707 酪氨酸(Tyr)2.849 谷氨酸(Glu)38.657 苯丙氨酸(Phe)4.872 甘氨酸(Gly)2.602 组氨酸(His)1.561 丙氨酸(Ala)2.264 赖氨酸(Lys)3.594 缬氨酸(Val)3.359 精氨酸(Arg)2.384 胱氨酸(Cys)20.963 脯氨酸(Pro)11.891 蛋氨酸(Met)1.445
2.2 谷氨酰胺肽消化前后的分子质量分布
根据表2的数据,谷氨酰胺肽的分子质量分布主要集中在132~1 000 Da,占总体的比例超过70%,该分子质量分布表明了其具有水溶性,使得其能够在水环境中均匀分散,同时也确保了其优异的消化吸收性能,易于被机体吸收利用[17]。谷氨酰胺肽通常由2~10个氨基酸的短链构成。经过胃蛋白酶和胰蛋白酶的作用,分子质量的分布没有出现明显的变化,而是保持稳定的水平。进一步分析分子质量1 000 U以下的组分时,经过胃蛋白酶的单独消化处理,这些组分的分子质量占比的变化均在0.5%以内。这一结果表明,在分子质量低于1 000 U的范围内,谷氨酰胺肽对胃蛋白酶的分解作用展现出极高的抗性,仅有极少部分被分解;分子质量在1 000 U以下范围内的组分,经胰蛋白酶消化后的比例变化不超过1.5%。
表2 不同处理的谷氨酰胺肽的分子质量分布
Table 2 Molecular weight distribution of glutamine peptides under different treatments
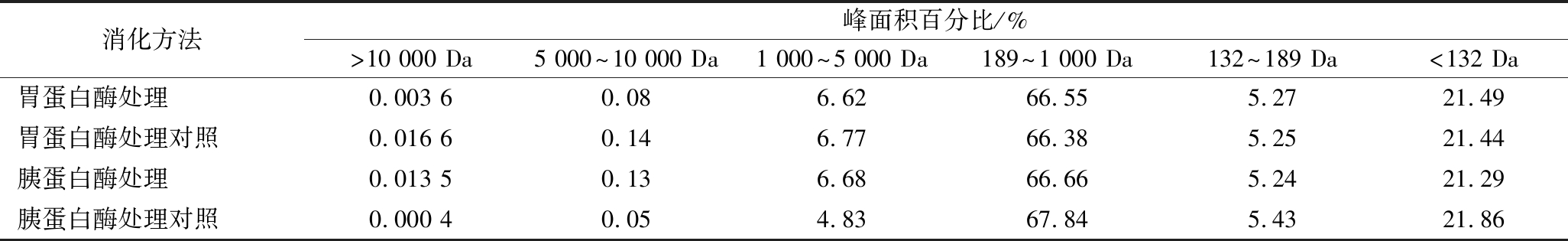
消化方法峰面积百分比/%>10 000 Da5 000^10 000 Da1 000^5 000 Da189^1 000 Da132^189 Da<132 Da胃蛋白酶处理0.003 6 0.08 6.6266.55 5.27 21.49 胃蛋白酶处理对照0.016 6 0.14 6.7766.38 5.25 21.44 胰蛋白酶处理0.013 5 0.13 6.6866.66 5.24 21.29 胰蛋白酶处理对照0.000 4 0.05 4.8367.84 5.43 21.86
由表3可知,胃蛋白酶和胰蛋白酶消化后,谷氨酰胺肽的特征肽段含量变化幅度不大,与对照组比较,均无明显变化。由此看出,谷氨酰胺肽的特征肽段对胃蛋白酶和胰蛋白酶消化均具有稳定性,基本不受蛋白酶作用影响,显示出极小变化。因此,谷氨酰胺肽的肽段pEQ和LQ是能在消化后保持一定抗氧化活性的物质。由此看出,谷氨酰胺肽具有较强的抗消化能力,其中的肽段基本不受蛋白酶作用的影响,进一步解释了谷氨酰胺肽消化后活性得以保持的原因。
表3 pEQ和LQ模拟体外消化结果 单位:g/100 mL
Table 3 Results of pEQ and LQ simulated digestion in vitro

肽段谷氨酰胺肽谷氨酰胺肽和胃蛋白酶处理谷氨酰胺肽和胃蛋白酶对照谷氨酰胺肽和胰蛋白酶处理谷氨酰胺肽和胰蛋白酶对照pEQ2.06 0.15 0.19 0.21 0.22LQ1.81 0.15 0.17 0.17 0.22
2.3 细胞毒性检测
细胞存活率的检测结果如图1所示,通过CCK-8实验测定细胞存活率,谷氨酰胺肽的质量浓度为1 000、2 000 μg/mL时,细胞存活率有显著性差异,其余各质量浓度样本均无明显差异。本研究选用谷氨酰胺肽的质量浓度为200、800 μg/mL(记为谷200、谷800),标准肽段选用30、60 μg/mL 2个质量浓度进行后续的实验(分别记为pEQ30、pEQ60、LQ30、LQ60)。
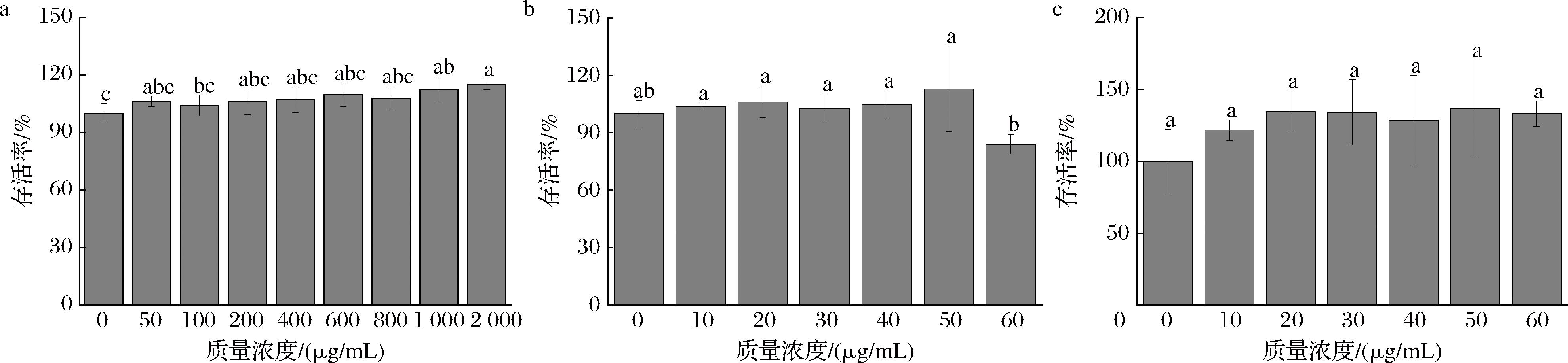
a-谷氨酰胺肽组;b-肽段pEQ组;c-肽段LQ组
图1 样品对GES-1细胞存活率的影响
Fig.1 Effect of samples on the survival rate of GES-1 cells
注:不同小写字母之间存在显著性差异(P<0.05),相同小写字母表示无显著性差异(P>0.05)(下同)。
2.4 细胞损伤模型建立
乙醇对于黏膜组织具有破坏力,若长时间接触胃黏膜上皮细胞,会产生2个显著的危害:首先,乙醇具有强烈的腐蚀性,能够直接穿透并破坏上皮细胞表层的黏液屏障,这一过程不仅直接刺激胃黏膜,还促使胃液分泌增多,从而加剧了胃黏膜的损害程度。其次,乙醇具有脱水性质,能够深入胃黏膜细胞内部,导致细胞失水,同时会伴随着细胞结构的改变,甚至引发细胞的变性和死亡[18]。鉴于乙醇的腐蚀性和脱水性,以乙醇作为诱导剂,以模拟和研究胃黏膜损伤的过程,是一种较为普遍的实验方法。
在正常情况下,LDH被严格限制在细胞内部。然而,一旦细胞受到损伤,其细胞膜的通透性会随之发生变化,这时LDH便会突破细胞膜的屏障,从受损的细胞中泄露出来[19]。由图2可知,在乙醇体积分数升至4%时,GES-1细胞的存活率明显下降,并且伴随着细胞释放的LDH量的大幅增加,因此选择以体积分数4%的乙醇体积分数对GES-1细胞进行12 h的处理,以构建相应的细胞损伤模型。
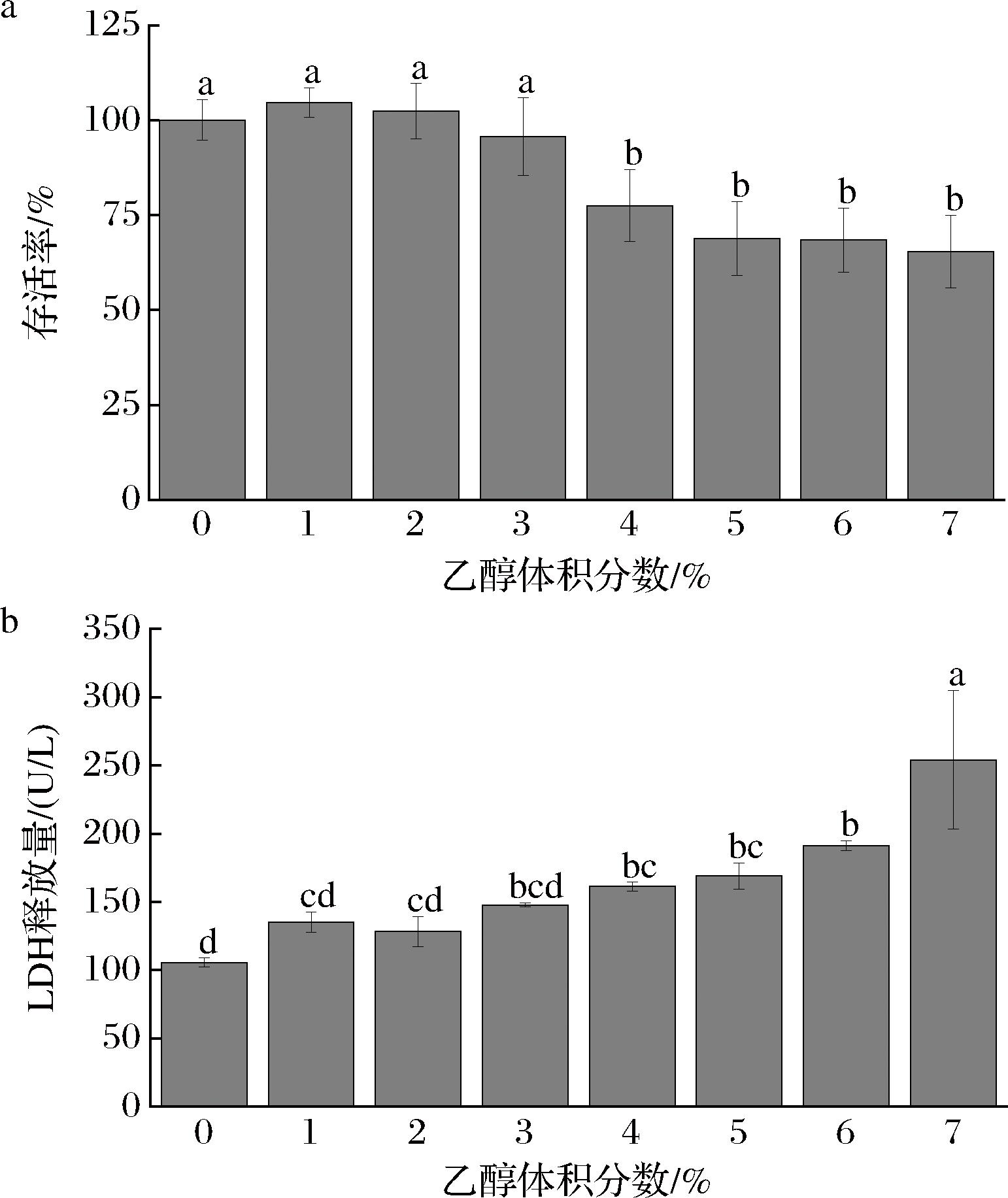
a-细胞存活率;b-细胞培养液上清液中LDH活力
图2 细胞存活率和细胞培养上清液中LDH活力
Fig.2 Cell survival rate and LDH activity in cell culture supernatant
2.5 谷氨酰胺肽和肽段对乙醇损伤GES-1细胞的保护作用
用4%乙醇处理GES-1细胞12 h后,使用不同浓度的谷氨酰胺肽和肽段处理GES-1细胞12 h,结果如图3所示。与模型组相比,谷氨酰胺肽和肽段显著改善了乙醇诱导的细胞活性降低的趋势,说明谷氨酰胺肽和肽段pEQ和LQ对乙醇损伤的GES-1细胞具有良好的保护作用。
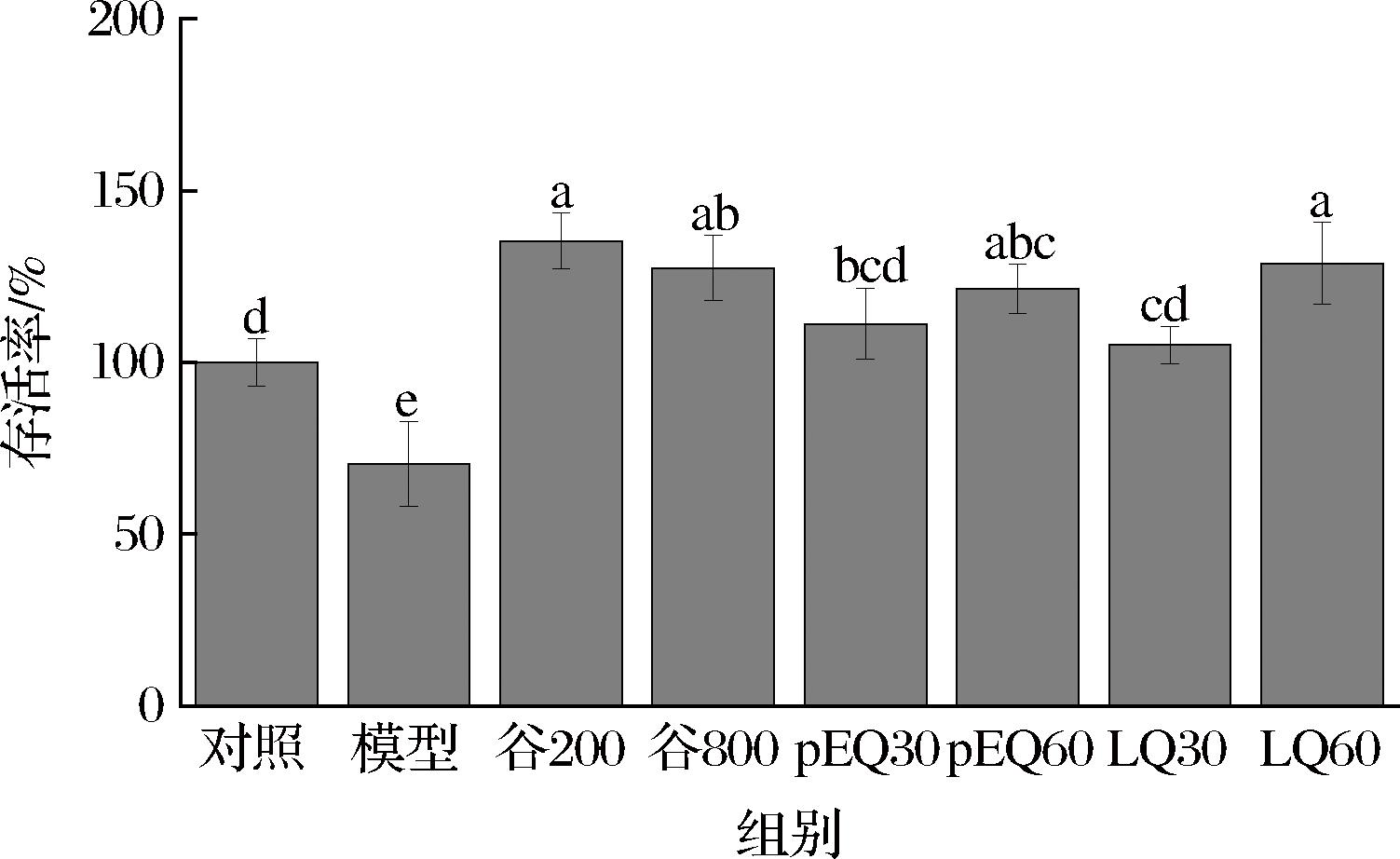
图3 谷氨酰胺肽和肽段对乙醇导GES-1细胞活力的影响
Fig.3 Effects of glutamine peptides and peptide segments on the viability of GES-1 cells induced by ethanol
2.6 谷氨酰胺肽和肽段对乙醇损伤GES-1细胞内ROS清除效果的影响
当细胞面临氧化应激时,内部ROS的蓄积量会明显上升。ROS在此过程中激活了一系列对氧化还原反应敏感的信号通路,这些通路进而触发了细胞内的炎症反应,作为细胞应对环境压力的一种机制;但同时,作为氧化应激的直接产物,ROS也可以通过多种机制诱导细胞走向凋亡,即细胞的程序性死亡,这是细胞在严重受损时的一种自我保护性反应[20]。因此,细胞内ROS含量的水平高低,能够直接体现细胞损伤的程度。如图4所示,经乙醇处理后细胞ROS含量显著增加,GES-1细胞ROS含量在谷氨酰胺肽及肽段干预后均有不同程度下降,呈浓度依赖性,较pEQ、LQ而言,高浓度的谷氨酰胺肽的清除效果更佳。
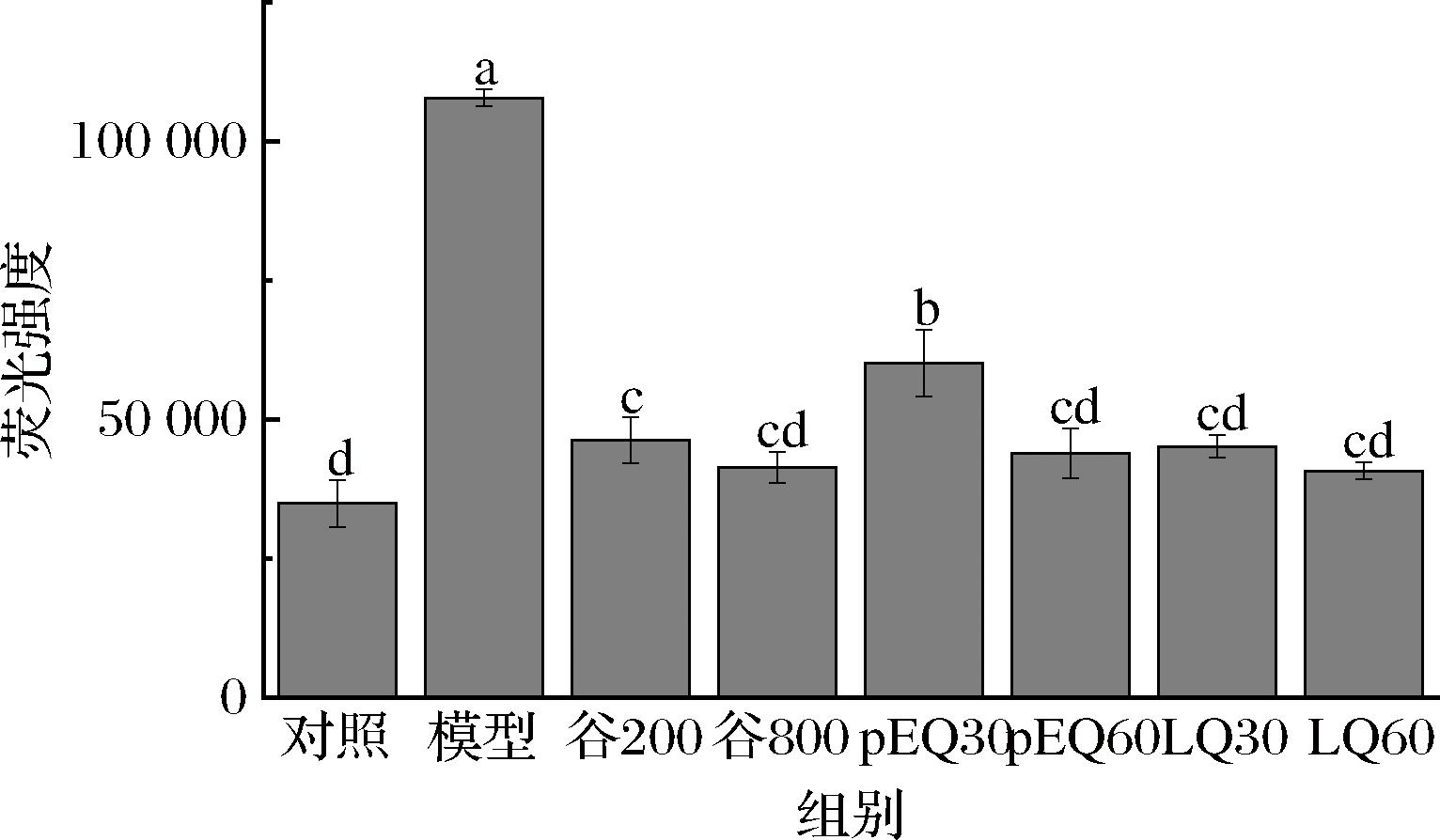
图4 谷氨酰胺肽和肽段对GES-1细胞内ROS含量的影响
Fig.4 Effects of glutamine peptide and peptide segment on ROS content in GES-1 cells
2.7 谷氨酰胺肽和肽段对乙醇损伤GES-1细胞内MDA的影响
当ROS水平增加时,其能够透过损伤细胞的生物膜来引发多不饱和脂肪酸的过氧化反应[21],不仅破坏了细胞的结构和功能,同时产生了MDA等物质。MDA是一种具有潜在致癌性的物质,能够极大地危害人类的健康[22]。以MDA含量作为量化标准,可以间接评估身体细胞遭受自由基侵害的程度,从而精准反映体内脂质过氧化水平的状况[23]。如图5所示,乙醇处理使细胞内MDA含量明显增加,GES-1细胞经谷氨酰胺肽和pEQ、LQ肽段介入后,MDA含量均有不同程度的下降,呈浓度依赖性,且LQ降低MDA量的效果好于pEQ。
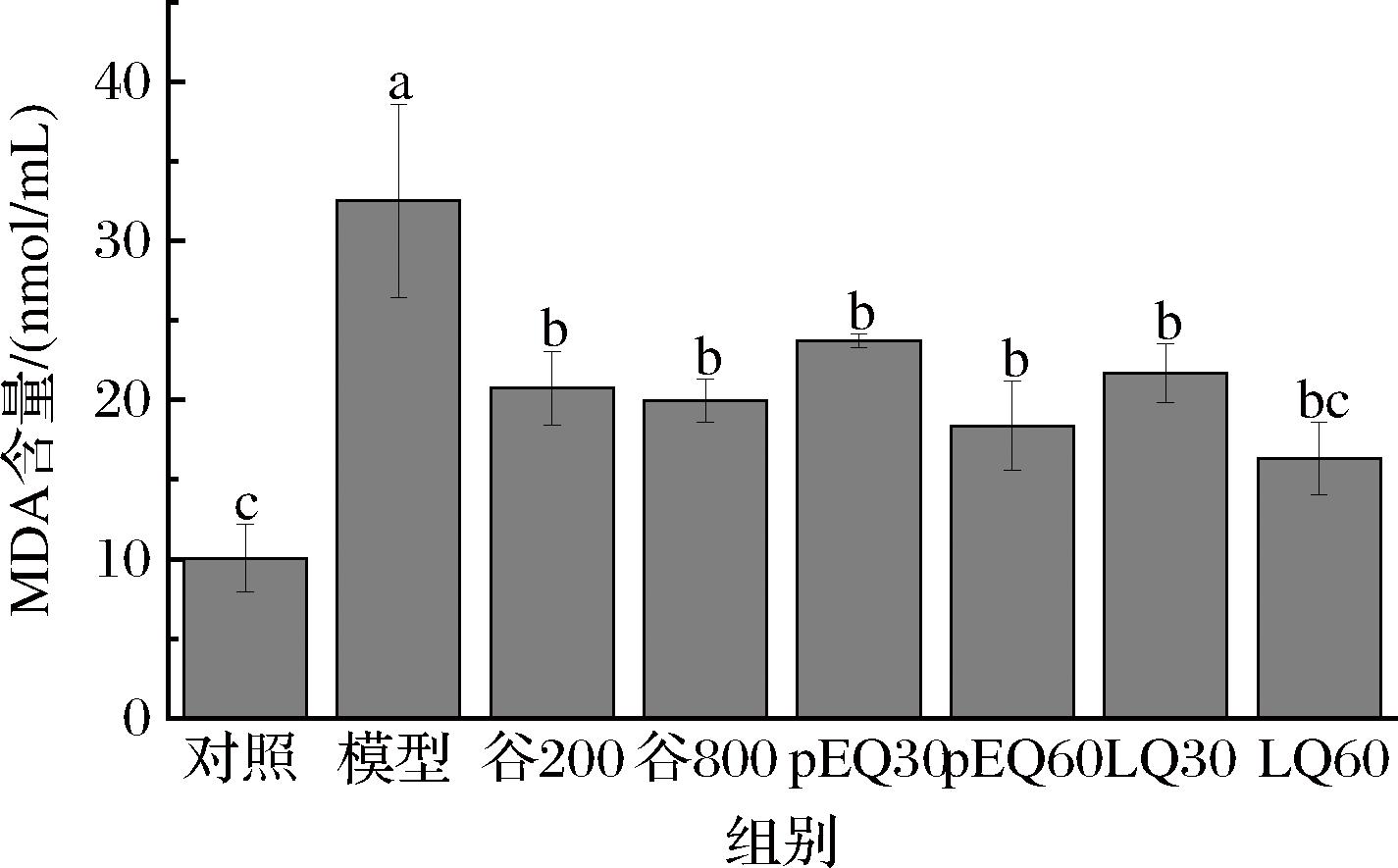
图5 谷氨酰胺肽和肽段对GES-1细胞内MDA含量的影响
Fig.5 Effects of glutamine peptide and peptide segment on MDA content in GES-1 cells
2.8 谷氨酰胺肽和肽段对乙醇损伤GES-1细胞内SOD活力的影响
SOD在细胞中起到关键的作用,负责消除氧化代谢过程中产生的ROS,从而防止ROS对细胞造成损害[24]。细胞内SOD活力的强弱可以作为衡量细胞清除自由基能力的一个间接指标,反映出细胞对氧化应激的应对能力。如图6所示,乙醇损伤后的GES-1细胞呈现出显著的SOD活力下降趋势,与对照组相比存在显著差异(P<0.01)。谷氨酰胺肽与特征肽段能够在不同程度上提升细胞内的SOD活力。除了LQ肽段外,其余肽段及谷氨酰胺肽的增强效果随着其浓度的提升而更加显著。其中,pEQ肽段在提升SOD活力方面效果最好,其效果甚至优于高浓度的谷氨酰胺肽。
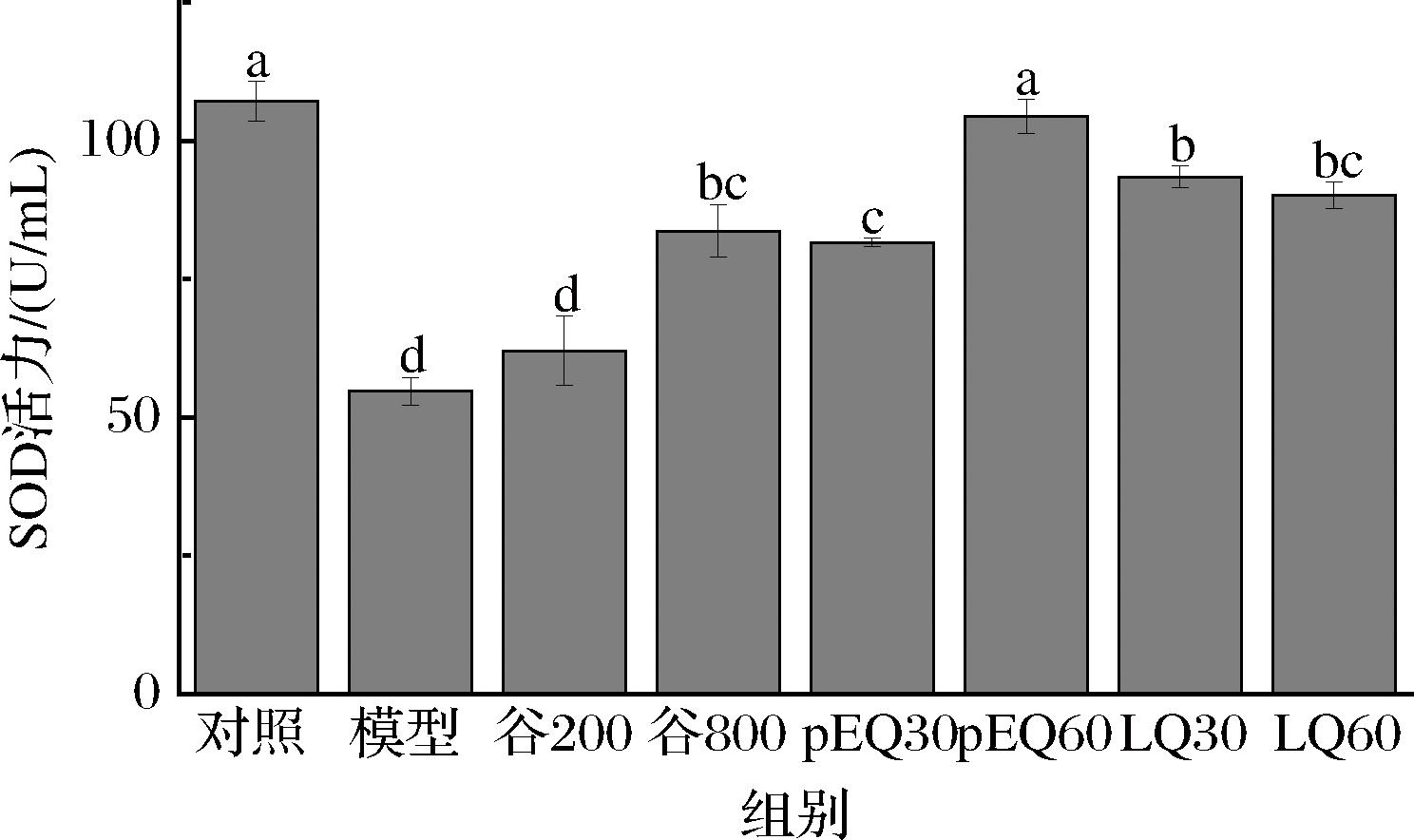
图6 谷氨酰胺肽和肽段对GES-1细胞内SOD活力的影响
Fig.6 Effect of glutamine peptide and peptide segment on SOD activity in GES-1 cells
2.9 谷氨酰胺肽和肽段对乙醇损伤GES-1细胞内GSH和GSH-Px含量的影响
GSH是一种强效的抗氧化物质,可以有效地消灭自由基,保护人体免受损害。GSH结合自由基、重金属等有毒物质,再通过代谢途径排出体内,可将这些体内有害毒素转化为无害的形态[25]。此外,作为一种关键酶,在机体中广泛分布的GSH-Px对过氧化物的降解十分关键。GSH-Px的活力中心具有将GSH催化变为GSSG的能力。这一过程将潜在的致病性过氧化物转变为安全的羟基化合物,从而保护细胞的正常生理机制,并减少它们可能带来的损伤[26]。结果如图7所示,与对照相比,GES-1细胞经酒精损伤处理后,其GSH和GSH-Px含量均显著降低(P<0.05),经过不同质量浓度的谷氨酰胺肽(200 μg/mL、800 μg/mL)以及pEQ、LQ等肽段干预后,细胞中GSH和GSH-Px的含量有所提高,其中谷氨酰胺肽的促进效果最优,与其质量浓度高有一定关系。
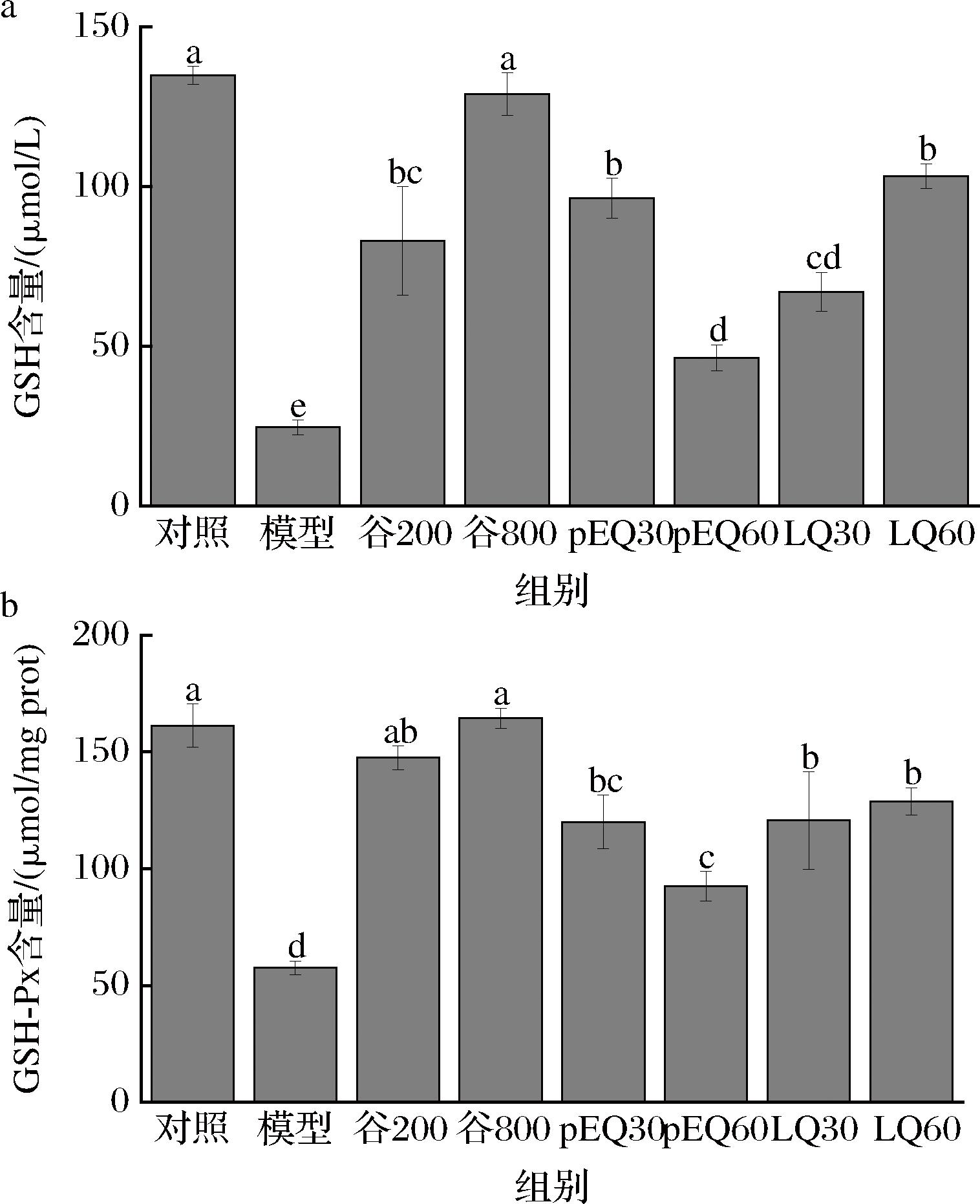
a-GSH含量;b-GSH-Px含量
图7 谷氨酰胺肽和肽段对GES-1细胞内GSH和 GSH-Px含量的影响
Fig.7 Effects of glutamine peptide and peptide segment on GSH and GSH-Px contents in GES-1 cells
综上说明,谷氨酰胺肽和含有谷氨酰胺的二肽可以有效提高细胞内GSH和GSH-Px水平,改善酒精造成的胃黏膜损伤。
3 结论
有研究表明以N端封闭的肽段形式存在的肽段可抵抗外切酶的消化。EJIMA等[27]分析了玉米蛋白水解物和小麦蛋白水解物的抗消化性能,在人体摄入水解物后观察发现人体血液中PyroGlu-Pro、PyroGlu-Leu-Pro和PyroGlu-Gln-Pro等含有焦谷氨酸的肽段含量显著增加,进一步证明了N端为焦谷氨酰可以以完整的肽段形式被人体吸收进入血液系统,进而发挥潜在的生物活性功能。支链氨基酸是指亮氨酸(Leu)、异亮氨酸(Ile)和缬氨酸(Val),不仅是体内糖异生过程的关键底物,参与调控糖代谢并有效供给能量[28],还因其独特的生理效应,在促进酒精代谢、缓解醉酒状态及保护肝脏健康方面展现出显著效果[29]。谷氨酰胺肽富含这些支链氨基酸,从而强化了其对于糖代谢调节、能量供给及肝脏保护功能的基础与效果。
在模拟体外胃肠道消化环境的实验中,发现谷氨酰胺肽中分子质量小于1 000 U的始终保持在90%的高水平,且各分子质量区间的变化均不显著,分子质量在1000 U以下的组分,经消化后的比例变化均不超过1.5%。这一结果充分证明了其消化稳定性。表明当谷氨酰胺肽被人体摄入后,它能够耐受胃肠道中胃蛋白酶和胰蛋白酶的消化作用,这表明谷氨酰胺肽可以在人体内保持其原有的生理活性,从而发挥其潜在的生物功效。
构建以人胃黏膜上皮细胞GES-1为基础的体外模型,以模拟酒精性胃黏膜损伤。通过细致评估细胞内的氧化应激状态,以及相关损伤标志物的变化,本研究深入探讨了谷氨酰胺肽及二肽pEQ、LQ在提高GES-1细胞对酒精性损伤抵抗能力方面的潜在作用。实验结果显示,当GES-1细胞经4%(体积分数)的乙醇处理后,细胞内的ROS水平和MDA含量显著上升,这标志着氧化应激的加剧;同时,SOD的活力以及GSH和GSH-Px的含量则显著下降,反映出细胞抗氧化防御系统的受损。经过不同质量浓度的谷氨酰胺肽以及pEQ、LQ肽段干预后,ROS含量、MDA含量均有不同程度下降,且呈浓度依赖;而SOD活力、GSH和GSH-Px含量均有所提高。实验数据表明,酒精引起的细胞氧化应激在一定程度上被谷氨酰胺肽和二肽pEQ和LQ所降低,从而降低了细胞损伤。谷氨酰胺肽及其衍生的二肽pEQ、LQ在提升胃黏膜上皮细胞对抗酒精诱导损伤的能力上展现出卓越效果,预示着其在作为功能性食品成分,用以增强机体对酒精伤害的防御机制方面,具有极其广阔的发展前景和巨大的应用潜力。这些肽类物质不仅能够有效减轻酒精对胃黏膜上皮细胞的损害,还能促进细胞的抗氧化反应,从而保护胃黏膜健康,为开发新型护胃保健产品提供了新的思路与方向。谷氨酰胺肽及二肽pEQ、LQ在提升胃黏膜上皮细胞对抗酒精诱导损伤的能力上展现出优越的效果,表明它们在作为功能性食品成分,用以增强机体对酒精伤害的防御机制方面,具有极其广阔的发展前景和巨大的应用潜力。谷氨酰胺肽不仅能够有效减轻酒精对胃黏膜上皮细胞的损害,还能促进细胞的抗氧化反应,从而保护胃黏膜健康,为开发新型护胃保健产品提供了新的思路与方向。
[1] CRUZAT V F, PANTALE O L C, DONATO J Jr, et al.Oral supplementations with free and dipeptide forms of L-glutamine in endotoxemic mice:Effects on muscle glutamine-glutathione axis and heat shock proteins[J].The Journal of Nutritional Biochemistry,2014,25(3):345-352.
O L C, DONATO J Jr, et al.Oral supplementations with free and dipeptide forms of L-glutamine in endotoxemic mice:Effects on muscle glutamine-glutathione axis and heat shock proteins[J].The Journal of Nutritional Biochemistry,2014,25(3):345-352.
[2] RUI C R, NEWSHOLME P, MARZUCA-NASSR G N, et al.Regulatory principles in metabolism-then and now[J].The Biochemical Journal,2016,473(13):1845-1857.
[3] 栗芳军.谷氨酰对胃癌术后肠道炎症恢复及免疫状况影响的研究[D].开封:河南大学,2013.LI F J.A study on the effects of glutamine on intestinal inflammation recovery and immune status after gastric cancer surgery [D].Kaifeng:Henan University, 2013.
[4] YU H B, GAO Q F, DONG S L, et al.Regulation of dietary glutamine on the growth, intestinal function, immunity and antioxidant capacity of sea cucumber Apostichopus japonicus (Selenka)[J].Fish &Shellfish Immunology,2016,50:56-65.
[5] 陈思思.谷氨酰胺肽的制备及其性质的研究[D].无锡:江南大学,2014.CHEN S S.Study on preparation and properties of glutamine peptide [D].Wuxi:Jiangnan University, 2014.
[6] 张丽.谷氨酰胺活性肽的制备及性质研究[D].合肥:合肥工业大学,2009.ZHANG L.Preparation and properties of glutamine-derived bioactive peptides [D].Hefei:Hefei University of Technology, 2009.
[7] 郑燕斌,董娜,单安山.谷氨酰胺二肽生物学功能及在动物营养中的应用[J].动物营养学报,2011,23(8):1264-1268.ZHENG Y B, DONG N, SHAN A S.Glutamine dipeptides:Biological function and its application in animal production[J].Chinese Journal of Animal Nutrition, 2011, 23(8):1264-1268.
[8] 任国谱,李玉英,谷文英.“条件必需氨基酸:Gln”生理功能的研究进展及应用现状[J].氨基酸和生物资源,2001,23(4):39-43.REN G P, LI Y Y, GU W Y.Advancement in physiological function of gln:A conditionally essential amino acid and its use in nutrition[J] Amino Acids &Biotic Resources, 2001, 23(4):39-43.
[9] ABUMRAD N N, MORSE E L, LOCHS H, et al.Possible sources of glutamine for parenteral nutrition:Impact on glutamine metabolism[J].The American Journal of Physiology,1989,257(2 Pt1):E228-E234.
[10] SATO K, EGASHIRA Y, ONO S, et al.Identification of a hepatoprotective peptide in wheat gluten hydrolysate against D-galactosamine-induced acute hepatitis in rats[J].Journal of Agricultural and Food Chemistry, 2013, 61(26):6304-6310.
[11] SUZUKI Y, ASANO M, SATO K, et al.Wheat gluten hydrolysate alters the progress of hepatic pathology induced by prolonged carbon tetrachl oride administration in rat[J].Biomedical Research,2011,22(1):481-488.
[12] 林峰,马勇,徐亚光,等.基于分子质量分布的食源性低聚肽品质评价[J].食品与发酵工业,2008,34(9):128-131.LIN F, MA Y, XU Y G, et al.Study on the quality evaluation of food-derived oligopeptides based on the molecular weight distribution[J].Food and Fermentation Industries, 2008, 34(9):128-131.
[13] 刘文颖, 谷瑞增, 林峰, 等.海洋骨胶原低聚肽钙配合物的稳定性[J].食品工业科技, 2015, 36(4):111-115.LIU W Y, GU R Z, LIN F, et al.Stability of calcium-chelating marine bone collagen oligopeptides[J].Science and Technology of Food Industry, 2015, 36(4):111-115.
[14] 赵荣, 张英雪, 单春乔, 等.酶解对豆粕营养成分及体外消化率的影响[J].粮食与饲料工业, 2019(1):41-43.ZHAO R, ZHANG Y X, SHAN C Q, et al.Effects of enzymatic hydrolysis on nutritional components and digestibility of soybean meal[J].Cereal &Feed Industry, 2019(1):41-43.
[15] 冯晓文, 赵晓涵, 潘骁琦, 等.体外模拟消化对海洋鱼骨胶原低聚肽结构和抗氧化活性的影响[J].食品与发酵工业, 2022,48(5):173-179.FENG X W, ZHAO X H, PAN X Q, et al.The effect of simulated digestion in vitro on structure and antioxidant activity of marine fish bone collagen oligopeptides[J].Food and Fermentation Industries, 2022, 48(5):173-179.
[16] 李明亮,许锦珍,冯志远,等.二肽AQ、SQ和IQ增强GES-1细胞对酒精损伤的抵抗能力[J].食品与发酵工业,2023,49(6):143-148.LI M L, XU J Z, FENG Z Y, et al.Enhancement of dipeptides AQ, SQ, and IQ on the resistance of GES-1 cells to alcohol damage[J].Food and Fermentation Industries, 2023, 49(6):143-148.
[17] 方磊,李诒光,陈亮,等.小麦低聚肽营养成分和特征功能肽段研究[J].食品与发酵工业,2023,49(11):178-182.FANG L, LI Y G, CHEN L, et al.Study on nutritional components and characteristic functional peptides of wheat oligopeptides[J].Food and Fermentation Industries, 2023, 49(11):178-182.
[18] 秦书敏.黄芪甲苷对乙醇诱导的大鼠胃黏膜损伤的保护作用及机制研究[D].广州:广州中医药大学,2017.QIN S M.Protective effects and mechanisms of astragaloside Ⅳ on ethanol-induced gastric mucosal injury in rats [D].Guangzhou:Guangzhou University of Chinese Medicine, 2017.
[19] 凌空,张铭晧,高丽辉,等.体外模拟消化对小麦低聚肽抗氧化活性影响[J].食品工业,2021,42(4):82-86.LING K, ZHANG M H, GAO L H, et al.Effect on the antioxidant activity of wheat oligopeptides after in vitro digestion[J].The Food Industry, 2021, 42(4):82-86.
[20] 朱艳,李明亮,张瑞雪,等.自主研发复合低聚肽对乙醇损伤的GES-1细胞修复作用的研究[J].食品科技,2020,45(05):24-30.ZHU Y, LI M L, ZHANG R X, et al.Study on the cytoprotection of combined oligopeptide on ethanol-induced GES-1 cells damage[J].Food Science and Technology, 2020, 45(5):24-30.
[21] FISKUM G, ROSENTHAL R E, VERECZKI V, et al.Protection against ischemic brain injury by inhibition of mitochondrial oxidative stress.[J].Journal of Bioenergetics and Biomembranes,2004,36(4):347-352.
[22] 方磊,郭颖,朱艳,等.紫苏籽肽及其协同硒解酒护肝作用研究[J].食品科技,2020,45(7):216-222.FANG L, GUO Y, ZHU Y, et al.Study on Perilla seed peptide and its synergistic effect on selenium-relieving wine[J].Food Science and Technology, 2020, 45(7):216-222.
[23] 朱向东,王燕,何兰娟,等.四神丸对溃疡性结肠炎模型大鼠结肠组织Toll样受体2、4表达的影响[J].中国中医药信息杂志,2016,23(10):67-71.ZHU X D, WANG Y, HE L J, et al.Effects of Sishen pills on expressions of TLR-2 and TLR-4 of colonic tissue in rats with ulcerative colitis[J].Chinese Journal of Information on Traditional Chinese Medicine, 2016, 23(10):67-71.
[24] 阳丹,蔡舒,彭成海,等.老香黄多糖的分离纯化及其体外胃黏膜保护活性研究[J].食品工业科技,2023,44(19):440-448.YANG D, CAI S, PENG C H, et al.Studies on isolation, purification and gastric mucosal protective activity in vitro of Laoxianghuang polysaccharide[J].Science and Technology of Food Industry, 2023, 44(19):440-448.
[25] YONG Y, ZHANG C F, GU Z J, et al.Polyoxometalate-based radiosensitization platform for treating hypoxic tumors by attenuating radioresistance and enhancing radiation response.[J].ACS Nano,2017,11(7):7164-7176.
[26] 孙跃博,罗瑞卿,陈洁,等.中药对围产期奶牛血液免疫及抗氧化活性指标的影响[J].西北农业学报,2015,24(11):18-23.SUN Y B, LUO R Q, CHEN J, et al.Effects of traditional Chinese medicine on the hematogenic immunity and antioxidant activity of perinatal cows[J].Acta Agriculturae Boreali-Occidentalis Sinica, 2015, 24(11):18-23.
[27] EJIMA A, NAKAMURA M, SUZUKI Y A, et al.Identification of food-derived peptides in human blood after ingestion of corn and wheat gluten hydrolysates[J].Journal of Food Bioactives,2018:104-111.
[28] 李剑锋. 富含支链氨基酸的氨基酸配方对胃肠外科手术创伤患者的营养支持效果研究[J]. 名医, 2018(9):236.LI J F. Effect of the formula of amino acid enriched branch chain amino acid on nutritional support in postoperative traumatic patients[J]. Renowned Doctor, 2018(9):236.
[29] 蒋竹青.玉米高F值寡肽的制备及生理功能研究[D].济南:济南大学,2015.JIANG Z Q.Preparation and physiological function of high F-value oligopeptides from corn [D].Jinan:University of Jinan, 2015.