近年来,肉制品加工产业发展迅速,其中,牛肉饼产品因其营养丰富、加工便捷及口感风味俱佳颇受餐饮产业及消费者青睐[1]。但由于其含有大量水分、蛋白质和脂肪,极易滋生腐败微生物,造成品质下降,因此选取恰当的保鲜方法至关重要。目前牛肉饼主要还是以冷冻方式贮藏,需借助冷链运输与销售[2]。低温可以抑制微生物和酶的活性,延长产品保质期。但在冷链过程中不可避免出现由温度波动造成的反复冷冻-解冻(冻融),导致冰晶重结晶产生不规则大冰晶,对产品细胞和组织结构造成机械损伤[3]。这也造成产品出现不可逆的保水性降低、质地劣变和风味丧失,同时伴随着蛋白脂质氧化,使解冻后的冷冻产品质量显著下降,降低消费者对产品的接受度[4]。
添加抗冻剂被认为是解决这一产业化问题的有效途径[5]。常见抗冻剂包括蔗糖、山梨糖醇和磷酸盐类因价格低廉、稳定性高被广泛使用,但使用后产生的风味改变和健康隐患随消费品质的升级被大众抵触,人们更倾向于寻求天然健康、低热量的抗冻剂[2]。胶原抗冻肽(collagen antifreeze peptides,CAFP)源于动物皮、骨中的胶原,安全性高,且具有非依数性降低水的冰点、抑制冰晶重结晶和修饰冰晶形态等特性,最大限度降低冻结和冻融对冷冻食品组织的破坏,保持产品质地和营养品质[6]。目前,已有研究将CAFP添加到冷冻鱼糜[7]、虾肉[8]和冰淇淋[9]等产品中,发现其能最大限度地降低冻融损伤且延缓氧化。然而,将CAFP应用于肉饼产品的研究却鲜有报道。
基于此,本研究制备了一种来源于牛皮的CAFP,并对其活性进行表征,后以不同添加量(0%、2%、4%,质量分数)混入牛肉饼中,通过周期性冻融循环模拟极端环境来探究CAFP对贮藏过程中牛肉饼保水性、冻结特性、颜色、质地和氧化反应(蛋白质氧化和脂质氧化)的影响,以期明确CAFP对反复冻融牛肉饼的保护效果,旨在为天然抗冻剂研发和冷冻产品品质保持提供参考。
1 材料与方法
1.1 材料与试剂
牛皮、牛背最长肌及牛胸口脂肪,购自甘肃张掖祁连牧歌实业公司,选取6头30月龄、平均体重450 kg的健康西门塔尔牛,按GB/T 19477—2018《畜禽屠宰操作规程 牛》屠宰,收集所需材料于冷链贮运箱中4 h内运回实验室处理。牛皮胶原蛋白由实验室制备。食品级胃蛋白酶、碱性蛋白酶,河南中晨生物科技有限公司;过氧化氢酶,上海毕得医药科技股份有限公司。此外,本研究中使用的所有试剂均为分析级。
1.2 仪器与设备
LGJ-12A V真空冻干机,北京四环启航科技有限公司;SDC-200S接触角测量仪,晟鼎精密仪器有限公司;Discovery X3差示热量扫描仪,美国TA仪器公司;S-433D全自动氨基酸分析仪,德国Sykam公司;CR-10色度仪,日本Konica Minolta公司;PHB 4便携酸度计,南京科环分析仪器有限公司;TA-XT2 Express质构仪,英国Stable Micro Systems公司;K1160全自动凯氏定氮仪,山东海能科学仪器有限公司。
1.3 实验方法
1.3.1 CAFP的制备
牛皮胶原的提取:将脱毛脱脂后的牛皮切成小块,取10 g加入100 mL 0.5 mol/L的乙酸溶液中浸泡24 h后匀浆。加入等体积 0.5 mol/L的乙酸溶液稀释匀浆液,再添加4%(质量分数)胃蛋白酶酶解12 h,4 000 r/min离心20 min,取上清液。加入NaCl并缓慢搅拌使絮状胶原析出,收集胶原溶于0.5 mol/L的乙酸溶液中,在蒸馏水中透析48 h后冻干备用。以上操作均在4 ℃下进行。
CAFP的制备:以过氧化氢酶保护活性为指标进行CAFP制备工艺优化,得到最佳工艺为:将3 g冻干胶原溶于100 mL去离子水中,调节溶液pH值至9.0,加入4%(质量分数)的碱性蛋白酶,在50 ℃下以300 r/min速度磁搅酶解4 h,所得酶解液沸水浴15 min灭酶,冷却后8 000 r/min离心15 min,取上清液加入截留分子质量为3 kDa的超滤离心管中,5 000 r/min离心20 min,收集小于3 kDa的部分冻干备用。
1.3.2 牛肉饼的制作及冻融实验设计
按质量比9∶1称取牛背最长肌和脂肪,加入10%(质量分数)冰水和2%(质量分数)的食盐后绞碎,将所得肉馅等分,分别加入0%、2%和4%的CAFP,0%添加量组为对照组记为CK,搅拌均匀后4 ℃静置2 h,称取(55±0.2) g肉馅于圆形模具中,制成直径为7.2 cm,厚度为1 cm的牛肉饼,取部分作为新鲜样品直接测定相应指标,剩余样品在-24 ℃冰箱中速冻塑型6 h后单独包装在聚乙烯袋中,取出0次冻融样品用于指标测定,随后对肉饼进行冻融循环:牛肉饼在-18 ℃下冷冻保存7 d,随后取出在4 ℃下解冻24 h,即为完成1次冻融循环,留出待测样品后剩余样品继续进行3、5、7次冻融循环,按冻融次数取样用于后续分析。
1.3.3 CAFP活性表征
1.3.3.1 过氧化氢酶低温保护活性测定
参考CAO等[8]的方法并略作修改。将2 mg/mL CAFP溶液与1 mg/mL过氧化氢酶溶液等体积混合,混合溶液先在-24 ℃下冷冻24 h,然后在25 ℃下解冻,再于-24 ℃下冷冻6 h,进行4次冻融。测定冻融前后过氧化氢酶活,以过氧化氢酶残余活性表示。
过氧化氢酶活性测定:在石英比色皿中加入1.9 mL蒸馏水、0.1 mL过氧化氢稀释酶液和1 mL 体积分数1%的过氧化氢稀释液,盖上盖子立即摇匀,测定波长240 nm下初始吸光值,而后间隔1 min记录吸光值,共计时4 min,以1 min内A240减少0.1为1个酶活性单位(U)。过氧化氢酶活性和残余活性的计算分别如公式(1)、公式(2)所示:
过氧化氢酶活性![]()
(1)
过氧化氢酶残余活性![]()
(2)
1.3.3.2 热滞活性(thermal hysteresis, THA)测定
参考CAO等[10]的方法并略作修改,采用差示扫描量热法(differential scanning calorimetry,DSC)分析THA,以无热滞活性的牛血清白蛋白(bovine serum albumin,BSA)为对照。取10 mg/mL的CAFP溶液10 μL于坩埚中,先以5 ℃/min的速度降温至-20 ℃保持2 min,然后以相同的速率升温至-6 ℃后,以1 ℃/min的速率升温至样品部分熔融状态保持5 min,此温度为保留温度(Th),然后以1 ℃/min的速率冷却至-20 ℃,记录初始结晶温度(T0),THA计算如公式(3)所示:
THA=Th-T0
(3)
1.3.3.3 水接触角测定
参考袁志承等[11]的方法,CAFP压制成片剂状,置于载物台上,在表面滴加5 μL超纯水,记录超纯水与胶原肽片剂接触角。
1.3.3.4 氨基酸测定
氨基酸测定按ZHANG等[12]的程序进行。测试前CAFP需在6 mol/L盐酸中水解24 h,使用A300自动氨基酸分析仪测定,检测波长分别设置为570 nm和440 nm。
1.3.4 牛肉饼冻结融化特性测定
参考FU等[2]的方法用DSC测定新鲜牛肉饼的冷冻和融化特性。取10 mg样品于坩埚中,先以10 ℃/min的速度降温至-40 ℃保持5 min,然后以相同的速率升温至20 ℃。
1.3.5 牛肉饼水分分布测定
参考LI等[13]的方法用低场核磁共振(low field nuclear magnetic resonance,LF-NMR)测定新鲜牛肉饼和冻融7次后牛肉饼中的水分分布和迁移。将2 g样品放入直径12 mm、1.5 mL的样品管中密封。通过核磁共振结合卡尔-帕塞尔-梅布利-吉尔脉冲序列得到样品的横向弛豫时间。主要参数为:数据增益3,重复时间1 000 ms,回波时间0.2 ms,回波数4 000,扫描次数16次。
1.3.6 牛肉饼保水性测定
1.3.6.1 解冻损失
分别称取解冻前(m1)和解冻后(m2)牛肉饼的质量。解冻损失计算如公式(4)所示:
解冻损失![]()
(4)
1.3.6.2 离心损失
称取5 g样品包入滤纸中放入离心管内,2 000×g离心10 min,称取离心前(m3)和离心后(m4)样品质量。离心损失计算如公式(5)所示:
离心损失![]()
(5)
1.3.6.3 蒸煮损失
参考FRANGOPOULOS等[14]的方法并略作修改,取30 g牛肉饼样品于50 mL离心管中,2 000 r/min离心2 min排气,后将离心管置于80 ℃水浴锅中煮至内部温度达72 ℃,取出于冷水中冷却5 min,取出样品擦干表面水分称重,记录蒸煮前(m5)和离心后(m6)样品质量。蒸煮损失计算如公式(6)所示:
蒸煮损失![]()
(6)
1.3.7 牛肉饼pH测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》进行测定。
1.3.8 牛肉饼色度测定
使用色度仪测量牛肉饼的L*、a*、b*值,随机采点测定5次,取平均值。
1.3.9 牛肉饼挥发性盐基氮(total volatile basic nitrogen,TVB-N)测定
参照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》。
1.3.10 牛肉饼过氧化值(peroxide value,POV)测定
参照GB 5009.227—2016《食品安全国家标准食品中过氧化值的测定》。
1.3.11 牛肉饼硫代巴比妥酸反应物(thiobarbituric acid reactive substances,TBARS)值测定
参照GB 5009.181—2016《食品安全国家标准 食品中丙二醛的测定》。
1.3.12 牛肉饼质构测定
煮制牛肉饼样品冷却后室温平衡30 min,使用圆柱形取样器制备样品(直径1.2 cm,高1 cm)进行质构测定。选用P/50探头,设置测前和测中速率2 mm/s,测后速率5 mm/s,触发力5 g,压缩比为50%的应变,每组重复测定6次。
1.3.13 牛肉饼微观构象观察
参考ZOU等[15]的方法并略作修改。将肉饼切成1 cm×1 cm×1.5 cm方块,在4%(体积分数)多聚甲醛中固定,之后在不同体积分数的乙醇中逐渐脱水,石蜡包埋,在苏木精-伊红染色后通过显微镜进行组织学观察。
1.4 统计分析
上述指标至少重复测定3次,结果以“平均值±标准差”表示。采用SPSS 23软件进行统计学分析,P<0.05表示具有统计学差异。使用Origin 2021软件绘制图形。
2 结果与分析
2.1 CAFP活性表征
抗冻肽的THA可反映其非依数降低溶液冰点的能力。如图1-A所示,CAFP的THA达到1.92 ℃,BSA未出现热滞现象,且CAFP结晶峰出现明显延迟。CAFP的THA高于凡纳滨对虾头自溶物(1.82 ℃)和鲢鱼肉水解物(0.87 ℃),但低于牦牛皮胶原水解物(4.21 ℃)[16-18],说明陆生动物源胶原肽具有替代海洋生物抗冻肽的潜力,且与生存环境具有较高相关性。
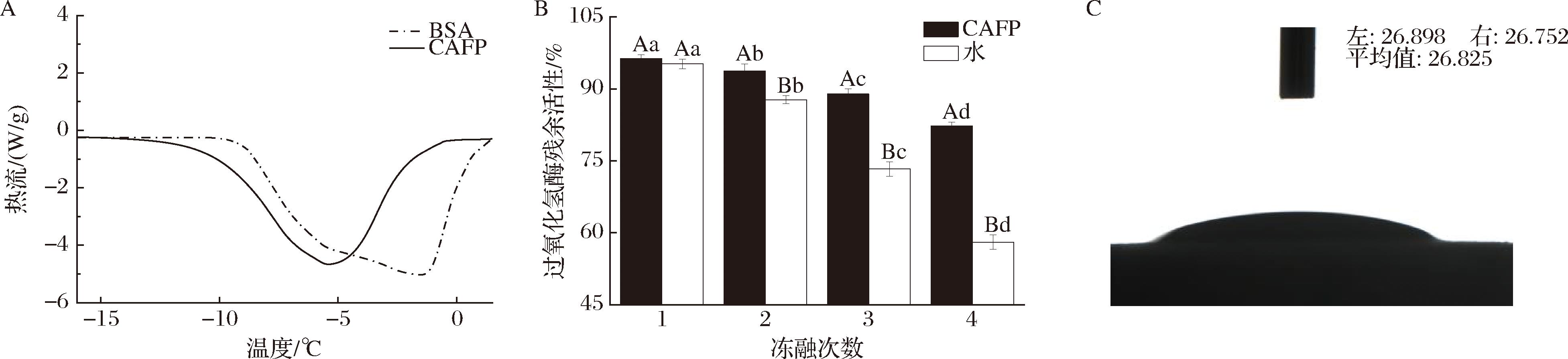
A-热滞活性;B-过氧化氢酶低温保护活性;C-接触角
图1 胶原抗冻肽的活性表征
Fig.1 Activity characterization of collagen antifreeze peptides
注:不同大写字母表示组间(不同处理组)差异显著(P<0.05),不同小写字母表示组内(不同冻融次数)差异显著(P<0.05)(下同)。
如图1-B所示,过氧化氢酶活性随冻融次数增加而降低,冻融2次后CAFP组与纯水组过氧化氢酶残余活性出现显著性差异(P<0.05),且随冻融次数增多,4次后CAFP组过氧化氢酶残余活性为82.27%,较纯水组高24.22%。相同浓度下的猪皮明胶抗冻肽保护活性仅提高21.8%,显示出CAFP具有良好的抗冻潜力[19]。
接触角用于表征物质的水亲和性,如图1-C所示,CAFP接触角为26.86°,显示出极强的亲水性,有利于抗冻肽与水分子结合发挥抗冻作用。抗冻肽的抗冻活性及亲水性与氨基酸组成密切相关[20]。如表1所示,CAFP氨基酸总量为90.04 g/100 g,甘氨酸(Gla)、脯氨酸(Pro)及丙氨酸(Ala)是与抗冻活性密切相关的特征性氨基酸[21],含量分别为22.03 g/100 g、14.62 g/100 g和11.82 g/100 g,这与CAFP良好的抗冻活性相印证。此外,CAFP中极性氨基酸含量高于非极性氨基酸,意味着CAFP有大量亲水性氨基酸残基位点与冰晶结合形成氢键,依附于冰晶表面,阻碍冰晶生长[12]。此外,Pro和Ala等非极性氨基酸在维持氢键稳定以及通过疏水阻碍水分子接近冰晶方面发挥着积极作用,极性与非极性氨基酸协同作用实现抗冻[22]。
表1 CAFP的氨基酸组成
Table 1 Amino acid content of CAFP
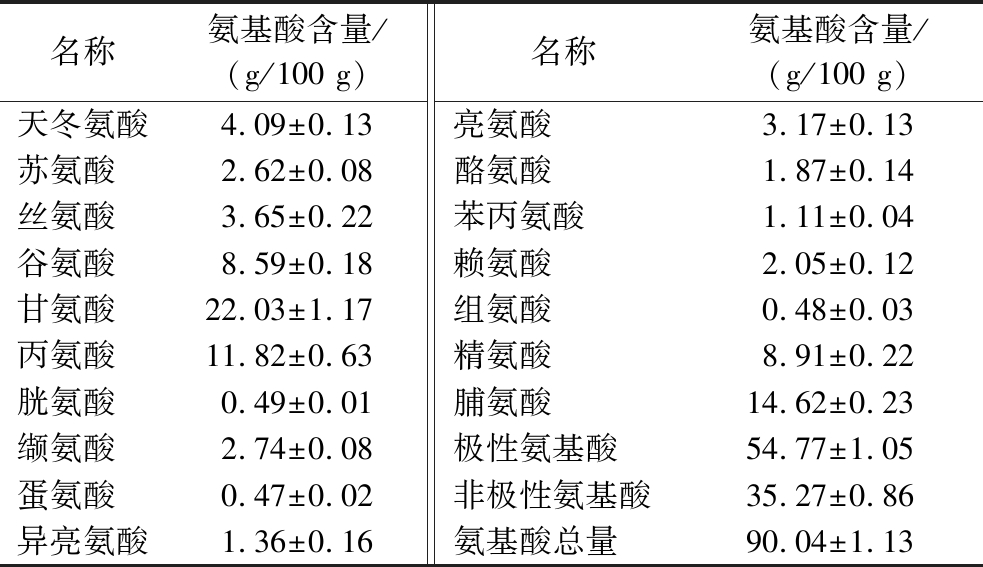
名称氨基酸含量/(g/100 g)名称氨基酸含量/(g/100 g)天冬氨酸4.09±0.13亮氨酸3.17±0.13苏氨酸 2.62±0.08酪氨酸1.87±0.14丝氨酸 3.65±0.22苯丙氨酸1.11±0.04谷氨酸 8.59±0.18赖氨酸2.05±0.12甘氨酸 22.03±1.17组氨酸0.48±0.03丙氨酸 11.82±0.63精氨酸8.91±0.22胱氨酸 0.49±0.01脯氨酸14.62±0.23缬氨酸 2.74±0.08极性氨基酸54.77±1.05蛋氨酸 0.47±0.02非极性氨基酸35.27±0.86异亮氨酸1.36±0.16氨基酸总量90.04±1.13
2.2 CAFP对牛肉饼冻结融化特性的影响
本研究运用DSC模拟研究新鲜牛肉饼的冻融过程。如图2-A、图2-B所示,当温度低于-11.68 ℃时,CK组牛肉饼最早出现放热结晶峰,添加2% CAFP和4%CAFP组牛肉饼放热结晶峰分别出现在-13.37、-14.46 ℃,表明CAFP的添加能有效降低牛肉饼中水分冰点,但牛肉饼的融点无显著变化。同时,CAFP的添加降低了结晶峰和融化峰的焓值,表示牛肉饼冻结和解冻速度更快,牛肉饼内部形成冰晶更加细小均匀[23]。张灵芝[24]发现甘露低聚糖能有效降低鱼糜冰点并减少冻结所需潜热,使鱼糜能快速通过最大冰晶形成区,生成细小均匀的冰晶,这与本研究结果一致。值得注意的是,FU等[2]研究显示,虽然金针菇多糖的添加加速了牛肉饼的冻结,但降低了牛肉饼的融化温度,这种差异可能与CAFP特殊的热滞效应相关。

A-冻结曲线;B-融化曲线;C-弛豫时间;D-水峰面积;E-牛肉饼苏木精-伊红染色图
图2 牛肉饼冻结融化特性、水分分布及组织结构
Fig.2 Freezing and thawing characteristics, water distribution, and organization structure of beef patties
2.3 CAFP对反复冻融牛肉饼水分分布的影响
低场核磁共振是一种精准快速地检测食品中水分分布与迁移的光谱技术[25]。横向弛豫时间(T2)反映食品组织中的水分含量和结合状态。由图2-C可知,牛肉饼的弛豫图像中可观察到4个水峰,其中,T2在0.1~10 ms的峰代表结合水(T2b),0.1~1 ms为强结合水(T2b1),1~10 ms为弱结合水(T2b2);10~100 ms的峰代表不易流动水(T21);100~1 000 ms范围峰代表自由水(T22)[26]。不易流动水和自由水的峰面积如图2-D所示。与鲜样相比,冻融7次后各组样品的T21延迟且P21下降,其中CK组变化最为显著,说明反复冻融促进了牛肉饼中不易流动水向自由水的转化。王芊彤[27]在冷冻牛肉贮藏中也观察到T21延迟现象。可能是冰晶造成的机械损伤导致原本处于细胞中的水分在解冻后渗出,水分自由度和流动性提升[2]。CAFP的添加明显减缓了这种变化,尤其是4% CAFP,这说明CAFP的添加可增强大分子与水结合体系的稳定性[28]。冻融后牛肉饼T2b和P2b的轻微改变可能是反复冻融对肌细胞组织结构的破坏及蛋白氧化变性所致,而结合水本身较为稳定,迁移率较低[4]。新鲜样品的自由水含量极低,其随着反复冻融由不易流动水转化产生,并逐渐增多,研究显示冻融7次后CK组牛肉饼的自由水含量略低于试验组。FU等[2]发现反复冻融过程中牛肉饼的水分从肌原纤维蛋白内部逐渐迁移到肌原纤维间隙中,而后迁移到肉饼表面逐渐丧失。这说明水分转变为自由水后的流失可能是CK组牛肉饼自由水含量低的原因,WANG等[25]也观察到牛肉在冻融后出现了类似变化。而CAFP的添加使牛肉饼中保留了更多的不易流动水和自由水,重组抗冻蛋白[29]和金针菇多糖[2]也表现出类似的性质,原因可能是CAFP和水分子的羟基形成氢键,使水分子更牢固地结合在肌肉组织中,同时抑制肌原纤维蛋白(myofibrillar protein,MP)氧化变性和聚集,维持MP网络结构,增大牛肉饼保水性[16, 30]。
2.4 CAFP对冻融牛肉饼组织形态的影响
如图2-E所示,冻融0次的牛肉饼肌纤维组织结构较完整,排列整齐,间隔较小,经过7次冻融后,各组肌纤维组织结构松散、间隔增大、孔隙增多。这可能是由于反复冻融中大量冰晶多次生成挤压相邻肌纤维,破坏了牛肉饼完整结构[31]。CK组肌细胞破坏严重,出现组织溶解、内容物泄出,细胞间存在较大间隔,肉饼组织结构损伤严重;2%CAFP组肌细胞形态相对完整,但细胞间出现较大间隔;4%CAFP组肌细胞完整且细胞间隔较小,肉饼组织结构保持较为完好,表明CAFP抑制冰晶的生长和重结晶降低了反复冻融过程中肌细胞损伤,维持牛肉饼组织形态,且呈现浓度依赖性。WANG等[4]的研究发现抗冻蛋白也可减轻反复冻融对肉品组织结构的破坏。
2.5 CAFP对反复冻融牛肉饼色度和pH的影响
牛肉饼的pH如图3-A所示,随冻融次数的增加,牛肉饼pH呈下降趋势,7次冻融后CK、2%CAFP和4%CAFP组pH值分别为5.43、5.51和5.56。pH的降低可能是冻融导致脂肪氧化酸败和磷酸化酶激活糖酵解引起的[24]。RAHMAN等[32]也发现冻融会导致牛肉pH下降。但CAFP的下降趋势低于CK组,且4%CAFP组在3次冻融循环后与对照组出现显著性差异(P<0.05),这可能是由于CAFP抑制了牛肉饼中蛋白和脂质氧化的发生,减少脂肪酸、氨基酸的生成,维持了蛋白缓冲体系稳定,延缓了pH的下降[32]。
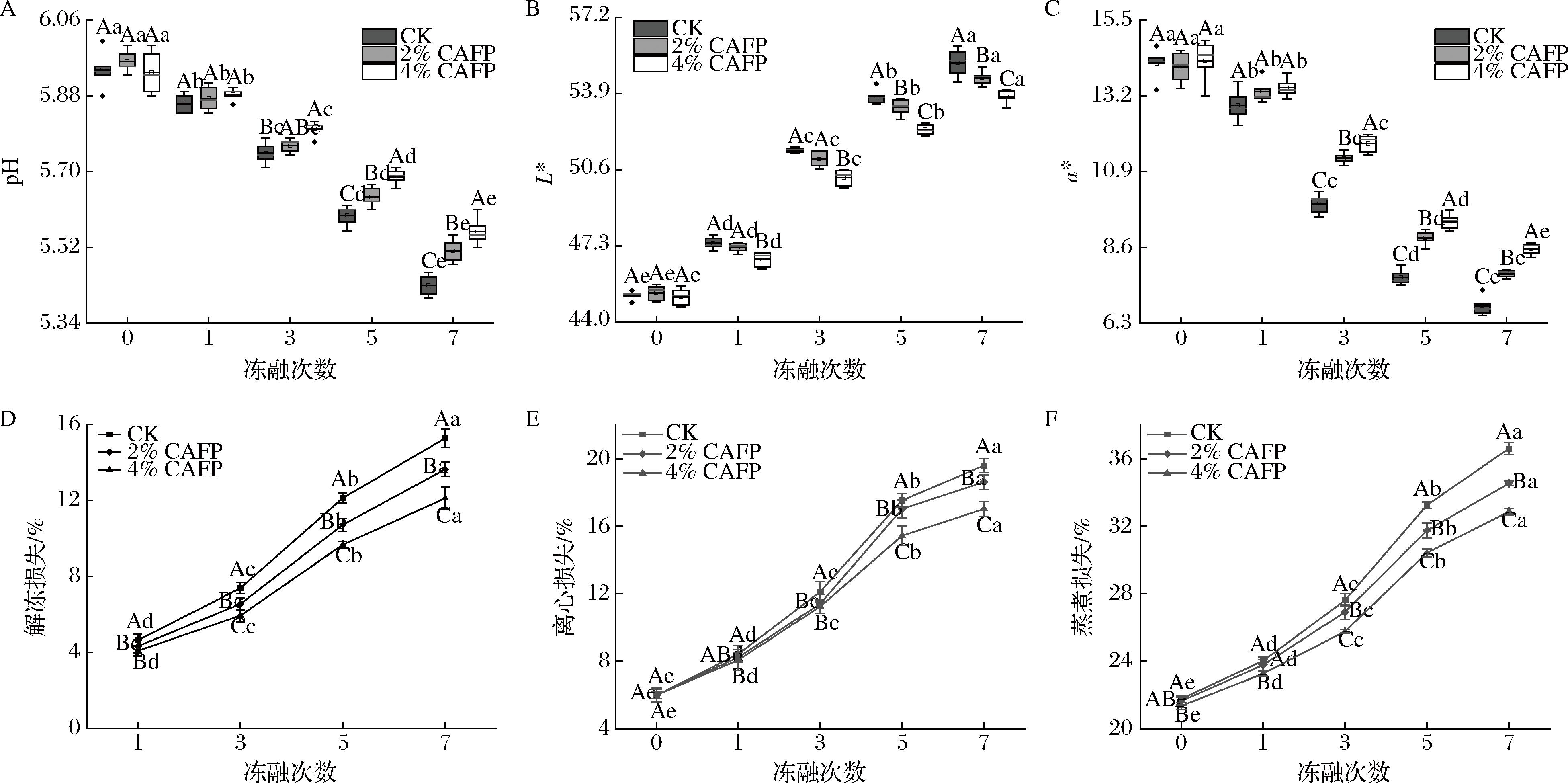
A-pH;B-L*;C-a*;D-解冻损失;E-离心损失;F-蒸煮损失
图3 牛肉饼pH、色度及保水性
Fig.3 pH, color, and water holding capacity of beef patties
牛肉饼的L*值和a*值如图3-B、图3-C所示,随冻融次数增多,L*值升高,a*值降低,且在3次冻融后,实验组L*值和a*值与CK组出现显著性差异(P<0.05),7次冻融后4%CAFP组L*值和a*值分别为53.77和8.56。L*值的上升可能与水分渗出导致肉饼光反射率增加及脂质氧化有关,而a*值的下降可能是冻融过程中肌红蛋白变性和高铁肌红蛋白的形成所致[33-34]。CAFP通过抑制冰晶的生长和重结晶,保护肌肉组织细胞完整性,抑制蛋白及脂质氧化的发生,提高了牛肉饼的颜色稳定性。KONG等[35]也称抗冻肽可最大限度地减少樱桃的冻融损伤和色泽劣变,与本研究结果一致。
2.6 CAFP对反复冻融牛肉饼保水性的影响
保水性反映牛肉饼保留自身水分和额外水分的能力。如图3-D、图3-E、图3-F所示,随冻融次数增多牛肉饼的解冻损失、烹饪损失和离心损失显著增加(P<0.05)。这可能是由于冻融循环中肉饼的组织结构因冰晶生长和重结晶而受到破坏,冰晶挤压肌原纤维,破坏细胞膜并改变细胞内部结构,同时引发MP氧化聚集,导致牛肉饼持水力的下降[28]。本研究与WANG等[4]和LI等[36]的研究结果中冻融和冷冻导致牛肉和猪肉饼保水性降低结果一致。添加CAFP较好地维持了牛肉饼的持水能力,4%CAFP组在第1次冻融后的保水性显著优于对照组(P<0.05),且随冻融次数增多,冻融7次后4%CAFP组牛肉饼解冻损失、离心损失和蒸煮损失分别为12.11%、17.03%和32.87%,而CK组为15.27%、19.60%和36.61%。主要是CAFP降低牛肉饼冰点,提升冻结速率,形成细小均匀的冰晶,组织结构破坏程度低;此外CAFP与MP相互作用抑制氧化,维持MP网络结构,水结合能力提升[30]。
2.7 CAFP对反复冻融牛肉饼质地的影响
质构特性直接反映牛肉饼的食用品质。表2展示了反复冻融过程中牛肉饼硬度、弹性和回复性的变化,结果显示硬度随反复冻融次数增加先上升后下降,在冻融1次后上升,而后显著下降(P<0.05),弹性和回复性随冻融次数增加显著降低(P<0.05),这主要是反复冻融中冰晶破坏牛肉饼组织结构,使其汁液流失加重、MP降解[37],与本研究前期观察到肌肉组织结构变化和水分迁移具有一致性。此外,蛋白和脂质氧化也可能影响牛肉饼的质地[25]。添加CAFP较好地维持了牛肉饼的质构,冻融7次后4%CAFP组硬度、弹性和回复性分别较CK组高2.40 N、0.115、0.058。
表2 牛肉饼的质构特性
Table 2 Texture of beef patties
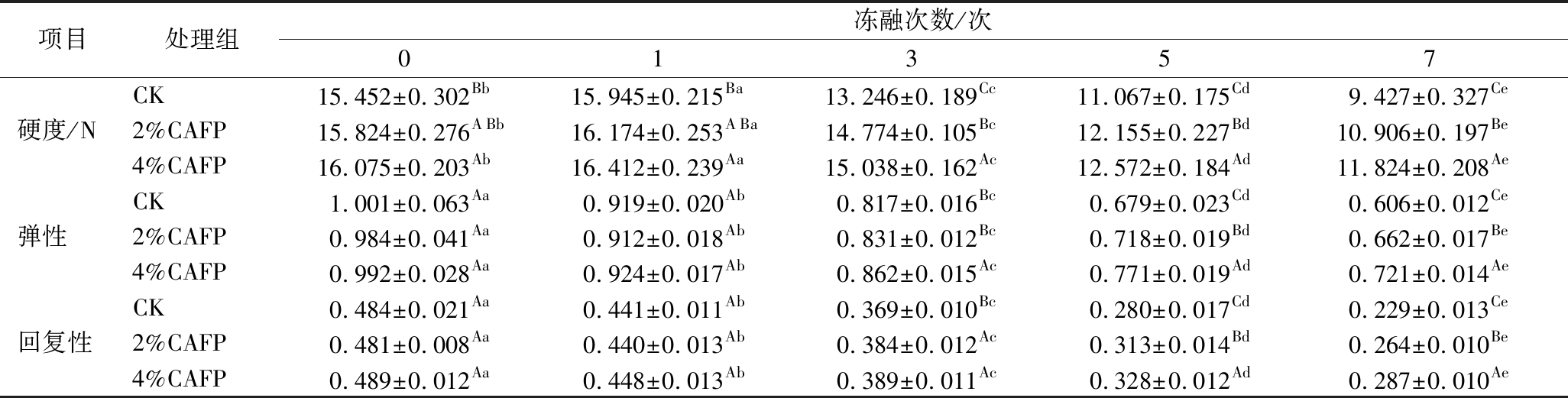
注:不同大写字母表示组间(不同处理组)差异显著(P<0.05),不同小写字母表示组内(不同冻融次数)差异显著(P<0.05)。
项目处理组冻融次数/次01357CK15.452±0.302Bb15.945±0.215Ba13.246±0.189Cc11.067±0.175Cd9.427±0.327Ce硬度/N2%CAFP15.824±0.276ABb16.174±0.253ABa14.774±0.105Bc12.155±0.227Bd10.906±0.197Be4%CAFP16.075±0.203Ab16.412±0.239Aa15.038±0.162Ac12.572±0.184Ad11.824±0.208AeCK1.001±0.063Aa0.919±0.020Ab0.817±0.016Bc0.679±0.023Cd0.606±0.012Ce弹性2%CAFP0.984±0.041Aa0.912±0.018Ab0.831±0.012Bc0.718±0.019Bd0.662±0.017Be4%CAFP0.992±0.028Aa0.924±0.017Ab0.862±0.015Ac0.771±0.019Ad0.721±0.014AeCK0.484±0.021Aa0.441±0.011Ab0.369±0.010Bc0.280±0.017Cd0.229±0.013Ce回复性2%CAFP0.481±0.008Aa0.440±0.013Ab0.384±0.012Ac0.313±0.014Bd0.264±0.010Be4%CAFP0.489±0.012Aa0.448±0.013Ab0.389±0.011Ac0.328±0.012Ad0.287±0.010Ae
这可能是由于CAFP具有对肌肉组织的维持和蛋白氧化的抑制作用,最终达到提高牛肉饼的食用品质的效果[4]。ZHANG等[38]将乳清肽添加到反复冻融的猪肉丸中,猪肉丸的硬度和弹性下降幅度减小,显示出与CAFP类似的效果。
2.8 CAFP对反复冻融牛肉饼蛋白及脂质氧化的影响
TVB-N是酶及微生物分解蛋白质产生的氨和胺类物质,反映肉制品的新鲜度。如图4-A所示,牛肉饼的TVB-N含量随反复冻融次数增加而升高,CK和2%CAFP组牛肉饼在5次冻融后TVB-N值分别达到25.27、21.37 mg/100 g,超过牛肉的腐败阈值,4%CAFP组牛肉饼在7次冻融后达到腐败阈值(22.49 mg/100 g),杨洁茹等[39]发现鹅肉在反复冻融过程中TVB-N含量也出现上升趋势,且添加复合抗冻剂对TVB-N含量的上升有抑制效果。TVB-N含量的增大可能是冻融造成了牛肉中水分、营养物质渗出和内源酶外泄,在解冻条件下,酶及微生物的繁殖作用共同导致TVB-N的积累[40]。CAFP的加入减轻了冰晶对细胞结构的破坏,减少了细胞内容物渗出和酶释放,并抑制微生物增殖,最终延缓了TVB-N的累积和腐败进程。通过测定POV和TBARS来确定牛肉饼中脂质初级氧化产物和次级氧化产物生成,以考察冻融过程中牛肉饼的脂质氧化。如图4-B所示,随冻融次数的增加,各组牛肉饼POV呈现先上升后下降的趋势(P<0.05),这是因为冻融过程中脂质过氧化反应生成了氢过氧化物等初级氧化产物,导致POV升高;但初级氧化产物本身并不稳定,随着氧化进程逐步分解为丙二醛等次级代谢产物,导致POV下降[41]。CAFP的加入延缓了POV的上升(P<0.05),拐点延迟至冻融5次后出现,主要是由于CAFP的加入减轻了细胞损伤,胞内氧化酶和促氧因子释放量减少,对脂质氧化的诱导减弱,氢过氧化物的积累速度减慢[42]。如图4-C所示,随冻融次数的增加,牛肉饼TBARS值显著增大(P<0.05),可能由于细胞损伤诱导促氧化剂的释放,加速脂质氧化,造成丙二醛的大量积累[25]。CAFP加入抑制了反复冻融过程中TBARS值的增大,7次冻融后4%CAFP组牛肉饼TBARS值为0.954 mg/kg,显著低于CK组(P<0.05),归因于CAFP对细胞结构的维持及其本身作为小分子肽的抗氧化活性。由此可知,CAFP能够抑制牛肉饼中蛋白和脂质氧化的发生,延缓牛肉饼的腐败变质,对维持产品品质具有重要意义。
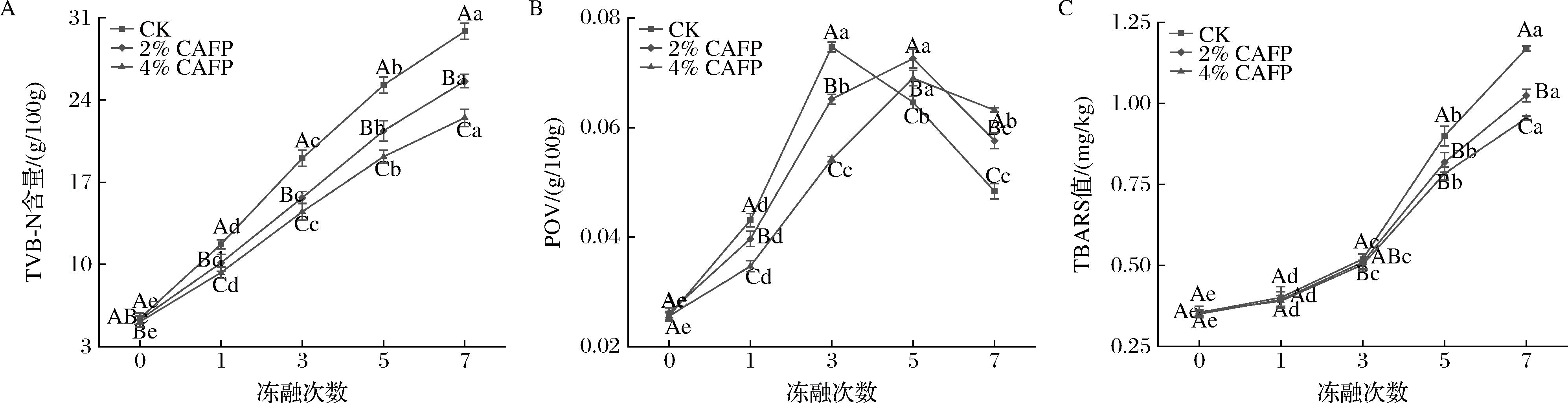
A-TVB-N;B-POV;C-TBARS
图4 牛肉饼的氧化特性
Fig.4 Oxidation characteristics of beef patties
3 结论
本研究探讨了牛皮CAFP对反复冻融牛肉饼品质的影响。结果显示,CAFP通过降低牛肉饼冰点和结晶焓使牛肉饼冻结过程中形成更加细小均匀的冰晶,同时抑制反复冻融过程中冰晶的生长和重结晶来发挥抗冻作用。添加CAFP可有效降低冰晶对牛肉饼组织结构的破坏,抑制牛肉饼中结合水和不易流动水向自由水的转化以及自由水的丧失,显著提高牛肉饼保水性和质地,维持良好的食品品质;延缓蛋白和脂质氧化,减少胺类物质、氢过氧化物和丙二醛的积累,抑制TVB-N值、POV和TBARS值的上升,延缓牛肉饼腐败变质与色泽劣变。综上,CAFP可以有效提升反复冻融过程中牛肉饼的品质,对延长冷冻产品货架期具有积极意义。
[1] 廖洪梅, 丁寅寅.糙米粉和柑橘皮粉的复配添加对牛肉饼品质的影响[J].安徽农业大学学报, 2023,50(6):1075-1081.LIAO H M, DING Y Y.Effects of the combined addition of brown rice flour and citrus peel powder on the quality of beef patties[J].Journal of Anhui Agricultural University, 2023, 50(6):1075-1081.
[2] FU Y, CAO Y, CHANG Z Y, et al.Effects of Flammulina velutipes polysaccharide with ice recrystallization inhibition activity on the quality of beef patties during freeze-thaw cycles:An emphasis on water status and distribution[J].Meat Science, 2024, 209:109420.
[3] UTRERA M, MORCUENDE D, ESTÉVEZ M.Temperature of frozen storage affects the nature and consequences of protein oxidation in beef patties[J].Meat Science, 2014, 96(3):1250-1257.
[4] WANG B, LI F F, PAN N, et al.Effect of ice structuring protein on the quality of quick-frozen patties subjected to multiple freeze-thaw cycles[J].Meat Science, 2021, 172:108335.
[5] CAO Y, ZHAO L Y, HUANG Q L, et al.Water migration, ice crystal formation, and freeze-thaw stability of silver carp surimi as affected by inulin under different additive amounts and polymerization degrees[J].Food Hydrocolloids, 2022, 124:107267.
[6] FAN X R, GENG W H, LI M, et al.Cryoprotective effects and quality maintenance of antifreeze proteins and peptides on aquatic products:A review[J].Foods, 2024, 13(6):917.
[7] CHEN X, LI X Z, YANG F J, et al.Effects and mechanism of antifreeze peptides from silver carp scales on the freeze-thaw stability of frozen surimi[J].Food Chemistry, 2022, 396:133717.
[8] CAO S Q, CAI J X, WANG X Z, et al.Cryoprotective effect of collagen hydrolysates from squid skin on frozen shrimp and characterizations of its antifreeze peptides[J].LWT, 2023, 174:114443.
[9] 朱玉兵. 胶原抗冻肽的制备及其功能特性研究[D].上海:上海理工大学, 2013.ZHU Y B.Studies on the preparation and functional feature of collagen antifreeze peptide[D].Shanghai:University of Shanghai for Science and Technology, 2013.
[10] CAO L, MAJURA J J, LIU L, et al.The cryoprotective activity of tilapia skin collagen hydrolysate and the structure elucidation of its antifreeze peptide[J].LWT, 2023, 179:114670.
[11] 袁承志, 王发祥, 黄轶群, 等.基于Lasso回归模型研究抗冻肽性质对冷冻鱼糜肌原纤维蛋白的影响[J].食品科学, 2024, 45(13):8-16.YUAN C Z, WANG F X, HUANG Y Q, et al.Effects of antifreeze peptide properties on myofibrillar proteins in frozen surimi investigated using least absolute shrinkage and selection operator regression model[J].Food Science, 2024, 45(13):8-16.
[12] ZHANG Y, GUI M, FAN W, et al.Response surface methodology optimization on extraction and antioxidant activity evaluation of antioxidant peptide from enzymatic hydrolysates of sturgeon bone[J].LWT, 2024, 198:116042.
[13] LI F F, WANG B, KONG B H, et al.Decreased gelling properties of protein in mirror carp (Cyprinus carpio) are due to protein aggregation and structure deterioration when subjected to freeze-thaw cycles[J].Food Hydrocolloids, 2019, 97:105223.
[14] FRANGOPOULOS T.Incorporation of Trigonella Foenum-Graecum seed powder in meat emulsion systems with olive oil:Effects on physicochemical, texture, and color characteristics[J].Journal of Food Science and Technology, 2022, 59(5):2060-2070.
[15] ZOU Y, LI L, YANG J, et al.Effect of ultrasound assisted collagen peptide of chicken cartilage on storage quality of chicken breast meat[J].Ultrasonics Sonochemistry, 2022, 89:106154.
[16] MA X T, WANG W X, SHI H M, et al.Identification of novel antifreeze peptides from yak skin gelatin ultrasound-assisted enzymatic hydrolysate[J].Ultrasonics Sonochemistry, 2024, 111:107102.
[17] CUI M L, LI J L, LI J, et al.Screening and characterization of a novel antifreeze peptide from silver carp muscle hydrolysate[J].Food Chemistry, 2023, 403:134480.
[18] MAJURA J J, HAN M, OUYANG J J, et al.The antifreeze activity and physicochemical properties of Litopenaeus vannamei head autolysate[J].International Journal of Food Science &Technology, 2023, 58(11):6131-6142.
[19] 李晓坤. 利用猪皮明胶制备抗冻多肽及其低温保护作用研究[D].福州:福州大学, 2013.LI X K.Preparation of antifreeze polypeptide from pigskin gelatin and study on the cryoprotective activity[D].Fuzhou:Fuzhou University, 2013.
[20] DAMODARAN S, WANG S Y.Ice crystal growth inhibition by peptides from fish gelatin hydrolysate[J].Food Hydrocolloids, 2017, 70:46-56.
[21] 韩梅, 欧阳及锦, 陈秀娟, 等.超声辅助虾头自溶制备热滞活性产物的工艺研究[J].食品与发酵工业, 2024,50(15):196-204.HAN M, OUYANG J J, CHEN X J, et al.Study on the process of ultrasonic-assisted autolysis of shrimp heads for the preparation of thermally lagged active products[J].Food and Fermentation Industries, 2024,50(15):196-204.
[22] LUO W, YUAN C Z, WU J H, et al.Inhibition mechanism of membrane-separated silver carp hydrolysates on ice crystal growth obtained through experiments and molecular dynamics simulation[J].Food Chemistry, 2023, 414:135695.
[23] KE Y, WANG Y Y, DING W P, et al.Effects of inulin on protein in frozen dough during frozen storage[J].Food &Function, 2020, 11(9):7775-7783.
[24] 张灵芝. 甘露低聚糖和可得然胶对淡水鱼糜冻融稳定性的影响[D].长沙:中南林业科技大学, 2023.ZHANG L Z.Effects of mannooligosaccharide and curdlan on freeze-thaw stability of freshwater surimi[D].Changsha:Central South University of Forestry and Technology, 2023.
[25] WANG W L, ZHAO Y C, MA Y B, et al.Effects of sodium carboxymethyl cellulose-tea polyphenols ice coating on the quality degradation of frozen-thawed beef due to changes in protein structure and fat and protein oxidation[J].International Journal of Biological Macromolecules, 2024, 280:135975.
[26] SUN Q X, SUN F D, XIA X F, et al.The comparison of ultrasound-assisted immersion freezing, air freezing and immersion freezing on the muscle quality and physicochemical properties of common carp (Cyprinus carpio) during freezing storage[J].Ultrasonics Sonochemistry, 2019, 51:281-291.
[27] 王芊彤.亚冻结贮藏对牛肉品质的影响及其机制探究[D].泰安:山东农业大学, 2023.WANG Q T.Effect of sub-freezing storage on beef quality and its mechanism[D].Taian:Shandong Agricultural University, 2023.
[28] LYU Y, CHU Y M, ZHOU P C, et al.Effects of different freezing methods on water distribution, microstructure and protein properties of cuttlefish during the frozen storage[J].Applied Sciences, 2021, 11(15):6866.
[29] LIU M, LIANG Y, ZHANG H, et al.Comparative study on the cryoprotective effects of three recombinant antifreeze proteins from Pichia pastoris GS115 on hydrated gluten proteins during freezing[J].Journal of Agricultural and Food Chemistry, 2018, 66(24), 6151-6161.
[30] NIAN L Y, CAO A L, CAI L Y,et al.Effect of vacuum impregnation of red sea bream (Pagrosomus major) with herring AFP combined with CS@Fe3O4 nanoparticles during freeze-thaw cycles[J].Food Chemistry, 2019, 291:139-148.
[31] HASHIMOTO K, KAWASHIMA T, YOSHINO N, et al.Effects of freshness on thawing drip and ice crystal formation in frozen spotted mackerel Scomber australasicus[J].Nippon Suisan Gakkaishi, 2015, 81(1):124-129.
[32] RAHMAN M H, HOSSAIN M M, RAHMAN S M E, et al.Evaluation of physicochemical deterioration and lipid oxidation of beef muscle affected by freeze-thaw cycles[J].Korean Journal for Food Science of Animal Resources, 2015, 35(6):772-782.
[33] LIANG H H, FAN X K, GAO X, et al.Effects of glycerol on the freezing behaviors and physicochemical properties of pork patties under freeze-thaw cycles[J].Journal of Food Measurement and Characterization, 2024, 18(8):7172-7184.
[34] TURGUT S S, ![]()
 SIKÇI F, SOYER A.Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J].Meat Science, 2017, 129:111-119.
SIKÇI F, SOYER A.Antioxidant activity of pomegranate peel extract on lipid and protein oxidation in beef meatballs during frozen storage[J].Meat Science, 2017, 129:111-119.
[35] KONG C H Z, HAMID N, MA Q L, et al.Antifreeze peptide pretreatment minimizes freeze-thaw damage to cherries:An in-depth investigation[J].LWT, 2017, 84:441-448.
[36] LI F F, ZHONG Q, KONG B H, et al.Deterioration in quality of quick-frozen pork patties induced by changes in protein structure and lipid and protein oxidation during frozen storage[J].Food Research International, 2020, 133:109142.
[37] WARNER R D, WHEELER T L, HA M, et al.Meat tenderness:Advances in biology, biochemistry, molecular mechanisms and new technologies[J].Meat Science, 2022, 185:108657.
[38] ZHANG X T, YU P J, YAN J Y, et al.Effects of whey peptides on the quality of pork ball preprepared dishes during repeated freezing-thawing[J].Foods, 2023, 12(19):3597.
[39] 杨洁茹, 杨晓聪, 杨孟园, 等.复合抗冻剂对反复冻融鹅肉品质的影响[J].肉类研究, 2024, 38(10):45-51.YANG J R, YANG X C, YANG M Y, et al.Effect of a mixture of antifreeze agents on the quality of repeatedly frozen and thawed goose meat[J].Meat Research, 2024, 38(10):45-51.
[40] SHAO Y, WANG L, CHEN C S, et al.Antioxidant capacity of fermented soybeans and their protective effect on protein oxidation in largemouth bass (Micropterus salmoides) during repeated freezing-thawing (FT) treatments[J].LWT, 2018, 91:213-221.
[41] PAN N, DONG C H, DU X, et al.Effect of freeze-thaw cycles on the quality of quick-frozen pork patty with different fat content by consumer assessment and instrument-based detection[J].Meat Science, 2021, 172:108313-.
[42] 楼丹露, 王清政, 邹祖全, 等.冻融循环对熟制鲣鱼暗色肉脂质变化的影响[J].食品科学, 2022, 43(13):177-183.LOU D L, WANG Q Z, ZOU Z Q, et al.Lipid changes in dark meat of cooked bonito during multiple freeze-thaw cycles[J].Food Science, 2022, 43(13):177-183.