γ-氨基丁酸(γ-aminobutyric acid,GABA)是一种广泛存在于原核生物和真核生物中的四碳非蛋白质氨基酸[1-2]。研究表明,GABA具有多种生理功能,包括调节血压和心率、改善失眠、缓解癫痫症状、预防阿尔茨海默病以及诱导癌细胞凋亡等[3]。GABA主要通过GABA支路和多胺降解2种途径合成。在GABA支路途径中,谷氨酸(glutamic acid,Glu)在谷氨酸脱羧酶(glutamate decarboxylase,GAD)的催化下生成GABA,然后经GABA转移酶(GABA transaminase,GABA-T)降解生成琥珀酸半醛,最后进入三羧酸循环[4]。在多胺降解途径中,腐胺(putrescine,Put)、亚精胺(spermidine,Spd)和精胺(spermine,Spm)通过二胺氧化酶(diamine oxidase,DAO)和多胺氧化酶(polyamine oxidase,PAO)催化生成4-氨基丁醛,随后在4-氨基丁醛脱氢酶(aminoaldehyde dehydrogenase,AMADH)的作用下转化为GABA[5-6]。研究表明,在中性和偏碱性条件下,GAD受Ca2+/CaM(钙调蛋白)复合物的调节,从而使植物体内GABA的积累增加[7]。
桑树为桑科桑属的落叶乔木或灌木,是一种兼具食用、药用、观赏和生态价值的重要经济作物[8]。《本草纲目》中记载,桑叶具有补血、养肝、降压、降糖等功效[9]。近年来,随着桑叶中活性成分的逐步解析,其开发利用价值日益凸显。除作为传统中药材外,桑叶还被广泛应用于茶饮、饼干、饮料和果酒等日常饮食中[10-12]。因此,提高桑叶中GABA的积累,不仅有助于开发新型功能性食品,也将为桑树产业高质量发展注入新的动力,显著提升其健康、经济和生态效益。据相关报道显示,盐、低温、高温、低氧、超声、微波和冷等离子体等非生物胁迫均能促进植物体内GABA的积累[13]。目前,富集桑叶中GABA的方法主要有盐溶液浸泡、低温处理、厌氧处理和超声波处理等。TU等[14]研究发现,在25 ℃的谷氨酸钠溶液中浸泡桑叶15 h,产生的GABA水平高于低温和厌氧处理。石杨等[15]研究表明,桑叶进行抽真空厌氧处理后,产生的GABA比未处理的桑叶提高了将近3倍。WANYO等[16]研究发现,桑叶经40 kHz的超声处理10 min后,产生的GABA比未处理组提高了将近2倍。然而,这些单独的处理方法富集效率较低,难以满足消费者的健康需求。
以往的研究发现,在盐胁迫、缺氧胁迫以及两者联合胁迫下,植物主要通过GABA支路合成GABA,而多胺降解途径的贡献率约为25%~40%[17]。然而,目前尚无研究比较超声、厌氧好氧交替以及超声协同厌氧好氧交替处理下这2个途径对GABA积累的贡献度,同时其作用机制仍有待进一步探讨。以往的研究主要集中于GAD和DAO活力的变化[7],而关于不同胁迫条件下其他酶的活力和基因表达也有待进一步研究。基于上述问题,本研究比较了超声、厌氧好氧交替和超声协同厌氧好氧交替处理对桑叶GABA积累效率的影响,并结合氨基胍(aminoguanidine,AG)抑制多胺降解途径,深入探讨了不同条件下,GABA支路和多胺降解途径对GABA合成的贡献度,以及对这2条途径中的相关代谢物、关键酶的活力和基因表达的影响。研究结果不仅为桑叶中GABA的高效生物合成提供了新的技术手段,还揭示了多胺代谢与GABA合成之间的潜在调控机制。这些发现为进一步优化植物次生代谢产物的积累效率、提升食品营养价值以及探索食品绿色加工方向提供了重要理论依据和实践指导。
1 材料与方法
1.1 材料与试剂
新鲜桑叶均于2024年3月采集于浙江省丽水市的桑叶种植园“蚕满园”。桑树品种为强桑1号,由中国农业科学院蚕业研究所(江苏科技大学蚕业研究所)选育,具有高产、优质、抗病性强等特性。所有叶片均为靠近树梢第2至第4片的嫩叶。采摘后,次日运送到江苏大学(镇江,江苏),并进行人工分拣,优选出嫩绿色、大小均匀、无机械损伤的完整叶片用于实验,所有叶片保存于4 ℃冰箱内,并在3 d内完成处理。GABA标准品、辣根过氧化物酶,北京索莱宝生物科技有限公司;氨基胍盐酸盐、腐胺、精胺、亚精胺、氧化型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)、NADH、Trizol和HPLC级乙腈,镇江国药控股化学试剂有限公司;RNA isolater Total RNA Extraction Reagent试剂、HiScript Q RT SuperMix for qPCR(+gDNA wiper)试剂盒和ChamQ SYBR qPCR Master Mix试剂盒,南京诺唯赞生物科技有限公司;其他化学试剂均为分析级。
1.2 仪器与设备
实验所使用超声设备为江苏大学马海乐教授团队设计的一种多频扫描槽式超声装置,由江大五棵松生物科技有限公司(中国,镇江)生产制造。该装置主要部件包括:电气控制柜、超声波反应池、进出水管、水浴锅、蠕动泵、超声波振动器和电磁铁等,设备的详细信息参见文献[18]。其中,超声波发生器有6种可选频率(20、28、35、40、50、60 kHz),可通过电气控制柜设置频率和超声作用/间歇时间等参数。水浴锅温度可调控,并借助进出水管与蠕动泵形成水循环系统,以维持超声池内温度的稳定。
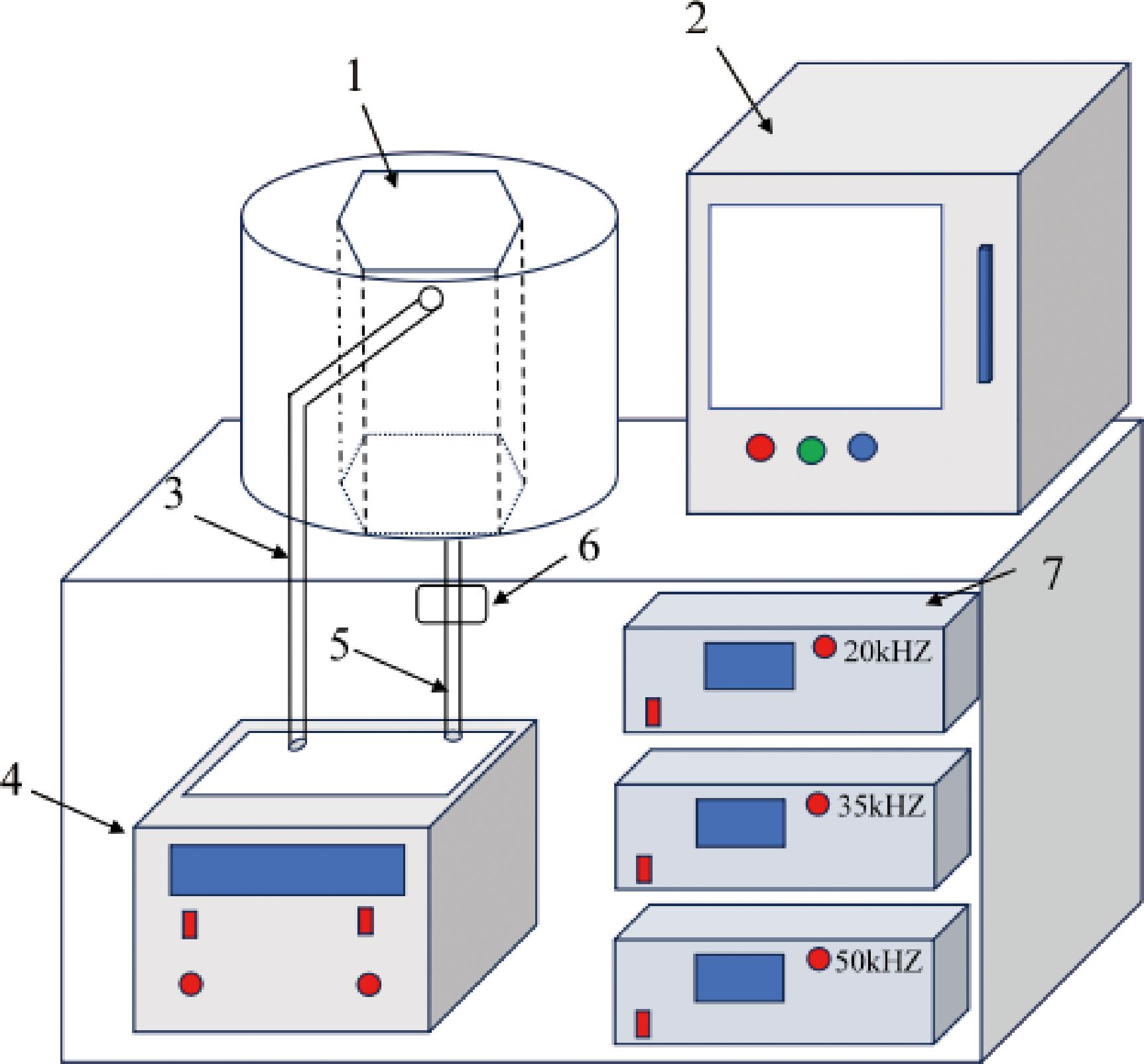
1-超声反应池;2-电气控制柜;3-出水管;4-水浴锅;5-进水管; 6-蠕动泵;7-超声波发生器。
图1 多频扫描功率超声设备示意图
Fig.1 Schematic diagram of multi-frequency scanning ultrasonic power equipment
1.3 实验方法
1.3.1 氨基胍盐酸盐浓度确定
分别将50 g桑叶(完整叶片)分别放置于浓度为2.5、5.0、7.5、10.0、12.5 mmol/L的AG溶液(抑制组)和蒸馏水(对照组)中浸泡20 min,然后将桑叶洗净、擦干,取部分叶片迅速浸泡在液氮中并贮存于-80 ℃,用于DAO、GAD和GABA-T活力测定。
1.3.2 超声处理桑叶
根据1.3.1节筛选的结果,参照JI等[18]的方法并稍作改进,对桑叶进行超声处理。具体步骤如下:称取50 g桑叶,分别置于10 mmol/L的AG溶液(抑制组)或蒸馏水(对照组)中浸泡20 min,将桑叶洗净、擦干后转移到至5 g/L的谷氨酸钠溶液中进行超声处理。根据预实验的结果,超声条件设置为:时间7.3 min,功率密度12 W/L,频率20/35 kHz,温度40 ℃,pH 7.2。处理完成后,将桑叶清洗干净并拭干,置于25 ℃恒温条件下静置9 h。处理完后一部分样品冷冻干燥用于测定GABA和多胺含量,剩余样品贮存于-80 ℃冰箱用于酶活力和基因表达测定。
1.3.3 厌氧好氧交替处理桑叶
称取50 g桑叶,按照1.3.2节的方法分别置于10 mmol/L的AG溶液(抑制组)或蒸馏水(对照组)中浸泡20 min,将桑叶洗净、擦干后用5 g/L的谷氨酸钠溶液浸泡7.3 min。将浸泡后的桑叶取出,用ddH2O清洗以去除残留的谷氨酸钠溶液,并擦干表面水分。随后将叶子置于真空袋中,使用得力真空包装机(得力集团有限公司,浙江,中国)进行真空封存2 h(厌氧处理),真空度可达-65 kPa。随后开启袋口,将叶片暴露于空气中1 h(好氧处理)。上述厌氧好氧交替处理过程重复3次,处理过程在25 ℃恒温培养箱中进行,处理总时长为9 h。处理完后样品分别冷冻干燥或贮存于-80 ℃冰箱用于后续测定。
1.3.4 超声协同厌氧好氧交替处理桑叶
称取50 g桑叶,首先按照1.3.2节的方法分别置于10 mmol/L的AG溶液(抑制组)或蒸馏水(对照组)中浸泡20 min,将桑叶洗净、擦干后转移到至5 g/L谷氨酸钠溶液中进行超声处理7.3 min。超声处理完成后将桑叶取出并清洗掉残留的谷氨酸钠溶液,接着擦干表面水分。然后,按照1.3.3节中的方法进行厌氧好氧交替处理3次,每次先在真空中封存2 h再暴露在空气中1 h,处理过程在25 ℃恒温培养箱中进行,处理总时长为9 h。处理完后样品分别冷冻干燥或贮存于-80 ℃冰箱用于后续测定。
上述3个处理过程中桑叶与5 g/L的谷氨酸钠溶液的接触时间均为7.3 min,静置总时长均为9 h,处理过程在25 ℃恒温培养箱中进行。
1.3.5 GABA与Glu含量测定
GABA和Glu含量的测定采用JI等[18]的测定方法。
1.3.6 多胺含量测定
多胺含量的测定参考KEBERT等[19]的方法,并作部分修改。取1.5 g冷冻干燥的桑叶粉末,加入6 mL预冷的5%(体积分数)高氯酸,至冰上研磨并提取1 h,然后在4 ℃下10 000×g离心20 min。吸取0.5 mL上清液,加入0.5 mL氢氧化钠(2 mol/L)和10 μL苯甲酰氯,振荡均匀后于37 ℃水浴30 min。随后,加入1 mL饱和氯化钠和2 mL乙醚,涡旋离心后静置1 min,取1 mL乙醚相置60 ℃水浴,去除有机溶剂。将提取的样品重新溶于500 μL甲醇后上机测定。采用高效液相色谱(Agilent 1260 Infinity, Waldbronn, Germany)和Agilent Zorbax SB-C18 (4.6 mm×150 mm,5 μm,USA)色谱柱进行分析,以60%(体积分数)甲醇水溶液为流动相对样品进行等梯度洗脱,流速为0.7 mL/min,柱温30 ℃,进样量20 μL,紫外检测器波长为230 nm。
1.3.7 GAD酶活力测定
GAD活性测定参考SUN等[20]的方法并略作修改。称取1.0 g新鲜或处理后的桑叶样品加入5 mL磷酸钾缓冲液后冰上研磨10 min,然后在4 ℃下10 000×g离心20 min。取离心后的上清(粗酶液)700 μL,加入300 μL底物溶液(10 g/L的谷氨酸钠溶液,pH 5.8),40 ℃水浴中反应2 h后,沸水浴加热5 min使酶灭活。然后加入1 mL苯酚(6%,体积分数)和1 mL次氯酸钠(5.2%,体积分数)溶液,充分振荡均匀后于沸水浴中反应10 min,接着继续冰浴20 min。最后加入2 mL乙醇(60%,体积分数)终止反应,所得溶液在640 nm处测定其吸光度。以每30 min 产生1 μmol GABA所需要的酶量为1个酶活力单位(U)。
1.3.8 GABA-T酶活力测定
参考JI等[18]的测定方法并略作修改。称取0.5 g待测样品,加入5 mL磷酸钾缓冲液研磨提取后,置于冰浴中反应10 min,然后在4 ℃下经10 000×g离心20 min,所得上清液即为粗酶液。取100 μL粗酶液或NADH标准品溶液,加入1.45 mL磷酸钾缓冲液(包含1 mmol/L NAD+,pH 8.75)和100 μL的底物溶液[V(4.8 mmol/L α-酮戊二酸)∶V(18 mmol/L GABA)=1∶1,pH 8.75],混匀后于30 ℃水浴中反应30 min。以缓冲液代替粗酶液作空白对照,在340 nm处测定其吸光度。采用不同浓度的NADH标准溶液(0、4、8、16、32、64 μg/mL)绘制标准曲线。每30 min内生成1 μmol NADH所需酶量定义为1个酶活力单位(U)。
GABA+α-酮戊二酸![]() 琥珀酸半醛
琥珀酸半醛![]() 琥珀酸+NADH
琥珀酸+NADH
1.3.9 DAO和PAO酶活力测定
参考SUN等[20]研究方法并略作修改。称取1.0 g样品于研钵中,加入6 mL的70 mmol/L磷酸盐缓冲液(pH 6.5,含20%甘油),磨成匀浆后置冰上反应提取15 min,离心后所得上清液即为粗酶液。取0.3 mL粗酶液与2 mL磷酸盐缓冲液(70 mmol/L, pH 6.5)混匀后,加入0.1 mL(250 U/mL)辣根过氧化物酶液和0.2 mL显色溶液(70 mmol/L磷酸盐缓冲液,pH 6.5,每100 mL含25 μL N,N-二甲基苯胺和10 mg 4-氨基安替比林)孵育5 min后,加入0.1 mL Put(50 mmol/L)反应10 min,以测定DAO活力。PAO活力的测定方法同上,以0.1 mL Spm(25 mmol/L)和Spd(25 mmol/L)的混合物替代Put作为底物。在555 nm处测定单位时间内吸光值的变化,以每分钟每增加0.01 OD值为1个酶活力单位(U)。
1.3.10 AMADH酶力性测定
AMADH活性的测定参考CHI等[21]的方法,略有修改。称取0.5 g桑叶在液氮中研磨成粉末,加入4 mL预冷提取缓冲液(0.1 mmol/L三羟甲基氨基甲烷盐酸盐(Tris-HCl)溶液,pH 8.0,含5 mmol/L二硫代硫代乙醇、5 mmol/L乙二胺四乙酸、100 g/L的蔗糖),在冰水中孵育15 min。取125 μL离心后的上清液与0.5 mL反应缓冲液(100 mmol/L Tris-HCl溶液,pH 8.0,含有1 mmol/L NAD+)在37 ℃下反应10 min,随后加入25 μL底物(1 mmol/L 1-氨基-3,3-二乙氧基丙烷),继续37 ℃下反应20 min。在340 nm处测定吸光度值变化。以每分钟变化0.01 OD值为1个酶活力单位(U)。
1.3.11 GAD、GABA-T和PAO、CaM基因表达测定
采用RNA提取试剂RNA isolater Total RNA Extraction Reagent提取桑叶总RNA,具体操作及RNA浓度的检测见试剂说明书。使用逆转录试剂盒逆转录成cDNA,然后使用ChamQ SYBR qPCR Master Mix试剂盒进行实时荧光定量PCR测定,具体操作见试剂盒说明书。实时荧光定量PCR程序为:预变性,95 ℃,30 s;95 ℃变性10 s,55 ℃退火20 s,60 ℃延伸30 s,循环40个周期。所用引物序列见表1,其中以β-actin作为内参基因。
表1 GAD、GABA-T、PAO和CaM基因引物序列
Table 1 PCR primer sequences of GAD、 GABA-T、PAO and CaM

基因正向引物序列(5′-3′)反向引物序列(5′-3′)GADTTCCGATGGATTGTCCCAGCGCCTATCACGGAGACATGGGGABA-TAGATGCCAACGACACTCAGGGTCGGTGTGCAGAACGAATGPAOAACTGGCCATCCTGTCCTTGTGAGTTAACGTCTGTGCCCCCaMAGTTCAAGGAGGCCTTCAGCAAATCAATGGTGCCGTTGCCβ-actinCATTGTCTTGTCTGGTGGTTTCATCATACTCCGACTTTGC
1.4 统计分析
使用Minitab18软件(Minitab Inc., State College,PA,USA)分析结果。采用单因素方差分析和Fisher’s检验分析不同处理组间的显著性差异,采用student’s t test分析相同处理组添加AG和未添加AG实验组的显著性差异。P<0.05,表示有显著性差异。使用GraphPad Prism 8软件(GraphPad Software Inc. Boston, MA, USA) 绘图。通过Origin 2021(Origin Lab Corporation,USA)进行相关性分析。每种处理方法进行3次生物重复实验,测定的结果表示为“平均值±标准差”。
2 结果与分析
2.1 氨基酸盐酸盐浓度对酶活力的影响
AG是多胺降解途径关键酶DAO和PAO的抑制剂[17,22-24],因此用来处理桑叶,研究不同代谢途径在超声胁迫下对GABA积累的影响。不同浓度AG对DAO、GAD和GABA-T酶活力影响的结果见图2。随着AG浓度的升高,DAO活力呈现先下降后上升的趋势。当浓度为10 mmol/L时,对DAO活力的抑制达到80%(图2-A),然而对GAD(图2-B)和GABA-T(图2-C)的活力无显著性影响(P>0.05),表明AG浸泡桑叶能够阻断多胺降解途径生成GABA,同时不影响GABA支路生成GABA。因此,在后续的实验中,选择10 mmol/L的AG处理桑叶。
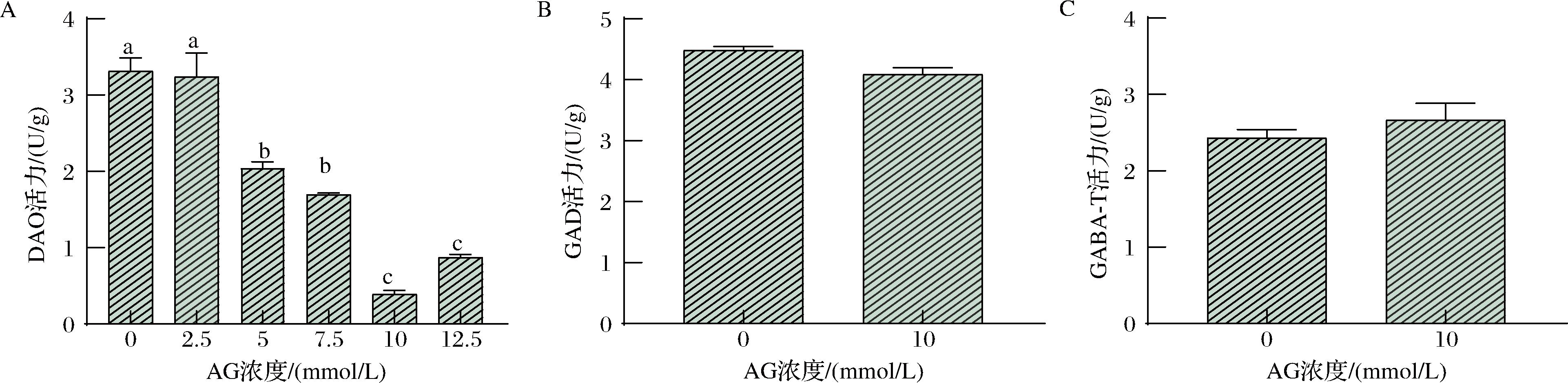
A-DAO活力;B-GAD活力;C-GABA-T活力
图2 不同氨基胍盐酸盐(AG)浓度对桑叶DAO、GAD、GABA-T活力的影响
Fig.2 Effects of different concentrations of aminoguanidine hydrochloride (AG) on DAO, GAD and GABA-T enzyme activities in Mulberry leaves
注:不同小写字母表示组内不同水平之间存在显著性差异(P<0.05)。
2.2 超声、厌氧好氧交替及超声协同厌氧好氧交替处理对桑叶GABA含量的影响
如图3所示,超声、厌氧好氧交替及其联合处理均显著提高了桑叶中的GABA含量,分别达到对照组(未处理鲜叶的GABA含量为0.30 mg/g)的3.0、5.0、6.7倍,表明超声协同厌氧好氧处理比单独超声或厌氧好氧处理具有更优的GABA富集效果。
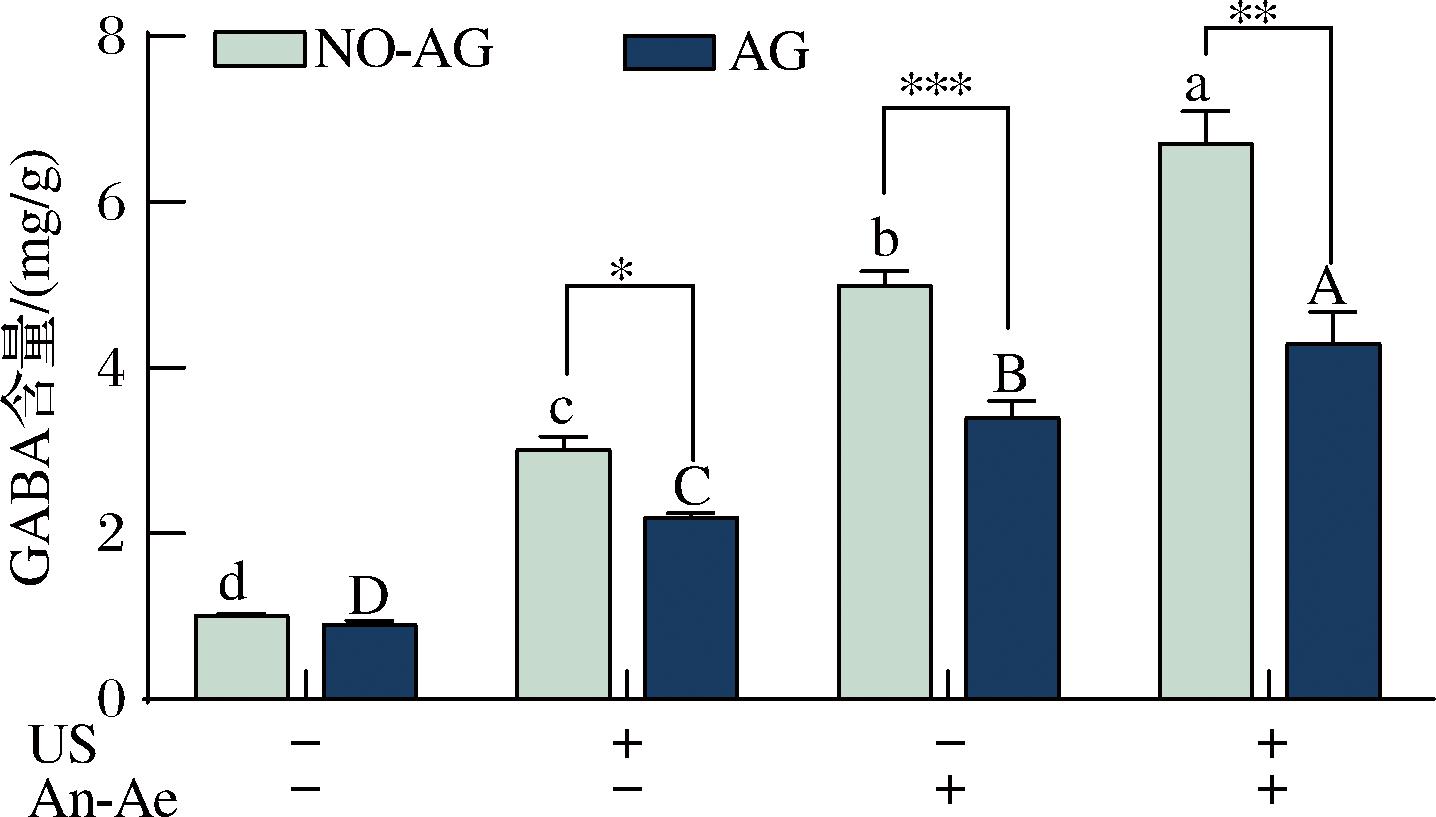
US为超声处理;An-Ae为厌氧好氧交替处理(下同)。
图3 不同处理组桑叶在添加氨基胍(AG)和未添加氨基胍(NO-AG)条件下的GABA含量的变化
Fig.3 Changes of GABAcontents in mulberry leaves with aminoguanidine (AG) and without aminoguanidine (NO-AG) in different treatment groups
注:不同小写字母表示未添加氨基胍的不同处理组存在显著性差异, 不同大写字母表示添加氨基胍的不同处理组存在显著性差异 (P<0.05);星号比较同一处理组添加和未添加AG的显著性差异: *P<0.05,**P<0.01;***P<0.001(下同)。
已有研究表明,超声的空化效应能破坏植物细胞壁和细胞膜结构,提高底物Glu的可及性,进而促进GABA的合成[18]。而WU等[25]的研究表明,厌氧和好氧交替通过降低细胞内的pH值,从而激活GAD,促进GABA的积累。两者的协同作用可能进一步增强关键酶活力,从而显著提升富集效果,这一结果在后续的酶活实验中得到证明。添加AG处理组的GABA含量与未添加AG的结果趋势相似,但是GABA含量分别下降了28%、30%和37%(P<0.05)。AG是DAO的特异性抑制剂[22],可阻断多胺降解途径,从而抑制GABA合成。因此,在超声、厌氧好氧交替以及超声协同厌氧好氧交替处理的桑叶中,多胺降解途径对GABA富集的贡献率分别约为28%、30%和37%。YANG等[23]在缺氧条件下用7.5 mmol/L AG处理萌发的蚕豆后,GABA含量分别下降了32.96%,认为在缺氧条件下萌发的蚕豆中形成的GABA中约有30%是由多胺降解途径提供的。FANG等[22]的研究结果表明,Spd和Spd-NaCl处理下多胺降解对GABA积累分别贡献了57%和46%,认为发芽大豆中的多胺降解途径在GABA合成途径中占据了重要比例。因此,不同的胁迫方式对多胺降解途径在GABA合成中贡献度不同,可能是由于不同物种间的耐受性以及胁迫方式的不同导致的[26]。
2.3 超声、厌氧好氧交替及超声协同厌氧好氧交替处理对GABA合成的底物浓度的影响
Glu是GABA支路合成GABA的底物,而Put、Spd和Spm则是多胺降解途径的底物。因此,我们测定了这些底物经过处理后的含量变化,以进一步了解超声、厌氧好氧交替以及超声协同厌氧好氧交替处理对这2个合成途径的影响。
如图4-A所示,经超声和厌氧好氧交替单独处理后桑叶中的Glu含量显著低于(P<0.05)对照组(未处理的鲜叶Glu含量为1.26 mg/g),但是2种方法协同处理组的Glu含量较对照组则无显著差异(P>0.05)。添加AG与未添加AG的对照组相比,Glu含量无显著差异(P>0.05)。Glu是细胞内氨基酸代谢的重要中间体,不仅是合成GABA的直接底物,同时也参与多种氨基酸的合成过程,其含量易受代谢途径调控的影响[27-28]。本研究中,处理组(包括超声、厌氧好氧交替及两者联合处理)中的Glu含量低于对照组,说明这3种处理方法可能促进了Glu向GABA的转化,导致底物消耗[29]。值得注意的是,超声协同厌氧好氧交替处理组的Glu含量相比其他2个单独处理组的含量高,同时GABA含量也高于其他2组。这一结果表明,该胁迫处理不仅促进了Glu向GABA转化,同时可能也增强了Glu的内源性合成。已有研究表明,Glu含量的增加会提高GAD活力[30-31],从而促进GABA合成。ZHANG等[32]的研究也发现,超声处理可以加快Glu合成速率和代谢速率。XU等[29]的研究在浸泡与萌发处理燕麦的实验中也观测到类似现象,发现Glu向GABA的转化显著影响了内源Glu的水平。此外,Glu还可以通过谷氨酰胺合成酶-谷氨酸合成酶循环途径增加[33-34]或通过GABA转氨酶反应再生[33]。
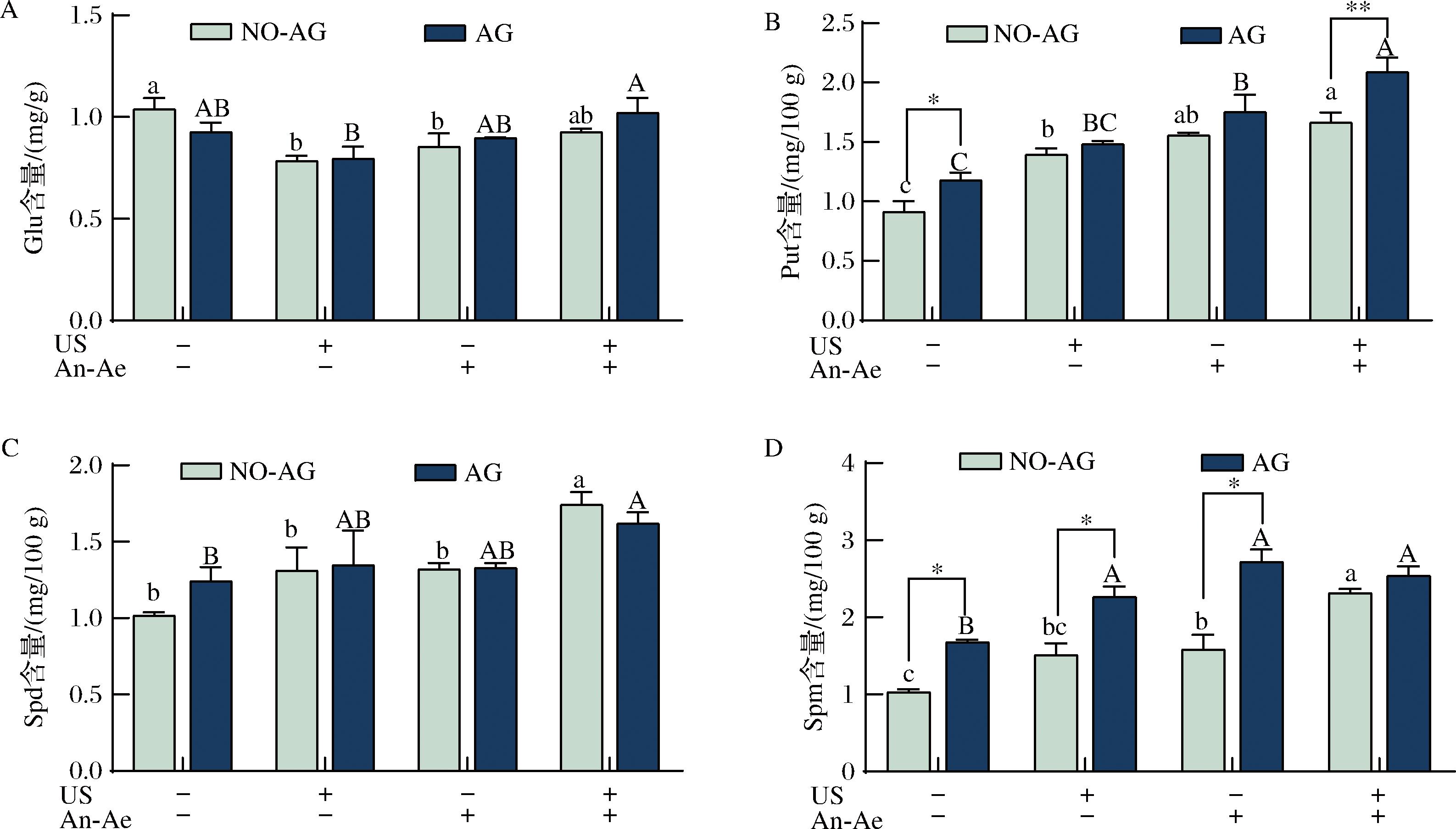
A-Glu含量;B-Put含量;C-Spd含量;D-Spm含量
图4 不同处理组桑叶在添加氨基胍(AG)和未添加氨基胍(NO-AG)条件下Glu、Put、Spd、Spm含量变化
Fig.4 Changes of the contents of Glu,Put,Spd,and Spm in mulberry leaves of different treatment groups with or without aminoguanidine (AG or NO-AG)
桑叶中多胺含量如图4-B~图4-D所示。与对照组(未处理鲜叶的Put、Spd和Spm的含量分别为2.37、1.11、3.47 mg/100 g)相比,超声、厌氧好氧交替及超声协同厌氧好氧交替处理显著提高了Put、Spd和Spm的含量。以往的研究表明,Put和Spd分别经DAO或PAO催化下生成γ-氨基丁醛,随后在AMADH的催化作用下被氧化为GABA[5-6]。此外,Spm可通过逆向转换作用在PAO的催化下生成Put和Spd,从而间接参与GABA的合成。在缺氧条件下,GABA通过增加游离Put、Spd和Spm的生物合成来降低短期缺氧的影响[35]。WU等[25]也发现缺氧条件能够使茶叶积累Put、Spd和Spm。因此,与单独超声和厌氧好氧交替处理相比,超声协同厌氧好氧交替处理使这3种多胺的含量提高更多,原因可能是协同处理通过提高多胺降解途径底物的浓度来促进GABA的积累[36]。与添加AG处理组相比,Put和Spm的含量比未处理的高,而Spd的含量则没有显著性差异,其原因可能在于AG抑制了DAO和PAO的活力,从而使多胺的消耗量降低[22]。
2.4 超声、厌氧好氧交替及超声协同厌氧好氧交替处理对桑叶GABA支路相关酶活力的影响
如图5-A所示,不同处理组GAD活力均高于未处理组,其中超声协同厌氧好氧交替处理组的GAD活力显著高于单独超声或厌氧好氧交替处理组,分别提高了153%、125%、252%。研究表明,超声处理可以通过改变酶的构象以及细胞内的信号分子ROS和钙离子的浓度,激活GAD活力[37],而厌氧和好氧处理则能通过降低细胞内的pH值,提高GAD活力[25]。
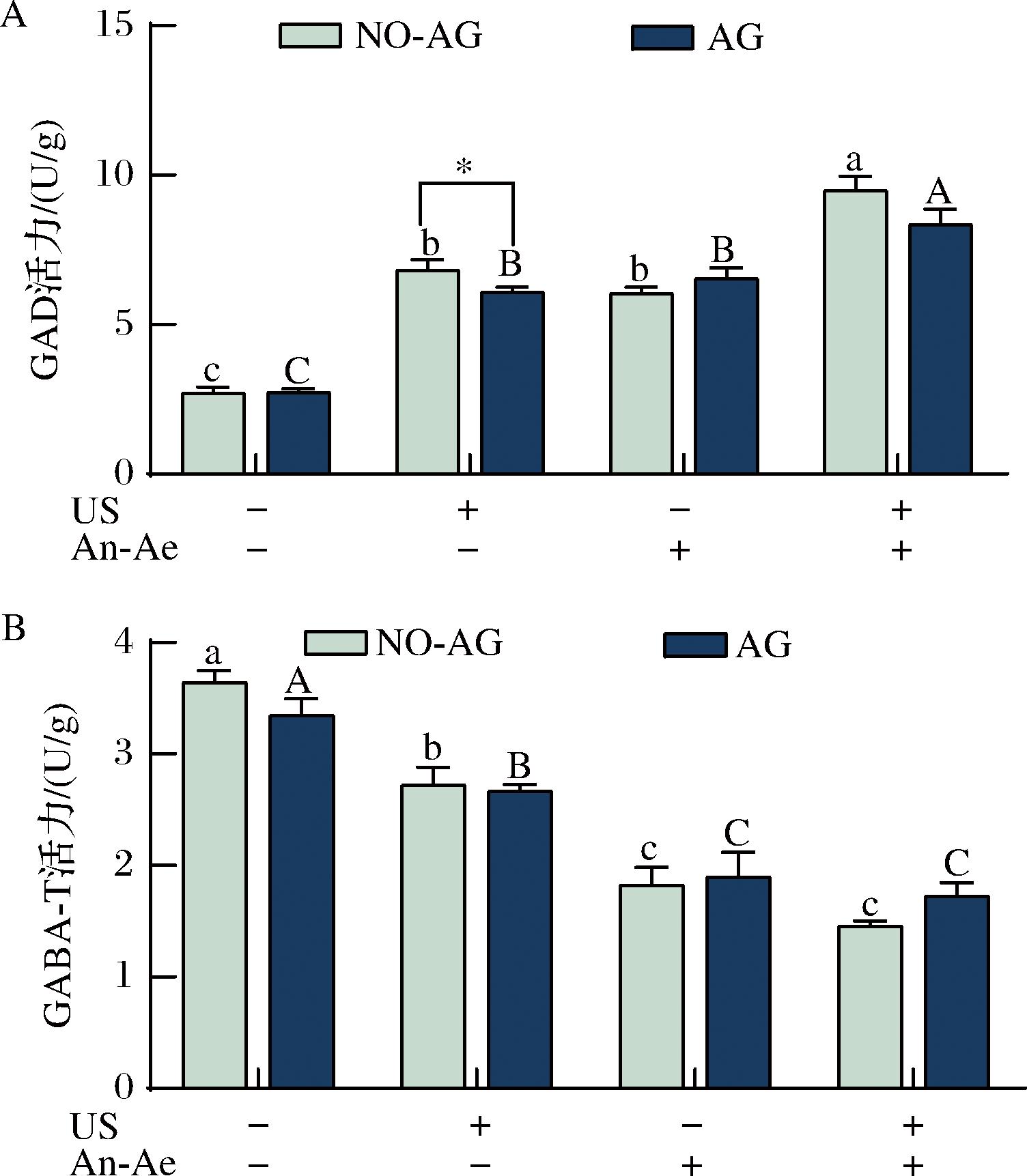
A-GAD活力;B-GABA-T活力
图5 不同处理组桑叶在添加氨基胍(AG)和未添加氨基胍 (NO-AG)条件下的GAD、GABA-T活力的变化
Fig.5 The activities of GAD and GABA-T in mulberry leaves with or without aminoguanidine (AG or NO-AG) in different treatment groups
GABA-T活力的变化趋势则与GAD相反(图5-B),经过不同处理后其活力呈下降趋势。其原因可能在于胁迫能够导致细胞内pH值降低,从而抑制GABA-T活力[4]。JI等[18]和LIU等[38]也发现了相似的研究结果,即超声或厌氧胁迫处理能一定程度上提高GAD的活力而抑制GABA-T的活力。添加AG后,除了厌氧好氧交替处理组的GAD活力,其他各处理组的GAD和GABA-T与未添加AG的对照组组结果无显著差异,表明添加AG对桑叶中的GAD和GABA-T的活力影响可能较小,这与WU等[39]的研究结果相似。
2.5 超声、厌氧好氧交替及超声协同厌氧好氧交替处理对桑叶多胺途径相关酶活力的影响
超声、厌氧好氧交替及超声协同厌氧好氧交替处理对DAO、PAO和AMADH活力的影响结果如图6所示。桑叶经过这3种方法处理后,DAO的活性比对照组分别提高了224%、245%和342%,PAO的活性分别提高了167%、196%和306%,AMADH的活性分别提高了63%、91%和169%。该结果显示,超声和厌氧好氧交替处理能够显著提高多胺降解途径的酶活性,而且对DAO的激活效果最佳。SUN等[20]和WU等[25]也得到了相似的结果,表明这3种处理方法能够通过激活多胺降解途径的关键酶促进GABA的富集。然而,添加AG后,DAO酶活性分别显著下降了62%、62%和56%,PAO酶活性则分别下降了29%、24%和23%。AMADH酶活性则不受AG影响。结果显示,AG主要通过抑制多胺降解途径的DAO酶活性来抑制GABA合成的,该结果与LIAO等[36]的研究结果相似。
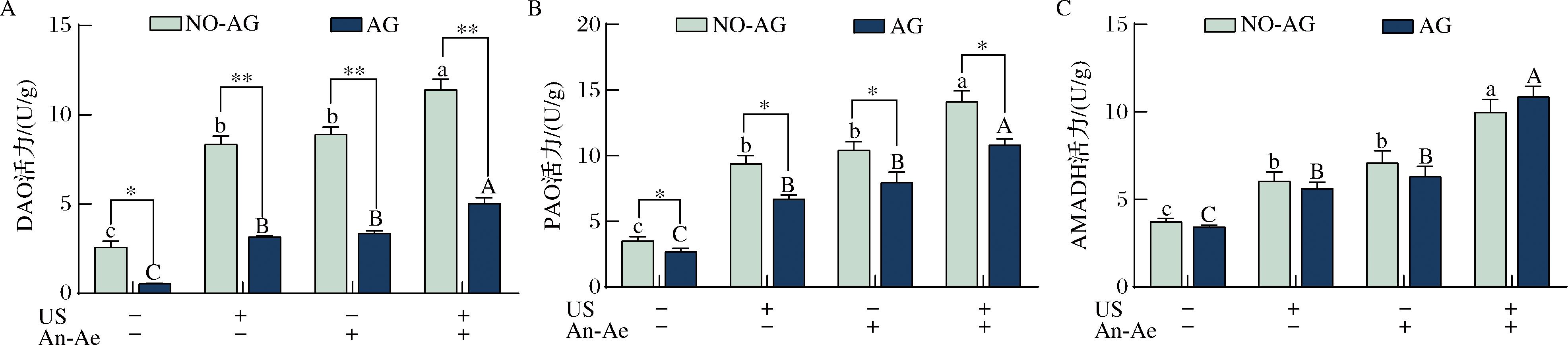
A-DAO活性;B-PAO活性;C-AMADH活性
图6 不同处理组桑叶在添加氨基胍(AG)和未添加氨基胍(NO-AG)条件下DAO、PAO、AMADH活力变化
Fig.6 The activities of DAO, PAO and AMADH in mulberry leaves with or without aminoguanidine (AG or NO-AG) in different treatment groups
2.6 超声、厌氧好氧交替及超声协同厌氧好氧交替处理对桑叶GAD、GABA-T、CaM和PAO基因表达的影响
超声、厌氧好氧交替及超声协同厌氧好氧交替处理对桑叶GAD、GABA-T、CaM和PAO基因表达的影响见图7。超声和超声协同厌氧好氧处理组的GAD基因表达量与对照组相比分别提高了2.9、3.1倍(图7-A),但是单独厌氧好氧交替处理则无显著影响。与之相反,单独超声组的GABA-T基因表达量与对照组相似,然而厌氧好氧和超声协同厌氧好氧交替处理显著抑制了GABA-T基因的表达(图7-B)。各处理组的CaM基因的表达均比对照组高,但组间无显著差异(图7-C)。众所周知,植物GAD受pH变化和Ca2/CaM复合物的双重调控,该机制在GABA的生物合成过程中起关键作用[40]。植物GAD的C端通常含有一个特异性的Ca2+/CaM结合结构域[41],在Ca2+存在条件下,CaM被激活,并与该结构域结合,从而调控GAD活性,促进GABA的合成[7]。已有研究表明,低氧胁迫一方面可通过细胞质酸化激活GAD,另一方面还可能诱导线粒体释放Ca2+至细胞质,进而激活Ca2+/CaM介导的GAD调控机制[42],促进GABA合成。此外,当植物受到外源性胁迫时,Ca2+首先以钙信号的形式参与刺激信号的转导,然后通过与CaM结合激活下游靶蛋白(如GAD)或调控相关转录因子,进而诱导一系列生理响应[38]。
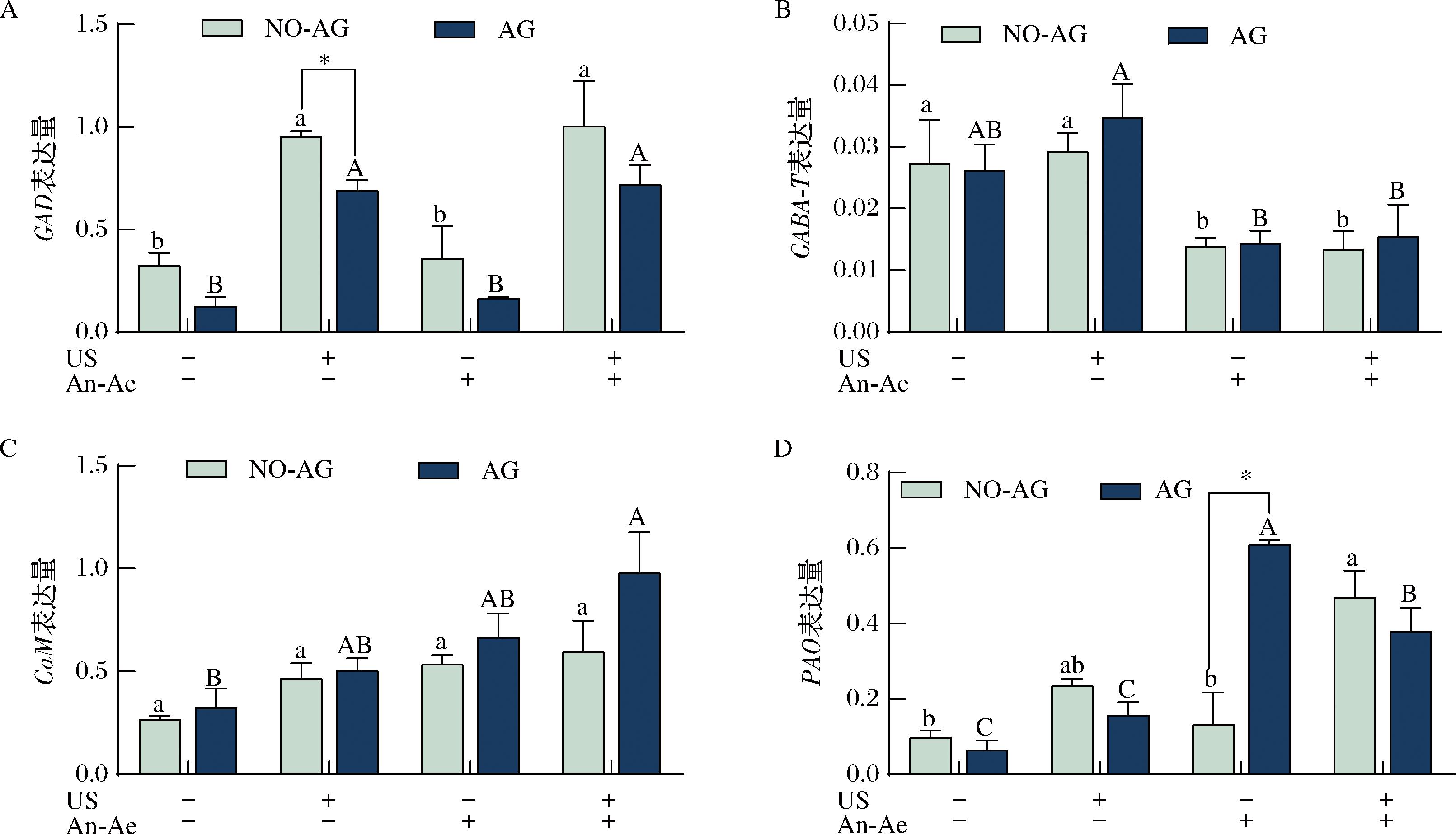
A-GAD基因表达;B-GABA-T基因表达;C-CaM基因表达;D-PAO基因表达
图7 不同处理组桑叶在添加氨基胍(AG)和未添加氨基胍(NO-AG)条件下GAD、GABA-T、CaM、PAO基因表达变化
Fig.7 Changes of GAD, GABA-T, CaM, and PAO gene expression in mulberry leaves with or without aminoguanidine (AG or NO-AG) in different treatment groups
超声和超声协同厌氧好氧交替处理能显著提高PAO基因表达量,其中2种方法联合处理时,PAO基因表达相对于对照组提高了4.8倍(图7-D),但是单独的厌氧好氧交替处理则不影响该基因的表达。LIU等[43]的研究发现,在低氧条件下,水心梨果实中大部分GAD和PAO基因显著上调,从而促进GABA的合成,该结果与本研究结果不同。添加AG后,超声组的GAD基因表达量显著(P<0.05)降低,而厌氧好氧交替处理组的PAO表达量则显著提高,其他基因的表达量则无显著差异。研究结果表明[36],虽然AG并不能抑制GAD的活力,但有可能通过抑制GAD基因的表达,影响GABA的积累。WANG等[44]的研究表明,添加AG能够提高厌氧好氧交替处理的桃子的多胺积累,从而通过反馈机制激活PAO基因的表达,以维持多胺代谢的平衡。本研究结果显示,不同的处理方法对GABA合成途径中的关键酶的基因表达影响不同。超声处理可能通过提高GAD、CaM和PAO的基因表达,进而促进GABA的合成[45],而厌氧好氧交替处理则可能通过降低GABA-T基因表达[46],从而降低GABA的降解,最终起到提高GABA积累的目的。超声协同厌氧好氧交替处理则可能是结合了两者的优势,从而起到协同提高GABA积累的作用。
2.7 相关性分析
为了进一步探讨这3种处理方法对GABA积累的影响及其与底物含量、酶活力以及基因表达的关联性,对所有数据进行了Pearson相关性分析。如图8所示,GABA的含量与Put和Spd含量,GAD、DAO、PAO和AMADH活力,以及CaM基因表达量呈正相关(P<0.05),但是与GABA-T活力和基因表达呈显著负相关(P<0.05)。GAD活力与GABA-T活力负相关,但是与Put、Spd和Spm含量,DAO、PAO和AMADH活力,以及PAO和CaM基因表达水平呈显著正相关。DAO、PAO和AMADH的活力则与多胺含量呈正相关。上述结果表明,在GABA支路中,超声协同厌氧好氧交替处理通过激活GAD活力、抑制GABA-T活力和基因表达以及提高CaM的基因表达,促进GABA在桑叶中的积累。在多胺降解途径中,DAO、PAO和AMADH活力的提高对GABA的积累起关键作用。

图8 超声协同厌氧好氧交替处理对桑叶GABA合成通路影响的相关性分析
Fig.8 Pearson correlation analysis of the effects of ultrasound combined with alternating anaerobic and aerobic treatment on GABA synthesis pathway in mulberry leaves
3 结论
本研究首次探讨了超声、厌氧好氧交替及其协同处理对桑叶GABA合成的影响机制。研究表明,这3种方法都能够显著提高GABA的含量,其中以两者联合处理对GABA的富集效果更佳。通过AG抑制剂处理发现,在这3种胁迫下,GABA支路是合成GABA的主要途径。此外,研究发现,超声、厌氧好氧交替以及两者协同处理均能够通过提高GAD、DAO、PAO和AMADH活力,降低GABA-T活力,促进GABA积累。然而,超声和厌氧好氧交替处理对关键酶基因表达的影响则不同。超声处理主要通过上调GAD、CaM和PAO基因表达,促进GABA合成;厌氧好氧交替处理通过下调GABA-T基因表达,减少GABA降解,从而提高其积累。超声协同厌氧好氧交替处理综合两者优势,进一步增强GABA富集效果。本研究有助于深入解析超声协同厌氧好氧交替处理胁迫桑叶积累GABA的机制,为开发富含GABA的桑叶茶或者功能食品提供理论和技术支撑。
[1] ZHANG Q L, ZHU L, LI H L, et al.Insights and progress on the biosynthesis, metabolism, and physiological functions of gamma-aminobutyric acid (GABA):A review[J].PeerJ, 2024, 12:e18712.
[2] 徐开媛, 王默涵, 刘金洋, 等. 谷氨酸钠协同低温冻融促进发芽芸豆富集γ-氨基丁酸的机理研究[J]. 食品与发酵工业, 2025, 51(5):190-196.XU K Y, WANG M H, LIU J Y, et al. Study on mechanism of γ-aminobutyric acid enrichment in germinated kidney beans with synergy treatment of monosodium glutamate and low-temperature freeze-thaw[J]. Food and Fermentation Industries, 2025, 51(5):190-196.
[3] 路静, 白术群, 郑学玲. 萌芽谷物中γ-氨基丁酸代谢及应激积累机制的研究进展[J]. 食品与发酵工业, 2024, 50(17):380-386.LU J, BAI S Q, ZHENG X L. Research progress on the metabolism of γ-aminobutyric acid and the mechanism of stress accumulation in germinated grains[J]. Food and Fermentation Industries, 2024, 50(17):380-386.
[4] SHELP B J, AGHDAM M S, FLAHERTY E J.γ-Aminobutyrate (GABA) regulated plant defense:Mechanisms and opportunities[J].Plants, 2021, 10(9):1939.
[5] YUAN D, WU X L, GONG B B, et al.GABA metabolism, transport and their roles and mechanisms in the regulation of abiotic stress (hypoxia, salt, drought) resistance in plants[J].Metabolites, 2023, 13(3):347.
[6] ZHU J, LI C Y, SUN L, et al.Application of γ-aminobutyric acid induces disease resistance in apples through regulation of polyamine metabolism, GABA shunt and reactive oxygen species metabolism[J].Scientia Horticulturae, 2022, 291:110588.
[7] GUO Z J, GONG J Q, LUO S T, et al.Role of γ-aminobutyric acid in plant defense response[J].Metabolites, 2023, 13(6):741.
[8] KATTIL A, HAMID, DASH K K, et al.Nutritional composition, phytochemical extraction, and pharmacological potential of mulberry:A comprehensive review[J].Future Foods, 2024, 9:100295.
[9] BAI H X, JIANG W, WANG X F, et al. Component changes of mulberry leaf tea processed with honey and its application to in vitro and in vivo models of diabetes[J]. Food Additives &Contaminants. Part A, Chemistry, Analysis, Control, Exposure &Risk Assessment, 2021, 38(11):1840-1852.
[10] JAMES A, WANG K, CHEN Y, et al.Functional benefits of mulberry leaf tea or extracts to alleviate metabolic diseases:Current opinion and perspectives[J].Food Bioscience, 2024, 59:104218.
[11] GAO T Q, CHEN J L, XU F, et al.Mixed mulberry fruit and mulberry leaf fermented alcoholic beverages:Assessment of chemical composition, antioxidant capacity in vitro and sensory evaluation[J].Foods, 2022, 11(19):3125.
[12] JAN B, PARVEEN R, ZAHIRUDDIN S, et al.Nutritional constituents of mulberry and their potential applications in food and pharmaceuticals:A review[J].Saudi Journal of Biological Sciences, 2021, 28(7):3909-3921.
[13] YOU W L, MENG X W, ZHANG J L, et al.Effects of dielectric barrier discharge cold plasma treatment on quality maintenance, energy and γ-aminobutyric acid accumulation of fresh-cut carrots[J].Food Control, 2024, 165:110649.
[14] TU J, LIU G H, JIN Y C, et al.Enrichment of γ-aminobutyric acid in mulberry leaves and the inhibitory effects of the water extract on ACE and α-glucosidase activity[J].Industrial Crops and Products, 2022, 177:114485.
[15] 石杨, 李美凤, 王家伦, 等. 厌氧时间对桑叶茶γ-氨基丁酸等主要成分及其感官品质的影响[J]. 南方农业学报, 2022, 53(4):1170-1176.SHI Y, LI M F, WANG J L, et al. Effects of anaerobic time on main mulberry leaf tea components such as γ-aminobutyric acid and sensory quality[J]. Journal of Southern Agriculture, 2022, 53(4):1170-1176.
[16] WANYO P, UNIVERSITY K, CHAMSAI T, et al. Enhancing bioactivity and bioaccessibility of mulberry leaf tea: The influence of pretreatment and kombucha fermentation[J]. ACS Food Science &Technology, 2025, 5(3):999-1009.
[17] KABA A K, JANICKA M.Relationship between the GABA pathway and signaling of other regulatory molecules[J].International Journal of Molecular Sciences, 2024, 25(19):10749.
A K, JANICKA M.Relationship between the GABA pathway and signaling of other regulatory molecules[J].International Journal of Molecular Sciences, 2024, 25(19):10749.
[18] JI D Y, MA H L, CHEN X M.Ultrasonication increases γ-aminobutyric acid accumulation in coffee leaves and affects total phenolic content and angiotensin-converting enzyme inhibitory activity[J].Journal of Food Processing and Preservation, 2021, 45(10):e15777.
[19] KEBERT M, RAPPARINI F, NERI L, et al.Copper-induced responses in poplar clones are associated with genotype-and organ-specific changes in peroxidase activity and proline, polyamine, ABA, and IAA levels[J].Journal of Plant Growth Regulation, 2017, 36(1):131-147.
[20] SUN Y, JI D Y, MA H L, et al.Ultrasound accelerated γ-aminobutyric acid accumulation in coffee leaves through influencing the microstructure, enzyme activity, and metabolites[J].Food Chemistry, 2022, 385:132646.
[21] CHI Z Y, DAI Y Q, CAO S F, et al.Exogenous calcium chloride (CaCl2) promotes γ-aminobutyric acid (GABA) accumulation in fresh-cut pears[J].Postharvest Biology and Technology, 2021, 174:111446.
[22] FANG W M, QI F, YIN Y Q, et al.Exogenous spermidine promotes γ-aminobutyric acid accumulation and alleviates the negative effect of NaCl stress in germinating soybean (Glycine max L.)[J].Foods, 2020, 9(3):267.
[23] YANG R Q, GUO Q H, GU Z X.GABA shunt and polyamine degradation pathway on γ-aminobutyric acid accumulation in germinating fava bean (Vicia faba L.) under hypoxia[J].Food chemistry, 2013, 136(1):152-159.
[24] YANG R Q.Polyamine degradation pathway regulating growth and GABA accumulation in germinating fava bean under hypoxia-NaCl stress[J].Journal of Agricultural Science and Technology, 2015, 17:311-320.
[25] WU Q Y, MA S Z, ZHANG W W, et al.Accumulating pathways of γ-aminobutyric acid during anaerobic and aerobic sequential incubations in fresh tea leaves[J].Food Chemistry, 2018, 240:1081-1086.
[26] GHUMMAN A, KAUR A, SINGH N.Impact of germination on flour, protein and starch characteristics of lentil (Lens culinari) and horsegram (Macrotyloma uniflorum L.) lines[J].LWT, 2016, 65:137-144.
[27] KHWANCHAI P, CHINPRAHAST N, PICHYANGKURA R, et al.Gamma-aminobutyric acid and glutamic acid contents, and the GAD activity in germinated brown rice (Oryza sativa L.):Effect of rice cultivars[J].Food Science and Biotechnology, 2014, 23(2):373-379.
[28] LU T C, MENG L B, YANG C P, et al.A shotgun phosphoproteomics analysis of embryos in germinated maize seeds[J].Plants, 2008, 228(6):1029-1041.
[29] XU J G, HU Q P, DUAN J L, et al.Dynamic changes in gamma-aminobutyric acid and glutamate decarboxylase activity in oats (Avena nuda L.) during steeping and germination[J].Journal of Agricultural and Food Chemistry, 2010, 58(17):9759-9763.
[30] CHUNG H J, JANG S H, CHO H Y, et al.Effects of steeping and anaerobic treatment on GABA (γ-aminobutyric acid) content in germinated waxy hull-less barley[J].LWT-Food Science and Technology, 2009, 42(10):1712-1716.
[31] SAIKUSA T, HORINO T, MORI Y.Distribution of free amino acids in the rice kernel and kernel fractions and the effect of water soaking on the distribution[J].Journal of Agricultural and Food Chemistry, 1994, 42(5):1122-1125.
[32] ZHANG L C, HAO N, LI W J, et al.Effect of Ultrasonic induction on the main physiological and biochemical indicators and γ-aminobutyric acid content of maize during germination[J].Foods, 2022, 11(9):1358.
[33] BOUCHÉ N, FROMM H.GABA in plants:Just a metabolite?[J].Trends Plant Science, 2004, 9(3):110-115.
[34] SHELP B J, BOWN A W, MCLEAN M D.Metabolism and functions of γ-aminobutyric acid[J].Trends in Plant Science, 1999, 4(11):446-452.
[35] WANG C Y, FAN L Q, GAO H B, et al.Polyamine biosynthesis and degradation are modulated by exogenous gamma-aminobutyric acid in root-zone hypoxia-stressed melon roots[J].Plant Physiology and Biochemistry, 2014, 82:17-26.
[36] LIAO J R, WU X Y, XING Z Q, et al.γ-Aminobutyric acid (GABA) accumulation in tea (Camellia sinensis L.) through the GABA shunt and polyamine degradation pathways under anoxia[J].Journal of Agricultural and Food Chemistry, 2017, 65(14):3013-3018.
[37] XIA Q, ZHENG Y R, WANG L B, et al.Proposing signaling molecules as key optimization targets for intensifying the phytochemical biosynthesis induced by emerging nonthermal stress pretreatments of plant-based foods:A focus on γ-aminobutyric acid[J].Journal of Agricultural and Food Chemistry, 2023, 71(34):12622-12644.
[38] LIU M Q, WANG B R, QIU Y C, et al.Regulation and mechanism of enzyme metabolism in germinated hemp seeds by ultrasound combined with exogenous calcium chloride treatment[J].International Journal of Biological Macromolecules, 2024, 276:133732.
[39] WU Q Y, GUO R, ZHANG W W, et al.Effects of aminoguanidine on γ-aminobutyric acid accumulation pathways in fresh tea leaves under hypoxic conditions[J].International Journal of Food Science & Technology, 2020, 55(2):899-907.
[40] BAUM G, LEV-YADUN S, FRIDMANN Y, et al.Calmodulin binding to glutamate decarboxylase is required for regulation of glutamate and GABA metabolism and normal development in plants[J].The EMBO Journal, 1996, 15(12):2988-2996.
[41] AKTER N, KULSUM U, MONIRUZZAMAN M, et al.Truncation of the calmodulin binding domain in rice glutamate decarboxylase 4 (OsGAD4) leads to accumulation of γ-aminobutyric acid and confers abiotic stress tolerance in rice seedlings[J].Molecular Breeding, 2024, 44(3):21.
[42] SUBBAIAH C C, BUSH D S, SACHS M M.Mitochondrial contribution to the anoxic Ca2+ signal in maize suspension-cultured cells[J].Plant Physiology, 1998, 118(3):759-771.
[43] LIU X, LIU D H, CHEN T, et al.Watercore pear fruit respiration changed and accumulated γ-aminobutyric acid (GABA) in response to inner hypoxia stress[J].Genes, 2022, 13(6):977.
[44] WANG W, ZHENG X B, LIU S H, et al.Polyamine oxidase (PAO)-mediated polyamine catabolism plays potential roles in peach (Prunus persica L.) fruit development and ripening[J].Tree Genetics &Genomes, 2021, 17:1-15.
[45] SAMARAH N H, AL-QURAAN N A, AL-WRAIKAT B S.Ultrasonic treatment to enhance seed germination and vigour of wheat (Triticum durum) in association with γ-aminobutyric acid (GABA) shunt pathway[J].Functional Plant Biology, 2023, 50(4):277-293.
[46] MEI X, CHEN Y Y, ZHANG L Y, et al.Dual mechanisms regulating glutamate decarboxylases and accumulation of γ-aminobutyric acid in tea (Camellia sinensis) leaves exposed to multiple stresses[J].Scientific Reports, 2016, 6:23685.