我国是全球最大的草莓生产国和消费国[1-2]。草莓作为世界七大水果之一,素有“水果皇后”之称[3-4]。草莓汁清甜可口,富含维生素、矿物质、氨基酸、酚类、黄酮等营养成分[5-6],具有改善便秘、促进肠道蠕动、抗氧化、延缓衰老、预防心脑血管疾病等营养功效[6-7],但由于其营养丰富、含水量高,不耐贮藏、极易腐烂变质,以草莓汁为代表的草莓制品易发生酶促及非酶促褐变,导致品质劣变等痛点制约着草莓资源的深加工利用[1,8]。
近年来,功能性发酵产品成为全球消费新趋势,益生菌发酵果汁不仅营养价值高,且在保留水果自然风味的基础上增添了发酵制品的独特风味,提升产品附加值[4]。植物乳植杆菌(Lactiplantibacillus plantarum)是最常用的植源性食品商业发酵菌属之一,具备良好的耐酸性和发酵适应性,在果蔬发酵中通过产酶释放酚类,转化生物活性物质,进而提升制品风味、抗氧化活性和营养价值[9]。唾液链球菌嗜热亚种(Streptococcus salivarius subsp.thermophilus)因其优良的产酸、产粘、产香等特性在发酵行业得到广泛应用[10]。已有研究证实草莓汁可作为理想的益生菌载体,L. plantarum和S. thermophilus可利用草莓中丰富的活性物质,改善草莓汁的色泽特性、抗氧化活性及营养功效[4]。但活益生菌在产品加工、贮藏及人体胃肠道消化过程中极易失活,且研究表明部分益生菌仍存在安全性风险[11]。而非活菌型益生菌发酵果汁不仅具有相较活菌体系相同甚至更强的益生作用,还具备更优越的加工贮运稳定性、安全性、抗逆性和协同功效等优势,发展前景广阔[12]。
本研究以草莓汁为原料,以理化指标(色差、pH值、可溶性固形物含量、总酚含量、1,1-二苯基-2-苦基肼(2,2-diphenyl-1-picrylhydrazyl,DPPH)和2,2′-联氮基双- (3-乙基苯并噻唑啉-6-磺酸)(2,2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)阳离子自由基清除率)和感官评分为依据优化L. plantarum和S. thermophilus混菌发酵工艺。对照鲜汁,利用顶空固相微萃取-气相色谱-质谱技术(headspace solid-phase microextraction-gas chromatography-mass spectrometry,HS-SPME-GC-MS)探析非活菌型益生菌发酵草莓汁的挥发性物质的组成。通过构建脂多糖诱导的RAW264.7细胞炎症模型及高糖诱导的HepG2细胞胰岛素抵抗模型进行营养功效验证,为产品市场化提供理论依据。
1 材料与方法
1.1 材料与试剂
实验所用市售新鲜草莓购自陕西省西安市鄠邑区红颜奶油草莓;植物乳植杆菌菌粉(Lactiplantibacillus plantarum 85,LP85)和唾液链球菌嗜热亚种菌粉(Streptococcus salivarius subsp.Thermophilus 81,ST81),西安米先尔生物科技有限公司;碳酸氢钠(食品级)、福林酚试剂、碳酸钠、DPPH试剂盒、无水乙醇、ABTS试剂盒、过硫酸钾为分析纯,没食子酸为标准品,晶博生物科技有限公司;RAW246.7细胞、HepG2细胞,中国科学院细胞库;杜氏改良Eagle培养基(Dulbecco’s modified eagle medium,DMEM)、胎牛血清、胰蛋白酶、脂多糖(lipopolysaccharide,LPS),结晶牛胰岛素、二甲双胍,上海源叶生物科技有限公司;葡萄糖、Cell counting kit-8(CCK-8)试剂盒、半胱天冬蛋白酶-3(Caspase-3,CASP3)试剂盒、Trizol、Taq酶逆转录试剂盒、MCP-1、NO、PGE2、IL-6 ELISA试剂盒,南京建成生物工程研究所。RT-qPCR引物由北京清科生物技术有限公司提供。
1.2 仪器与设备
IN70L恒温培养箱,苏州环美生物医疗科技有限公司;DK-98-ⅡA电热恒温水浴锅,天津泰斯特仪器有限公司;3nh-NS800色差仪,深圳三恩时科技有限公司;PHS-3C pH计,上海仪电科学仪器有限公司;MASTER-53阿贝折光仪,日本ATAGO;K6600全波长酶标仪,北京凯奥科技发展有限公司;7890B-5977B气相色谱-质谱联用仪,美国Agilent公司;Agilent 122-7032毛细管柱(30 m×250 μm×0.25 μm);MOC-18AIC二氧化碳恒温细胞培养箱,日本SANYO公司;3K15高速冷冻离心机,德国Sigma公司;IQ5荧光定量PCR仪,美国BIO-RAD公司。
1.3 实验方法
1.3.1 发酵草莓汁工艺
1.3.1.1 草莓汁的制备
用无菌水重悬菌体,按比例称量LP85和ST81菌粉(菌粉活菌数≥1×1010 CFU/g),配置菌液。选择新鲜成熟品质良好的草莓,去蒂去叶,流水反复冲洗直至完全去除杂质。按照料液比2∶1(质量比)加水,混匀打浆160 s,使用200目纱布过滤得到草莓汁。配制100 g/L的碳酸氢钠(食品级),调草莓汁pH值至4.0,75 ℃下巴氏杀菌30 min。待冷却至室温后将菌液按体积百分比接种至草莓汁中,置于振荡培养箱中,37 ℃发酵,发酵结束后取出进行75 ℃巴氏杀菌30 min,得到草莓发酵液。样品放置在-20 ℃备用。
1.3.1.2 工艺优化
固定接种前pH值4.0、发酵温度37 ℃、巴氏杀菌75 ℃下巴氏杀菌30 min,以发酵后pH值和喜爱度打分为评价指标,对接种量、发酵时间、糖量、混菌比例4个因素设计L9(34)正交试验。根据理化指标和感官评价结果考察上述因素对非活菌型益生菌发酵草莓汁品质的影响。因素和水平见表1。
表1 L9(34)正交试验因素水平表
Table 1 Factors and levels of L9(34) orthogonal test

水平因素A(菌量)/(CFU/mL)B(发酵时间)/hC(糖量)/(g/L)D(LP85∶ST81接种体积比)110610501∶1210714801∶33108181003∶1
表2 RT-qPCR引物序列
Table 2 Sequence of primers used in RT-qPCR

基因上游引物(5′-3′)下游引物(5′-3′)TNF-αGACGTGGAACTGGCAGAAGAGTTGGTGGTTTGTGAGTGTGAGiNOSGTTCTCAGCCCAACAATACAAGAGTGGACGGGTCGATGTCACINSRAAAACGAGGCCCGAAGATTTGAGCCCATAGACCCGGAAGGLUT4AGTCTTCACCTTGGTCTCGGCAGAGCCACAGTCATCAGGAG6paseTACCTTGCGGCTCACTTTCTCTGGAGGCTGGCATTGSK3βCTTTTCACAGGGCTACGCACAGGCAAGCACATTTCCAKTTATCCAGGCTGTAGCAGACAGACAATTTCTGCACCATAGAAACGTLR4ATGGGTTTAGGCGAGAGTTTGCCGGAAAGTTATTGTGGTGGTGAPDHGAAGGTGAAGGTCGGAGTCAACCAGAGTTAAAAGCAGCCCTGGT
1.3.1.3 感官评价及理化指标测定
参考NY 82.2—1988《果汁测定方法 感官检验》及文献[13]中的方法并针对性优化调整。由20名(8男12女,年龄:20~35岁)受过专业感官培训的评价员组成的评价小组从色泽、风味、组织状态和口感等方面进行品评打分,依据评分对样品进行排序,样品的位次作为确定非活菌型发酵草莓汁最优工艺的依据。
色差(ΔE):参考LI等[14]的方法测定,使用色差仪依据ΔE对样品进行排序。pH值、可溶性固形物含量、总酚含量、样品DPPH和ABTS阳离子自由基清除率参考WANG等[15]的方法测定。
1.3.2 最优制备工艺下草莓发酵汁的挥发性香气成分分析
将最优制备条件的草莓发酵汁和未发酵样本,装入顶空样品瓶进行顶空固相微萃取,完成气相色谱质谱联用仪(GC-MS)的分离检测[16]。移取5 mL样品于20 mL顶空瓶中,用封口膜密封。40 ℃水浴平衡10 min,萃取15 min。进样,250 ℃解析7 min。GC-MS条件:采用Agilent 122-7032毛细管柱(30 m×250 μm×0.25 μm),以99.999%的高纯度氦气作为载气,流速为1.6 mL/min。采用不分流进样,进样口温度为250 ℃。程序升温:起始40 ℃保持5 min,然后以5 ℃/min升至120 ℃,保持8 min,再以10 ℃/min升至220 ℃保持3 min。MS条件采用EI(electron impact)电离模式,电子轰击能量为70 eV,离子源温度为230 ℃,采用标准扫描模式。通过计算机检索各组分并与美国国家标准技术研究所(National Institute of Standards and Technology, NIST)14标准质谱数据库检索对比分析,保留与标准质谱库相似度>80%的化合物,并对各色谱峰按面积归一化法计算各化学成分的相对百分含量。
1.3.3 草莓发酵汁营养功效分析
1.3.3.1 脂多糖诱导免疫细胞
RAW264.7细胞复苏及培养:将冻存的细胞在37 ℃恒温水浴中解冻,吸取细胞悬浊液至新的离心管中,加入2 mL培养基,吹打混匀,1 000 r/min离心4 min,去除上清液,再次加入2 mL培养基后轻轻吹打混匀。将所有细胞悬液移至新的培养瓶中,置于37 ℃、5%CO2(体积分数)的细胞培养箱中培养,待细胞密度达到80%~90%时进行传代培养。
RAW264.7细胞分组及处理:将细胞分为空白组(胎牛血清+DMEM培养基),模型组(胎牛血清+含10 μg/mL LPS的DMEM培养基),未发酵组(未发酵草莓汁+含有10 μg/mL LPS的DMEM培养基),发酵组(最优发酵草莓汁+含有10 μg/mL LPS的DMEM培养基),培养24小时。
1.3.3.2 高糖诱导HepG2细胞
参考文献[17]中的方法采用高糖高胰岛素培养基诱导培养胰岛素抵抗HepG2细胞(IR-HepG2)。活化后的HepG2细胞在含10%(体积分数)胎牛血清和1%(体积分数)双抗的DMEM培养基中于37℃、5%CO2(体积分数)的培养箱中进行培养,当细胞融合度达到80%~90%时,取阴性对照组以外的细胞在含100 IU胰岛素的DMEM全培养基培养,24 h后用无血清无酚红DMEM高糖培养基继续培养12 h,使细胞同步化,得IR-HepG2细胞。
用胰酶消化IR-HepG2细胞,1 500 r/min离心5 min去上清液,加入无血清无酚红DMEM高糖培养基使其均匀悬浮。实验分为阴性对照组(葡萄糖5.5 mmol/L)、模型组(葡萄糖5.5 mmol/L+胰岛素100 μg/mL,葡萄糖30 mmol/L+胰岛素100 μg/mL)、二甲双胍组(葡萄糖30 mmol/L+胰岛素100 μg/mL+二甲双胍100 μmol/L)、发酵草莓汁组(葡萄糖30 mmol/L+胰岛素100 μg/mL+最优发酵草莓汁40 μL/mL)和未发酵草莓汁组(葡萄糖30 mmol/L+胰岛素100 μg/mL+未发酵草莓汁40 μL/mL)。每组设置6个复孔,孵育24 h后,以葡萄糖氧化酶法检测上清液中的葡萄糖含量,计算各孔细胞的葡萄糖消耗量ΔGC。
1.5.3 细胞活力、凋亡及相关蛋白、mRNA分析
采用CCK-8试剂盒检测细胞活力[18]。采用ELISA试剂盒测定Caspase-3活性[19]。用Trizol试剂盒提取细胞总RNA,逆转录构建cDNA,使用实时荧光定量PCR仪检测RAW264.7细胞的免疫炎症标志物—TNF-α、iNOS mRNA的表达水平;HepG2细胞INSR、GLUT4、G6pase、GSK3β、AKT及TLR4 mRNA的表达水平,以GAPDH作为内参基因计算相对表达量,各组mRNA表达以SED-H2O组的倍数表示[20]。按照ELISA试剂盒说明书进行操作,用酶标仪在450 nm处测量吸光值,计算RAW264.7细胞中MCP-1、NO、PGE2及IL-6的蛋白表达量。
1.4 统计分析
发酵实验均做3次重复,细胞实验均做6次重复,连续变量以“平均值±标准差”表示。数据采用R(V4.2.2)软件进行显著性分析。
2 结果与分析
2.1 发酵工艺优化
选取菌量(A)、发酵时间(B)、糖量(C)、接种比例(D)作为自变量因素,以感官评分作为因变量。如表3所示,各因素对草莓汁品质的影响顺序为:菌量(A)>糖量(C)>发酵时间(B)>接种比例(D)。根据感官评分,最优发酵工艺条件为菌量107 CFU/mL、糖添加量100 g/L、发酵时间14 h、接种体积比LP85∶ST81=3∶1。表4方差分析结果表明,接种菌量(A)和糖添加量(C)对感官评分有显著影响(P<0.05),而发酵时间和接种比例的影响不显著(P>0.05)。
表3 非活菌型发酵草莓汁正交试验结果
Table 3 Orthogonal test results of pasteurized fermented strawberry juice
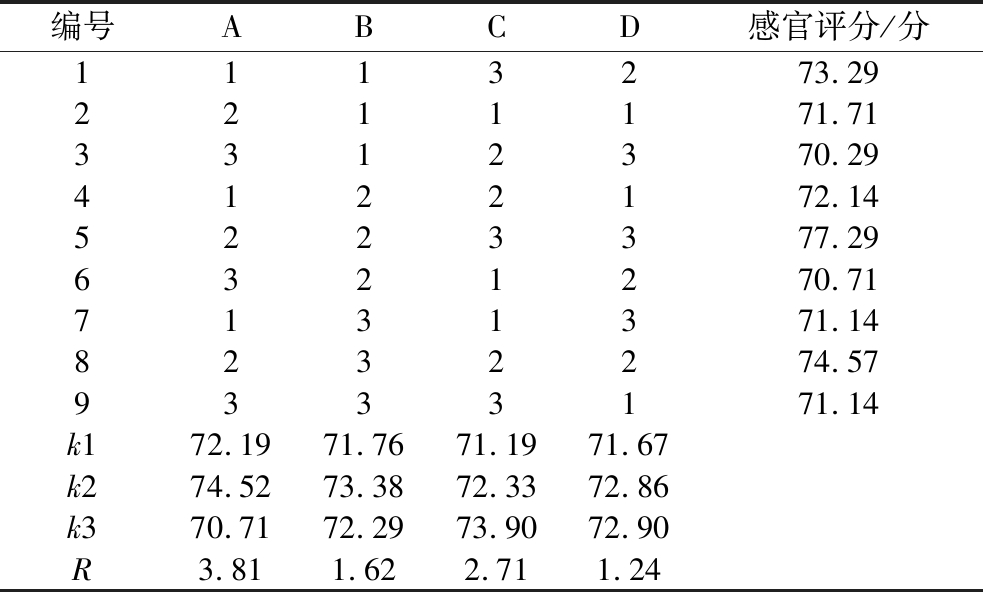
编号ABCD感官评分/分1113273.292211171.713312370.294122172.145223377.296321270.717131371.148232274.579333171.14k172.1971.7671.1971.67k274.5273.3872.3372.86k370.7172.2973.9072.90R3.811.622.711.24
表4 方差分析结果
Table 4 Analysis of Variance Results
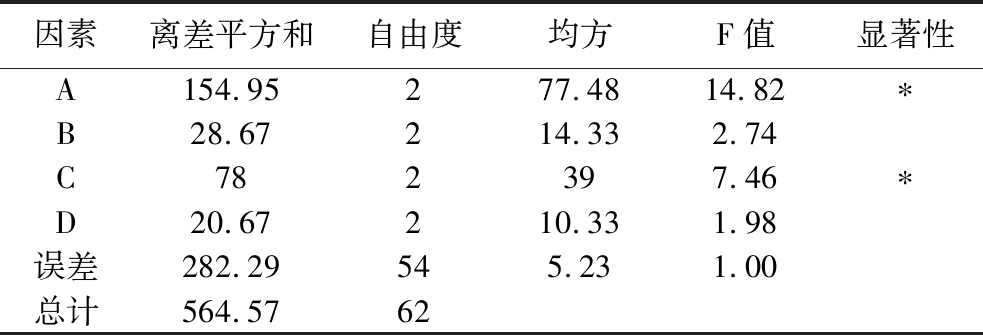
注:*表示差异显著(P<0.05)。
因素离差平方和自由度均方F值显著性A154.95277.4814.82∗B28.67214.332.74C782397.46∗D20.67210.331.98误差282.29545.231.00总计564.5762
如图1所示,发酵液pH降低,总可溶性固形物含量以及总酚含量增加。与T0相比,发酵14 h组的DPPH自由基清除能力的增幅为20.69%~36.13%,其中T14-6最高。除T10-1外,对比鲜汁,发酵组对ABTS阳离子自由基的清除能力均有显著性提升(P<0.05),其中T14-5组的清除率提高了58.92%。发酵组与放置相同时间的未发酵组与鲜汁相比,ΔE值降低,表明LP85和ST81混菌发酵对草莓汁具有显著的护色作用。这种护色效果可能是由于发酵抑制了多酚氧化酶的活性,并产生了具有强抗氧化活性的代谢产物,从而减轻了草莓汁的褐变[14,21]。

a-pH值;b-总可溶性固形物含量;c-总酚含量;d-色差;e-DPPH自由基清除率;f-ABTS阳离子自由基清除率
图1 不同发酵工艺对非活菌型益生菌发酵草莓汁pH、可溶性固形物含量、总酚含量、色差、DPPH和ABTS阳离子自由基清除率的影响
Fig.1 Effects of samples’pH, soluble solids content, total phenols content, color difference, DPPH and ABTS scavenging rate of pasteurized probiotic fermented strawberry juice by different fermentation process
注:T0:未发酵的新鲜草莓汁;T10:未发酵放置10 h;T10-1:发酵10 h 菌量106 CFU/mL 糖量100 g/L LP85∶ST81=1∶3;T10-2:发酵10 h 菌量107 CFU/mL 糖量50 g/L LP 85∶ST81=1∶1;T10-3:发酵10 h 菌量108 CFU/mL 糖量80 g/L LP85∶ST81=3∶1;T14:未发酵放置14 h; T14-4:发酵14 h 菌量106 CFU/mL 糖量80 g/L LP85∶ST81=1∶1;T14-5:发酵14 h 菌量107 CFU/mL糖量100 g/L LP85∶ST81=3∶1;T14-6:发酵14 h 菌量108 CFU/mL 糖量50 g/L LP85∶ST81=1∶3;T18:未发酵放置18 h;T18-7:发酵18 h 菌量106 CFU/mL糖量50 g/L LP85∶ST81=3∶1; T18-8:发酵18 h 菌量107 CFU/mL糖量80 g/L LP85∶ST81=1∶3;T18-9:发酵18 h 菌量108 CFU/mL糖量100 g/L LP85∶ST81=1∶1。
综合理化指标和感官评价结果,最终选定T14-5为最优发酵条件组。该条件下,感官评分为81.29分,风味以果香和发酵香为主,口感、质地、风味和色泽均有所提升,风味协调,色泽鲜红,口感酸甜适中。
2.2 挥发性成分分析
采用HS-SPME-GC-MS技术对未发酵的新鲜草莓汁(T0)和最优发酵条件组(T14-5)的挥发性风味物质进行分析鉴定。T0共检测到47种挥发性物质,T14-5共检测到43种。酯类是草莓汁挥发性物质中的主要成分,是形成草莓花果香味和发酵制品独特风味的主要来源[22-23],如图2所示,2组样品中酯类物质的相对含量均超过50%。如表5所示,相较于T0样品,T14-5损失了乙酸丁酯、乙酸己酯、丁酸乙酯等大量酯类物质,可能是由于益生菌的高酯酶活性[22]。丁酸甲酯是T14-5中的主要酯类挥发性成分(21.48%),具有苹果和干酪香气。T14-5检测到6种醛类物质,其中反式-2-己烯醛(5.03%)具有清新的绿叶和水果香气。2,4-二甲基苯甲醛是苦杏仁味的来源,发酵后未检出。酮类是理想的挥发性成分,有助于产生甜味和果香味。发酵后酮类显著增加,其中4-羟基-2,5-二甲基l-3(2H)-呋喃酮,2,5-二甲基-4-甲氧基-3(2H)-呋喃酮是草莓的关键香气物质[24]。异佛尔酮仅在T14-5检测到,呈樟脑、薄荷味。此外,酚类、酸类物质经发酵后均有不同程度的增加。其中2,4-二叔丁基酚具有抗氧化、抗炎功效,发酵后其含量提升了3倍[25]。
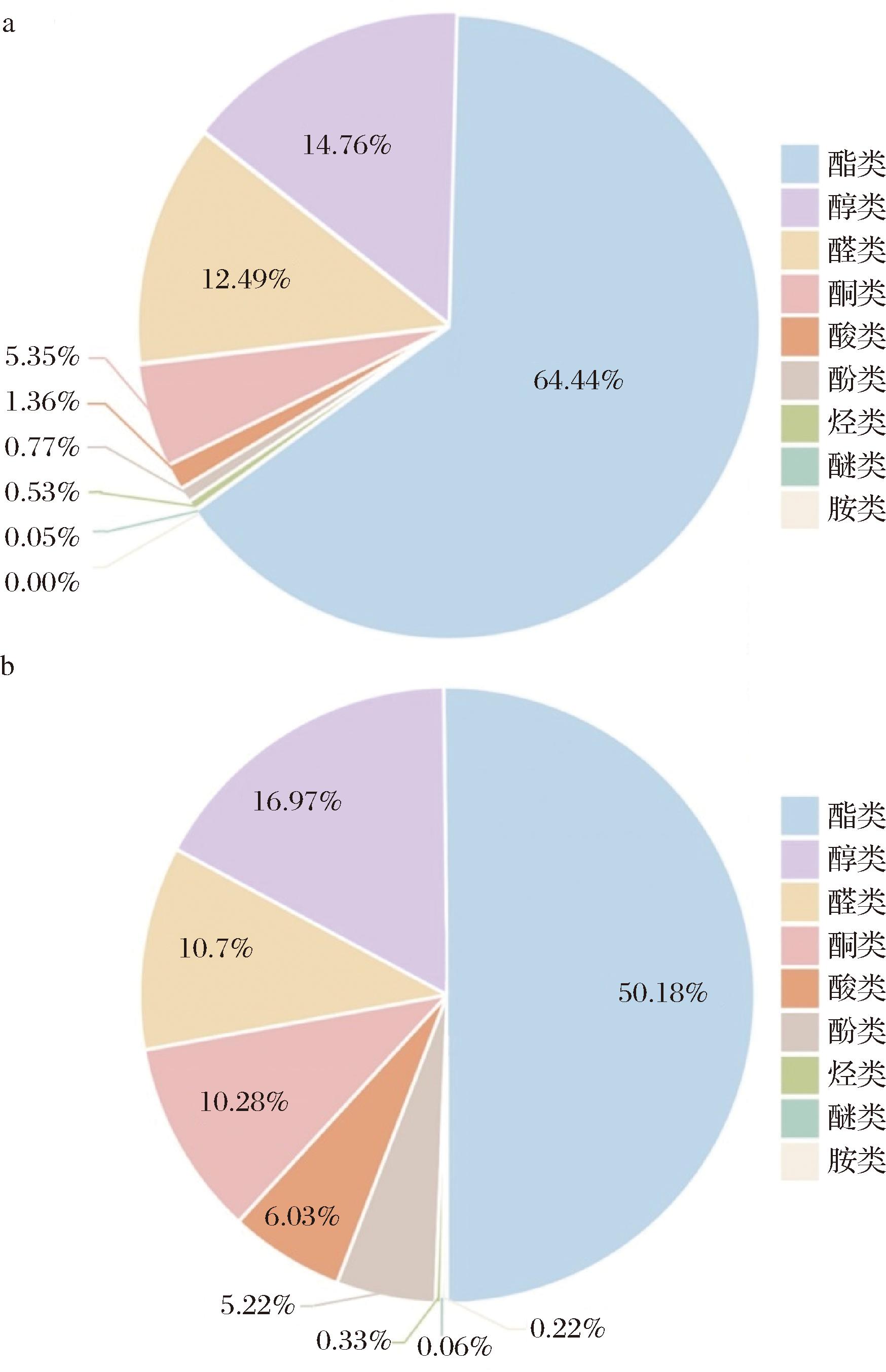
a-鲜汁(T0);b-最优发酵草莓汁(T14-5)
图2 草莓汁挥发性物质种类
Fig.2 Types of volatile compounds in strawberry juice
表5 T0与T14-5差异挥发性成分相对含量表
Table 5 Relative content of differential volatile compounds between T0 and T14-5
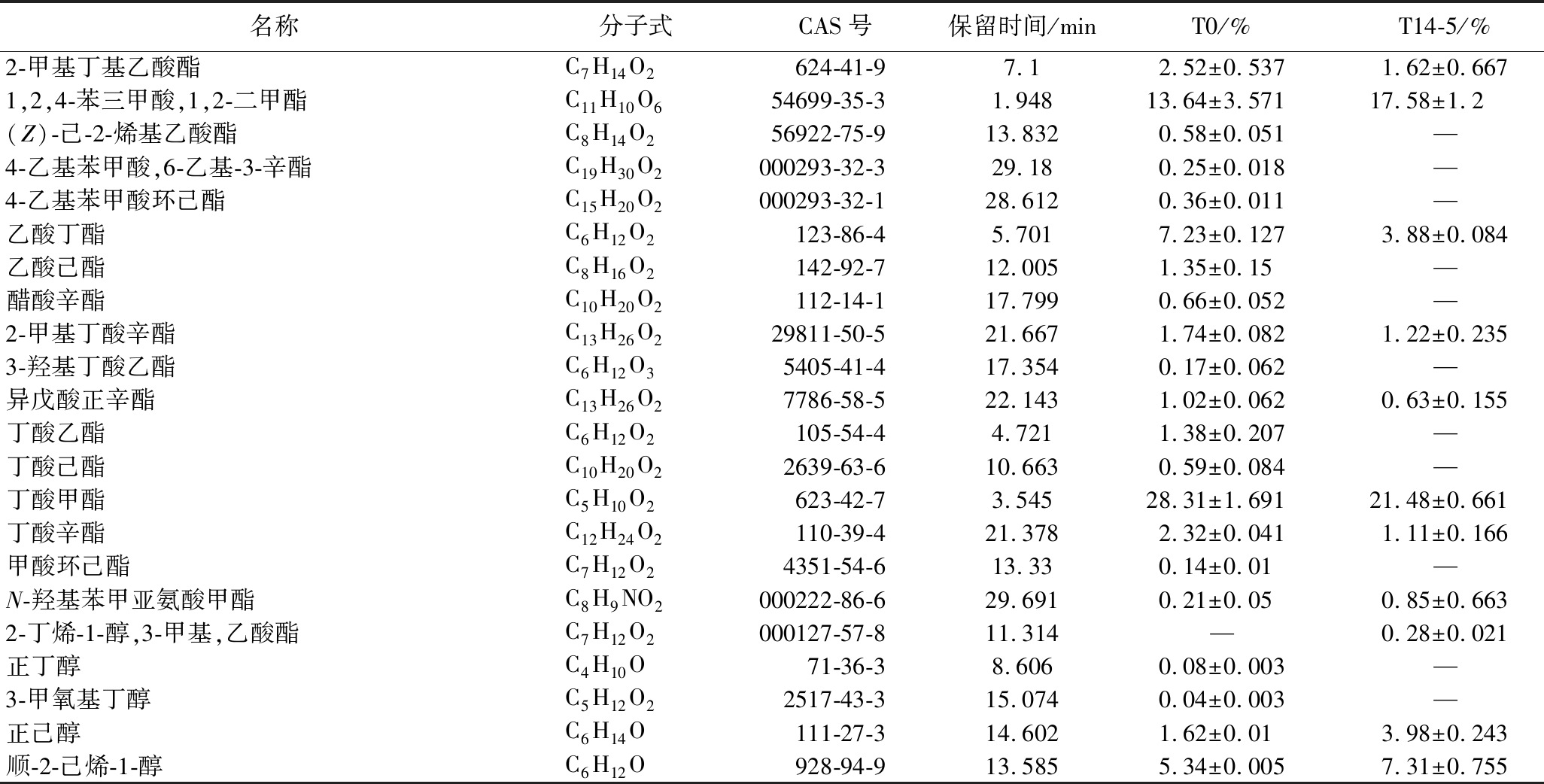
名称分子式CAS号保留时间/minT0/%T14-5/%2-甲基丁基乙酸酯C7H14O2624-41-97.12.52±0.5371.62±0.6671,2,4-苯三甲酸,1,2-二甲酯C11H10O654699-35-31.94813.64±3.57117.58±1.2(Z)-己-2-烯基乙酸酯C8H14O256922-75-913.8320.58±0.051—4-乙基苯甲酸,6-乙基-3-辛酯C19H30O2000293-32-329.180.25±0.018—4-乙基苯甲酸环己酯C15H20O2000293-32-128.6120.36±0.011—乙酸丁酯C6H12O2123-86-45.7017.23±0.1273.88±0.084乙酸己酯C8H16O2142-92-712.0051.35±0.15—醋酸辛酯C10H20O2112-14-117.7990.66±0.052—2-甲基丁酸辛酯C13H26O229811-50-521.6671.74±0.0821.22±0.2353-羟基丁酸乙酯C6H12O35405-41-417.3540.17±0.062—异戊酸正辛酯C13H26O27786-58-522.1431.02±0.0620.63±0.155丁酸乙酯C6H12O2105-54-44.7211.38±0.207—丁酸己酯C10H20O22639-63-610.6630.59±0.084—丁酸甲酯C5H10O2623-42-73.54528.31±1.69121.48±0.661丁酸辛酯C12H24O2110-39-421.3782.32±0.0411.11±0.166甲酸环己酯C7H12O24351-54-613.330.14±0.01—N-羟基苯甲亚氨酸甲酯C8H9NO2000222-86-629.6910.21±0.050.85±0.6632-丁烯-1-醇,3-甲基,乙酸酯C7H12O2000127-57-811.314—0.28±0.021正丁醇C4H10O71-36-38.6060.08±0.003—3-甲氧基丁醇C5H12O22517-43-315.0740.04±0.003—正己醇C6H14O111-27-314.6021.62±0.013.98±0.243顺-2-己烯-1-醇C6H12O928-94-913.5855.34±0.0057.31±0.755
续表5

注:—表示未检出。
名称分子式CAS号保留时间/minT0/%T14-5/%3-甲基-4-戊醇C6H12O51174-44-813.5110.22±0.0370.1±0.017芳樟醇C10H18O78-70-619.6586.40±0.0554.99±0.244S-(Z)-3,7,11-三甲基-1,6,10-十二烷三烯-3-醇C15H26O142-50-734.5540.62±0.03—反-α,α-5-三甲基-5-乙烯基四氢化-2-呋喃甲醇C10H18O234995-77-217.6260.45±0.0760.58±0.037反式-2-己烯醛C6H10O6728-26-310.1459.21±0.4365.03±0.2252,4-二甲基苯甲醛C9H10O15764-16-627.2262.75±0.305—壬醛C9H18O124-19-615.470.14±0.0160.11±0.0292,5-二甲基苯甲醛C9H10O5779-94-227.23—5.07±0.2322,4-二叔丁基酚C14H22O96-76-437.780.25±0.0570.96±0.092二丁基羟基甲苯C15H24O128-37-031.971.36±0.6361.57±0.3054-烯丙基苯酚C9H10O501-92-837.954—0.42±0.0324-乙基苯酚C8H10O123-07-936.168—2.13±0.2254-丙基苯酚C9H12O645-56-737.205—0.14±0.015冰醋酸C2H4O264-19-717.0660.77±0.1645.43±1.1312-甲基丁酸C5H10O2116-53-022.86—0.35±0.1632-甲基己酸C7H14O24536-23-623.091—0.14±02-甲基丙酸C4H8O279-31-220.251—0.11±0.0172,5-二甲基-4-甲氧基-3(2H)-呋喃酮C7H10O34077-47-820.4985.30±0.587.55±0.6374-羟基-2,5-二甲基l-3(2H)-呋喃酮C6H8O33658-77-334.2330.05±0.0220.31±0.034乙酰丙酮C4H8O2513-86-012.215—2.16±0.011异佛尔酮C9H14O78-59-120.408—0.22±0.003
2.3 发酵工艺优化
2.3.1 发酵草莓汁对LPS诱导损伤RAW264.7细胞活力及炎症因子的影响
如图3所示,与NC组相比,除F10和R10组外,其余组RAW264.7细胞存活率上升,且在相同浓度下发酵草莓汁组更能提升细胞活力,其中80 μL/mL发酵草莓汁组的细胞存活率最高。相较于NC组,LPS组各炎症因子的mRNA及蛋白表达量显著升高(P<0.05)。对比LPS组,非活菌型发酵草莓汁可逆转这一炎症反应,降低各炎症因子的mRNA及蛋白表达,且草莓汁浓度越高,缓解效果越明显;除R20组iNOS mRNA表达水平高于LPS组外,其余未发酵组各炎症因子的mRNA及蛋白表达量均随浓度的增加而下降。实验表明,非活菌型发酵草莓汁可显著提高LPS诱导的免疫细胞存活率,可有效降低相关促炎因子的表达,缓解细胞炎症反应。其中40 μL/mL发酵草莓汁的改善效果最佳。

a-RAW264.7细胞存活率;b-TNF-α mRNA相对表达量;c-iNOS mRNA相对表达量;d-MCP-1含量;e-NO含量;f-PGE2含量;g-IL-6含量
图3 发酵前后不同浓度草莓汁对免疫细胞活力及炎症因子表达水平的影响
Fig.3 Effects of strawberry juice on immune cell viability and expressions of inflammatory cytokine levels
注:NC:正常对照组;LPS:炎症模型组;F:发酵草莓汁干预组;R:未发酵草莓汁干预组;10、20、40、80分别代表以μL/mL为单位的浓度梯度;下同。
2.3.2 发酵草莓汁对高糖诱导HepG2细胞活力及糖代谢功能的影响
如图4所示,F10、F20、R10、R40、R80组的HepG2细胞存活率均低于对照组,而F40、F80、R20组显著升高。在80 μL/mL浓度下,发酵组的细胞存活率显著高于未发酵组,表明发酵草莓汁对细胞活力的提升作用更强。相比于阴性对照组(葡萄糖5.5 mmol/L),模型组1(葡萄糖5.5 mmol/L+胰岛素100 μg/mL)葡萄糖消耗量(ΔGC)显著上升,而模型组2(葡萄糖30 mmol/L+胰岛素100 μg/mL)ΔGC下降。与模型组2相比,发酵组、未发酵组和二甲双胍组的ΔGC显著升高(P<0.05),其中发酵组的ΔGC高于未发酵组,但低于二甲双胍组。结果表明,发酵和未发酵草莓汁均能改善胰岛素抵抗,增加HepG2细胞葡萄糖消耗,且优于正常HepG2细胞,具有一定的降血糖作用。
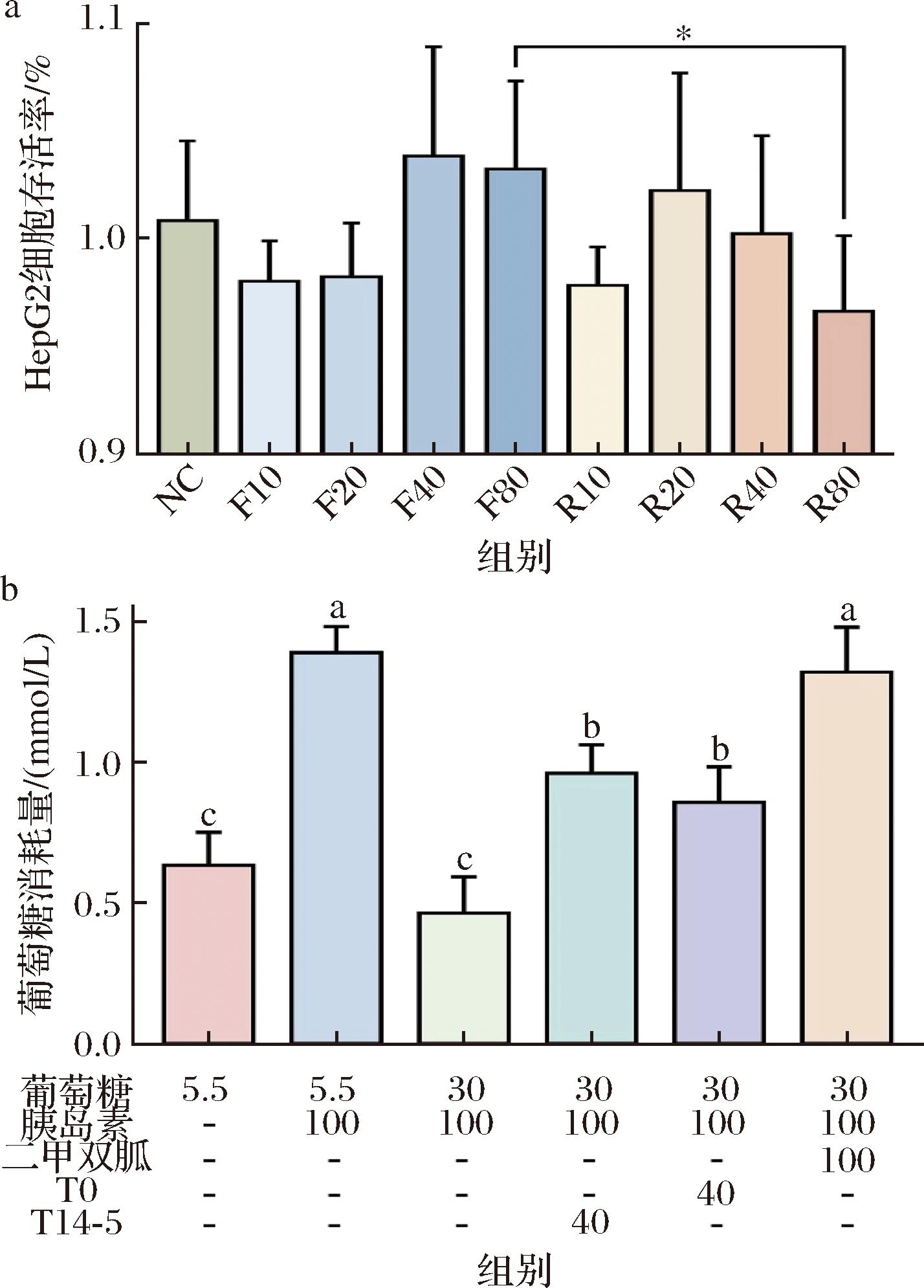
a-HepG2细胞存活率;b-葡萄糖消耗量
图4 发酵前后不同浓度草莓汁对高糖诱导的HepG2 细胞活力和糖消耗量的影响
Fig.4 Effects of strawberry juice on cell viability and glucose consumption of high sugar induced-HepG2 cells
注:*代表差异显著。
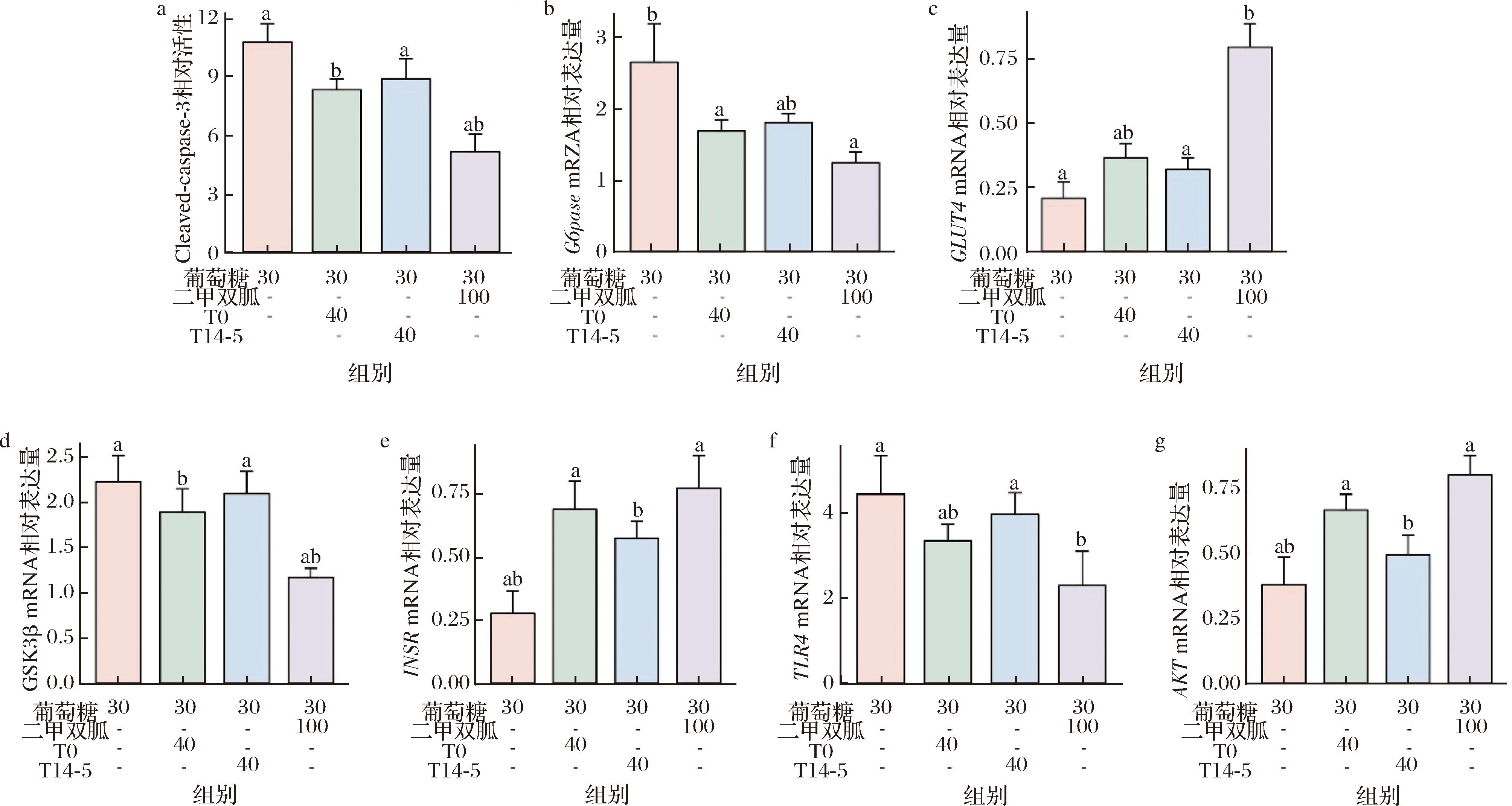
a-细胞凋亡;b-G6pase mRNA相对表达量;c-GLUT4 mRNA相对表达量;d-GSK3β mRNA相对表达量;e-INSR mRNA相对表达量; f-TLR4 mRNA相对表达量;g-AKT mRNA相对表达量
图5 发酵前后草莓汁对高糖诱导的HepG2细胞凋亡及糖代谢相关基因表达的影响
Fig.5 Effects of strawberry juice on high-sugar-induced HepG2 apoptosis and mRNA expressions of glucose metabolism
通过Caspase-3活性实验(图5),发酵和未发酵草莓汁均能减少高糖引起的HepG2细胞凋亡,但不及二甲双胍。在糖异生关键酶的mRNA表达方面,发酵组和未发酵组均显著降低G6pase、GSK3β和TLR4的表达,并提高GLUT4、INSR和AKT的表达。二甲双胍则显著抑制G6pase和TLR4,同时促进GLUT4和INSR的表达。
3 结论与讨论
本研究通过系统的实验设计和多维度分析,优化了非活菌型益生菌发酵草莓汁的工艺,并深入探究了其风味物质和潜在的健康功效。通过正交试验,本研究确定了非活菌型益生菌发酵草莓汁的最优工艺条件:接种菌量10 CFU/mL、糖添加量100 g/L、发酵时间14 h、接种比例(LP85∶ST81)为3∶1。这一优化条件不仅显著改善了草莓汁的口感,还解决了传统草莓汁在榨汁后易褐变、口感不佳及营养价值降低等问题。发酵过程中,益生菌代谢产生的有机酸、酶类及其他活性物质,有效抑制了褐变反应,同时提升了草莓汁的风味和稳定性。这一工艺为草莓深加工提供了一种新的技术路径,具有较高的工业化应用潜力。
益生菌发酵是提升果汁风味、改善色泽等感官特性、丰富功能活性物质的有效方法[26-28]。已有研究表明,乳酸菌发酵产生的乳酸和其他风味物质,赋予果汁独特的酸甜口感和香气。部分菌株(如L. plantarum)具有酯酶活性,可将水果中的前体物质转化为酯类(如乙酸乙酯、己酸乙酯),释放花果香。基于HS-SPME-GC-MS分析,相较于鲜汁,发现非活菌型发酵草莓汁挥发性物质的种类和含量发生较大变化。发酵后消失了18种挥发性成分,新产生了2,5-二甲基苯甲醛,异佛尔酮,4-羟基-2,5-二甲基l-3(2H)-呋喃酮,2,5-二甲基-4-甲氧基-3(2H)-呋喃酮等13种挥发性成分。其中酮类、酸类、酚类化合物种类与含量均有显著增加,为草莓汁增添了独特而丰富的风味特征,提升了感官附加值。
益生菌发酵可显著改变果汁营养成分谱,提升果汁营养价值。WANG等[15]用嗜酸乳杆菌(Lactobacillus acidophilus)、瑞士乳杆菌(Lactobacillus helveticus)和L. plantarum发酵显著提高猕猴桃汁中的主要抗氧化活性成分,如总酚和总黄酮,且存在发酵特异性,新生成的原儿茶酸和儿茶素与发酵果汁的抗氧化活性呈正相关。CHEN等[29]用L. plantarum和L. acidophilus通过β-葡萄糖苷酶降解草莓汁中的花青素和黄酮,生成高活性酚酸(如没食子酸、原儿茶酸等)从而提高总酚含量和抗氧化活性。另一项以桑椹汁为基质的研究发现,发酵显著提升酚酸(丁香酸、原儿茶酸)、花青素(矢车菊素-3-O-芸香糖苷)和黄酮醇(槲皮素)等多种生物活性成分的含量[30]。研究还表明,乳酸菌发酵会产生B族维生素和维生素C,同时分解一些抑制维生素吸收的抗营养素(如凝集素、草酸盐等),从而提高维生素的生物利用率[31-33]。还有研究表明,发酵过程中,果汁中的膳食纤维可能会被部分分解,转化为更易吸收的低聚糖或其他功能性成分,从而提升其营养价值,与本研究结果一致[34]。
值得注意的是,灭活型发酵果汁作为新型生物工程技术的产物,通过精确控制益生菌代谢周期,在菌体对数生长末期实施灭活处理,使得发酵体系稳定在代谢产物富集阶段。相较于传统活菌发酵体系,非活菌型发酵果汁依赖灭活前菌体的代谢产物驱动褐变抑制与风味形成,有效避免了活菌发酵后期可能存在的产品后酸化引发的风味劣变、稳定性降低和活菌增殖风险[35-36]。目前关于控制益生菌发酵制品后酸化的研究主要集中在酸奶等乳制品,发酵果蔬汁的后酸化研究较少。BAI等[35]向贮藏期间的乳酸菌发酵苹果汁中添加乳酸链球菌素和ε-聚赖氨酸,发现后酸化控制的发酵苹果汁可显著抑制活菌数增长、维持 pH 稳定并减少有机酸生成,从而延长货架期。对比常见的传统发酵果蔬汁、非浓缩还原果汁等,非活菌型发酵果汁在健康功效层面展现出独特的生物学特性与应用优势。
此外,基于LPS损伤RAW246.7细胞和高糖诱导HepG2细胞实验,本研究结果证实非活菌型发酵草莓汁抑制炎症因子释放,降低氧化应激水平,改善胰岛素敏感性,发挥调节细胞生长、凋亡,抗炎、抗氧化及降血糖等多重功效。这些发现为其在预防慢性代谢性疾病(如糖尿病、肥胖症)中的应用提供了科学依据。
尽管本研究已经取得了显著的成果,但依然存在一些问题需要进一步探讨。首先,对于代谢产物在生物体内的生物利用度及其具体作用机制仍需深入挖掘。明确这些代谢产物如何被人体吸收、分布、代谢和排泄,以及它们在体内发挥确切生物学效应的具体路径,是未来研究的重要方向。其次,发酵过程中微生物群落动态变化及其对最终产物组成的影响也尚未完全揭示。了解不同微生物之间的相互作用,以及它们如何共同影响发酵产物的特性,将有助于更精准地控制发酵过程。
综上所述,本研究为非活菌型发酵草莓汁的开发提供了系统的理论支持和技术路径,不仅拓展了草莓深加工的应用领域,也为功能性食品的开发提供了新的思路。随着消费者对健康食品需求的不断增加,非活菌型发酵草莓汁有望成为一种兼具营养与功能性的新型饮品,具有广阔的市场前景和社会价值,满足消费者日益增长的健康需求。
[1] 董辉, 杨莉, 李莉, 等. 我国草莓资源加工利用现状及发展趋势[J]. 江西农业学报, 2017, 29(6):80-83; 89.DONG H, YANG L, LI L, et al. Current situation and developmental trend of processing and utilization of strawberry resources in China[J]. Acta Agriculturae Jiangxi, 2017, 29(6):80-83; 89.
[2] 时宽芹. 草莓品种对其发酵酒理化性质与感官品质的影响研究[D]. 合肥:安徽农业大学, 2021.SHI K Q. Effects of strawberry breeds on the physicochemical properties and sensory quality of wine[D]. Hefei: Anhui Agricultural University, 2021.
[3] 李涛, 周颖, 张军, 等. 基于顶空固相微萃取-气相色谱-质谱和主成分分析法研究不同发酵原料对草莓酒香气成分的影响[J]. 食品与发酵工业, 2023, 49(5):261-268.LI T, ZHOU Y, ZHANG J, et al. Effect of different fermentation materials on aroma components of strawberry wines based on HS-SPME-GC-MS and PCA[J]. Food and Fermentation Industries, 2023, 49(5):261-268.
[4] 杨雪梅. 益生菌发酵草莓汁工艺优化及代谢组学研究[D]. 泰安:山东农业大学, 2023.YANG X M. Process optimization and metabolomics of strawberry juice by probiotic fermentation[D]. Taian: Shandong Agricultural University, 2023.
[5] FU H J, WANG L Y, GU J H, et al. Effects of Litsea cubeba essential oil-chitosan/corn starch composite films on the quality and shelf-life of strawberry (Fragaria×Ananassa)[J]. Foods, 2024, 13(4):599.
[6] GAZWI H S S, HASSAN M S, ISMAIL H A, et al. The hypoglycemic and hypolipidemic effects of polyphenol-rich strawberry juice on diabetic rats[J]. Plant Foods for Human Nutrition, 2023, 78(3):512-519.
[7] 王苑馨, 宋娇娇, 任寅印, 等. 不同品种草莓果实生物活性物质和抗氧化能力比较[J]. 山西农业大学学报(自然科学版), 2022, 42(1):69-76.WANG Y X, SONG J J, REN Y Y, et al. Comparison of bioactive substances and antioxidant activity of different strawberry cultivars[J]. Journal of Shanxi Agricultural University (Natural Science Edition), 2022, 42(1):69-76.
[8] 张波波, 王丹, 马越, 等. 超高压和UHT对草莓汁中多酚氧化酶活性的影响[J]. 食品与机械, 2014, 30(1):145-148.ZHANG B B, WANG D, MA Y, et al. Effect of ultra high pressure and ultra high-temperature treatment on polyphenol oxidase activity in strawberry beverage[J]. Food &Machinery, 2014, 30(1):145-148.
[9] 王红梅, 蒋思睿, 陶阳, 等. 超声辅助植物乳杆菌发酵苹果汁及草莓汁过程中菌体生长及酚类等物质代谢[J]. 食品科学, 2020, 41(14):72-81.WANG H M, JIANG S R, TAO Y, et al. Effect of ultrasound on microbial growth and metabolisms of various components including phenolics during fermentation of apple and strawberry juice by Lactobacillus plantarum[J]. Food Science, 2020, 41(14):72-81.
[10] 吴坤. 高产香能力唾液链球菌嗜热亚种筛选及在酸牛乳中应用研究[D].长沙:湖南农业大学, 2020.WU K. Screening of streptococcus thermophilus with high aroma production capacity and its application in sour milk[D]. Changsha: Hunan Agricultural University, 2020.
[11] 田云, 郝娟, 马永轩. 食品中益生菌的功能与安全性研究进展[J]. 现代食品科技, 2024, 40(8):415-427.TIAN Y, HAO J, MA Y X. Research progress on the function and safety of probiotics in food[J]. Modern Food Science and Technology, 2024, 40(8):415-427.
[12] 谢莹莹, 庞旭, 周海泳, 等. 后生元的作用机制及其在食品领域的应用[J]. 食品科学, 2024, 45(8):354-363.XIE Y Y, PANG X, ZHOU H Y, et al. Action mechanisms of postbiotics and their applications in food field[J]. Food Science, 2024, 45(8):354-363.
[13] 邹伟, 丁翘, 朱思莹, 等. 单一及混合益生菌发酵南酸枣果汁理化性质、感官评定和香气成分分析[J]. 食品与发酵工业, 2025, 51(13):301-310.ZOU W, DING Q, ZHU S Y, et al. Analysis of physicochemical properties, sensory evalution and aroma components of fermented Choerospondias axillaris juices inoculated with single and mixed probiotics[J]. Food and Fermentation Industries, 2025, 51(13):301-310.
[14] LI X Y, GAO J, SIMAL-GANDARA J, et al. Effect of fermentation by Lactobacillus acidophilus CH-2 on the enzymatic browning of pear juice[J]. LWT, 2021, 147:111489.
[15] WANG Z N, FENG Y Z, YANG N N, et al. Fermentation of kiwifruit juice from two cultivars by probiotic bacteria: Bioactive phenolics, antioxidant activities and flavor volatiles[J]. Food Chemistry, 2022, 373:131455.
[16] ZHAO Y, HE W Y, ZHAN P, et al. A comprehensive analysis of aroma quality and perception mechanism in ginger-infused stewed beef using instrumental analysis, sensory evaluation and molecular docking[J]. Food Chemistry, 2024, 460:140435.
[17] 方飞. 桑叶有效部位改善HepG2胰岛素抵抗及其机制的研究[D]. 广州:华南理工大学, 2012.FANG F. Ameliorative effects and mechanism of mulberry leaves extracts on insulin resistance of HepG2 cell[D]. Guangzhou: South China University of Technology, 2012.
[18] 朱彦彬, 徐鑫婷, 黎燕冰, 等. 桦褐孔菌醇抑制LPS诱导RAW264.7细胞炎症反应[J]. 食品工业科技, 2023,44(19):401-409.ZHU Y B, XU X T, LI Y B, et al. Effect of inotodiol on LPS-induced injury of RAW264.7 cells[J]. Science and Technology of Food Industry, 2023, 44(19):401-409.
[19]![]() A, AR
A, AR N S, HÖBEL A, et al. Boric acid exhibits anticancer properties in human endometrial cancer ishikawa cells[J]. Cureus, 2023, 15(8): e44277.
N S, HÖBEL A, et al. Boric acid exhibits anticancer properties in human endometrial cancer ishikawa cells[J]. Cureus, 2023, 15(8): e44277.
[20] ZHOU L Q, LIU T Q, YAN T, et al. ‘Nine Steaming Nine Sun-drying’ processing enhanced properties of Polygonatum kingianum against inflammation, oxidative stress and hyperglycemia[J]. Journal of the Science of Food and Agriculture, 2024, 104(5):3123-3138.
[21] 卢嘉懿, 李汴生, 阮征. 乳酸菌发酵对梨汁的护色作用[J]. 现代食品科技, 2019, 35(3):148-153; 45.LU J Y, LI B S, RUAN Z. Color protection of pear juice via lactic acid bacteria fermentation[J]. Modern Food Science and Technology, 2019, 35(3):148-153; 45.
[22] AIHAITI A, ZHAO L, MAIMAITIYIMING R, et al. Changes in volatile flavors during the fermentation of tomato (Solanum lycopersicum L.) juice and its storage stabilization[J]. Food Chemistry, 2025, 463:141077.
[23] 赵凤佳, 王桂霞, 孙健, 等. 草莓果实香气形成及调控机制研究进展[J]. 中国蔬菜, 2024(6):24-30.ZHAO F J, WANG G X, SUN J, et al. Research progress on aroma formation and regulation mechanism of strawberry fruit[J]. China Vegetables, 2024(6):24-30.
[24] SASAKI K, TAKASE H, KOBAYASHI H, et al. Molecular cloning and characterization of UDP-glucose: Furaneol glucosyltransferase gene from grapevine cultivar Muscat Bailey A (Vitis labrusca×V. vinifera)[J]. Journal of Experimental Botany, 2015, 66(20):6167-6174.
[25] ZHAO F Q, WANG P, LUCARDI R D, et al. Natural sources and bioactivities of 2, 4-di-tert-butylphenol and its analogs[J]. Toxins, 2020, 12(1):35.
[26] PLESSAS S. Advancements in the use of fermented fruit juices by lactic acid bacteria as functional foods: Prospects and challenges of lactiplantibacillus (lpb.) plantarum subsp. plantarum application[J]. Fermentation, 2022, 8(1):6.
[27] LAOSEE W, KANTACHOTE D, CHANSUWAN W, et al. Effects of probiotic fermented fruit juice-based biotransformation by lactic acid bacteria and Saccharomyces boulardii CNCM I-745 on anti-Salmonella and antioxidative properties[J]. Journal of Microbiology and Biotechnology, 2022, 32(10):1315-1324.
[28] NAGPAL R, KUMAR A, KUMAR M. Fortification and fermentation of fruit juices with probiotic lactobacilli[J]. Annals of Microbiology, 2012, 62(4):1573-1578.
[29] CHEN W D, XIE C Y, HE Q Q, et al. Improvement in color expression and antioxidant activity of strawberry juice fermented with lactic acid bacteria: A phenolic-based research[J]. Food Chemistry: X, 2023, 17:100535.
[30] KWAW E, MA Y K, TCHABO W, et al. Effect of Lactobacillus strains on phenolic profile, color attributes and antioxidant activities of lactic-acid-fermented mulberry juice[J]. Food Chemistry, 2018, 250:148-154.
[31] FAN J X, LU Y Z, LI X, et al. Omics analysis of key pathway in flavour formation and B vitamins synthesis during chickpea milk fermentation by Lactiplantibacillus plantarum[J]. Food Chemistry, 2025, 463:141083.
[32] XU H Y, FENG L X, DENG Y, et al. Change of phytochemicals and bioactive substances in Lactobacillus fermented Citrus juice during the fermentation process[J]. LWT, 2023, 180:114715.
[33] MOLINA G E S, RAS G, DA SILVA D F, et al. Metabolic insights of lactic acid bacteria in reducing off-flavors and antinutrients in plant-based fermented dairy alternatives[J]. Comprehensive Reviews in Food Science and Food Safety, 2025, 24(2): e70134.
[34] ZHU Y T, MA Q, ZHANG X Y, et al. Functional yacon juice fermented by Lactiplantibacillus plantarum QS7T: Chemical composition, flavor volatiles, and gut microbiota modulation[J]. Journal of Food Science, 2025, 90(2): e17528.
[35] BAI X, HAN M Z, YUE T L, et al. Control of post-acidification and shelf-life prediction of apple juice fermented by lactobacillus[J]. Food Control, 2022, 139:109076.
[36] 白雪. 德氏乳杆菌发酵苹果汁性能评价及后酸化控制[D]. 咸阳:西北农林科技大学, 2021.BAI X. Performance evaluation and post-acidification control of Lactobacillus delbrueckii fermented apple Juice[D]. Xianyang: Northwest A&F University, 2021.