麦角硫因(ergothioneine,EGT)是一种安全、无毒、多功能的天然组氨酸衍生物[1],研究表明EGT具有抗炎、抗氧化、抗衰老、预防神经系统类疾病、保护细胞等多种生理功能[2-5],在食品、化妆品及医药等领域已展现出良好的应用前景,受到国内外学者的广泛关注。随着EGT市场需求日益增长,EGT生产工艺更加趋向于高效化、安全化。目前EGT的生产方法主要有化学合成法[6]、食用菌子实体提取法[7]以及生物合成法[8],其中生物合成法是当前市场上EGT生产的主流方法。生物合成法中又包含真菌液态发酵法[9]、体外酶法[10]、构建微生物细胞工厂[11-13],这3种方式中真菌液态发酵法周期长、产率低,不适宜大规模工业化生产;体外酶法中EGT合成酶性质不稳定,且其催化机制尚未解析清楚;微生物代谢发酵被认为是目前生产EGT的最有效途径,相比于天然产物提取和化学合成方法,它具有成本低、产量高、生产周期短且对环境相对友好的优点,是高效制备EGT的重要发展方向。
EGT的原核生物合成途径于2010年由SEEBACK[14]在分枝杆菌中发现,由5种酶EgtA、EgtB、EgtC、EgtD、EgtE经历五步反应催化完成。此外,LEISINGER等[15]在绿硫细菌中发现了EGT的厌氧合成途径,其中EanB将组氨酸甜菜碱直接转化为EGT,此过程无须氧气参与。EGT的真核生物合成途径由HU等[16]在粗糙脉孢菌中发现,该途径仅由2种酶NcEgt1(NCU04343)和NcEgt2(NCU11365)参与合成,合成路径更短。虽然原核和真核生物中EGT的合成途径已经比较明确,但利用微生物细胞工厂进行EGT高效合成的研究仍不全面。当前生物合成法中利用真菌来源EGT合成酶生产EGT的产量最高已经能够达到4.34 g/L[17],而细菌来源的EGT合成酶生产EGT的产量只能达到1.31 g/L[18]。尽管工程菌株的构建策略与发酵条件等存在差异,难以直接比较不同来源EGT合成酶的催化效率,但这些结果也初步表明真菌来源的EGT合成酶在现有条件下可能具有更高的潜力。
国内外针对真菌EGT生物合成的研究主要以合成途径明确的粗糙脉孢菌为主[19],而对于作为EGT主要来源的大型食药用真菌的生物合成研究则相对较少。实验室前期对金针菇、灵芝、虎奶菇、蛹虫草、猴头菇5种菌菇进行深层发酵,结果显示在不额外添加其他外源物质的条件下,虎奶菇中EGT相较于其他4种菌菇含量最高。然而,目前虎奶菇中EGT合成的相关酶尚未挖掘,因此本研究以食药用真菌虎奶菇为研究对象,通过生物信息学分析挖掘其中的EGT合成酶基因,进而以大肠杆菌为宿主进行异源表达并建立虎奶菇EGT生物合成路径,通过代谢途径调控,获得高产量的EGT,为后续食药用真菌来源的EGT生物合成途径的研究奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株与试剂
虎奶菇(Pleurotus tuber-regium)、大肠杆菌[Escherichia coli BL21(DE3)],本研究室保存;真菌RNA基因组提取试剂盒,天根生化科技(北京)有限公司;质粒DNA小量抽提试剂盒、琼脂糖凝胶DNA回收试剂盒、高保真DNA聚合酶2×Phanta Max Master Mix、一步法克隆试剂盒ClonExpress Ⅱ One Step Cloning Kit,南京诺唯赞生物科技股份有限公司;组氨酸(Histidine,His)、半胱氨酸(Cysteine,Cys)、甲硫氨酸(Methionine,Met)、甜菜碱(betaine,Bet)、硫酸卡那霉素(kanamycin,Kan)、氨苄青霉素(ampicillin,Amp)、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-1-thiogalactopyranoside,IPTG),上海生工生物工程股份有限公司;S-腺苷甲硫氨酸(S-adenosyl methionine,SAM)、组氨酸甜菜碱(hercynine,HER)、磷酸吡哆醛(pyridoxal 5-phosphate monohydrate,PLP),上海源叶生物科技有限公司;EGT标准品,阿拉丁试剂(上海)有限公司;其他试剂(分析纯),国药集团化学试剂有限公司。
1.1.2 主要培养基
LB培养基(g/L):胰蛋白胨10.0、酵母提取物5.0、NaCl 10.0。固体培养基额外添加琼脂15.0。
TB培养基(g/L):胰蛋白胨12.0、酵母提取物24.0、K2HPO4 16.4、KH2PO4 1.7、甘油5.0。
合成培养基(g/L):胰蛋白胨10.0、酵母提取物5.0、25 mmol/L Na2HPO4、25 mmol/L KH2PO4、50 mmol/L NH4Cl、5 mmol/L Na2S2O3、2 mmol/L MgSO4、甘油5.0、葡萄糖0.5、乳糖2.0。再添加100×微量金属溶液10 mL/L。
100×微量金属溶液(g/L):FeSO4·7H2O 10.0、ZnSO4·7H2O 2.25、CuSO4·5H2O 1.0、MnSO4·H2O 0.7、H3BO3 0.15、CaCl2 1.5、Na2MoO4·2H2O 0.15、CoCl2·6H2O 0.05。
1.2 仪器与设备
S1000型PCR仪、凝胶电泳仪器,美国Bio-Rad公司;PICO17型台式高速冷冻离心机,美国Thermo公司;JY92-IIDN型超声波细胞破碎仪,宁波新芝生物科技股份有限公司;SCG-P型蛋白纯化仪,苏州赛谱仪器有限公司;FreeZone型真空冷冻干燥机,美国LABCONCO公司;Agilent 1260高效液相色谱仪,美国安捷伦公司。
1.3 实验方法
1.3.1 重组质粒构建
实验室前期已完成虎奶菇全基因组的测序分析(GenBank:GCA_019693315.1),在此基础上将测序获得的虎奶菇CDS序列与粗糙脉孢菌(Neurosporacrassa)的基因序列NcEgt1(NCBI Reference Sequence:XP_956324)与NcEgt2(NCBI Reference Sequence:XP_001728131)进行BLAST对比分析,获得虎奶菇EGT合成基因PTR-Egt1与PTR-Egt2。使用真菌RNA基因组提取试剂盒提取获得虎奶菇RNA后逆转录获得的cDNA作为PCR模板,扩增获得PTR-Egt1与PTR-Egt2目的基因,通过诺唯赞同源重组试剂盒ClonExpress® Ⅱ One Step Cloning Kit与经过NhoⅠ、XhoⅠ双酶切的pET28a质粒进行无缝连接,分别构建携带His、MBP、NuSA、SUMO、GST标签的PTR-Egt1质粒与PTR-Egt2质粒。
1.3.2 重组菌株构建及表达验证
将表1中的重组质粒通过热击转化导入大肠杆菌BL21(DE3)感受态中,在含不同抗性的LB固体平板上37 ℃倒置培养12 h。将鉴定转化成功的单菌落挑到LB种子液中,37 ℃、200 r/min培养12 h,以2%的接种量将种子液接种于TB培养基中,37 ℃、200 r/min培养至OD600值为0.6~0.8时,添加终浓度为0.5 mmol/L的IPTG,16 ℃、200 r/min培养24 h。
表1 主要重组菌株
Table 1 The main recombinant strains
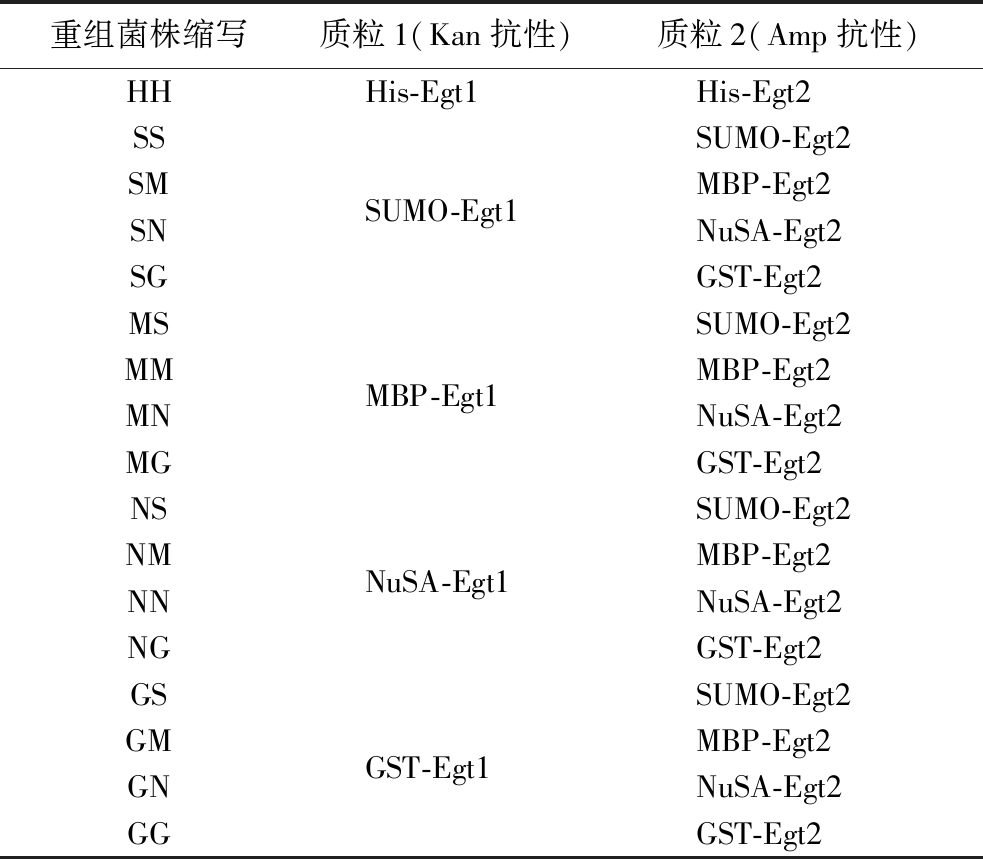
注:Kan(kanamycin)抗性:卡那霉素抗性;Amp(ampicillin)抗性:氨苄霉素抗性(表2同)。
重组菌株缩写质粒1(Kan抗性)质粒2(Amp抗性)HHHis-Egt1His-Egt2SSSUMO-Egt2SMSUMO-Egt1MBP-Egt2SNNuSA-Egt2SGGST-Egt2MSSUMO-Egt2MMMBP-Egt1MBP-Egt2MNNuSA-Egt2MGGST-Egt2NSSUMO-Egt2NMNuSA-Egt1MBP-Egt2NNNuSA-Egt2NGGST-Egt2GSSUMO-Egt2GMGST-Egt1MBP-Egt2GNNuSA-Egt2GGGST-Egt2
发酵结束后将发酵液12 000×g离心5 min,收集诱导表达后的菌体,每1 g菌体加入50 mL Tris-HCl溶液(pH 8.0)重悬,超声30 min破碎菌体(全程冰浴),工作时间1 s,间歇时间2 s,功率39%(满额750 W)。将破碎液4 ℃,12 000×g离心20 min,分别收集破碎上清液和沉淀,进行SDS-PAGE检测。
破碎上清液过0.45 μm滤膜后用AKTA蛋白纯化仪进行纯化获得纯酶,进行酶功能鉴定。
1.3.3 重组酶功能鉴定
为了验证PTR-Egt1与PTR-Egt2的催化功能,设置反应体系如下:
三步反应:将终浓度均为3 mmol/L的His、SAM、Cys、PLP、Fe2+混合均匀,加入蛋白终质量浓度为0.5 g/L PTR-Egt1与PTR-Egt2,37 ℃反应1 h。
两步反应:将终浓度均为3 mmol/L的HER、Cys、PLP、Fe2+混合均匀,加入蛋白终质量浓度为0.5 g/L PTR-Egt1与PTR-Egt2,37 ℃反应1 h。
煮沸终止反应,加入3倍乙腈,12 000×g离心10 min,取上清液进行LC-MS检测。
LC-MS检测条件:使用BEH C18柱(2.1 mm×150 mm,1.7 μm)。进样量:5 μL,柱温:45 ℃,流动相:A相为0.1%甲酸水,B相为乙腈;流速0.3 mL/min;洗脱梯度:100% A,10 min;70% A~30% B,10 min;20% A~80% B,10 min;100% B,10 min;100% A,10 min。检测波长:200~400 nm。
MS检测条件:阳离子检测模式,m/z的扫描范围20~2 000。
1.3.4 EGT含量测定
重组菌株发酵采用合成培养基,发酵后菌体与发酵液的收集方法同1.3.2节。
发酵液EGT测定:吸取1 mL发酵上清液与3倍体积乙腈混合均匀,过0.22 μm有机滤膜待测。
胞内EGT测定:将冷冻干燥后的菌体按照1∶40(g∶mL)的料液比与甲醇混合,超声提取30 min,然后4 000 r/min离心10 min,取1 mL上清液,吹干后用1 mL甲醇复溶,过0.22 μm有机滤膜,待测。
参考唐毓萍等[20]的检测方法,采用HPLC检测系统测定发酵液与胞内的EGT浓度,UV检测器,Hilic-Z柱(3 mm×100 mm,2.7 μm)。流动相为V水∶V乙腈=12∶88,流速:0.4 mL/min,柱温:30 ℃,紫外吸收:262 nm,进样体积:5 μL,检测时长:30 min。
2 结果与分析
2.1 虎奶菇EGT合成酶的挖掘与功能验证
基于已知真菌来源的Neurospora crassa基因序列NcEgt1和NcEgt2,对虎奶菇CDS序列进行BLAST分析。结果显示,GME4916与粗糙脉孢菌的NCEgt1序列相似度为32.86%;GME5414和粗糙脉孢菌的NCEgt2序列相似度为32.14%,初步确定虎奶菇中GME4916(PTR-Egt1),GME5414(PTR-Egt2)2个基因编码虎奶菇EGT合成酶,PTR-Egt1片段大小为2 619 bp,PTR-Egt2片段大小为1 284 bp。利用AlphaFold对虎奶菇EGT合成酶进行蛋白三级结构预测,结果如图1所示。PTR-Egt1具有甲基转移酶和亚砜合酶结构域,为双功能酶,具有3个活性口袋。其中65位酪氨酸、247位天冬酰胺、287位酪氨酸、365位谷氨酸与His形成氢键;44位缬氨酸、146位天冬氨酸、241位亮氨酸、244位丝氨酸与SAM形成氢键,His与SAM 2个底物位于同一活性口袋,而HER与Cys活性口袋位置相距较远。PTR-Egt2具有半胱氨酸亚砜裂解酶结构域,其中38位和98位丝氨酸、97位丙氨酸、211位天冬氨酸、235位天冬酰胺、237位组氨酸与PLP形成氢键,121位苏氨酸、186位丝氨酸、187位天冬酰胺、393位精氨酸与Cys-HER形成氢键,2个底物位于同一活性口袋。通过图2中系统发育树分析发现,虎奶菇PTR-Egt1与红平菇(Pleurotus djamor)、榆黄蘑(Pleurotus citrinopileatus)等亲缘关系较近;PTR-Egt2与秀珍菇(Pleurotus pulmonarius)、白黄侧耳(Pleurotus cornucopiae)等亲缘关系较近,与细菌及其他真菌亲缘性较低。
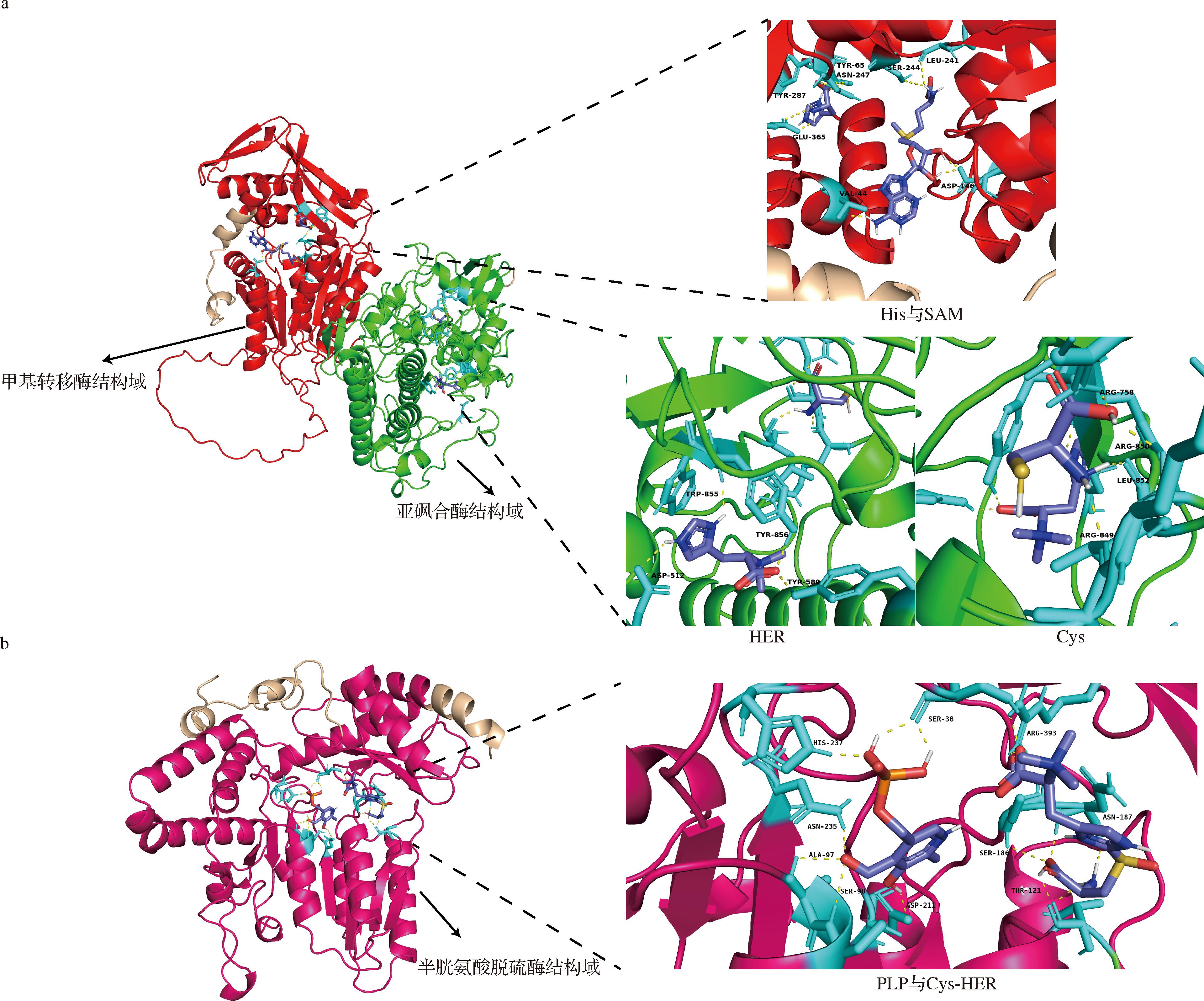
a-PTR-Egt1的三级结构及分子对接图;b-PTR-Egt2的三级结构及分子对接图
图1 虎奶菇EGT合成酶PTR-Egt1与PTR-Egt2的三级结构及分子对接图
Fig.1 Tertiary structure and molecular docking diagrams of EGT synthase PTR-Egt1 and PTR-Egt2

a-PTR-Egt1系统发育树;b-PTR-Egt2系统发育树
图2 虎奶菇EGT合成酶PTR-Egt1与PTR-Egt2的系统发育树
Fig.2 Phylogenetic tree of EGT synthase PTR-Egt1and PTR-Egt2
为了明确PTR-Egt1与PTR-Egt2在虎奶菇EGT合成过程中的具体功能(图3),以pET28a质粒为载体,分别构建携带His标签的重组质粒和重组菌株,并进行发酵表达和验证分析。携带His标签的PTR-Egt1与PTR-Egt2菌落PCR结果如图4-a与图4-b所示,PTR-Egt1(2 619 bp)与PTR-Egt2(1 284 bp)片段大小与预期相符。SDS-PAGE分析结果如图4-c与图4-d所示,携带His标签的PTR-Egt1(99.9 kDa)与PTR-Egt2(49.3 kDa)片段大小与预期相符,证明目标蛋白在大肠杆菌中成功实现异源表达。检测结果显示,两步反应(图4-f)与三步反应(图4-h)均在5.54 min 处有产物峰,质荷比(m/z=230)与EGT标准品(图4-e)理论分子量(229.3)一致,因此可以证明PTR-Egt1与PTR-Egt2具有合成EGT的能力。但相比于三步反应,两步反应生成的EGT产量明显更高,结合MISSON等[21]研究,细菌来源的EgtD在催化His生成HER的过程中,会依次产生N-α-单甲基组氨酸(N-α-monomethyl-histidine,MMH)和N-α-二甲基组氨酸(N-α-dimethyl-histidine,DMH)2种中间产物,当甲基受体是His而不是DMH或MMH时,EgtD催化消耗SAM的效率会分别降低至1/2和1/3,这表明第1个甲基转移是HER生产的限速步骤。PTR-Egt1中的甲基转移酶结构域与EgtD相似度为29%,具有同种生理活性,因此合理推测在虎奶菇中PTR-Egt1催化His与SAM生成HER的第一步反应为虎奶菇EGT生物合成中的限速步骤。
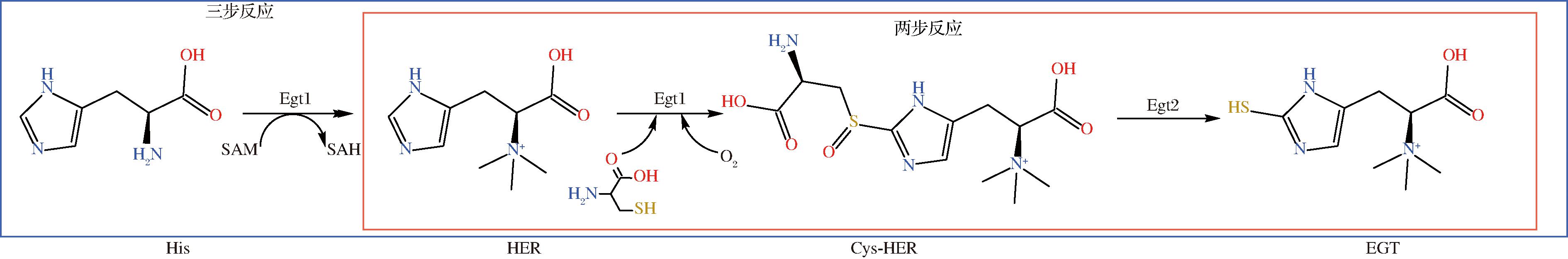
图3 真菌EGT合成路径
Fig.3 EGT synthesis pathway of fungi
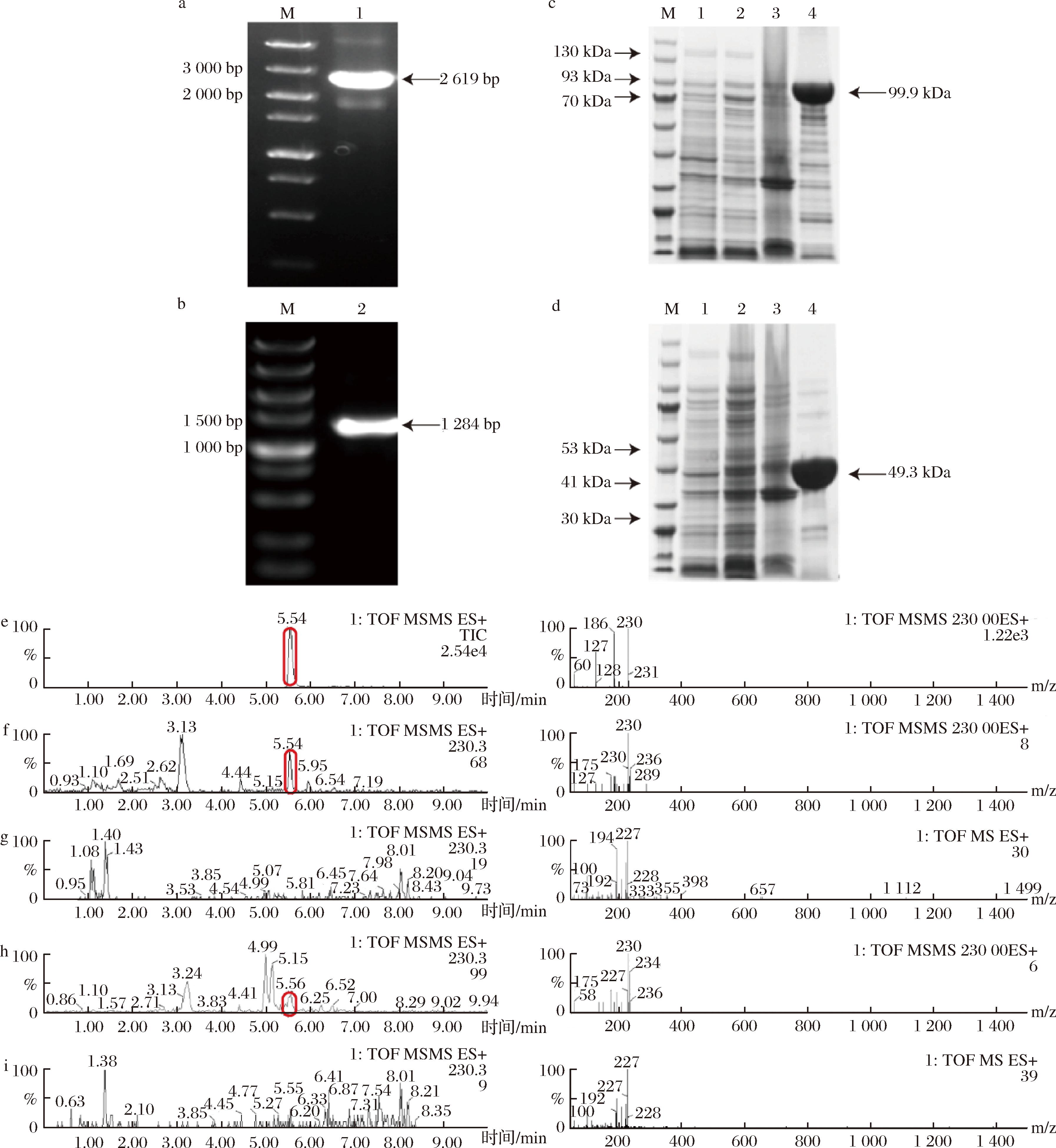
c、d图中:M-Marker;泳道1-空载;泳道2-上清液;泳道3-沉淀;泳道4-纯酶。 a-PTR-Egt1菌落PCR电泳胶图;b-PTR-Egt2菌落PCR电泳胶图;c-PTR-Egt1蛋白胶图;d-PTR-Egt2蛋白胶图;e-EGT标品;f-底物为HER、 Cys、PLP、Fe2+;g-底物为HER、Cys、PLP、Fe2+的阴性对照;h-底物为His、SAM、Cys、PLP、Fe2+;i-底物为His、SAM、Cys、PLP、Fe2+的阴性对照
图4 PTR-Egt1与PTR-Egt2的电泳胶图及体外酶反应产物的LC-MS图谱
Fig.4 Electropherogram of PTR-Egt1 and PTR-Egt2 and LC-MS identification of in vitro enzyme reaction
2.2 蛋白标签对虎奶菇EGT合成酶表达的影响
虽然携带His标签的PTR-Egt1与PTR-Egt2具有合成EGT的能力,但也存在酶活性较低、蛋白表达效果较差等问题。为了提高蛋白表达和酶活性,本研究针对大肠杆菌的特性,将PTR-Egt1与PTR-Egt2合成酶分别与小分子泛素相关修饰蛋白标签SUMO(small ubiquitin-like modifier,14.7 kDa)、麦芽糖结合蛋白标签MBP(maltose-binding protein,43.9 kDa)、谷胱甘肽巯基转移酶蛋白标签GST(glutathione-S-transferase,26.6 kDa)、转录延长的抗终止因子NuSA(N-utilization substance A,61.7 kDa)进行融合表达,表达结果如图5-a与图5-b所示。结果显示,在相同发酵条件下,携带5种标签的PTR-Egt1均能实现可溶性表达,但是His标签和MBP标签在表达过程中存在更多的包涵体。在PTR-Egt2与5种蛋白标签融合表达中,His标签与NuSA标签表达效果较差,其他3种标签表达效果较好。分别构建携带不同融合标签的PTR-Egt1和PTR-Egt2表达质粒,并将携带不同融合标签的2种质粒共同转化至同一宿主中,构建16种不同组合的菌株并进行共表达发酵,不同菌株组合如表1所示。蛋白表达结果如图5-c与图5-d所示;组合发酵结果如图6-a与表2所示,在16种组合中携带SUMO标签的Egt1与携带MBP标签的Egt2的组合在经过120 h的发酵后,EGT产量最高,此时胞内和发酵液中EGT含量分别为4.69 mg/g和74.20 mg/L。由于重组质粒并未添加信号肽,因此EGT合成酶在大肠杆菌中为胞内表达,但发酵液中EGT含量远远高于胞内EGT含量,推测原因可能是EGT在胞内合成,释放到胞外。为方便EGT的后期工业化应用,直接提取发酵液中游离的EGT更有利于纯品的分离制备,因此本研究后续EGT含量测定以发酵液为主。
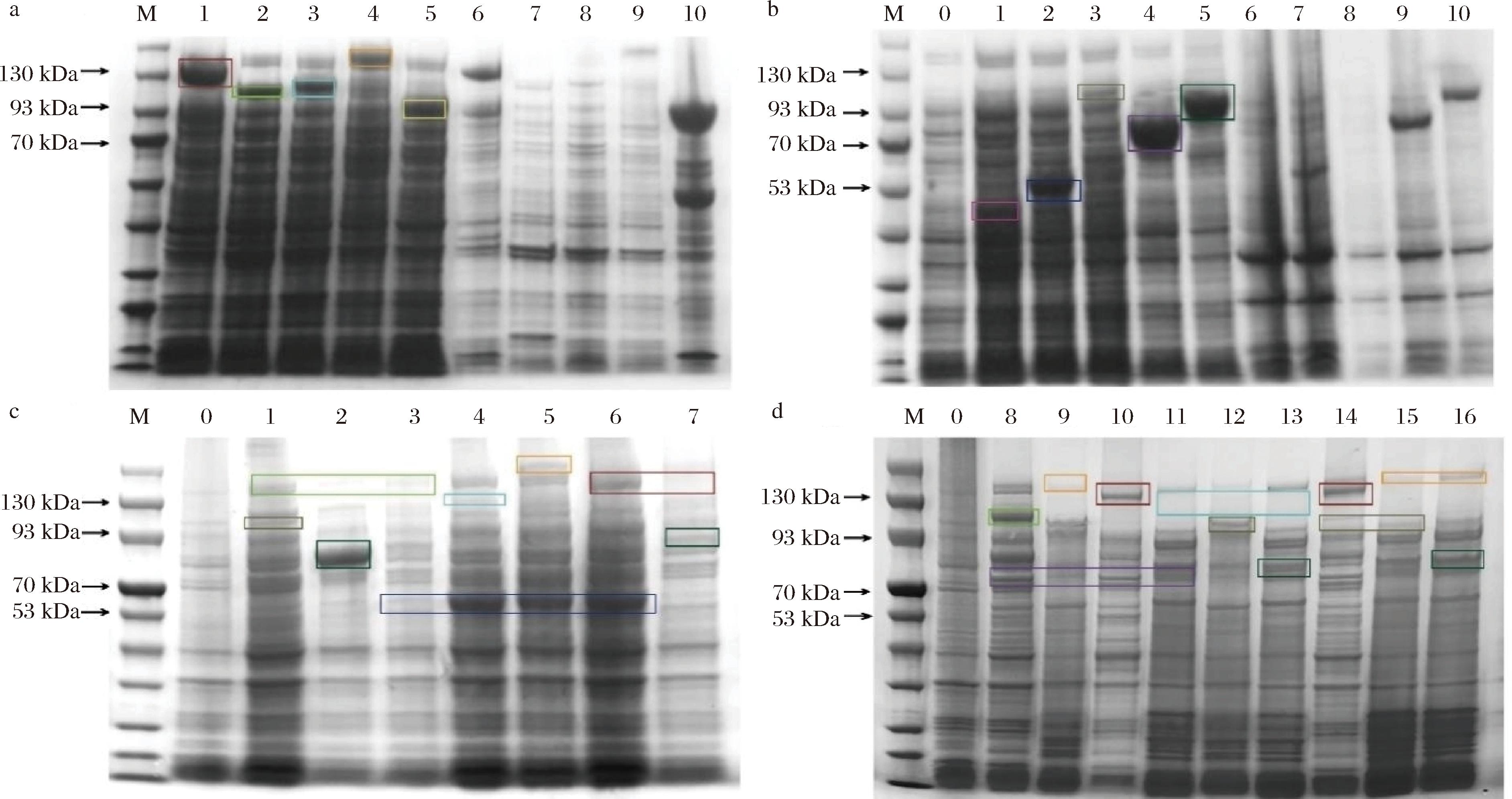
a图中:M-Marker;泳道1:MBP(142.7 kDa);泳道2:SUMO(114.6 kDa);泳道3:GST(125.6 kDa);泳道4:NuSA(160.5 kDa);5:His(99.9 kDa); 6~10分别为1~5的沉淀;b图中:M-Marker;泳道 0-空载;泳道1-His(49.3 kDa);泳道2-SUMO(62.8 kDa);泳道3-NuSA(109.8 kDa); 泳道4-GST(75 kDa);泳道5-MBP(92 kDa);泳道6~10分别为1~5的沉淀;c、d图中:M-marker;泳道0-空载;泳道1-SN;泳道2-SM; 泳道3-SS;泳道4-GS;泳道5-NS;泳道6-MS;泳道7-MM;泳道8-SG;泳道9-NG;泳道10-MG;泳道11-GG;泳道12-GN; 泳道13-GM;泳道14-MN;泳道15:NN;泳道16-NM。 a-携带不同蛋白标签的PTR-Egt1单独表达的上清液及沉淀;b-携带不同蛋白标签的PTR-Egt2单独表达的上清液及沉淀; c、d-PTR-Egt1与PTR-Egt2双质粒共同表达的上清液
图5 携带不同蛋白标签的目的蛋白SDS-PAGE分析
Fig.5 SDS-PAGE analysis of target proteins carrying different protein tags
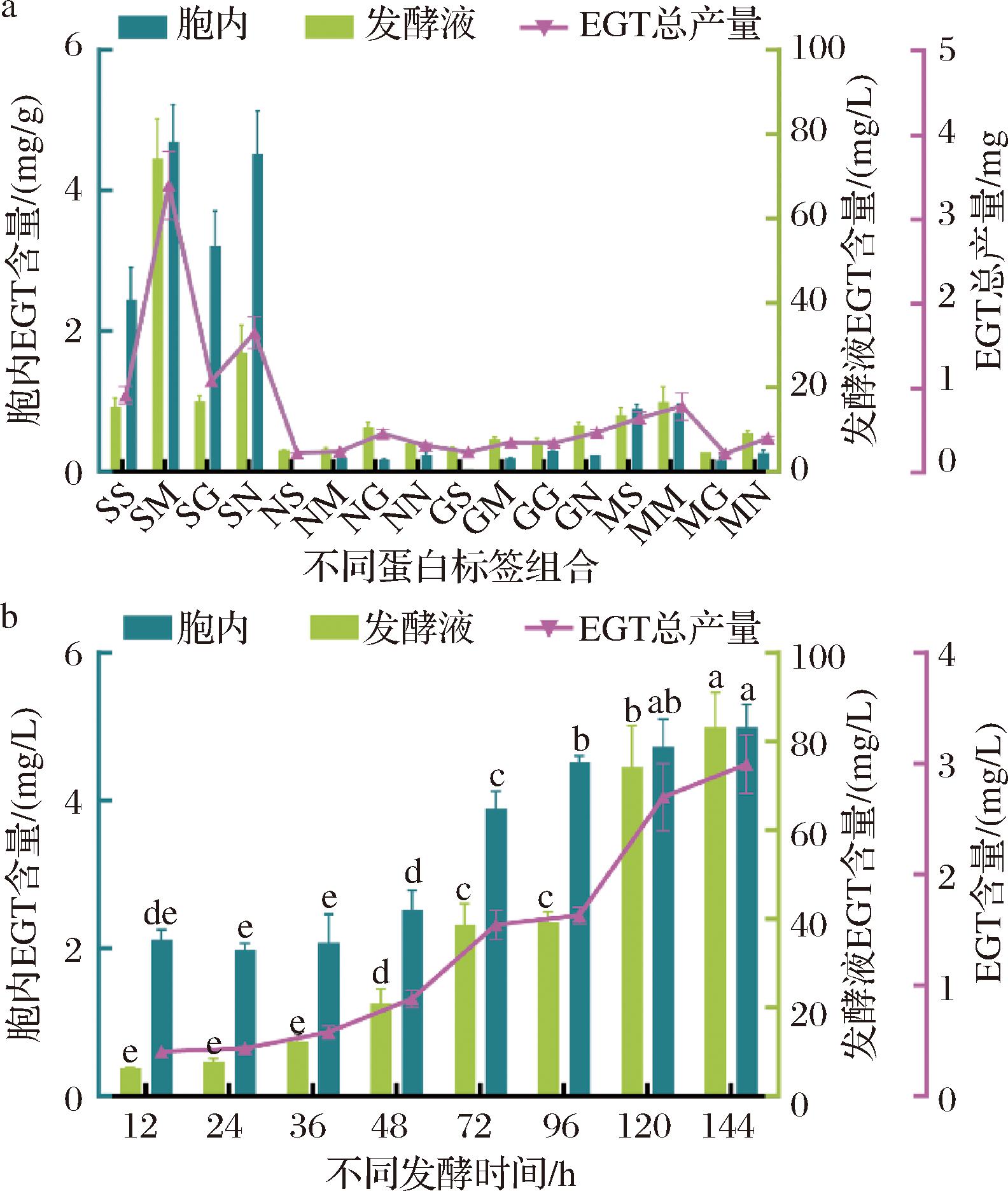
a-不同蛋白标签组合对EGT产量的影响;b-发酵时间对EGT产量的影响
图6 不同蛋白标签组合和不同发酵时间对EGT产量的影响
Fig.6 Effect of different protein tag combinations and different fermentation times on EGT yield
注:相同样品中同样的字母代表没有显著性差异, 不同字母代表差异显著(P<0.05)(下同)。
表2 不同蛋白标签组合的EGT产量比较
Table 2 Comparison of different protein tag combinations for EGT yield
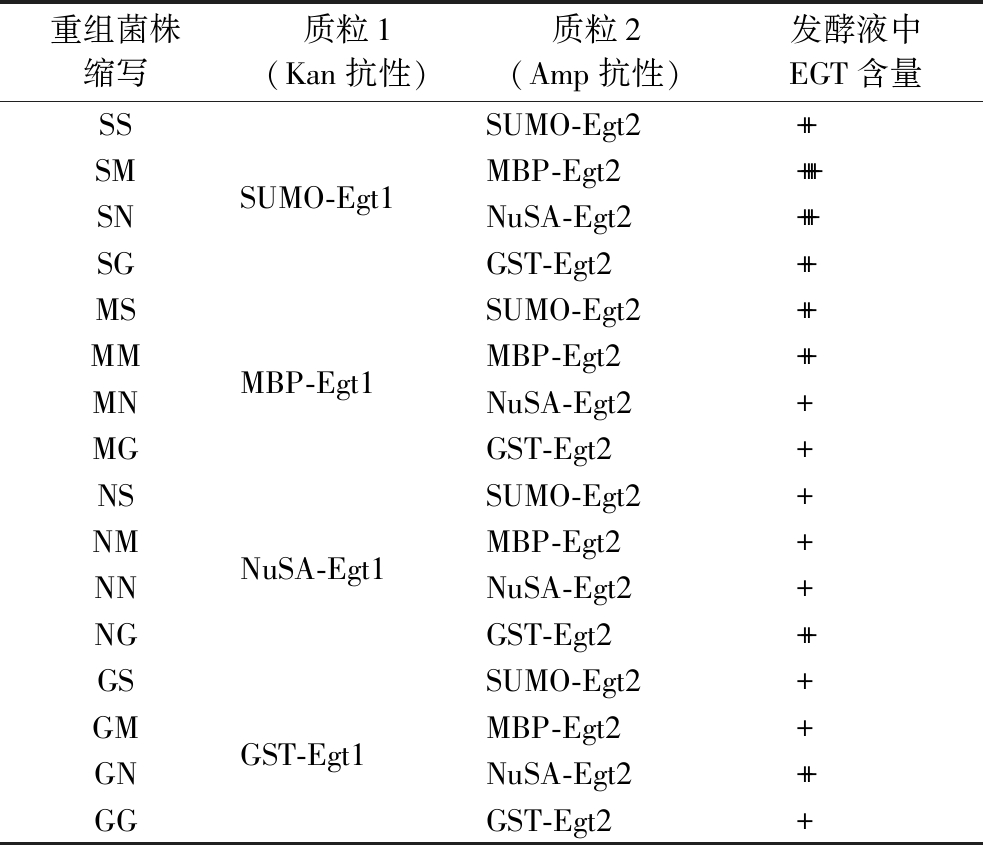
注:EGT含量>50 mg/L记为++++;20~50 mg/L记为+++;10~20 mg/L记为++;0~10 mg/L记为+。
重组菌株缩写质粒1(Kan抗性)质粒2(Amp抗性)发酵液中EGT含量SSSUMO-Egt2++SMSUMO-Egt1MBP-Egt2++++SNNuSA-Egt2+++SGGST-Egt2++MSSUMO-Egt2++MMMBP-Egt1MBP-Egt2++MNNuSA-Egt2+MGGST-Egt2+NSSUMO-Egt2+NMNuSA-Egt1MBP-Egt2+NNNuSA-Egt2+NGGST-Egt2++GSSUMO-Egt2+GMGST-Egt1MBP-Egt2+GNNuSA-Egt2++GGGST-Egt2+
在选定最优组合的基础上,对发酵时间进行优化,结果如图6-b所示。前期取样时间间隔为12 h,后期间隔延长为24 h,考虑摇瓶阶段大肠杆菌营养物质受限无法高密度培养,因此选定总发酵时间为144 h。随着发酵时间的延长,重组菌株的发酵液和胞内EGT含量持续上升,当发酵时间为72 h时,胞内EGT含量相比于48 h时显著上升,然后维持相对稳定;当发酵时间为120 h时,发酵液中EGT含量相比于96 h时显著上升,后续随发酵时间增长,产量延长缓慢。测定结果显示,发酵时间为120 h时EGT生产效率最高,发酵液中EGT含量为0.62 mg/(L·h)。
2.3 前体物质添加对EGT合成的影响
真菌EGT合成路径中共需要3种前体氨基酸参与[22],其中组氨酸与半胱氨酸作为直接底物参与EGT的合成,甲硫氨酸则为SAM合成的前体物质;此外,甜菜碱作为组氨酸甜菜碱合成中的另一种甲基供体间接参与EGT的合成。因此,采用单因素实验分别考察添加组氨酸(图7-a)、甲硫氨酸(图7-b)、半胱氨酸(图7-c)及甜菜碱(图7-d)添加量对EGT产量的影响。检测结果显示,增加组氨酸和甲硫氨酸添加量,发酵液中EGT含量均呈现出先增加后降低再增加的趋势,而增加半胱氨酸及甜菜碱添加量对EGT的生成呈现出先抑制后促进再抑制的作用。整体来看,甲硫氨酸、半胱氨酸与甜菜碱对EGT合成促进效果并不明显,而组氨酸对EGT合成的促进效果最好,当组氨酸添加量为1 g/L时,发酵液中EGT含量最高为124.03 mg/L,生产效率为1.03 mg/(L·h),为对照组的1.65倍。分析4种不同前体物质对EGT合成的影响,推测原因可能是组氨酸是EGT的主要前体物质,是构成EGT的骨架[23],在生物合成过程中EGT的生成与His的消耗量为1∶1,但大肠杆菌自身生产的组氨酸除了用于EGT生成外,还需要参与其他生命活动,组氨酸的生成速度远远低于PTR-Egt1酶的消耗,因此增加外源组氨酸的供给可以很大程度地缓解大肠杆菌组氨酸生成的负担,使得EGT含量显著上升;而在组氨酸添加量不变的前提下,HER的生成量保持不变,增加其他前体物质并不能有效增加EGT生成。

a-组氨酸添加量对EGT生成的影响;b-甲硫氨酸添加量对EGT生成的影响;c-半胱氨酸添加量对EGT生成的影响; d-甜菜碱添加量对EGT生成的影响
图7 不同前体物质添加对EGT产量的影响
Fig.7 Effect of different precursor addition on EGT yield
综合对比目前关于EGT生物合成的研究,EGT合成酶的来源主要分为细菌来源、真菌来源与食药用真菌来源,这3种来源的EGT合成酶生产EGT的效率也存在一定差异。例如,TANAKA等[18]通过在大肠杆菌中表达耻垢分枝杆菌来源的egtABCDE的5种基因及过表其代谢通路相关基因,EGT生产效率可达6.01 mg/(L·h);CHEN等[17]通过在大肠杆菌中高密度发酵表达里氏木霉来源的tregt1与tregt2,EGT生产效率达到30.34 mg/(L·h)。虎奶菇来源的PTR-Egt1与PTR-Egt2同细菌、真菌来源的EGT合成酶相比,在生产效率和发酵工艺优化方面仍有较大的提升和改进空间。
目前,关于食药用真菌来源的EGT合成酶在异源表达系统中实现EGT合成的研究相对有限,仅有杏鲍菇和灰树花的相关报道,且均基于酿酒酵母表达系统。其中杏鲍菇来源的PeEgt1与PeEgt2-2基因,通过双基因共表达发酵,EGT产量可达到4.30 mg/L,生产效率为25.5 μg/(L·h)[11];而在酿酒酵母中表达灰树花来源的GfEgt1与GfEgt2基因,尽管EGT产量为2.76 mg/L,其生产效率却提升至122.6 μg/(L·h)[24]。相比之下,关于其他食药用真菌(如平菇、白灵菇、金针菇、蛹虫草等)的相关研究多集中于EGT合成酶的功能鉴定,尚未深入探索其代谢发酵潜力。因此,虎奶菇来源的PTR-Egt1与PTR-Egt2在生物合成EGT方面展现了显著潜力,为进一步开发利用食药用真菌酶资源实现高效EGT生产提供了重要依据。
3 结论
本研究通过生物信息学分析,明确了虎奶菇中参与EGT生物合成的2个关键酶PTR-Egt1与PTR-Egt2,并成功实现了它们在大肠杆菌中的异源表达。通过体外酶反应验证,这2种酶协同具备催化EGT合成的能力。在异源表达过程中,通过蛋白标签的组合筛选,确定携带SUMO标签的PTR-Egt1与携带MBP标签的PTR-Egt2为最佳表达配置,从而显著提升了EGT的产量。在优化的表达条件下,发酵120 h时发酵液中EGT含量达到74.20 mg/L,生产效率为0.62 mg/(L·h)。进一步研究表明,添加前体氨基酸L-His对EGT产量有显著的促进作用。当L-His添加量为1 g/L、发酵时间为120 h时,发酵液中EGT含量提升至124.03 mg/L,生产效率提高至1.03 mg/(L·h)。这一结果证明了前体物质优化对提升生产效率的重要性。本研究系统性地探讨了虎奶菇来源EGT合成酶的功能和表达优化策略,为进一步开发食药用真菌中EGT的高效生物合成提供了科学依据和技术支持。
[1] WENG Y W, ZHU M, MA H G, et al.Recent progress in mushroom-derived ergothioneine:Techniques and applications[J].Food Bioscience, 2024, 62:105533.
[2] 张晓娜, 徐鹤然, 化璟琳, 等.麦角硫因生物学功能及在化妆品功效原料中的应用[J].当代化工研究, 2021(16):154-158.ZHANG X N, XU H R, HUA J L, et al.The biological function and application of ergothioneine in cosmetic efficacy raw materials[J].Modern Chemical Research, 2021(16):154-158.
[3] CHEN F Y, WANG B T, SUN X, et al.Ergothioneine improves cognitive function by ameliorating mitochondrial damage and decreasing neuroinflammation in a D-galactose-induced aging model[J].Food &Function, 2024, 15(23):11686-11696.
[4] LYU X Y, NIE C Y, SHI Y H, et al.Ergothioneine ameliorates metabolic dysfunction-Associated Steatotic Liver Disease (MASLD) by enhancing autophagy, inhibiting oxidative damage and inflammation[J].Lipids in Health and Disease, 2024, 23(1):395.
[5] CHEN L, ZHANG L P, YE X J, et al.Ergothioneine and its congeners:Anti-ageing mechanisms and pharmacophore biosynthesis[J].Protein &Cell, 2024, 15(3):191-206.
[6] XU J Z, YADAN J C.Synthesis of L-(+)-ergothioneine[J].The Journal of Organic Chemistry, 1995, 60(20):6296-6301.
[7] ZHANG C G, XIE Y T, LIU D Y, et al.Effects of drying process and high hydrostatic pressure on extraction of antioxidant ergothioneine from Pleurotus citrinopileatus singer[J].Foods, 2024, 13(6):878.
[8] QIU Y B, CHEN Z L, SU E Z, et al.Recent strategies for the biosynthesis of ergothioneine[J].Journal of Agricultural and Food Chemistry, 2021, 69(46):13682-13690.
[9] 康梦媛, 任芮瑶, 刘月含, 等.液态深层发酵松杉灵芝提取麦角硫因的技术研究[J].现代食品, 2024, 30(7):78-80;86.KANG M Y, REN R Y, LIU Y H, et al.Research on the technology of liquid deep fermentation for extracting ergothioneine from Ganoderma tsugae Murr[J].Modern Food, 2024, 30(7):78-80;86.
[10] YANG X Q, LIN S X, LIN J D, et al.The biosynthetic pathway of ergothioneine in culinary-medicinal winter mushroom, Flammulina velutipes (Agaricomycetes)[J].International Journal of Medicinal Mushrooms, 2020, 22(2):171-181.
[11] 郭心悦, 潘涛, 郭丽琼.杏鲍菇麦角硫因生物合成基因挖掘及在酵母中的组合表达[J].福建农林大学学报(自然科学版), 2024, 53(6):841-849.GUO X Y, PAN T, GUO L Q.Discovery of ergothioneine biosynthesis genes from Pleurotus eryngii and its combinatorial expression in Saccharomyces cerevisiae[J].Journal of Fujian Agriculture and Forestry University (Natural Science Edition), 2024, 53(6):841-849.
[12] LI L, XU S S, JIANG Y J.Ergothioneine biosynthesis:The present state and future prospect[J].Synthetic and Systems Biotechnology, 2025, 10(1):314-325.
[13] KAMIDE T, TAKUSAGAWA S, TANAKA N, et al.High production of ergothioneine in Escherichia coli using the sulfoxide synthase from Methylobacterium strains[J].Journal of Agricultural and Food Chemistry, 2020, 68(23):6390-6394.
[14] SEEBECK F P.In vitro reconstitution of mycobacterial ergothioneine biosynthesis[J].Journal of the American Chemical Society, 2010, 132(19):6632-6633.
[15] LEISINGER F, BURN R, MEURY M, et al.Structural and mechanistic basis for anaerobic ergothioneine biosynthesis[J].Journal of the American Chemical Society, 2019, 141(17):6906-6914.
[16] HU W, SONG H, HER A S, et al.Bioinformatic and biochemical characterizations of C-S bond formation and cleavage enzymes in the fungus Neurospora crassa ergothioneine biosynthetic pathway[J].Organic Letters, 2014, 16(20):5382-5385.
[17] CHEN Z H, HE Y Z, WU X Y, et al.Toward more efficient ergothioneine production using the fungal ergothioneine biosynthetic pathway[J].Microbial Cell Factories, 2022, 21(1):76.
[18] TANAKA N, KAWANO Y, SATOH Y, et al.Gram-scale fermentative production of ergothioneine driven by overproduction of cysteine in Escherichia coli[J].Scientific Reports, 2019, 9:1895.
[19] VAN DER HOEK S A, RUSN K M, JACOBSEN I H, et al.Engineering ergothioneine production in Yarrowia lipolytica[J].FEBS Letters, 2022, 596(10):1356-1364.
K M, JACOBSEN I H, et al.Engineering ergothioneine production in Yarrowia lipolytica[J].FEBS Letters, 2022, 596(10):1356-1364.
[20] 唐毓萍, 何吉超.亲水作用液相色谱法测定化妆品中麦角硫因的含量[J].质量安全与检验检测, 2023, 33(1):33-35;57.TANG Y P, HE J C.Determination of ergothioneine in cosmetics by hydrophilic interaction liquid chromatography[J].Quality Safety Inspection and Testing, 2023, 33(1):33-35 57.
[21] MISSON L, BURN R, VIT A, et al.Inhibition and regulation of the ergothioneine biosynthetic methyltransferase EgtD[J].ACS Chemical Biology, 2018, 13(5):1333-1342.
[22] ZHANG H F, ZHANG Y F, ZHAO M, et al.Fermentative production of ergothioneine by exploring novel biosynthetic pathway and remodulating precursor synthesis pathways[J].Journal of Agricultural and Food Chemistry, 2024, 72(25):14264-14273.
[23] ZHANG L W, TANG J W, FENG M Q, et al.Engineering methyltransferase and sulfoxide synthase for high-yield production of ergothioneine[J].Journal of Agricultural and Food Chemistry, 2023, 71(1):671-679.
[24] YU Y H, PAN H Y, GUO L Q, et al.Successful biosynthesis of natural antioxidant ergothioneine in Saccharomyces cerevisiae required only two genes from Grifola frondosa[J].Microbial Cell Factories, 2020, 19(1):164.