硫化氢(H2S)通常被认为是一种具有强烈臭鸡蛋气味的无色有毒气体[1]。H2S是由含有机硫的食品(例如鸡蛋、肉类、酒类、蔬菜、水果等)在加工、贮存和运输过程中产生的[2],不仅对生物体眼部和呼吸道黏膜有强烈的刺激性和腐蚀性,而且食用变质的食物后会导致食品中毒和急性传染病,严重时则会危及生命[3]。目前,研究已明确将H2S列为葡萄酒和啤酒中的常见有害成分,因为它会严重损害酒的口感和品质,并对人体健康产生潜在毒性[4-5]。因此,开发用于葡萄酒和啤酒中H2S的定量分析方法具有至关重要的意义。随着H2S检测日益受到重视,研究人员对光谱法[6]、色谱法[7]和电化学法[8]等多种方法已经进行了探索,但由于通常需要复杂的样品制备且操作过程复杂,大多数尚未得到广泛应用。因此,迫切需要建立一种对葡萄酒和啤酒中H2S水平进行快速灵敏的检测方法。
基于拉曼光谱的表面增强拉曼散射(surface-enhanced Raman scattering,SERS),可以捕获特定分子或纳米材料的独特化学指纹,具有操作简单快速、灵敏度高、原位和无损检测等特点[9-10],在生物医学、环境监测和食品安全等领域具有广泛的应用前景。SERS主要发生在特定的金属表面,尤其是经过粗糙化处理的金(Au)和银(Ag)表面,这种粗糙的金属纳米材料表面提供了更多的热点效应,有利于拉曼增强效应的产生,增强倍数可达到107~108倍[11-12]。
作为一种无机气体分子,H2S的拉曼截面非常弱,这意味着在拉曼光谱中其信号强度相对较低,这一特性使得利用SERS技术直接进行H2S检测面临挑战。研究表明,通过结合H2S引发的特定化学反应(如还原反应和金属沉淀反应),可以开发出对H2S具有高灵敏度与高选择性的SERS纳米探针。其中还原法是利用H2S可以快速地将硝基或叠氮还原为氨基,从而伴随着明显的拉曼光谱的变化来定量检测H2S[13-14]。基于此,本论文构建了一种基于H2S引起的特殊还原反应的SERS纳米探针,用于H2S的快速灵敏检测。如图1所示,首先制备了3种不同形貌的纳米材料:金纳米星(gold nanostars,AuNSs)、金纳米立方体(gold nanocubes,AuNCs)和金纳米球(gold nanospheres,AuNPs)。然后,通过Au-S键将H2S的检测分子4-硝基苯硫酚(4-nitrophenylthiophenol,4-NTP)[15]分别修饰至这3种材料的表面,制备出3种纳米探针:AuNSs@4-NTP、AuNCs@4-NTP和AuNPs@4-NTP。通过比较三者的拉曼光谱,筛选出拉曼增强效果最好的AuNSs@4-NTP作为SERS纳米探针开展H2S的快速灵敏检测。当不存在H2S时,由于AuNSs强烈的拉曼增强效应,使得SERS纳米探针上的4-NTP具有较强的拉曼信号。当H2S存在时,SERS纳米探针中的4-NTP的硝基被H2S还原成氨基,使得硝基峰(1 329 cm-1)的拉曼信号强度明显降低,因此可以根据SERS探针在1 329 cm-1处的信号强度的变化实现对H2S的定量检测。
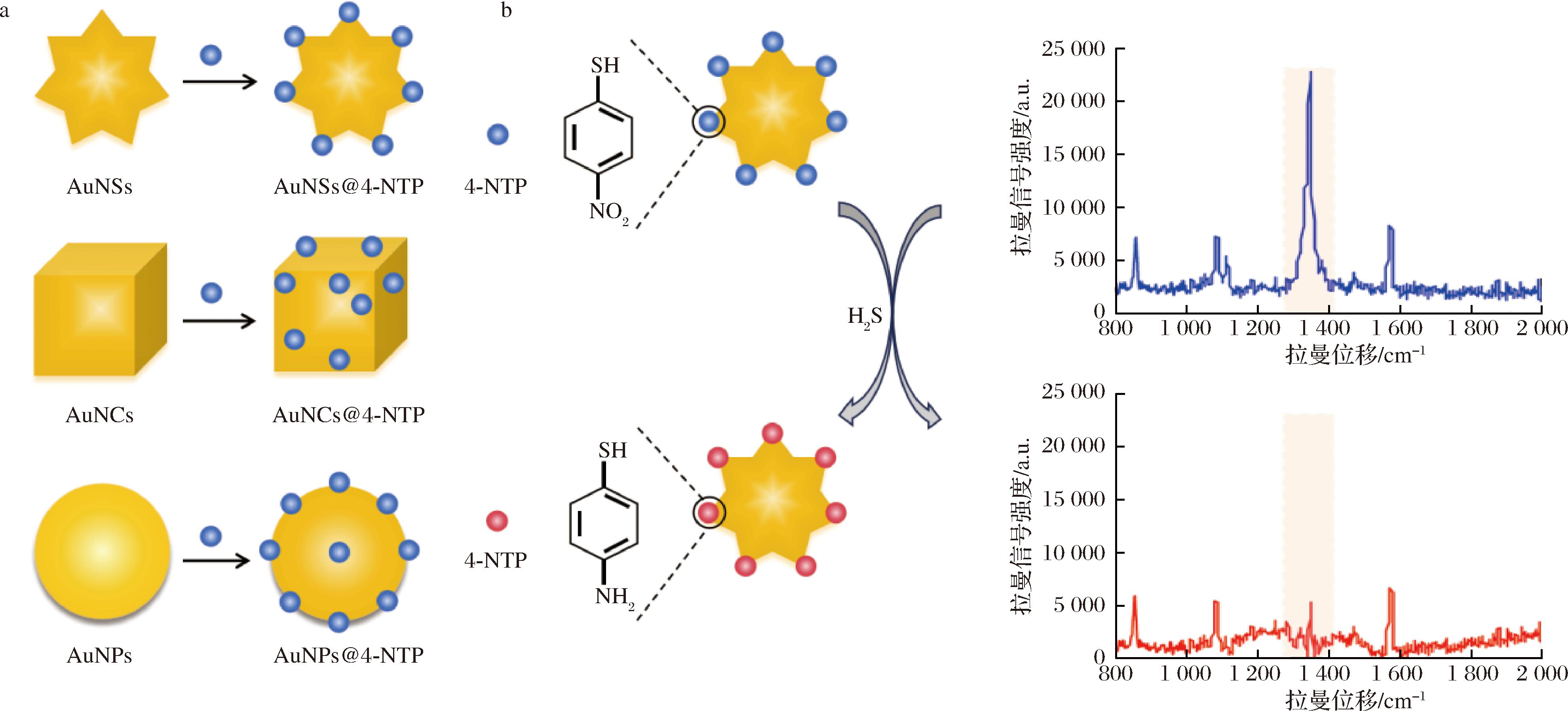
a-SERS纳米探针的构建;b-SERS纳米探针检测H2S的原理
图1 SERS纳米探针检测H2S的原理示意图
Fig.1 Schematic diagram of SERS nanoprobes for H2S detection
1 材料与方法
1.1 材料与试剂
HAuCl4·3H2O、聚乙烯吡咯烷酮(polyvinyl pyrrolidone,PVP),西格玛奥德里奇(上海)贸易有限公司;AgNO3、抗坏血酸、柠檬酸三钠、4-NTP、Na2S、半胱氨酸、谷胱甘肽、硫酸钠、次氯酸钠和硝酸钾,国药集团化学试剂有限公司。待测的葡萄酒和啤酒均购于当地一家超市(中国无锡)。
1.2 仪器与设备
ZEN3700激光粒度仪,英国马尔文仪器有限公司;JEM-2100透射电子显微镜,日本电子株式会社;U-3900紫外分光光度计,日本日立公司;Synergy H4多功能酶标仪,美国伯腾仪器有限公司;DXR2xi显微拉曼成像光谱仪,美国赛默飞世尔科技公司。
1.3 实验方法
1.3.1 SERS探针的制备
首先按照文献所报道的方法制备了AuNSs[16]、AuNCs[17]和AuNPs[18]。然后将62 μL 1 mg/mL 4-NTP乙醇溶液与1 mL的AuNSs或AuNCs或AuNPs溶液充分混匀,在25 ℃下避光反应2 h。最后4 000 r/min离心10 min,重复离心3次,以除去溶液中未结合的4-NTP,得到AuNSs@4-NTP、AuNCs@4-NTP、AuNPs@4-NTP,并将其重悬于1 mL超纯水中。
1.3.2 SERS纳米探针的筛选
对制备的3种SERS探针,通过显微拉曼成像光谱仪测定4-NTP的拉曼图谱(激发波长为785 nm),并比较特征峰的强度,筛选出具有最大SERS信号增强作用的SERS纳米探针,进行后续研究。
1.3.3 实验可行性验证
取200 μL的AuNSs@4-NTP溶液,再加入20 μL 10 mmol/L Na2S溶液。Na2S作为一种外源性H2S供体,可以缓慢有效释放出H2S,因此常被用作H2S的来源[19]。将混合溶液置于37 ℃恒温培养箱中反应0.5 h。通过显微拉曼成像光谱仪测定与H2S反应前后的AuNSs@4-NTP的拉曼图谱(激发波长为785 nm),测定硝基拉曼信号强度的变化。
1.3.4 H2S的定量检测
取20 μL不同浓度(10-3~102 μmol/L)的Na2S溶液,分别加入到7组200 μL的AuNSs@4-NTP溶液中,室温反应0.5 h后,通过显微拉曼成像光谱仪测定各组4-NTP的拉曼强度(激发波长为785 nm),探究SERS纳米探针的检测限和线性范围。
1.3.5 SERS纳米探针的选择性研究
选取与H2S具有相似化学性质的半胱氨酸和谷胱甘肽,以及酒类中常见的阴阳离子:![]() 作为潜在的干扰物质,开展了SERS纳米探针的选择性实验研究。将6组200 μL的AuNSs@4-NTP溶液(n=3)分别处置,第1组加入100 μL 1 μmol/L Na2S溶液,剩余5组分别加入100 μL 10 μmol/L的干扰物质(半胱氨酸、谷胱甘肽、硫酸钠、次氯酸钠和硝酸钾)。反应10 min后,比较各组的拉曼特征峰强度(激发波长为785 nm),以评估SERS纳米探针的选择性。
作为潜在的干扰物质,开展了SERS纳米探针的选择性实验研究。将6组200 μL的AuNSs@4-NTP溶液(n=3)分别处置,第1组加入100 μL 1 μmol/L Na2S溶液,剩余5组分别加入100 μL 10 μmol/L的干扰物质(半胱氨酸、谷胱甘肽、硫酸钠、次氯酸钠和硝酸钾)。反应10 min后,比较各组的拉曼特征峰强度(激发波长为785 nm),以评估SERS纳米探针的选择性。
1.3.6 SERS纳米探针的稳定性研究
将一组1 mL的AuNSs@4-NTP溶液(n=3)在4 ℃下放置不同时间,每次间隔1 d对其进行1次拉曼光谱检测(激发波长为785 nm),通过比较4-NTP在不同时间的拉曼信号强度,评估SERS纳米探针的稳定性。
1.3.7 啤酒和葡萄酒样品中H2S的检测
为了验证SERS纳米探针在H2S检测中的适用性和可靠性,选取从当地超市购买的葡萄酒和啤酒作为实际样品。为了模拟未知样本中的H2S检测过程,将已知浓度的Na2S标准溶液分别添加到了葡萄酒和啤酒样本中,进行回收实验。具体而言,选择浓度为100、200 nmol/L的Na2S标准溶液用于拉曼信号传感。样品预处理步骤如下:首先,将样品以转速10 000 r/min离心10 min,随后弃沉淀,收集上清液并通过滤膜过滤以去除杂质。取1 mL样品加入100 μL的AuNSs@4-NTP溶液和不同浓度的Na2S溶液,充分反应后,测定实际样品的拉曼信号强度(激发波长为785 nm)。上述过程重复3次,并计算回收率和相对标准偏差。
2 结果与分析
2.1 SERS纳米探针的表征
首先使用透射电子显微镜对制备的3种金纳米材料进行了形貌表征,结果显示,AuNSs呈现出具有突出尖端结构的星状形态,尺寸约为115 nm(图2-a);AuNCs呈现出均匀的立方体结构,尺寸约为60 nm(图2-b);AuNPs呈现出典型的球形形态,尺寸约为18 nm(图2-c)。随后,采用激光粒度仪探究了修饰4-NTP前后纳米颗粒的水合粒径和电荷性质的变化情况,经4-NTP修饰后,AuNSs、AuNCs和AuNPs的平均水合粒径均略有增加,分别从164、122、44 nm增加到195、164、59 nm(图2-d)。AuNSs、AuNCs和AuNPs均呈现电负性,且在修饰4-NTP后电负性均进一步增强,这可能是由于4-NTP解离后带负电荷,结合后致使纳米材料带有更多负电荷(图2-e)。最后,运用紫外分光光度计分别测定了3种纳米材料的UV-Vis(ultraviolet-visible spectroscopy)图谱,AuNSs、AuNCs和AuNPs的吸收峰分别位于760、590、550 nm,且在修饰4-NTP后并无明显偏移(图2-f),表明修饰4-NTP未对纳米材料的吸收峰值产生影响。
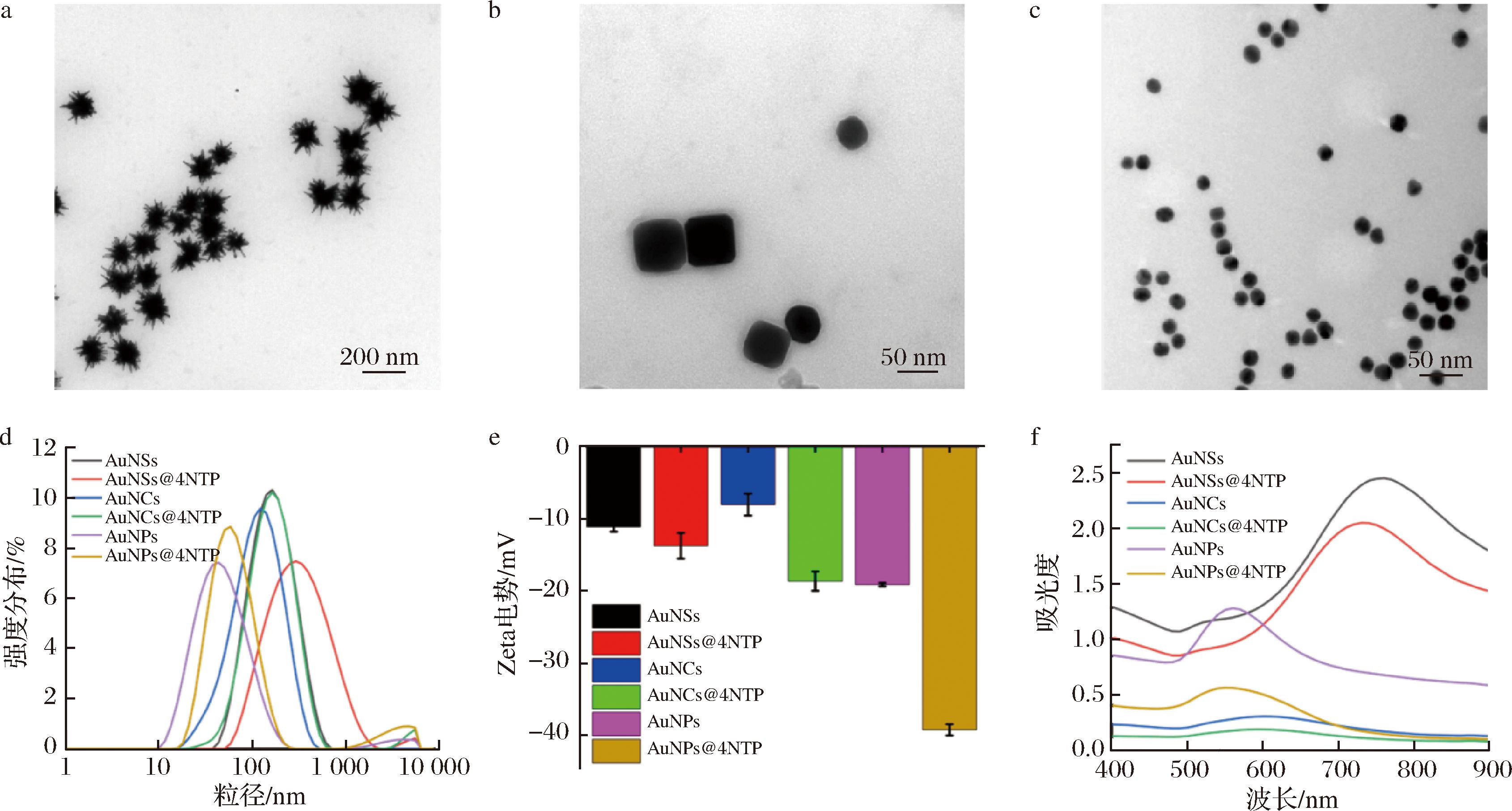
a-AuNSs的透射电镜图;b-AuNCs的透射电镜图;c-AuNPs的透射电镜图;d-纳米探针的平均水合粒径;e-纳米探针的Zeta电势; f-纳米探针的紫外-可见光吸收光谱
图2 纳米探针的表征
Fig.2 Characterization of the nanoprobes
2.2 SERS纳米探针的筛选
为了筛选出具备最佳拉曼增强效果的SERS探针,本研究通过拉曼光谱仪测定了3种制备的SERS探针的拉曼光谱,并比较了各探讨上的4-NTP拉曼特征峰的强度。如图3-a所示,与AuNCs@4-NTP和AuNPs@4-NTP相比,AuNSs@4-NTP显示出更强的拉曼信号强度,表明AuNSs对4-NTP的拉曼增强效果最显著。这主要归因于AuNSs的尖端结构、较大的表面曲率以及热点效应:AuNSs独特的尖端结构和突起之间容易形成电磁场强度极高的区域,产生“热点”效应,此外,AuNSs的表面曲率较大,进一步增加了其表面的电荷密度和电场强度,在拉曼散射过程中,AuNSs的这种“热点”效应能够极大地增强其表面的拉曼信号分子4-NTP的拉曼信号强度,使得AuNSs在拉曼光谱学中表现出更高的拉曼增强效应。因此选择以AuNSs@4-NTP作为SERS探针进行后续研究。
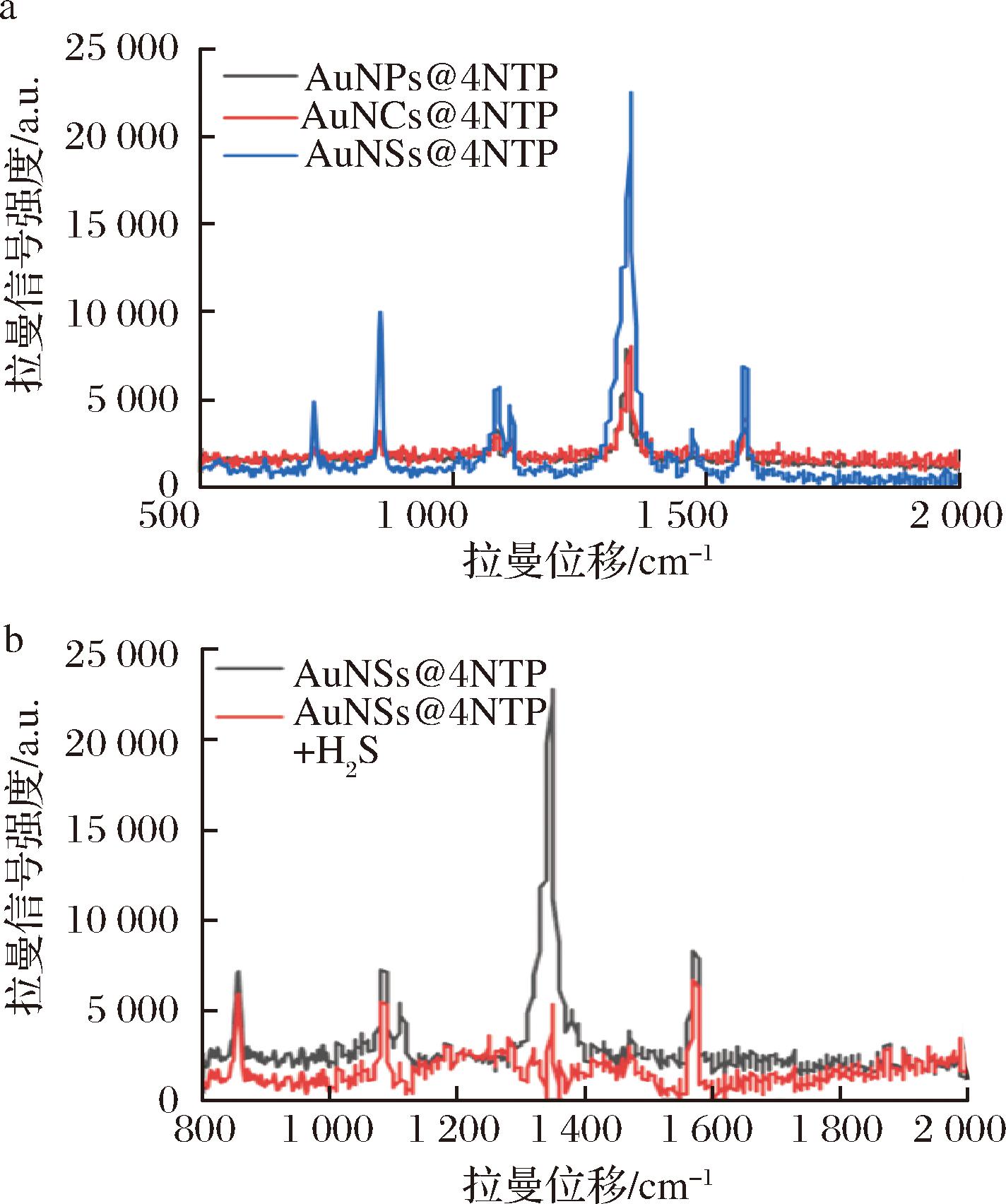
a-AuNSs@4-NTP、AuNCs@4-NTP、AuNPs@4-NTP的拉曼光谱; b-AuNSs@4-NTP添加H2S前后的拉曼光谱
图3 纳米探针的筛选及实验可行性验证
Fig.3 Screening of nanoprobes and verification of experimental feasibility
2.3 实验可行性验证
通过AuNSs@4-NTP与Na2S反应前后拉曼光谱的变化,探究了SERS探针用于检测H2S的可行性。实验结果表明,Na2S作为一种外源性H2S供体在溶液中可有效释放出H2S。如图3-b所示,与H2S反应前,AuNSs@4-NTP在1 329 cm-1处显示出较强的硝基特征拉曼峰。而与H2S反应后,SERS纳米探针中的4-NTP的硝基被H2S还原成含有氨基的4-ATP,使得硝基峰的拉曼信号强度显著降低。以上结果证明SERS探针对H2S具有良好的响应能力,可以根据硝基拉曼特征峰强度的变化实现对H2S的定量检测。
2.4 实验条件的优化
为了提高SERS纳米探针对H2S的检测性能,我们对几个关键实验条件进行了优化。首先探究了不同质量浓度的4-NTP对SERS基底拉曼信号的影响。当4-NTP质量浓度逐渐增加时,AuNSs@4-NTP的拉曼信号强度相应增强,并在质量浓度达到0.75 mg/mL时达到峰值。随后,随着4-NTP质量浓度进一步升高,拉曼信号强度反而呈下降趋势(图4-a)。这表明0.75 mg/mL为4-NTP的最优质量浓度,当质量浓度超过0.75 mg/mL后引起拉曼信号强度的下降,可能是因为高质量浓度的4-NTP导致了AuNSs@4-NTP的聚集,从而降低了其拉曼信号强度,影响了检测效果。其次,适当的反应时间可以保证AuNSs上装载足够数量的4-NTP,因此接下来对反应时间进行了优化。结果表明,随着反应时间的延长,AuNSs@4-NTP的拉曼强度逐渐增强,在45 min达到最大(图4-b),因此选择45 min作为4-NTP与AuNSs的最优反应时间。最后,为了探究探针与H2S反应时间对拉曼信号强弱的影响,将AuNSs@4-NTP加入相同浓度的Na2S溶液反应不同时间。AuNSs@4-NTP与H2S反应仅5 min时硝基强度就发生显著降低;反应20 min内,AuNSs@4-NTP的硝基拉曼信号强度仍随时间延长而不断减小;20 min后硝基信号强度随时间改变不明显(图4-c)。因此,选择20 min作为AuNSs@4-NTP与H2S的最优反应时间。
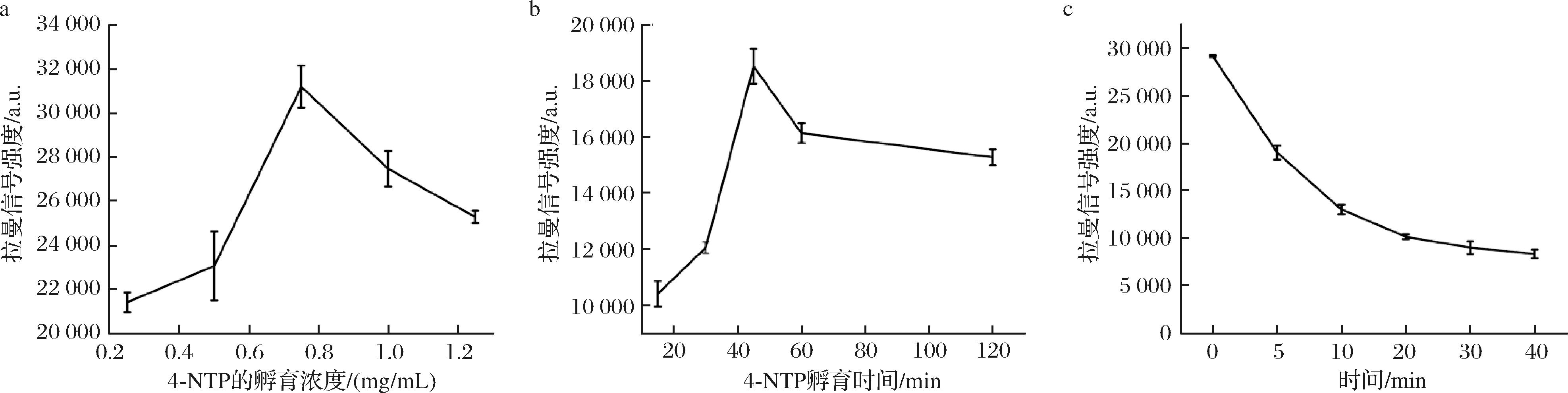
a-AuNSs@4-NTP上4-NTP质量浓度的优化;b-AuNSs@4-NTP与4-NTP反应时间的优化;c-AuNSs@4-NTP与H2S反应时间的优化
图4 关键实验条件的优化
Fig.4 Optimization of key experimental conditions
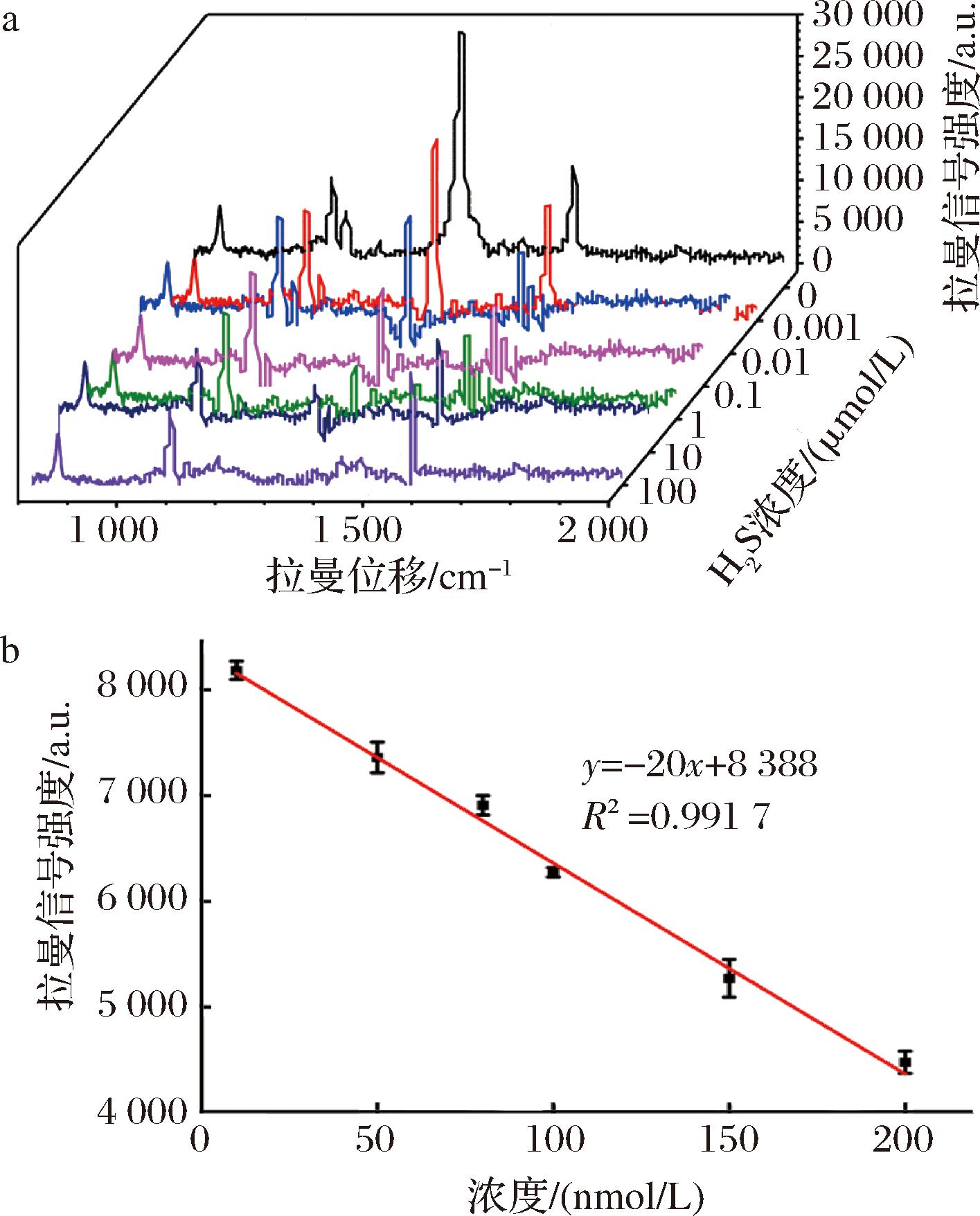
a-SERS纳米探针与不同浓度H2S反应的拉曼光谱; b-I1 329与H2S浓度间的线性关系
图5 SERS纳米探针对H2S的定量检测
Fig.5 Quantitative detection of H2S with the SERS nanoprobe
2.5 H2S的定量检测
为了探索该SERS纳米探针在H2S定量检测中的应用,本研究在优化的实验条件下制备了AuNSs@4-NTP,并将其分别与不同浓度的Na2S溶液(10-3~102 μmol/L)反应。随后,通过测量各样品的拉曼光谱,根据硝基拉曼信号强度与H2S浓度的关系,绘制了拉曼信号强度变化曲线及检测的线性曲线。如图5-a所示,硝基的拉曼信号随着H2S浓度的增加而逐渐降低。此外,在10~200 nmol/L浓度内,H2S的浓度与硝基的拉曼特征峰强度(I1 329)之间具有一定的线性关系,线性回归方程为y=-20x+8 338(R2=0.991 7),其中y为4-NTP硝基峰强度,x为Na2S浓度(图5-b)。根据线性回归方程,计算得到SERS纳米探针对H2S的检测限(limit of detection,LOD)为3.24 nmol/L,LOD=3σ/k,其中σ是空白对照测量值(n=3)的标准偏差,k是线性回归方程的斜率。
2.6 SERS纳米探针的选择性研究
选择性是影响SERS纳米探针检测应用的关键因素。因次,本文选取了与H2S具有相似化学性质的半胱氨酸和谷胱甘肽,以及酒类中常见的阴阳干扰离子![]() 对应的硫酸钠、硝酸钾和次氯酸钠,作为干扰物质开展了SERS纳米探针的选择性实验研究。将AuNSs@4-NTP分别和上述物质进行反应(Na2S的浓度为1 μmol/L,干扰物质的浓度为10 μmol/L),然后测定它们的拉曼光谱。从图6-a可以看出,在Na2S存在的情况下,SERS纳米探针的硝基特征峰的信号强度最小,而SERS纳米探针与干扰物质混合反应后硝基特征峰的信号强度和水溶液中的信号强度相比则无明显区别,这表明SERS纳米探针对H2S具有独特的识别能力,而对其他干扰物质的响应几乎可以忽略不计。
对应的硫酸钠、硝酸钾和次氯酸钠,作为干扰物质开展了SERS纳米探针的选择性实验研究。将AuNSs@4-NTP分别和上述物质进行反应(Na2S的浓度为1 μmol/L,干扰物质的浓度为10 μmol/L),然后测定它们的拉曼光谱。从图6-a可以看出,在Na2S存在的情况下,SERS纳米探针的硝基特征峰的信号强度最小,而SERS纳米探针与干扰物质混合反应后硝基特征峰的信号强度和水溶液中的信号强度相比则无明显区别,这表明SERS纳米探针对H2S具有独特的识别能力,而对其他干扰物质的响应几乎可以忽略不计。
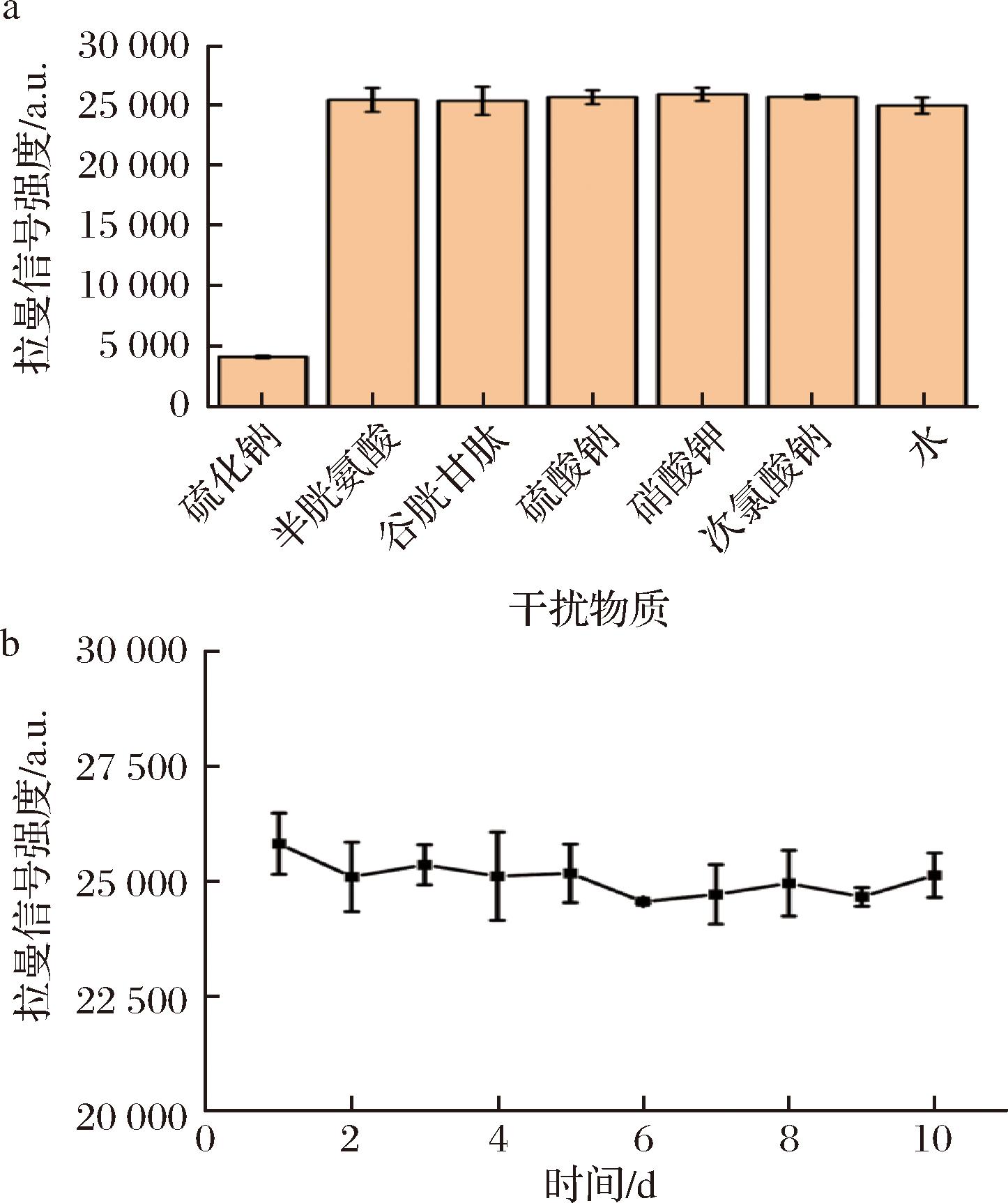
a-SERS纳米探针的选择性;b-SERS纳米探针的稳定性
图6 SERS纳米探针的选择性和稳定性研究
Fig.6 Study on the selectivity and stability of the SERS nanoprobe
2.7 SERS纳米探针的稳定性研究
稳定性是衡量探针性能的重要指标,不仅直接影响其实际应用中的可靠性,还关系到测量结果的准确性。良好的稳定性是确保纳米探针广泛应用的先决条件。因此,对SERS纳米探针在10 d内的拉曼信号稳定性进行了评估。如图6-b所示,AuNSs@4-NTP在10 d内的拉曼信号强度保持稳定,没有显著波动,这一结果证实AuNSs@4-NTP探针具有良好的稳定性。
2.8 葡萄酒和啤酒样品中H2S的检测
为了评估该方法在实际样品中的应用潜力,选取市售葡萄酒和啤酒作为研究对象,并分别向其中添加不同浓度的Na2S溶液。实际样品的检测条件与标准样品保持一致。实验结果如表1所示,所有实际样品H2S的回收率在97.54%~101.78%,相对标准偏差值为4.16%~8.68%。以上结果表明,SERS生物传感器可用于实际样品中H2S的检测,具有良好的实际应用潜能。
表1 H2S在实际样品中加标回收的实验结果(n=3)
Table 1 Experimental results of recovery of H2S in actual samples
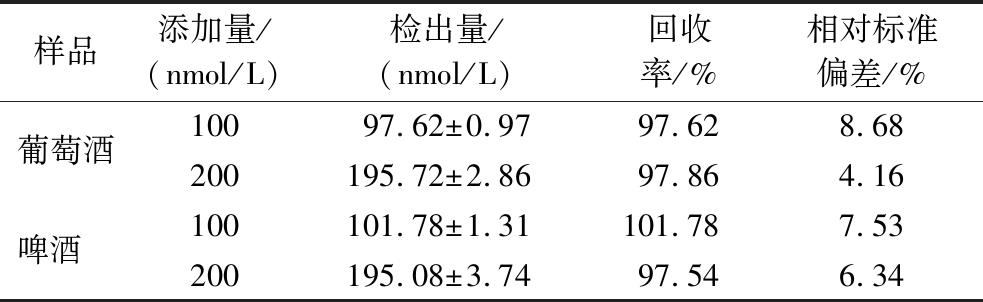
样品添加量/(nmol/L)检出量/(nmol/L)回收率/%相对标准偏差/%葡萄酒10097.62±0.9797.628.68200195.72±2.8697.864.16啤酒 100101.78±1.31101.787.53200195.08±3.7497.546.34
3 结论
本文构建了一种基于SERS的纳米探针,用于高效、灵敏地检测H2S。当H2S存在时,SERS纳米探针中的4-NTP的硝基被H2S还原成氨基,使得硝基峰的拉曼信号强度明显降低,从而实现对H2S的灵敏检测。结果表明,SERS纳米探针对H2S表现出10~200 nmol/L的线性响应范围,检测限为3.24 nmol/L。该纳米探针具有良好的H2S检测特异性,对其他干扰物质的响应能力较弱。此外,其拉曼信号在10 d内无明显波动,显示出优异的稳定性。最后,该纳米探针已被用于检测葡萄酒和啤酒中的H2S,回收率为97.54%~101.78%,表明其初步具有良好的实际应用能力。这种高度选择性的方法为测定其他食品基质中的H2S提供了广阔的前景。
[1] KOLLURU G K, SHACKELFORD R E, SHEN X G, et al.Sulfide regulation of cardiovascular function in health and disease[J].Nature Reviews Cardiology, 2023, 20(2):109-125.
[2] LI S P, HU K D, HU L Y, et al.Hydrogen sulfide alleviates postharvest senescence of broccoli by modulating antioxidant defense and senescence-related gene expression[J].Journal of Agricultural and Food Chemistry, 2014, 62(5):1119.
[3] SHANG Z Y, MENG Q T, TIAN D H, et al.Red-emitting fluorescent probe for hydrogen sulfide detection and its applications in food freshness determination and in vivo bioimaging[J].Food Chemistry, 2023, 427:136701.
[4] YU Y X, LI G L, WU D, et al.Determination of hydrogen sulfide in wines based on chemical-derivatization-triggered aggregation-induced emission by high-performance liquid chromatography with fluorescence detection[J].Journal of Agricultural and Food Chemistry, 2020, 68(3):876-883.
[5] VELA E, HERN NDEZ-ORTE P, FRANCO-LUESMA E, et al.The effects of copper fining on the wine content in sulfur off-odors and on their evolution during accelerated anoxic storage[J].Food Chemistry, 2017, 231:212-221.
NDEZ-ORTE P, FRANCO-LUESMA E, et al.The effects of copper fining on the wine content in sulfur off-odors and on their evolution during accelerated anoxic storage[J].Food Chemistry, 2017, 231:212-221.
[6] XING X, WU L Y, ZHANG Y C, et al.Femtomolar hydrogen sulfide detection via hybrid small-molecule nano-arrays[J].Nature Communications, 2024, 15:10831.
[7] ZHAI X R, LI S, WANG Y K, et al.A magnet-renewable electroanalysis strategy for hydrogen sulfide in aquaculture freshwater using magnetic silver metal-organic frameworks[J].Analytica Chimica Acta, 2022, 1195:339450.
[8] CAO J, LOPEZ R, THACKER J M, et al.Chemiluminescent probes for imaging H2S in living animals[J].Chemical Science, 2015, 6(3):1979-1985.
[9] ZHANG Y Q, GU Y Q, HE J, et al.Ultrabright gap-enhanced Raman tags for high-speed bioimaging[J].Nature Communications, 2019, 10(1):3905.
[10] HANG Y J, BORYCZKA J, WU N Q.Visible-light and near-infrared fluorescence and surface-enhanced Raman scattering point-of-care sensing and bio-imaging:A review[J].Chemical Society Reviews, 2022, 51(1):329-375.
[11] QI X Y, YE Y F, WANG H, et al.An ultrasensitive and dual-recognition SERS biosensor based on Fe3O4@Au-Teicoplanin and aptamer functionalized Au@Ag nanoparticles for detection of Staphylococcus aureus[J].Talanta, 2022, 250:123648.
[12] TONG L M, ZHU T, LIU Z F.Approaching the electromagnetic mechanism of surface-enhanced Raman scattering:From self-assembled arrays to individual gold nanoparticles[J].Chemical Society Reviews, 2011, 40(3):1296-1304.
[13] ZHONG Q M, ZHANG R R, YANG B B, et al.A rational designed bioorthogonal surface-enhanced Raman scattering nanoprobe for quantitatively visualizing endogenous hydrogen sulfide in single living cells[J].ACS Sensors, 2022, 7(3):893-899.
[14] ZHANG W S, WANG Y N, XU Z R.High sensitivity and non-background SERS detection of endogenous hydrogen sulfide in living cells using core-shell nanoparticles[J].Analytica Chimica Acta, 2020, 1094:106-112.
[15] CHEN S, FAN J Y, LV M Y, et al.Internal standard assisted surface-enhanced Raman scattering nanoprobe with 4-NTP as recognition unit for ratiometric imaging hydrogen sulfide in living cells[J].Analytical Chemistry, 2022, 94(42):14675-14681.
[16] WANG X L, YANG H R, SUN T, et al.A fluorescence and SERS dual-mode biosensor for quantification and imaging of Mucin1 in living cells[J].Biosensors and Bioelectronics, 2025, 270:116964.
[17] WANG J W, MA S, GE K Z, et al.Face-to-face assembly strategy of Au nanocubes:Induced generation of broad hotspot regions for SERS-fluorescence dual-signal detection of intracellular miRNAs[J].Analytical Chemistry, 2024, 96(22):8922-8931.
[18] LIU H, CHEN R, WU K X, et al.Ratiometric fluorescent biosensor for detection and real-time imaging of nitric oxide in mitochondria of living cells[J].Biosensors and Bioelectronics, 2024, 248:116000.
[19] ZHU A F, ALI S, JIAO T H, et al.Facile synthesis of fluorescence-SERS dual-probe nanocomposites for ultrasensitive detection of sulfur-containing gases in water and beer samples[J].Food Chemistry, 2023, 420:136095.