“金花”菌(Aspergillus chevalieri)是茯砖茶“发花”过程中形成的优势菌种,主要包括冠突散囊菌、冠突曲霉、谢瓦曲霉、阿姆斯特丹散囊菌等具有相似结构和活性功能的微生物[1],是目前研究较深入的发酵类真菌[2]。在茶叶加工过程中,利用“金花”菌(冠突散囊菌)进行发酵,可在茶叶表面形成密集的金黄色颗粒(“金花”)。该过程能显著改善茶汤的感官品质(滋味与香气),并赋予茶叶多种生理活性功能。孙玉姣等[3]将黑毛茶、乌龙茶、黄茶、绿茶、红茶以及白茶作为基质人工接种冠突散囊菌发酵后有效地改善了茶叶的理化性能。周祎炜等[4]从茯砖茶中分离出“金花”菌,经过“金花”菌发酵后的紫娟红茶不仅能有效改善其茶汤色泽滋味,还可以促进紫娟红茶发酵过程中抗氧化物质的释放。研究表明,在茯砖茶发酵过程中“金花菌”能显著降低茶多酚、氨基酸等化合物的含量,改善茶叶原本的苦涩味感,同时提供发酵茶木香、花香、冬青油香、蘑菇香和果香等多种香气[5]。宋林瑶等[6]利用冠突散囊菌固态发酵制备的成品茶,具有由芳樟醇、水杨酸甲酯等8种特征挥发性化合物组成的一种复合花香,呈现出浓郁的“金花”香。李学震等[7]用“金花”菌发酵桑叶,发酵后减少了不良风味的挥发性成分并且增加了具有水果和脂肪香气的物质。目前,“金花菌”的研究大多集中在茯砖茶发酵、菌株胞外活性物质鉴定、菌种分类学的研究上[8]。“金花菌”在酒类、醋类、调味品的酿造与功能食品的开发方面还有待进一步研究。
“紫娟”是云南省农科院茶叶研究所于1985年利用云南大叶群体国家级茶树良种单株培育而成,因其芽尖、叶片、茎干、花萼、花梗和茶汤等多紫红色而得名[9]。该茶树鲜叶常用于制作干茶,既有较好的饮用价值,又有较高的色素利用价值。其中的花色苷显著高于普通大叶茶。此外,紫娟茶还具有降血压、降血糖、保护肝脏、增强记忆力、影响脂类代谢和抗氧化等作用。不同的加工工艺对于紫娟茶的品质有着显著的影响[10],李沅达等[11]分析发现采用自然萎凋方式加工的紫娟白茶可以有效地提高其品质。在发酵过程中,紫娟红茶的挥发性成分发生显著变化。该过程增强了其香气的复杂度,特别是提升了甜香特征。感官评价结果表明,发酵前紫娟红茶主要呈现花果香与辛香特征,而发酵完成后则转化为以木香和甜香为主导的香气轮廓[12]。目前对于紫娟茶的研究多集中于紫娟茶的成分以及生理活性研究,紫娟茶花青素的种类以及代谢合成途径方面已有大量研究。作为一种高花青素含量的茶叶品种,紫娟茶本身汤色偏暗紫,高花青素含量又会让茶汤产生涩感,紫娟做生茶涩感明显、品种香强烈,口腔有收敛,相较于其他品种茶叶品质与饮用口感效果往往欠佳[13-16]。
多酚类物质作为重要的天然活性成分之一,具有抗氧化、抑菌、抗癌、保护心脑血管健康以及降低血脂血糖等多种功能[17-18]。茶多酚作为茶叶中多酚类物质的总称,是茶叶主要的次生代谢产物,种类多样,结构复杂,在茶叶中占比达到15%~30%。茶多酚物质的含量占比影响着茶叶色香味等品质。
本研究采用“金花”菌发酵紫娟红茶,利用气相-离子迁移谱(gas phase ion mobility spectrometry,GC-IMS)技术对紫娟红茶发酵过程中挥发性物质变化进行对比,阐明了不同发酵时期紫娟红茶的挥发性成分及其差异,结合聚类热图对茶叶中三大多酚类物质进行分析,探究紫娟红茶发酵过程中特征风味物质的变化规律,本研究旨在为紫娟茶树品种的发酵工艺优化及风味品质定向调控提供理论依据与实践参考。
1 材料与方法
1.1 材料与试剂
“金花”菌(谢瓦曲霉,Aspergillus chevalieri)分离自茯砖茶:陕西怡泽茯茶有限公司;紫娟红茶:采自陕西省汉中市特殊教育园艺圃试验地茶园,并采用传统红茶工艺加工制成。
马铃薯葡萄糖琼脂培养基(potato dextrose agar,PDA)、马铃薯葡萄糖肉汤培养基(potato dextrose broth,PDB),北京奥博星生物技术有限责任公司;芦丁、甲醇、磷酸、福林酚、乙腈(均为色谱纯),没食子酸(gallic acid, GA)(纯度≥99%),上海麦克林生化科技有限公司;儿茶素(catechin, C)、表儿茶素(epicatechin, EC)、表儿茶素没食子酸酯(epicatechin gallate, ECG)、表没食子酸儿茶素没食子酸酯(epigallocatechin gallate, EGCG)、表没食子酸酯儿茶素(epigallocatechin, EGC)、没食子儿茶素没食子酸酯(gallocatechin gallate, GCG)、没食子酸儿茶素(gallocatechin, GC)(纯度均≥98%),上海同田生物技术有限公司。
1.2 仪器与设备
FlavourSpec®气相离子迁移色谱仪,德国G.A.S公司;H1850R低温冷冻离心机,湖南湘仪实验室仪器开发有限公司;1260高效液相色谱仪,美国安捷伦科技有限公司;BMJ-160C霉菌培养箱,上海博迅实业有限公司医疗设备厂;名牌之星SW-CJ-2D型超净工作台,苏州净化设备有限公司;ULD160 2012紫外可见分光光度计,上海美谱达仪器有限公司;JY-6CHZ-1B型茶叶烘焙机,福建佳友茶叶机械智能科技股份有限公司。
1.3 实验方法
1.3.1 “金花”菌孢子悬液制备
取保存于-20 ℃“金花”菌单菌落PDA培养基,在无菌操作条件下,用接种环将黄色闭囊壳刮下,悬浮于150 mL装有玻璃珠的无菌水中,置于摇床1 min目的是使菌均匀分散,调整孢子液浓度1×108 CFU/mL,将“金花”菌孢子引种至锥形瓶中,其中含200 mL液体PDB培养基,摇床转速设置为180 r/min,25 ℃恒温培养7 d;冷藏备用。
1.3.2 紫娟“金花”茶样品的制备
“金花”散茶制备参考XU等[19]的方法进行修改,基本工艺流程:紫娟红茶→称样→复水→灭菌(汽蒸)→接种→发花→干燥→“金花”散茶。
取50 g紫娟红茶,置于250 mL锥形瓶中,共5组,121 ℃灭菌20 min,在室温下放置30 min后,使用“金花”菌孢子悬液接种5组灭菌紫娟红茶,未接种茶叶组作为未发酵组进行指标测定,调整含水量至60%,使茶叶充分湿润,接种量为35%,在28 ℃的恒温培养箱中进行固态发酵,发酵8~10 d,观察到“金花”菌分布整瓶茶样后终止发酵,每2 d取出1组,在60 ℃烘箱内干燥3 h,得到茶样,并在发酵10 d后取出全部分组,即未发酵组、发酵2 d组、发酵4 d组、发酵6 d组、发酵8 d组以及发酵10 d组。
1.3.3 GC-IMS检测挥发性成分
参考敬思群等[20]的方法稍作修改,分别称取1.0 g各组茶样于20 mL顶空瓶中,80 ℃孵育15 min后进样。
GC-IMS测定条件:顶空孵化温度80 ℃;孵化时间:15 min;进样体积:500 μL;不分流进样;孵化转速:500 r/min色谱柱温度:60 ℃;载气:高纯氦(纯度≥99.999%);程序升压:初始流量2.00 mL/min保持2 min,在8 min内线性增至10.00 mL/min,在10 min内线性增至100.00 mL/min,保持10 min。色谱运行时间:30 min;进样口温度:80 ℃。电离源:氚源(3H);迁移管长度:53 mm;电场强度:500 V/cm;迁移管温度:45 ℃;漂移气:高纯氮气(纯度≥99.999%);流速:150 mL/min;正离子模式。
检测6种酮的混标,建立保留时间和保留指数的校准曲线,随后通过目标物的保留时间计算出该物质的保留指数,使用VOCal软件内置的GC保留指数(NIST 2020)数据库和IMS迁移时间数据库检索和比对,对目标物进行定性分析。
1.3.4 理化成分含量的测定
茶多酚、儿茶素含量测定参考GB/T 8313—2018 《茶叶中茶多酚和儿茶素类含量的检测方法》,花青素测定采用酸性乙醇提取并采用分光光度法进行测定[21],总黄酮含量测定采用三氯化铝比色法[22]。
1.4 数据处理与分析
利用VOCal数据处理软件中的Reporter、Gallery Plot和Dynamic PCA等插件分别生成挥发性成分的三维谱图、二维谱图、差异谱图、指纹图谱及主成分分析(principal component analysis,PCA)图,用于样品间挥发性有机物的对比。采用SPSS19.0软件进行数据处理、Excel 2016和Origin 2018进行数据统计和图表制作。
2 结果与分析
2.1 “金花菌”发酵紫娟红茶过程中挥发性成分对比分析
图1为“金花菌”发酵不同时间的紫娟红茶的挥发性成分二维谱图,通过GC-IMS技术可对样品的不同组分进行直观的分析且提高定性的准确度。谱图中的每一个点代表一种化合物,一种化合物可能会有2个或多个斑点,代表二聚体或多聚体。气味成分的含量通过颜色深浅呈现,颜色越深表示该物质含量越高[23]。由图1可见,“金花菌”发酵过程中,随着发酵时间的延长,挥发性成分有明显变化。利用Vocal软件内置的Reporter插件制作不同发酵时间紫娟红茶样品中挥发性成分差异图谱(经过归一化处理,如图2所示),选取未发酵(0 d组)的紫娟红茶图谱作为参比,若二者所含挥发性成分相似,扣除背景色后显示为白色,若呈现蓝色则代表该物质的浓度低于参比,若呈现红色则代表该物质浓度高于参比。图2中化合物的颜色直接反映信号峰的相对强度,从而判断该挥发性成分在不同样品中的相对含量,颜色越深代表相对含量越大,颜色越浅表示该化合物的相对含量越低[24]。目的是更直观地对比“金花菌”发酵紫娟红茶前后挥发性成分的差异。发酵后差异图2-A中出现了红色斑点,随着发酵时间的迁移,以图2-A为对照组图,图2-C~图2-F蓝色斑点面积逐渐增多。这表明发酵过程中随着发酵程度的深入紫娟红茶挥发性成分相对含量的差异较大。
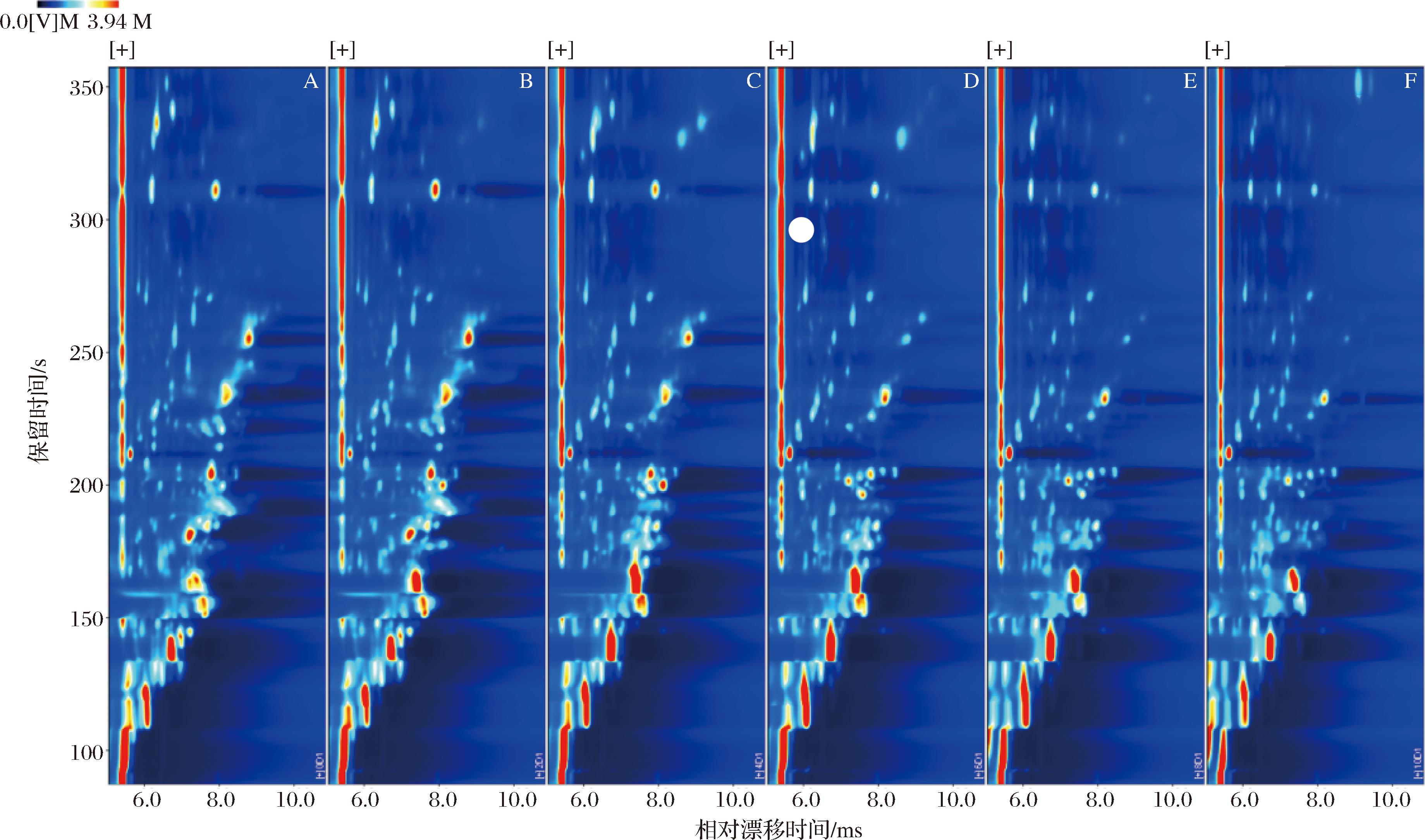
A-发酵0 d;B-发酵2 d;C-发酵4 d;D-发酵6 d;E-发酵8 d;F-发酵10 d
图1 紫娟红茶发酵前后GC-IMS二维图谱
Fig.1 Two-dimensional profile of volatile components in Zijuan black tea before and after fermentation
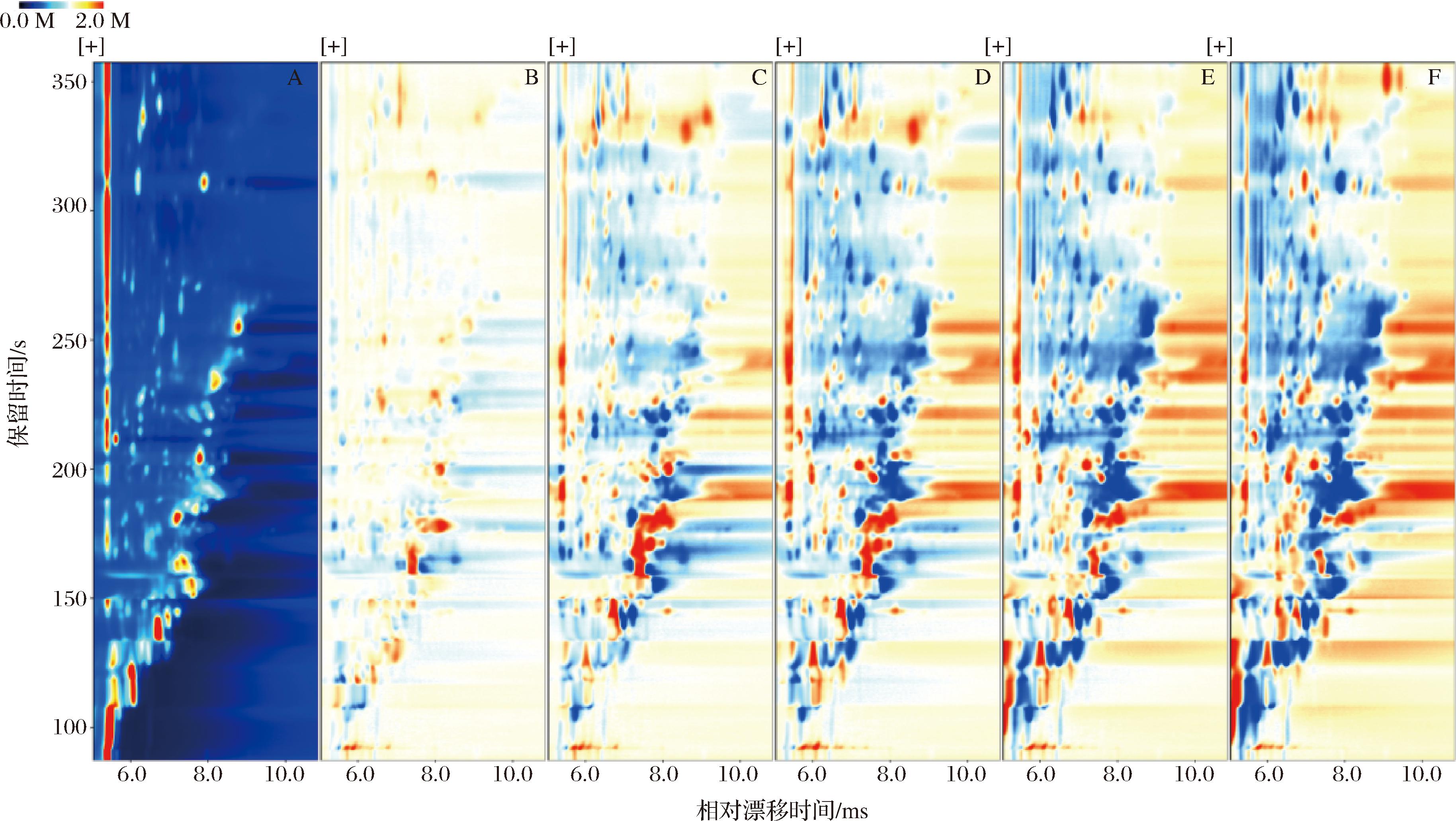
1-发酵0 d;B-发酵2 d;C-发酵4 d;D-发酵6 d;E-发酵8 d;F-发酵10 d
图2 紫娟红茶发酵前后挥发性物质差异图
Fig.2 Differential analysis diagram of volatile components in Zijuan black tea before and after fermentation
2.2 “金花菌”发酵紫娟红茶过程中挥发性成分定性定量分析
为探究紫娟红茶发酵过程中的挥发性成分,通过对照VOCal软件内置的NIST数据库和IMS数据库检索和比对,根据不同发酵天数的紫娟红茶挥发性物质的保留指数、保留时间和迁移时间进行定性分析,共检测出112种挥发性成分,定性检出100种,以及12种未知成分。其中,包括醇类23种、酯类20种、醛类18种、酮类16种、烯类9种、酸类4种、吡嗪类4种、醚类3种、呋喃类1种、硫类1种、噻唑类1种,100种挥发性成分在不同发酵时间内的峰值体积见附表1(https://doi.org/10.13995/j.cnki.11-1802/ts.042043)。根据不同发酵时间紫娟茶挥发性成分的变化,采用归一法对样品中鉴定出的不同类型化合物进行半定量分析。如图3所示,检测出挥发性成分以醇类、醛类、酯类以及酮类四类为主。
表1 紫娟红茶发酵过程中各类儿茶素含量的变化
Table 2 Changes in the contents of various catechins during the fermentation process of Zijuan black tea
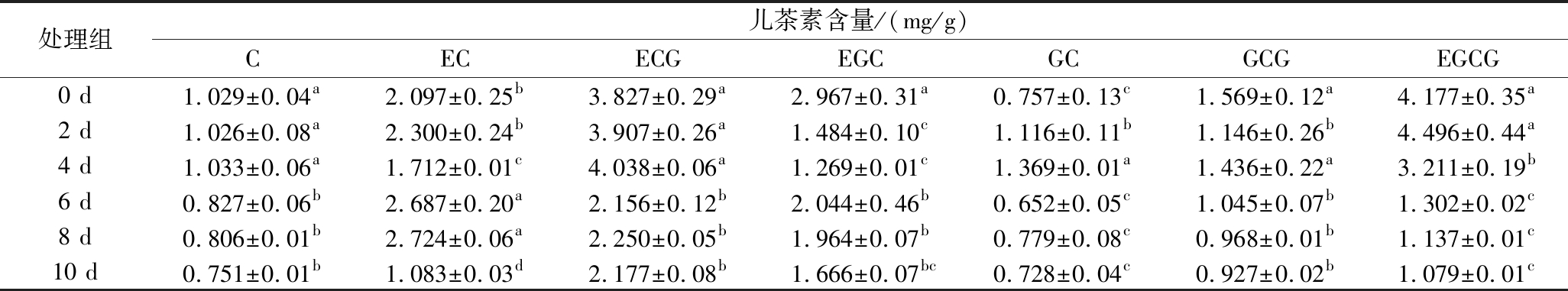
注:同列数据不同小写字母表示差异显著(P<0.05)。
处理组儿茶素含量/(mg/g)CECECGEGCGCGCGEGCG0 d1.029±0.04a2.097±0.25b3.827±0.29a2.967±0.31a0.757±0.13c1.569±0.12a4.177±0.35a2 d1.026±0.08a2.300±0.24b3.907±0.26a1.484±0.10c1.116±0.11b1.146±0.26b4.496±0.44a4 d1.033±0.06a1.712±0.01c4.038±0.06a1.269±0.01c1.369±0.01a1.436±0.22a3.211±0.19b6 d0.827±0.06b2.687±0.20a2.156±0.12b2.044±0.46b0.652±0.05c1.045±0.07b1.302±0.02c8 d0.806±0.01b2.724±0.06a2.250±0.05b1.964±0.07b0.779±0.08c0.968±0.01b1.137±0.01c10 d0.751±0.01b1.083±0.03d2.177±0.08b1.666±0.07bc0.728±0.04c0.927±0.02b1.079±0.01c
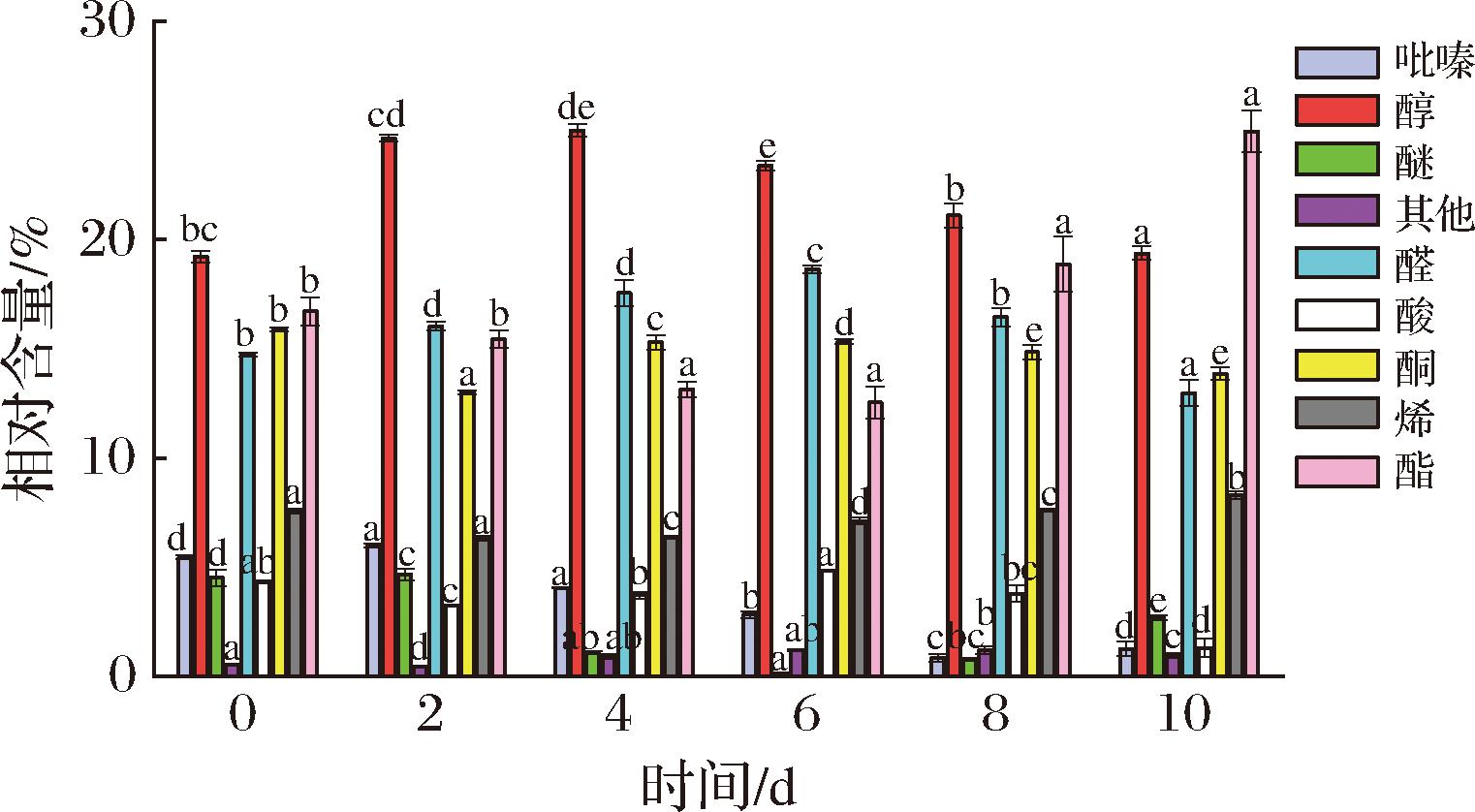
图3 不同发酵时间紫娟红茶的挥发性成分相对含量
Fig.3 Relative contents of volatile components in Zijuan black tea with different fermentation times
注:不同小写字母表示差异显著(P<0.05)(下同)。
醇类物质是茶叶香气的重要组成部分,在紫娟红茶发酵的过程中,茶叶中的酶类(如多酚氧化酶、过氧化物酶等)会催化茶叶中的成分发生反应。其次,在茶树生长以及“金花菌”发酵茶茶的过程中,微生物的代谢活动会促使茶叶中的物质发生转化生成醇类。样品中检测出来的醇类物质主要有芳樟醇氧化物(D)、1-辛烯-3-醇(M)、顺-2-戊烯-1-醇、(3E)-己烯醇、顺-3-己烯-1-醇-D2、正庚醇、糠醇(D)、正己醇(D)、氧化芳樟醇以及β-香茅醇相对含量随发酵时间的延长而持续减少。这些醇类物质的挥发性气味多为青草香、青叶香以及花香。正己醇、丙硫醇、仲辛醇、2-甲基丁醇、1-戊醇以及异丁醇相对含量则在持续增多。其中1-戊烯-3-醇(M)、1-戊烯-3-醇(D)、2-己醇、糠醇(M)、3-甲基-3-丁烯-1-醇在发酵第6天到第10天时相对含量不再增多。需要注意的是芳樟醇氧化物(M)、1-辛烯-3-醇(D)、正己醇(M)相对含量呈现先增多再减少的趋势,在发酵中后期,这些醇类物质赋予了茶叶辛香、木香以及水果香气。
酯类物质通常具有果香、花香等令人愉悦的香气特征。在茶叶发酵阶段,由醇类和酸类物质相互作用生成。样品中的酯类物质主要包括丙酸丁酯、乙酸乙酯(D)、丙酸丙酯、乙酸乙酯(M)、甲氟膦酸异丙酯以及乙酸庚酯,其随发酵时间延长逐渐减少,直至消失。水杨酸甲酯、丙烯酸乙酯、当归内酯、异硫氰酸烯丙酯(M)、辛酸甲酯在发酵第4天增多,在第6天之后相对含量逐渐下降。乙酸丙酯、乙酸甲酯、异硫氰酸烯丙酯(D)以及乙酸丁酯相对含量持续增多。甲酸异戊酯、醋酸丙酯、2-甲基丙酸乙酯、3-甲基-1-丁酰基乙酸酯、异戊酸甲酯在发酵第6天到第10天时逐渐增多。呈现出甜美酒香、成熟果香的气味特点。
醛类物质往往具有清新的花果香气,为茶叶的香气增添丰富度和层次感。样品中检测出来的醛类物质有糠醛-d4(M)、异戊烯醛、顺-4-庚二醛、(反,反)-2,4-庚二烯醛、反-2-辛烯醛、正己醛,其相对含量随发酵时间逐渐增加,在发酵第4天增长幅度剧烈。同时苯甲醛(D)、3-(甲硫基)丙醛、2-己烯醛(M)、2-乙酰基苯甲醛(M)以及2-乙酰基苯甲醛(D)的相对含量逐渐减少,并且在发酵第4天下降速度加快。糠醛-d4(D)、3-甲硫基丙醛在发酵第4天时相对含量增加,而在发酵第6天时减少。2-己烯醛(D)的相对含量比较稳定,在发酵过程中没有太大变化。
茶叶中的脂肪酸在酶的作用下发生氧化分解,产生酮类化合物,是茶叶整体香气的重要组成部分。样品中2-己酮、2,3-戊二酮、环己烯-2-酮、环戊酮以及2-壬酮的相对含量逐渐增多。这些酮类物质具有辛香等令人愉快的气味。甲基庚烯酮、2-庚酮、2-丁酮-3-羟基、二丙基甲酮、2-庚酮、异丙叉丙酮(M)以及异丙叉丙酮(D)的相对含量则持续减少。值得注意的是,2-戊酮(M)以及2-戊酮(D)的相对含量在发酵过程中呈现先上升再下降趋势,在发酵中期赋予茶叶甜果香、酒香以及木质香的气味特征。
烯类物质容易挥发,在嗅闻时能迅速被感知,常具有清新、芬芳的气味,对于茶叶整体的香气风格有显著影响。样品中检测到的烯类物质分别是α-萜品烯、β-罗勒烯、α-水芹烯(M)、2-戊基呋喃、α-蒎烯、苯乙烯、1-丙烯-3-甲硫基以及1-辛烯,它们共同赋予了茶叶柑橘香以及青草香等。
酸类化合物不仅提供酸味,同时提供香气和一些不愉快的气味,是独特风味形成过程中不可或缺的物质[25]。样品中的酸类物质分别是丁酸、正戊酸、异戊酸和异丁酸。
醚类物质通常具有独特的香气特征,茶叶的加工过程促使醚类物质生成,为茶叶带来花香、果香、草香等不同风味,样品中检测出醚类物质为乙二醇乙醚、二丙基硫醚以及四氢呋喃,这3种醚类物质散发出温和,令人愉快的气味。
杂环化合物通常在茶叶中含量较低,其香气类型涵盖了花香、果香、烘焙香、焦糖香等多种复杂且独特的香气,对于茶叶整体的香气品质和特征具有重要的影响。样品中的杂环化合物一共有6种,其中含氮六元杂环化合物吡嗪类物质有2,5-二甲基吡嗪、2,3-二甲基吡嗪、2,3-二甲基-5-乙基吡嗪、2-异丁基-3-甲氧基吡嗪,以及五元杂环化合物2-甲基-3-甲硫基呋喃和4-甲基噻唑。杂环类化合物主要是在发酵过程中由美拉德反应和斯特勒克降解产生的氨基酮经缩合反应产生[26]。样品最后还检测出1种硫类化合物为二乙基二硫。
2.3 “金花菌”发酵紫娟红茶过程中挥发性成分指纹图谱分析
图4是利用Gallery Plot插件绘制的指纹谱图对比较紫娟红茶发酵过程中挥发性成分的差异,同一行代表一个样品的挥发性成分组成,同一列代表某种挥发性成分在不同样品中的信号峰;信号峰的颜色明、暗代表该物质的浓度高低[27]。如图4(A区域)所示,发酵前后紫娟红茶含量相似的挥发性成分有水杨酸甲酯、香茅醛、芳樟醇氧化物、苯乙酮、当归内酯、2-乙酰基苯甲醛、2-己烯醛、异硫氰酸烯丙酯、2-丙酮、苯甲醛、丁酸、丙硫醇、1-辛烯等物质这些香气物质作为紫娟红茶发酵过程中的所有香气来源,使紫娟红茶整体呈现水果香气、木香和花香。图4(B区域)显示的是发酵后含量减少的物质,其中正庚醇、正己醇、反-2-壬醛、顺-3-己烯-1-醇-D2、丙酸丁酯、丙酸丙酯、异丁酸-1-13C、2,5-二甲基吡嗪、乙酸庚酯、甲氟膦酸异丙酯、糠醇、正壬醛、二乙基二硫、1-丙烯-3-甲硫基、乙二醇乙醚、乙酸乙酯和2-甲基丙酸乙酯在发酵4 d开始减少,二丙基甲酮、3-(甲硫基)丙醛、2-异丁基-3-甲氧基吡嗪、β-香茅醇、2-庚酮在发酵6 d开始减少,需要特别关注的是二丙基甲酮、(反)-2-辛烯醛、顺-3-己烯-1-醇-D2以及丙酸丁酯在发酵后期(8~10 d)完全消失。这表明紫娟红茶的挥发性成分在发酵过程中可能发生了转化,花果香、青草香气逐渐消失。图4(C区域)显示的是发酵后过程中呈现先向上升后下降的变化规律,特别是2-戊酮、2-甲基-3-甲硫基呋喃、糠醛-d4、乙酸甲酯、1-辛烯-3-醇、辛酸甲酯含量变化呈现先增加后减少。图4(D区域)显示的是发酵后含量增加的物质,有2-甲基丙酸乙酯、环戊酮、2-甲基丁醇、2,3-戊二酮、1-己醇、甲酸异戊酯、α-蒎烯、异硫氰酸烯丙酯、仲辛醇、乙酸丙酯、(反)-2-辛烯醛、乙酸丁酯、2-己酮、2-壬酮,然而醋酸丙酯、α-水芹烯(D)只有在发酵10 d的紫娟红茶中有明显检出,使发酵后期具有明显的芳香与木香。
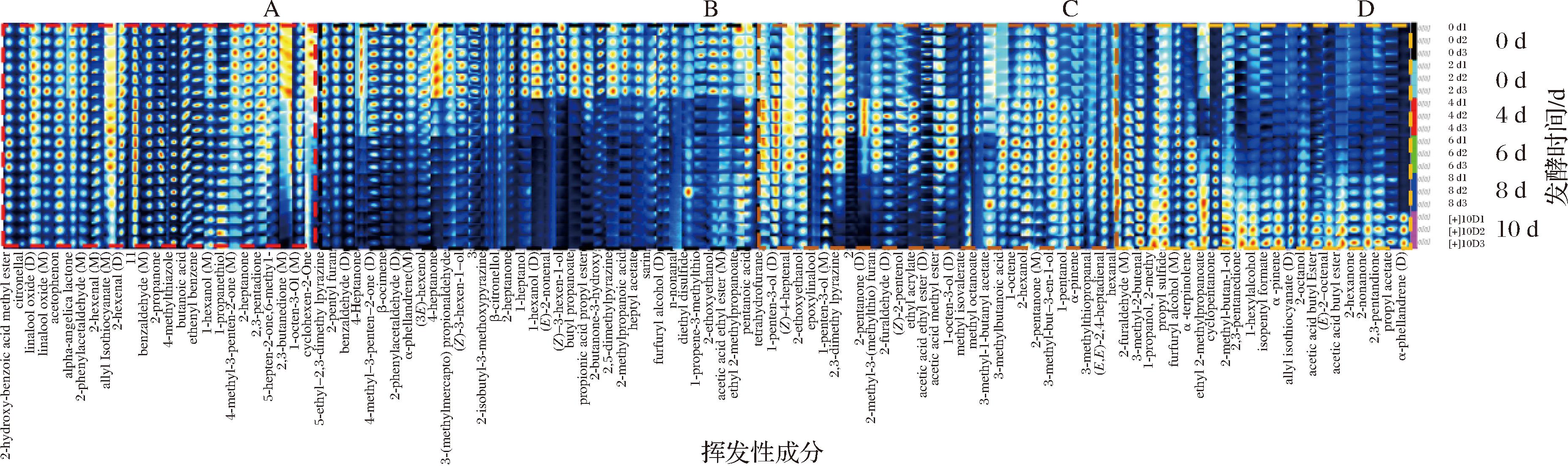
图4 不同发酵时间紫娟红茶香气指纹图谱
Fig.4 Aroma fingerprint spectra of Zijuan black tea at different fermentation times
注:2-hydroxy-benzoic acid methyl ester, 水杨酸甲酯;citronellal,香茅醛;linalool oxide(D),芳樟醇氧化物(D);linalool oxide(M),芳樟醇氧化物(M); acetophenon, 苯乙酮;alpha-angelica lactone,当归内酯;2-phenylacetaldehyde(M), 2-乙酰基苯甲醛(M);2-hexenal(M), 2-己烯醛(M); allyl isothiocyanate(M), 异硫氰酸烯丙酯(M);2-hexenal(D), 2-己烯醛(D);undefined compound未定性化合物;benzaldehyde(M),苯甲醛(M); 2-propanone, 2-丙酮;4-methylthiazole, 4-甲基噻唑;butanoic acid,丁酸; ethenyl benzene, 苯乙烯;1-hexanol(M), 正己醇(M);1-propanethiol, 丙硫醇;4-methyl-3-penten-2-one(M), 异丙叉丙酮(M);2-heptanone, 2-庚酮;2,3-pentadione, 2,3-戊二酮;5-hepten-2-one,6-methy,1-甲基庚烯酮; 2,3-butanedione(M),2,3-丁二酮(M);1-octen-3-ol(M), 1-辛烯-3-醇(M);cyclohexen-2-one, 环己烯-2-酮;5-ethyl-2,3-dimethylpyrazine, 2,3-二甲基-5-乙基吡嗪;2-pentyl furan, 2-戊基呋喃;benzaldehyde(D), 苯甲醛(D);4-heptanone, 二丙基甲酮;4-methyl-3-penten-2-one(D), 异丙叉丙酮(D);β-ocimene, β-罗勒烯;2-phenylacetaldehyde(D), 2-乙酰基苯甲醛(D);α-phellandrene(M), α-水芹烯(M);(3E)-hexenol(3E), 己烯醇;4-heptanone, 二丙基甲酮;3-(methylmercapto)propionaldehyde, 3-(甲硫基)丙醛;(Z)-3-hexen-1-ol, 顺-3-己烯-1-醇-D2; 2-isobutyl-3-methoxypyrazine, 2-异丁基-3-甲氧基吡嗪;β-citronellol, β-香茅醇;2-heptanone, 2-庚酮;1-heptanol, 正庚醇;1-hexanol(D), 正己醇(D); (E)-2-nonenal, 反-2-壬醛;(Z)-3-hexen-1-ol, 顺-3-己烯-1-醇-D2;butyl propanoate, 丙酸丁酯;propionic acid propyl ester, 丙酸丙酯; 2-butanone-3-hydroxy, 2-丁酮-3-羟基;2,5-dimethylpyrazine, 2,5-二甲基吡嗪;2-methylpropanoic acid, 异丁酸;heptyl acetate, 乙酸庚酯; sarin, 甲氟膦酸异丙酯;furfuryl alcohol(D), 糠醇(D);n-nonanal, 正壬醛;diethyl disulfide, 二乙基二硫;1-propene-3-methylthio, 1-丙烯-3-甲硫基; 2-ethoxyethanol, 乙二醇乙醚;acetic acid ethyl ester(M),乙酸乙酯(M);ethyl 2-methylpropanoate, 2-甲基丙酸乙酯;pentanoic acid, 正戊酸; tetrahydrofurane, 四氢呋喃;1-penten-3-ol(D),1-戊烯-3-醇(D);(Z)-4-heptenal, 顺-4-庚二醛;2-ethoxyethanol, 乙二醇乙醚;epoxylinalool, 氧化芳樟醇;1-penten-3-ol(M),1-戊烯-3-醇(M);2,3-dimethylpyrazine, 2,3-二甲基吡嗪;2-pentanone(D), 2-戊酮(D);2-methyl-3-(methylthio)furan, 2-甲基-3-甲硫基呋喃;2-furaldehyde(D), 糠醛-D4(D);(Z)-2-Pentenol, 顺-2-戊烯-1-醇;ethyl acrylate, 丙烯酸乙酯;acetic acid ethyl ester(D), 乙酸乙酯(D);acetic acid methyl ester,乙酸甲酯;1-octen-3-ol(D), 1-辛烯-3-醇(D);methyl isovalerate, 异戊酸甲酯;methyl octanoate, 辛酸甲酯; 3-methyl-1-butanyl acetate,3-甲基-1-丁酰基乙酸酯;3-methylbutanoic acid, 异戊酸;1-octene, 1-辛烯;2-hexanol, 2-己醇;2-pentanone(M), 2-戊酮(M);3-methyl-but-3-en-1-ol, 3-甲基-3-丁烯-1-醇;1-pentanol, 1-戊醇;α-pinene, α-蒎烯;3-methylthiopropanal, 3-甲硫基丙醛; (E,E)-2,4-heptadienal, (反,反)-2,4-庚二烯醛;Hexanal, 正己醛;2-furaldehyde(M), 糠醛-D4(M);3-methyl-2-butenal, 异戊烯醛;1-propanol, 2-methy, 1-异丁醇;propyl sulfide, 二丙基硫醚;furfuryl alcohol(M), 糠醇(M);α-terpinolene, α-萜品烯;ethyl 2-methylpropanoate,2-甲基丙酸乙酯; cyclopentanone, 环戊酮;2-methyl-butan-1-ol, 2-甲基丁醇;2,3-pentanedione, 2,3-戊二酮;1-hexylalcohol, 1-羟基己烷;isopentyl formate, 甲酸异戊酯;α-pinene, α-蒎烯;allyl isothiocyanate(D), 异硫氰酸烯丙酯(D);2-octanol, 仲辛醇;acetic acid butyl ester,乙酸丁酯;(E)-2-octenal, 反-2-辛烯醛;acetic acid butyl ester, 乙酸丁酯;2-hexanone, 2-己酮;2-nonanone, 2-壬酮;2,3-pentandione, 2, 3-戊二酮;propyl acetate, 醋酸丙酯;α-phellandrene(D), α-水芹烯(D)。
2.4 “金花菌”发酵紫娟红茶过程中挥发性成分主成分分析
主成分分析是一种使用最广泛的数据降维算法之一,将原有复杂信息简化成少量综合性指标,进而在原始变量中阐明变量之间元素的突出关系[28]。如图5所示,PC1和PC2贡献值分别为57%和29%,解释累积贡献值为86%,图中不同发酵天数的挥发性成分具有明显的区别,大致可以分为发酵前中后3个阶段,发酵2 d与发酵4 d、发酵6 d 2组距离较远,属于发酵前期。发酵4 d与发酵6 d作为挥发性成分发生变化最剧烈的阶段,属于发酵中期。在此之后,发酵8 d与发酵10 d 2组距离较近,挥发性成分变化趋于稳定,属于发酵后期。图中的累积贡献率包含了紫娟红茶样本中的大部分信息,较好地反映出不同发酵时期成分的差异,证明发酵前后紫娟红茶挥发性成分有明显区别,特别是发酵0 d组与8、10 d之间差异显著,可以表明“金花”菌发酵极大程度地影响了紫娟红茶的品质。
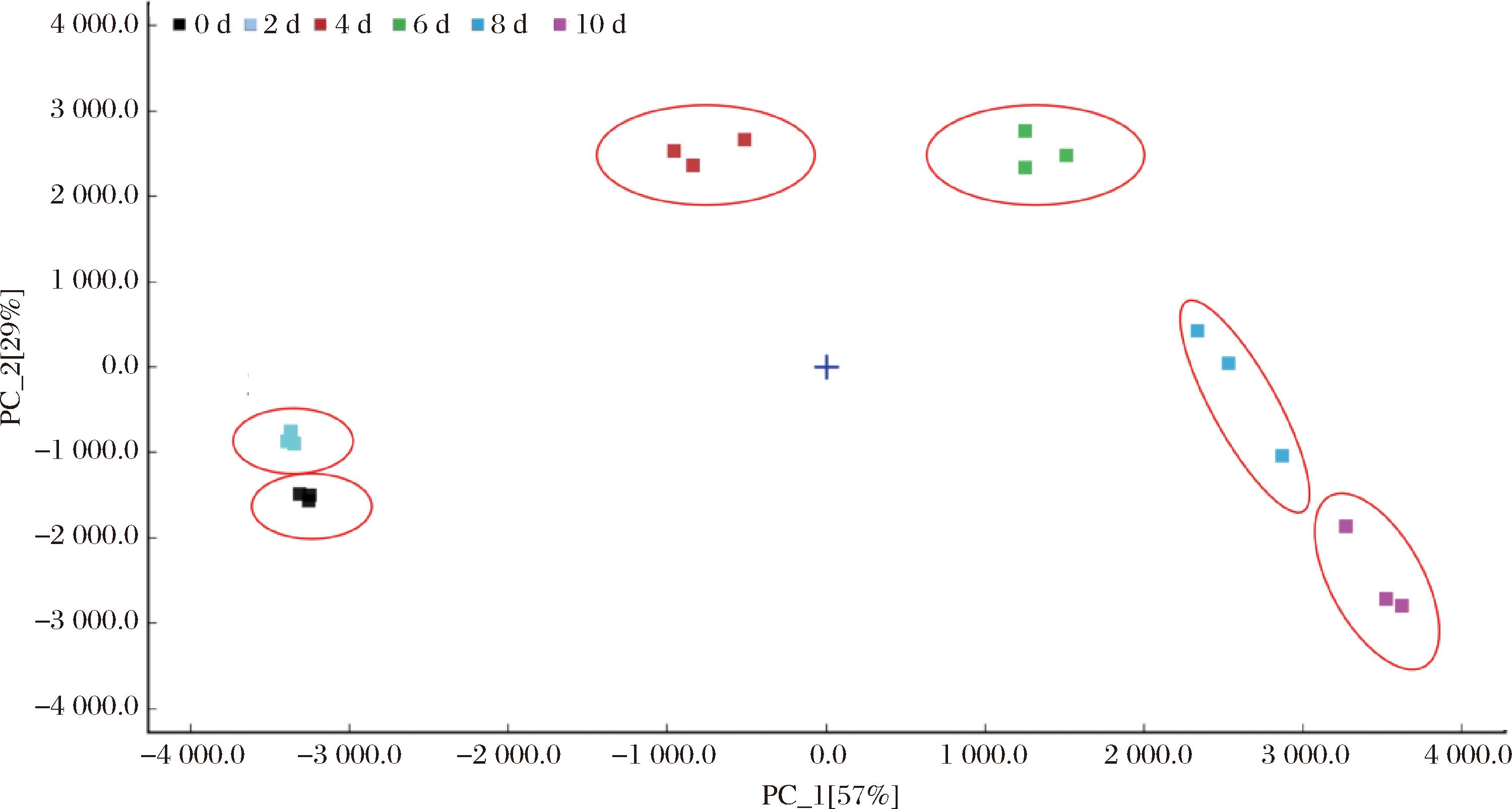
图5 紫娟红茶发酵前后挥发性物质PCA图
Fig.5 PCA diagrams of volatile compoents in Zijuan black tea before and after fermentation
2.5 紫娟红茶发酵过程中多酚类物质变化
2.5.1 茶多酚含量的变化
茶多酚是茶叶中多元酚的混合物,是茶叶的主要代表物质,同时也是茶叶中涩味的主要来源之一[29],茶多酚含量的增减对茶叶醇和滋味与茶汤色泽有着重要影响。由图6可知,在发酵过程中茶多酚含量总体呈下降趋势,与发酵0 d组相比,含量下降最多的是10 d 组,下降了3.81%。这种变化主要是因为谢瓦曲霉在生长代谢过程中分泌出大量多酚氧化酶、过氧化物酶等胞外酶将茶多酚转化为茶色素等呈色物质;同时,在发酵过程中,由于高湿、高温的作用下,茶多酚发生非酶促反应、自动水解等反应,也会导致茶多酚含量的下降。随着谢瓦曲霉发酵程度的加深,紫娟红茶茶多酚含量出现了显著的降低,这也使得茶汤滋味逐渐醇和甘厚。
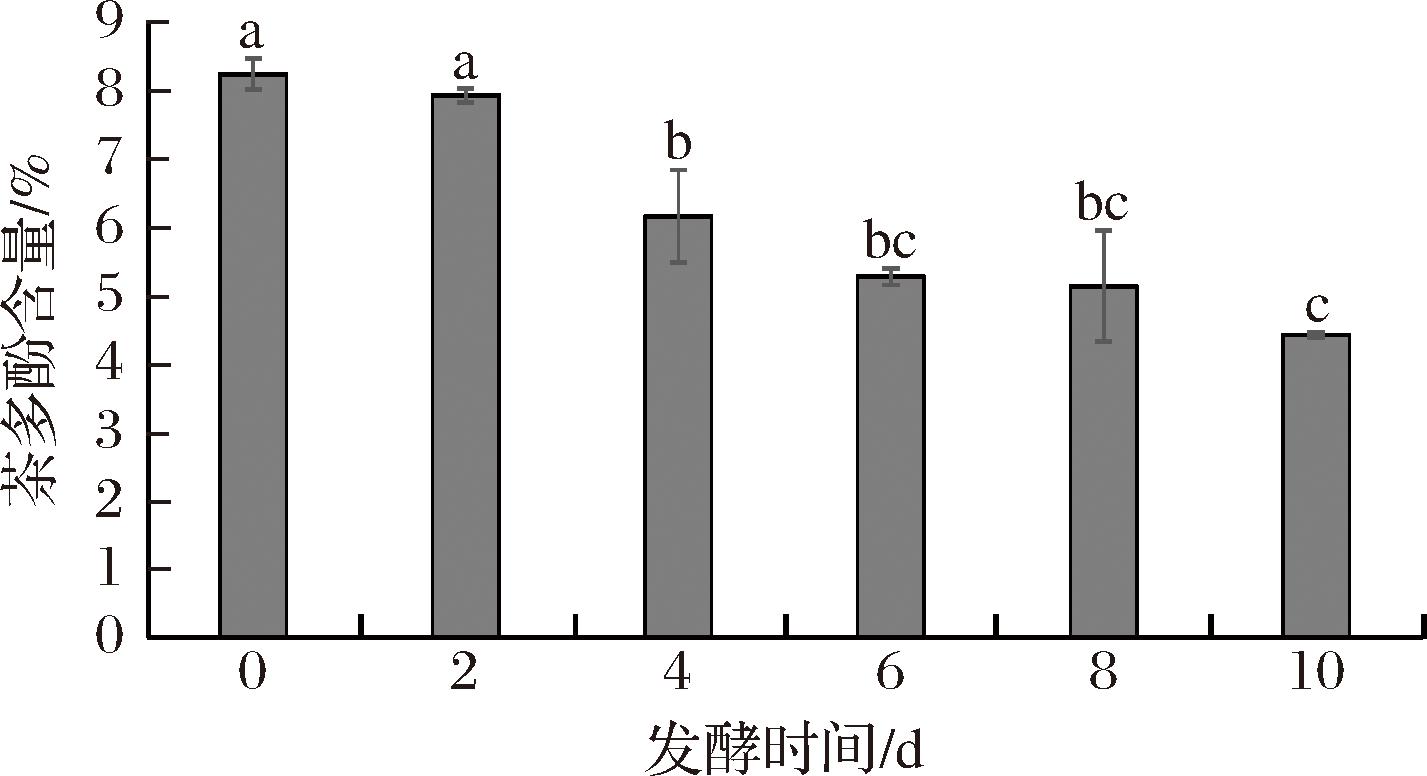
图6 紫娟红茶发酵过程中茶多酚含量的变化
Fig.6 Changes in the content of tea polyphenols during the fermentation process of Zijuan black tea
2.5.2 儿茶素含量的变化
儿茶素又称茶单宁,是茶叶中的主要功能成分,占茶叶干质量的12%~24%,同时也是茶叶苦涩滋味主要来源之一[30]。利用液相色谱法对紫娟红茶发酵过程中的儿茶素单体含量进行测定。如表1所示,各组分儿茶素含量均出现了不同程度的下降,7种儿茶素单体在发酵过程中C、ECG、GCG、EGCG含量均下降显著,降幅分别为27.01%、43.11%、40.91%及74.17%;其中EGCG下降最为明显,儿茶素中C在发酵过程中变化幅度最小。儿茶素与酯型儿茶素比值是影响茶汤滋味品质是否醇和苦涩的重要指标之一,由于发酵过程中,微生物强烈的代谢反应,同时在湿热作用的影响下,导致儿茶素发生氧化和异构化转化等化学反应,从而使大量酯型儿茶素降解为简单儿茶素[31],发酵10 d非酯型儿茶素与酯型儿茶素比值增大了42.2%,两者比值的增大表明发酵茶滋味醇和,苦涩味减轻。
2.5.3 总花青素含量的变化
花青素是一类广泛存在于植物中的水溶性天然色素,属生物类黄酮化合物,同时也是紫娟红茶苦涩味的来源之一[32]。紫娟红茶则富含花青素,具有很强的抗氧化活性和显著的降血压功效[33],但高花青素含量同样影响着紫娟红茶汤色的品质。由图7可知,在发酵过程中紫娟红茶花青素含量呈现先下降后升高的趋势,从发酵4 d到发酵10 d,花青素含量显著升高,出现这种现象主要是因为谢瓦曲霉在生长繁殖过程中分泌的多种胞外酶作用于茶叶细胞壁,改变了其通透性,有利于键合态黄酮类化合物的释放[34]。花青素在微生物胞外酶的影响下发生部分降解[35],总体增加,这也有助于保持紫娟红茶本身的特点。
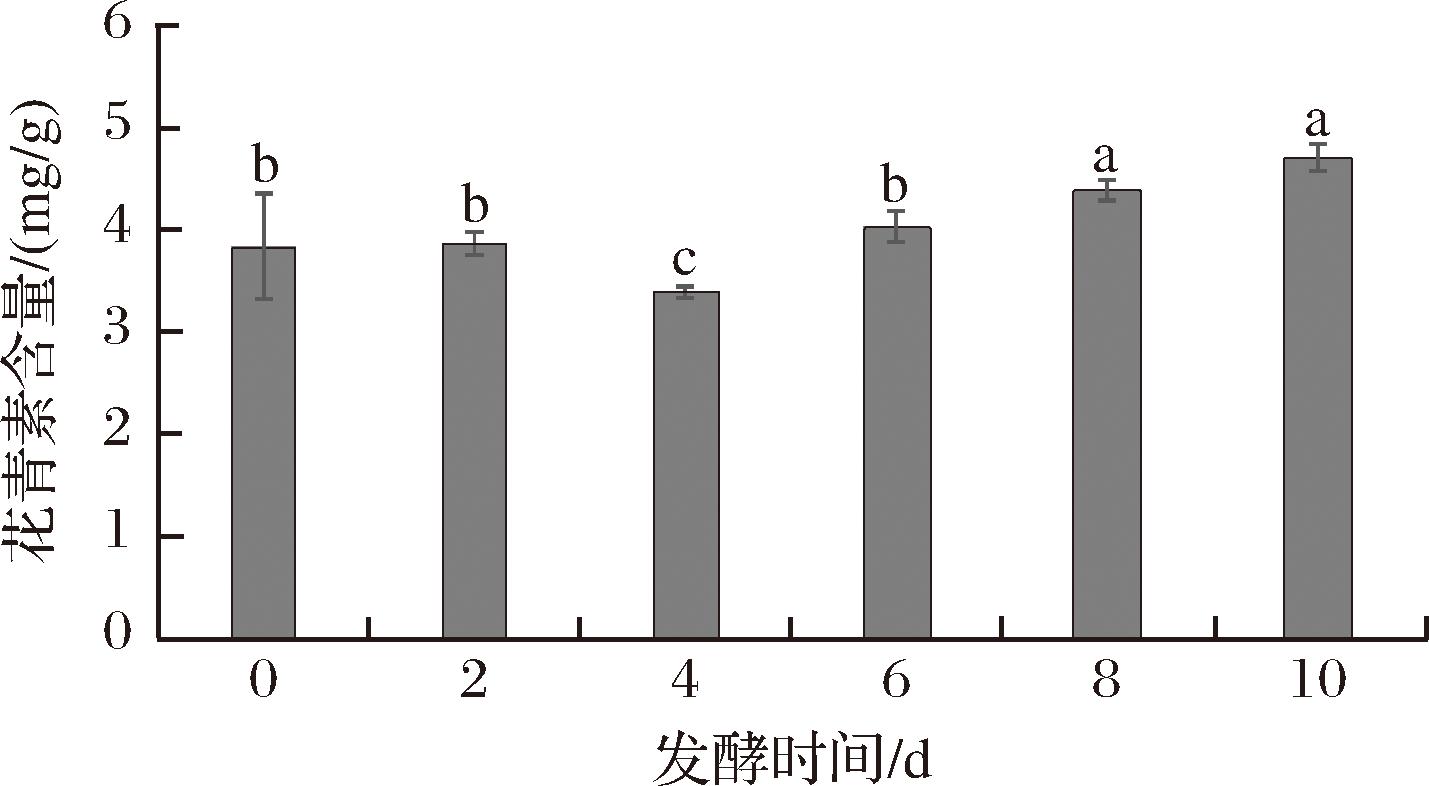
图7 紫娟红茶发酵过程中总花青素含量的变化
Fig.7 Changes in total anthocyanin content during the fermentation of Zijuan black tea
2.5.4 总黄酮含量的变化
黄酮类化合物具有柔和的涩感,是茶叶品质的一个重要影响因子[36],也是茶叶滋味的贡献物之一,具有良好的清除自由基能力,是一种具有良好抗氧化活性的多酚物质[37],紫娟红茶发酵过程中总黄酮含量的变化如图8所示。紫娟红茶经发酵后,茶叶总黄酮含量总体呈上升趋势,与0 d组相比,发酵2 d组总黄酮含量降低最多,降低了0.20 mg/g。发酵2 d以上,总黄酮含量呈现上升趋势,与发酵2 d组相比,发酵4、6、8、10 d组均显著增加,其中发酵10 d组总黄酮含量增加得最多,达0.788 mg/g。与0 d相比,发酵2 d组总黄酮含量降低的原因一方面可能是汽蒸工艺使黄酮类物质在高温、高压的作用下发生降解;另一方面,紫娟红茶在发酵过程中,谢瓦曲霉分泌多酚氧化酶、过氧化氢酶等蛋白酶,从而导致黄酮类化合物出现降解。发酵4~10 d组总黄酮含量出现明显上升的原因可能是谢瓦曲霉生长过程中分泌的胞外酶作用于紫娟红茶细胞壁,增加了细胞壁的通透性,降低了对黄酮类物质溶出的滞碍作用,从而导致总黄酮含量显著增加[38],促进活性功能的提高。
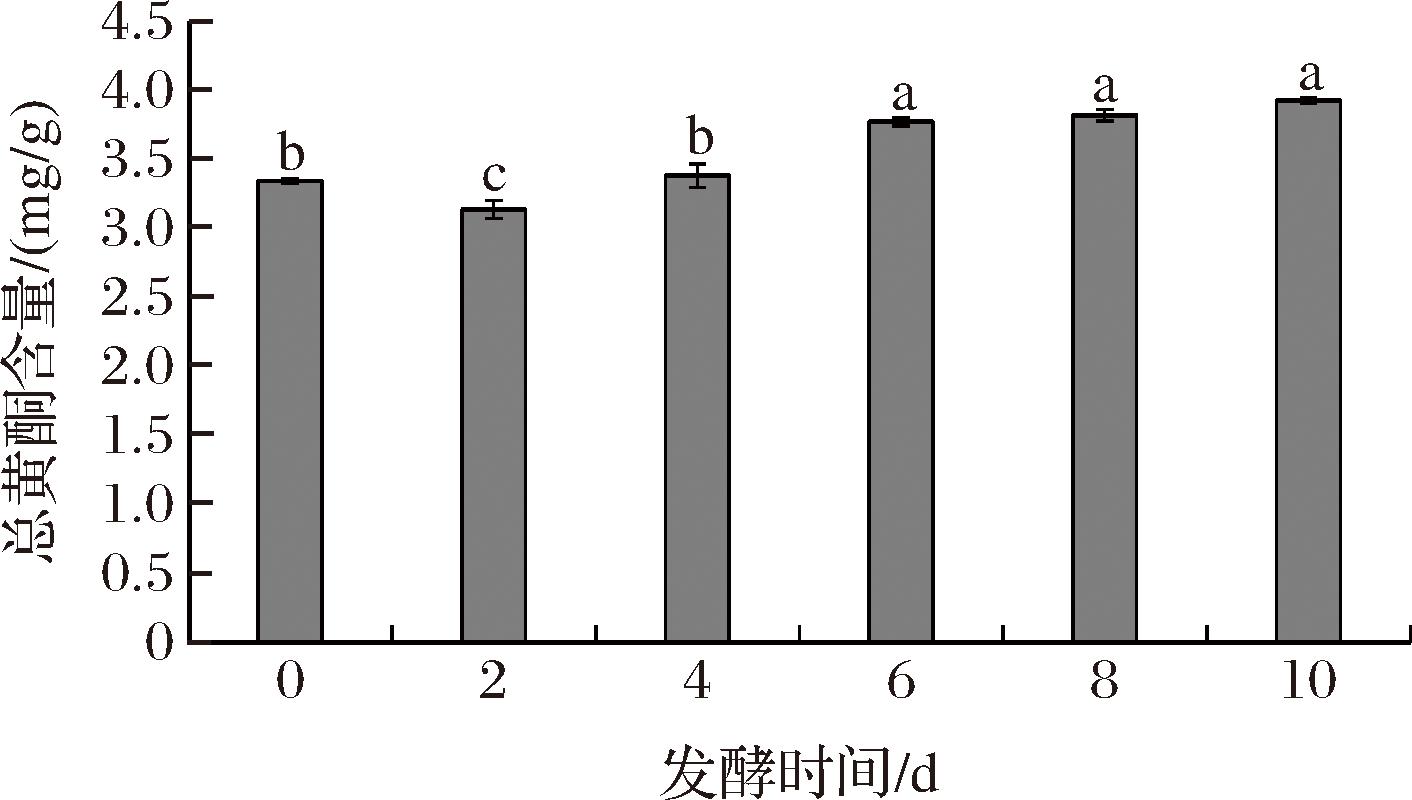
图8 紫娟红茶发酵过程中总黄酮含量的变化
Fig.8 Changes in the total flavonoid content during the fermentation process of Zijuan black tea
2.6 紫娟红茶发酵过程中多酚类物质聚类分析
在面对较多数据时,单因素分析往往不能满足综合评价需求,这时就要考虑多因素分类分析[39],聚类分析是将研究对象按照品质特性相似程度聚合在一起,并按照综合性多品种聚合,完成分析过程[40]。采用Origin软件对发酵过程中紫娟红茶主要多酚类物质进行系统聚类分析[41],如图9所示。发酵过程中用10种多酚类物质含量作为聚类变量样品可分为两大类,发酵0、2、4 d分为第一类,多酚含量较高,酚类物质较为丰富;发酵6、8、10 d为第二类,总酚含量略低,酚类物质主要由黄酮和花青素提供。多酚类物质随着发酵程度的加深,被金花菌代谢消耗转化,由儿茶素类转变为花青素类与黄酮类,改善了紫娟红茶苦涩感。从物质变化来看,主要分为三类,在发酵过程中总黄酮、花青素聚为一类,在发酵过程中总体呈现增加趋势;儿茶素中的EGC、EC聚为一类,发酵先增加后减少;GC、GCG、ECG、C、EGCG、茶多酚聚为一类,在发酵过程中呈现减少趋势。紫娟红茶发酵过程中多酚类物质的变化与金花菌发酵过程中生长特性相吻合,在发酵第6~10天达到菌群生长对数期,菌的代谢活动激增,分泌大量多酚氧化酶以及过氧化物酶等胞外酶,将多数茶多酚物质分解消耗[42]。另外,在紫娟红茶发酵过程中发生的非酶促反应以及其自身的氧化反应,使得茶多酚总量下降。其中儿茶素类物质的下降主要是因为“金花”菌增殖分化及在水热的综合作用下,引起的儿茶素氧化、降解和转化[43]。通过聚类热图分析,可以直观地看出紫娟红茶发酵过程中的多酚类物质的变化规律及变化特点,多酚类物质的总体减少也使得紫娟红茶滋味收敛苦涩,滋味醇和。
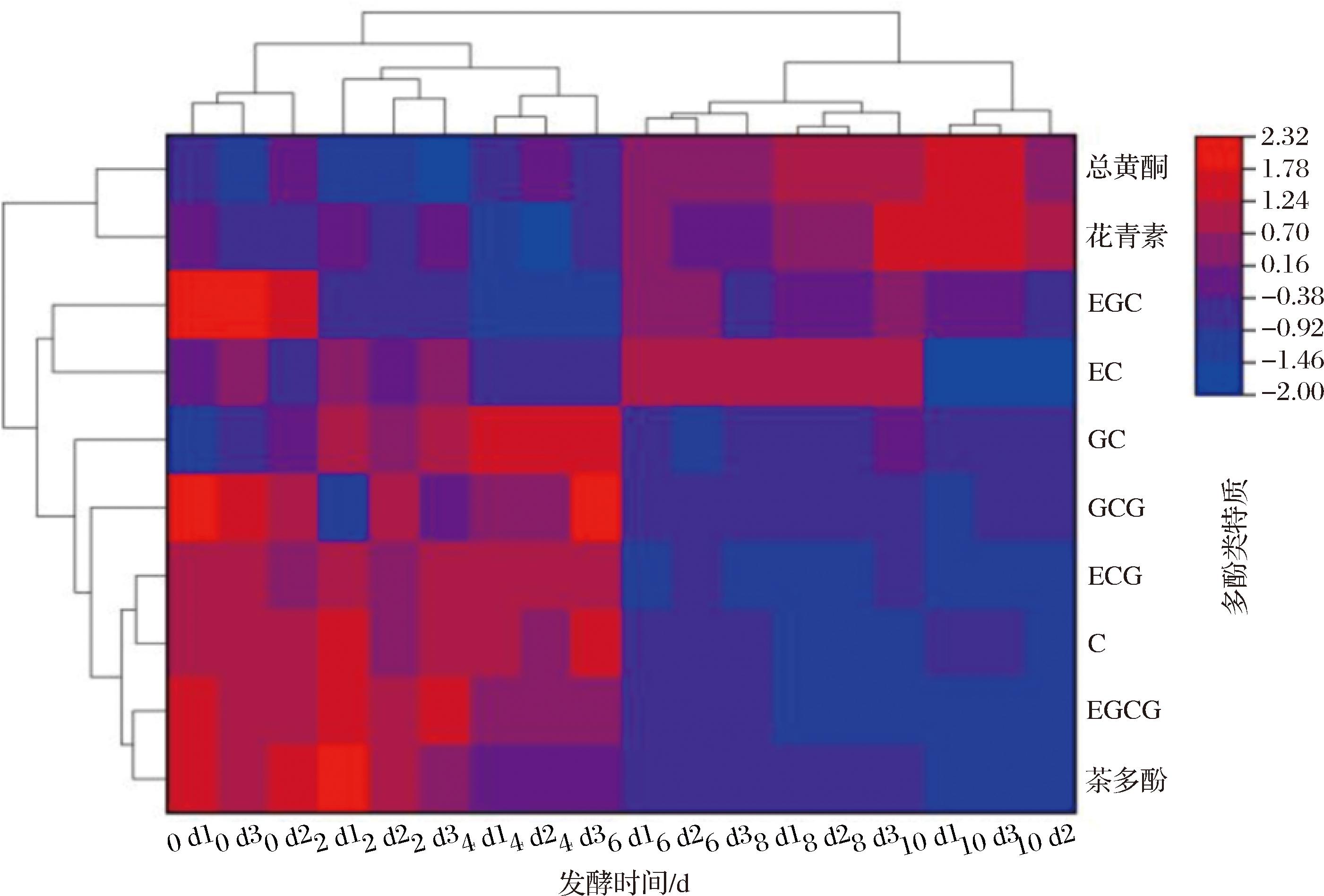
图9 紫娟红茶发酵前后多酚类物质聚类分析热图
Fig.9 Hierarchical clustering heatmap of polyphenolic compounds in Zijuan black tea before and after fermentation
3 讨论与结论
3.1 挥发性成分的变化规律
本研究通过GC-IMS技术对紫娟红茶发酵过程中的挥发性成分进行了系统分析,共检测出112种,定性100种,主要包括醇类、酯类、醛类和酮类物质。随着发酵时间的延长,挥发性物质的组成发生了显著变化。二丙基甲酮、(E)-2-辛烯醛等物质相对含量逐渐降低,醋酸丙酯、α-水芹烯(D)等陆续生成,紫娟红茶茶叶青草气降低,菌花香逐渐浓郁。与茯砖茶发酵过程中的挥发性成分变化相比,紫娟红茶的挥发性成分变化更为复杂。茯砖茶发酵过程中,醇类和酯类物质的增加主要赋予茶叶木香和花香[5],而紫娟红茶在发酵过程中不仅出现了类似的香气变化,还伴随着青草气味的减少和菌花香气的增加。这一现象可能与“金花”菌在紫娟红茶发酵过程中分泌的胞外酶种类和活性有关[4]。
3.2 多酚类物质的变化及其对茶叶品质的影响
发酵过程中,紫娟红茶的多酚类物质发生了显著变化。茶多酚和儿茶素单体含量显著下降,尤其是EGCG的降幅达到74.17%。但紫娟红茶中的花青素含量在发酵后期显著增加,这与茯砖茶中花青素的降解趋势不同[6]。花青素的增加可能与“金花”菌分泌的胞外酶对茶叶细胞壁的破坏有关,导致键合态黄酮类化合物的释放[34]。此外,总黄酮含量在发酵过程中总体呈上升趋势,这与茯砖茶发酵过程中黄酮类物质的变化趋势相似[38]。黄酮类物质的增加不仅有助于改善茶汤的滋味,还增强了茶叶的抗氧化活性[32]。因此,紫娟红茶在发酵过程中多酚类物质的变化不仅改善了茶叶的苦涩味,还保留了其独特的保健功能。
3.3 发酵过程中挥发性成分与多酚类物质的相互作用
通过主成分分析和聚类分析,本研究进一步揭示了紫娟红茶发酵过程中挥发性成分与多酚类物质的动态变化规律。在“金花”菌生长繁殖与代谢时,大量营养物质被消耗,同时它分泌出多酚氧化酶、果胶酶、纤维素酶、蛋白酶等大量活性胞外酶,这些酶类参与芳香物质前体和滋味物质的转化,与茯砖茶相比,紫娟红茶的发酵过程表现出更为复杂的物质转化规律,这一差异可能是由于紫娟红茶中较高的花青素含量通过调控菌株胞外酶的活性,进一步影响挥发性前体物质的转化。
“金花”菌的代谢改善了紫娟红茶原本的青草气,赋予其独特的陈香与“菌花”香气[44],使得香气更具层次感;但其代谢产生的含酸、硫挥发物会导致紫娟发酵茶产生不良气味。在品质形成方面,“金花”菌借助茶叶内含物代谢以及分泌的胞外酶,促进了多酚类物质转化、聚合、降解和氧化,形成了茶汤色香味的品质特点[45]。这与茯茶发酵中,“金花”菌的活动影响了茯砖茶包括茶汤香气[46]、味道[47]、颜色[48]等在内的所有感官属性一致。
3.4 结论
“金花”菌发酵紫娟红茶过程中挥发性成分的组成发生了显著变化,茶多酚和儿茶素含量显著下降,花青素和总黄酮含量增加。这些变化不仅改善了紫娟红茶的香气和滋味,还保留了其独特的保健功能。今后的研究可以通过代谢组学技术进一步揭示“金花”菌发酵过程中关键代谢途径的变化,为紫娟红茶的发酵工艺优化提供更为深入的理论支持。
[1] 周祎炜, 燕飞, 曲东, 等. 冠突散囊菌对茶叶品质的影响及其发酵茶的功能活性研究进展[J]. 茶叶通讯, 2024, 51(1):16-22.ZHOU Y W, YAN F, QU D, et al. Research progress on the effect of Eurotium cristatum on the quality of tea and the functional activity of fermented tea[J]. Journal of Tea Communication, 2024, 51(1):16-22.
[2] XIE Z Y, BAI Y X, CHEN G J, et al. Immunomodulatory activity of polysaccharides from the Mycelium of Aspergillus cristatus, isolated from Fuzhuan brick tea, associated with the regulation of intestinal barrier function and gut microbiota[J]. Food Research International, 2022, 152:110901.
[3] 孙玉姣, 高润凝, 袁旭霜, 等. 应用冠突散囊菌人工接种发酵不同种类茶叶的研究[J]. 陕西科技大学学报, 2024, 42(2):41-52.SUN Y J, GAO R N, YUAN X S, et al. Study on the artificial inoculation and fermentation of different types of tea by Aspergillus cristatus[J]. Journal of Shaanxi University of Science &Technology, 2024, 42(2):41-52.
[4] 周祎炜, 燕飞, 曲东, 等. “金花”菌的分离鉴定及其对紫娟红茶发酵品质的影响[J]. 食品研究与开发, 2024, 45(5):44-52.ZHOU Y W, YAN F, QU D, et al. Isolation and identification of ‘Golden-Flower’ fungus and its influence on fermentation quality of Zijuan black tea[J]. Food Research and Development, 2024, 45(5):44-52.
[5] 张贻杨. 茯砖茶加工过程中非挥发性成分代谢组学研究[D].长沙: 湖南农业大学, 2019.ZHANG Y Y. Components in the processing of Fu brick tea metabolomics study of non-volatile[D]. Changsha: Hunan Agricultural University, 2019.
[6] 宋林瑶, 徐辉, 吴思瑶, 等. “散茶发花”发酵贵州绿茶的工艺优化及其特征挥发性化合物解析[J]. 食品工业科技,2025, 46(1):33-44.SONG L Y, XU H, WU S Y, et al. Optimization of the ‘Loose Tea Blooming’ process for Guizhou green tea and analysis of characteristic volatile compounds[J]. Science and Technology of Food Industry, 2025, 46(1):33-44.
[7] 李学震, 孙庆泽, 刘光鹏, 等. 基于HS-GC-IMS技术分析桑叶发酵过程中挥发性物质的差异[J]. 中国果菜, 2024, 44(1):10-14.LI X Z, SUN Q Z, LIU G P, et al. Differences of volatile substances in folium Mori during fermentation based on HS-GC-IMS technology[J]. China Fruit &Vegetable, 2024, 44(1):10-14.
[8] WANG Y P, TAN Y M, WANG Y C, et al. Role of AcndtA in cleistothecium formation, osmotic stress response, pigmentation and carbon metabolism of Aspergillus cristatus[J]. Fungal Biology, 2021, 125(10):749-763.
[9] 杨兴荣, 包云秀, 黄玫. 云南稀有茶树品种“紫娟” 的植物学特性和品质特征[J]. 茶叶, 2009, 35(1):17-18; 54.YANG X R, BAO Y X, HUANG M. The botanical and quality characteristics of the tea cultivar “Zi-Juan” in Yunnan province[J]. Journal of Tea, 2009, 35(1):17-18; 54.
[10] 时鸿迪, 王邦政, 李乾, 等. 不同加工工艺下‘紫娟’茶品质的比较[J]. 中国农学通报, 2020, 36(34):142-147. SHI H D, WANG B Z, LI Q, et al. The quality of ‘Zijuan’ tea under different processing techniques: A comparative analysis[J]. Chinese Agricultural Science Bulletin, 2020, 36(34):142-147.
[11] 李沅达, 吴婷, 黄刚骅, 等. SPME-GC-MS技术结合ROAV分析不同加工工艺紫娟白茶的关键香气物质[J]. 食品工业科技, 2023, 44(9):324-332.LI Y D,WU T,HUANG G H, et al. SPME-GC-MS technique combined with ROAV for the analysis of key aroma substances of zijuan white tea with different processing processes[J]. Science and Technology of Food Industry, 2023, 44(9):324-332.
[12] 苏丹, 黄刚骅, 李亚莉, 等. 紫娟(熟茶)人工发酵过程中挥发性香气组分特征分析[J]. 食品科学, 2021, 42(12):166-172.SU D, HUANG G H, LI Y L, et al. Characteristic aroma components in ripe Zijuan tea during artificial fermentation[J]. Food Science, 2021, 42(12):166-172.
[13] ZOU C, LI R Y, CHEN J X, et al. Zijuan tea-based kombucha: Physicochemical, sensorial, and antioxidant profile[J]. Food Chemistry, 2021, 363:130322.
[14] YU H X, XU X R, ZHAO S, et al. Effect of Zijuan tea (Camellia sinensis var. assamica cv. Zijuan) on starch digestion properties of bread and its mechanisms[J]. International Journal of Food Science &Technology, 2024, 59(5):2983-2997.
[15] 杨高中, 施江, 张悦, 等. 厌氧处理条件下紫娟茶化学成分的变化及其对体外ACE活性的影响[J]. 茶叶科学, 2023, 43(4):553-566.YANG G Z, SHI Z, ZHANG Y, et al. Changes in chemical composition of Zijuan tea under anaerobic treatment conditions and their effects on in vitro ACE activity[J]. Journal of Tea Science, 2023, 43(4):553-566.
[16] CHEN Y J, YANG J, MENG Q, et al. Non-volatile metabolites profiling analysis reveals the tea flavor of “Zijuan” in different tea plantations[J]. Food Chemistry, 2023, 412:135534.
[17] BOUARAB CHIBANE L, DEGRAEVE P, FERHOUT H, et al. Plant antimicrobial polyphenols as potential natural food preservatives[J]. Journal of the Science of Food and Agriculture, 2019, 99(4):1457-1474.
[18] PICCOLELLA S, CRESCENTE G, CANDELA L, et al. Nutraceutical polyphenols: New analytical challenges and opportunities[J]. Journal of Pharmaceutical and Biomedical Analysis, 2019, 175:112774.
[19] XU S, ZHOU Y F, YU L J, et al. Protective effect of Eurotium cristatum fermented loose dark tea and Eurotium cristatum particle on MAPK and PXR/AhR signaling pathways induced by electronic cigarette exposure in mice[J]. Nutrients, 2022, 14(14):2843.
[20] 敬思群, 吴飞虎, 程金生, 等. GC-IMS技术与HS-SPME/GC-MS技术分析3种茶叶风味成分[J]. 食品研究与开发, 2022, 43(8):167-176.JING S Q, WU F H, CHENG J S, et al. Detection of flavor components in three tea products by GC-IMS combined with HS-SPME/GC-MS[J]. Food Research and Development, 2022, 43(8):167-176.
[21] 刘长姣, 郑霞, 熊湘炜, 等. 分光光度法测定黑米花青素方法的建立[J]. 粮食与油脂, 2019, 32(1):73-77.LIU C J, ZHENG X, XIONG X W, et al. Detection of anthocyanin in black rice by spectrophotometry[J]. Cereals &Oils, 2019, 32(1):73-77.
[22] 张波. 冠突散囊菌固态发酵对葛根黄酮组分及抗氧化活性的影响[D]. 南京: 南京农业大学, 2017.ZHANG B. Effects of solid-state fermentation with Eurotium Cristatum on flavonoids constituents and antioxidant activities of kudzu root (Pueraria lobata)[D]. Nanjing: Nanjing Agricultural University, 2017.
[23] HE W, REN F, WANG Y Q, et al. Application of GC-IMS in detection of food flavor substances[J]. IOP Conference Series: Earth and Environmental Science, 2020, 545(1):012030.
[24] CAVANNA D, ZANARDI S, DALL’ASTA C, et al. Ion mobility spectrometry coupled to gas chromatography: A rapid tool to assess eggs freshness[J]. Food Chemistry, 2019, 271:691-696.
[25] 张婧年, 李升升, 马纪兵, 等. 基于GC-IMS的牦牛部位肉特征风味物质分析[J]. 食品工业科技, 2025, 46(2):258-270.ZHANG J N, LI S S, MA J B, et al. Analysis of characteristic flavor substances of Yak Part meat based on GC-IMS[J]. Science and Technology of Food Industry, 2025, 46(2):258-270.
[26] 罗静, 赵红宇, 徐炜桢, 等. 郫县豆瓣后发酵过程中挥发性呈香物质测定及主成分分析[J]. 食品科学, 2018, 39(18):209-216. LUO J, ZHAO H Y, XU W Z, et al. Analysis of volatile compounds in Pixian soybean paste during post-fermentation by SPME-GC-MS combined with PCA[J]. Food Science, 2018, 39(18):209-216.
[27] 王兆明, 马云昊, 浦馨源, 等. 基于GC-IMS的符离集烧鸡挥发性物质指纹图谱分析[J]. 中国食品学报, 2022, 22(11):343-354.WANG Z M, MA Y H, PU X Y, et al. The fingerprint analysis of violate flavor compounds in fuliji-braised chicken by gas chromatography-ion mobility spectroscopy[J]. Journal of Chinese Institute of Food Science and Technology, 2022, 22(11):343-354.
[28] WU Z B, CHEN L Z, WU L M, et al. Classification of Chinese honeys according to their floral origins using elemental and stable isotopic compositions[J]. Journal of Agricultural and Food Chemistry, 2015, 63(22):5388-5394.
[29] 刘武嫦, 仇云龙, 黄建安, 等. 冠突散囊菌对发花黑毛茶品质呈味成分的影响[J]. 食品安全质量检测学报, 2015, 6(5):1554-1560.LIU W C, QIU Y L, HUANG J A, et al. Studies on Eurotium cristatum fungus growing affects quality tasting ingredients of primary dark tea[J]. Journal of Food Safety &Quality, 2015, 6(5):1554-1560.
[30] 陆昌琪, 毛世红, 童华荣, 等. 儿茶素及其衍生物合成研究进展[J]. 食品科学, 2018, 39(11):316-326.LU C Q, MAO S H, TONG H R, et al. Progress in the synthesis of catechin and its derivatives[J]. Food Science, 2018, 39(11):316-326.
[31] 罗密, 俞梦瑶, 禹利君, 等. 冠突散囊菌LJSC.2001对不同黑毛茶发花品质的影响[J]. 食品科学, 2023, 44(14):106-115.UO M, YU M Y, YU L J, et al. Effect of fermentation by Eurotium cristatum LJSC.2001 on the fermentation quality of raw dark tea made from different varieties[J]. Food Science, 2023, 44(14):106-115.
[32] WANG Q P, PENG C X, GAO B, et al. Influence of large molecular polymeric pigments isolated from fermented Zijuan tea on the activity of key enzymes involved in lipid metabolism in rat[J]. Experimental Gerontology, 2012, 47(9):672-679.
[33] GAO X, HO C T, LI X F, et al. Phytochemicals, anti-inflammatory, antiproliferative, and methylglyoxal trapping properties of zijuan tea[J]. Journal of Food Science, 2018, 83(2):517-524.
[34] 顾秋亚, 李姝瑶, 杨文华, 等. 富含黄酮苷元沙棘叶发酵茶的制备及其生物活性[J]. 食品研究与开发, 2022, 43(24):118-124.GU Q Y, LI S Y, YANG W H, et al. Preparation and activity of the fermented tea of seabuckthorn leaf rich in flavonoid glycosides[J]. Food Research and Development, 2022, 43(24):118-124.
[35] AN T T, CHEN M X, ZU Z Q, et al. Untargeted and targeted metabolomics reveal changes in the chemical constituents of instant dark tea during liquid-state fermentation by Eurotium cristatum[J]. Food Research International, 2021, 148:110623.
[36] GUO X Y, LYU Y Q, YE Y, et al. Polyphenol oxidase dominates the conversions of flavonol glycosides in tea leaves[J]. Food Chemistry, 2021, 339:128088.
[37] WANG C Z, MEHENDALE S R, CALWAY T, et al. Botanical flavonoids on coronary heart disease[J]. The American Journal of Chinese Medicine, 2011, 39(4):661-671.
[38] 尹家全, 刘歆旖, 王兰, 等. 冠突散囊菌发酵罗汉果渣过程中功能性成分及抗氧化活性的变化[J]. 现代食品科技, 2023, 39(4):88-95.YIN J Q, LIU X Y, WANG L, et al. Changes in functional components and antioxidant activity during the fermentation of Siraitia grosvenorii pomace by Eurotium cristatum[J]. Modern Food Science and Technology, 2023, 39(4):88-95.
[39] 公丽艳, 孟宪军, 刘乃侨, 等. 基于主成分与聚类分析的苹果加工品质评价[J]. 农业工程学报, 2014, 30(13):276-285.GONG L Y, MENG X J, LIU N Q, et al. Evaluation of apple quality based on principal component and hierarchical cluster analysis[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(13):276-285.
[40] KUANG L X, WANG Z Q, ZHANG J Y, et al. Factor analysis and cluster analysis of mineral elements contents in different blueberry cultivars[J]. Journal of Food Composition and Analysis, 2022, 109:104507.
[41] CHEN X Y, WANG Z X, LI Y Y, et al. Survey of the phenolic content and antioxidant properties of wines from five regions of China according to variety and vintage[J]. LWT, 2022, 169:114004.
[42] 李佳莲, 胡博涵, 刘素纯, 等. 微生物与茯砖茶品质形成研究进展[J]. 食品工业科技, 2010, 31(9):406-408; 413.LI J L, HU B H, LIU S C, et al. Research progress in microorganism and the formation of Fuzhuan tea quality[J]. Science and Technology of Food Industry, 2010, 31(9):406-408; 413.
[43] 赵仁亮, 胥伟, 吴丹, 等. 黑毛茶不同产区发花对茯砖茶品质的影响[J]. 食品科学, 2017, 38(21):8-14.ZHAO R L, XU W, WU D, et al. Quality evaluation of fu brick tea fermented in different regions from the same raw tea materials[J]. Food Science, 2017, 38(21):8-14.
[44] 张杏民, 陈宏宇, 王超, 等. 茯砖茶独特香气形成的物质基础及评价方法研究进展[J]. 食品科学, 2023, 44(3):296-305.ZHANG X M, CHEN H Y, WANG C, et al. Research progress on the material basis and evaluation methods for the unique aroma of Fu Brick tea[J]. Food Science, 2023, 44(3):296-305.
[45] LI Z Y, FENG C X, LUO X G, et al. Revealing the influence of microbiota on the quality of Pu-erh tea during fermentation process by shotgun metagenomic and metabolomic analysis[J]. Food Microbiology, 2018, 76:405-415.
[46] CHENG L Z, WANG Y F, ZHANG J R, et al. Integration of non-targeted metabolomics and E-tongue evaluation reveals the chemical variation and taste characteristics of five typical dark teas[J]. LWT, 2021, 150:111875.
[47] 李月, 朱俊烨, 刘子涵, 等. 基于主成分分析与聚类分析评价茯砖茶滋味品质[J]. 食品安全质量检测学报, 2023, 14(21):283-291.LI Y, ZHU J Y, LIU Z H, et al. Evaluation of taste quality of Fuzhuan tea based on principal component analysis and cluster analysis[J]. Journal of Food Safety &Quality, 2023, 14(21):283-291.
[48] XIAO Y, HE C, CHEN Y L, et al. UPLC-QQQ-MS/MS-based widely targeted metabolomic analysis reveals the effect of solid-state fermentation with Eurotium cristatum on the dynamic changes in the metabolite profile of dark tea[J]. Food Chemistry, 2022, 378:131999.