母乳是婴儿最佳的营养和能量来源,富含多种生物活性成分,对婴儿的免疫功能、肠道健康、认知发育具有重要作用[1]。然而发展中国家的母乳喂养率仅44%,其中60%的婴儿母乳喂养时间小于6个月[2]。婴儿配方奶粉成为及时补充婴儿所需营养的最佳母乳替代品。乳脂肪是母乳中重要的能量载体,在母乳中以脂肪球的形式存在,其内部为中性的甘油三酯(triglycerides, TAG),外部由磷脂、蛋白质、固醇等物质形成的3层膜包裹,即乳脂肪球膜(milk fat globule membrane, MFGM)[3]。MFGM的存在能够提升乳脂肪球的稳定性,还有助于改善消化功能、调节肠道菌群、增强免疫功能和促进大脑发育等[4-6]。
市售婴儿配方奶粉的脂肪球表面主要被酪蛋白和乳清蛋白包裹,其消化吸收特性与母乳存在极大差异,甚至存在增加婴儿肥胖的风险[7]。大豆磷脂和蛋黄卵磷脂是婴儿配方奶粉的重要磷脂来源,其添加在一定程度上缩小了与母乳之间的差距。然而膳食磷脂与母乳的关键磷脂组成(如鞘磷脂)上存在显著差异,仅添加膳食磷脂难以完全模拟母乳的脂质组成和功能[8]。因此MFGM的补充成为优化婴儿配方奶粉的重要方向。研究表明,MFGM的应用能够进一步缩小婴配粉与母乳之间的差异,并对婴儿的脂质代谢、认知发育、肠道健康和免疫功能具有诸多益处[9-11]。羊乳因其优异的脂肪酸组成、蛋白质比例和低致敏的特点成为婴儿配方奶粉的理想乳基来源[12]。然而MFGM中除脂质成分外,还富含大量MFGM蛋白,但新国标GB 10765—2021《食品安全国家标准 婴儿配方食品》中明确规定了婴配粉中主要蛋白质的来源必须与乳基一致,因此牛MFGM并不适用于羊乳基婴配粉,深入研究羊MFGM和膳食磷质、母乳MFGM的脂质组成差异具有重要意义[13-14]。
本研究以母乳MFGM为对照,采用非靶脂质组学技术系统分析羊乳MFGM及婴儿配方奶粉中常用的2种膳食磷脂原料(大豆磷脂和蛋黄卵磷脂)的磷脂和脂肪酸组成,旨在明确它们与母乳MFGM的差异,为羊乳基婴儿配方奶粉的脂质母乳化研究提供理论依据和数据支持,进一步推动婴儿配方奶粉在脂肪球界面构建和功能模拟方面的优化。
1 材料与方法
1.1 材料与试剂
成熟期母乳由黑龙江省哈尔滨市志愿者提供,乳母年龄25~30岁,身体指标均正常,采集乳样时间为上午9∶00~11∶00,母乳样品低温运至实验室,置于-80 ℃冰箱冷冻贮藏。新鲜萨能山羊乳样品采集于黑龙江省哈尔滨市当地农场,为30~60天泌乳期的成熟乳,样品运送至实验室-80 ℃冰箱中贮藏。蛋黄卵磷脂,陕西米先尔生物科技有限公司;大豆磷脂,上海添阔生物科技有限公司;氯仿(质谱纯)、甲醇(质谱纯)和正己烷(质谱纯),天津星马克科技发展有限公司;无水硫酸钠(分析纯),天津市凯通化学试剂有限公司;无水氯化钙(分析纯),天津市巴斯夫化工有限公司。
1.2 仪器与设备
TripleTOF® 5600+四极杆飞行时间串联质谱仪,美国AB SCIEX公司;7000D GC/TQ三重四极杆气质联用仪,美国Agilent Technologies公司;XZ-10 DTD超声波破碎仪,宁波新芝生物科技股份有限公司;XMTD-204恒温水浴锅,上海比朗仪器有限公司;HT175R离心机,湖南湘仪实验室仪器开发有限公司。
1.3 实验方法
1.3.1 乳脂肪球膜的提取
具体提取方法参考LU等[15]并进行适当调整。取50 g新鲜乳样置于洁净的离心管中,在4 ℃,4 000×g条件下离心20 min。取上层乳脂肪层,加等体积PBS缓冲溶液(0.1 mol/L,pH 6.8)溶解,用玻璃棒缓慢搅拌10 min。然后在4 ℃,1 500×g条件下离心10 min。弃去含有蛋白质的水相,收集上层乳脂肪层。上述离心操作重复3次。在最后一次离心结束后获得的乳脂肪层中加入等体积去离子水进行漂洗,以去除残留的PBS溶液中的盐离子。将漂洗过的样品进行1 min超声处理,然后在4 ℃,10 000×g条件下离心1 h。下层沉淀即为乳脂肪球膜样品,收集并置于-20 ℃条件下贮藏备用。
1.3.2 脂质的提取
采用Folch法进行脂肪提取并加以改动。取5 mL样品置于洁净的离心管中,加入20 mL三氯甲烷-甲醇溶液(体积比2∶1)和5 mL NaCl溶液(0.125 mol/L),并用封口膜缠紧管口,在25 ℃下超声处理10 min。超声后的样品在4 ℃,2 652×g条件下离心10 min。转移下层有机相并用氮气吹干,得到脂肪样品,收集并置于-20 ℃条件下贮藏备用。
1.3.3 脂肪酸甲酯化
甲酯化处理方式参考WANG等[16]的方法并加以修改。取30 mg脂质样品置于洁净的离心管中,加入1 mL正己烷溶解,在25 ℃条件下超声处理5 min。向超声后的样品中加入1 mL甲醇和1 mL氢氧化钠-甲醇溶液(5 mol/L),继续超声处理(25 ℃,1 min)。然后将样品用封口膜封紧,转移至60 ℃恒温水浴锅中处理30 min,期间每5分钟振荡1次。待样品冷却至室温,加入1 mL正己烷和4 mL纯水。静置片刻,取1 mL上层有机相于洁净的离心管中,加入0.5 g无水Na2SO4,在25 ℃,4 000 r/min条件下离心5 min。得到的上层溶液即为甲酯化后的脂肪酸样品。
1.3.4 脂肪酸检测
取200 μL甲酯化后的脂肪酸样品,加入4 mL正己烷(色谱级),过0.22 μm有机滤膜,置于进样瓶中待测。采用顶空吹扫捕集三重四极杆气质联用仪对样品进行脂肪酸检测。
色谱条件:Agilent DB-WAX 毛细管柱(30 m×0.25 mm ID×0.25 μm)气相色谱系统分离。以50 ℃保持3 min,以10 ℃/min的速度升高到220 ℃;维持20 min。(氦气为载气)。进样10 μL,分流比30∶1。质谱条件:进样温度280 ℃;离子源温度 230 ℃;传输线温度250 ℃。电子轰击电离源,SIM扫描方式,电子能量70 eV。
1.3.5 磷脂检测
取2 mg脂质样品,加入2 mL三氯甲烷-甲醇溶液(体积比2∶1)溶解,过0.22 μm有机滤膜,置于进样瓶中,用封口膜密封待测。采用四极杆飞行时间串联质谱检测器对样品进行磷脂检测。
色谱条件:流动相A为(V水∶V甲醇∶V乙腈=1∶1∶1)+10 mmol/L乙酸铵;流动相B为(V异丙醇∶V乙腈=1∶1)+10 mmol/L乙酸铵。以下梯度进行洗脱:0~1.0 min, 80% A;1.0~6.0 min, 80%~20% A;6.0~10.0 min, 20%~5% A;10.0~12.0 min, 5% A;12.0 min~20.0 min, 5%~80% A。流速300 μL/min,柱温35 ℃,进样2 μL。
质谱条件:采集强度最强且大于100的分子离子对应的二级质谱数据。轰击能量为35 eV,每50 ms采集15张二级谱图。设置ESI离子源参数:雾化气压为60 Pa;气帘气压为0 Pa,辅助气压为60 Pa;温度为550 ℃;喷雾电压为5 500 V。
1.3.6 代谢途径分析
将处理后的磷脂数据(P<0.05且VIP>1)导入Metabo Analyst 6.0(https://www.metaboanalyst.ca/),通过通路拓扑进行富集分析,识别出通路,并研究每个通路的影响。
1.4 数据处理
采用SPSS 23进行统计分析。数据采用Student’s t检验进行分析,P<0.05视为差异显著。图表由 Origin 9.0 绘制。乳脂肪球膜磷脂和脂肪酸以百分比表示,分别为总脂质(%)和总脂肪酸(%)。
2 结果与分析
2.1 不同样品磷脂脂肪酸组成和含量分析
图1结果表明,不同样品来源对磷脂脂肪酸的种类及相对含量具有显著影响。在所有样品中共检测到13种脂肪酸,但并非所有样品中都包含这13种脂肪酸,且同一种类脂肪酸的相对含量存在显著差异(P<0.05)。
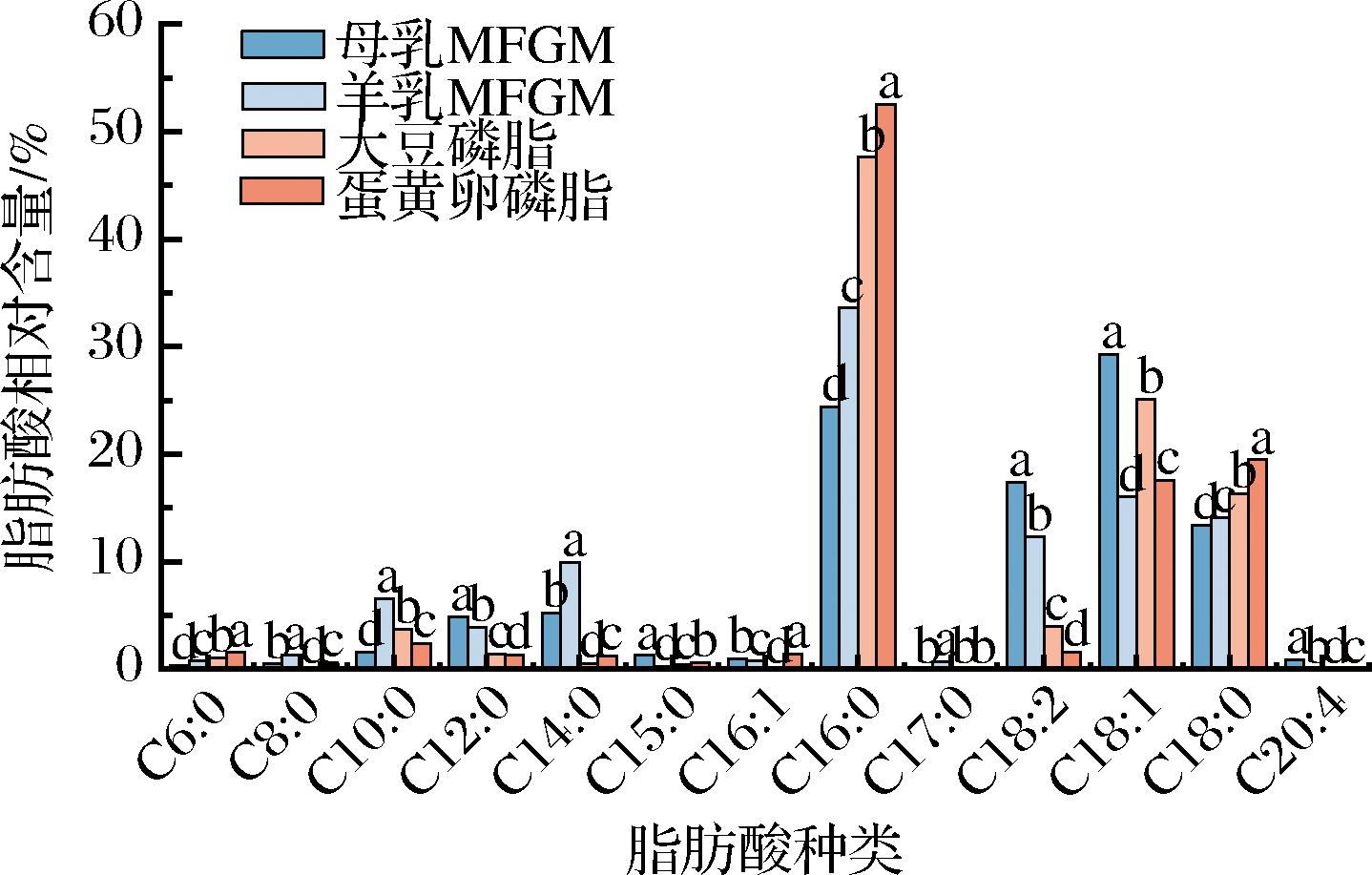
图1 脂肪酸组成及相对含量
Fig.1 Composition and content of phospholipid fatty acids
注:不同小写字母表示差异显著(P<0.05)(下同)。
在母乳MFGM中检测到12种脂肪酸,其中相对含量最丰富的饱和脂肪酸(saturated fatty acid,SFA)为棕榈酸(C16:0,24.38%),其次是硬脂酸(C18:0,13.40%)和肉豆蔻酸(C14:0,5.24%)。不饱和脂肪酸(unsaturated fatty acid,UFA)中油酸(C18:1,29.24%)的相对含量最为丰富,这与前期研究结果一致[16]。在羊乳MFGM中检测到全部的13种脂肪酸,棕榈酸(C16:0,33.57%)是相对含量最丰富的SFA,其次是硬脂酸(C18:0,14.04%)和肉豆蔻酸(C14:0,9.94%)。油酸(C18:1,16.00%)是相对含量最丰富的UFA,这一研究与之前的研究一致[15]。值得注意的是,羊乳MFGM中短链脂肪酸的相对含量要高于母乳MFGM,这与羊乳本身的脂肪酸组成特点相符[17]。大豆磷脂检测到9种脂肪酸,其中棕榈酸(C16:0,47.61%)是相对含量最高的SFA,油酸(C18:1,25.07%)是相对含量最高的UFA。与母乳MFGM相比,在大豆磷脂中未检测出辛酸(C8:0)、棕榈油酸(C16:1)、花生四烯酸(C20:4),可能与这几种脂肪酸在大豆磷脂中本身含量较低有关[18]。蛋黄卵磷脂中检测到12种脂肪酸,其中棕榈酸(C16:0,52.52%)是相对含量最高的SFA,油酸(C18:1,17.54%)是相对含量最高的UFA。
2.2 不同样品磷脂脂肪酸饱和度
如图2所示,在所有样品中,SFA相对含量从高到低依次为:蛋黄卵磷脂(79.47%)>羊乳MFGM(70.96%)≈大豆磷脂(70.97%)>母乳MFGM(51.59%)。UFA相对含量从高到低依次为:母乳MFGM(48.42%)>大豆磷脂(29.03%)≈羊乳MFGM(29.04%)>蛋黄卵磷脂(20.53%)。值得注意的是,羊乳MFGM中多不饱和脂肪酸(polyunsaturated fatty acid,PUFA)[如亚油酸(C18:2)]相对含量较高,对婴儿的神经发育和视力健康具有潜在益处[19]。母乳MFGM中SFA与UFA相对含量相近,分别为51.58%和48.42%,其中单不饱和脂肪酸(monounsaturated fatty acid,MUFA)占30.17%,PUFA占18.25%。羊乳MFGM中SFA相对含量为70.96%,UFA相对含量为29.04%,其中PUFA[如亚油酸(C18:2)]相对含量较高,对婴儿大脑和视力发育具有积极作用[19]。大豆磷脂的SFA相对含量为70.97%,UFA相对含量为29.03%,其中MUFA相对含量与母乳MFGM较为接近,可在一定程度上弥补羊乳MFGM与母乳MFGM之间的差异。蛋黄卵磷脂的SFA相对含量为79.47%,显著高于其他样品,而UFA相对含量为20.53%,其中PUFA相对含量较低。
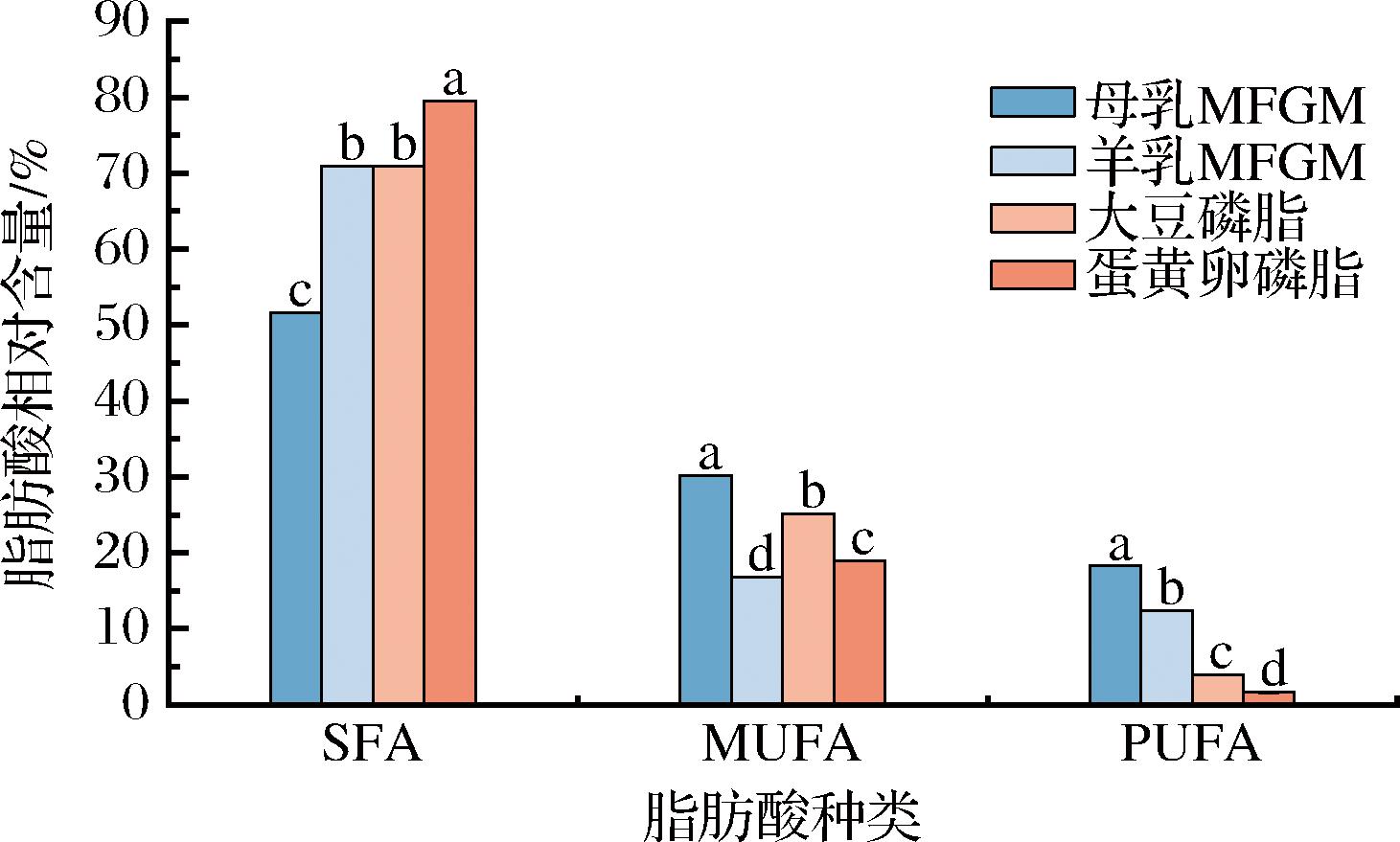
图2 不同样品脂肪酸饱和度分析
Fig.2 Fatty acid saturation analysis of different samples
由此可得出,不同样品中脂肪酸组成和相对含量存在显著差异。母乳MFGM的SFA与UFA比例较为均衡,而羊乳MFGM中短链脂肪酸和PUFA相对含量较高,可能更适合婴儿的生长发育需求。大豆磷脂的MUFA相对含量与母乳MFGM接近,可在一定程度上弥补羊乳MFGM与母乳MFGM之间的差异。
2.3 不同样品磷脂组成分析
如表1所示,对母乳MFGM、羊乳MFGM和2种膳食磷脂(大豆、蛋黄)中的磷脂成分进行系统分析鉴定,在正负离子2种模式下共有548种磷脂分子被检测到,涵盖七大类,包括34种鞘磷脂(sphingomyelin,SM)、120种磷脂酰胆碱(phosphatidylcholine,PC)、141种磷脂酰乙醇胺(phosphatidylethanolamine,PE)、103种磷脂酰甘油(phosphatidylglycerol,PG)、91种磷脂酰肌醇(phosphatidylinositol,PI)、32种磷脂酰丝氨酸(phosphatidylserine,PS)和27种神经酰胺(ceramide,Cer)。具体而言,在母乳MFGM、羊乳MFGM、大豆磷脂和蛋黄卵磷脂中分别检测到195种、204种、233种和234种磷脂分子,市售膳食磷脂(大豆磷脂和蛋黄卵磷脂)中检测到了更多种类的磷脂分子,这可能是由于工业提取方式与实验室提取方式不同,并存在一定的富集工艺,提高了部分磷脂的相对含量,使得容易被检出。进一步分析发现,母乳MFGM和羊乳MFGM中含有更多种类的SM,这与乳源MFGM的天然组成特点及其在婴儿神经发育和免疫功能中的重要作用一致。相比之下,大豆磷脂和蛋黄卵磷脂中则含有更多种类的PC和PI,这与前期结果类似,但本研究检测到的磷脂分子更丰富[18,20]。
表1 磷脂数量 单位:种
Table 1 The number of phospholipids
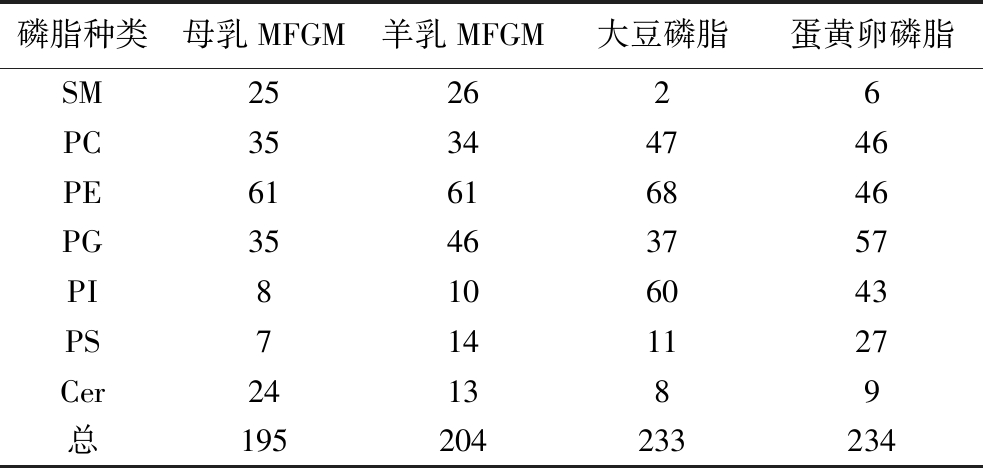
磷脂种类母乳MFGM羊乳MFGM大豆磷脂蛋黄卵磷脂SM252626PC35344746PE61616846PG35463757PI8106043PS7141127Cer241389总195204233234
2.4 不同样品磷脂种类相对含量分析
如图3所示,母乳MFGM、羊乳MFGM、大豆磷脂和蛋黄卵磷脂中磷脂种类相对含量的分布上存在显著差异。母乳MFGM和羊乳MFGM中含量较多的是SM、PC和PE。其中,母乳MFGM中相对含量最多的磷脂依次为SM(22.86%)、PE(21.51%)和PC(20.01%),而羊乳MFGM中相对含量最多的磷脂依次为SM(28.84%)、PC(23.91%)和PE(23.59%)。这一结果与其他研究学者在乳源MFGM中检测到的磷脂种类结果相近,但相关磷脂种类的相对含量存在一定差异[21]。这可能与乳样所处地理位置、采样季节、泌乳期以及检测方式不同等多种因素有关[22]。大豆磷脂和蛋黄卵磷脂中相对含量较多的磷脂种类均为PC、PE和PG。其中,PC是相对含量占比最多的磷脂种类,均超过40%。蛋黄卵磷脂中PC的相对含量(48.33%)显著高于大豆磷脂(42.62%),大豆磷脂中相对含量占比第二的是PG(23.41%),其次是PE(20.83%);而在蛋黄卵磷脂中PE的相对含量(17.75%)占比略高于PG的相对含量(13.01%)。
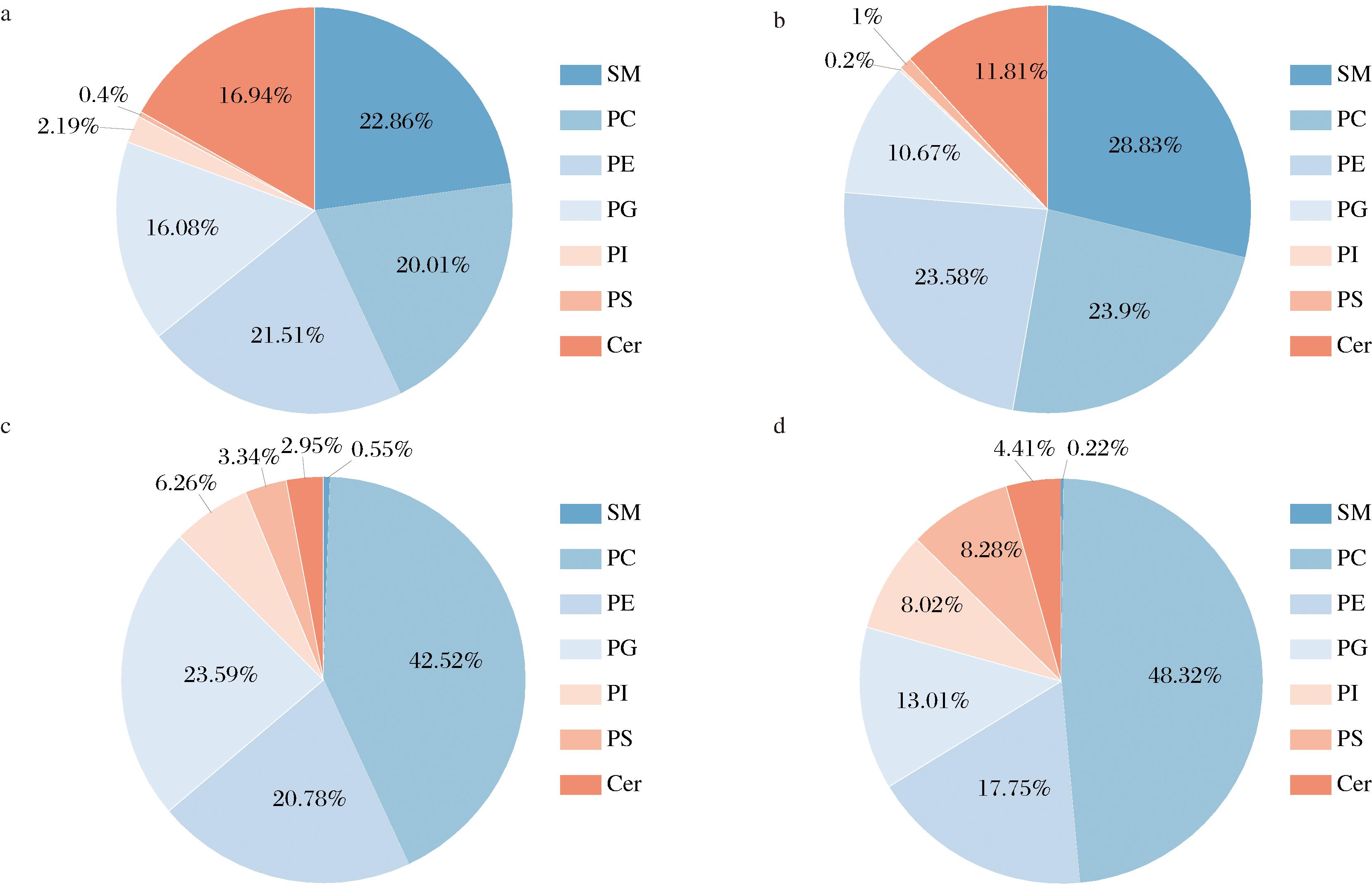
a-母乳MFGM磷脂相对含量;b-羊乳MFGM磷脂相对含量;c-大豆磷脂的磷脂相对含量;d-蛋黄卵磷脂的磷脂相对含量
图3 不同样品中各类磷脂的相对含量
Fig.3 The relative contents of various phospholipids in different samples
对比4组样品发现,2种膳食磷脂(大豆磷脂和蛋黄卵磷脂)中PC的相对含量显著高于乳源MFGM,但缺乏对婴儿生长发育更为重要的SM和Cer。这一差异表明,尽管膳食磷脂在PC和PE的含量上具有一定优势,但其磷脂组成与母乳MFGM仍存在较大差距,特别是在SM和Cer等关键功能脂质方面。
2.5 不同样品差异磷脂分子组成分析
通过对母乳MFGM、羊乳MFGM、大豆磷脂和蛋黄卵磷脂中同一种类的磷脂分子进行热图分析(附图1,https://doi.org/10.13995/j.cnki.11-1802/ts.042822),发现2种乳源MFGM的磷脂分子组成较为接近,而2种膳食磷脂的分子组成和相对含量表现出较高的相似性。对4种样品中含量大于0.5%的差异磷脂分子及其含量进行统计分析(附表1,https://doi.org/10.13995/j.cnki.11-1802/ts.042822),结果表明SM、PC、PE和PG是种类和相对含量较多的典型磷脂。4种样品共有的典型磷脂仅有5种,分别是PE(21:0/0:0)、PG(O-16:0/20:1)、PG(O-16:0/22:2)、Cer(d14:2/18:1)和Cer(d16:2/22:1),且在相对含量上存在显著差异。
SM是2种MFGM与膳食磷脂差异最大的磷脂种类,羊乳MFGM和母乳MFGM中共有的典型SM磷脂分子为6种,仅在蛋黄卵磷脂中检测到1种与母乳MFGM共有的磷脂(SM)。这与其他研究结果一致,表明乳源磷脂中SM的含量相对较高,是与母乳更为接近的重要原因之一[21]。羊乳MFGM和母乳MFGM共有的典型PC分子为9种,其中有7种在2种膳食磷脂中都不典型,另外2种[PC(O-16:0/2:0)和PC(O-20:0/22:0)]在蛋黄卵磷脂中典型。此外在蛋黄卵磷脂中还检测到另外4种与母乳MFGM共有的典型PC磷脂分子,在大豆磷脂中仅检测到1种。PE在2种MFGM中的典型分子相对含量类似,PE(18:1/18:2)、PE(18:1/18:1)、PE(21:0/22:2)是母乳MFGM和羊乳MFGM中特有的共同典型磷脂分子,在膳食磷脂中的相对含量并未超过0.5%。而PE(20:0/0:0)、PE(16:0/18:1)、PE(18:1/20:5)则是2种膳食磷脂和母乳MFGM中典型的PE磷脂分子。羊乳MFGM与大豆磷脂在典型PG磷脂分子的相对含量上具有更高的相似性,而蛋黄卵磷脂与母乳MFGM在分子种类上更加相似。其中PG(O-16:0/20:1)、PG(O-16:0/22:2)在4种样品中均被检测到,且相对含量差异不大。PG(6:0/6:0)、PG(13:0/0:0)、PG(18:0/14:0)是2种膳食磷脂与母乳MFGM中共有的,而在羊乳MFGM中并不典型。Cer是母乳MFGM与其他样品差异较大的典型磷脂,这与之前的研究结果一致[21]。有9种仅为母乳MFGM特有。Cer(d18:0/16:0)在母乳MFGM和羊乳MFGM中特有,但相对含量存在显著差异。4种样品共有典型Cer磷脂分子3种,其中Cer(d14:2/22:1)在2种膳食磷脂和母乳MFGM中相对含量较高。在蛋黄卵磷脂中检测到种类最多的典型PS磷脂分子,分别与2种乳源MFGM呈现出较高的相似性,其中3种样品共有的典型PS磷脂有5种。在大豆磷脂中检测到较少的典型PS分子,且仅有PS(12:0/18:2)与母乳MFGM共为典型。在羊乳MFGM中并未发现与母乳MFGM共有的典型PI磷脂分子,表明其在PI磷脂组成上存在显著差异。2种膳食磷脂与母乳MFGM存在共有的典型PI磷脂分子,如PI(P-16:0/0:0)、PI(P-18:0/0:0)、PI(17:0/0:0)和PI(14:1/22:2)。此外在大豆磷脂和蛋黄卵磷脂中检测到了部分在母乳MFGM中相对含量较高而在羊乳MFGM中相对含量较低的磷脂分子,如:PC(O-20:0/22:0)、PE(P-20:0/22:0)、Cer(d14:2/22:1)。上述结果表明,羊乳MFGM与母乳MFGM在SM、PC和PE等关键磷脂分子种类上呈现较高相似性,而膳食磷脂则以PG、PI和PS为主,且在SM和Cer等功能脂质的种类及相对含量上存在明显不足。
2.6 不同样品差异磷脂代谢途径分析
将2种乳源MFGM和膳食磷脂中显著不同的磷脂种类(P<0.05)进行代谢分析,以阐明乳源MFGM和膳食磷脂中差异磷脂种类的相关代谢途径。如图4所示,母乳MFGM主要代谢途径有七类,分别为甘油磷脂代谢(glycerophospholipid metabolism)、鞘脂代谢(sphingolipid metabolism)、亚油酸代谢(linoleic acid metabolism)、α-亚麻酸代谢(α-linolenic acid metabolism)、糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定生物合成[glycosylphosphatidylinositol(GPI)-anchor biosynthess]、醚脂代谢(ether lipid metabolism)和花生四烯酸代谢(arachidonic acid metabolism)。羊乳MFGM和大豆磷脂中主要代谢途径有六类,相较于母乳MFGM均缺乏醚脂代谢。蛋黄卵磷脂中存在六类主要代谢途径,其中拥有羊乳MFGM和大豆磷脂所没有的醚脂代谢,但相较于母乳MFGM缺乏鞘脂代谢。
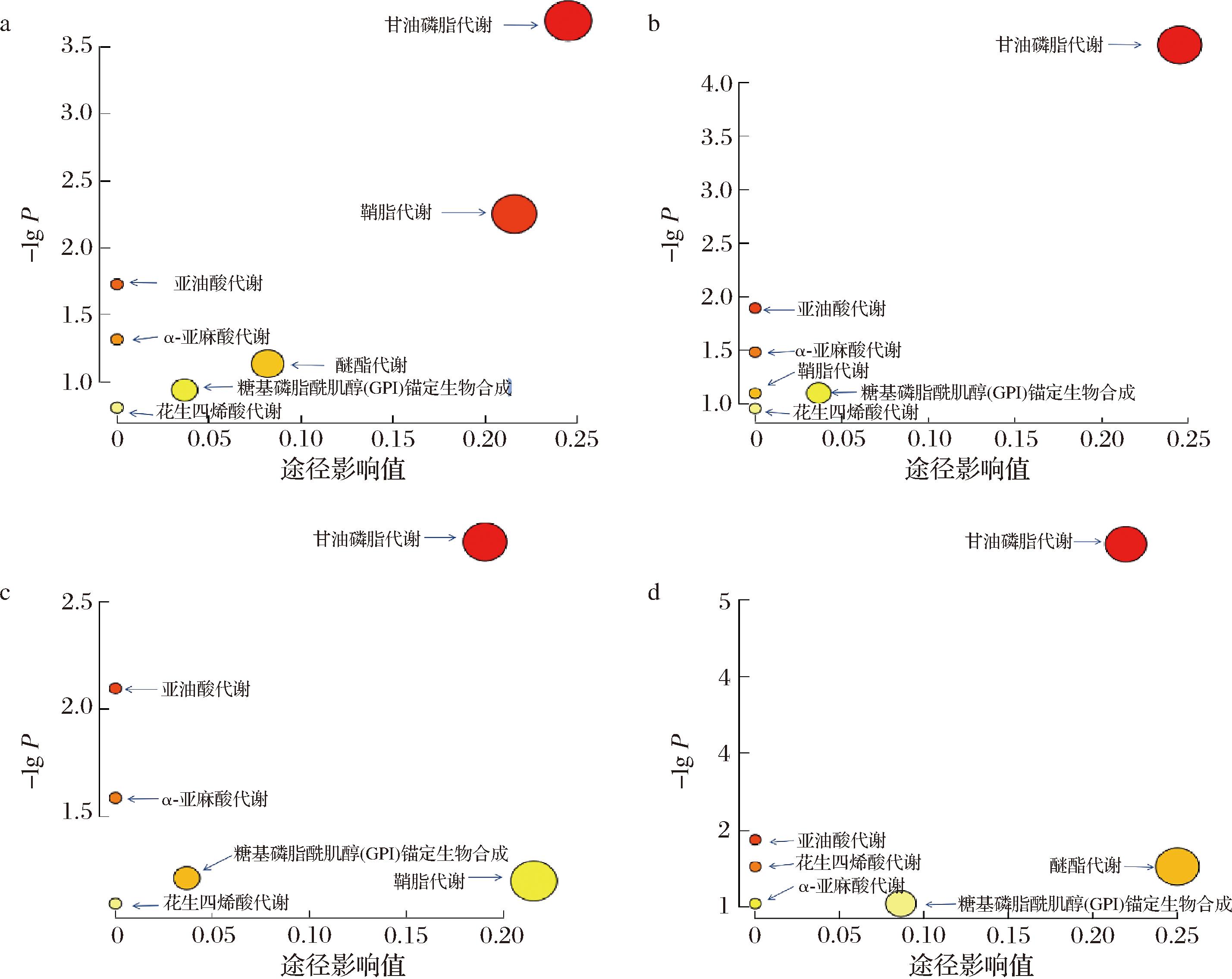
a-母乳MFGM磷脂代谢途径;b-羊乳MFGM磷脂代谢途径;c-大豆磷脂磷脂代谢途径;d-蛋黄卵磷脂磷脂代谢途径
图4 不同样品中磷脂代谢途径的代谢组学图
Fig.4 Metabolomics map of phospholipid metabolic pathways in different samples
以P<为0.05和途径影响值(pathway impact)>0.1的代谢途径为最显著的途径。在最相关的途径中,甘油磷脂代谢分别是母乳MFGM、羊乳MFGM、大豆磷脂、蛋黄卵磷脂之间最重要的途径,这与之前的研究结果相似[8]。
3 结论与讨论
本研究通过对母乳MFGM、羊乳MFGM、大豆磷脂和蛋黄卵磷脂的脂肪酸及磷脂组成进行系统分析,发现羊乳MFGM在脂肪酸和磷脂组成上与母乳MFGM具有较高的相似性,尤其是在SM等关键功能脂质方面,而大豆磷脂与蛋黄卵磷脂在磷脂组成上更为接近。然而,羊乳MFGM中仍缺乏部分母乳MFGM中含有的重要脂质成分,如PC(O-20:0/22:0)、PE(P-20:0/22:0)、Cer(d14:2/22:1),这些成分在大豆磷脂或蛋黄卵磷脂中含量较高。代谢途径分析发现,这些磷脂主要参与甘油磷脂代谢途径。因此,在以羊乳为乳基料的婴儿配方奶粉研发中,仅依赖羊乳MFGM难以完全模拟母乳的脂质组成,需结合大豆磷脂和蛋黄卵磷脂进行补充,以弥补羊乳MFGM在特定脂质成分上的不足。这种组合策略不仅能够优化婴儿配方奶粉的脂肪酸和磷脂组成,还能更好地模拟母乳的功能特性,为婴儿的生长发育提供更全面的营养支持。本研究为羊乳基婴儿配方奶粉的脂质母乳化研究提供了重要的理论依据和数据参考。
[1] WEI W, JIN Q Z, WANG X G. Human milk fat substitutes: Past achievements and current trends[J]. Progress in Lipid Research, 2019, 74:69-86.
[2]  AHIN-YE
AHIN-YE ILÇUBUK N, AKOH C C. Biotechnological and novel approaches for designing structured lipids intended for infant nutrition[J]. Journal of the American Oil Chemists’ Society, 2017, 94(8):1005-1034.
ILÇUBUK N, AKOH C C. Biotechnological and novel approaches for designing structured lipids intended for infant nutrition[J]. Journal of the American Oil Chemists’ Society, 2017, 94(8):1005-1034.
[3] 时佳, 张海娇, 赵锋, 等. 乳脂肪球膜结构、功能特性及其应用研究进展[J]. 乳业科学与技术, 2025, 48(1):46-52.SHI J, ZHANG H J, ZHAO F, et al. Advances in structure, functional characteristics and application of milk fat globule membrane[J]. Journal of Dairy Science and Technology, 2025, 48(1):46-52.
[4] LI B L, CHEN Q X, MU L K, et al. Milk fat globule membrane regulates the physicochemical properties and surface composition of infant formula powders by improving the stability of the emulsion[J]. Food Chemistry, 2024, 440:137522.
[5] SUN Y, ZHU B, CONG P Y, et al. Regulating fat globule structure of infant formula based on MFGM to promote lipid uptake by improving lipolysis[J]. Food Hydrocolloids, 2024, 155:110167.
[6] CAVALETTO M, GIVONETTI A, CATTANEO C. The immunological role of milk fat globule membrane[J]. Nutrients, 2022, 14(21):4574.
[7] OOSTING A, KEGLER D, WOPEREIS H J, et al. Size and phospholipid coating of lipid droplets in the diet of young mice modify body fat accumulation in adulthood[J]. Pediatric Research, 2012, 72(4):362-369.
[8] WANG S L, DE SOUZA C, RAMACHANDRAN M, et al. Lipidomics insight on differences between human MFGM and dietary-derived lipids[J]. Food Chemistry, 2023, 422:136236.
[9] FRANCE T C, KENNEDY E, O’REGAN J, et al. Current perspectives on the use of milk fat globule membrane in infant milk formula[J]. Critical Reviews in Food Science and Nutrition,2024,11: 1-16.
[10] ROELOFS J J M, TJOELKER R S, LAMBERS T T, et al. Mild processing and addition of milk fat globule membrane in infant formula may better mimic intragastric behavior of human milk: A proof of concept trial in healthy males[J]. Food Hydrocolloids, 2024, 151:109839.
[11] XIA Y, JIANG B W, ZHOU L H, et al. Neurodevelopmental outcomes of healthy Chinese term infants fed infant formula enriched in bovine milk fat globule membrane for 12 months-A randomized controlled trial[J]. Asia Pacific Journal of Clinical Nutrition, 2021, 30(3):401-414.
[12] 杨博睿.牛乳、羊乳和人乳的消化特性及对肠道微生物的影响[D].陕西师范大学,2020.YANG B O. Digestibility characteristics and effects on intestinal microbiota of cow milk, goat milk, and human milk[D]. Shanxi Normal University, 2020.
[13] WEI W, LI D, JIANG C Y, et al. Phospholipid composition and fat globule structure Ⅱ: Comparison of mammalian milk from five different species[J]. Food Chemistry, 2022, 388:132939.
[14] JIANG H, GONG H, LI Q, et al. Differences in proteomic profiles and immunomodulatory activity of goat and cow milk fat globule membrane[J]. Food Chemistry, 2024, 455:139885.
[15] LU J, LIU L, PANG X Y, et al. Comparative proteomics of milk fat globule membrane in goat colostrum and mature milk[J]. Food Chemistry, 2016, 209:10-16.
[16] WANG L N, LI X D, HUSSAIN M, et al. Effect of lactation stages and dietary intake on the fatty acid composition of human milk (a study in Northeast China)[J]. International Dairy Journal, 2020, 101:104580.
[17] PAN Z, YE A Q, FRASER K, et al. Comparative lipidomics analysis of different-sized fat globules in sheep and cow milks[J]. Current Research in Food Science, 2024, 8:100655.
[18] MA Q, SUN M, ZHAO Y J, et al. Improving lipid digestion by modulating interfacial structure of fat globule based on milk fat globule membrane and different phospholipids[J]. Food Hydrocolloids, 2024, 150:109736.
[19] EDIRIWEERA M K. Analyzing the fatty acid composition of goat milk and its HDAC inhibitory effects: A rational approach towards understanding the epigenetic impacts of goat milk[J]. Natural Product Research, 2025, 39(6):1714-1717.
[20] ALI A H, ZOU X Q, LU J, et al. Identification of phospholipids classes and molecular species in different types of egg yolk by using UPLC-Q-TOF-MS[J]. Food Chemistry, 2017, 221:58-66.
[21] SUN Y, TIAN S F, HUSSAIN M, et al. Profiling of phospholipid classes and molecular species in human milk, bovine milk, and goat milk by UHPLC-Q-TOF-MS[J]. Food Research International, 2022, 161:111872.
[22] ZHANG Y, ZHENG Z J, LIU C H, et al. Lipid profiling and microstructure characteristics of goat milk fat from different stages of lactation[J]. Journal of Agricultural and Food Chemistry, 2020, 68(27):7204-7213.