蜂蜜是以蜜蜂采集植物的花蜜、分泌物或蜜露,与自身分泌物混合后,充分酿造而成的天然甜味物质,具有较高的营养价值[1]。其化学成分较为复杂,其中糖类占总成分的75%,如图1所示,葡萄糖和果糖含量最高,占蜂蜜总糖的85%~95%,其次是蔗糖,占蜂蜜总量的1%~5%,除此之外还包括近30种低聚糖,如海藻糖、松二糖、麦芽糖、纤维二糖、蜜二糖、曲二糖、异麦芽糖、龙胆二糖、麦芽酮糖和昆布二糖等糖,及一些三糖,如松三糖、棉子糖、麦芽三糖和异麦芽三糖,还包括微量的异麦芽四糖、麦芽四糖、蔗果四糖、异麦芽五糖等[2]。这些糖类物质部分存在于花蜜之中,部分是在一定温度下,由花蜜或蜜露中的蔗糖等物质,在蜜蜂咽下腺等分泌的消化酶(如淀粉酶和α-葡萄糖苷酶等)的作用下转化而成的[3],是蜂蜜的重要组成部分。根据国际食品法典委员会(CAC 2002.Pesticide Residues in Food and Feed)标准要求蜂蜜中果糖和葡萄糖总量应≥60%,蔗糖含量根据蜜源植物不同应控制在5%以下。而像海藻酮糖、棉子糖、麦芽酮糖这类在蜂蜜中的微量低聚糖是蜂蜜的功能性成分,起到抗糖尿病、改善肠道功能、抗氧化等作用[4]。因此,蜂蜜的品质和特性与其中糖的组成和比例密切相关。
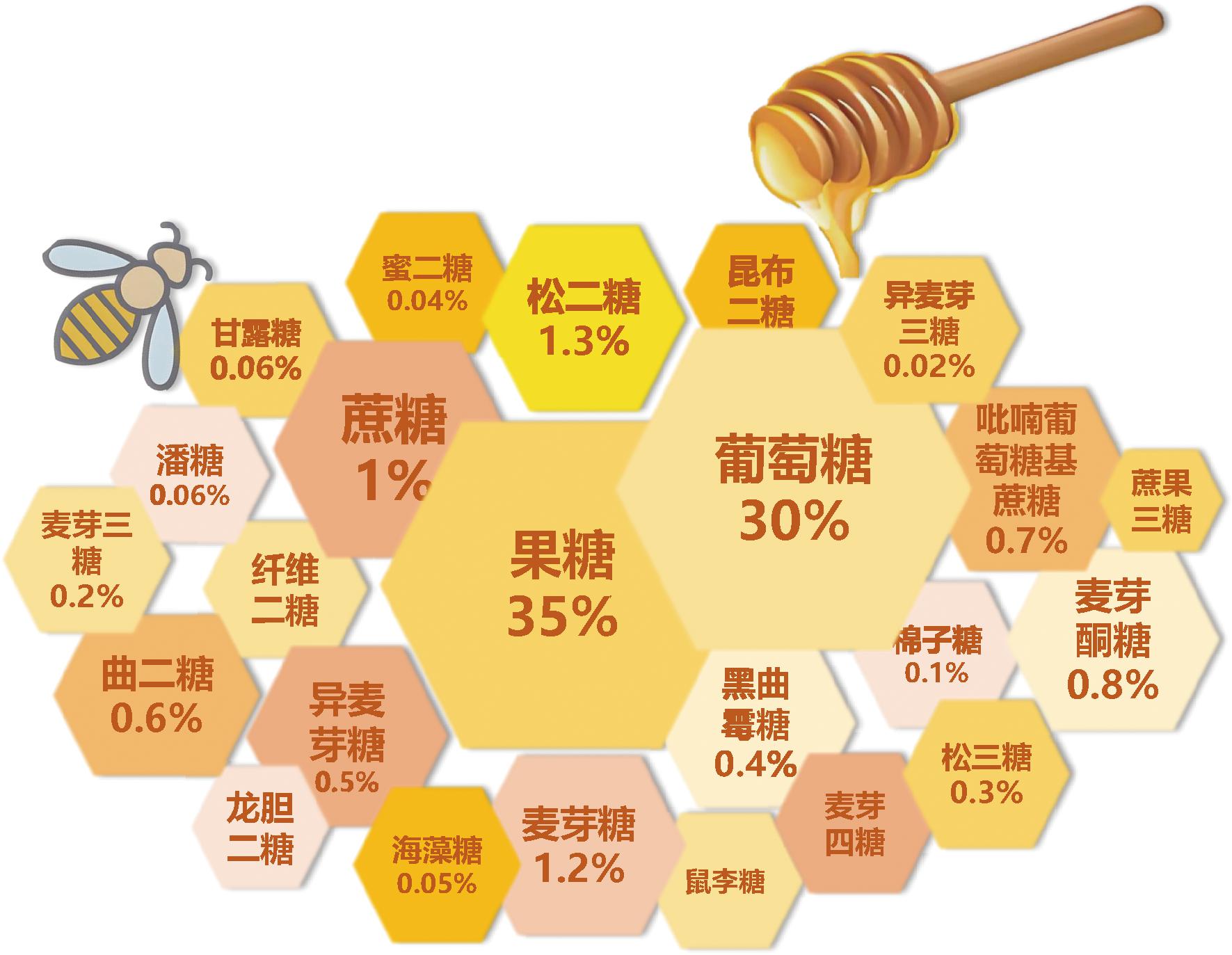
图1 蜂蜜中的糖[4,13]
Fig.1 The sugars in honey[4,13]
在蜂蜜的分类与植物源溯源方面,不同种类蜂蜜的糖分组成,存在显著差异。可以选择果糖、葡萄糖、蔗糖、麦芽糖含量和葡萄糖与水含量之比,作为正确划分蜂蜜样品亲本类型的表征参数,成功对单花蜂蜜进行划分[5]。糖组分分析结合多元统计技术分析数据,能够发现不同蜜源植物蜂蜜之间的低聚糖组分存在普遍差异,表明蜂蜜中的微量低聚糖有助于确定蜂蜜样品的植物源品种,特别是二糖和三糖之间的差异可以区分不同产地和不同成熟度的蜂蜜样品[6]。此外,不同植物源的蜂蜜中,低聚糖的含量也具有显著性差异[7]。低聚糖组成可以作为单花蜂蜜分类和鉴定的可靠指标,能够通过特定糖组分的比例、含量,结合其他指标(如电导率,多酚谱等)来区分蜂蜜类型[6]。
在蜂蜜的糖浆掺假鉴别方面,MORALES等[8]采用高效阴离子色谱-脉冲电流检测器(high-performance anion-exchange chromatography with pulsed amperometric detection, HPAEC-PAD)对糖浆和蜂蜜样品中的高分子质量糖组分进行分析,可检出低至5%玉米糖浆和高果糖玉米糖浆的掺假。除了存在聚合度(degree of polymerization,DP)较高(DP≥13)的多糖之外,有些掺假蜂蜜样品中会出现糖类含量的异常趋势,也可以一起作为鉴别蜂蜜中掺入高果糖玉米糖浆和玉米糖浆的指标。采用基质辅助激光解吸电离质谱得到低聚糖和多糖图谱,能够表征蜂蜜样品与掺有玉米糖浆或转化糖浆的样品之间低聚糖异构体组成的差异,对蜂蜜掺假进行高通量有效监控[9]。工业糖浆对主要单糖水平的影响微乎其微,不同的研究表明,一些次要糖类的糖谱可以更好地代表蜂蜜的指纹图谱[10]。通过比较蜂蜜样品的准确低聚糖谱可以对较难分辨的糖浆掺假(如糖浆饲喂蜜蜂产蜜)进行准确鉴别[11]。
因此,糖成分是蜂蜜的重要营养组分,也可以作为内源性指标,对蜂蜜的分类、糖浆掺假鉴别以及植物源溯源具有重要的意义[12]。蜂蜜中单糖和低聚糖的检测现已成为国内外的研究重点,本文基于国内外用于蜂蜜中糖类物质的检测方法进行综述,如表1所示,分析方法主要可以分为旋光法、滴定法、光谱法、液相色谱法、气相色谱法、离子色谱法等。方法的检测原理、灵敏度以及样品的前处理方法不同,其适用的分析目的和范围也不同。对蜂蜜中的多种糖类进行准确地定性、定量将有助于提高蜂蜜品质、为蜂蜜中糖的测定与质量评价提供参考。
表1 蜂蜜中糖的分析方法
Table 1 The analytical methods for sugars in honey

检测方法适用范围优缺点参考文献旋光法果糖、葡萄糖、蔗糖前处理和检测方法简单,但结果相对不准确,适用于检测的糖种类少[14]化学滴定法果糖、葡萄糖、麦芽糖准确性高,但操作复杂,对于检测人员滴定操作的要求高,适用于检测的糖种类少[15]液相色谱-示差折光检测器果糖、葡萄糖、蔗糖、麦芽糖、乳糖、木糖、海藻酮糖、甘露糖方便、普适,但灵敏度低,主要适用于蜂蜜中主要糖成分如葡萄糖、果糖、蔗糖的定性定量[16-17]液相色谱-蒸发光检测器果糖、葡萄糖、蔗糖、松二糖、麦芽酮糖、麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖、麦芽七糖、阿洛酮糖、曲二糖、异麦芽糖、吡喃葡糖基蔗糖、松三糖、蜜三糖灵敏度较高,可以检测蜂蜜中多种糖成分,但不能同时对高含量和低含量糖成分进行定量[18-19]离子色谱法果糖、葡萄糖、蔗糖、乳糖、半乳糖、甘露糖、核糖、木糖、鼠李糖、棉子糖、麦芽糖、吡喃葡萄糖基蔗糖、曲二糖、帕拉金糖、松二糖、蜜二糖、黑格糖、松三糖、异麦芽三糖、水苏糖灵敏度高,可以对蜂蜜中多种糖组分进行检测,绿色环保,但分离梯度时间较长,与质谱串联存在困难,不能同时定量[20]气相色谱法果糖、葡萄糖、蔗糖、木糖、海藻糖、麦芽酮糖、麦芽糖、曲二糖、龙胆二糖、异麦芽糖、棉子糖、松二糖、松三糖分离性好,但检测之前需要对样品进行衍生化处理,可能会对色谱柱造成损坏[21]红外光谱法果糖、葡萄糖、蔗糖、麦芽糖快速、高效,但准确测定依赖于建模,对检测温度要求高,灵敏度低,不适用于低含量低聚糖的检测[22]拉曼光谱法果糖、葡萄糖、蔗糖、麦芽糖快速、高效,出峰清晰,但要求检测环境中无自然光,灵敏度低,不适用于低含量低聚糖的检测[23]核磁共振光谱法果糖、葡萄糖、甘露糖、鼠李糖、蔗糖、海藻糖、松二糖、麦芽糖、麦芽酮糖、帕拉金糖、蜜二糖、异麦芽糖、龙胆二糖、黑格糖、曲二糖、棉子糖、潘糖、松三糖、异麦芽三糖、松三糖、麦芽三糖、蔗果三糖、麦芽四糖分离性好,适用于结构相似的多种糖类的鉴别和定量,但检测成本较高[24-25]
1 旋光法
旋光法操作简便快捷,但检测结果易受到环境条件的影响和蜂蜜样品中杂质的干扰。其检测原理是根据特定温度条件下,不同种类的糖具有相应的比旋光度,在分析过程中,光线通过样品,糖的旋光性会使偏振光的振动平面发生旋转,产生旋光度。此时,检测器会将该旋光度转换为电信号,对所获得的电信号进行测量和分析,能够从中获取手性糖类的结构以及浓度信息[26]。连会[14]利用旋光度具有加和性的特质,采用AP-300-B全自动旋光仪对蜂蜜中的主要糖成分葡萄糖、果糖、蔗糖进行了分析,该方法前处理简单,结果相对可靠。对化学法与旋光法进行比较,测定蜂蜜中的葡萄糖、果糖和蔗糖,通过测定结果与F检验法验证后发现,旋光法与化学法相比偏差更小,稳定性更好,且操作更为简便[27]。旋光法也可用于蜂蜜掺假的辨别,CAMPOS等[28]对41个样品(包括蜂蜜、花蜜以及掺假蜂蜜)的特定光学旋转角进行了测定,结果表明所有测定的掺假蜂蜜样品都呈现出中等偏高的正旋光角,这证实了蜂蜜的糖度分布与旋光度之间存在很强的相关性,可以用于区分蜂蜜掺假。虽然旋光法具有操作简便的特点,但在对蜂蜜中糖成分含量进行检测时,只考虑到了占据主要成分的葡萄糖、果糖等,未考虑到同样具有旋光性的其他糖类如麦芽糖、海藻糖等,因此该分析方法具有局限性[28]。
2 化学滴定法
化学滴定法主要应用于还原糖的分析测定,该方法是基于氧化还原反应原理,如还原糖能够将二价铜还原为氧化亚铜,利用该反应,采用指示剂如碱性酒石酸铜溶液,进行样品溶液滴定从而对蜂蜜中还原糖含量进行测定。URSULIN-TRSTENJAK等[29]对于克罗地亚刺槐蜂蜜的理化指标进行分析,其中还原糖和蔗糖通过使用费林溶液滴定法来测定,根据其糖含量及比例从而证实了蜂蜜的植物来源。崔颖等[30]针对蜂蜜中还原糖和蔗糖含量的化学滴定法,进行了方法不确定性的评估,通过建立模型对于样品质量、样品定容、酒石酸铜溶液标定、滴定操作等多环节进行了不确定度评定。结果表明滴定操作对于不确定度的贡献最大,当还原糖含量为78.8 g/100 g时,扩展不确定度为1.0 g/100 g。由此说明化学滴定法对蜂蜜中糖组分进行测定时,步骤较为繁琐,费时费力,对结果的准确度影响较大[30]。将测定蜂蜜中果糖、葡萄糖、麦芽糖含量的化学测定法和高效液相色谱法相比较,结果表明,后者的回收率更为稳定,结果重复性好,准确性高,而化学法通过氧化还原反应测定还原糖,通过碘量法滴定葡萄糖。这种方式忽略了麦芽糖组分的存在,使得葡萄糖和蔗糖的含量测定结果普遍偏高[15]。因此,化学法具有成本低、检测过程不依赖于大型仪器的特点但是对于检测人员滴定操作的要求高,且检测糖种类少,多用于测定蜂蜜中葡萄糖、果糖、蔗糖,因此,化学法测定糖含量逐渐被其他更为方便、快捷、准确性高的方法所取代。
3 色谱法
3.1 液相色谱-示差折光检测法(liquid chromatography with refractive index detection, LC-RID)
液相色谱法是食品分析较为常用的方法[31],糖的分析一般以示差折光检测器和蒸发光检测器为主。由于不同介质具有不同的折射率,通过色谱柱的流出液所含物质不同,其折射率不同,LC-RID法就是利用连续测定参比池与样品池中溶液折射率变化来对样品中的各类化合物进行检测的[32],广泛应用于分析蜂蜜中的主要糖组分。研究采用超高效液相色谱-示差折光检测法(high performance liquid chromatography with refractive index detection, HPLC-RID)对于蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖进行分析测定,基于国标对于食品中还原糖的检测方法,可以很好地将4种还原糖进行分离,检出限均为0.5 g/100 g,结果准确率高、精密度好,适用于蜂蜜的质量监控与品质评价[16]。示差折光检测器的灵敏度相对蒸发光检测器较低,大多数用来检测蜂蜜中的主要糖类。郑星等[17]建立了一种快速、准确的方法,可以检测无刺蜂蜂蜜中海藻酮糖的含量,其检出限为0.07 mg/mL,定量限为0.22 mg/mL。该方法采用离子配体交换柱Hi-Plex Pb对该低聚糖与蔗糖、麦芽糖等同分异构体进行了有效地分离。以分析质量设计方法为基础,基于分析风险评估、多变量统计和质量控制程序,可以作为较为完善的化学计量方法结合反相液相色谱-示差折光检测器对葡萄糖、果糖、蔗糖、木糖和甘露糖进行准确测定[33]。JALALUDIN等[34]对高效液相色谱RID检测器和紫外(ultraviolet detector, UV)检测器对于蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖的检测定量进行了比较,在单糖的高效液相色谱分析中,RID和UV的检测限结果相当,在二糖的分析中,HPLC-RID的检测限结果优于HPLC-UV。在小分子糖的检测当中,由于无法进行流动相的梯度洗脱,当样品中该糖成分浓度较低时,RID检测器会产生较大偏差,其灵敏度的提升仍是方法优化的关键。因此,HPLC-RID具有方便、普适的特点,主要适用于蜂蜜中主要糖成分如葡萄糖、果糖、蔗糖的定性定量,由于其灵敏度低,不适用于分析蜂蜜中含量较低的低聚糖。
3.2 液相色谱-蒸发光检测法(liquid chromatography with evaporative light scattering detection, LC-ELSD)
液相色谱-蒸发光检测法是分析定量蜂蜜中糖组分的常用方法,样品通过色谱柱进行分离,流动相雾化蒸发后,留下来的不挥发样品颗粒通过光散射池,通过光散射的角度对物质含量进行测定。LC-ELSD检测法对于蜂蜜中的主要糖类如果糖、葡萄糖、蔗糖的测定具有准确性高,低检出限,前处理方法简单、分析时间短的特点[35]。除了含量较高的主要糖组分之外,HPLC-ELSD检测器同样适用于蜂蜜中多种低聚糖的含量测定,我国行业标准GH/T 1316—2020《蜂蜜中松二糖、松三糖、吡喃葡糖基蔗糖、异麦芽糖和蜜三糖含量的测定 高效液相色谱法》采用HPLC-ELSD检测法测定了蜂蜜中松二糖、松三糖、吡喃葡糖基蔗糖、异麦芽糖和蜜三糖含量。并且能够有效应用于蜂蜜掺假的鉴别,对于市场上麦芽糖的掺杂,主要包括6种麦芽低聚糖(麦芽糖、麦芽三糖、麦芽四糖、麦芽五糖、麦芽六糖和麦芽七糖)进行检出,定量限为0.30~0.60 mg/g,灵敏度高于示差折光检测器,能够作为蜂蜜真实性的有效检测工具[18]。贾茹等[19]建立了HPLC-ELSD法检测蜂蜜中果糖、葡萄糖、蔗糖、松二糖、麦芽酮糖、麦芽糖、曲二糖、异麦芽糖、吡喃葡糖基蔗糖、松三糖、蜜三糖和麦芽三糖12种糖组分的方法,采用3.5 μm,250 mm×4.6 mm氨基色谱柱可以将12种糖组分良好分离,该方法对蜂蜜中果糖和葡萄糖的检出限为0.5 g/100 g,定量限为1.0 g/100 g,其余10种低聚糖的检出限均为0.1 g/100 g,可以实现蜂蜜中微量低聚糖的准确定量,为质量评价提供良好支撑。YAN等[36]和XIE等[37]采用高效液相色谱-蒸发光散射检测法,采用2.1 mm×150 mm,2.5 μm氨基色谱柱进行分离,分别对蜂蜜中的微量低聚糖进行含量测定,其中YAN等[36]建立的检测方法能够对洋槐蜜中的松二糖精确定量,检出限为0.05 g/L,定量限为0.1 g/L,确立了松二糖可作为蜂蜜成熟过程中的一种内源性标志物。XIE等[37]测定了多种蜂蜜样品中的阿洛酮糖含量,检出限、定量限值与松二糖相同,确定了阿洛酮糖可以作为除枣花蜜外其他蜂蜜掺假检测的新标记物。张英等[31]采用HPLC-ELSD和HPLC-RID法对蜂蜜中的果糖、葡萄糖、蔗糖、麦芽糖的含量进行检测,从而对这2种方法进行比较。对于同一种糖,ELSD在灵敏度、检出限和线性范围3个方面都优于RID检测器,因此可以判断ELSD检测器更适用于蜂蜜中糖的定性。对于定量方面,由于ELSD检测器灵敏度较高,而蜂蜜中主要糖组分与其他低聚糖的含量差距较大,因此在实际测定过程中无法同时对这两类糖进行定量,具有一定局限性。
3.3 液相色谱-质谱检测法(liquid chromatography-mass spectrometry,LC-MS)
液相色谱-质谱法灵敏度高,能够快速给出糖分子的结构信息,主要用于分析蜂蜜的掺假,但由于某些糖类物质的极性较强,在质谱分析中的离子化过程相对困难。在分析过程中,样品经过液相色谱柱分离后,中性样品分子经过离子源被电离为离子碎片,并形成离子束,通过质量分析器将不同离子按质荷比大小顺序进行分离,并实现相同质荷比离子的良好聚焦,最后经检测器将离子流强度转化为包含物质信息的电信号[32]。
DU等[38]建立了一种超高效液相色谱/四极杆飞行时间质谱检测蜂蜜糖浆掺假,可检测出掺假蜂蜜中DP为3~19的低聚糖,根据谱图生成外源糖浆标志数据库,对10%糖浆掺假蜂蜜可以起到准确、快速、高效的鉴别。QU等[9]提出了一种高效的基质辅助激光解吸电离飞行时间质谱方法(matrix-assisted laser desorption/ionization time of flight mass spectrometry, MALDI-TOF-MS)来分析低聚糖异构体的组成,根据谱图,二糖、三糖和四糖在蜂蜜和掺假蜂蜜样品中呈现出不同的片段模式,从而可以实现对它们的区分,准确应用于蜂蜜糖浆掺假的鉴别。对于外源糖浆的掺假,也可以通过稳定同位素质谱分析,对比蜂蜜样品与分析样品的δ13C同位素比值,来确定样品是否掺杂了C4植物来源糖浆,不仅可以为检测蜂蜜掺假提供信息,还可以作为蜂蜜地理来源的一种标志[39]。液质联用法灵敏度高,选择性好,能够区分不同分子质量和结构的糖类化合物,由于糖类物质的离子化效率较低,增加了该方法的复杂性。
3.4 离子色谱法(ion chromatography, IC)
阴离子交换分离技术结合脉冲安培检测器可以完成对蜂蜜中大多数单糖、低聚糖的检测。阴离子交换色谱的分离过程以离子交换剂为固定相,以阴离子交换基团与糖组分的阴离子进行交换,根据离子的极性不同从而使化合物被先后洗脱出来,实现对不同糖的分离测定[40]。脉冲安培检测器的检测过程以金、铂等为工作电极,通过离子在其表面发生氧化还原反应引起的电流变化来测量化合物的含量。
在对蜂蜜进行检测时,由于蜂蜜中含有糖以及维生素、氨基酸、蛋白质等,会对柱子造成损坏,NI等[20]建立了一种分析蜜露和花蜜中糖的柱切换离子色谱-脉冲安培检测法(ion chromatography-pulsed amperometric detector, IC-PAD),使用反相柱作为在线去除有机物的预处理柱,并使用柱切换技术将糖从收集环洗脱到分析柱。对蜂蜜等高糖含量样品进行预处理,能够有效分离鼠李糖、葡萄糖、果糖、蔗糖、乳糖、棉子糖、麦芽糖、吡喃葡萄糖基蔗糖,该方法准确度高、精密度好、线性范围宽、检出限低。对于蜂蜜中的低聚糖,其乳糖检出限为10.17 μg/L、棉子糖检出限为6.62 μg/L、麦芽糖检出限为2.6 μg/L、吡喃葡萄糖基蔗糖检出限为6.69 μg/L,各糖的检出限、定量限均高于液相色谱[20]。蜂蜜中的松二糖主要通过HPLC-RID法以及HPLC-ELSD法进行检测,但二者分别具有分离度差和重复性差的问题,离子色谱安培检测器法可以较好地弥补这2点问题。与国标相比,该方法灵敏度高,检出限、定量限值更低,且具有98.3% 的总平均回收率[41]。离子色谱结合脉冲安培检测常与质谱进行联用,可使目标物得到有效分离,测定不同级分低聚糖的分子质量分布。ZHANG等[42]在对于无刺蜂蜂蜜中海藻酮糖来源的探究中同样采用了IC-PAD法对于葡萄糖、蔗糖、果糖和海藻酮糖的比例以及含量进行测定,所有相关化合物均能够在10 min内洗脱完毕,可以使培养实验样品中的微量海藻酮糖得到鉴定。TEDESCO等[6]开发了一种采用高效阴离子交换色谱-质谱联用技术(high-performance anion-exchange chromatography-mass spectrometry,HPAEC-MS)检测蜂蜜中多种糖组分的方法,应用该方法测定了各种蜂蜜样品中的7种单糖、8种二糖包括海藻酮糖和帕拉金糖、4种三糖如异麦芽酮糖、松三糖和1种四糖,可以根据低聚糖的种类和含量对不同产地和不同年份的蜂蜜样品进行区分。通过测试线性、仪器精密度(日内重复性和日间重现性)、检出限、定量限、方法检出限、方法定量限和真实度验证了该方法具有高准确性和低检测限[6]。由于离子色谱具有极高的灵敏度,因此可以对蜂蜜中多种糖组分进行分析,且离子色谱的流动相通常为酸、碱、盐或络合物的水溶液,相较于液相检测方法具有绿色环保的特点,但此类流动相会使离子色谱与质谱串接存在困难,且离子色谱分离梯度时间较长,因此更适用于多糖同分异构体和多种糖组分的分离,在定量方面具有和HPLC-ELSD同样的问题。
3.5 气相色谱法
气相色谱以气体作为流动相,通常与质谱进行联用。GC-MS检测法对于样品的分离性好,可以实现准确定性,因此适用于蜂蜜中多种结构相近低聚糖的分析检测。但是由于糖类化合物沸点高、极性强,在气相色谱的分析中应先对样品进行衍生化处理。
蜂蜜中所含糖类化合物较为复杂,糖苷键所在的位置不同或构型不同组成了多达14种二糖和11种三糖。由于共洗脱问题或洗脱时其他的基质化合物影响,采用高分辨色谱(或结合质谱联用)较难对大数目的糖类进行分离鉴定,可以采用气相色谱法解决这一问题。三甲基硅烷基(trimethylsilyl, TMS)是一种常用的糖类衍生物,TERRAB等[43]以其为衍生物,分析鉴定摩洛哥蜂蜜中2种单糖、8种二糖和3种三糖,通过建立模型可以对5种单花蜜分别进行表征。同样,SANZ等[21]采用TMS肟和TMS醚作为双重衍生剂,使用了2种涂有不同固定相35%二甲基-65%二苯基聚硅氧烷交联甲基硅酮的毛细管色谱柱。通过这种方式,每个样品可以获得2种不同的色谱图,以改善所获得的定性和定量数据,从10种蜂蜜中分离得到24种低聚糖,有助于样品的成分识别,超越常规气相色谱对于蜂蜜中碳水化合物的检测范围。这种综合二维气相色谱技术(GC×GC)已经趋于成熟并广泛用于复杂的糖类化合物分析中,BROKL等[44]将其与飞行时间质谱结合使用,分析蜂蜜中糖的四亚甲基亚砜衍生物。相比于以前的一维气相(1D GC)色谱方法,该组合方法明显提高了二糖的分离度,检测到之前与1D GC色谱图中的其他二糖重叠的未知化合物二糖,并且可以做到清楚地分离松二糖和麦芽糖的同分异构体。
在蜂蜜掺假的应用中,稳定碳同位素比率分析(stable carbon isotope ratio analysis, SCIRA)可以用于蜂蜜糖浆掺假的检测,但是该技术仅限于检测来自C4植物,对于C3植物,可以通过GC-MS检测掺假样本中较低水平的特征物质进行鉴别。RUIZ-MATUTE等[45]以TMS肟为衍生剂,采用GC-MS检测,以果糖二苷为掺假特征物,可在5%掺杂样本中检测到微量目标物,以菊粉三糖为掺假特征物,具有明显检出峰,易于洗脱,检出限为0.03 mg/g,可鉴定糖浆添加量少于1%的掺假样本,表明气相色谱法可广泛用于微量高果糖菊粉糖浆的蜂蜜掺假鉴别。不过该方法操作复杂并且难以保证重复性,对人工的要求较高,且衍生化处理可能会对色谱柱造成损坏,对质谱扫描定量也会产生影响,因此适用于多种糖的定性分析和分离。
4 光谱法
4.1 红外光谱法(infrared spectroscopy, IR)
蜂蜜中糖类的检测主要包括近红外光谱法(near-infrared spectroscopy, NIR)和中红外光谱法(mid-infrared spectroscopy, MIR),近红外光的波长为700~2 500 nm,中红外光波长为2.5~25 μm。当红外光照射至待测样本时,待测物质分子内部会发生分子振动和分子转动,不同的化学键或原子团对有着特定波长的红外光进行吸收,分子由基态向高能级跃迁,从而形成红外光谱,因此红外光谱包含了丰富的分子结构与组成的信息[46]。DOWNEY等[47]采用近红外光谱法,结合判别偏最小二乘回归(partial least squares regression, PLS)、K最邻近分类算法和SIMCA类建模法对光谱收集进行化学计量学分析,对于蜂蜜样品中的葡萄糖和果糖进行检测,结果表明样品温度是光谱的显著干扰因素,其中偏最小二乘回归方法可以最准确地对糖含量进行分析。GUELPA等[48]通过使用近红外光谱法结合偏最小二乘判别分析(partial least squares discriminant analysis,PLS-DA),对南非蜂蜜的糖组分建立指纹图谱,采用3种不同的NIR仪器(实验室仪器,以及便携式和移动式仪器)对样品进行检测,获得的结果准确率为93.3%~99.9%。高文佳等[22]采用中红外光谱法对多种蜂蜜样本中还原糖进行检测,并以高效液相色谱法检测结果作为真值与中红外光谱法相比较。结合主成分分析以及偏最小二乘判别分析建立模型并对红外吸收波段选择进行优化。模型的预测结果与真值的均方根误差小,可以作为准确性较高,无需样品前处理的快速检测方法。该方法同样可以应用于蜂蜜的糖浆掺假辨别。ÖZBAY等[49]对单花蜜、多花蜜以及糖浆掺假蜂蜜等311个样品进行定性和定量检测。NIR方法结合化学计量学如SIMCA、PLS-R分析可以用来鉴定出糖浆掺假物的含量<0.44%的未知蜂蜜样品,并能够对不同植物来源的纯蜂蜜样品进行准确分类。张广琪等[50]采用近红外光谱法与中红外光谱法对于蜂蜜的理化指标进行测定,探究指标之间的相关性以及对于2种方法进行比较。2种方法对于果糖、葡萄糖、还原糖、果糖与葡萄糖含量之比均可准确定量分析,其中果糖含量与果糖/葡萄糖2项指标的建模集和预测集相关系数均大于0.9,中红外光谱对于糖的定量分析准确性相较于近红外光谱更高。红外光谱技术可以通过建立蜂蜜中葡萄糖、果糖、蔗糖、麦芽糖的预测模型,实现对蜂蜜中糖类成分的检测。此类模型R值较高,可以有效替代传统的化学检测法,具有快速、高效的检测特点[51]。但此方法的准确测定依赖于所建模型的准确性,需不断进行数据修正,且谱带之间干扰较大,影响蜂蜜中含量较低的低聚糖分析。
4.2 拉曼光谱法(Raman spectroscopy, RS)
拉曼光谱是单色光照射待测样品时,光子与物质分子发生非弹性碰撞的相互作用,光子和分子之间产生能量交换发生了拉曼散射,拉曼光谱分析技术是基于拉曼散射效应,通过对拉曼位移的分析获取分子振动、转动方面的信息,从而实现对于待测物的定性与定量[52]。DAFERERA等[53]应用傅里叶变换拉曼光谱结合相应的软件,实现了蜂蜜中果糖和葡萄糖质量分数的同时测定,证明了透射光谱法对于复杂混合物定量分析的效率。拉曼光谱法具有分析速度快,几乎无需前处理的优点,使用F验验和T检验统计工具将该方法与HPLC测定蜂蜜中葡萄糖、果糖方法进行比较,所得结果具有高准确性和再现性。拉曼光谱能够结合SIMCA多元变量统计分析软件和机器学习,建立糖组分、水分含量等预测模型,以区分不同类型的蜂蜜的地理和植物来源。ÖZBALCI等[23]将拉曼光谱与化学计量学方法,包括主成分分析、偏最小二乘法和人工神经网络相结合,能够准确定量蜂蜜样品中的葡萄糖、果糖、蔗糖和麦芽糖含量。对每种糖组分进行单波段处理,结合高通量多元方法,能够实现一次性对蜂蜜中4种糖进行定量测定。苏东林等[54]采用便携式拉曼光谱仪对蜂蜜中果糖、葡萄糖、蔗糖和麦芽糖进行了快速测定,方法结合了偏最小二乘回归模型和向量机回归模型对于4种糖进行预测,二者均能进行准确预测,后者更适用于蜂蜜中主要糖分的定量测定与预测,尤其是果糖、葡萄糖、麦芽糖。结果表明拉曼光谱仍具有分辨率、信噪比较低以及样品中荧光干扰的问题。
对于蜂蜜中的糖成分测定,拉曼光谱与红外光谱法在检测过程和结果方面都具有很多相似之处,二者都具有方便、快捷、高效的特点,红外光谱法对检测环境的温度要求较高,而拉曼光谱法要求检测环境中无自然光。拉曼光谱出峰较为清晰,有利于进行差异性分析,但红外光谱的精准度要高于拉曼光谱,二者分析同样依赖建模准确性,具有灵敏度较低的问题[55]。
4.3 核磁共振光谱法(nuclear magnetic resonance, NMR)
核磁共振光谱主要分为1H氢谱和13C碳谱,波长范围为1~1 000 μm,广泛应用于物质的结构鉴定与定量分析[56]。样品特定的原子核在一定强度的外部磁场中,其共振吸收的电磁波频率与原子核在分子中的微环境相关;共振吸收的强度与产生核磁共振原子核的数目有关,由此能够根据NMR谱图,得到该分子结构与含量的相关信息[57]。LOW等[58]在1988年采用13C NMR光谱对蜂蜜中结构相似的葡萄糖-葡萄糖和葡萄糖-果糖二糖进行定性和定量分析,旨在通过添加弛豫试剂可使核溢出效应正常化,缓解其所导致的定量测量误差,通过结果可以成功定量麦芽酮糖、麦芽糖、黑格糖、松二糖、帕拉金糖和异麦芽糖等结构相似的蜂蜜中存在的二糖[58]。
CONSONNI等[24]通过1H和1H-13C NMR光谱法研究了86份意大利蜂蜜样品,其中包含中5种不同植物的糖谱,在蜂蜜的水提物中鉴定出了果糖、葡萄糖、蔗糖、异麦芽糖、曲二糖、麦芽糖、麦芽酮糖、异麦芽三糖、棉子糖和麦芽四糖等19种糖。通过对核磁共振数据进行多元统计分析,可以根据糖类含量的相对差异,从而确定不同植物产地蜂蜜的特征。SCHIEVANO等[25]基于高选择性化学位移过滤器的核磁共振方法,结合全相关谱(total correlation spectroscopy, TOCSY)对蜂蜜中常见的22种糖进行了定量,其中包括4种单糖(葡萄糖、果糖、甘露糖、鼠李糖)、11种二糖(蔗糖、海藻糖、松二糖、麦芽糖、麦芽酮糖等)和7种三糖(棉子糖、异麦芽三糖、松三糖、麦芽三糖等),化学位移选择性滤光片可以提高一维质子核磁共振光谱的选择性,与TOCSY结合使用可获得高分辨率的糖类化合物子光谱。NMR光谱检测成本较高,但能够适用于结构相似的多种糖类的鉴别和定量,适用于蜂蜜中糖类的常规分析。目前,光谱法被越来越多地用于样品的快检和无损检测,具有较广阔的应用前景。
5 结论与展望
全文对蜂蜜中糖测定方法进行了总结,主要包括旋光法、滴定法,液相色谱法、气相色谱法、离子色谱法、光谱法,各种仪器方法均可用于检测蜂蜜中含量较高的主要糖类,在分析前应根据样品特性、检测目的和成本等因素,选择合适的分析方法。针对蜂蜜中常规糖的定量检测,通常基于液相方法进行分析,GB 5009.8—2023《食品安全国家标准 食品中果糖、葡萄糖、蔗糖、麦芽糖、乳糖的测定》规定采用高效液相色谱法对蜂蜜中主要糖成分进行测定,液相方法前处理简单,可以对多种糖成分进行准确定量;光谱法适用于样品的无损检测,并且分析过程对环境的污染较少,核磁、红外等光谱方法还可以进行准确的结构鉴定,对蜂蜜中未知糖类化合物的发现和鉴定具有重要的意义。后续可以开发针对蜂蜜中特有功能性糖,如松二糖、海藻酮糖的快检试剂盒方法,能够实现不依赖于大型仪器,快速、便捷地对蜂蜜品质进行鉴定。此外,可以基于不同植物源或地理源特色蜂蜜的糖谱,筛选、组合、建立合适的分析方法,为特色蜂蜜的品质评价、质量控制提供技术支撑。
[1] BRAR D S, AHMAD NAYIK G, AGGARWAL A K, et al.Chemical and functional characteristics to detect sugar syrup adulteration in honey from different botanical origins[J].International Journal of Food Properties, 2023, 26 (1):1390-1413.
[2] CRANE E.Honey:A Comprehensive Survey [M].London:William Heinemann in co-operation with the International Bee Research Association, 1975:157-206.
[3] 蒲晓亚,杜旭升,刘泊,等.蜂蜜中果糖和葡萄糖含量测定问题的研究[J].安徽农业科学, 2015, 43(32):147-148.PU X Y, DU X S, LIU B, et al.Study on the determination of fructose and glucose in honey[J].Journal of Anhui Agricultural Sciences, 2015, 43(32):147-148.
[4] WESTON R J, BROCKLEBANK L K.The oligosaccharide composition of some New Zealand honeys[J].Food Chemistry, 1999, 64(1):33-37.
[5] MATEO R, BOSCH-REIG F.Sugar profiles of Spanish unifloral honeys[J].Food Chemistry, 1997, 60 (1):33-41.
[6] TEDESCO R, BARBARO E, ZANGRANDO R, et al.Carbohydrate determination in honey samples by ion chromatography-mass spectrometry (HPAEC-MS)[J].Analytical and Bioanalytical Chemistry, 2020, 412(22):5217-5227.
[7] CAN Z, YILDIZ O, SAHIN H, et al.An investigation of Turkish honeys:Their physico-chemical properties, antioxidant capacities and phenolic profiles[J].Food Chemistry, 2015, 180:133-141.
[8] MORALES V, CORZO N, SANZ M L.HPAEC-PAD oligosaccharide analysis to detect adulterations of honey with sugar syrups[J].Food Chemistry, 2008, 107(2):922-928.
[9] QU L L, JIANG Y M, HUANG X Y, et al.High-throughput monitoring of multiclass syrup adulterants in honey based on the oligosaccharide and polysaccharide profiles by MALDI mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2019, 67(40):11256-11261.
[10] RUIZ-MATUTE A I, RAMOS L, MART NEZ-CASTRO I, et al.Fractionation of honey carbohydrates using pressurized liquid extraction with activated charcoal[J].Journal of Agricultural and Food Chemistry, 2008, 56(18):8309-8313.
NEZ-CASTRO I, et al.Fractionation of honey carbohydrates using pressurized liquid extraction with activated charcoal[J].Journal of Agricultural and Food Chemistry, 2008, 56(18):8309-8313.
[11] SCHIEVANO E, SBRIZZA M, ZUCCATO V, et al.NMR carbohydrate profile in tracing Acacia honey authenticity[J].Food Chemistry, 2020, 309:125788.
[12] SERAGLIO S K T, SILVA B, BERGAMO G, et al.An overview of physicochemical characteristics and health-promoting properties of honeydew honey[J].Food Research International, 2019, 119:44-66.
[13] MORALES V, SANZ M L, OLANO A, et al.Rapid separation on activated charcoal of high oligosaccharides in honey[J].Chromatographia, 2006, 64(3):1-6.
[14] 连会. 旋光法测定蜂蜜中蔗糖、果糖和葡萄糖的含量[J].北京农业, 2011(6):7-8.LIAN H.Determination the contents of glucose, fructose and sucrose in honey with optical rotation[J].Beijing Agriculture, 2011(6):7-8.
[15] 田艳玲, 王浩, 张曼玲, 等.高效液相色谱法与化学法测定蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖含量的比较与研究[J].食品研究与开发, 2008, 29(8):126-129.TIAN Y L, WANG H, ZHANG M L, et al.Comparison and research of high-performance liquid chromatography and chemical method determination honey the fructose, glucose, sucrose, maltose content[J].Food Research and Development, 2008, 29(8):126-129.
[16] 赵芳. HPLC-RID法测定蜂蜜中果糖、葡萄糖、蔗糖、麦芽糖及乳糖含量[J].食品安全导刊,2021(33):92-94.ZHAO F.Determination of fructose, glucose, sucrose, maltose and lactosein honey by HPLC-RID[J].China Food Safety Magazine, 2021(33):92-94.
[17] 郑星, 王凯,薛晓锋, 等.高效液相色谱-示差折光检测法检测无刺蜂蜂蜜中海藻酮糖含量[J].食品科学,2022,43(16):217-225.ZHENG X, WANG K, XUE X F, et al.Determination of trehalulose in stingless bee honey by high performance liquid chromatography with refractive index detector[J].Food Science, 2022, 43(16):217-225.
[18] ZHOU J H, QI Y T, RITHO J, et al.Analysis of maltooligosaccharides in honey samples by ultra-performance liquid chromatography coupled with evaporative light scattering detection[J].Food Research International, 2014, 56:260-265.
[19] 贾茹, 黄学者, 贾光群, 等.超高效液相色谱-蒸发光散射检测法测定蜂蜜中12种糖组分[J].分析测试学报,2022,41(6):851-857.JIA R, HUANG X Z, JIA G Q, et al.Determination of 12 saccharides in honey by ultra high performance liquid chromatography coupled with evaporative light scattering detection[J].Journal of Instrumental Analysis, 2022, 41(6):851-857.
[20] NI C Z, ZHU B H, WANG N N, et al.Simple column-switching ion chromatography method for determining eight monosaccharides and oligosaccharides in honeydew and nectar[J].Food Chemistry, 2016, 194:555-560.
[21] SANZ M L, SANZ J, MART NEZ-CASTRO I.Gas chromatographic-mass spectrometric method for the qualitative and quantitative determination of disaccharides and trisaccharides in honey[J].Journal of Chromatography A, 2004, 1059(1-2):143-148.
NEZ-CASTRO I.Gas chromatographic-mass spectrometric method for the qualitative and quantitative determination of disaccharides and trisaccharides in honey[J].Journal of Chromatography A, 2004, 1059(1-2):143-148.
[22] 高文佳, 张海华, 马雪巍, 等.基于中红外光谱法快速检测蜂蜜中还原糖的研究[J].中国蜂业, 2017, 68(5):52-54.GAO W J, ZHANG H H, MA X W, et al.Study on rapid detection of reducing sugar in honey based on mid-infrared spectroscopy[J].Apiculture of China, 2017, 68(5):52-54.
[23] ÖZBALCI B, BOYACI ![]() H, TOPCU A, et al.Rapid analysis of sugars in honey by processing Raman spectrum using chemometric methods and artificial neural networks[J].Food Chemistry, 2013, 136 (3-4):1444-1452.
H, TOPCU A, et al.Rapid analysis of sugars in honey by processing Raman spectrum using chemometric methods and artificial neural networks[J].Food Chemistry, 2013, 136 (3-4):1444-1452.
[24] CONSONNI R, CAGLIANI L R, COGLIATI C.NMR characterization of saccharides in Italian honeys of different floral sources[J].Journal of Agricultural and Food Chemistry, 2012, 60(18):4526-4534.
[25] SCHIEVANO E, TONOLI M, RASTRELLI F.NMR quantification of carbohydrates in complex mixtures.A challenge on honey[J].Analytical Chemistry, 2017, 89(24):13405-13414.
[26] 丁海铭. 旋光计量测试技术[M].北京:中国计量出版社, 2009:11-29.DING H M.Polarimetric Metrology and Testing Techniques [M].China Metrology Publishing House, 2009:11-29.
[27] 吴彦蕾. 蜂蜜中葡萄糖、果糖和蔗糖含量测定方法比较研究[J].现代食品,2020,26(4):156-157;160.WU Y L.Comparative study on determination methods of glucose, fructose and sucrose in honey[J].Modern Food, 2020,26(4):156-157;160.
[28] CAMPOS G, DELLA-MODESTA R C, SILVA T J P, et al.Classificação do mel em floral ou mel de melato[J].Ciência e Tecnologia de Alimentos, 2003, 23 (1):1-5.
[29] URSULIN-TRSTENJAK N, LEVANIC D, GALIC A, et al.Confirming the botanical origin of the Croatian black locust honey (Istria region) using physicochemical parameters during two seasons[J].Journal of Hygienic Engineering &Design, 2014, 8:124-128.
[30] 崔颖, 肖亚兵, 贺艳, 等.蜂蜜中还原糖的测量不确定度评定[J].食品研究与开发,2014, 35(20):133-137.CUI Y, XIAO Y B, HE Y, et al.Evaluation of the uncertainties in the measurement of the content of reducing sugar in honey[J].Food Research and Development, 2014, 35(20):133-137.
[31] 张英,石雪萍,张卫明.HPLC-ELSD法与HPLC-RID法检测蜂蜜中糖分的比较[J].中国野生植物资源,2009,28(1):43-47. ZHANG Y, SHI X P, ZHANG W M.Comparison of HPLC-ELSD and HPLC-RID methods in detecting the sugar of honey[J].Chinese Wild Plant Resources, 2009, 28(1):43-47.
[32] 严衍禄. 现代仪器分析[M].北京:中国农业大学出版社,2010.YAN Y L.Modern Instrumental Analysis [M].Beijing:China Agricultural University Press, 2010.
[33] SILVA P, SILVA C L, PERESTRELO R, et al.Application of quality-by-design approach in the analytical method development for quantification of sugars in sugarcane honey by reversed-phase liquid chromatography[J].Food Analytical Methods, 2020, 13(8):1634-1649.
[34] JALALUDIN I, KIM J.Comparison of ultraviolet and refractive index detections in the HPLC analysis of sugars[J].Food Chemistry, 2021, 365:130514.
[35] MA C M, SUN Z, CHEN C B, et al.Simultaneous separation and determination of fructose, sorbitol, glucose and sucrose in fruits by HPLC-ELSD[J].Food Chemistry, 2014, 145:784-788.
[36] YAN S, WANG W Q, ZHAO W, et al.Identification of the maturity of Acacia honey by an endogenous oligosaccharide:A preliminary study[J].Food Chemistry, 2023, 399:134005.
[37] XIE Q, HUANG X Z, JI X X, et al.Comprehensive investigation of psicose in Chinese honeys and the assessment of its potential as a new marker for honey adulteration detection[J].Journal of Food Composition and Analysis, 2022, 108:104444.
[38] DU B, WU L M, XUE X F, et al.Rapid screening of multiclass syrup adulterants in honey by ultrahigh-performance liquid chromatography/quadrupole time of flight mass spectrometry[J].Journal of Agricultural and Food Chemistry, 2015, 63(29):6614-6623.
[39] VETROVA O V, KALASHNIKOVA D A, MELKOV V N, et al.Detection of honey adulterations with sugar syrups by stable isotope mass spectrometry[J].Journal of Analytical Chemistry, 2017, 72(7):756-760.
[40] 卢佩章. 色谱理论基础[M].上海:华东化工学院出版社,1986.LU P Z.Fundamentals of Chromatography Theory [M].Shanghai:East China University of Science and Technology Press, 1986.
[41] 蔡小钦, 侯美玲, 赵博, 等.离子色谱法测定蜂蜜中松二糖含量[J].食品安全质量检测学报,2022, 13(9):2901-2906.CAI X Q, HOU M L, ZHAO B, et al.Determination of turanose in honey by ion chromatography[J].Journal of Food Safety &Quality, 2022, 13(9):2901-2906.
[42] ZHANG J L, HUNGERFORD N L, YATES H S A, et al.How is trehalulose formed by Australian stingless bees? -an intermolecular displacement of nectar sucrose[J].Journal of Agricultural and Food Chemistry, 2022, 70(21):6530-6539.
[43] TERRAB A, VEGA-PÉREZ J M, D EZ M J, et al.Characterisation of northwest Moroccan honeys by gas chromatographic-mass spectrometric analysis of their sugar components[J].Journal of the Science of Food and Agriculture, 2002, 82(2):179-185.
EZ M J, et al.Characterisation of northwest Moroccan honeys by gas chromatographic-mass spectrometric analysis of their sugar components[J].Journal of the Science of Food and Agriculture, 2002, 82(2):179-185.
[44] BROKL M, SORIA A C, RUIZ-MATUTE A I, et al.Separation of disaccharides by comprehensive two-dimensional gas chromatography-time-of-flight mass spectrometry.Application to honey analysis[J].Journal of Agricultural and Food Chemistry, 2010, 58(22):11561-11567.
[45] RUIZ-MATUTE A I, RODR GUEZ-S
GUEZ-S NCHEZ S, SANZ M L, et al.Detection of adulterations of honey with high fructose syrups from inulin by GC analysis[J].Journal of Food Composition and Analysis, 2010, 23(3):273-276.
NCHEZ S, SANZ M L, et al.Detection of adulterations of honey with high fructose syrups from inulin by GC analysis[J].Journal of Food Composition and Analysis, 2010, 23(3):273-276.
[46] 严衍禄. 近红外光谱分析基础与应用[M].北京:中国轻工业出版社, 2005.YAN Y L.Fundamentals and Applications of Near Infrared Spectroscopy Analysis [M].Beijing:China Light Industry Press, 2005.
[47] DOWNEY G, FOURATIER V, KELLY J D.Detection of honey adulteration by addition of fructose and glucose using near infrared transflectance spectroscopy[J].Journal of Near Infrared Spectroscopy, 2003, 11(6):447-456.
[48] GUELPA A, MARINI F, DU PLESSIS A, et al.Verification of authenticity and fraud detection in South African honey using NIR spectroscopy[J].Food Control, 2017, 73:1388-1396.
[49] ÖZBAY M, ARSLAN F N, GÖRÜR G, et al.Qualitative and quantitative detection of monofloral, polyfloral, and honeydew honeys adulteration by employing mid-infrared spectroscopy and chemometrics[J].Food Analytical Methods, 2022, 15 (8):2274-2289.
[50] 张广琪, 甘芝霖, 杨阳, 等.基于红外光谱技术的蜂蜜理化性质快速检测[J].农业工程学报,2023, 39(10):275-284.ZHANG G Q, GAN Z L, YANG Y, et al.Rapid detection of the physicochemical properties of honey based on infrared spectroscopy[J].Transactions of the Chinese Society of Agricultural Engineering, 2023, 39(10):275-284.
[51] 谢有超, 彭黔荣, 杨敏, 等.近红外光谱技术在蜂蜜检测中的应用[J].食品工业科技, 2020, 41(12):334-341.XIE Y C, PENG Q R, YANG M, et al.Application of near infrared technology in the determination of honey[J].Science and Technology of Food Industry, 2020, 41(12):334-341.
[52] 陶少华, 刘国根.现代谱学[M].北京:科学出版社, 2015:128-134. TAO S H, LIU G G.Modern Spectroscopy[M].Science Press, 2015:128-134.
[53] DAFERERA D J, TARANTILIS P A, POLISSIOU M G.Characterization of essential oils from Lamiaceae species by Fourier transform Raman spectroscopy[J].Journal of Agricultural and Food Chemistry, 2002, 50(20):5503 - 5507.
[54] 苏东林,张欣,李高阳,等.拉曼光谱结合化学计量学方法测定蜂蜜的主要糖分[J].中国食品学报,2016,16(11):263-272.SU D L, ZHANG X, LI G Y, et al.Quantification of main sugar content of honey using Raman spectroscopy and chemometrics[J].Journal of Chinese Institute of Food Science and Technology, 2016, 16(11):263-272.
[55] 张欣. 近红外和拉曼光谱法测定蜂蜜掺假研究[D].长沙:中南大学,2011.ZHANG X.Studies on discrimination of honey adulteration by near infrared and Raman spectroscopy[D].Changsha:Zhongnan University, 2011.
[56] HOLZGRABE U.Quantitative NMR spectroscopy: Principles and applications[J].Journal of Pharmaceutical and Biomedical Analysis, 2005, 38(5):797.
[57] 朱明华. 仪器分析[M].北京:高等教育出版社,2000.ZHU M H.Instrumental Analysis[M].Beijing:Higher Education Press, 2000.
[58] LOW N H, BRISBANE T, BIGAM G, et al.Carbon-13 nuclear magnetic resonance for the qualitative and quantitative analysis of structurally similar disaccharides[J].Journal of Agricultural and Food Chemistry, 1988, 36(5):953-957.