花生是世界重要的经济及营养作物,富含油脂和蛋白质,同时含有糖类、膳食纤维、维生素和微量元素等多种人体所需的营养物质[1]。目前我国花生年产量在1 900万t以上,其中52%用于榨油,会产生大量的副产物——花生粕。花生粕中含有47%~55%的蛋白质,是植物性蛋白质的良好来源[2]。与天然蛋白质相比,花生肽成本低、安全性较高且吸收速度快、能量消耗低[3]。不仅具有抗氧化活性和血管紧张素转换酶抑制活性[4],还具有金属螯合活性,目前已经有多项关于花生肽与金属离子螯合的研究,如花生肽钙螯合物[5]、花生肽亚铁螯合物[6]、花生肽锌螯合物[7]等。
金属离子在人体内发挥着重要的生理作用,如维持体液平衡、参与骨骼构成、调节神经肌肉兴奋性[8]、作为酶的辅基或激活剂,参与体内多种生化反应等[9],目前已发现约20种金属元素对人体的电解质平衡、结构和功能等起着关键性作用[10]。金属离子的缺乏或过量都可能导致健康问题,所以应该适当补充。部分常见金属离子的生理意义及其补充剂如表1所示。
表1 部分金属离子的生理意义及其补充剂
Table 1 Physiological significance and their supplements of metal ions

金属离子生理意义补充剂参考文献Ca2+参与细胞代谢、神经传导、骨骼生长、肌肉收缩、心脏功能、细胞增殖以及免疫反应无机钙(氧化钙、碳酸钙、氯化钙等)、有机钙(乳酸钙、葡萄糖酸钙、枸橼酸钙等)[11-12]Fe2+参与氧气运输、能量代谢;与多种蛋白质的正常功能相关(DNA合成、线粒体呼吸、血红蛋白合成)无机铁(氯化亚铁、硫酸亚铁、碳酸亚铁等),有机铁(葡萄糖酸亚铁、山梨醇铁、乳酸亚铁等)[13]Zn2+与某些激素(如睾酮)的合成、抗氧化、应对运动诱发的氧化应激、肌肉生长、能量产生以及免疫系统正常功能等相关无机锌(如硫酸锌、氯化锌、硝酸锌等)、有机酸锌(如葡萄糖酸锌、醋酸锌、氨基酸锌等)[14-15]Mg2+参与骨骼、肌肉、软组织和器官的形成;与高血压和抑郁症等疾病相关无机镁(氧化镁、氯化镁、硫酸镁等)、有机镁(柠檬酸镁、葡萄糖酸镁、甘氨酸镁等)[16-17]K+参与细胞代谢、激素分泌以及蛋白质和糖原合成的调节、具有维持酸碱平衡、调节渗透压的功能、与神经冲动传导以及肌肉收缩有关无机钾(硫酸钾、氯化钾、碳酸钾等)、有机钾(门冬氨酸钾、谷氨酸钾、枸橼酸钾等)[18]
随着社会经济的快速发展,人们的饮食习惯由粗放型逐步转变为精细型,然而精深加工往往会造成金属离子的大量流失,导致居民从膳食中获取的金属离子严重不足。有调查研究显示中国15省18~35岁成年人金属离子膳食摄入量大体呈下降趋势,膳食磷、镁、铁、锌和铜存在摄入不足风险的人群比例呈现逐年上升趋势,各调查年份存在钙摄入量不足风险的人群比例维持在90%以上[19]。金属离子缺乏的问题日渐受到政府重视,但受价格和宗教等限制,丰富饮食以解决金属离子缺乏的问题并不可行,并且某些食物还含有抗营养因子,会抑制金属离子的吸收[20],因此无机金属离子补充剂开始走进大众视野。它是一种可持续且经济的补充途径,但近些年的研究表明,长期过量食用无机金属离子补充剂会使其在人体内积累而产生毒性,从轻微的不适到严重影响肝脏、大脑和代谢等疾病[21]。此外,当无机金属离子以游离形式存在时,会释放游离活性氧而加剧毒性,并且长期过量食用无机金属离子还会导致代谢性酸中毒[22]。
为解决这些问题,近年来,关于肽的营养功能和生物活性的研究逐渐增多,对肽螯合金属离子的研究受到广泛关注,这种方法能够提高金属离子的生物利用度和安全性,降低风险,确保这些必需营养素在人体内被有效利用。由于食源性肽金属离子螯合物兼具功能性和营养性,研究普遍认为肽金属离子螯合物是当前较为理想的新型金属元素补充剂,极具发展潜力。本文对花生肽金属离子螯合物的最新研究进展进行综述,主要包括花生金属离子螯合肽的制备及分离纯化、影响花生肽螯合能力的因素、螯合机制以及促进金属离子吸收和提高金属离子生物利用率的效果,以期对未来金属离子补充剂的研究提供参考。
1 花生金属离子螯合肽的制备及分离纯化
花生肽金属离子螯合物是由花生肽与金属离子通过配位键结合形成的一种化合物。其制备通常是先由花生蛋白制备得到多肽,再将多肽分离纯化出高螯合率的部分,最后通过与金属离子之间的配位作用结合形成化合物。
1.1 花生金属离子螯合肽的制备
目前,花生肽的制备方法主要包括微生物发酵法、酸法、碱法、蛋白酶水解法、化学合成法以及DNA重组技术等。其中化学合成法和DNA重组技术通常涉及许多副反应且成本较高[23-24],不适宜大规模生产。目前,国内对于花生肽的研究重点在于通过对制备工艺条件的优化来获取具有某种目标特定功能的花生肽。以下选取酶解法和微生物发酵法以及化学合成法进行花生肽制备方法的概述。
1.1.1 酶解法
酶解法是制备花生肽最常用的方法。通过使用特定的单一酶或复合酶,选择合适的酶解时间、温度、加酶量和pH值,对蛋白质进行酶解而获得多肽,还可以适当调节酶解条件来获得具有不同活性的多肽。常用的酶有胃蛋白酶、胰蛋白酶、木瓜蛋白酶、中性蛋白酶、碱性蛋白酶以及风味蛋白酶等,不同酶的酶切位点存在差异。花生肽的酶解工艺根据蛋白酶的选择,可以分成单酶解法、双酶解法以及复合酶解法。为提高花生肽的产品质量,目前大多利用复合酶解法。王孟丽[25]分别用单酶酶解、双酶同步酶解以及双酶分步酶解3种酶解方法来制备花生肽酶解液,结果发现双酶分步酶解法制备的花生肽钙螯合率最高。总之,酶解法是改善蛋白质功能和营养性能最常用的方法,尽管具有反应温和、提取率高、副反应产物少、对蛋白质结构和活性的损害小等优点[23],但因其成本高、产量低,且食品级酶的选择有限的缺点使其在实际应用中受限[26]。
为了提高酶解效率,往往对原料蛋白进行预处理,以提高酶解产生的多肽的生物活性。WANG等[27]在酶解前对蛋白进行了超声预处理,然后再用碱性蛋白酶酶解,结果表明,超声预处理可以暴露酶解的活性位点,提高酶解的效率,而且还显著提高了蛋白水解物的脱氧能力和羟自由基清除能力。此外,超高压和微波处理也有助于提高蛋白质酶解的效率[28]。
1.1.2 微生物发酵法
在微生物发酵过程中,微生物菌株的生长与代谢会产生蛋白酶,在适宜的条件下这些蛋白酶可以将大分子底物蛋白质水解为小分子多肽。枯草芽孢杆菌、地衣芽孢杆菌、曲霉和乳酸菌是发酵过程中的主要细菌。ZHANG等[29]通过枯草芽孢杆菌发酵花生粉制备出抗氧化性能较好的花生肽,并发现在水解度为21.41%时,可有效减少或防止食品中的脂质氧化,延缓有毒氧化化合物的形成,保持营养价值,延长食品的保质期。ZHANG等[30]采用枯草芽孢杆菌发酵花生粕制备抗氧化肽,通过6种体外实验评估其抗氧化活性,结果表明,不同浓度下的花生肽对多种自由基均有一定清除效果,对亚油酸自氧化有抑制作用,还原能力和金属螯合能力也有体现。微生物发酵法的优点在于过程中产生的外肽酶可以作用于多肽链的末端,将引起苦味的疏水性氨基酸残基切除从而去除苦味,微生物代谢过程不仅可以通过产生复合酶来释放活性多肽,而且细菌自身也可以合成并分泌肽类物质[31],从而得到更多的肽产物,而酶解法会产生主要由疏水性氨基酸构成的小分子肽,导致形成苦味[32]。目前微生物发酵法制备多肽的研究仍然处于起步阶段,且有许多产酶菌株会产生微量毒素,生产过程中蛋白质的利用率会降低。因此,将此法进行实际运用时还需要多考虑其安全性及生产效率的问题。
1.1.3 化学合成法
化学合成主要通过氨基酸缩合来实现。当合成原料中包含官能度大于2的氨基酸单体时,为获得具有特定序列的合成多肽,应暂时保护不需要反应的基团,然后进行连接反应以确保目标序列多肽的合成[33]。固相合成和液相合成是化学合成肽的2种主要方法。固相合成是将目标多肽的C末端氨基酸通过共价键连接到一个不溶性的固相载体(如树脂)上,按照氨基酸的序列顺序,从C末端向N末端逐个添加氨基酸。每添加1个氨基酸,都要进行一系列的化学反应,包括脱保护、活化和偶联等步骤[34]。LI等[35]用高效液相色谱法确定出锌螯合率较高的肽序列,并通过计算机模拟预测物理化学性质和安全性之后,通过化学合成了该序列的多肽。它是效率极高的一种方法,因为它容易去除掉未反应的试剂,并且由于存在保护基团,在这种方法中能防止侧基发生反应。液相合成的效率较低,但仅可用于较大和难以合成的肽。这两种方法对肽的合成都至关重要,对它们的选择取决于具体的肽和应用所需。化学合成法的优点是能够生产具有特定序列的肽链,但同时也伴随着一些挑战,如复杂的设计和操作程序、高昂的生产成本以及复杂的纯化步骤等[36]。目前,合成肽已成为肽类药物研究与开发的主流趋势,不过在食品领域,更多的还是把目标活性肽从食物基质当中分离获取,化学合成法更多地被当作深入研讨的一种方式。
综合比较上述3种方法,酶解法最佳,因为酶解法的技术成熟,大量酶解方法研究和实践积累了丰富的工艺参数调控经验,能根据需求灵活制备不同活性的花生肽。而且这种方法对蛋白质结构和活性损害小,有利于保持花生肽原有的营养特性。通过复合酶解法等手段能进一步提升产品质量,提高花生肽与金属离子的螯合率。虽然酶解法存在成本高、产量低等缺点,但相较于微生物发酵法可能产生微量毒素、蛋白质利用率低以及化学合成法的高昂成本和复杂操作,酶解法的问题在现有技术改进和成本控制手段下相对更容易克服,从而在大规模生产中具有更高的可行性。
1.2 花生金属离子螯合肽的分离纯化
花生蛋白酶解后得到的产物非常复杂,不同多肽组分的结构使它们跟各种金属离子相结合的方式和结合量不同。为了获取高纯度的目标多肽,需要依照金属离子结合能力的强弱运用各类分离技术从酶解的混合物里分离提纯出具有高金属离子螯合活性的多肽。
目前多肽的分离方式纷繁众多,其中超滤、大孔吸附树脂色谱、凝胶层析色谱、固相金属亲和层析、离子交换色谱以及反向高效液相色谱等最为多见[37]。但仅依靠一种手段进行分离难以取得理想的效果,因而在实际操作过程中往往将多种技术结合来获取目标多肽。LI等[7]用超滤法将所得花生肽初步分为3个分子质量不同的组分,筛选出锌螯合率最高的组分后进一步采用Sephadex G-25色谱二次分离,连续2次分离纯化后,花生肽与锌离子的螯合率最高可达65.38%。BU等[38]采用超滤、凝胶过滤色谱和离子交换色谱结合的手段,分离了与亚铁离子螯合率较高,可达90.7%的花生肽。WANG等[39]使用凝胶过滤色谱法从花生蛋白水解物中纯化出一种新型钙结合肽,其钙结合量达到(15.67±0.39) mg/g。于丽颖[40]利用超滤法和Sephadex G-25凝胶色谱法对小于3 kDa组分的多肽进行分离纯化,从而得到具有目标功能特性的花生肽。张春芝等[41]先运用酸化法对花生肽进行脱酰胺处理,初步提高了对钙的结合能力,然后又凭借大孔树脂DM301对脱酰胺花生肽予以富集使其钙结合能力进一步增强。BAO等[42]将水解后得到的葵花籽蛋白和花生蛋白进行超滤,分离出≤1、1~3、3~5、5~10和≥10 kDa 5个组分,发现分子质量在1~3 kDa和≥10 kDa分别显示出最高的钙结合能力。
2 影响花生肽螯合能力的因素
花生肽能够和金属离子螯合是因为其小分子结构和含有大量能与金属离子结合的氨基酸(例如组氨酸的咪唑基、半胱氨酸的巯基等)。已经有研究指出花生肽的分子质量、氨基酸组成及序列等自身因素会影响其螯合能力[38],此外,酶制剂的选择以及酶解和螯合条件等外界因素也会对其螯合能力造成影响[1]。
2.1 自身因素
2.1.1 花生肽的分子质量
不同分子质量的花生肽与不同金属离子的螯合能力不同。BU等[43]将花生肽用凝胶过滤色谱法进行分离,花生蛋白酶解物被分为2个不同的组分,发现分子质量较小的组分与钙的螯合率更高。说明分子质量大小对螯合率存在一定影响,分子质量小的钙螯合率较高。LI等[7]的研究通过超滤法将水解后的花生肽分为3个分子质量不同的组分,得出结果分子质量<3 kDa的组分与锌离子的螯合率最高。这一发现与遆光慧[44]的研究相一致。BU等[38]进一步将分子质量细化,发现当肽的分子质量约为1 kDa时,显示出良好的亚铁结合能力。多肽相对分子质量的大小是相对的,具有高螯合率的肽分子质量大多在500~1 500 Da。
目前的大多数研究均表明分子质量相对较小的花生肽与金属离子的螯合效果会更好,但是不同研究中最适合进行螯合的肽分子质量存在一定差异。这可能是由于花生肽来源的花生品种、分离纯化肽的方法、与花生肽螯合的具体金属离子的差异,以及评价金属离子螯合活性方法的不同等造成的,继续提高花生肽与不同金属离子的螯合能力还有待进一步探索。
2.1.2 花生肽的氨基酸组成及排序
花生肽与金属离子螯合的能力不仅与花生肽的分子质量有关,与其氨基酸的组成及排序也有关系。一般情况下,能够参与螯合的肽段中氨基酸包括组氨酸、半胱氨酸、谷氨酸和天冬氨酸等氨基酸。BU等[43]对花生肽与钙离子螯合的研究在螯合率较高的组分中鉴定出NLAGNHEQEFLR、NAEFNEIR、YDEEDRRR、YEEPAQQGR、DQSQQQQDSHQKVR以及NN-NDNQLDQFPR 6种肽段,发现金属离子钙结合肽通常含有较多的天冬氨酸、谷氨酸和精氨酸,且多肽与钙离子结合后酸性氨基酸的含量提高,表明花生肽与钙离子结合依赖于酸性氨基酸。SUN等[45]的研究表明,酸性氨基酸和碱性氨基酸均参与了肽锌螯合物的形成。对于亚铁离子螯合率较高的肽段往往酸性氨基酸的含量更高或者包含连续相同的氨基酸,且即使氨基酸种类相同但序列不同也会影响肽与亚铁离子的结合能力[46]。BU等[38]对花生亚铁螯合肽的分离、鉴定及螯合机理的研究中,采用分子对接模拟,表明肽段中氨基酸与亚铁离子的结合能随时间变化,且在模拟4种肽段与亚铁离子螯合的过程中,肽段中的谷氨酸和精氨酸在此过程中对结合能的贡献比其他氨基酸更多,并且指出酸性氨基酸、碱性氨基酸、极性氨基酸和非极性氨基酸都可以提供受体与亚铁离子螯合。此外,经过纯化后的肽段中疏水性氨基酸可以提供更多的螯合空间[47]。
2.2 外界因素
通过酶解法制备花生肽时,会暴露出肽段的结合位点,使其能够与金属离子螯合。但是各种酶的酶切位点不同,会影响蛋白酶解物和金属离子的螯合程度。张春芝等[41]在花生肽钙螯合物的制备研究中,对Alcalase 2.4L碱性蛋白酶、Neutrase 0.8 L中性蛋白酶、Protamex复合蛋白酶、FlavourzymeTM蛋白酶、木瓜蛋白酶、酸性蛋白酶、Corolase®LAP外切蛋白酶以及ProteAXH肽酶进行筛选和复合,结果表明Alcalase 2.4L碱性蛋白酶的单独酶解效果最好且与钙离子的结合能力最强,将其与ProteAXH肽酶进行复配后钙离子的结合能力达到84.09 mg/g。李晨等[48]研究发现,在酶解2 h时,胰蛋白酶水解物表现出较高的锌螯合能力,且在底物浓度3%、酶解温度50 ℃、pH值为6、酶解时间2 h条件下,花生肽的锌螯合率为52.71%。因此,酶制剂的筛选、复配以及酶解条件的控制对于花生肽与金属离子的螯合非常重要。除蛋白酶的种类外,花生肽与金属离子螯合时的条件,包括pH、温度、时间、肽盐比以及与其螯合的金属离子种类等也会影响其螯合能力。遆光慧[44]制备花生肽亚铁螯合物时在pH值为8.0、时间30 min,温度38 ℃、肽铁质量比3.2∶1时实现了67.1%的最大亚铁离子螯合率。王孟丽[25]同样也研究了这些条件对花生肽钙螯合物制备的影响,得出pH值为7.5、时间50 min、温度47 ℃、肽钙质量比7.2∶1的条件下得到的肽钙螯合率最大为75.26%。
总而言之,无论是花生肽的自身因素还是外界因素都对其螯合金属的能力有重要影响,优化这些因素对于提高螯合效率至关重要。此外,不同来源的金属离子对肽螯合能力也可能存在一定影响,但关于这方面的研究很少,未来需要多对此展开研究。
3 花生肽金属离子的螯合机制
目前,研究花生肽是否与金属离子进行螯合及其螯合机制的明确主要是通过荧光光谱、傅里叶变换红外光谱以及扫描电镜等方法来进行。花生肽与金属离子发生螯合的前提条件是其能够提供电子对[49],在一定的pH条件下,羧基可以失去质子带负电,与带正电的金属离子结合。
3.1 花生肽与金属离子的结合位点
多肽能够与金属离子结合是因为它特殊的官能团并且具有多样的空间结构,比如螺旋、折叠等结构,这些结构可以创造出特定的微环境,给金属离子提供结合位点,从而形成稳定结构。目前已经通过傅里叶红外光谱、X射线衍射和核磁共振等多种现代分析技术确定肽和金属离子之间的分子间作用力是通过氢键、静电相互作用、配位键和疏水相互作用产生的[50]。目前的研究表明,花生肽与金属离子结合官能团主要为氨基、羧基、羟基以及羰基等,这些官能团中的孤对电子可以与金属离子的空轨道形成配位键,从而实现与金属离子的螯合,形成稳定结构,参与螯合的金属离子不同,其螯合位点也存在差异,如表2所示。目前对于肽与金属离子结合位点的研究尚浅,其结构关系和动力学过程还需要进一步的探索。
表2 花生金属离子螯合肽的结合位点
Table 2 Binding sites for peanut metal ion chelating peptides

螯合金属离子制备方法螯合能力/%分子质量(u)结合位点文献Fe2+酶解法90.7500^1 500氨基、羧基、羰基[38,51]Ca2+酶解法81.4±0.8<3 000氨基、羧基[42-43]Zn2+酶解法53.01±1.61<3 000羟基、氨基、羧基[14]
3.2 花生肽与金属离子的螯合模式
单齿、双齿、三齿、桥接和α模式通常被认为是典型的螯合模式[52],如图1所示。不同金属离子的螯合模式存在差异,相同的金属离子在不同基团上的螯合模式也有所不同。钙离子与肽上的羧酸基团螯合的主要模式是单齿、双齿和α模式[53]。有相关研究指出,源自太平洋鳕鱼骨的一种十肽跟钙离子存在3种结合模式,分别是单齿、双齿以及α模式[54]。而磷酸基团与钙离子的结合则是通过单齿、双齿和三齿这3种模式,具体取决于磷酸基团或参与结合的其他基团的数量[49]。LUO等[55]采用分子动力学来可视化酪蛋白磷酸肽的结合模式。钙结合位点包括谷氨酸残基的羰基和磷酸丝氨酸残基的磷酸基团,并且观察到了所有3种螯合模式。类似的,在一项肽铁螯合物的研究中同样也采取这种方法,表明亚铁离子以单齿和双齿螯合模式与Glu-Glu残基的羧基氧原子螯合[56]。LIN等[57]在研究锌离子螯合模式的表征以及促进Caco-2细胞中锌离子转运的潜在机制中,发现在GFLGSP肽序列的第6个氨基酸残基中锌离子和羧基氧原子之间是通过双齿模式进行螯合的。BU等[38]的分子动力学模拟结果表明花生肽中谷氨酸、精氨酸和赖氨酸侧链中的氧原子;甘氨酸、苏氨酸和苯丙氨酸主链上的氧原子与亚铁离子配位(图2),另外,还发现了水分子中的氧原子也参与了亚铁离子的螯合。
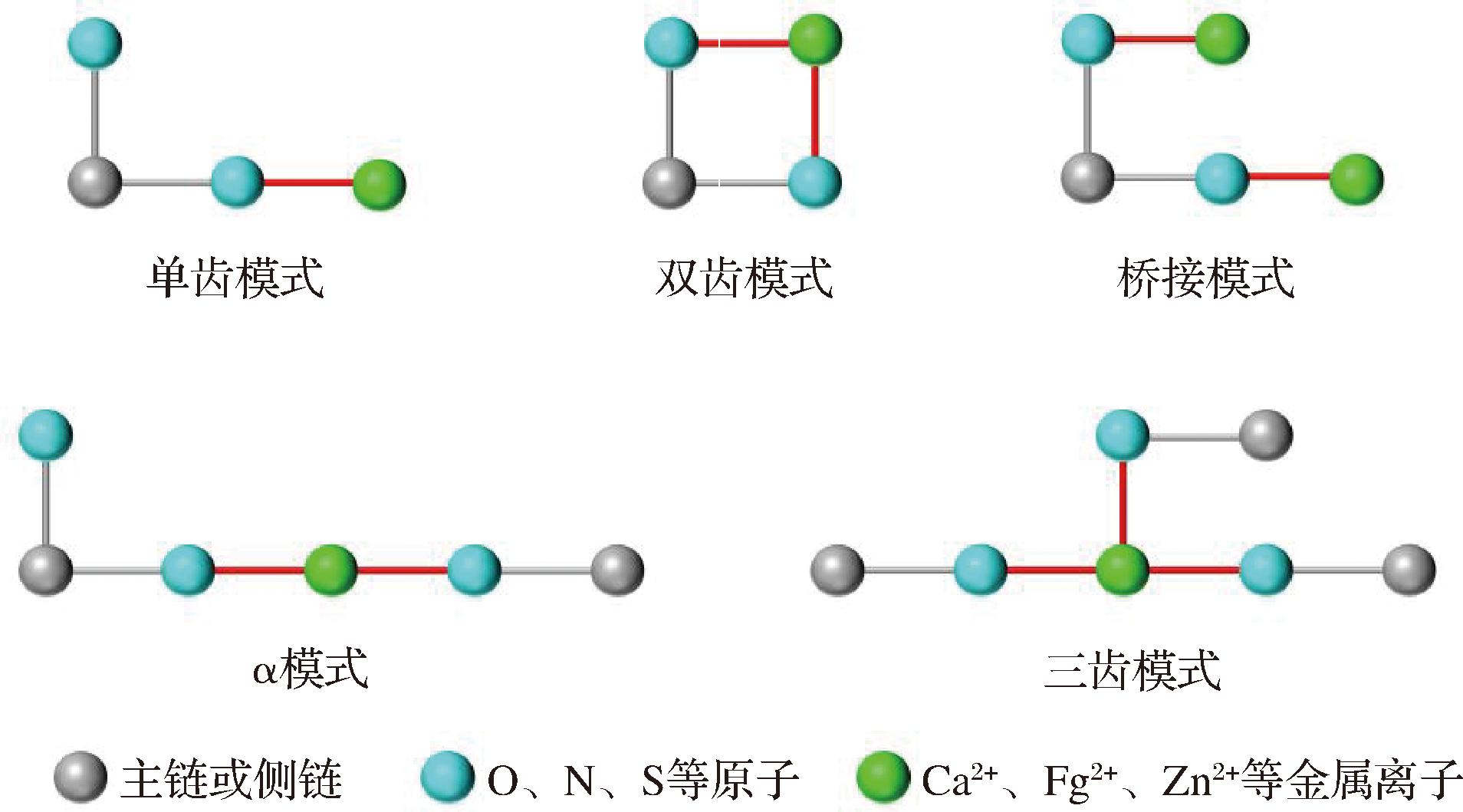
图1 多肽与金属离子典型的螯合模式
Fig.1 Typical chelation patterns of peptides with metal ions
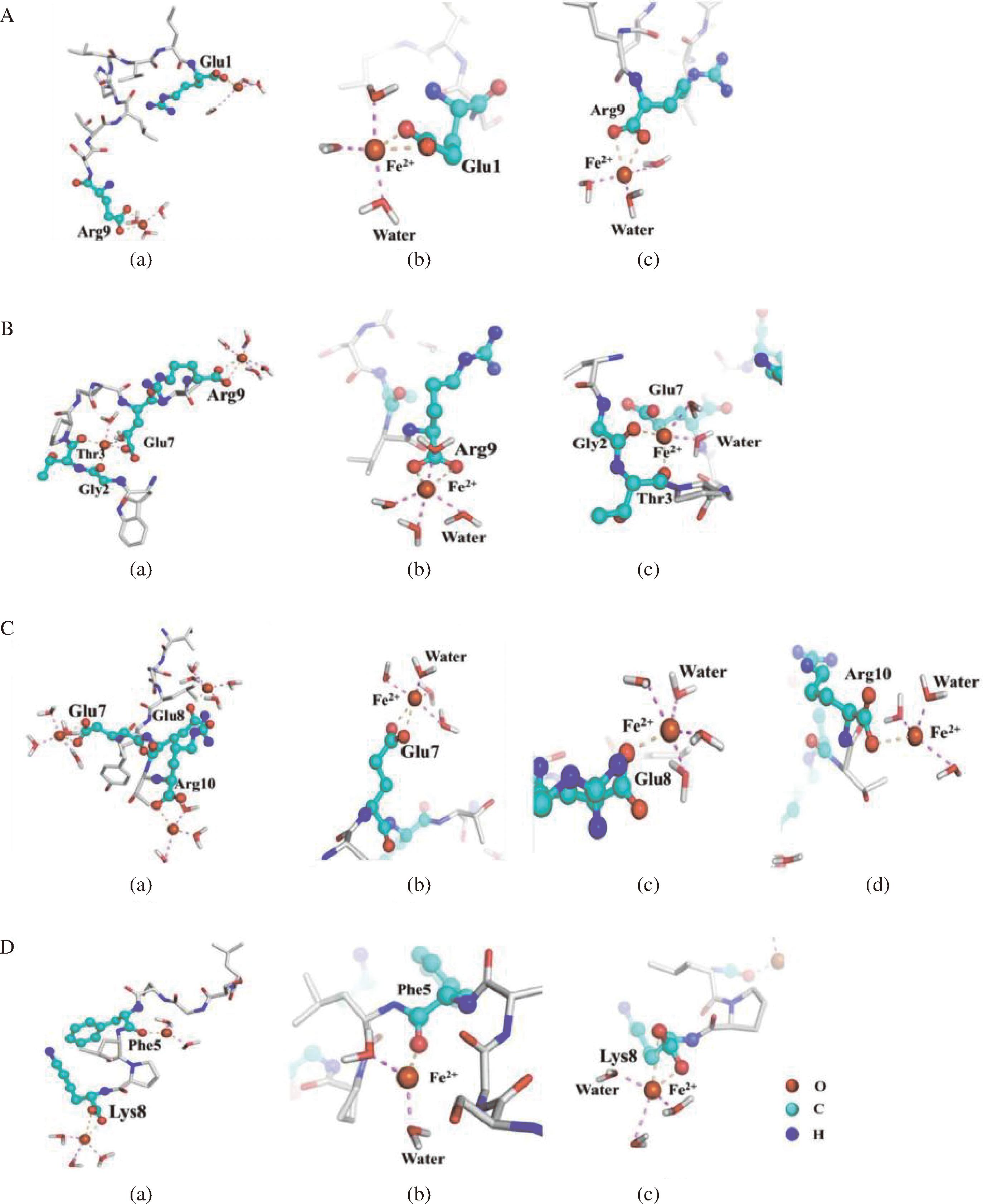
A-ESTLHLVLR模式;B-WGTPGSEVR模式;C-ISGLIYEETR模式;D-LSGSFLPK模式
图2 亚铁离子与肽段的结合模式
Fig 2 The binding mode of Fe2+ to peptides
注:(a)为整个肽段的结合模式图;(b)、(c)、(d)为局部放大图。
国内关于肽和金属离子在不同结合位点上的螯合模式目前只是局限于参与螯合的基团以及特殊的氨基酸分析,因此,需要进一步加深对肽与金属离子螯合机制的研究。
4 花生肽金属离子螯合物的生物利用度
金属离子的生物利用度是指其被生物体吸收、转运并发挥生理功能的程度。一般包括摄入、吸收以及转运这几个过程。现有的商业金属元素补充剂的溶解性差、生物利用度低且对胃肠道的刺激性大[52],而食品来源的肽金属离子螯合物可以通过小肠上皮细胞上的肽转运蛋白(如PepT1和PepT2)和细胞膜内吞作用轻松转运到细胞内,还能防止金属离子在消化道中沉淀,从而提高其吸收和利用率[58-60]。此外,食品来源的肽金属离子螯合物在改善肠道微生物群等方面更安全、成本也更低[50]。与无机金属离子补充剂相比,肽金属离子螯合物表现出更好的溶解度和生物利用度,对人体的刺激更低[61]。目前,评价金属离子生物利用度的方法主要有体外模拟消化、Caco-2细胞模型和动物体内实验[62],肽与金属离子螯合后生物利用度得到明显提高。
4.1 体外模拟消化
在消化过程中,由于胃蛋白酶和胰蛋白酶的降解以及环境pH的改变,肽金属离子螯合物会被分解为小肽和游离氨基酸,所以如果螯合物要作为新一代膳食金属离子补充剂,还需要研究其经过消化后金属离子保留率。遆光慧[44]对花生肽铁螯合物进行体外模拟消化,结果表明在胃部进行消化时,亚铁离子的保留率会下降,螯合物的稳定性变弱;但在肠部消化时,亚铁离子会和肽段重新进行螯合,保留率也随之提高。不溶性化合物不能被小肠黏膜细胞吸收,在体内没有营养价值。因此,肽金属离子螯合物的溶解性是体内金属离子补充剂生物利用度的一个重要影响因素[63]。LI等[35]制备的肽锌螯合物具有优异的热稳定性和溶解性,用胰蛋白酶和胃蛋白酶对其进行模拟消化后,发现螯合物的锌溶解度与消化前仍保持相当,且远高于葡萄糖酸锌和硫酸锌。除了溶解性之外,其他的共存食物成分对螯合物或许存在不同程度的影响。王孟丽[25]的研究表明乳糖和氯化钠对花生肽钙螯合物的稳定性没有显著影响,而粗纤维则会降低螯合物的稳定性。
4.2 螯合物促进金属离子的吸收
Caco-2细胞模型用于模拟人体对金属离子生物利用的第二阶段(即吸收),是最常用于检查金属离子运输和摄取的细胞模型[62]。Caco-2细胞在无菌培养中能够持续分化为顶侧和基底侧小肠绒毛。它的表面形态和功能性酶表达与人类小肠细胞相似,且具有与小肠上皮细胞类似的转运系统[42]。因此,可用于评估金属离子的吸收。WANG等[39]利用Caco-2细胞模型测定花生肽钙螯合物和氯化钙在120 min内肠外液和肠内液中的钙含量来探究螯合物的促钙吸收能力。研究发现,在肠外液中氯化钙组的钙含量是肽钙螯合物组的3.09倍,但在小肠吸收120 min后,肽钙螯合物组肠内液中钙含量达到9.31 mg/g,是氯化钙组3.37 mg/g的2.76倍。表明肽钙螯合物的促钙吸收能力远高于氯化钙。在BU等[43]的研究中,花生肽钙螯合物经过模拟胃肠道消化后,也通过该细胞模型探究了在肠道中的钙转移量、生物利用度及其促进钙吸收的特性,实验通过测定细胞模型中AP侧和BL侧中钙离子浓度,比较氯化钙溶液与花生肽钙螯合物溶液的在两侧钙浓度变化,发现花生肽钙螯合物的生物利用度为(58.4±0.5)%,远高于氯化钙的(37.0±0.4)%,表明花生肽钙螯合物能有效促进肠道对钙的吸收。BAO等[42]的研究不仅表明肽钙螯合物能够促进钙的吸收,而且确定了转运机制为主动运输和被动运输2种,且以主动运输为主。虽然Caco-2细胞系建模是评估金属离子生物利用度的一种有用且相对准确的工具,但与简单的胃肠道消化模型相比,成本较高,技术要求也更严格。此外,由于Caco-2细胞源自结肠癌,细胞在体内正常的代谢过程的参与度仍存在一定争议。因此,对于肽金属离子螯合物生物利用度的研究仍需进一步的探索。
体内实验模型较为复杂,主要通过观察动物模型或人类志愿者消化后金属离子的生物利用度实现[62]。人体实验虽然可信度最高,但其所需成本高、耗费时间长,可能会涉及伦理问题以及存在很多不确定性因素等,因此并不常用。动物模型试验一般包括大鼠、小型猪以及家兔等。在YUAN等[64]的研究中,以雄性小鼠为实验对象,发现喂食肽钙螯合物组的小鼠骨干重、骨密度以及骨骼的柔韧性显著高于对照组和喂食碳酸钙组的小鼠,且会随着螯合物剂量的增加而增加,对照组骨表面存在明显的裂缝和凸起结构,骨形成过程受到抑制,碳酸钙组中这种情况存在较少,肽钙螯合物组骨骼的裂纹和凸起结构进一步减少,这些结果表明肽钙螯合物可以有效促进钙在骨骼中的积累,促钙吸收效果显著,可用作潜在的新型钙补充剂。LI等[65]将鸭蛋清肽与亚铁离子进行螯合,通过动物试验发现螯合物可以显著改善缺铁性贫血大鼠的健康状况并增加其体重,且无任何副作用,表明鸭蛋清肽能够显著提高铁的生物利用度。鸭蛋清肽铁螯合物可以作为一种铁添加剂应用于患有营养缺乏症的人群。
花生肽和金属离子形成螯合物之后,金属离子受到配体的保护,稳定性增强。螯合物进入小肠细胞后,肽可以作为金属离子的运输载体直接透过肠壁快速地被小肠膜吸收。但螯合物中的金属离子在人体内的生物利用度仍需通过人体临床试验进一步验证。同时,过量金属离子对免疫系统存在负面影响,还应当开展避免超负荷使用肽金属离子螯合物的相关研究。
5 结论与展望
金属元素在人类健康中发挥着关键作用,因此国内外对肽金属离子螯合物的研究日益增多。本文综述了近年来花生肽金属离子螯合物研究进展,主要介绍了花生肽的制备、分离纯化方法、影响其螯合能力和生物利用度的因素及其生物利用度。研究表明,制备和分离纯化方法虽多样,但主要以提高金属离子的螯合率和生物利用度为目的,螯合物的生物利用度与其在胃肠道中的稳定性及肠道吸收性等因素密切相关。虽然肽与金属离子螯合的研究已取得一定进展,但仍有以下问题亟待进一步研究:首先,需借助分子对接和分子动力学模拟等方法深入探究花生肽与金属离子的具体螯合机制,包括结合位点、立体化学结构及动态过程;其次,不同来源多肽在肠道内的吸收转运途径及其促进金属离子吸收的机制各异,需通过动物实验等方法进一步阐明其体外和体内的吸收转运机制;最后,花生肽金属离子螯合物作为金属离子补充剂的安全性评价体系尚不完善,其补充金属离子的潜力证据不足。未来研究应聚焦这些问题,为肽金属离子螯合物的应用提供更强理论支持,推动花生蛋白肽的高水平、多元化发展。
[1] CAI C N, LIU Y T, XU Y L, et al.Mineral-element-chelating activity of food-derived peptides:Influencing factors and enhancement strategies[J].Critical Reviews in Food Science and Nutrition, 2025,65(16):3241-3255.
[2] ZHAO T, YING P F, ZHANG Y H, et al.Research advances in the high-value utilization of peanut meal resources and its hydrolysates:A review[J].Molecules, 2023, 28(19):6862.
[3] SUN N, WU H T, DU M, et al.Food protein-derived calcium chelating peptides:A review[J].Trends in Food Science &Technology, 2016, 58:140-148.
[4] JAMDAR S N, RAJALAKSHMI V, PEDNEKAR M D, et al.Influence of degree of hydrolysis on functional properties, antioxidant activity and ACE inhibitory activity of peanut protein hydrolysate[J].Food Chemistry, 2010, 121(1):178-184.
[5] 王孟丽,布冠好,陈复生,等.花生肽-钙螯合物的制备及其结构表征[J].河南工业大学学报(自然科学版), 2021, 42(5):47-54;76.WANG M L, BU G H, CHEN F S, et al.The preparation and structural characterization of peanut peptide-calcium chelate[J].Journal of Henan University of Technology (Natural Science Edition), 2021, 42(5):47-54;76.
[6] 慈傲特,王彪,何玮.花生肽亚铁离子螯合物的制备工艺研究[J].食品安全导刊, 2024(4):130-134;138.CI A T, WANG B, HE W.Study on the preparation process of peanut peptide ferrous ion chelate[J].China Food Safety Magazine, 2024(4):130-134;138.
[7] LI C, BU G H, CHEN F S, et al.Preparation and structural characterization of peanut peptide-zinc chelate[J].CyTA-Journal of Food, 2020, 18(1):409-416.
[8] 陈卫. 功能食品与膳食健康[J].食品与生物技术学报, 2024, 43(4):1-7.CHEN W.Functional foods and dietary health[J].Journal of Food Science and Biotechnology, 2024, 43(4):1-7.
[9] ![]() M, HUNEK G, SZCZASNY M, et al.Supplementation of micro- and macronutrients-a role of nutritional status in non-alcoholic fatty liver disease[J].International Journal of Molecular Sciences, 2024, 25(9):4916.
M, HUNEK G, SZCZASNY M, et al.Supplementation of micro- and macronutrients-a role of nutritional status in non-alcoholic fatty liver disease[J].International Journal of Molecular Sciences, 2024, 25(9):4916.
[10] ZORODDU M A, AASETH J, CRISPONI G, et al.The essential metals for humans:A brief overview[J].Journal of Inorganic Biochemistry, 2019, 195:120-129.
[11] LIU T, LI T, XU D D, et al.Small-conductance calcium-activated potassium channels in the heart:Expression, regulation and pathological implications[J].Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2023, 378(1879):20220171.
[12] DIAZ DE BARBOZA G, GUIZZARDI S, TOLOSA DE TALAMONI N.Molecular aspects of intestinal calcium absorption[J].World Journal of Gastroenterology, 2015, 21(23):7142-7154.
[13] PORRAS C A, ROUAULT T A.Iron homeostasis in the CNS:An overview of the pathological consequences of iron metabolism disruption[J].International Journal of Molecular Sciences, 2022, 23(9):4490.
[14] KWON I, SONG W, JANG Y, et al.Elevation of hepatic autophagy and antioxidative capacity by endurance exercise is associated with suppression of apoptosis in mice[J].Annals of Hepatology, 2020, 19(1):69-78.
[15] THOMAS D T, ERDMAN K A, BURKE L M.American college of sports medicine joint position statement.Nutrition and athletic performance[J].Medicine and Science in Sports and Exercise, 2016, 48(3):543-568.
[16] FIORENTINI D, CAPPADONE C, FARRUGGIA G, et al.Magnesium:Biochemistry, nutrition, detection, and social impact of diseases linked to its deficiency[J].Nutrients, 2021, 13(4):1136.
[17] CHOU M H, YANG Y K, WANG J D, et al.The association of serum and dietary magnesium with depressive symptoms[J].Nutrients, 2023, 15(3):774.
[18] AFFONFERE M, CHADARE F J, FASSINOU F T K, et al.In-vitro digestibility methods and factors affecting minerals bioavailability:A review[J].Food Reviews International, 2023, 39(2):1014-1042.
[19] 李惟怡, 王柳森, 王邵顺子, 等.1989—2018年中国15个省(自治区、直辖市)18~35岁成年人部分矿物质摄入现状及其变化趋势[J].卫生研究, 2023, 52(1):20-26.LI W Y, WANG L S, WANG S S Z, et al.Situation and trends in dietary minerals intakes of adults aged 18-35 years in 15 provinces (autonomous regions, municipalities) of China in 1989—2018[J].Journal of Hygiene Research,2023, 52(1):20-26.
[20] MAULI S, THOW A M, MULCAHY G, et al.Opportunities to strengthen fish supply chain policy to improve external food environments for nutrition in the Solomon Islands[J].Foods, 2023, 12(4):900.
[21] OLSON R, GAVIN-SMITH B, FERRABOSCHI C, et al.Food fortification:The advantages, disadvantages and lessons from sight and life programs[J].Nutrients, 2021, 13(4):1118.
[22] DE BEM A F, KROLOW R, FARIAS H R, et al.Animal models of metabolic disorders in the study of neurodegenerative diseases:An overview[J].Frontiers in Neuroscience, 2020, 14:604150.
[23] CAO C W, XIAO Z C, GE C R, et al.Animal by-products collagen and derived peptide, as important components of innovative sustainable food systems—A comprehensive review[J].Critical Reviews in Food Science and Nutrition, 2022, 62(31):8703-8727.
[24] DU C, GONG H S, ZHAO H W, et al.Recent progress in the preparation of bioactive peptides using simulated gastrointestinal digestion processes[J].Food Chemistry, 2024, 453:139587.
[25] 王孟丽.花生肽-钙螯合物的制备、结构表征及促钙吸收特性研究[D].郑州:河南工业大学, 2022.WANG M L.Preparation and structural characterization of peanut peptide-calcium chelate andits properties of promoting calcium absorption[D].Zhengzhou:Henan University of Technology, 2022.
[26] ULUG S K, JAHANDIDEH F, WU J P.Novel technologies for the production of bioactive peptides[J].Trends in Food Science &Technology, 2021, 108:27-39.
[27] WANG Y T, WANG Z J, HANDA C L, et al.Effects of ultrasound pre-treatment on the structure of β-conglycinin and glycinin and the antioxidant activity of their hydrolysates[J].Food Chemistry, 2017, 218:165-172.
[28] TIAN S Q, DU K, YAN F, et al.Microwave-assisted enzymatic hydrolysis of wheat germ albumin to prepare polypeptides and influence on physical and chemical properties[J].Food Chemistry, 2022, 374:131707.
[29] ZHANG Y W, ZHANG H, WANG L, et al.Influence of the degree of hydrolysis (DH) on antioxidant properties and radical-scavenging activities of peanut peptides prepared from fermented peanut meal[J].European Food Research and Technology, 2011, 232(6):941-950.
[30] ZHANG Y W, LIU J, LU X, et al.Isolation and identification of an antioxidant peptide prepared from fermented peanut meal using Bacillus subtilis fermentation[J].International Journal of Food Properties, 2014, 17(6):1237-1253.
[31] FENG L, WANG Y, YANG J, et al.Overview of the preparation method, structure and function, and application of natural peptides and polypeptides[J].Biomedicine &Pharmacotherapy, 2022, 153:113493.
[32] LIU B Y, LI N N, CHEN F S, et al.Review on the release mechanism and debittering technology of bitter peptides from protein hydrolysates[J].Comprehensive Reviews in Food Science and Food Safety, 2022, 21(6):5153-5170.
[33] SIBILSKA-KAMINSKI I K, YIN J.Toward molecular cooperation by de novo peptides[J].Origins of Life and Evolution of Biospheres, 2021, 51(1):71-82.
[34] 乔虹, 黎松松, 周南希, 等.海洋来源金属离子螯合肽研究进展[J].食品工业科技, 2024, 45(1):368-377.QIAO H, LI S S, ZHOU N X, et al.Research progress in metal ion chelated peptides of marine sources[J].Science and Technology of Food Industry, 2024, 45(1):368-377.
[35] LI Y, SHI P Q, ZHENG Y J, et al.Millet bran protein hydrolysates derived peptides-zinc chelate:Structural characterization, security prediction in silico, zinc transport capacity and stability against different food processing conditions[J].Journal of Food Science, 2023, 88(1):477-490.
[36] MÜNZKER L, ODDO A, HANSEN P R.Chemical synthesis of antimicrobial peptides[J].Methods in Molecular Biology, 2017, 1548:35-49.
[37] 杨雅梦, 胥健萍, 刘婉月, 等.植物多肽分离技术及功能研究进展[J].食品科技, 2021, 46(6):194-200.YANG Y M, XU J P, LIU W Y, et al.Research progress of plant polypeptide separation technology and function[J].Food Science and Technology, 2021, 46(6):194-200.
[38] BU G H, TI G H, ZHAO X L, et al.Isolation, identification, and chelation mechanism of ferrous-chelating peptide from peanut protein hydrolysate[J].Journal of the Science of Food and Agriculture, 2024, 104(15):9368-9378.
[39] WANG J, ZHANG Y X, HUAI H P, et al.Purification, identification, chelation mechanism, and calcium absorption activity of a novel calcium-binding peptide from peanut (Arachis hypogaea) protein hydrolysate[J].Journal of Agricultural and Food Chemistry, 2023, 71(31):11970-11981.
[40] 于丽颖.花生抗氧化肽的制备、分离纯化及其缓解小鼠疲劳活性研究[D].长春:吉林农业大学, 2021.YU L Y.Preparation, isolation and purification of peanut antioxidant peptide and their antifatigue activity in mice[D].Changchun:Jilin Agricultural University, 2021.
[41] 张春芝, 王明清, 黄国清, 等.花生蛋白钙螯合肽的制备、富集及表征[J].中国粮油学报, 2023, 38(11):83-91.ZHANG C Z, WANG M Q, HUANG G Q, et al.Preparation, enrichment, and characterization of calcium-chelating peptides from peanut protein[J].Journal of the Chinese Cereals and Oils Association, 2023, 38(11):83-91.
[42] BAO X L, YUAN X Y, FENG G X, et al.Structural characterization of calcium-binding sunflower seed and peanut peptides and enhanced calcium transport by calcium complexes in Caco-2 cells[J].Journal of the Science of Food and Agriculture, 2021, 101(2):794-804.
[43] BU G H, ZHAO X L, WANG M L, et al.Identification of calcium chelating peptides from peanut protein hydrolysate and absorption activity of peptide-calcium complex[J].Journal of the Science of Food and Agriculture,2024, 104(11):6676-6686.
[44] 遆光慧.花生肽-亚铁螯合物的螯合作用机理及促铁吸收特性研究[D].郑州:河南工业大学, 2023.TI G H.Study on the chelating mechanism andpromoting iron absorption characteristics ofpeanut peptide ferrous chelate[D].Zhengzhou:Henan University of Technology, 2023.
[45] SUN R N, LIU X F, YU Y, et al.Preparation process optimization, structural characterization and in vitro digestion stability analysis of Antarctic krill (Euphausia superba) peptides-zinc chelate[J].Food Chemistry, 2021, 340:128056.
[46] CHUNKAO S, YOURAVONG W, YUPANQUI C T, et al.Structure and function of mung bean protein-derived iron-binding antioxidant peptides[J].Foods, 2020, 9(10):1406.
[47] LIU B T, ZHUANG Y L, SUN L P.Identification and characterization of the peptides with calcium-binding capacity from tilapia (Oreochromis niloticus) skin gelatin enzymatic hydrolysates[J].Journal of Food Science, 2020, 85(1):114-122.
[48] 李晨,布冠好,陈复生.酶法制备花生源锌螯合肽工艺[J].食品工业, 2020, 41(1):59-63.LI C, BU G H, CHEN F S.The preparation of peanut zinc chelated peptide by enzymatic method[J].The Food Industry, 2020, 41(1):59-63.
[49] FILIPONI M P, GAIGHER B, CAETANO-SILVA M E, et al.Microencapsulation performance of Fe-peptide complexes and stability monitoring[J].Food Research International, 2019, 125:108505.
[50] AN J L, ZHANG Y X, YING Z W, et al.The formation, structural characteristics, absorption pathways and bioavailability of calcium-peptide chelates[J].Foods, 2022, 11(18):2762.
[51] QU W J, FENG Y T, XIONG T, et al.Preparation of corn ACE inhibitory peptide-ferrous chelate by dual-frequency ultrasound and its structure and stability analyses[J].Ultrasonics Sonochemistry, 2022, 83:105937.
[52] TIAN Q J, FAN Y, HAO L, et al.A comprehensive review of calcium and ferrous ions chelating peptides:Preparation, structure and transport pathways[J].Critical Reviews in Food Science and Nutrition, 2023, 63(20):4418-4430.
[53] NARA M, MORII H, TANOKURA M.Coordination to divalent cations by calcium-binding proteins studied by FTIR spectroscopy[J].Biochimica et Biophysica Acta (BBA)-Biomembranes, 2013, 1828(10):2319-2327.
[54] TIAN L J, XIONG D D, JIA J, et al.Mechanism study on enhanced emulsifying properties of phosvitin and calcium-binding capacity of its phosphopeptides by lactic acid bacteria fermentation[J].LWT, 2022, 155:113002.
[55] LUO M N, XIAO J, SUN S W, et al.Deciphering calcium-binding behaviors of casein phosphopeptides by experimental approaches and molecular simulation[J].Food &Function, 2020, 11(6):5284-5292.
[56] LIN S T, HU X, YANG X Q, et al.GLPGPSGEEGKR:Fe2+ chelating characterization and potential transport pathways for improving Fe2+ bioavailability in Caco-2 cells[J].Food Bioscience, 2022, 48:101806.
[57] LIN S T, LI J, HU X, et al.Zn2+ chelating peptide GFLGSP:Characterization of structure/Zn2+ chelating mode and the potential mechanisms for promoting Zn2+ transport in Caco-2 cells[J].Food Research International, 2024, 192:114829.
[58] ZHANG Y J, DING X J, LI M Q.Preparation, characterization and in vitro stability of iron-chelating peptides from mung beans[J].Food Chemistry, 2021, 349:129101.
[59] PENG M Y, LU D, YU M, et al.Identification of zinc-chelating pumpkin seed (Cucurbita pepo L.) peptides and in vitro transport of peptide-zinc chelates[J].Journal of Food Science, 2022, 87(5):2048-2057.
[60] CAETANO-SILVA M E, NETTO F M, BERTOLDO-PACHECO M T, et al.Peptide-metal complexes:Obtention and role in increasing bioavailability and decreasing the pro-oxidant effect of minerals[J].Critical Reviews in Food Science and Nutrition, 2021, 61(9):1470-1489.
[61] ZHANG M H, LIU K L.Calcium supplements and structure-activity relationship of peptide-calcium chelates:A review[J].Food Science and Biotechnology, 2022, 31(9):1111-1122.
[62] WANG X, HE Y F, GAO Q, et al.Approaches to evaluate nutrition of minerals in food[J].Food Science and Human Wellness, 2021, 10(2):141-148.
[63] KHAN S T, MALIK A, ALWARTHAN A, et al.The enormity of the zinc deficiency problem and available solutions;an overview[J].Arabian Journal of Chemistry, 2022, 15(3):103668.
[64] YUAN X Y, BAO X L, FENG G X, et al.Effects of peptide-calcium complexes from sunflower seeds and peanuts on enhancing bone mineral density[J].International Journal of Food Science &Technology, 2020, 55(8):2942-2953.
[65] LI B, HE H, SHI W, et al.Effect of duck egg white peptide-ferrous chelate on iron bioavailability in vivo and structure characterization[J].Journal of the Science of Food and Agriculture, 2019, 99(4):1834-1841.