多层乳液通常在使用2种乳化剂的基础上,额外添加带有不同电荷的多糖稳定剂,以提升乳液在不同离子强度、pH值和温度条件下的稳定性和耐受性。这种方法能够有效保护乳液中包裹的油脂或脂溶性营养物质,减少氧化分解并提高其生物利用度。例如,廖一等[1]基于静电层层自组装技术,利用大豆分离蛋白、壳聚糖和海藻酸钠制备多层乳液,显示出良好的物理稳定性和油脂缓释效果。ZHANG等[2]研究表明,通过低酯果胶、乳铁蛋白和膳食纤维制备的多层乳液,能够在胃肠道中有效抑制液滴絮凝,并调节钙离子的结合,进而影响脂肪的消化速率。李进伟等[3]利用浓缩乳清蛋白、果胶和壳聚糖,通过静电层层自组装技术制备多层乳液,显著延缓油脂释放,并提高亚麻籽油的消化吸收效率。尽管如此,目前关于多糖稳定剂的界面吸附顺序及浓度如何影响多层乳液的热杀菌稳定性和肠道消化特性的研究,仍较为有限。
壳寡糖(chitosan oligosaccharide,COS)是一种由甲壳素和壳聚糖部分水解制得的低聚物,其分子质量和脱乙酰度低于壳聚糖。COS具有良好的水溶性和生物可吸收性,是乳液制备的理想稳定剂[4]。本研究通过调节COS的界面吸附顺序和浓度,制备二十二碳六烯酸(docosahexaenoic acid,DHA)藻油多层乳液,并通过平均粒径、多分散性指数(polydispersity index,PDI)、Zeta电位、剪切黏度和离心稳定系数等指标对乳液稳定性进行评价。同时,研究乳液在模拟体外消化条件下对DHA藻油的保护与缓释作用,以及高温灭菌对乳液稳定性的影响,旨在优化乳液的功能特性并拓展其应用潜力。
1 材料与方法
1.1 材料与试剂
浓缩乳清蛋白(whey protein concentrate,WPC),深圳市鑫鑫食品有限公司;COS、低酯果胶(low-methoxy pectin,LMP),江苏正宏生物科技有限公司;谷氨酰胺转氨酶(transglutaminase,TG)(120 U/g),新乡市派力特食品有限责任公司;三(羧甲基)氨基甲烷、丙酮、NaOH、NaCl,分析级,上海阿拉丁生物科技有限公司;HCl,西陇科学股份有限公司;CaCl2、NaCl、胆酸钠、胃蛋白酶、胰酶,上海麦克林生物科技有限公司。
1.2 仪器与设备
PD500-TP高速剪切机,英国PRIMASCI戈普公司;NanoGenizer微射流超高压均质机,苏州微流纳米生物技术有限公司;PTY-124/223电子天平,华志(福建)电子科技有限公司;FST-R0-22超纯水机,上海富诗特环保科技有限公司;CR21GⅡ高速离心机,日立Hitachi公司;TU-1900紫外可见光分光光度计,北京普析通用仪器有限责任公司;Zetasizer Nano ZS激光粒度分析仪,英国Malvern公司;Zeiss LSM 700激光共聚焦显微镜,德国卡尔蔡司公司;BX41光学显微镜,奥林巴斯公司;HR20流变仪,美国TA仪器沃特斯公司;890A-5975C气相色谱-质谱联用仪,美国Aglient公司;AJ-6A恒温磁力搅拌器,江苏金怡仪器科技有限公司。
1.3 实验方法
1.3.1 改性乳清蛋白制备
将WPC溶于去离子水配制150 g/L乳清蛋白溶液,45 ℃磁力搅拌2 h后于4 ℃冰箱静置过夜水化。乳清蛋白溶液经过15 000 psi微射流高压(dynamic high pressure microfluidization,DHPM)处理3次,制备DHPM处理的WPC(DHPM-WPC)溶液。随后加入TGase(30 U/g),50 ℃搅拌4 h酶交联,冰水钝酶后,制备DHPM-TG协同处理的WPC溶液(DHPM-TG-WPC)。样品经冷冻干燥后用于进一步研究。
1.3.2 DHA藻油多层乳液的制备
将DHPM-TG-WPC溶于去离子水中配制成质量浓度为20 g/L的水相。加入质量浓度为60 g/L的DHA藻油相,用高速剪切机5 000 r/min剪切1 min形成粗乳液,经30 MPa高压均质1次形成纳米乳液,按照表1所示顺序,依次添加LMP或COS溶液,混匀后用高速剪切机5 000 r/min剪切1 min,形成双层乳液;再添加COS或LMP溶液,同样剪切后形成多层乳液并进行121 ℃、15 min高压灭菌。COS0.5%、COS1%分别代表添加5、10 g/L COS。
表1 乳化剂/稳定剂添加顺序和多层乳液的质量浓度
Table 1 Emulsifier addition order and concentration of multilayer emulsion

组别WPC/LMPWPC/LMP/COS0.5%WPC/LMP/COS1%WPC/COS0.5%WPC/COS0.5%/LMPWPC/COS1%/LMP第一层DHPM-TG-WPC20 g/LDHPM-TG-WPC20 g/LDHPM-TG-WPC20 g/LDHPM-TG-WPC20 g/LDHPM-TG-WPC20 g/LDHPM-TG-WPC20 g/L第二层LMP(10 g/L)LMP(10 g/L)LMP(10 g/L)COS(10 g/L)COS(5 g/L)COS(10 g/L)第三层0COS(5 g/L)COS(10 g/L)0LMP(10 g/L)LMP(10 g/L)
1.3.3 乳液宏观现象的测定
观察经过121 ℃高压灭菌15 min后乳液的宏观现象,拍照并记录。
1.3.4 乳液粒径、PDI的测定
用Zetasizer激光粒度仪测量。设定分散相折射率为1.460,连续相折射率为1.330。4组纳米乳液用0.05 mol/L Tris-HCl缓冲液(pH=7.0)稀释1 000倍后转移至比色皿和电极毛细管池中分别测定平均粒径、PDI。
1.3.5 乳液电位的测定
根据FAN等[5]的方法用Zetasizer激光粒度仪测量乳液的Zeta电位值。乳液样品用0.05 mol/L Tris-HCl缓冲液(pH=7.0)稀释1 000倍后转移至电极毛细管池中测定。每个样品测定3次取平均值。
1.3.6 乳液离心稳定性的测定
取1 mL样液于8 000 r/min离心10 min,取中间清液稀释100倍后,用分光光度计于500 nm波长下测定吸光度A2,与离心前吸光度A1的比值即为稳定系数R,计算如公式(1)所示:
(1)
1.3.7 乳液流变学的测定
通过旋转流变仪测定乳液的流变学。转子型号为PP25,测试温度为25 ℃,剪切速率为1~100 s-1。将样品加载到平行板几何形状上并使其平衡2 min后,将转子降低至指定的高度(1.0 mm)以进行测量[6]。
1.3.8 多层乳液灭菌前后脂肪酸含量的测定
取1.5 mL乳液样品,分别加入5 mL正己烷、2 mL 20 g/L KOH甲醇溶液于10 mL具塞试管中,摇匀30 s后,加入1 g无水Na2SO4,涡旋30 s。静置30 min后,将上清液通过0.22 μm生物有机膜过滤,装入体积约为1 mL的进样瓶中。
脂肪酸含量通过GC-MS测定,具体条件为:FID检测器温度250 ℃,进样口温度250 ℃;升温程序为45 ℃保持3 min,以13 ℃/min升至175 ℃并保持27 min,再以4 ℃/min升至215 ℃并保持35 min;载气为高纯度氢气。脂肪酸定性定量分析参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》,采用外标法完成。
1.3.9 模拟体外消化游离脂肪酸的释放的测定
参考廖一等[1]的方法进行体外模拟消化并稍作修改,模拟胃液配方为3.2 mg/mL胃蛋白酶,0.7 mol/L HCl 和2 mg/mL NaCl,使用1 mol/L HCl 将pH调节至2.0,将乳液与模拟胃液等体积混合,在37 ℃、100 r/min下振荡消化1 h。模拟肠液配方为10 mmol/L CaCl2、150 mmol/L NaCl、5 mg/mL胆盐和1.6 mg/mL胰酶,按3∶1体积比与胃消化物混合,用0.1 mol/L NaOH调pH至7.0,在30 ℃、100 r/min下振荡消化2 h,实时监控pH值。每10 min用0.1 mol/L NaOH滴定,计算释放的游离脂肪酸(free fatty acid,FFA)含量,如公式(2)所示:
(2)
式中:VNaOH,滴定NaOH体积,L;CNaOH,滴定用NaOH溶液浓度,0.1 mol/L;Wlipid,藻油质量,g;Mlipid,藻油分子质量,328.49 g/mol。
1.3.10 模拟消化过程中粒径电位变化的测定
用Zetasizer激光粒度仪测量原始及消化过程中的乳液的粒径和Zeta电位值。
1.3.11 多层乳液消化前后脂肪酸含量的测定
样品制备与操作方法同1.3.8节。取1.5 mL消化前或消化后乳液样品,分别加入5 mL正己烷和2 mL 2 mol/L KOH甲醇溶液于10 mL具塞试管中,摇匀30 s后,加入1 g无水Na2SO4,涡旋30 s。静置30 min后,将上清液通过0.22 μm生物有机膜过滤,装入体积约为1 mL的进样瓶中。
脂肪酸含量通过GC-MS测定,具体条件为:FID检测器温度250 ℃,进样口温度250 ℃;升温程序为45 ℃保持3 min,以13 ℃/min升至175 ℃并保持27 min,再以4 ℃/min升至215 ℃并保持35 min;载气为高纯度氢气。脂肪酸定性定量分析参照GB 5009.168—2016《食品安全国家标准 食品中脂肪酸的测定》,采用外标法完成。
1.4 数据处理与统计分析
所有乳液均在3个独立实验中制备,并且所有测量至少重复2次。利用SPSS软件处理数据,以单因素方差分析法对所得数据进行差异显著性分析(P<0.05),采用Origin软件作图。
2 结果与分析
2.1 COS界面吸附顺序及浓度对热杀菌多层乳液观察的影响
本研究探讨了COS界面吸附顺序及浓度对多层乳液热稳定性的影响。如图1所示,“DHPM-TG-WPC-LMP-COS”添加顺序制备的乳液在高温灭菌后表现出良好的稳定性,表明该顺序能够在液滴表面形成均匀且致密的界面层,有效抑制絮凝与分层现象。然而,当COS添加量增至10 g/L时,多余COS在高温灭菌过程中发生析出,导致乳液失稳。相比之下,“DHPM-TG-WPC-COS-LMP”添加顺序制备的乳液因界面层不稳定,在高温条件下发生絮凝,这可能是由于COS未完全包裹DHPM-TG-WPC,或游离COS与LMP的相互作用破坏了乳液结构。

图1 高温灭菌后多层乳液的宏观图像
Fig.1 Macro-image of multilayer emulsion after high temperature sterilization
2.2 COS界面吸附顺序及浓度对乳液粒径、PDI的影响
COS的界面吸附顺序与添加量显著影响多层乳液的平均粒径和PDI。如图2所示,添加3种乳化/稳定剂制备的乳液粒径显著大于仅使用2种乳化/稳定剂的乳液。这可能是由于COS在DHPM-TG-WPC-LMP界面层的基础上包裹形成额外层结构,增加了界面厚度,导致颗粒变大[7]。WPC/LMP组的PDI值为0.268±0.015,而WPC/LMP/COS0.5%组为0.275±0.016,均低于0.3,表明乳液分布均匀且稳定性良好。然而,当COS浓度增至10 g/L时,正电荷与LMP负电荷之间的静电吸附可能过剩,多余的正电荷引发絮凝,从而导致粒径和PDI显著增加。例如,WPC/COS0.5%组的粒径达到(320.50±5.96) nm,显著高于WPC/LMP组(P<0.05)。这一结果与高浓度COS易引发絮凝的现象一致[8]。此外,COS的界面吸附顺序对于乳液的界面稳定性至关重要。当COS先于LMP添加时,其与DHPM-TG-WPC的静电作用可能阻碍液滴表面形成稳定界面层,导致液滴聚集和粒径增大;而“LMP-COS”顺序能够使COS均匀分布在界面层上,形成致密的多层结构,从而提高乳液的稳定性[9]。在高温灭菌条件下,DHPM-TG-WPC与LMP的共价作用进一步增强了抗絮凝性能,使乳液在高温处理后仍能保持稳定[10]。
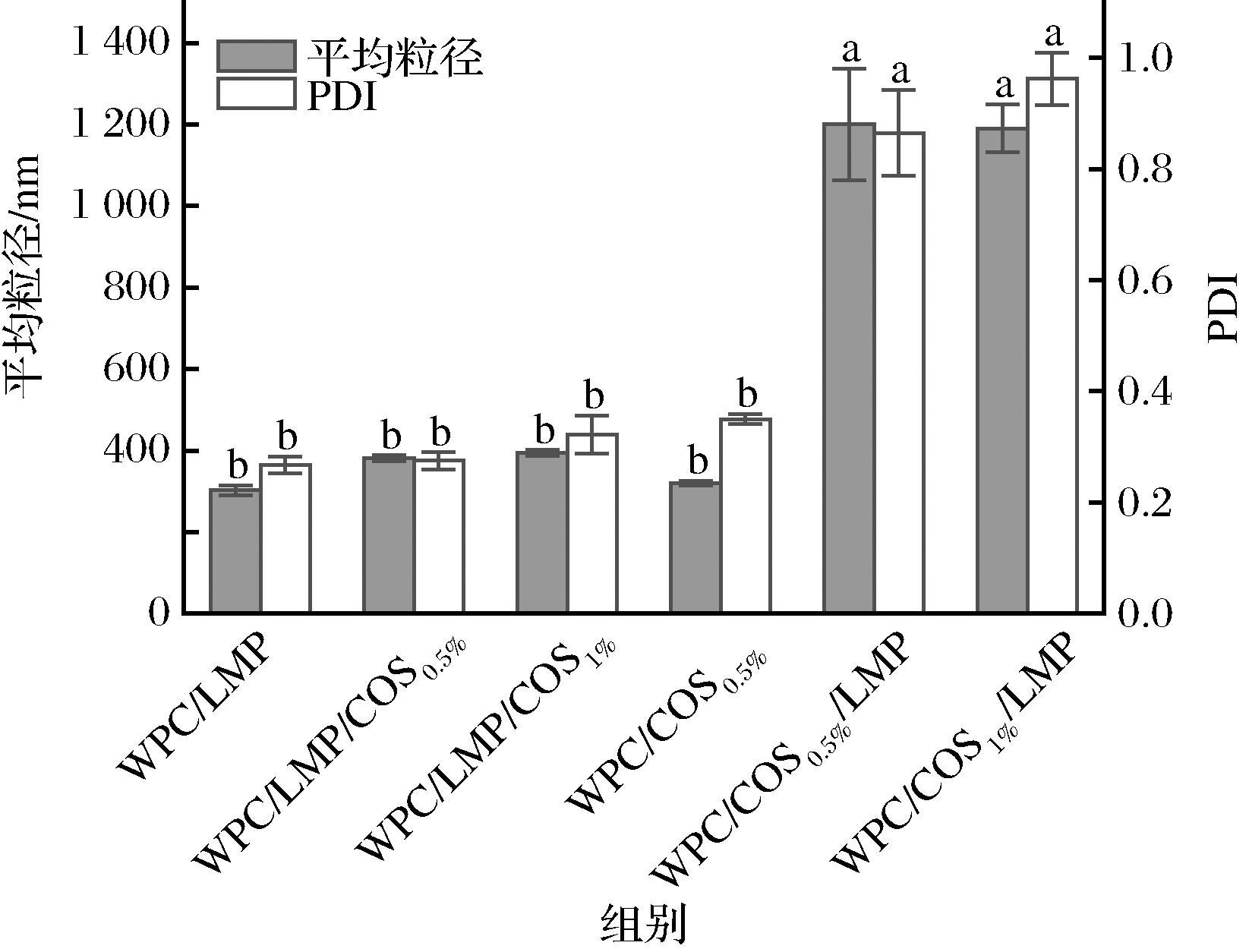
图2 COS界面吸附顺序和浓度对多层乳液平均粒径和PDI的影响
Fig.2 Effect of COS interfacial adsorption Sequence and concentration on the average particle size and PDI of multilayer emulsions
注:不同小写字母代表差异显著(P<0.05)(下同)。
2.3 COS界面吸附顺序及浓度对多层乳液Zeta电位的影响
COS是自然界中唯一带有阳离子碱性氨基的低聚糖,由于其显著的正电荷,COS可通过静电吸附与DHPM-TG-WPC结合,从而调控乳液的界面电荷特性。如图3所示,添加COS后,乳液的Zeta电位从双层乳液的(-33.32±0.56) mV升至正值,形成了稳定的静电屏障,抑制了液滴聚集。当COS质量浓度为5 g/L时,Zeta电位达(29.91±0.75) mV(接近30 mV),增强了静电排斥,使乳液稳定性最佳[11]。然而,当COS质量浓度增至10 g/L时,Zeta电位降至(14.30±1.21) mV,这可能是由于COS在界面饱和吸附后,游离的COS分子在液相中发生絮凝,破坏了界面电荷均匀性,从而降低乳液稳定性。此外,COS通过静电吸附与DHPM-TG-WPC结合使表面电位转为正值,随后添加带负电荷的LMP后,表面电位转为负值,从而形成更稳定的多层界面。然而,高温灭菌可能导致COS从界面脱落,与DHPM-TG-WPC形成不稳定复合物,削弱了静电屏障作用,破坏界面层最终导致乳液失稳。
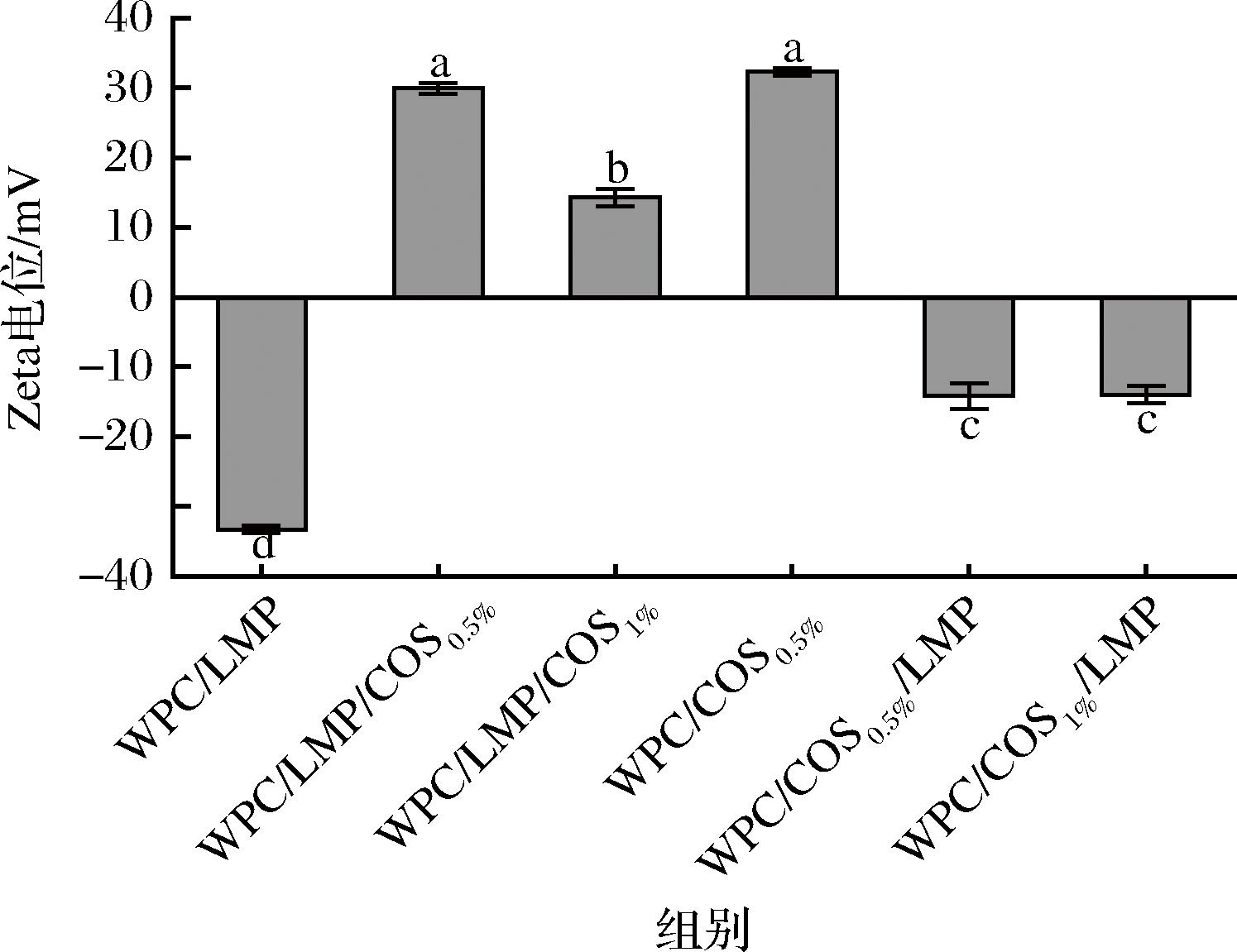
图3 COS界面吸附顺序和浓度对多层乳液Zeta电位的影响
Fig.3 Effect of COS interfacial adsorption sequence and concentration on the Zeta potential of multilayer emulsions
2.4 COS界面吸附顺序及浓度对多层乳液离心稳定性的影响
如图4所示,DHPM-TG-WPC与LMP构建的双层乳液表现出良好的离心稳定性,其R值为(75.72±2.65)%。当添加适量COS(5 g/L)后,R值进一步提升至(82.45±2.00)%,说明COS通过阳离子静电作用与DHPM-TG-WPC和LMP形成了稳定的界面结构,显著抑制液滴聚集[12]。然而,当COS添加量增加至10 g/L时,R值下降至(69.47±3.34)%,可能是由于过量COS在油水界面产生电荷富集,干扰了DHPM-TG-WPC与LMP的相互作用,导致蛋白凝聚和絮凝,从而降低乳液的稳定性[13]。对比来看,WPC/LMP组的R值显著高于WPC/COS0.5%组的(66.32±4.17)%,表明在高温灭菌条件下,DHPM-TG-WPC与LMP通过共价和非共价交联形成的复合物可有效改善界面特性并增强热稳定性。KOCH等[14]研究指出,在120~140 ℃条件下,高温处理WPC与柑橘果胶的共混物可显著提升乳化力和稳定性,这主要归因于美拉德反应产物(如偶联物)的形成。此外,其他研究也表明,LMP在提高乳液热稳定性方面具有重要作用,能够有效增强乳液的分散性和整体稳定性[8]。
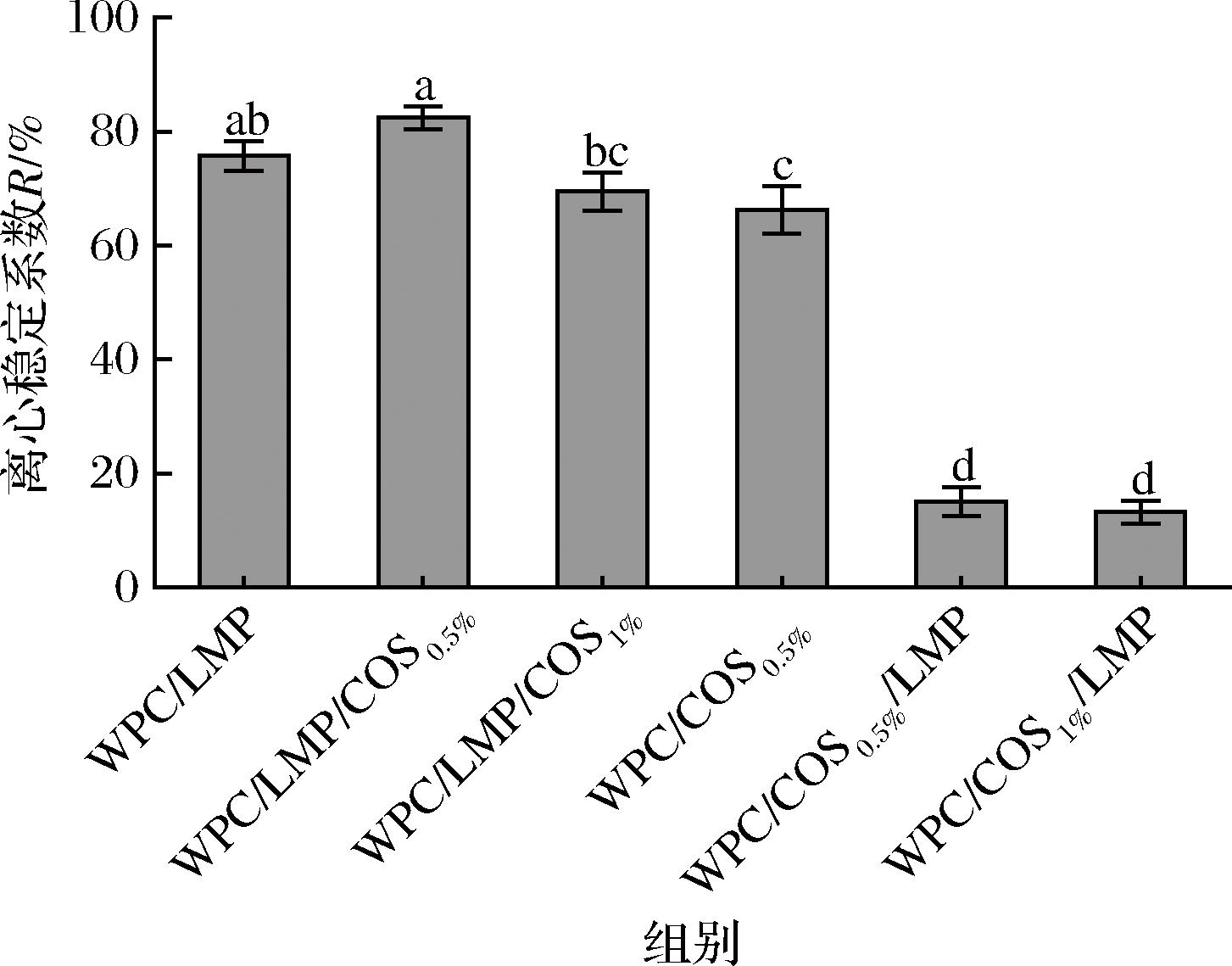
图4 COS界面吸附顺序和浓度对多层乳液离心稳定性的影响
Fig.4 Effect of COS interfacial adsorption sequence and concentration on the centrifugal stability of multilayer emulsions
2.5 COS界面吸附顺序及浓度对多层乳液流变学的影响
黏度是评估乳液稳定性、流变行为和内部结构强度的重要指标。如图5所示,实验结果表明,在0~100 s-1的剪切速率范围内,乳液的表观黏度随着剪切速率的增加显著下降,表现出典型的剪切变稀特性,表明乳液内部网络结构逐渐被破坏。与双层乳液相比,添加COS的多层乳液黏度更高,这主要归因于COS的增稠作用,其阳离子特性通过静电相互作用与DHPM-TG-WPC和LMP在界面处形成稳定的网络结构,从而显著提升乳液的分散性和稳定性[15]。此外,研究发现乳液黏度的增加通常与油滴尺寸减小相关,较小的油滴具有更大的比表面积,利于乳化剂在界面形成稳定的保护层,进一步增强乳液的分散性和稳定性。然而,当COS质量浓度过高(10 g/L)时,黏度显著增加,可能导致液滴聚集和絮凝现象,从而降低乳液的整体稳定性。这一结果与相关研究中COS作为增稠剂的现象一致[16],表明过量COS可能对乳液稳定性产生负面影响。
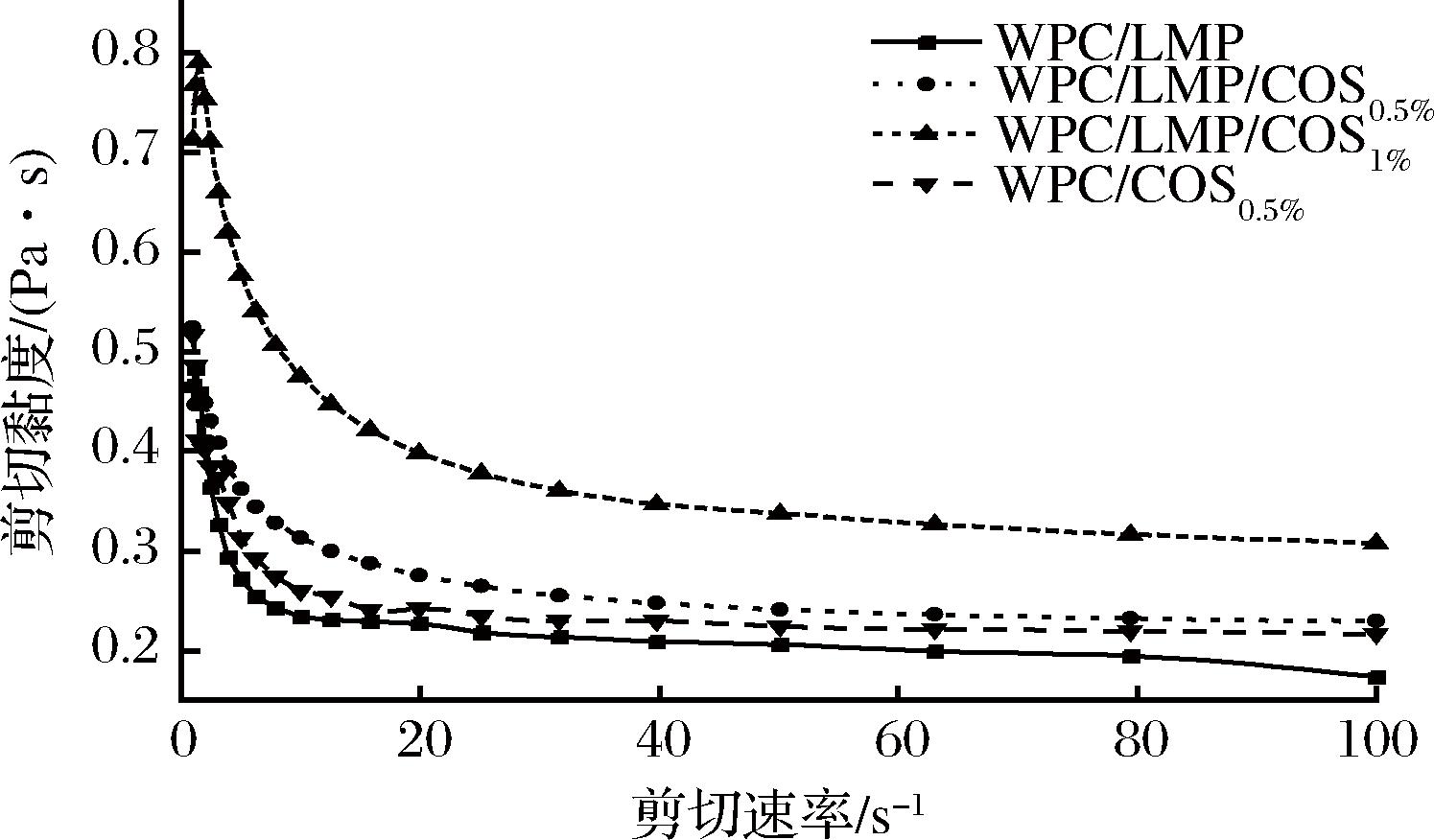
图5 COS界面吸附顺序和浓度对多层乳液剪切黏度的影响
Fig.5 Effect of COS interfacial adsorption sequence and concentration on the shear viscosity of multilayer emulsions
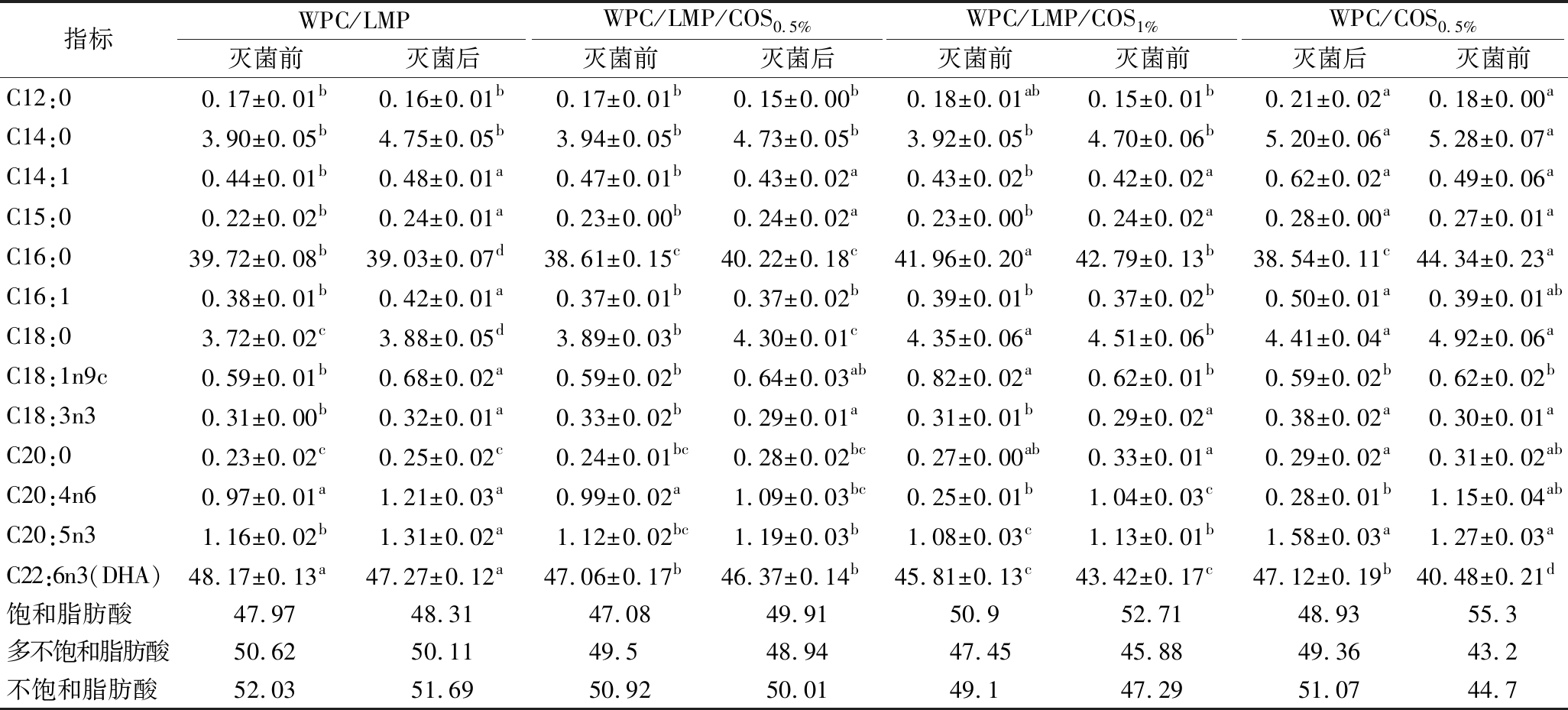
2.6 COS界面吸附顺序及浓度对乳液灭菌前后脂肪酸组成的影响
表2显示了灭菌前后多层乳液中主要脂肪酸(如DHA、棕榈酸和肉豆蔻酸)的组成变化。未灭菌时,多层乳液的DHA含量低于双层乳液,可能是由于添加COS过程中剪切力导致DHA分子链断裂,或液滴稳定性降低引发的氧化和分解[17]。灭菌后,DHA含量进一步降低,表明高温处理加速了DHA的氧化,这可能与DHA分子中多双键的不饱和结构易受氧化有关。然而,在“DHPM-TG-WPC-LMP-COS”吸附顺序的多层乳液中,适量添加COS(5 g/L)对DHA具有显著保护作用,其含量从47.06%仅减少至46.37%。这一效果归因于LMP与COS通过静电吸附,在液滴表面形成致密且稳定的界面层,从而提高乳液的抗氧化性能[18]。然而,当COS质量浓度增加至10 g/L时,DHA含量从45.81%降至43.42%,这可能是因为过量COS在界面上吸附不均,导致界面层结构破坏和絮凝现象,削弱了对DHA的保护能力[19]。“DHPM-TG-WPC-COS-LMP”顺序制备的乳液因界面吸附不稳定,在高温灭菌过程中COS易从界面层脱落,导致油滴暴露,从而加剧了DHA的氧化。此外,在单独使用COS的乳液中,保护效果受COS浓度的限制,过量添加COS反而因絮凝和不均匀吸附破坏乳液稳定性,导致DHA和多不饱和脂肪酸含量显著下降。
表2 多层乳液灭菌前后脂肪酸组成对比 单位:%
Table 2 Comparison of fatty acid composition before and after multilayer emulsion sterilization
注:不同小写字母代表差异显著(P<0.05)(下同)。
指标WPC/LMPWPC/LMP/COS0.5%WPC/LMP/COS1%WPC/COS0.5%灭菌前灭菌后灭菌前灭菌后灭菌前灭菌前灭菌后灭菌前C12:00.17±0.01b0.16±0.01b0.17±0.01b0.15±0.00b0.18±0.01ab0.15±0.01b0.21±0.02a0.18±0.00aC14:03.90±0.05b4.75±0.05b3.94±0.05b4.73±0.05b3.92±0.05b4.70±0.06b5.20±0.06a5.28±0.07aC14:10.44±0.01b0.48±0.01a0.47±0.01b0.43±0.02a0.43±0.02b0.42±0.02a0.62±0.02a0.49±0.06aC15:00.22±0.02b0.24±0.01a0.23±0.00b0.24±0.02a0.23±0.00b0.24±0.02a0.28±0.00a0.27±0.01aC16:039.72±0.08b39.03±0.07d38.61±0.15c40.22±0.18c41.96±0.20a42.79±0.13b38.54±0.11c44.34±0.23aC16:10.38±0.01b0.42±0.01a0.37±0.01b0.37±0.02b0.39±0.01b0.37±0.02b0.50±0.01a0.39±0.01abC18:03.72±0.02c3.88±0.05d3.89±0.03b4.30±0.01c4.35±0.06a4.51±0.06b4.41±0.04a4.92±0.06aC18:1n9c0.59±0.01b0.68±0.02a0.59±0.02b0.64±0.03ab0.82±0.02a0.62±0.01b0.59±0.02b0.62±0.02bC18:3n30.31±0.00b0.32±0.01a0.33±0.02b0.29±0.01a0.31±0.01b0.29±0.02a0.38±0.02a0.30±0.01aC20:00.23±0.02c0.25±0.02c0.24±0.01bc0.28±0.02bc0.27±0.00ab0.33±0.01a0.29±0.02a0.31±0.02abC20:4n60.97±0.01a1.21±0.03a0.99±0.02a1.09±0.03bc0.25±0.01b1.04±0.03c0.28±0.01b1.15±0.04abC20:5n31.16±0.02b1.31±0.02a1.12±0.02bc1.19±0.03b1.08±0.03c1.13±0.01b1.58±0.03a1.27±0.03aC22:6n3(DHA)48.17±0.13a47.27±0.12a47.06±0.17b46.37±0.14b45.81±0.13c43.42±0.17c47.12±0.19b40.48±0.21d饱和脂肪酸47.9748.3147.0849.9150.952.7148.9355.3多不饱和脂肪酸50.6250.1149.548.9447.4545.8849.3643.2不饱和脂肪酸52.0351.6950.9250.0149.147.2951.0744.7
2.7 COS界面吸附顺序及浓度对乳液体外消化FFA的影响
本研究通过滴定法测定多层乳液中FFA释放量,以探讨COS对脂肪消化的影响。如图6所示,实验结果显示,在模拟消化过程中,乳液的FFA释放量在前20 min迅速增加,随后释放速率逐渐减缓并趋于平稳。相比WPC/LMPA和WPC/COS0.5%双层乳液,WPC/LMP/COS0.5%和WPC/LMP/COS1%多层乳液的FFA释放速度显著降低。这可能是由于多层乳液形成了较厚的界面结构,有效阻隔了胰脂肪酶与油滴的接触,从而减缓脂肪的水解并降低FFA的释放[20]。COS不仅通过物理屏障减少胰脂肪酶与油滴的接触,还通过静电排斥及与胆盐、脂解酶等成分的相互作用进一步抑制FFA的释放[4]。此外,WPC/LMP/COS0.5%和WPC/LMP/COS1%组的FFA释放量均低于双层乳液组。COS在模拟肠液的偏碱性条件下部分失去正电荷,从乳液界面层脱落,进一步阻碍了胰脂肪酶与油滴的接触。同时,COS的残余正电荷与胰脂肪酶的负电荷发生静电相互作用,降低了胰脂肪酶的活性,从而有效延缓FFA的释放[21]。
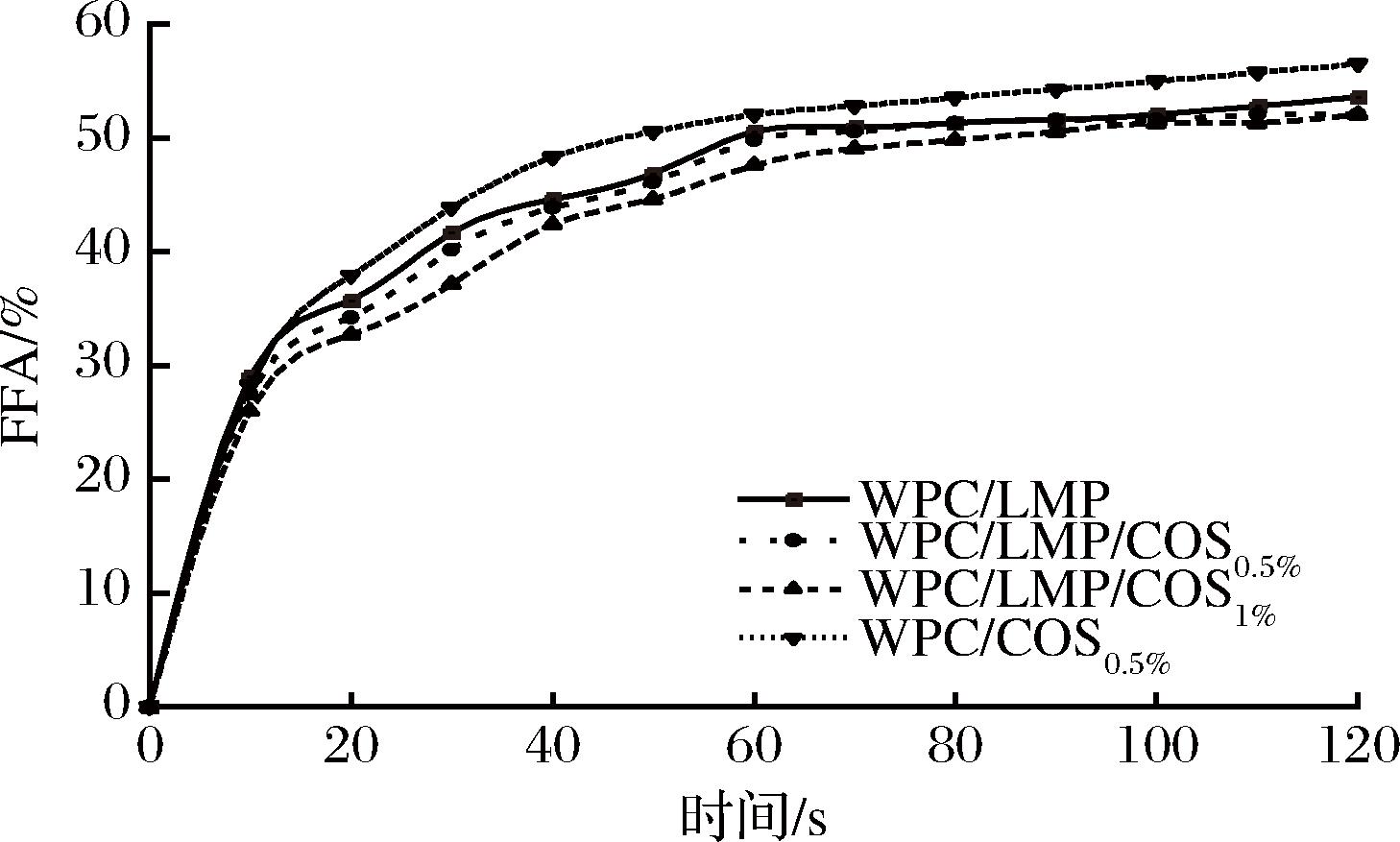
图6 COS界面吸附顺序和浓度对FFA的影响
Fig.6 Effect of COS interfacial adsorption sequence and concentration on the FFA of multilayer emulsions
2.8 COS界面吸附顺序及浓度对乳液体外消化粒径电位的影响
如图7所示,经过胃消化后,所有乳液的粒径均显著增大,主要由于模拟胃液的强酸环境(低pH)下液滴表面的静电斥力减弱,导致液滴发生絮凝与合并。此外,胃蛋白酶对DHPM-TG-WPC的分解破坏了界面层,进一步降低了乳液的稳定性[22-23]。相比WPC/LMP组,添加COS的WPC/LMP/COS0.5%和WPC/LMP/COS 1%组均表现出更高的液滴聚集稳定性。这是因为COS在液滴表面形成了较厚的界面层,不仅有效阻止胃蛋白酶对油滴的直接作用,延缓酶促水解,还通过与蛋白的相互作用产生空间位阻效应,进一步抑制液滴聚集[24]。在小肠消化阶段,乳液的粒径进一步增大。尽管胰酶分解油相从理论上会减小粒径,但未消化的乳化剂、磷脂、胆盐等分子形成的胶束,以及未完全消化的脂滴与胶束或未溶钙盐结合形成的聚合物,使粒径显著增大[25]。尤其是在高浓度COS组(WPC/LMP/COS1%),粒径增幅最为显著,表明COS在碱性肠液中逐渐从界面脱落,降低了界面稳定性,进而加剧液滴聚集。
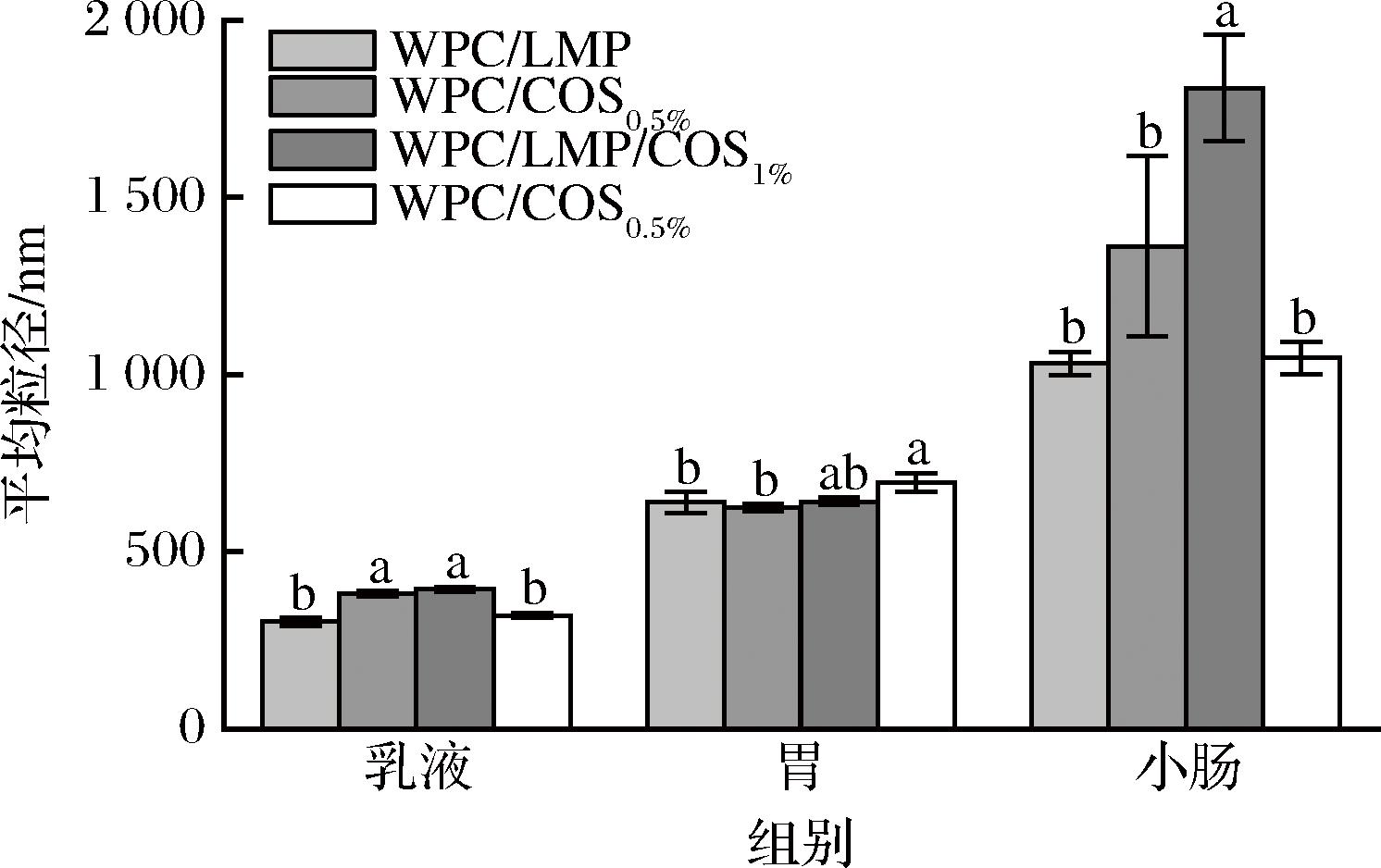
图7 COS界面吸附顺序和浓度对多层乳液在消化 过程中平均粒径的影响
Fig.7 Effect of COS interfacial adsorption sequence and concentration on the average particle size of multilayer emulsions during digestion
在体外胃肠消化过程中,乳液液滴的电荷变化如图8所示。胃消化阶段,Zeta电位迅速向正值移动,这主要是因为强酸环境下胃蛋白酶对DHPM-TG-WPC的酶解破坏了液滴表面的界面结构,显著削弱了液滴的静电斥力,导致表面净电荷逐渐减少。这一现象与RIBAS等[26] 的研究一致,其指出胃蛋白酶作用下的蛋白水解显著削弱界面电荷。在小肠环境中,液滴表面电荷再次发生显著变化,Zeta电位从正值转为负值,这与肠液中胆盐、钙离子等带电物质与液滴间的静电相互作用密切相关,特别是正电荷的COS在碱性肠液中与负电荷的胆盐发生静电吸引作用,逐渐从液滴表面脱落,破坏电荷平衡,最终使液滴表面电位转为负值。此外,消化后的乳液表面带有约-20 mV的负电荷,这与ZHANG等[4]的研究结果一致,其指出液滴表面的负电荷主要来源于肠液中的阴离子成分,如游离脂肪酸、胆汁酸和肽等。
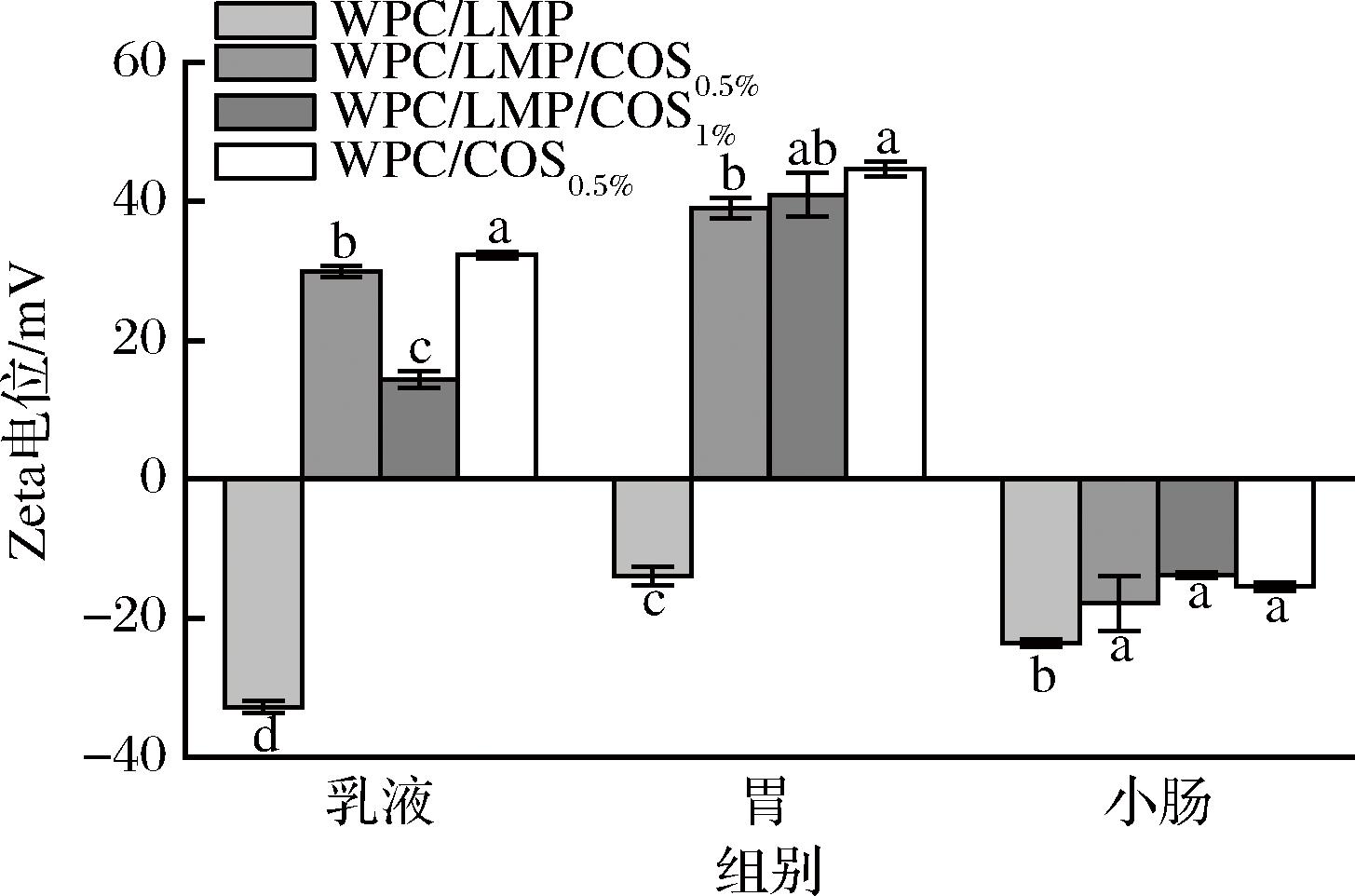
图8 COS界面吸附顺序和浓度对多层乳液在消化过程中Zeta电位的影响
Fig.8 Effect of COS interfacial adsorption sequence and concentration on the Zeta potential of multilayer emulsions during digestion
2.9 COS界面吸附顺序及浓度对乳液消化前后脂肪酸组成的影响
如表3所示,多层乳液在消化前后脂肪酸组成发生显著变化。消化后,饱和脂肪酸比例明显下降,而多不饱和脂肪酸比例相应增加,这可能是因为胰脂肪酶优先水解饱和脂肪酸(如棕榈酸和肉豆蔻酸),而不饱和脂肪酸(如DHA)的水解速率较慢[27]。其中,C16:0比例显著降低,原因可能是胰酶优先水解与Sn-1键相连的脂肪酸,其次是Sn-3键,而C16:0主要分布在Sn-1位点[28]。添加COS后,DHA的释放速率存在显著差异。在单独使用COS的WPC/COS0.5%组中,DHA增幅达到70.39%,表明在消化过程中,COS逐渐从界面脱落,导致界面稳定性降低,油脂更易被水解。在高浓度COS组(WPC/LMP/COS1%),尽管初期界面较厚,但在小肠碱性环境下,COS易发生脱落和絮凝,DHA增幅为64.21%,说明高浓度COS(10 g/L)的保护效果有限。相较之下,WPC/LMP/COS0.5%组表现出更优的保护效果,DHA增幅仅为43.48%,显著低于单独使用COS的组别。这可能是因为LMP与COS通过静电吸附和空间位阻作用,在乳液表面形成稳定的多层界面结构,从而有效延缓油脂水解,减少DHA的释放和氧化损失[29]。
表3 多层乳液消化前后脂肪酸组成对比 单位:%
Table 3 Comparison of fatty acid composition before and after multilayer emulsion digestion

脂肪酸组成WPC/LMPWPC/LMP/COS0.5%WPC/LMP/COS1%WPC/COS0.5%消化前消化后变化幅度消化前消化后变化幅度消化前消化后变化幅度消化前消化后变化幅度C12:00.16±0.01b0.23±0.01b40.720.15±0.00b0.25±0.01b64.330.15±0.01b0.29±0.00a96.600.18±0.00a0.30±0.02a64.08C14:04.75±0.05b3.07±0.14c-35.394.73±0.05b3.65±0.08a-22.824.70±0.06b3.23±0.05bc-31.265.28±0.07a3.46±0.09ab-34.40C14:10.48±0.01a0.62±0.03b28.370.43±0.02a0.69±0.04b61.050.42±0.02a0.79±0.01a88.310.49±0.06a0.81±0.04a64.38C15:00.24±0.01a0.17±0.01b-30.880.24±0.02a0.20±0.01a-16.860.24±0.02a0.12±0.00c-49.730.27±0.01a0.15±0.01b-45.31C16:039.03±0.07d18.25±0.18b-53.2440.22±0.18c21.30±0.13a-47.0342.79±0.13b17.02±0.10c-60.2144.34±0.23a18.24±0.11b-58.85C16:10.42±0.01a0.53±0.03b26.960.37±0.02b0.59±0.03b58.620.37±0.02b0.54±0.01b44.920.39±0.01ab0.66±0.02a68.67C18:03.88±0.05d2.10±0.09ab-45.944.30±0.01c2.22±0.06a-48.414.51±0.06b1.89±0.03c-58.094.92±0.06a2.01±0.04bc-59.07C18:1n9c0.68±0.02a0.75±0.04b9.780.64±0.03ab0.81±0.02b26.550.62±0.0b0.75±0.01b21.080.62±0.02b0.89±0.01a42.91C18:3n30.32±0.01a0.46±0.01b44.420.29±0.01a0.46±0.01b57.850.29±0.02a0.55±0.02a89.520.30±0.01a0.52±0.02a74.52C20:00.25±0.02c0.17±0.00b-33.640.28±0.02bc0.18±0.01ab-35.020.33±0.01a0.20±0.01a-39.070.31±0.02ab0.17±0.01b-43.70C20:4n61.21±0.03a1.50±0.10ab24.371.09±0.03bc1.42±0.06b30.301.04±0.03c1.47±0.04b41.781.15±0.04ab1.66±0.03a44.75C20:5n31.31±0.02a2.13±0.07a62.821.19±0.03b1.70±0.03c43.021.13±0.01b1.84±0.04b62.521.27±0.03a2.15±0.03a69.13C22:6n3(DHA)47.27±0.12a70.03±0.34ab48.1546.37±0.14b66.53±0.51c43.4843.42±0.17c71.30±0.58a64.2140.48±0.21d68.98±0.49b70.39饱和脂肪酸 48.3123.97-50.38 49.9227.80-44.31 52.7222.76-56.83 55.3024.34-55.99 不饱和脂肪酸51.6976.0347.0850.0872.2044.1747.2877.2463.3644.7075.6669.26多不饱和脂肪酸50.1174.1347.9448.9459.7322.0545.8856.0722.2143.2073.3169.70
3 结论
通过分析乳液的粒径、Zeta电位、离心稳定性及脂肪酸组成,本研究系统探讨了COS界面吸附顺序及浓度对藻油多层乳液热稳定性和DHA缓释保护的调节机制及作用。“DHPM-TG-WPC-LMP-COS”吸附顺序能够通过形成均匀且致密的界面层,显著提升乳液的热稳定性,尤其是在COS质量浓度为5 g/L时,乳液表现出最佳的稳定性和DHA保护效果。然而,当COS质量浓度升高至10 g/L时,界面吸附不均削弱了界面层的稳定性,导致乳液絮凝加剧和DHA释放加速。在模拟胃肠消化实验中,5 g/L COS通过物理屏障和静电排斥作用有效延缓脂肪酸释放,体现出显著的缓释效果;而10 g/L COS在碱性肠液中易脱落,导致界面层失稳并加速DHA水解。消化后DHA含量的升高是由于饱和脂肪酸优先水解和界面层保护作用,表明乳液系统能有效保护DHA,延缓其水解,提高其在消化后的保留率。本研究揭示了COS吸附顺序和浓度对多层乳液稳定性及功能特性的关键影响,为多层乳液配方优化及高稳定性功能食品开发提供理论支持。
[1] 廖一, 孙禹凡, 彭新辉, 等.紫苏油多层乳液的制备及乳液油脂体外消化特性[J].食品科学, 2022, 43(12):58-65.LIAO Y, SUN Y F, PENG X H, et al.Preparation in vitro digestibility of Perilla oil multilayer emulsion[J].Food Science, 2022,43(12):58-65.
[2] ZHANG Q, ZHOU Y Y, YUE W T, et al.Nanostructures of protein-polysaccharide complexes or conjugates for encapsulation of bioactive compounds[J].Trends in Food Science &Technology, 2021, 109:169-196.
[3] 李进伟, 林传舟, 刘元法.制备亚麻籽油多层乳液及其稳定性研究[J].食品科学, 2016, 37(11):1-6.LI J W, LIN C Z, LIU Y F.Preparation and stability of multilayer emulsions of linseed oil by electrostatic layer-by-layer deposition[J].Food Science, 2016, 37(11):1-6.
[4] ZHANG R Y, BELWAL T, LI L, et al.Recent advances in polysaccharides stabilized emulsions for encapsulation and delivery of bioactive food ingredients:A review[J].Carbohydrate Polymers, 2020, 242:116388.
[5] FAN Y T, PENG G F, PANG X, et al.Physicochemical, emulsifying, and interfacial properties of different whey protein aggregates obtained by thermal treatment[J].LWT, 2021, 149:111904.
[6] DU Q W, JI X H, LYU F, et al.Heat stability and rheology of high-calorie whey protein emulsion:Effects of calcium ions[J].Food Hydrocolloids, 2021, 114:106583.
[7] LIU B Q, ZAN L T, LI X H, et al.Modification of liposomes:Preparation, purpose, methods and the application in food[J].International Journal of Food Science &Technology, 2024, 59(6):3523-3536.
[8] JIA Y Y, WANG C, KHALIFA I, et al.Pectin:A review with recent advances in the emerging revolution and multiscale evaluation approaches of its emulsifying characteristics[J].Food Hydrocolloids, 2024, 157:110428.
[9] XU Y J, ZHANG J, HE J M, et al.Influences of ultrasonic treatments on the structure and antioxidant properties of sugar beet pectin[J].Foods, 2023, 12(5):1020.
[10] LI Y, PEI Y Q, SHAN Z Y, et al.A pH-sensitive W/O/W emulsion-bound carboxymethyl chitosan-alginate hydrogel bead system through the Maillard reaction for probiotics intestine-targeted delivery[J].Food Hydrocolloids, 2024, 153:109956.
[11] XIE L, DAI X L, LI Y K, et al.Pickering emulsion of curcumin stabilized by cellulose nanocrystals/chitosan oligosaccharide:Effect in promoting wound healing[J].Pharmaceutics, 2024, 16(11):1411.
[12] DIAO X Q, JIA R X, WANG Y, et al.The physicochemical properties, microstructure, and stability of diacylglycerol-loaded multilayer emulsion based on protein and polysaccharides[J].LWT, 2024, 196:115879.
[13] SUN X W, LIU C Z, WANG D F, et al.Effects of coating layers chitosan/pectin on lipid stability and in vitro digestion of astaxanthin-loaded multilayer emulsions[J].LWT, 2023, 173:114282.
[14] KOCH L, HUMMEL L, SCHUCHMANN H P, et al.Structural changes and functional properties of highly concentrated whey protein isolate-Citrus pectin blends after defined, high temperature treatments[J].LWT, 2017, 84:634-642.
[15] CHEN Y F, SUN Y, DING Y T, et al.Recent progress in fish oil-based emulsions by various food-grade stabilizers:Fabrication strategy, interfacial stability mechanism and potential application[J].Critical Reviews in Food Science and Nutrition, 2024, 64(6):1677-1700.
[16] ZHOU L, LIU Y, LI Y C, et al.Pickering emulsion stabilized by glycosylated whey protein isolate complexed with chitooligosaccharide for the improving stability of delivery and bioaccessibility of DHA[J].Food Hydrocolloids, 2024, 151:109858.
[17] WANG C X, SUN C X, LU W, et al.Emulsion structure design for improving the oxidative stability of polyunsaturated fatty acids[J].Comprehensive Reviews in Food Science and Food Safety, 2020, 19(6):2955-2971.
[18] JULIO L M, COPADO C N, DIEHL B W K, et al.Chia bilayer emulsions with modified sunflower lecithins and chitosan as delivery systems of omega-3 fatty acids[J].LWT, 2018, 89:581-590.
[19] DU Q W, ZHOU L H, LI M H, et al.Omega-3 polyunsaturated fatty acid encapsulation system:Physical and oxidative stability, and medical applications[J].Food Frontiers, 2022, 3(2):239-255.
[20] SUN X H, WANG H, LI S N, et al.Maillard-type protein-polysaccharide conjugates and electrostatic protein-polysaccharide complexes as delivery vehicles for food bioactive ingredients:Formation, types, and applications[J].Gels, 2022, 8(2):135.
[21] LI H Y, LI Z, WANG P W, et al.Evaluation of Citrus pectin extraction methods:Synergistic enhancement of pectin’s antioxidant capacity and gel properties through combined use of organic acids, ultrasonication, and microwaves[J].International Journal of Biological Macromolecules, 2024, 266:131164.
[22] WANG L L, WANG L L, WEN C R, et al.Chitosan and chitosan oligosaccharide influence digestibility of whey protein isolate through electrostatic interaction[J].International Journal of Biological Macromolecules, 2022, 222:1443-1452.
[23] WANG W D, LI C, CHEN C, et al.Effect of chitosan oligosaccharide glycosylation on the emulsifying property of lactoferrin[J].International Journal of Biological Macromolecules, 2022, 209:93-106.
[24] HU S S, LI W B, CAI Z, et al.Research progress on chitin/chitosan-based emulsion delivery systems and their application in lipid digestion regulation[J].Critical Reviews in Food Science and Nutrition, 2024, 64(33):13275-13297.
[25] CHANG Y G, MCCLEMENTS D J.Influence of emulsifier type on the in vitro digestion of fish oil-in-water emulsions in the presence of an anionic marine polysaccharide (fucoidan):Caseinate, whey protein, lecithin, or Tween 80[J].Food Hydrocolloids, 2016, 61:92-101.
[26] RIBAS FONSECA L, PORTO SANTOS T, CZAIKOSKI A, et al.Modulating properties of polysaccharides nanocomplexes from enzymatic hydrolysis of chitosan[J].Food Research International, 2020, 137:109642.
[27] SOLOMANDO J C, ANTEQUERA T, PEREZ-PALACIOS T.Lipid digestion products in meat derivatives enriched with fish oil microcapsules[J].Journal of Functional Foods, 2020, 68:103916.
[28] LYU W W, XU D X.Docosahexaenoic acid delivery systems, bioavailability, functionality, and applications:A review[J].Foods, 2022, 11(17):2685.
[29] ZHOU Q, WEI Z H.Food-grade systems for delivery of DHA and EPA:Opportunities, fabrication, characterization and future perspectives[J].Critical Reviews in Food Science and Nutrition, 2023, 63(15):2348-2365.