果胶主要由半乳糖醛酸通过β-1,4糖苷键连接而成,是一种广泛存在于高等植物中的亲水性胶体。研究表明,天然果胶具有抗炎、抗凝、抗肿瘤、抗氧化、抗菌和调节肠道等多种生物活性。然而,果胶分子质量大、结构复杂,溶解性差且生物利用率低,这限制了其生物活性的发挥[1]。在饲料工业中,果胶作为抗营养因子,会与其他营养物质结合,降低饲料的营养利用率,并对胃肠道功能产生不利影响,难以被动物吸收利用[2]。果渣是水果加工的副产物,因其产量大且富含蛋白质、维生素和各类矿物质,可被作为地域性的饲料原料。然而,果渣中通常含有大量的果胶,如苹果渣中含有10%~15%的果胶,番茄渣中含有5%~10%的果胶,这些果胶阻碍了动物对其他营养成分的利用,从而限制了果渣在饲料中的应用[3-4]。
目前,果胶降解的主要方法包括化学法、物理法和生物法。化学法是最传统也是应用最广泛的,但化学反应过于剧烈,降解过程与产物不易控制,且化学试剂的大量使用和残留可能对环境造成负面影响,在实际应用中存在诸多局限性[5]。物理降解法包括微波降解法、等离子体降解法、辐射降解法等,一般用于果胶预处理,性价比低,难以工业化应用[6]。生物法降解通过微生物发酵为果渣处理提供高效且丰富的酶系,可将果胶等大分子及难利用物质降解为小分子并转化为高价值的营养与功能物质[7],具有特异性强、反应条件温和和无毒副作用等优点,是果胶降解最有前景的工业化生产方法[8]。王婷[6]采用黑曲霉对柑橘果渣进行发酵,果胶降解率达到63.5%,然而,黑曲霉等真菌发酵过程需要强制通风,导致设备投入高,处理量低等不足,难以实现饲料工业的大规模应用。乳酸菌也常被用于果渣的青贮发酵,尽管乳酸菌发酵会产生大量的有机酸等有益代谢产物,但是由于乳酸菌分泌果胶酶能力低下,导致果胶降解率低,发酵后的果渣在单胃动物中使用比例不高[9]。酵母菌相对于乳酸菌和霉菌,具有更好的耐受性和生长速度,并具备一定的果胶降解能力,NAGA PADMA等[10]从果渣中分离出酵母菌,在以橙皮为底物的液体发酵条件下表现出最大21 U/mL的果胶酶活力,并有效降解果胶。此外,酵母在固态发酵过程中,可以产生多种可分解细胞壁的解聚酶,将结合态酚酸从细胞壁中释放出来,产生具有抗氧化力和抗菌能力的功能物质[11],但目前对产果胶酶酵母菌研究较少,在酵母菌发酵果渣方面有待研究。
因此,筛选具有产果胶酶能力的且具有一定益生潜力的酵母,将其应用于果渣发酵中,降低果渣中抗营养因子含量,积累有益代谢产物,提高发酵效率和产物的营养与功能价值,进而提高果渣的附加值,可以为动物养殖和食品工业等领域带来多重收益,实现资源的循环利用。
1 材料与方法
1.1 材料与试剂
分离培养基(g/L):牛肉膏5,蛋白胨5,果胶3,氯化钠(NaCl)1,硫酸镁(MgSO4)1,三水合磷酸氢二钾(K2HPO4·3H2O)1,磷酸二氢钾(KH2PO4)0.5。
果胶培养基(g/L):果胶5,酵母粉10,胰蛋白胨20。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基(g/L):葡萄糖20,酵母粉10,胰蛋白胨20。
YPD琼脂(g/L):葡萄糖20,酵母粉10,胰蛋白胨20,琼脂20。
LB培养基(g/L):胰蛋白胨10,酵母粉5,氯化钠10。
血琼脂平板(g/L):含有马血的哥伦比亚琼脂(胰酪胨10、心胰酶水解物3、肉胃蛋白酶水解物5、酵母浸出粉5、氯化钠5、玉米淀粉1、琼脂15、马血50),上海泰坦科技股份有限公司。
刚果红、果胶、胆汁盐、氯化钠、正己烷、半乳糖醛酸、咔唑、乙醇、硫酸、α-萘酚、三氯乙酸、盐酸、硼酸、氢氧化钠、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、碧云天SO119抗氧化力测定试剂盒、索莱宝D1900酵母基因组DNA提取试剂盒。
1.2 仪器与设备
CHS-100CL恒温恒湿培养箱,上海一恒科学仪器有限公司;Multiskan FC酶标仪,美国Thermo Fisher Scientific公司;H1750R高速冷冻离心机,湖南湘仪实验室仪器开发有限公司;1260高效液相色谱仪,美国Agilent Technologies公司;K1100全自动凯氏定氮仪,山东海能科学仪器有限公司;GSX1 PCR基因扩增仪,德国Eppendorf公司。
1.3 实验方法
1.3.1 菌种分离
采用从市场购买的新鲜采摘番茄,切取一定量番茄表皮作为菌种来源。将新鲜番茄皮浸泡在100 mL无菌水中,通过220 r/min摇床振荡30 min,将表面微生物转移至无菌水中。将分离液接入分离培养基中,在摇床(220 r/min,28 ℃)培养72 h后,培养液在YPD固体平板上进行稀释涂布培养,从而得到酵母菌单菌落,将分离得到的酵母菌接种在YPD培养基中培养24 h保存备用。
1.3.2 果胶培养基初筛
将分离得到的酵母菌接种在果胶培养基中,在28 ℃下220 r/min摇床培养过夜,对培养得到的菌液测定在600 nm下的吸光度,分析分离得到的酵母菌在果胶培养基中的生长情况。
1.3.3 刚果红染色法辅助菌种筛选
对分离得到的酵母菌采用刚果红染色法进行果胶酶酶活力鉴定。先将高压灭菌后的牛津杯用无菌镊子精准置于平整的果胶培养基平板上并轻压使其稳固,随后用微量移液器吸取200 mL酵母菌培养液缓慢注入牛津杯,避免气泡产生。接着把平板置于28 ℃恒温培养箱培养24 h,培养结束后将平板浸入5 g/L刚果红水溶液静置15 min,取出倒去溶液,再用1 mol/L氯化钠溶液浸没平板15 min后倒去,最后观测菌落旁有无明显水解圈的出现。
1.3.4 果胶酶活力测定
将初筛中可能具备良好果胶酶酶活力的菌株接种至YPD,在30 ℃的摇床上培养24 h。完成培养后,对培养液进行适度稀释,运用DNS法测定稀释粗酶液的果胶酶活力,进而筛选出酶活力较高的菌株。具体测定步骤如下:首先,利用0.05 mol/L、pH 5.0的柠檬酸-磷酸盐缓冲液配制10 g/L的果胶底物溶液,吸取1.8 mL该溶液置于具塞比色管中,接着加入0.2 mL稀释粗酶液,随后将其置于50 ℃水浴环境中酶解30 min。反应结束后取出,添加3 mL DNS试剂并充分混匀,立即放入沸水浴中煮沸10 min以灭活,之后用流动水快速冷却,再用蒸馏水定容至25 mL。在此过程中,以煮沸灭活的稀释粗酶液作为空白对照。最后,分别取0.2 mL溶液加入96孔板中,借助酶标仪在540 nm处测定OD值。按照果胶酶活力的定义,在50 ℃、pH 5.0的反应条件下,每分钟能够水解10 g/L的果胶底物溶液生产1 mmol半乳糖醛酸所需的酶量,将其定义为1个酶活力单位(U)。
1.3.5 耐酸耐胆盐性能鉴定
在YPD琼脂上通过滴板法评估存活率。存活率为最终lg CFU/mL与初始lg CFU/mL比值,以百分比表示。将在YPD培养基中生长的过夜酵母培养物离心(4 000×g,5 min),用pH 7.0的无菌磷酸盐缓冲液洗涤细胞沉淀2次,并重悬于5 mL pH 2.5的无菌磷酸盐缓冲液中。
菌株耐胆盐性能测定方法同耐酸性能测定方法相似,将细胞沉淀重悬于pH 4.5的磷酸缓冲液中,并加入3 g/L的胆汁盐,然后,将如此制备的样品在37 ℃的静态条件下孵育3 h。在0 h(初始)和3 h(最终)后取等分试样,并在无菌盐水下进行稀释涂布,培养24 h后,得到每毫升试样的细菌数,进而计算出存活率。
1.3.6 疏水性
疏水性能参考LATA等[12]的方法,将过夜酵母培养物以4 000×g离心10 min。细胞沉淀用0.1 mmol/L的PB溶液(pH 7.0)洗涤2次并调整至OD600为1.0±0.05。通过涡旋(10 s)将3 mL细胞悬液与0.6 mL正己烷充分混合,在37 ℃培养3 h后,小心回收水相并测量OD600值。细胞表面疏水性的计算如公式(1)所示:
疏水性![]()
(1)
式中:OD0,培养前OD600值;OD1,培养后OD600值。
1.3.7 自聚集能力与共聚集能力
自聚集能力的测定参考OGUNREMI等[13]的方法,通过离心(4 000×g,10 min)收集新鲜酵母细胞,并用0.2 mol/L磷酸缓冲液溶液(pH 7.2)洗涤2次。OD600调整为0.25±0.05。通过涡旋30 s将细胞沉淀重悬于2 mL无菌磷酸缓冲液中,然后在37 ℃下孵育24 h。从上部区域小心取出这些悬浮液的等分试样(1 mL),并测定OD600。自聚集能力的计算如公式(2)所示:
自聚集能力![]()
(2)
式中:OD0,培养前OD600值;OD1,培养后OD600值。
共凝集实验中,将病原菌大肠杆菌(革兰氏阴性菌)和金黄色葡萄球菌(革兰氏阳性菌)在LB培养基中37 ℃培养24 h,4 000×g离心5 min,用磷酸缓冲液调节OD600为0.25±0.02。将等体积的病原菌和酵母菌混合,在与自凝集实验相同的培养条件下培养,并记录OD600。共聚集能力的计算如公式(3)所示:
共聚集能力![]()
(3)
式中:OD0,培养前OD600值;OD1,培养后OD600值。
1.3.8 溶血活性
溶血活性是通过在血琼脂平板点接种酵母菌株来进行的。根据LATA等[12]使用的方法,将平板在37 ℃下孵育48 h。酵母菌落周围出现清晰区域(表示为b-溶血)或绿色区域(表示为a-溶血)被认为是阳性结果,这意味着不符合益生菌的资格。只有在血琼脂平板上生长后既不显示溶血晕圈也不显示绿色带的酵母菌株(表示为g-溶血,即不溶血)才被认为是安全的并用于接下来的研究。
1.3.9 分子生物学鉴定
首先利用DNA快速提取试剂盒从分离菌株中提取基因组DNA作为模板,接着采用通用引物ITS1(5′-TCCGTAGGTGAACCTGCGG-3′)和ITS4(5′-TCCTCCGCTTATTGATATGC-3′)进行PCR扩增,将扩增结果委托天霖生物科技无锡有限公司测序后,把测序结果提交至美国国家生物技术信息中心(https://blast.ncbi.nlm.nih.gov/)的Gen Bank数据库进行基本局部比对搜索工具同源性比对搜索,再选取同源性较高的模式菌株的26S rDNA基因序列用Clustal X2和MEGA11.0软件处理,最终采用邻接法构建系统进化树以完成对菌株的分子生物学鉴定。
1.3.10 酵母菌果渣发酵实验
将筛选所得菌株在YPD培养基中培养24 h,按5%接种量分别接种至番茄渣中并补充水分至60%,在30 ℃下发酵48 h,干燥粉碎。
1.3.11 果渣营养品质评价
果胶含量参考NY/T 2016—2011《水果及其制品中果胶含量的测定分光光度法》进行测定。还原糖采用DNS法进行测定。粗蛋白与酸溶蛋白含量参考NY/T 3801—2020《饲料原料中酸溶蛋白的测定》利用凯氏定氮法进行测定。总抗氧化力(ferric reducing antioxidant power assay,FRAP法)利用碧云天SO119试剂盒进行测定。水解氨基酸含量及组成采用HPLC测定,样品处理方法如下:精确称取0.1 g样品,将其置于水解管中,加入8 mL浓度为6 mol/L的盐酸溶液,混匀后采用氮气吹扫处理2 min,于120 ℃烘箱中水解22 h,取出冷却至室温。加入4.8 mL 10 mol/L氢氧化钠溶液中和,用蒸馏水定容至25 mL,之后采用双层滤纸对溶液进行过滤处理,取滤液在10 000×g的条件下离心10 min,最后准确吸取400 mL离心后的上清液转移至液相小瓶中,以便进行后续的HPLC测定分析。
1.4 数据处理
在本研究中,数据分析采用Origin 2023b(OriginLab,USA)和IBM SPSS Statistics 26.0(IBM,USA)进行数据整理与统计分析。
2 结果与分析
2.1 具有果胶利用能力的酵母菌的筛选
从果渣中分离得到161株酵母菌,将这161株酵母菌接种于果胶培养基中,测定培养液在600 nm下的吸光度,绘制频数分布直方图,结果如图1所示。具备果胶酶活力的酵母菌可以利用果胶从而在以果胶为唯一碳源的培养基中得到良好生长,因此,酵母菌在果胶培养基中的生长情况可以在一定程度上反映酵母菌产果胶酶的水平。以吸光度大于0.6为分离菌生长良好的标准,可以得到57株具有良好生长能力的酵母菌,分别保藏用于后续实验。
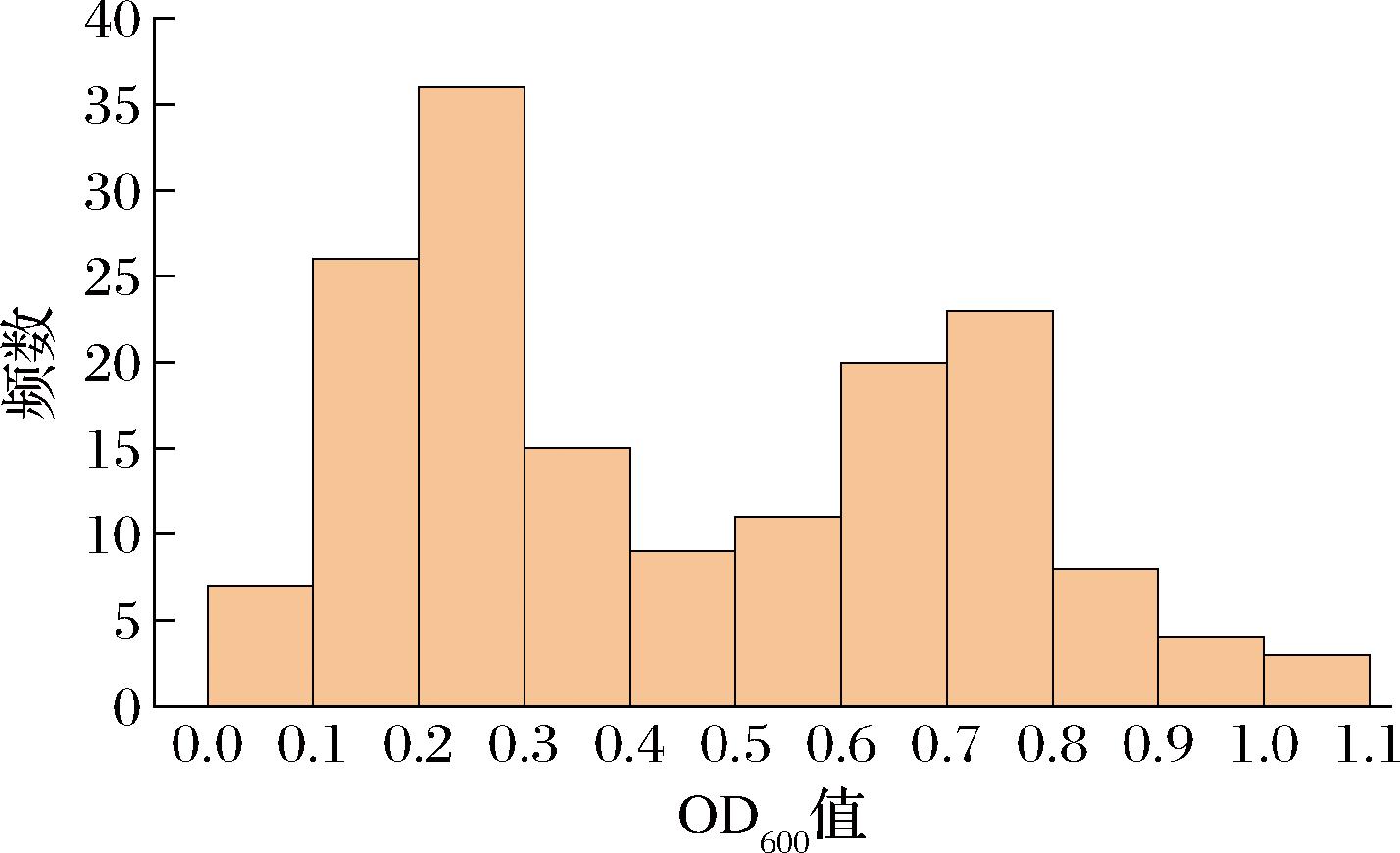
图1 酵母菌在果胶培养基生长能力频数分布图
Fig.1 Frequency distribution of yeast growth ability in pectin medium
2.2 产果胶酶酵母菌的初步筛选
采用刚果红染色法辅助筛选具有果胶酶活力的酵母菌,初筛得到的57株酵母菌中,有12株能够形成明显红色透明圈,而其余45株酵母菌未形成透明圈或透明圈不明显(图2-a)。果胶经果胶酶分解后,其多糖水解物可与刚果红染料形成有红色透明圈的复合物,由此可判别菌株是否具有产果胶酶的能力[14]。将12株能够形成明显红色透明圈的酵母分别命名为A1~A12,其中A9酵母菌在平板上利用刚果红染色法染色结果如图2-b所示,可以看出酵母菌A9周围出现较大透明圈,透明圈直径与菌落直径比例达到3以上。
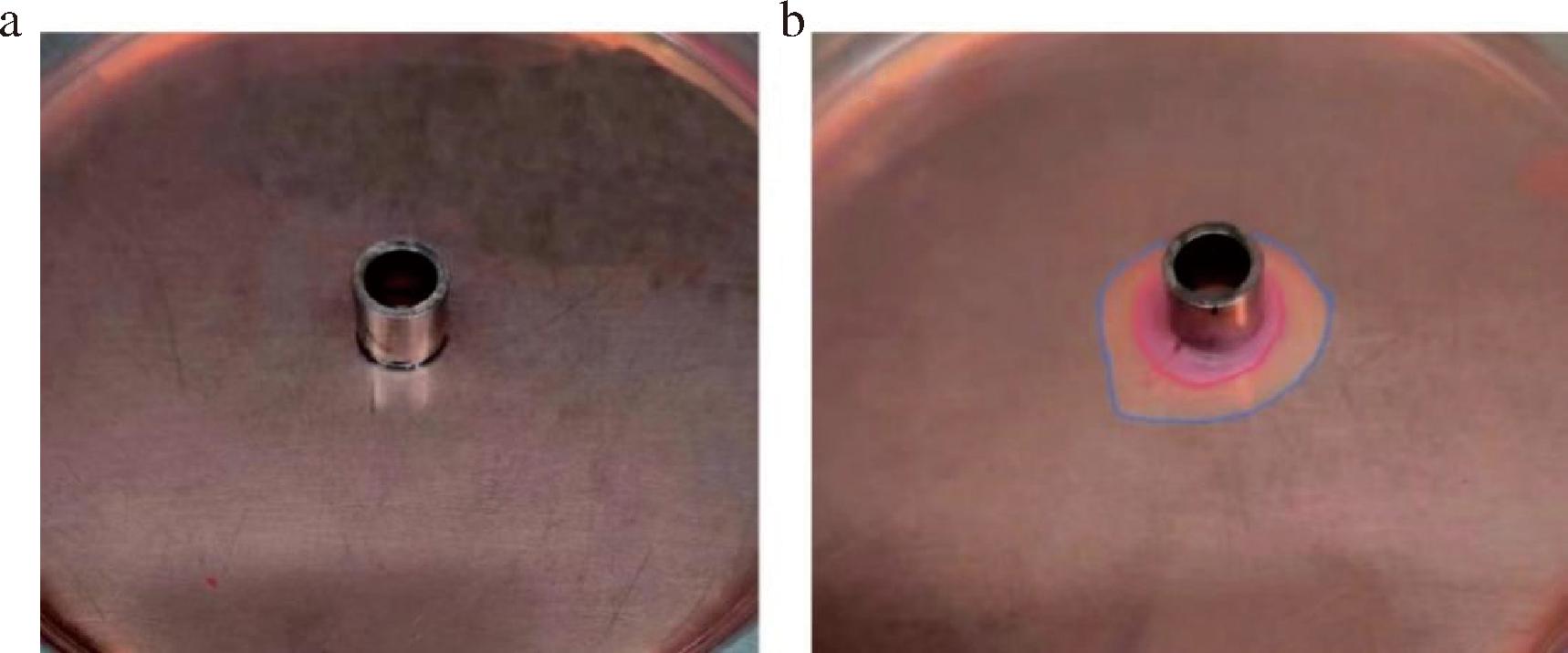
a-不产果胶酶酵母;b-产果胶酶酵母
图2 酵母菌刚果红染色结果
Fig.2 Yeast Congo red staining results
2.3 具有果胶利用能力的酵母菌的筛选
将初筛所获得的12株酵母菌进行培养,采用DNS法对发酵液的果胶酶活力进行测定,结果见表1,经过刚果红染色后形成的透明圈直径(DP)与菌落直径(DC)的比值与酵母菌发酵所产生的果胶酶活力大小在一定程度上呈正相关,随着(DP/DC)比值的增大,果胶酶活力逐渐增大。在50 ℃和pH 5.0 的条件下,A3、A4、A8、A9四株酵母菌与其他菌株相比表现出更高的产酶能力。此前,卢晓华[15]实验中采用相似筛选方法得到的酵母菌,其果胶酶活力最高为15.13 U/mL,因此认为这4株酵母菌在产果胶酶方面具有很好的优势,可以作为果渣发酵的候选菌株。
表1 产生透明圈菌株(DP/DC)比值及相应的果胶酶活力
Table 1 Ratio of strains producing transparent circle (DP/DC) and corresponding pectinase activity
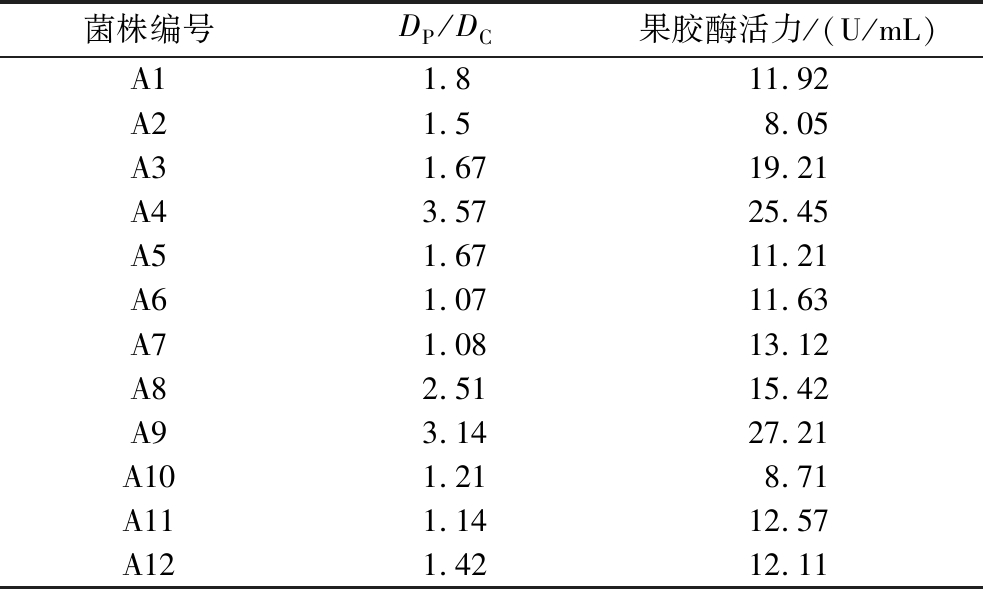
菌株编号DP/DC果胶酶活力/(U/mL)A11.811.92A21.58.05A31.6719.21A43.5725.45A51.6711.21A61.0711.63A71.0813.12A82.5115.42A93.1427.21A101.218.71A111.1412.57A121.4212.11
2.4 产果胶酶酵母菌的益生潜力评价
通过测定酵母菌耐酸耐胆盐性能、疏水性、自聚集与共聚集能力和溶血活性可以评估其益生潜力[16],对复筛获得的4株具有较好产果胶酶能力的酵母菌的益生潜力进行评价,结果见表2。在耐酸耐胆盐性能方面,4株酵母菌耐酸性能最低为81%,而在LATA等[12]的文献中,指出具有良好益生性能的酵母耐酸性能应大于78%,并且4株酵母菌的耐盐性能接近布拉氏酵母的89.98%,这表明,4株酵母菌能够在胃肠道极端酸度(pH 2.0~3.0)以及胆盐环境存活。
表2 产果胶酶酵母菌益生性能评估结果 单位:%
Table 2 Evaluation results of probiotic properties of yeasts producing pectinase
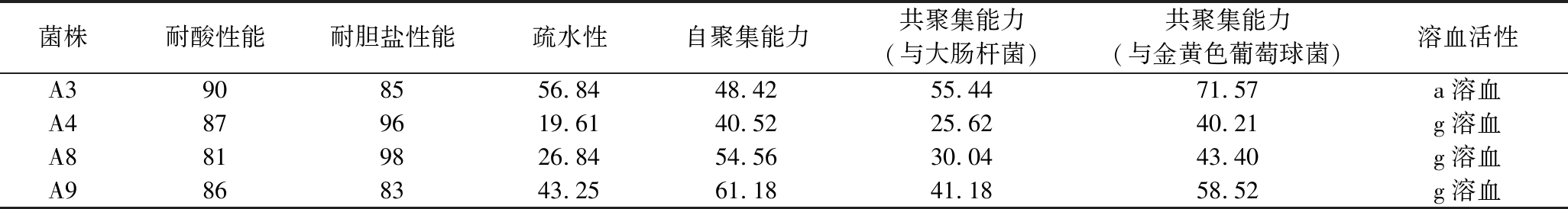
菌株耐酸性能耐胆盐性能疏水性自聚集能力共聚集能力(与大肠杆菌)共聚集能力(与金黄色葡萄球菌)溶血活性A3908556.8448.4255.4471.57a溶血A4879619.6140.5225.6240.21g溶血A8819826.8454.5630.0443.40g溶血A9868343.2561.1841.1858.52g溶血
由于哺乳动物胃肠道表面的磷脂层使其具有疏水性,高疏水性细胞能够更牢固得附着在上面,进而发挥益生功效,否则可能会更容易从肠道黏膜上分开,进而排出体外。菌株自聚集并表现出良好的疏水性,表明它们能够黏附在细胞单层上,可用于识别潜在的益生菌[17]。在疏水能力方面,A3和A9菌株的疏水性大于40%,而A4与A8菌株疏水性低于30%,疏水性欠佳。在自聚集方面,4株酵母菌自聚集能力均大于40%,且A9菌株自聚集能力最强(61.18%)。在DEL RE等[17]的研究中,对肠道细胞黏附性最好的菌株自聚集能力为40%~60%,自聚集能力过低,菌株在肠道中难以形成稳定定植;而过高时,聚集体因体积庞大,难以有效接近并附着于肠道上皮细胞的黏附位点。益生菌于病原菌的共聚集能力是肠道的一道免疫屏障,在益生菌与病原菌共聚集后可以与病原菌竞争营养物质,抑制其生长繁殖,甚至分泌抗菌物质,直接抑制或杀灭细菌。A3和A9菌株与大肠杆菌共聚集能力为40%~60%,而A4与A8菌株与酵母菌共聚集能力为30%左右,而在与金黄色葡萄球菌共聚集能力方面,A3菌株表现出71.57%的高共聚集能力,其次是A9菌株的58.52%,而其他2株酵母共聚集能力为40%左右。较低的共聚集能力不利于益生菌在肠道表面形成有效的屏障,使得肠道易受病原体侵蚀,损害肠道健康。综合疏水性和聚集能力,A3和A9菌株能够更好发挥肠道益生屏障作用,初步确定为潜在益生菌。
利用血琼脂平板评价其溶血活性,其中A3菌株结果为a-溶血,为条件致病菌,不具备明显安全性。综合产果胶酶能力和益生潜力评价,最终确定A9菌株用于后续发酵实验。
2.5 目的菌种的鉴定
对A9酵母菌采用通用引物ITS1和ITS4进行PCR扩增,将扩增得到的ITS序列通过NCBI数据库进行比对通过MEGA构建系统发育树。系统发育树如图3所示,菌株A9与德氏圆酵母IC1的ITS序列同源性高达99%,因此确定该酵母菌为德氏圆酵母(Torulaspora delbrueckii)。德氏圆酵母是最早被商业化的非酿酒酵母之一,通常用于与酿酒酵母共同发酵以促进发酵并减少衍生物的产生,可以促进发酵过程中前体聚合物的分解,从而提高发酵性能,在啤酒与果酒酿造中得到广泛应用[18]。目前对德氏圆酵母的研究表明其在糖类物质的转化方面具有一定潜力,这与本研究中德氏圆酵母的高果胶酶活力相符合。
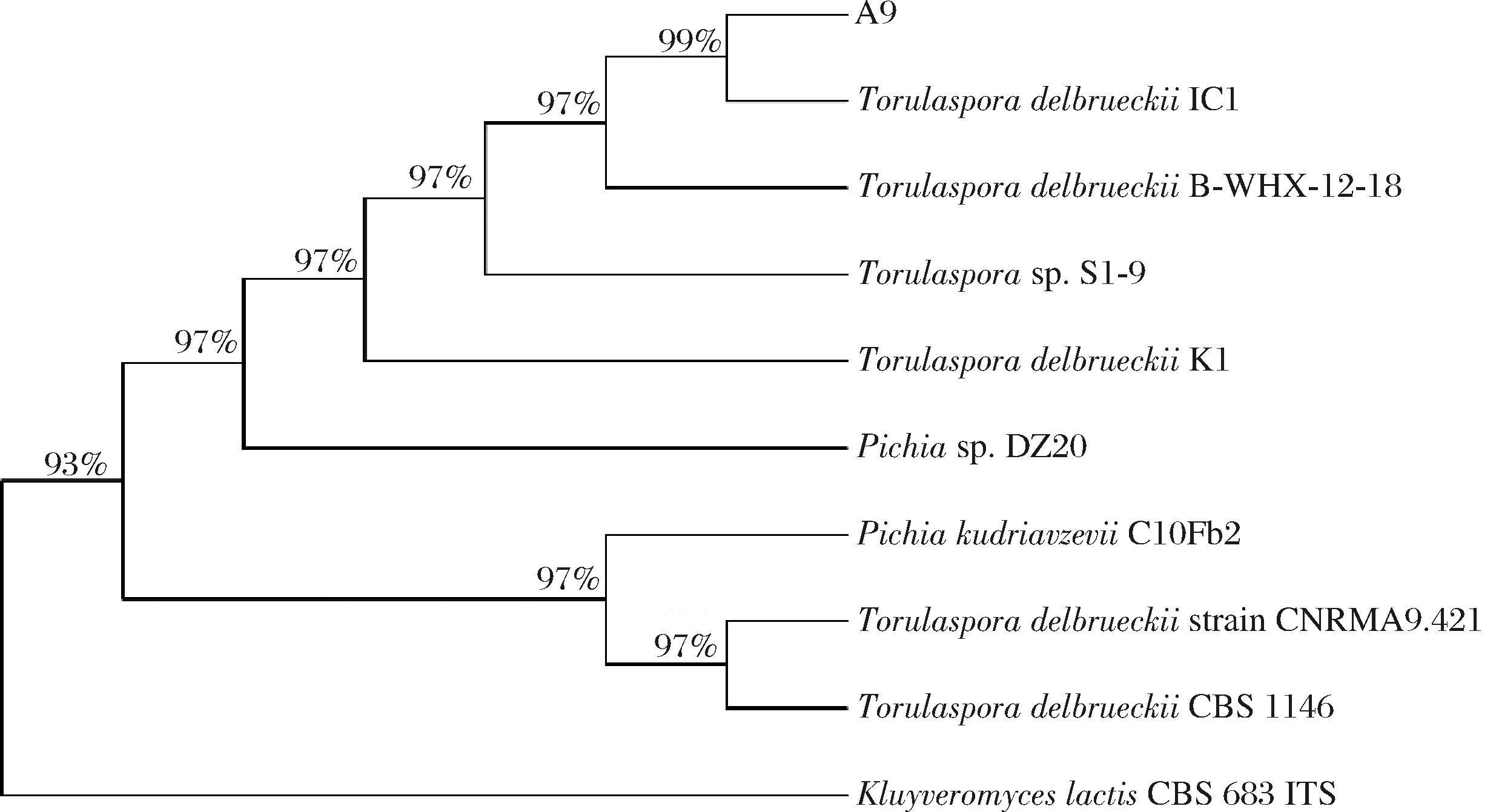
图3 酵母菌A9的系统发育树
Fig.3 Phylogenetic tree of yeast A9
2.6 产果胶酶酵母菌的益生潜力评价
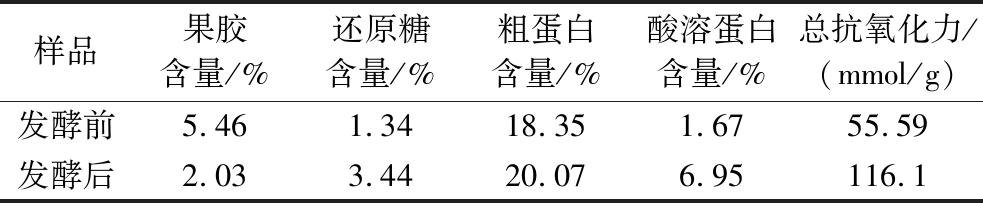
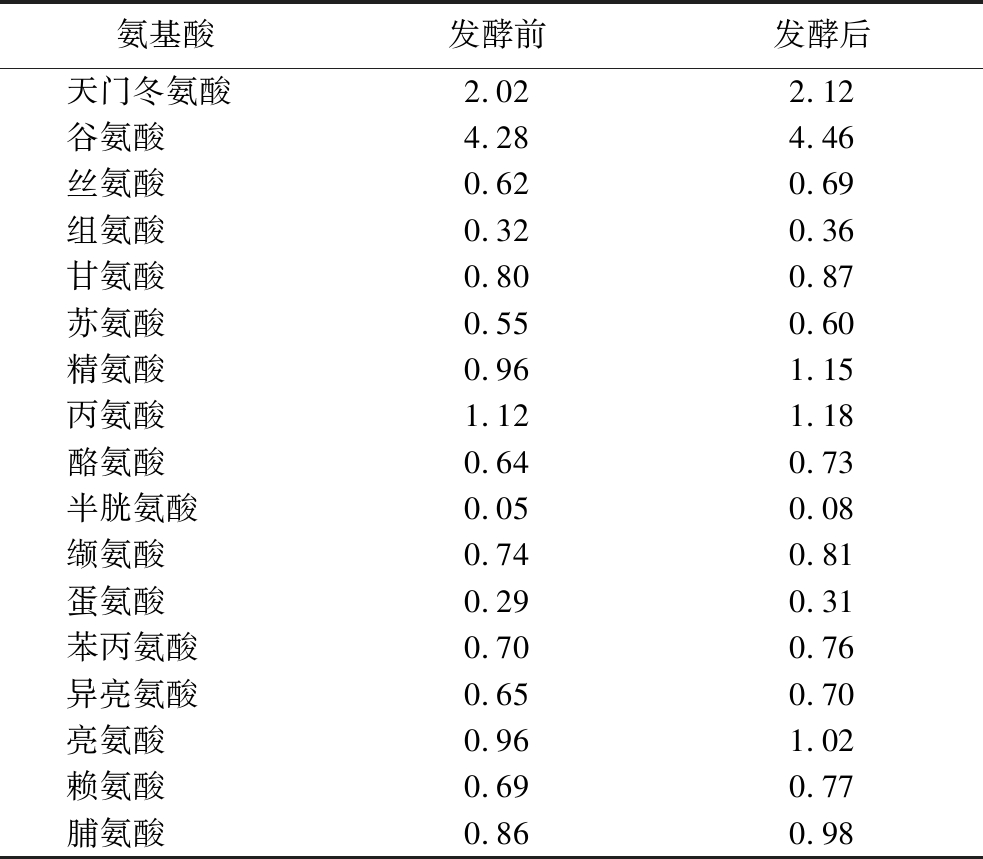
番茄果胶相较于柑橘与苹果果胶而言,具有更高的黏弹性[19],会对营养物质的吸收形成更大程度的阻碍。因此,以番茄渣作为研究对象,采用德氏圆酵母A9对番茄渣进行固态发酵处理,并对发酵前后番茄渣品质进行分析(表3)。发酵后,果胶含量从5.46%大幅下降至2.03%,相对应的,还原糖含量从1.34%提高到了3.44%。在发酵过程中,酵母菌对果胶进行了高效分解,这为动物提供了更为丰富的可利用能量,有助于显著提高动物的生长性能和生产效率。此外,果胶含量降低后,番茄渣的口感和质地也可能发生积极转变,更利于动物采食。粗蛋白含量从18.35%上升到20.07%,这可能与酵母菌在发酵过程中产生酒精和二氧化碳等代谢产物,并在干燥过程挥发,蛋白质得到相对浓缩有关,这一变化极大地提高了饲料的营养价值,为动物的生长发育提供了更充足的蛋白质支持。另外,大分子蛋白在酵母菌发酵过程中得到一定程度的降解,使得酸溶蛋白含量从1.67%显著提高至6.95%,酸溶蛋白的增加对于动物的消化系统来说,意味着蛋白质能够被更加高效地利用,减少了蛋白质的浪费,提高了饲料的利用率,降低养殖成本。在发酵过程中,由于酵母菌的菌体蛋白合成与生物转化作用,氨基酸组成也发生了改变,其发酵前后变化情况见表4。其中含量增加最明显的是半胱氨酸,相比发酵前提高60.3%。半胱氨酸作为人体条件必需氨基酸,也是酵母合成谷胱甘肽的重要前体,具有延缓自由基介导的细胞老化进程、增强动物免疫力和抗应激能力的作用,在维护细胞正常功能和机体健康稳态方面发挥重要作用[20]。其次,赖氨酸和精氨酸含量也有较为明显的增加。赖氨酸是动物体内合成蛋白质的必需氨基酸,对动物生长发育、骨骼肌肉生长有重要作用[21],精氨酸则对动物心血管系统和免疫系统具有重要调节作用[22]。在抗氧化能力方面,总抗氧化力从发酵前的55.59 mmol/g 提高到发酵后的116.1 mmol/g,表明发酵后的番茄渣具有更强的抗氧化能力,有助于减少饲料在贮存和使用过程中的氧化变质,延长饲料的保质期。抗氧化物质会对动物的健康产生积极影响,能够减少自由基对细胞的损伤,提高动物的免疫力和抗应激能力[23]。
表3 德氏圆酵母发酵对果渣品质的影响
Table 3 The effect of fermentation by T.delbrueckii on the quality of pomace
样品果胶含量/%还原糖含量/%粗蛋白含量/%酸溶蛋白含量/%总抗氧化力/(mmol/g)发酵前5.461.3418.351.6755.59发酵后2.033.4420.076.95116.1
表4 番茄渣发酵前后水解氨基酸组成对比 单位:%
Table 4 Comparison of hydrolyzed amino acid composition before and after tomato pomace fermentation
氨基酸发酵前发酵后天门冬氨酸2.022.12谷氨酸4.284.46丝氨酸0.620.69组氨酸0.320.36甘氨酸0.800.87苏氨酸0.550.60精氨酸0.961.15丙氨酸1.121.18酪氨酸0.640.73半胱氨酸0.050.08缬氨酸0.740.81蛋氨酸0.290.31苯丙氨酸0.700.76异亮氨酸0.650.70亮氨酸0.961.02赖氨酸0.690.77脯氨酸0.860.98
3 结论与讨论
本研究从果渣样品中进行产果胶酵母菌菌种筛选,通过果胶培养基分离初筛、刚果红染色辅助筛选和果胶酶活力测定,获得4株具有较高产果胶酶能力的酵母菌株,结合4株酵母菌的益生性能评价,最终确定酵母菌A9为发酵菌株,用于后续果渣发酵降解果胶的研究,经鉴定其为德氏圆酵母(Torulaspora delbrueckii)。番茄渣经德氏圆酵母A9发酵后,果胶含量从5.46%降至2.03%,还原糖含量从1.34%升至3.44%,粗蛋白含量从18.35%上升到20.07%,酸溶蛋白含量提高316.17%,此外,总抗氧化能力显著提高,发酵后果渣的抗营养因子含量降低,营养品质得到改善,为畜牧业可持续发展提供了优质饲料资源,为果渣资源的循环利用提供新的思路。
[1] 马文鑫, 贾敏, 李倩, 等.果胶改性的研究进展[J].食品与发酵工业, 2022, 48(9):274-279.MA W X, JIA M, LI Q, et al.Research progress of pectin modification[J].Food and Fermentation Industries, 2022, 48(9):274-279.
[2] 刘金梅, 常文环, 陈志敏, 等. 果胶及其微生物降解研究进展[J]. 畜牧兽医学报, 2023, 54(7):2723-2731.LIU J M, CHANG W H, CHEN Z M, et al. Research progress of pectin and its microbial degradation[J]. Acta Veterinaria et Zootechnica Sinica, 2023, 54(7):2723-2731.
[3] 孙静, 王宇滨, 王丹, 等.果胶提取方法、结构和改善慢性疾病研究进展[J].食品工业科技, 2024, 45(22):371-382.SUN J, WANG Y B, WANG D, et al.Research progress on extraction methods, structure and improvement of chronic diseases of pectins[J].Science and Technology of Food Industry, 2024, 45(22):371-382.
[4] 崔潇文, 袁茂翼, 叶发银, 等. 蒸汽爆破预处理对番茄皮渣膳食纤维组成及理化特性的影响[J]. 食品与发酵工业, 2021, 47(21):170-177.CUI X W, YUAN M Y, YE F Y, et al. Effects of steam explosion pretreatment on the composition and physicochemical properties of dietary fiber from tomato pomace[J]. Food and Fermentation Industries, 2021, 47(21):170-177.
[5] GARNA H, MABON N, NOTT K, et al.Kinetic of the hydrolysis of pectin galacturonic acid chains and quantification by ionic chromatography[J].Food Chemistry, 2006, 96(3):477-484.
[6] 王婷. 柑橘果胶低聚糖的酶法制备及生物活性研究[D].南京:南京林业大学, 2023.WANG T.Study on the enzymatic preparation and biological activity of citrus pectin oligosaccharides[D].Nanjing:Nanjing Forestry University, 2023.
[7] 车金鑫, 郭虹雨, 陈珂琴, 等.柑橘废弃物利用的研究进展[J].食品与发酵工业, 2022, 48(20):300-306.CHE J X, GUO H Y, CHEN K Q, et al.Research progress of citrus waste utilization[J].Food and Fermentation Industries, 2022, 48(20):300-306.
[8] LI J, PENG C, MAO A H, et al.An overview of microbial enzymatic approaches for pectin degradation[J].International Journal of Biological Macromolecules, 2024, 254:127804.
[9] 高博兰. 乳酸菌对苹果渣青贮发酵品质及体外发酵特性的影响[D].哈尔滨:东北农业大学, 2020.GAO B L.Effects of lactic acid bacteria on fermentation quality of apple residue silage and fermentation characteristics in vitro[D].Harbin:Northeast Agricultural University, 2020.
[10] NAGA PADMA P, ANURADHA K, REDDY G. Pectinolytic yeast isolates for cold-active polygalacturonase production[J]. Innovative Food Science &Emerging Technologies, 2011, 12(2):178-181.
[11] 张凯歌, 江迪, 万小乐, 等.微生物固态发酵麦麸的营养品质及其资源化利用的研究进展[J].食品与发酵工业, 2024, 50(4):337-346.ZHANG K G, JIANG D, WAN X L, et al.Research progress on nutritional quality and resource utilization of microbial solid-state fermented wheat bran[J].Food and Fermentation Industries, 2024, 50(4):337-346.
[12] LATA P, KUMARI R, SHARMA K B, et al.In vitro evaluation of probiotic potential and enzymatic profiling of Pichia kudriavzevii Y33 isolated from traditional home-made mango pickle[J].Journal of Genetic Engineering and Biotechnology, 2022, 20(1):132.
[13] OGUNREMI O R, AGRAWAL R, SANNI A.Production and characterization of volatile compounds and phytase from potentially probiotic yeasts isolated from traditional fermented cereal foods in Nigeria[J].Journal of Genetic Engineering and Biotechnology, 2020, 18(1):16.
[14] 谷艺明. 果胶酶高产菌株的筛选、发酵优化及酶学性质的研究[D].常州:常州大学, 2021.GU Y M.Screening of high-yielding pectinase strains, optimization of fermentation and study of enzymatic properties[D].Changzhou:Changzhou University, 2021.
[15] 卢晓华. 果胶酶产生菌的筛选鉴定、产酶条件优化及酶学性质研究[D].武汉:湖北工业大学, 2016.LU X H.Screen and identification of pectinase-production strains, optimization of pectinase-production conditions and study on characterization of pectinase[D].Wuhan:Hubei University of Technology, 2016.
[16] BONATSOU S, KARAMOUZA M, ZOUMPOPOULOU G, et al.Evaluating the probiotic potential and technological characteristics of yeasts implicated in cv.Kalamata natural black olive fermentation[J].International Journal of Food Microbiology, 2018, 271:48-59.
[17] DEL RE B, SGORBATI B, MIGLIOLI M, et al. Adhesion, autoaggregation and hydrophobicity of 13 strains of Bifidobacterium longum[J]. Letters in Applied Microbiology, 2000, 31(6):438-442.
[18] 侯若婷, 赵鹏, 徐馨莹, 等.德尔布有孢圆酵母与四种酿酒酵母顺序发酵对草莓酒香气与感官喜好性的影响[J].食品与发酵工业, 2024, 50(14):165-172.HOU R T, ZHAO P, XU X Y, et al.Effect of sequential fermentation with Torulaspora delbrueckii and four Saccharomyces cerevisiaes on volatile aromatic compounds and sensory preferences of strawberry wines[J].Food and Fermentation Industries, 2024, 50(14):165-172.
[19] 冯爽, 李祖迪, 岳伟, 等.番茄皮渣果胶结构表征与流变学特性研究[J].食品与发酵工业, 2024, 50(24):51-57.FENG S, LI Z D, YUE W, et al.Study on structural and rheological properties of pectin from tomato pomace[J].Food and Fermentation Industries, 2024, 50(24):51-57.
[20] LAHER I, BEAM J, BOTTA A, et al.Short-term exercise worsens cardiac oxidative stress and fibrosis in 8-month-old db/db mice by depleting cardiac glutathione[J].Free Radical Research, 2013, 47(1):44-54.
[21] 左家信, 冯家力, 周丽平, 等.湖南产地4种豆类蔬菜中氨基酸组成及营养评价[J].实用预防医学, 2022, 29(2):174-178.ZUO J X, FENG J L, ZHOU L P, et al.Amino acid composition and nutritional value evaluation of four kinds of legume vegetables produced in Hunan[J].Practical Preventive Medicine, 2022, 29(2):174-178.
[22] CHEN C L, HSU S C, ANN D K, et al.Arginine signaling and cancer metabolism[J].Cancers, 2021, 13(14):3541.
[23] CORINO C, ROSSI R.Antioxidants in animal nutrition[J].Antioxidants, 2021, 10(12):1877.