猪肉味道鲜美、营养丰富,深受广大消费者的喜爱,但在销售过程中,肉汁会积聚于包装盒底部,导致微生物快速繁殖,缩短猪肉货架期[1]。因此,控制猪肉的汁液损失和微生物的生长可以减少在生产、销售和贮存过程中的损失。市场上鲜肉包装采用难降解的一次性吸水垫吸收多余猪肉汁液来延缓腐败变质,但其吸液能力低,无抗菌性,不能有效抑制猪肉表面微生物的生长增殖,严重阻碍鲜肉行业的发展。因此,亟须开发具有超吸水性、抗菌性的食品级保鲜垫。与传统气凝胶海绵制备方法不同,冷冻凝胶海绵(简称冻胶海绵)通过冻融含有交联剂的前驱体溶液制得,具有松散的多孔结构、良好的孔隙率、机械性能及优异的吸水能力[2],是抗菌剂的理想载体,已广泛应用于药物传递、载药凝胶等领域。然而,在猪肉保鲜方面却鲜有报道。
为了确保海绵在猪肉保鲜中的安全,选择合适的基材至关重要。由单一生物聚合物组成的海绵的性能相对较差,许多研究使用2种或多种生物聚合物来改善海绵性能。壳聚糖(chitosan,CS)和明胶(gelatin,GEL)作为天然生物高分子材料,兼具原料来源广泛、无毒、可生物降解性等特性,广泛应用于食品、包装[3]、药物递送等领域,是制备复合海绵的潜在候选材料[4]。复合海绵常需交联剂以形成稳定致密的结构,而传统交联剂如戊二醛、环氧丙烷及京尼平等,存在生物毒性和成本问题,限制其在多糖基食品包装方面的应用。柠檬酸(citric acid,CA)作为一种天然三元酸,安全无毒、价格低廉且反应活性优良,可以积极参与聚合物网络的氢键作用。许多研究学者[5-7]使用CA作为交联剂改善材料的稳定性、机械性能和生物相容性。2,2,6,6-四甲基哌啶-N-氧化物(2,2,6, 6-tetramethylpiperidine-N-oxide,TEMPO)氧化纳米纤维素(tempo nanocellulose,TOCNF)通过将纤维素链上的C6-羟基选择性氧化为羧酸盐基团,赋予其出色的机械性能及亲水性、生物相容性及可降解性,而且符合食品安全标准[8],适用于各种食品接触材料[9]。在聚合物网络中加入TOCNF,引入羧酸盐基团与CS及GEL中的氨基进行交联,可以进一步增强海绵的吸水性及机械性能[10]。
同时,为了抑制猪肉的氧化和细菌生长,可以将具有抗菌和抗氧化特性的物质引入复合海绵[11-12]。牛至精油(oregano essential oil,OEO)主要成分是香荆芥酚和百里香酚[13],可以通过控制脂质和蛋白质氧化及抑制微生物生长来延长肉类的保质期[14],是理想的天然植物保鲜剂,已得到美国食品药品监督管理局的安全认证[15]。
本研究以CA为绿色交联剂,TOCNF为增强剂,以冷冻冰晶为制孔模板制备出壳聚糖/明胶基高吸水冻胶海绵。研究CA、TOCNF、OEO的加入对海绵溶胀性、机械性能、抗菌性能的影响。于4 ℃对冷鲜肉进行保鲜,评价吸水垫对冷鲜肉汁液损失率、总挥发性盐基氮(total volatile base nitrogen,TVB-N)含量、菌落总数(total viable count, TVC)、pH值、颜色的影响,为高吸水生物质基海绵垫应用于冷鲜肉贮藏保鲜提供参考。
1 材料与方法
1.1 材料与试剂
壳聚糖(脱乙酰度≥95%,黏度=100~200 MPa·s)、TEMPO,上海麦克林化学试剂有限公司;明胶(化学纯)、冰乙酸、柠檬酸、氢氧化钠、次氯酸钠、碳酸钠、碳酸氢钠、溴化钠,国药集团化学试剂有限公司;牛至精油(纯度≥85%),江西华宝天然香料油有限公司;去离子水,实验室提供;生鲜猪肉,江苏无锡方庙睦邻农贸市场。以上除特殊注明外均为分析纯。
1.2 仪器与设备
IKA HS4恒温数显磁力搅拌器,广州艾卡仪器有限公司;FJ 300-S数显高速分散均质机,上海精密科学仪器有限公司;Scientz-20F真空冷冻干燥机,宁波新芝生物科技有限公司;NEXUS傅里叶变换红外光谱(Fourier transform infrared spectroscopy, FTIR)仪,美国尼高力公司;Evo18钨灯丝扫描电子显微镜(scanning electron microscope, SEM),德国卡尔蔡司公司;Q500热重分析仪,美国沃特世公司;Bruker D8 X射线衍射(X-ray diffraction,XRD)仪,德国布鲁克AXS有限公司;E43-104 微机控制电子万能材料试验机,美特斯工业系统(中国)有限公司;CR-400/410色彩色差仪,柯尼卡美能达。
1.3 实验方法
1.3.1 TEMPO氧化芦苇纳米纤维素的制备
参照KWON等[16]的做法并进行修改。取10 g芦苇浆与0.5 mol/L的Na2CO3/NaHCO3缓冲溶液(pH值为10.5)混合,加入0.15 g TEMPO和2 g NaBr作为氧化剂和催化剂,在室温下混合均匀后加入12 mmol/L NaClO溶液,用1 mol/L的HCl和NaOH溶液将pH值维持在10~10.5,直至溶液体系的pH不再发生变化后,加入乙醇终止反应,离心后置于透析袋透析至中性,冷冻干燥48 h,配制成10 g/L的纤维素悬浮液,高压均质后备用。
1.3.2 TOCNF增强CA交联CS/GEL复合海绵的制备
参照YANG等[6]的做法并进行修改。取一定质量的TOCNF(质量分数,基于CS+GEL)与10 g/L CS(溶于体积分数为1%的乙酸)混合均匀后,加入4 g/L GEL 60 ℃搅拌1 h,然后加入一定质量的CA(质量分数,基于CS+GEL)继续搅拌2 h,高速均质5 min,超声消泡并待其冷却,制得前驱体溶液。将前驱体溶液倒入模具,将其置于保温箱中,在-20 ℃冰箱梯度降温冷冻24 h,取出后于0.5 mol/L NaOH溶液中融化除酸,并用去离子水反复洗涤至中性,然后冷冻干燥32 h,得到白色的复合海绵。将添加30%CA的复合海绵命名为CGC,添加30%CA和7%TOCNF的复合海绵命名为CGCT。将未添加CA和TOCNF的前驱体溶液直接进行冷冻干燥,制得纯的CS/GEL复合海绵,命名为CG。
1.3.3 CGCT-OEO复合海绵的制备
参照DAI等[11]的方式采用浸泡负载法将牛至精油均匀地负载到海绵上。将CGCT复合海绵放入含有体积分数为2%牛至精油的乙醇溶液中浸泡12 h,并于40 ℃真空干燥12 h,得到负载牛至精油的复合抗菌海绵CGCT-OEO。
1.3.4 性能测试
1.3.4.1 FTIR测试
将芦苇浆、TOCNF、CG、CGC、CGCT于干燥器中干燥12 h,采用FTIR仪进行扫描分析,扫描范围为4 000~600 cm-1,分辨率为4 cm-1,扫描32次。
1.3.4.2 XRD分析测试
将芦苇浆、TOCNF、CG、CGC、CGCT制成直径为35 mm2的圆片,于干燥器中干燥12 h,采用XRD分析仪扫描谱图,以2θ从5°~50°进行扫描,步长设置为6 °/min。
1.3.4.3 热稳定性测试
取3~10 mg干燥后的芦苇浆、TOCNF、CG、CGC、CGCT分别装于氧化铝坩埚中,通过热重分析仪分析热力学性质,升温范围为30~800 ℃,升温速率为15 ℃/min,氮气流量为50 mL/min。
1.3.4.4 SEM测试
用真空镀膜仪对样品喷镀铂金层,使用钨灯丝扫描电子显微镜分析和表征CGC、CGCT的微观形貌,测量电压为10 kV。
1.3.4.5 溶胀性能测试
参照WANG等[12]的方法,将样品在干燥器中干燥12 h去除孔隙中的水分,称重记为m0,然后将其在室温下完全浸泡在蒸馏水中24 h,用滤纸去除表面水后立即称重记为m1。溶胀率按公式(1)计算:
溶胀率![]()
(1)
1.3.4.6 机械性能测试
参照HOU等[17]的方法,使用电子万能试验机对海绵进行压缩性能测试。压缩速度为12 mm/min,压缩应变设置为70%。
1.3.4.7 孔隙率测试
按照赵静等[18]比重瓶测孔隙率的方法进行测试。先将干燥海绵称重WS待用,将比重瓶中倒入无水乙醇溶液至充满比重瓶内部并称重W1,将已称重样品放置比重瓶中并浸入无水乙醇中,超声脱气30 min,待无水乙醇完全浸入孔隙中,加满无水乙醇再次充满,并进行精确称重W2,将已浸满无水乙醇的样品取出后,精确称量剩余无水乙醇和比重瓶重W3。孔隙率按公式(2)计算:
孔隙率![]()
(2)
1.3.4.8 抗菌性能测试
参照WANG等[12]的方法进行,通过琼脂扩散法测试CGCT、CGCT-OEO对大肠杆菌及金黄色葡萄球菌的抗菌活性。制备直径为13.5 mm的CGCT、CGCT-OEO圆片,并在紫外光下照射30 min进行杀菌消毒,然后用灭菌后的镊子将CGCT-OEO圆片分别放置在接种有大肠杆菌及金黄色葡萄球菌的培养皿中,将培养皿置于37 ℃生化培养箱中培养24 h,测量CGCT、CGCT-OEO圆片周围抑菌圈的宽度。
1.3.5 猪肉保鲜实验
1.3.5.1 冷鲜肉包装处理
将新鲜猪肉置于超净工作台中,将其分割成均匀大小(20±0.1)g,分别置于无衬垫、市售吸水垫、CGCT海绵垫、负载牛至精油的CGCT-OEO海绵垫(65 mm×65 mm×3 mm)的PP材质塑料托盘(85 mm×85 mm×35 mm)中,封上PE保鲜膜模拟市售托盘包装,依次标记为CK、市售吸水垫组、CGCT海绵垫组、CGCT-OEO海绵垫组,于4 ℃下贮藏。分别在0、2、4、6、8、10 d取样进行各项指标的测定。
1.3.5.2 汁液损失率测试
准确称量样品冷藏前的初始质量m0和冷藏后的质量m1。根据公式(3)计算其汁液损失率:
汁液损失率![]()
(3)
1.3.5.3 TVB-N测试
按照GB 5009.228—2016《食品安全国家标准 食品中挥发性盐基氮的测定》中的微量扩散法进行测定。
1.3.5.4 猪肉菌落总数测试
按照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》进行测定。
1.3.5.5 pH值测试
按照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》进行测定。
1.3.5.6 色差测试
利用色差仪测定猪肉样品的L*值、a*值。
1.4 数据统计与分析
文中所有数据均为3次平行实验平均值,数据均由Microsoft Excel软件整理,利用Origin 2022软件绘图,使用IBM SPSS Statistics 27软件采用ANOVA进行数据分析,Duncan法进行多重比较,P<0.05表示显著。
2 结果与分析
2.1 TOCNF及CS/GEL海绵的基本性质分析
2.1.1 FTIR分析
图2为芦苇浆、TOCNF、CG、CGC、CGCT的FTIR谱图。芦苇浆和TOCNF在3 000、2 896、1 596、1 246、1 159、1 030、896 cm-1处出现相同吸收峰,属于天然纤维素I型结构的特征峰,表明经过TEMPO氧化之后,没有破坏纤维素的化学结构;TOCNF在1 596 cm-1附近的C![]() O特征吸收峰较芦苇浆明显增强,说明在经过TEMPO氧化的纤维素大分子中成功引入了大量羧基基团[19]。
O特征吸收峰较芦苇浆明显增强,说明在经过TEMPO氧化的纤维素大分子中成功引入了大量羧基基团[19]。
CG在3 334、1 589、1 335 cm-1处的吸收峰分别对应着CG中羟基的拉伸振动峰、C![]() O伸缩振动峰和N—H的的弯曲振动峰(酰胺Ⅱ带)、C—N吸收峰(酰胺Ⅲ带),可以发现,在CGC、CGCT中酰胺Ⅱ带吸收峰偏移至1 581 cm-1,说明CS和GEL的氨基与CA的羧基发生了离子交联。CGC、CGCT在1 335 cm-1处出现新的酰胺Ⅲ带吸收峰,表明酰胺键的生成[20]。CGCT中TOCNF的加入使N—H的伸缩振动峰由2 862 cm-1偏移至2 864 cm-1,C
O伸缩振动峰和N—H的的弯曲振动峰(酰胺Ⅱ带)、C—N吸收峰(酰胺Ⅲ带),可以发现,在CGC、CGCT中酰胺Ⅱ带吸收峰偏移至1 581 cm-1,说明CS和GEL的氨基与CA的羧基发生了离子交联。CGC、CGCT在1 335 cm-1处出现新的酰胺Ⅲ带吸收峰,表明酰胺键的生成[20]。CGCT中TOCNF的加入使N—H的伸缩振动峰由2 862 cm-1偏移至2 864 cm-1,C![]() O振动峰轻微减弱,表明TOCNF中的羧基和复合体系发生了静电作用。可以得出CGCT复合海绵形成的原因主要是基于复合体系的离子作用及酰胺化反应。
O振动峰轻微减弱,表明TOCNF中的羧基和复合体系发生了静电作用。可以得出CGCT复合海绵形成的原因主要是基于复合体系的离子作用及酰胺化反应。
2.1.2 XRD分析
图3为芦苇浆、TOCNF、CG、CGC、CGCT的XRD图。芦苇浆和TOCNF均在2θ=16.4°、22.9°和34.6°处显示出纤维素Iβ晶型结构的典型衍射峰,表明经过TEMPO氧化后,芦苇纤维素的晶体结构没有被破坏。CG组分别在2θ=10.5°和2θ=20°出现由CS的结晶度引起的弱衍射峰和强衍射峰,然而,在CGC和CGCT海绵中,2θ=10.5°及20.2°处的衍射峰强度明显减弱,且在2θ=15.4°附近出现了新衍射峰,说明CA与CS、GEL间的相互作用,使海绵原有的晶体结构发生变化。
2.1.3 热稳定性分析
采用热重分析和微分热重分析对制备的样品的热稳定性进行评价。由图4-a可知,TOCNF的起始分解温度为255 ℃,最大失重速率温度为293 ℃,相较于芦苇浆分别降低了37 ℃和87 ℃,表明TEMPO氧化使TOCNF的热稳定性下降。这是因为TEMPO介导氧化纤维素后,形成的葡萄糖醛酸基团热稳定性较低。LYU等[21]的研究中也出现了类似的情况。
从图4-b可以看出,3组海绵都经历了2个阶段的重量损失,第1个阶段发生在30~140 ℃,主要是由于水的分解,以及分子内和分子间氢键的损失。第2个阶段发生在280~520 ℃,是复合聚合物主链的快速降解阶段,质量损失速率进一步增加,主要是由于升温引起壳聚糖C—O—C等化学键的断裂。CGC初始分解温度为312 ℃,最大失重速率温度为337 ℃,较CG增加了21 ℃和9 ℃,由于CA的加入,使CGC的网络结构更致密,阻碍了热传递,增加了海绵的热稳定性,与YANG等[6]的研究一致。而TOCNF的加入,破坏了壳聚糖和明胶分子链的规则性,使CGCT初始分解温度及最大失重速率温度提前,导致其热稳定性降低,但仍较CG的热稳定性更高。
2.1.4 SEM分析
复合海绵的微观形貌如图5所示。在CA交联作用下,CGC复合海绵展现出由冷冻冰晶诱导的明显多孔结构。在-20 ℃下,随着复合体系冰晶的形成,CA和CS/GEL的局部浓度增加,CA的羧基与CS/GEL的氨基之间的相互作用增强,在静电作用及酰胺化反应下,CS和CA紧密交联形成冻胶海绵。而TOCNF的加入,使CGCT网络结构更加致密,展现出更小的孔径。结合FTIR结果可知,由于TOCNF丰富的羟基及羧基基团与CS/GEL间通过静电作用进一步增强了海绵结构,使网络更加致密。
2.1.5 CA及TOCNF含量对海绵性能的影响
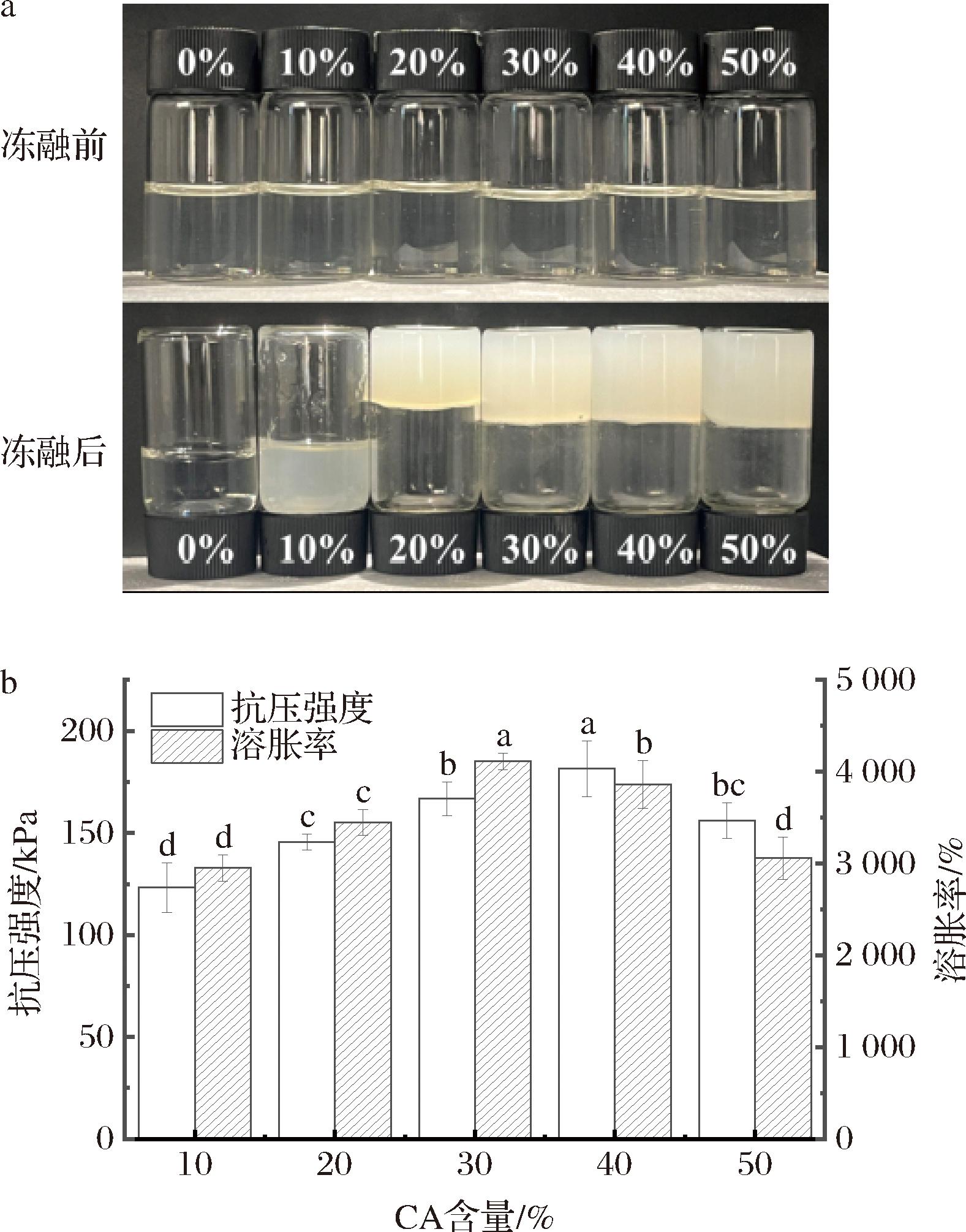
2.1.5.1 CA含量对海绵性能的影响
在冷鲜肉贮藏中,吸水垫的高吸水性能和良好支撑能力至关重要。如图6所示,探究了TOCNF添加量为0%时,不同CA含量对海绵成型性、抗压强度及溶胀率的影响。如图6-a所示,未添加CA时,海绵前驱体溶液在冻融后无法成型,随着CA的加入,前驱体溶液在冷冻-溶融后形成稳定的冻胶海绵,这是由于CA通过离子作用和酰胺键将壳聚糖和明胶交联,从而提升了复合海绵的成型性。从图6-b可以看出,随着CA的增加,海绵抗压强度和溶胀率均呈现先升后降的趋势。这是因为CA加入使海绵交联密度增大,网络结构得到优化,抗压强度随之提高;CA的加入增加了体系中亲水基团数量,从而提升了海绵的亲水性[22]。当添加30%CA时,海绵具有最佳吸水率(P<0.05)和良好的抗压强度,因此选择含30% CA的添加量进行后续实验。
2.1.5.2 TOCNF含量对海绵性能的影响
如图7所示,探究了CA添加量为30%时,不同TOCNF含量对海绵抗压强度、溶胀率及孔隙率的影响。随着TOCNF含量的增加,复合海绵的抗压强度提升了45 kPa;溶胀率提升了827%;孔隙率下降了7.3%。这是因为TOCNF的加入,引入了丰富的亲水基团(羟基、羧基),进一步提高了海绵的亲水性;同时TOCNF通过离子交联增强了复合海绵的交联强度,使海绵网络结构更加致密,从而增强了复合海绵的机械强度,降低了复合海绵的孔隙率[23],这与CGCT复合海绵SEM图像所展现的孔隙变小结果一致。因此,选择具有较高抗压强度(208 kPa)和孔隙率(77.19%),吸水性能最优(4 940%,P<0.05)的30%CA、7%TOCNF含量的复合海绵进行后续OEO的负载,并将其用于冷鲜肉的保鲜。
2.1.6 负载OEO对海绵性能的影响
由表1可知,OEO的加入对复合海绵的抗压强度没有显著影响,而使其吸水性能降低。这是由于疏水性牛至精油分子附着在复合海绵的内部网络以及表面上,降低了复合海绵的吸水性能,但CGCT-OEO复合海绵的吸水性仍高于同类型其他研究,如WANG等[1]所制备的气凝胶垫溶胀率仅为3 086%。
表1 负载OEO对复合海绵性能的影响
Table 1 Effect of loading OEO on properties of composite sponges
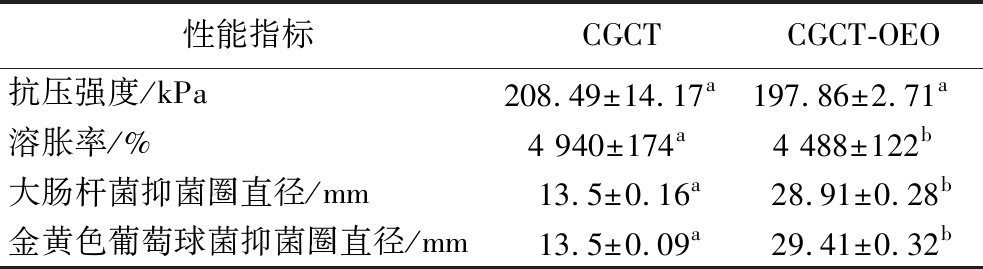
注:数值以“平均值±标准差”表示,同一行内不同小写字母表示差异性显著(P<0.05)。
性能指标CGCTCGCT-OEO抗压强度/kPa208.49±14.17a 197.86±2.71a 溶胀率/%4 940±174a 4 488±122b 大肠杆菌抑菌圈直径/mm13.5±0.16a28.91±0.28b金黄色葡萄球菌抑菌圈直径/mm13.5±0.09a29.41±0.32b
由图8可以看出,未负载OEO的复合海绵基本不具有抗菌性,而随着OEO的负载,复合海绵的抑菌圈直径增大,表现出优异的抗菌性能。CGCT-OEO复合海绵对金黄色葡萄球菌的抑制作用比大肠杆菌更强,这与YONCHEVA等[24]的研究相似。这种现象可以解释为革兰氏阳性菌的细胞壁组成与革兰氏阴性菌的不同,革兰氏阳性菌有很厚的肽聚糖层,除肽聚糖层外,革兰氏阴性菌还有一个由脂蛋白和磷脂组成的外层,导致对抗菌剂有更高的抗性。
2.2 猪肉保鲜实验
2.2.1 鲜肉在贮藏期间的汁液损失率变化
在贮藏过程中,及时去除猪肉流出的汁液以降低细菌繁殖速率对于鲜肉保鲜极为重要。由图9可以发现,在贮藏期内,猪肉汁液损失率整体呈现上升趋势,这是因为在储存过程中细菌对肌肉组织的破坏削弱了肌肉纤维蛋白的结合,从而降低了肌肉的持水能力,导致猪肉的汁液损失率增加[25]。猪肉的汁液损失率可以体现吸水垫对猪肉汁液的吸收能力,添加CGCT海绵垫组的汁液损失率显著高于CK组及市售吸水垫组(P<0.05),表明CGCT海绵垫对猪肉多余汁液具有更加优异的吸收效果,迅速吸收汁液防止液汁在托盘中的积累,从而避免为微生物繁殖提供有利条件。这与WANG等[12]、ZHANG等[26]的研究结果一致。
2.2.2 鲜肉在贮藏期间的TVB-N和TVC的变化
鲜肉TVB-N及TVC是判定其新鲜度的重要指标。如图10-a所示,猪肉的TVB-N值随时间的延长而增加,CK、市售吸水垫组、CGCT组、CGCT-OEO组猪肉的TVB-N值分别在第6天(15.75 mg/100 g)、第8天(17.15 mg/100 g)、第10天(16.8 mg/100 g)、第10 天(15.4 mg/100 g)时超过GB/T 9959.2—2008《分割鲜冻猪瘦肉》规定的限定值(15 mg/100 g)。如图10-b所示,猪肉的TVC值随时间的延长而逐渐增加,CK、市售吸水垫组、CGCT组猪肉的TVC值分别在第6天(6.36 lg CFU/g)、第8天(6.17 lg CFU/g)、第10天(6.47 lg CFU/g)超过国家标准规定的限定值(6 lg CFU/g),CGCT-OEO海绵垫组在贮藏10 d时TVC值为5.57 lg CFU/g。由上述可以看出CK组保质期为4 d,市售吸水垫组保质期为6 d,CGCT及CGCT-OEO复合海绵垫组的保质期为8 d。虽然CGCT及CGCT-OEO复合海绵垫组的TVB-N在贮藏第10天均超过安全值,但在相同贮藏时间内,CGCT-OEO组的TVB-N和TVC值始终低于CGCT组,显示出更加优异的保鲜效果。这是由于CGCT海绵垫的多孔结构可以迅速吸收多余汁液,从而防止微生物的快速生长繁殖。结合图8可知,CGCT-OEO具有良好的抗菌能力,可以通过释放OEO进一步降低细菌生长速率[27],抑制猪肉蛋白质等的分解,从而抑制TVB-N及TVC值的上升[28]。

图1 冷鲜肉包装贮藏示意图
Fig.1 Cold meat packaging storage diagram
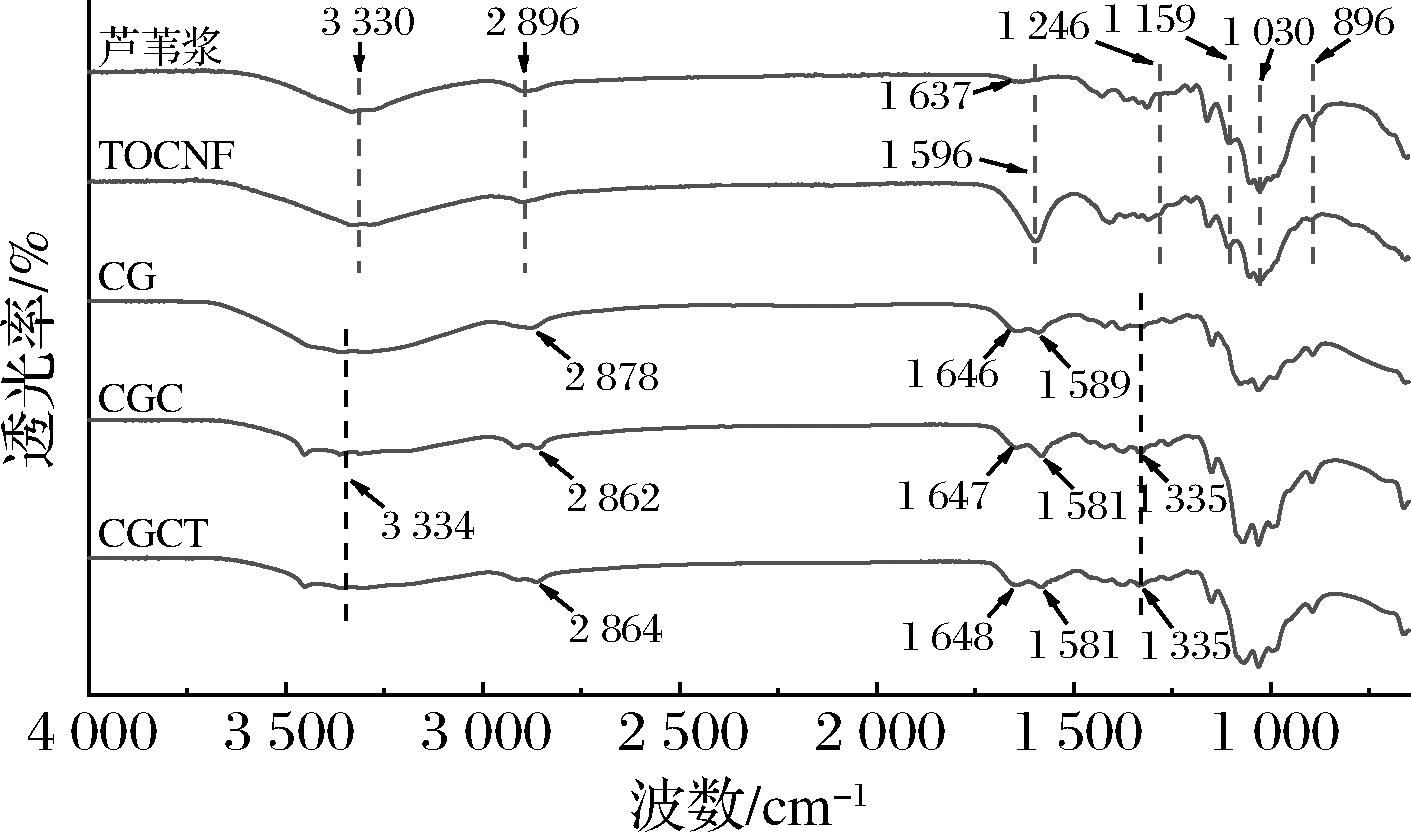
图2 芦苇浆、TOCNF、CG、CGC、CGCT的FTIR图
Fig.2 FTIR spectra of reed pulp, TOCNF, CG, CGC, and CGCT
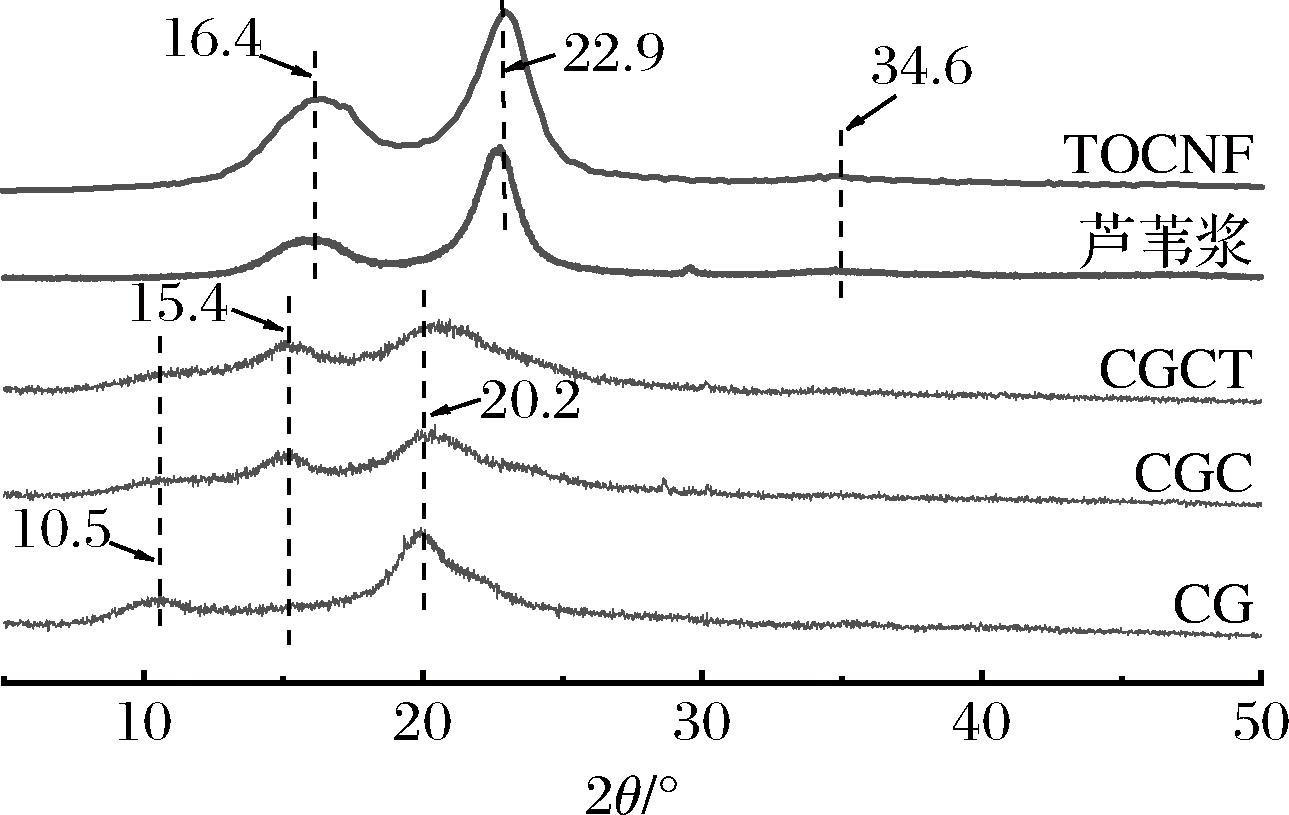
图3 芦苇浆、TOCNF、CG、CGC、CGCT的XRD分析
Fig.3 XRD analysis of reed pulp, TOCNF, CG, CGC, and CGCT
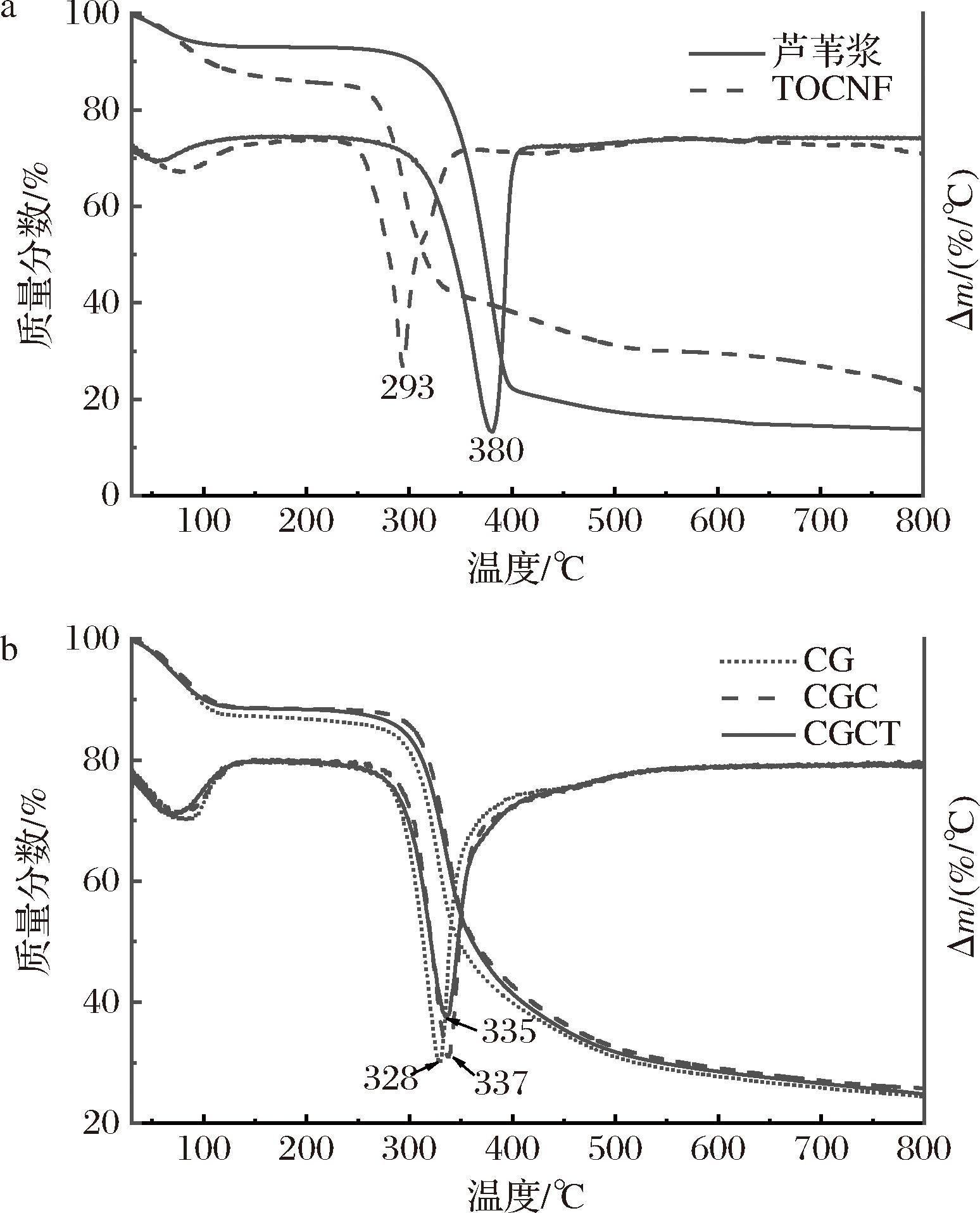
a-TOCNF、芦苇浆;b- CG、CGC、CGCT
图4 芦苇浆、TOCNF、CG、CGC、CGCT的热稳定性分析
Fig.4 Thermal stability analysis of reed pulp, TOCNF, CG, CGC, and CGCT

a-CGC;b- CGCT
图5 CGC和CGCT的SEM图
Fig.5 SEM images of CGC and CGCT
a-成型性;b-抗压强度及溶胀率
图6 CA含量对海绵性能的影响
Fig.6 Effect of CA content on sponge properties
注:同一指标不同小写字母表示差异性显著(P<0.05)(下同)。
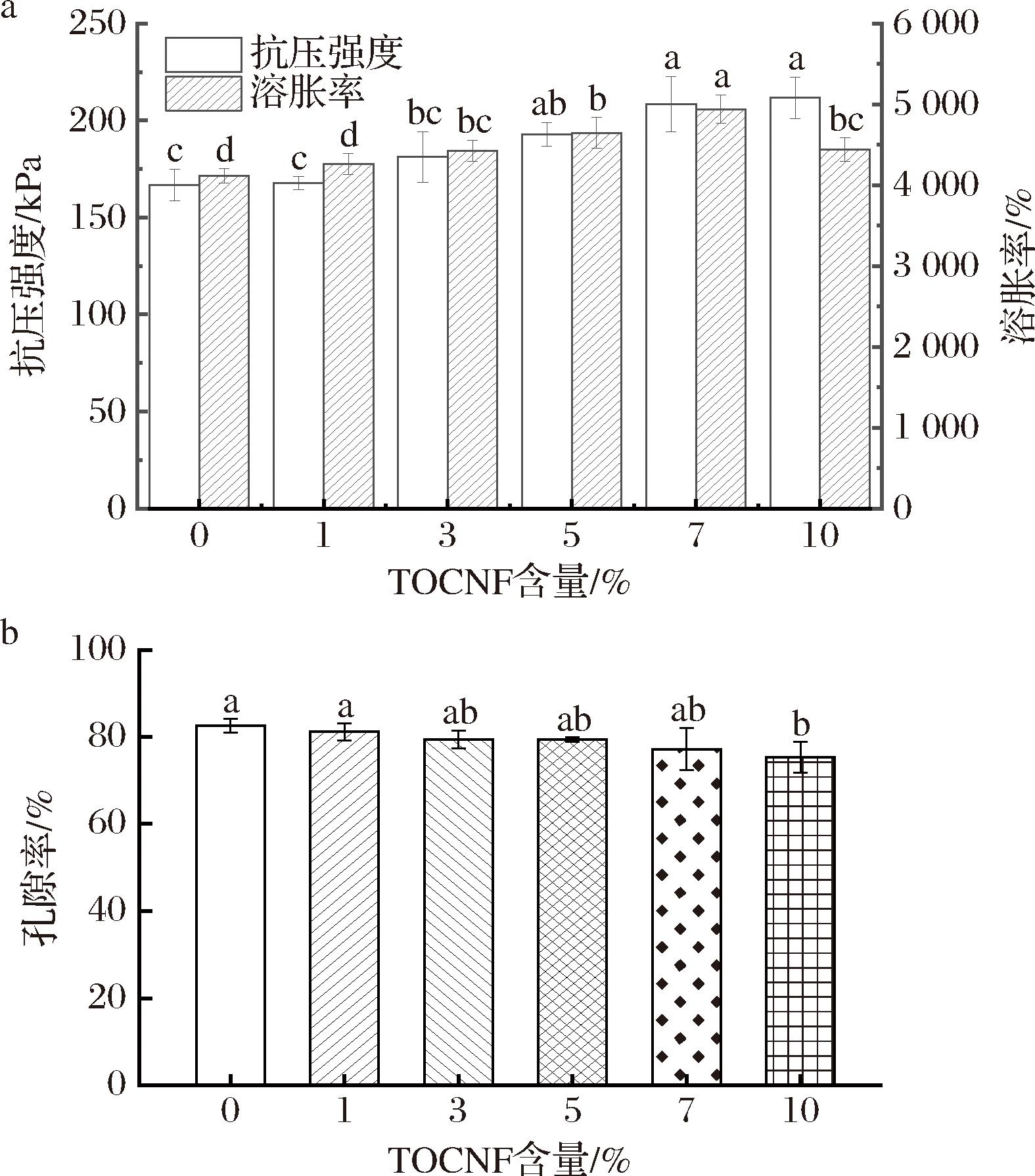
a-抗压强度及溶胀率;b-孔隙率
图7 TOCNF含量对海绵性能的影响
Fig.7 Effect of TOCNF content on sponge properties
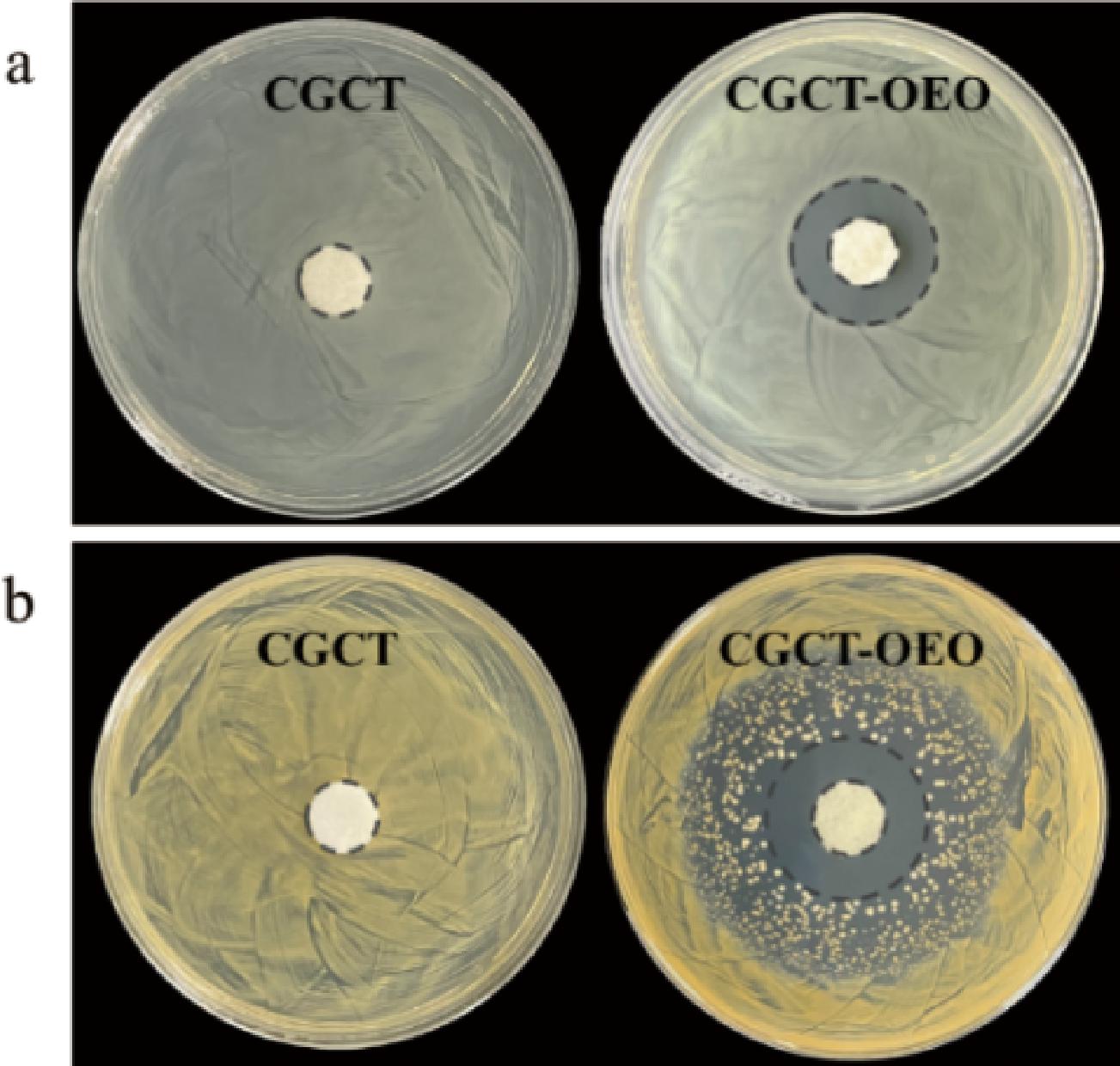
a-大肠杆菌;b-金黄色葡萄球菌
图8 CGCT、CGCT-OEO复合海绵对大肠杆菌及 金黄色葡萄球菌的抑菌能力
Fig.8 Inhibitory ability of CGCT and CGCT-OEO composite sponge against Escherichia coli and Staphylococcus aureus
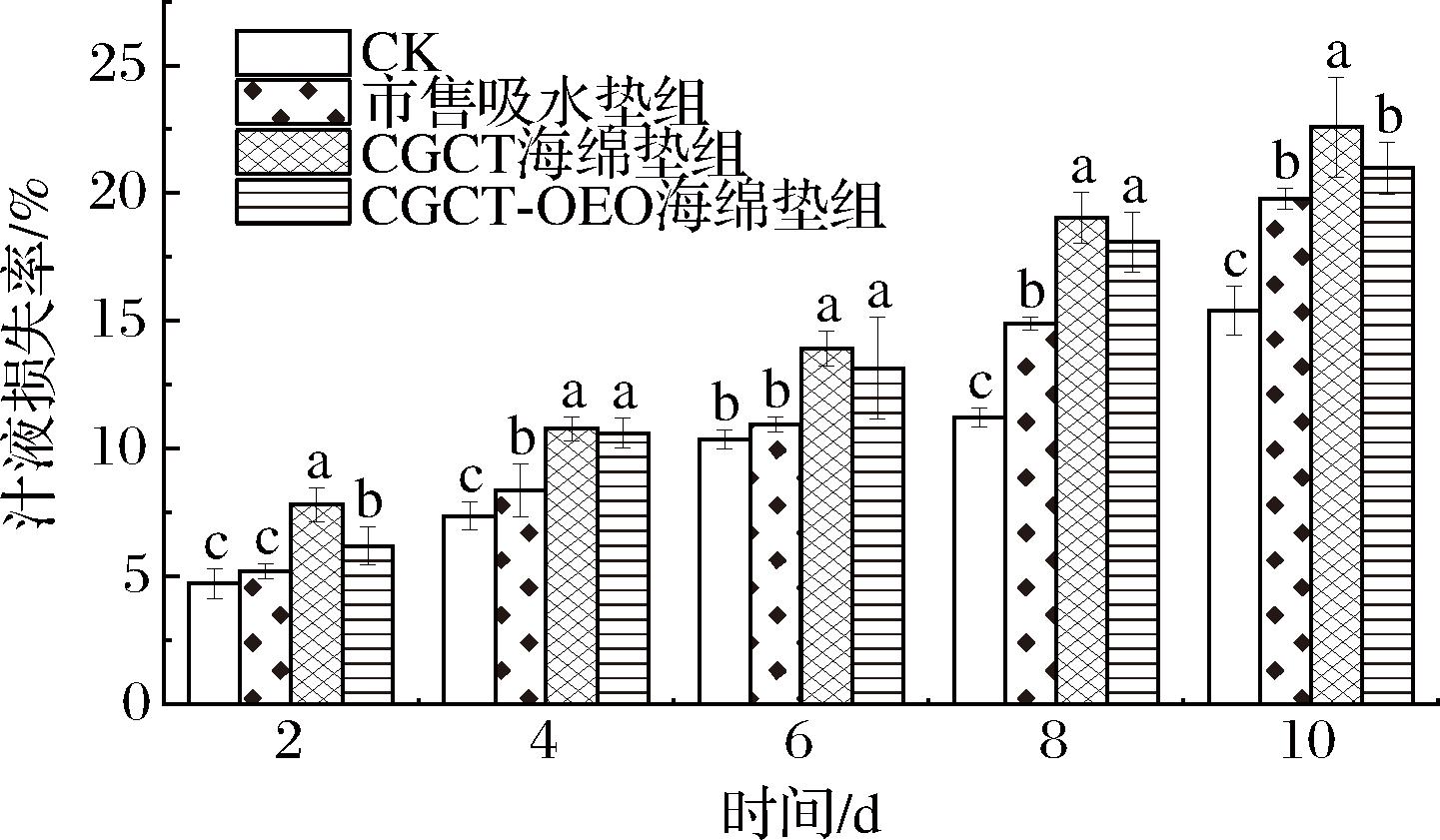
图9 冷鲜肉贮藏期间的汁液损失率
Fig.9 Rate of juice loss during storage of chilled meat
注:不同小写字母表示同一时间不同处理组的差异性显著(P<0.05)(下同)。
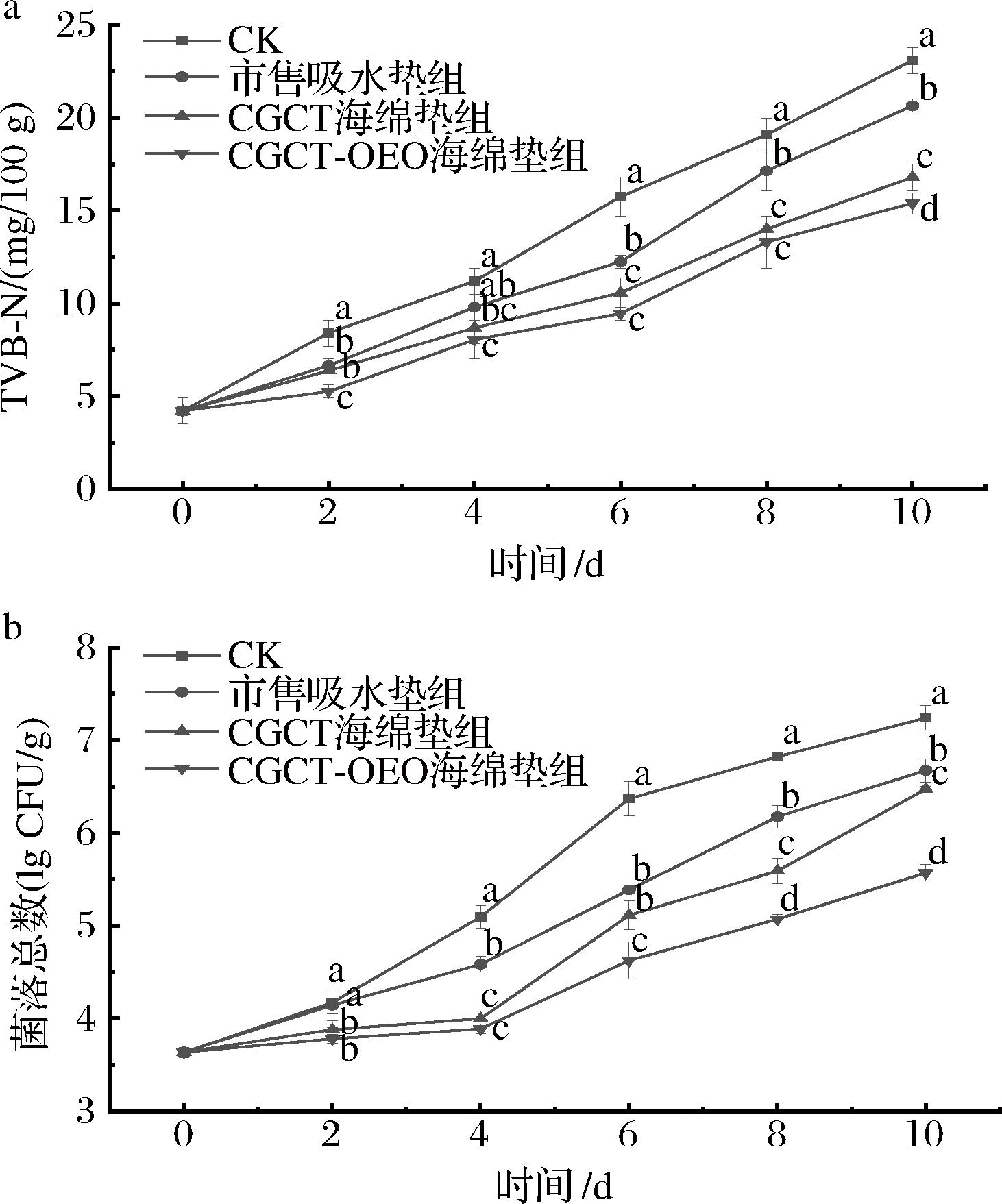
a-TVB-N;b-TVC
图10 冷鲜肉在贮藏期间的TVB-N和TVC变化
Fig.10 Changes of TVB-N and TVC in cold meat during storage
2.2.3 鲜肉在贮藏期间的pH变化
图11展示了猪肉在4 ℃贮藏期间pH值的变化。可以看到4组猪肉的pH值随着贮藏时间的延长均呈现先下降后上升的趋势。在贮藏前2 d,酶分解猪肉的肌糖原产生乳酸,同时肌肉三磷酸腺苷分解成磷酸[29],所有组猪肉的pH均出现小幅下降。贮藏4 d后,CGCT及CGCT-OEO海绵垫处理组的pH值均低于市售吸水垫组,表明CGCT及CGCT-OEO有着更加优异的汁液吸收率,抑制微生物的繁殖,减少含氮物质的产生,从而延缓猪肉的腐败变质过程。
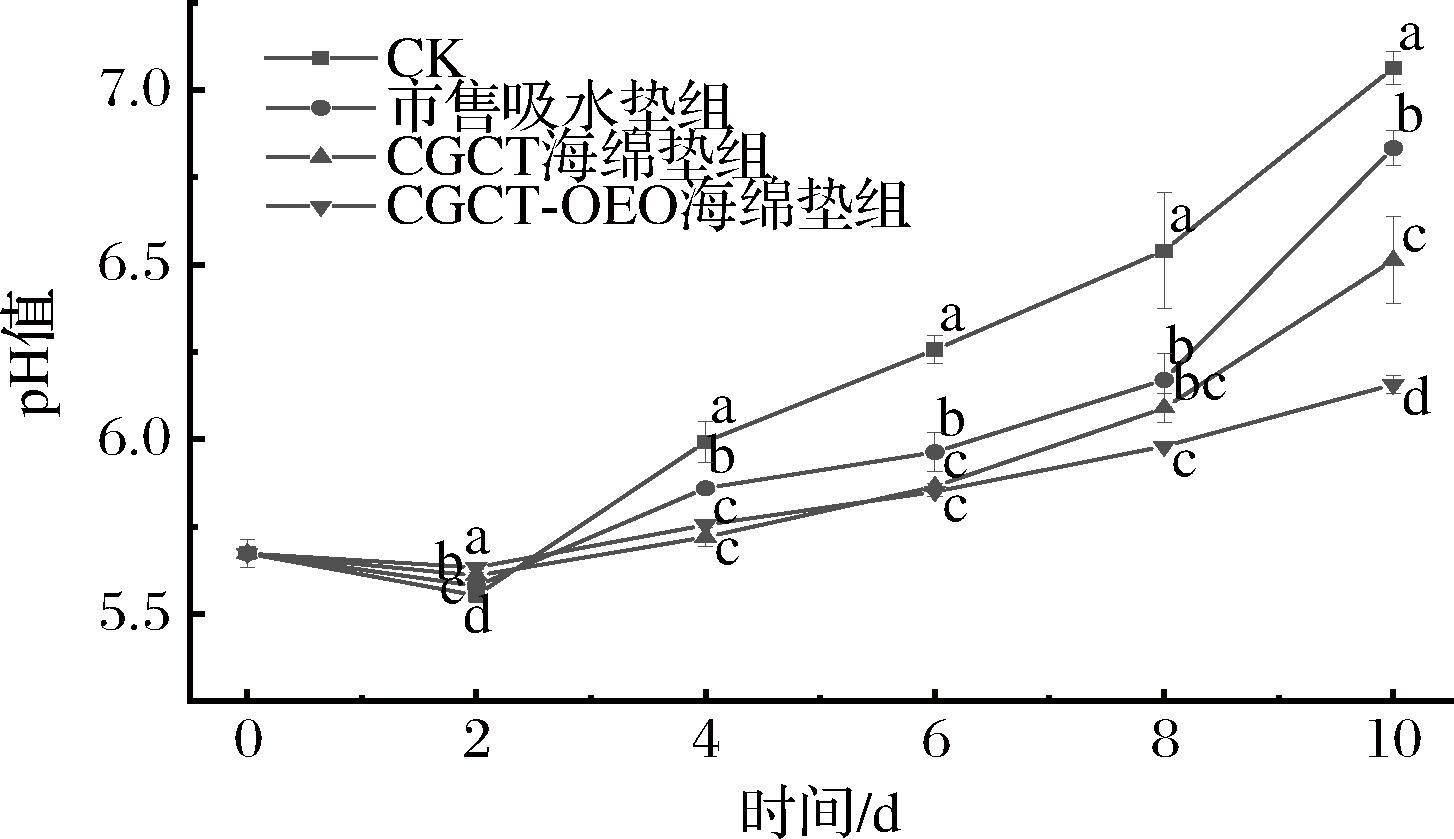
图11 冷鲜肉贮藏期间的pH值变化
Fig.11 pH changes of cold meat during storage
2.2.4 鲜肉在贮藏期间的颜色变化
鲜肉表面颜色是衡量鲜肉品质的重要指标。图12-a展示了4组猪肉的外观变化,随着时间的延长均由鲜红色变为暗红色。L*代表亮度,从图12-b中可以看出,4组猪肉在4 ℃贮藏期间的L*值整体均呈现先升高后降低的趋势。在储存过程中,少量铁肌红蛋白被还原为肌红蛋白,导致亮度降低。复合海绵垫处理组的L*值整体比CK组和市售吸水垫组的L*值高,这是因为CGCT优异的汁液吸收率以及OEO的抗氧化作用降低了鲜肉氧化的速度。
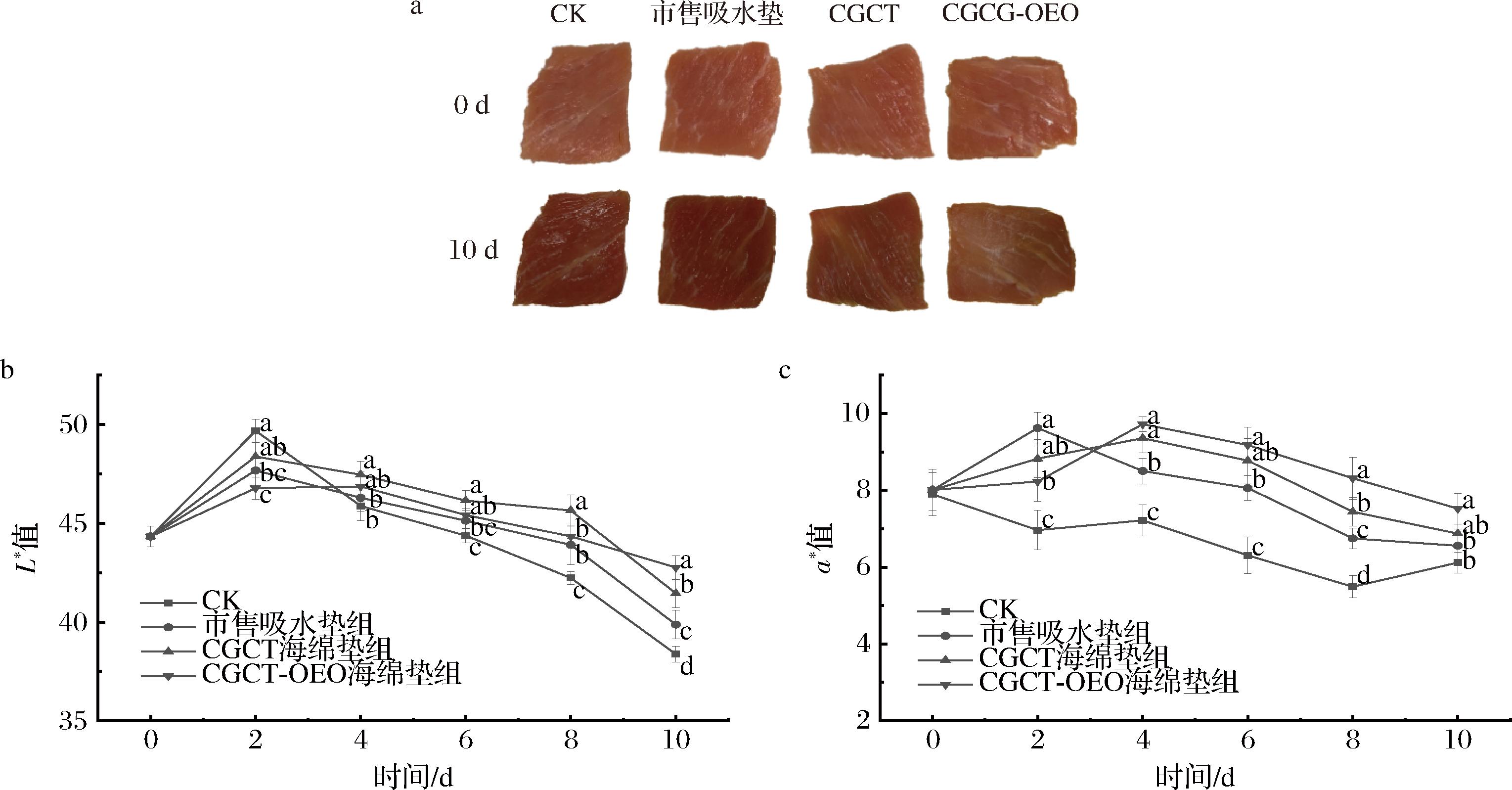
a-外观图;b-L*;c- a*
图12 冷鲜肉在贮藏期间的外观、L*、a*变化
Fig.12 Changes in appearance, L*, and a* of cold meat during storage
a*值代表红度,从图12-c可以看出,4组猪肉的a*值整体呈现下降趋势,有衬垫组的鲜肉在贮藏初期出现小幅上升,这是由于猪肉贮藏初期,盒内存在大量氧气,使得肉中的肌红蛋白被氧化生成氧合肌红蛋白,猪肉肉的颜色变得更加鲜红,在色度分析上就表现为a*值升高。随着贮藏时间的延长,猪肉中的氧合肌红蛋白逐渐被氧化为褐色的高铁血红蛋白[30],从而使a*值降低。CGCT-OEO组的a*值显著高于CK组,表明CGCT-OEO具有延缓猪肉颜色变化的作用。CGCT-OEO通过释放抗氧化活性物质OEO,抑制脂质氧化和肌红蛋白的氧化褐变,并延迟肌红蛋白氧化为高铁肌红蛋白,从而实现对猪肉的护色效果[31]。
3 结论与讨论
本研究以CA为交联剂,TOCNF为增强剂,通过负载OEO,制备了具有高吸水性能的CG/GEL复合冻胶海绵,并应用于冷鲜肉的保鲜。结果表明,在CA交联作用下,海绵展现出由冷冻冰晶诱导的明显多孔结构。当添加30%CA、7%TOCNF时,复合海绵具有最佳吸水性能及优异的抗压强度。复合海绵通过浸渍法负载OEO后对大肠杆菌和金黄色葡萄球菌表现出优异的抗菌性能。冷鲜肉保鲜实验发现, CGCT-OEO海绵垫有着优异的汁液吸收率,可有效抑制冷鲜肉细菌生长,延缓冷鲜肉TVB-N含量和pH值增加。CGCT-OEO组复合海绵相比于CK组可将冷鲜肉贮藏期延长4 d,相比于市售吸水垫组可延长2 d。本研究中,CS、GEL、TOCNF及CA来源天然且具有良好的生物降解性,OEO为天然抗菌抗氧化剂。综上所述,CGCT海绵垫具有优异的吸水性能及良好的机械强度,在冷鲜肉保鲜领域具有广阔的应用潜力。
[1] WANG F Q, XU Z P, CHEN L, et al.Super absorbent resilience antibacterial aerogel with curcumin for fresh pork preservation[J].Food Control, 2024, 159:110289.
[2] AKIN B, OZMEN M M.Antimicrobial cryogel dressings towards effective wound healing[J].Progress in Biomaterials, 2022, 11(4):331-346.
[3] 刘梦琪, 吕瑞, 陈菊, 等.壳聚糖的抗菌作用及在抑菌活性包装中的应用进展[J].食品科学, 2024, 45(1):261-271.LIU M Q, LYU R, CHEN J, et al.A review of the antibacterial activity of chitosan and its application in antibacterial packaging[J].Food Science, 2024, 45(1):261-271.
[4] ZHOU X, GUO X, CHAI Y W, et al.Superabsorbent whey protein isolates/chitosan-based antibacterial aerogels:Preparation, characterization and application in chicken meat preservation[J].International Journal of Biological Macromolecules, 2024, 259:128961.
[5] 凡淑婷, 张芷瑜, 郭睿, 等.壳聚糖/玉米淀粉交联膜的制备及性能研究[J].中国塑料, 2024, 38(7):37-42.FAN S T, ZHANG Z Y, GUO R, et al.Preparation and performance of chitosan/corn starch crosslinked films[J].China Plastics, 2024, 38(7):37-42.
[6] YANG J, DUAN A B, SHEN L P, et al.Preparation and application of curcumin loaded with citric acid crosslinked chitosan-gelatin hydrogels[J].International Journal of Biological Macromolecules, 2024, 264:130801.
[7] ZHANG A H, HAN Y, ZHOU Z J.Characterization of citric acid crosslinked chitosan/gelatin composite film with enterocin CHQS and red cabbage pigment[J].Food Hydrocolloids, 2023, 135:108144.
[8] QIN Z J, NG W, EDE J, et al.Nanocellulose and its modified forms in the food industry:Applications, safety, and regulatory perspectives[J].Comprehensive Reviews in Food Science and Food Safety, 2024, 23(6):e70049.
[9] PIAO X Y, LI J W, ZHAO Y D, et al.Oxidized cellulose nanofibrils-based surimi gel enhancing additives:Interactions, performance and mechanisms[J].Food Hydrocolloids, 2022, 133:107893.
[10] ZHU J Y, ZHU P H, ZHU Y L, et al.Surface charge manipulation for improved humidity sensing of TEMPO-oxidized cellulose nanofibrils[J].Carbohydrate Polymers, 2024, 335:122059.
[11] DAI H J, LYU T Y, LIU S Y, et al.Preparation of nanocellulose light porous material adsorbed with tannic acid and its application in fresh-keeping pad[J].Food Chemistry, 2024, 444:138676.
[12] WANG S Y, WANG F J, LU C H, et al.Citral-loaded nanocellulose/sodium alginate aerogel packaging liner for fresh pork preservation[J].Food Control, 2024, 155:110031.
[13] 张瑞, 刘婷, 吴建平, 等.牛至精油在食品保鲜中的应用[J].食品与发酵工业, 2018, 44(10):290-294.ZHANG R, LIU T, WU J P, et al.Application of oregano essential oil in food preservation[J].Food and Fermentation Industries, 2018, 44(10):290-294.
[14] CAO Y H, YIN L Y, LI F, et al.Characterization of sodium alginate film containing zein-Arabic gum nanoparticles encapsulated with oregano essential oil for chilled pork packaging[J].International Journal of Biological Macromolecules, 2024, 278:134824.
[15] LUO K Y, ZHAO P Y, HE Y F, et al.Antibacterial effect of oregano essential oil against Vibrio vulnificus and its mechanism[J].Foods, 2022, 11(3):403.
[16] KWON G, LEE K Y, KIM D, et al.Cellulose nanocrystal-coated TEMPO-oxidized cellulose nanofiber films for high performance all-cellulose nanocomposites[J].Journal of Hazardous Materials, 2020, 398:123100.
[17] HOU T M, WANG F J, WANG L Q.Facile preparation of pH-responsive antimicrobial complex and cellulose nanofiber/PVA aerogels as controlled-release packaging for fresh pork[J].Food Science and Biotechnology, 2024, 33(8):1871-1883.
[18] 赵静, 杨雪, 苏晓雷, 等.原位交联羧甲基壳聚糖/碳酸钙凝胶海绵的制备及其止血性能研究[J].高分子通报, 2023(7):844-850.ZHAO J, YANG X, SU X L, et al.Preparation of in situ crosslinked carboxymethyl chitosan/calcium carbonate gel sponge and its hemostatic performance[J].Polymer Bulletin, 2023(7):844-850.
[19] KRUER-ZERHUSEN N, CANTERO-TUBILLA B, WILSON D B.Characterization of cellulose crystallinity after enzymatic treatment using Fourier transform infrared spectroscopy (FTIR)[J].Cellulose, 2018, 25(1):37-48.
[20] GHAEE A, BAGHERI-KHOULENJANI S, AMIR AFSHAR H, et al.Biomimetic nanocomposite scaffolds based on surface modified PCL-nanofibers containing curcumin embedded in chitosan/gelatin for skin regeneration[J].Composites Part B:Engineering, 2019, 177:107339.
[21] LYU T Y, LUO Y Y, CHEN Y, et al.Tuning the properties of pineapple peel cellulose nanofibrils by TEMPO-mediated oxidation and ball milling[J].Cellulose, 2022, 29(18):9609-9625.
[22] THOMBARE N, MISHRA S, SIDDIQUI M Z, et al.Design and development of guar gum based novel, superabsorbent and moisture retaining hydrogels for agricultural applications[J].Carbohydrate Polymers, 2018, 185:169-178.
[23] DE LIMA G F, DE SOUZA A G, DOS S ROSA D.Nanocellulose as reinforcement in carboxymethylcellulose superabsorbent nanocomposite hydrogels[J].Macromolecular Symposia, 2020, 394:2000126.
[24] YONCHEVA K, BENBASSAT N, ZAHARIEVA M M, et al.Improvement of the antimicrobial activity of oregano oil by encapsulation in chitosan:Alginate nanoparticles[J].Molecules, 2021, 26(22):7017.
[25] HU S F, WANG H L, HAN W Y, et al.Development of double-layer active films containing pomegranate peel extract for the application of pork packaging[J].Journal of Food Process Engineering, 2017, 40(2):e12388.
[26] ZHANG N, XU X K, ZHANG S M, et al.Graphene oxide enhanced nanocellulose/chitosan biodegradable aerogel pad for fresh pork preservation[J].Food and Bioprocess Technology, 2024, 17(12):4768-4780.
[27] PAPARELLA A, MAZZARRINO G, CHAVES-L PEZ C, et al.Chitosan boosts the antimicrobial activity of Origanum vulgare essential oil in modified atmosphere packaged pork[J].Food Microbiology, 2016, 59:23-31.
PEZ C, et al.Chitosan boosts the antimicrobial activity of Origanum vulgare essential oil in modified atmosphere packaged pork[J].Food Microbiology, 2016, 59:23-31.
[28] JIANG C G, YU G R, WANG P D, et al.Preparation of delignified wood fibers based absorbent pad for tray package and its application in preservation of cold and fresh pork[J].Industrial Crops and Products, 2024, 219:119097.
[29] HUANG H, FAN L Y, WU L L, et al.Preparation of PET-EG-β-CD mat for the preservation of chilled pork[J].International Journal of Food Science &Technology, 2023, 58(9):4572-4581.
[30] HERN NDEZ-HERN
NDEZ-HERN NDEZ E, LIRA-MORENO C Y, GUERRERO-LEGARRETA I, et al.Effect of nanoemulsified and microencapsulated Mexican oregano (Lippia graveolens Kunth) essential oil coatings on quality of fresh pork meat[J].Journal of Food Science,2017,82(6):1423-1432.
NDEZ E, LIRA-MORENO C Y, GUERRERO-LEGARRETA I, et al.Effect of nanoemulsified and microencapsulated Mexican oregano (Lippia graveolens Kunth) essential oil coatings on quality of fresh pork meat[J].Journal of Food Science,2017,82(6):1423-1432.
[31] LORENZO J M, BATLLE R, G MEZ M.Extension of the shelf-life of foal meat with two antioxidant active packaging systems[J].LWT-Food Science and Technology, 2014, 59(1):181-188.
MEZ M.Extension of the shelf-life of foal meat with two antioxidant active packaging systems[J].LWT-Food Science and Technology, 2014, 59(1):181-188.