枇杷(Eriobotrya japonica),是一种源自于中国亚热带的常绿果树,其果实是具有中国特色的水果之一[1]。据中华人民共和国农业农村部统计当前中国枇杷栽培面积约为13.33万hm2,年产量超过90万t,占全球产量的80%以上。然而,枇杷果实质地柔软,易受机械损伤、生理变化和微生物感染,导致果实腐烂变质,影响枇杷采后品质[2]。其中,枇杷炭疽病是枇杷采后贮运和销售过程中危害最为严重的病害,尖孢炭疽菌是枇杷炭疽病的主要致腐性病原真菌[3]。据不完全统计,四川成都部分果园中枇杷采后由炭疽菌引起的果实损失超过3%[4]。当下,枇杷产业结构尚不健全,尤其是采后病害控制研究技术总体薄弱,与产业地位并不匹配[5]。
目前,枇杷采后主要保鲜方式是低温保鲜技术,但低温贮藏和运输过程不仅会带来高成本,而且枇杷果实在低温贮藏和运输过程中可能因低温出现冷害现象导致果实出现褐变木质化等,并且冷害导致枇杷果实代谢紊乱使其更易遭受病原菌侵染[6-7]。因此,寻找天然、高效、安全的植物源杀菌剂,以实现枇杷采后的绿色、安全、有效保鲜,对促进枇杷产业发展和提高农民收入具有重要意义。
实验室前期从柑橘挥发性组分中分离、鉴定出的脂肪醛类物质反,反-2,4-壬二烯醛(trans, trans-2,4-nonadienal,E24 N),是一种芳香性挥发物,呈强烈的花果和油脂香气,天然存在于各类的食品中,并对食品的风味起重要作用。ZHANG等[8]研究发现柑橘采用0.4 mL/L E24 N溶液与指状青霉同孔接种处理可以显著降低柑橘绿霉病的发病率,但E24 N是否具有广谱抑菌活性尚不明晰。因此,本研究围绕E24 N对枇杷采后炭疽病的防治效果和作用机理展开研究,探究E24 N是否对枇杷采后炭疽病主要致病菌尖孢炭疽菌有类似的抑菌效果。基于此,本研究对自然发病的枇杷果实进行了病原菌的分离和鉴定,确定主要致病菌并采用E24 N进行处理。探究E24 N对枇杷炭疽菌的抑制效果,揭示E24 N对枇杷炭疽菌的抑菌机制,评估其在果实上的抑菌效果,并对比E24 N与同为脂肪醛类的天然保鲜剂柠檬醛(citral,CIT)[9]在抑制枇杷果实病害方面的效能,旨在为E24 N对枇杷炭疽病的绿色防治提供参考。
1 材料与方法
1.1 菌株、材料与试剂
尖孢炭疽菌菌株由本实验室分离并保存在甘油管中,于-80 ℃条件下贮存。尖孢炭疽菌在PDA培养基活化后开展后续实验。
大五星枇杷(Eriobotrya japonica)于2024年5月购于四川省攀枝花市米易县肖杰果园。
E24 N(纯度>85%),上海阿拉丁生化科技股份有限公司;戊二醛电镜固定液、碘化丙啶(pyridine iodide,PI)试剂,上海麦克林生化科技股份有限公司;丙二醛(malondialdehyde,MDA)试剂盒,南京建成生物工程研究所;2,7-二氯荧光素二氢二乙酸酯(2,7-dichlorodihydrofluorescein diacetate,DCFH-DA)试剂盒,北京索莱宝科技有限公司。
1.2 仪器与设备
BX53荧光正置显微镜,日本Olympus公司;synergyH1MG酶标仪,美国基因公司;DDS-307A电导率仪,上海仪电科学仪器股份有限公司;LGJ-10真空冷冻干燥机,四环福瑞科仪科技发展(北京)有限公司;SU3500扫描电子显微镜(scanning electron microscopy,SEM),日本日立公司;HT7800透射电子显微镜(transmission electron microscopy,TEM),HITACHI。
1.3 实验方法
1.3.1 菌株的分离、鉴定及优势致病菌的确定
参考虞铭霞等[10]的方法略作修改,采用组织分离法对病原菌进行分离,选取带有典型病斑的枇杷果实,用75%(体积分数)乙醇消毒后,剪取病健交界处5 mm×5 mm组织于PDA培养基上,25 ℃培养7 d,多次重复挑取典型菌落菌丝于新PDA上,25 ℃培养7 d,待纯化后,根据Ezup柱式真菌基因组DNA抽提试剂盒说明提取DNA进行PCR扩增后送样鉴定并构建发育树。选取大小均一、成熟度一致的健康枇杷果实于0.1%(体积分数)的次氯酸钠溶液中浸泡消毒10 min,清水冲洗2次后晾干备用。在枇杷果实的赤道位置打1个深3 mm的伤口,接种5 μL的1×104孢子/mL分生孢子悬液,每个菌株样品接种3组,每组5个枇杷。每个枇杷用保鲜袋装好放入塑料筐中,在25 ℃下培养5 d,从接种后第3天开始观察并记录枇杷果实的发病率和病斑直径大小,共记录3 d,以接种无菌水为阴性对照。
1.3.2 尖孢炭疽菌菌株培养及孢子悬浮液制备
将尖孢炭疽菌菌接种于PDA平板中,置于25 ℃恒温生化培养箱中培养7 d。用无菌的磷酸盐缓冲液(phosphate buffered saline,PBS)冲洗,通过无菌纱布过滤来收集孢子,收集后的孢子悬浮液并保存于4 ℃冰箱备用。
1.3.3 E24 N处理尖孢炭疽菌抑菌活性测定
参考ZHANG等[11]的方法稍作修改,E24 N加入PDA中配制终浓度分别为0、0.1、0.2、0.3、0.4 mL/L的含药培养基,每组做3个平行实验,每组平行5个板。取培养7 d的尖孢炭疽菌边缘的5 mm×5 mm菌丝块于含药培养基中心,置于25 ℃恒温生化培养箱中培养7 d,观察并记录平板上菌落直径,从接种后第3 天开始记录,共记录5 d,将72、144 h内完全无菌丝生长的E24 N浓度分别记录为最小抑菌浓度(minimum inhibitory concentration,MIC)和最小杀菌浓度(minimum bactericidal concentration,MBC)。
1.3.4 尖孢炭疽菌孢子萌发率测定
参考ZHANG等[11]的方法稍作修改,以20%乙醇水溶液稀释E24 N,加入PDB中配制终浓度分别为0、0.012 5、0.025、0.05、0.1、0.2、0.4 mL/L的含药PDB液体培养基,参照1.3.2节制备孢子液加入含药液体培养基中配制成终浓度为1×106孢子/mL,在25 ℃摇床下培养12 h,取6、9、12 h菌液在显微镜下进行观察并按公式(1)计算尖孢炭疽菌孢子萌发率:
孢子萌发率![]()
(1)
1.3.5 E24 N处理尖孢炭疽菌形态变化观察
1.3.5.1 SEM观察菌丝形态
参考翁甜等[12]的方法并略作修改,参照1.3.2节处理孢子液,稀释到浓度为1×106 孢子/mL,加入1 mL到100 mL PDB培养基中在25 ℃,120 r/min恒温摇床中培养2 d, 6 500 r/min离心20 min,配制E24 N浓度为0、0.1、0.2、0.4 mL/L的PBS,并取1.5 g菌丝于30 mL的PBS中,在25 ℃,150 r/min的恒温摇床中培养6 h,收集菌丝在2.5%(体积分数)戊二醛电镜固定液中固定24 h后,经过不同浓度梯度乙醇脱水再冷冻干燥后镀金,使用SEM进行观察菌丝形态。
1.3.5.2 TEM观察细胞形态
参照1.3.2节处理孢子液,稀释到浓度为1×106 孢子/mL,加入1 mL到100 mL PDB培养基中在25 ℃,120 r/min恒温摇床中培养2 d, 6 500 r/min离心20 min,配制E24 N浓度为0、0.4 mL/L的PBS,并取1.5 g菌丝于30 mL配制的PBS中,在25 ℃,150 r/min的恒温摇床中培养6 h,收集菌丝在2.5%戊二醛电镜固定液中固定,使用TEM观察细胞形态。
1.3.6 E24 N处理尖孢炭疽菌细胞完整性测定
1.3.6.1 相对电导率测定
参考WANG等[13]的方法,参照1.3.2节处理孢子液,稀释到浓度为1×106孢子/mL,加入1 mL到100 mL PDB培养基中在25 ℃,120 r/min恒温摇床中培养2 d,6 500 r/min离心20 min,配制E24 N浓度为0、0.1、0.2、0.4 mL/L的PBS中,并取1.5 g菌丝于30 mL的PBS中,在25 ℃,150 r/min的恒温摇床中培养6 h,使用电导仪分别测定0、1、2、3、4、5、6 h尖孢炭疽菌的胞外电导率L,初始电导率为L0,12 h后将其煮沸10 min后冷却至室温,再次测定电导率L′。并按公式(2)计算相对电导率:
相对电导率![]()
(2)
1.3.6.2 蛋白质与核酸泄露水平测定
参考MI等[14]的方法稍作修改,参照1.3.2节处理孢子液,稀释到浓度为1×106 孢子/mL,加入1 mL到100 mL PDB培养基中在25 ℃,120 r/min恒温摇床中培养2 d,6 500 r/min离心20 min,配制E24 N浓度为0、0.1、0.2、0.4 mL/L的PBS中,取1.5 g菌丝分别悬浮在15 mL含有0、0.1、0.2、0.4 mL/L E24 N的PBS中,在25 ℃,150 r/min恒温摇床培养6 h,收集0、6 h的上清液,通过使用酶标仪分别检测260、280 nm处的吸光度值A′,初始吸光度A0,并按公式(3)计算吸光值测量核酸和蛋白质从细胞中释放的情况:
A=A′-A0
(3)
1.3.6.3 PI染色
参考翁甜等[12]的方法略作修改,参照1.3.5.1节处理菌丝6 h,收集菌丝,用500 μL PI避光染色20 min,PBS冲洗3次,在荧光正置显微镜下观察。
1.3.7 尖孢炭疽菌菌丝MDA含量测定
参照1.3.6.2节处理后收集0、2、4、6 h处理组和对照组菌丝悬浮液,根据MDA试剂盒说明书操作测定酸腐病菌菌丝体内MDA的含量。
1.3.8 尖孢炭疽菌菌丝活性氧(reactive oxygen species,ROS)含量测定
参照1.3.5.1节处理后收集处理组和对照组菌丝,并根据DCFH-DA试剂盒说明书检测菌丝体胞内ROS水平。
1.3.9 枇杷果实活体接种效果分析
参考LIU等[15]的方法并稍作修改,取大小均匀、成熟度一致的健康枇杷果实于1 g/L次氯酸钠溶液中浸泡消毒10 min,清水冲洗2次后晾干备用。用灭菌打孔器在枇杷赤道两侧进行打孔(直径2 mm,深度2 mm),晾干后每孔接入5 μL 1×104 孢子/mL尖孢炭疽菌孢子悬液晾干,同孔接入20 μL浓度为0、0.5、1、1.5、2 mL/L E24 N溶液,接种后放入水果盒,每10个枇杷果实为1组,每个测试浓度有3组平行。将保鲜盒室温25 ℃下放置5 d,每隔24 h观察果实发病情况,计算第3、4、5天发病果实的病斑直径。
2 结果与分析
2.1 尖孢炭疽菌进化树构建与致病性比较
以尖孢炭疽菌为外群构建系统进化树,如图1-A所示,菌株D-1和D-2的rDNA-ITS序列与GenBank中收录的尖孢炭疽菌(登陆号KF923808.1)序列同源性为100%,D-2的rDNA-ITS序列与GenBank中收录的尖孢炭疽菌复合种Colletotrichum nymphaeae(登陆号O888999.1)序列同源性为80%,说明此次在枇杷上分离的D-1为尖孢炭疽菌,D-2为尖孢炭疽菌复合种C.nymphaeae。
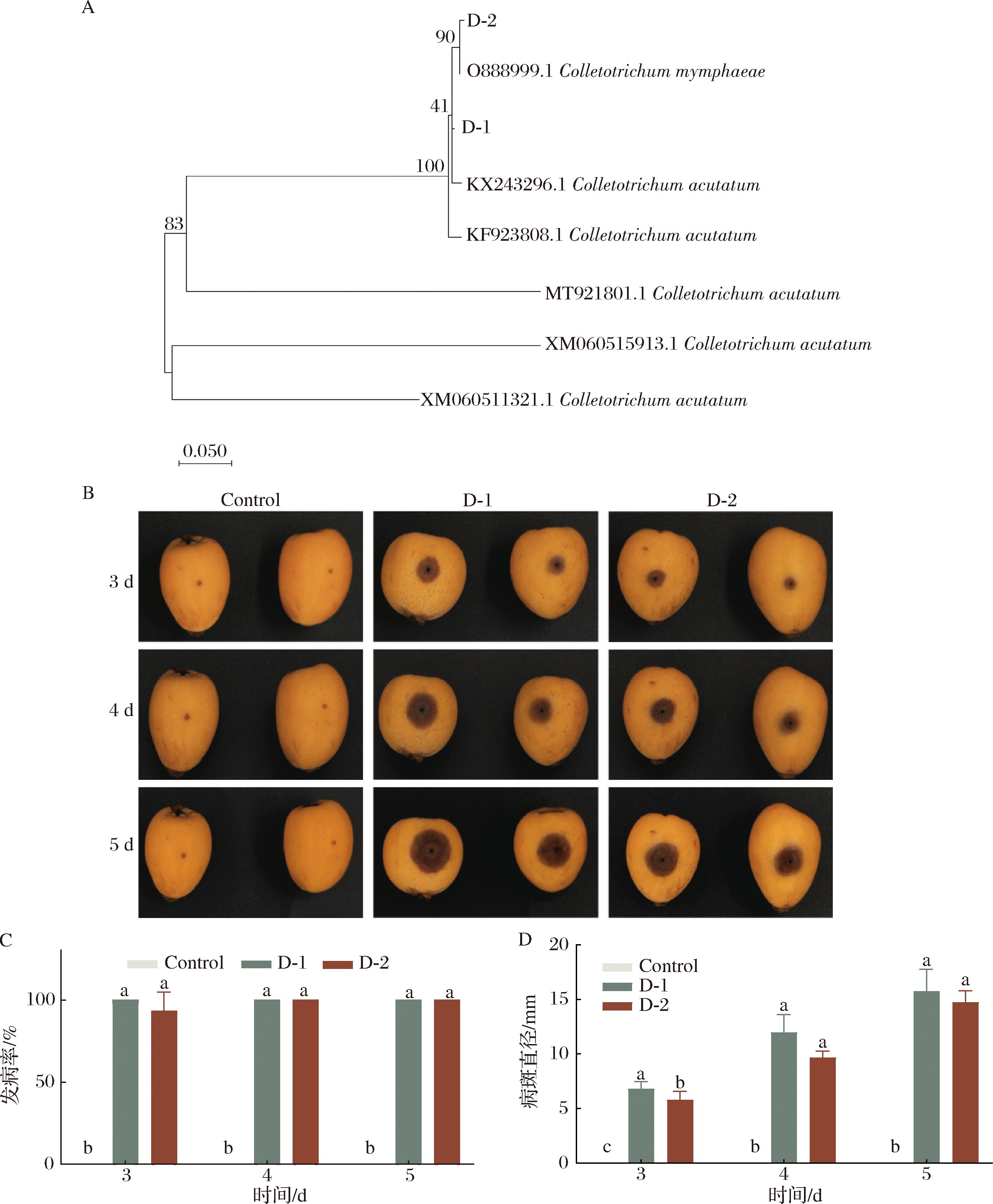
A-基于ITS序列构建的发育树;B-枇杷果实外观;C-发病率;D-病斑直径
图1 枇杷炭疽菌进化树构建与致病性比较
Fig.1 Construction of phylogenetic tree and comparison of pathogenicity of Colletotrichum in loquats
注:不同小写字母表示差异显著(P<0.05)(下同)。
如图1-C和图1-D所示,接种D-1尖孢炭疽菌孢子悬浮液的枇杷果实在第3天时发病率达到100%,果实病斑呈现出黑色,在第5天时,枇杷果实病斑直径达到15.73 mm,病斑出现凹陷,并且中心出现橘红色黏稠小点,对照组打孔接种处并未发生明显变化。结果说明分离到编号为D-1的尖孢炭疽菌对枇杷果实致病性较强,作为后续研究对象。
2.2 E24 N处理尖孢炭疽菌对抑菌活性影响
如图2所示,E24 N对尖孢炭疽菌抑制作用随浓度增加而增加,对照组菌落在培养7 d时直径达到(71.75±0.33) mm,而0.1、0.2、0.3 mL/L E24 N溶液培养的菌落直径分别为(63.46±1.20)、(49.83±6.53)和(35.88±1.44) mm,浓度为0.4 mL/L含药培养基培养完全抑制尖孢炭疽菌的生长。在培养3 d和6 d后浓度为0.4 mL/L含药培养基培养完全抑制尖孢炭疽菌的生长,说明E24 N对尖孢炭疽菌的MIC和MBC均为0.4 mL/L。
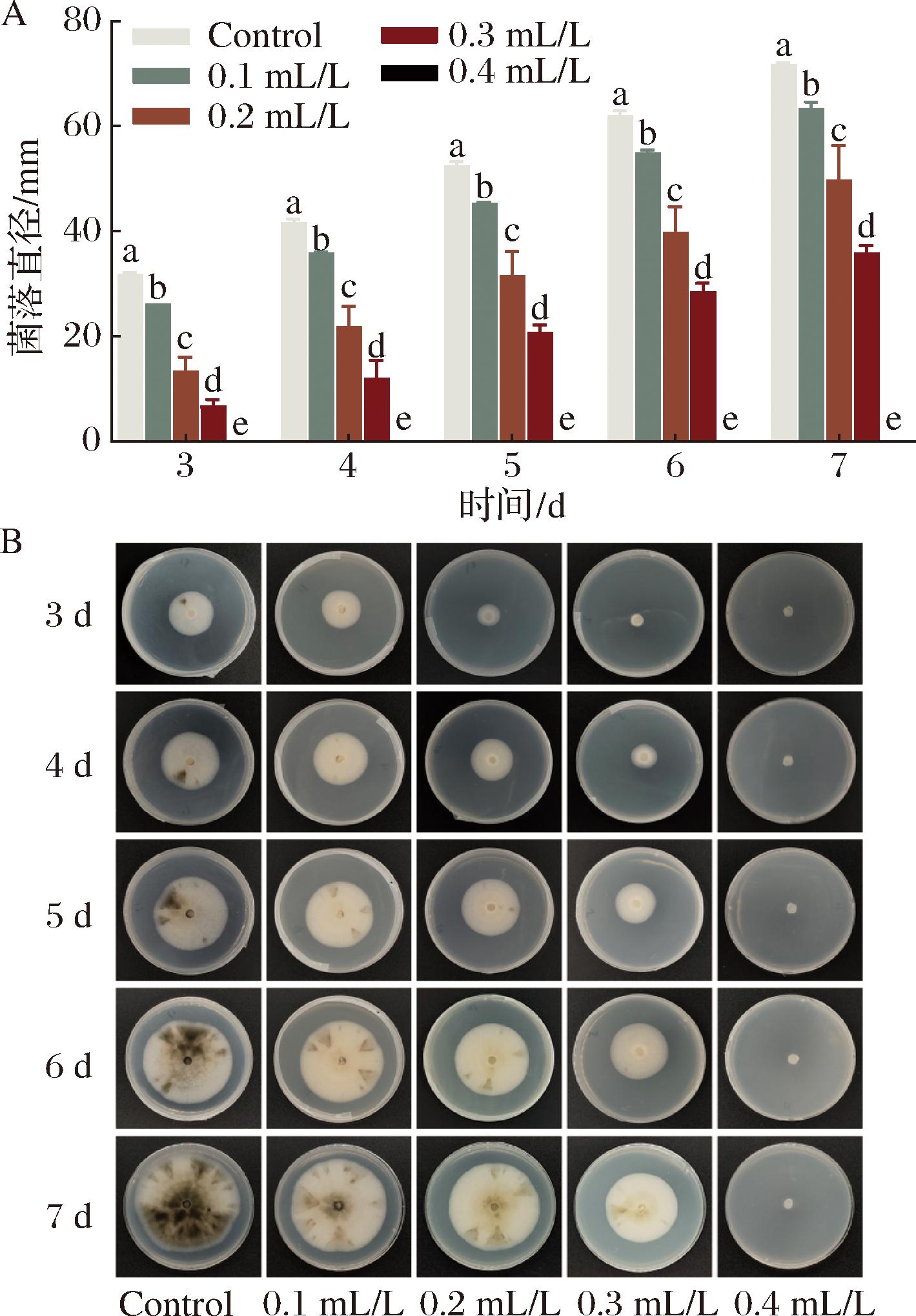
A-不同浓度E24 N处理尖孢炭疽菌菌落直径;B-不同浓度E24 N处理尖孢炭疽菌菌落生长状况
图2 E24 N处理对尖孢炭疽菌菌丝体生长的影响
Fig.2 Effect of E24 N treatment on mycelia growth of Colletotrichum acutatum
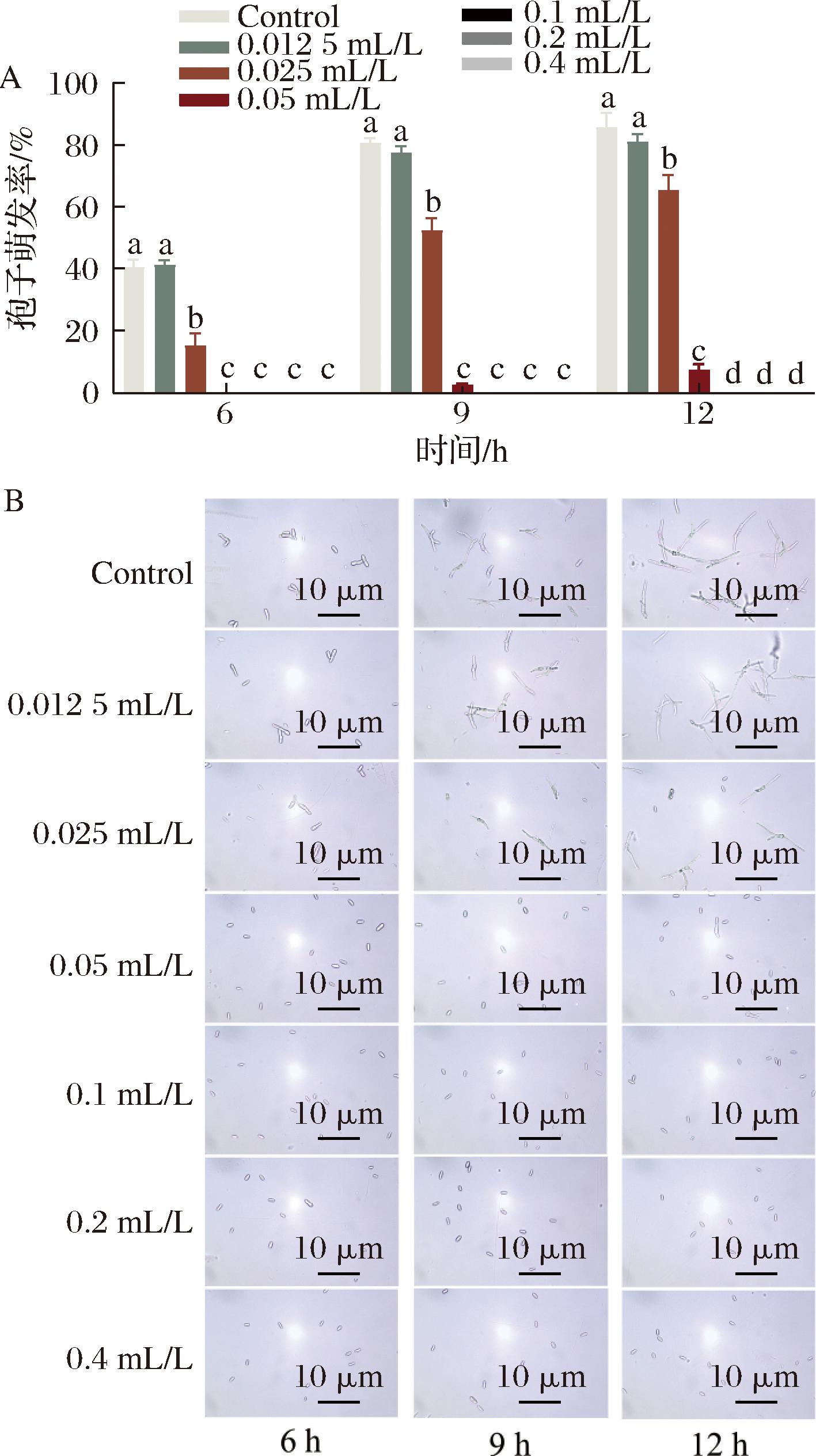
A-不同浓度E24 N溶液处理下尖孢炭疽菌孢子的孢子萌发率;B-光学显微镜观察不同浓度E24 N溶液处理下尖孢炭疽菌孢子的萌发形态
图3 E24 N处理对尖孢炭疽菌孢子萌发的影响
Fig.3 Effect of E24 N treatment on spore germination of C.acutatum

A-Control;B-0.1 mL/L E24 N溶液处理;C-0.2 mL/L E24 N溶液处理;D-0.4 mL/L E24 N溶液处理
图4 E24 N处理尖孢炭疽菌菌丝体的SEM图
Fig.4 SEM of C.acutatum mycelia with E24 N treatment
注:下标1:1 000×;下标2:2 000×。
2.3 E24 N处理对尖孢炭疽菌孢子萌发率影响
如图3所示,尖孢炭疽菌孢子在含有不同浓度E24 N的PDB培养基培养12 h后,对照组孢子萌发率达到(85.41±4.75)%,0.05 mL/L E24 N溶液处理组处理的尖孢炭疽菌仅萌发了(7.01±1.98)%,而0.1、0.2、0.4 mL/L E24 N溶液处理组处理完全抑制尖孢炭疽菌孢子的萌发,因此后续采用0.1、0.2、0.4 mL/L浓度梯度探究E24 N对尖孢炭疽菌抑菌机制。
2.4 E24 N处理尖孢炭疽菌形态影响
2.4.1 SEM观察E24 N尖孢炭疽菌菌丝形态
SEM对不同浓度E24 N溶液处理后尖孢炭疽菌菌丝的表征如图4所示,其中对照组呈表面光滑饱满的正常形态。然而,经E24 N处理后的尖孢炭疽菌细胞表面形态发生了变化,出现干瘪皱褶、表面粗糙、不规则的形态,干瘪皱褶和表面粗糙的程度随E24 N浓度增加而增加,并且E24 N浓度为0.4 mL/L处理尖孢炭疽菌菌丝表面出现了破裂。
2.4.2 TEM观察E24 N处理尖孢炭疽菌菌丝体微观结构的影响
如图5所示,经过E24 N处理后,尖孢炭疽菌细胞遭受显著损伤。在对照组中,细胞质分布均匀,细胞器保持完整。相比之下,处理组的细胞壁和细胞膜观察到明显的损伤,细胞质遭到降解,并伴有质壁分离现象,同时线粒体的形态也发生了变化。
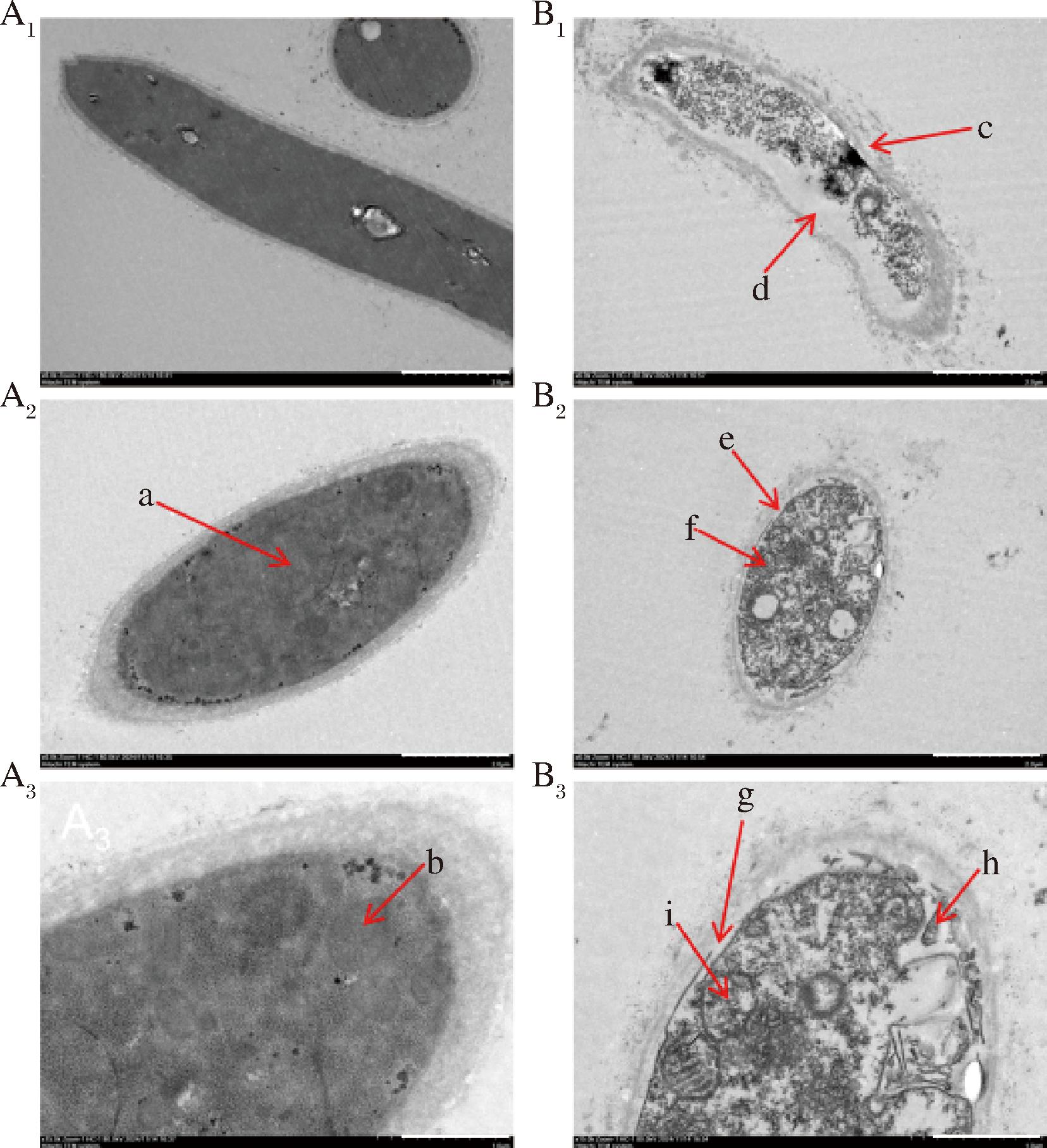
a-细胞核;b、f、i-线粒体;c、e-细胞壁破损;d、h-质壁分离;g-细胞膜破损。A-Control;B-0.4 mL/L E24 N处理
图5 E24 N处理尖孢炭疽菌菌丝体的TEM图
Fig.5 TEM of C.acutatum mycelia with E24 N treatment
注:下标1:菌丝纵截面;下标2:菌丝横截面;下标3:菌丝横截面局部放大图。
2.5 E24 N处理尖孢炭疽菌细胞膜完整性的影响
2.5.1 E24 N对尖孢炭疽菌相对电导率的影响
当真菌菌丝细胞膜受到损伤时细胞膜通透性改变,细胞内的电解质会渗漏在外界的环境中从而导致电导率的增加,所以菌丝电导率的变化可以评估细胞膜损伤程度。如图6所示,对照组的尖孢炭疽菌细胞膜相对电导率在培养期间保持相对稳定,未出现显著变化。相比之下,经0.2、0.4 mL/L E24 N溶液处理的尖孢炭疽菌,其相对电导率呈现出上升趋势,并且这种上升幅度与E24 N的浓度和处理时间呈正相关。随着处理时间的延长,这些处理组与对照组之间的差异变得更加显著,且不同处理组之间的差异也愈发明显(P<0.05)。特别是在0.4 mL/L E24 N溶液处理6 h后,相对电导率升至高达71.77%,约是对照组的6倍(P<0.05)。这些结果表明,E24 N处理对尖孢炭疽菌细胞膜的通透性具有显著影响,且这种影响随着E24 N浓度的增加和处理时间的延长而增强。
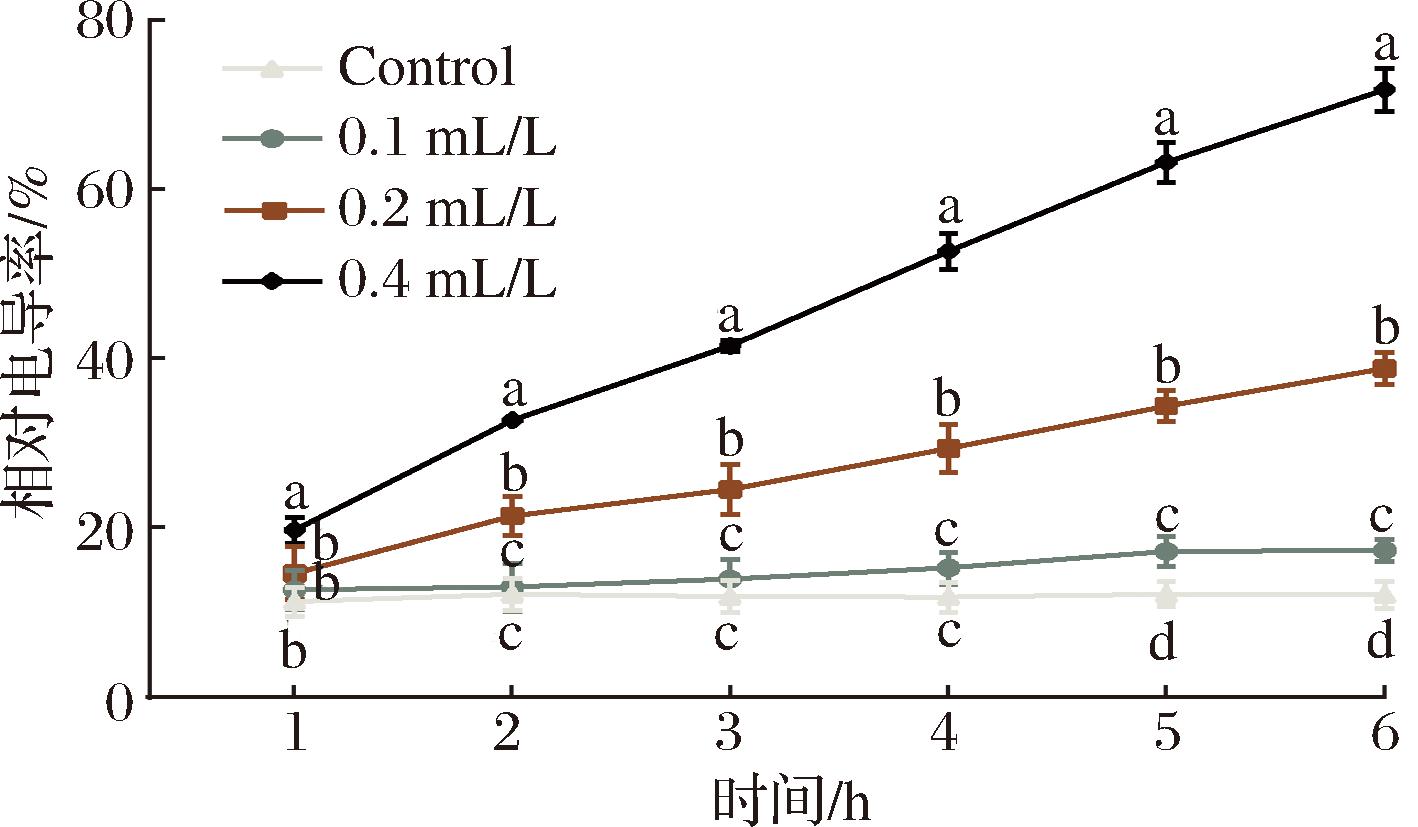
图6 E24 N处理尖孢炭疽菌菌丝体对相对电导率的影响
Fig.6 Effect of E24 N treatment on relative conductivity of C.acutatum mycelia
2.5.2 E24 N对尖孢炭疽菌核酸与蛋白质泄露影响
通过A260nm和A280nm测定分别来评估E24 N处理后尖孢炭疽菌的核酸和蛋白质泄露情况。如图7所示,0.2、0.4 mL/L E24 N溶液处理后的尖孢炭疽菌核酸和蛋白泄露情况均显著高于对照组(P<0.05)。在E24 N处理6 h后,A260nm和A280nm值均随着E24 N浓度的增加而增大,表现出一定的浓度依赖性。上述结果进一步证实了E24 N处理对尖孢炭疽菌菌造成蛋白质和核酸在内的细胞质内容物大量渗漏,这一结果与胞外电导率趋势保持一致。
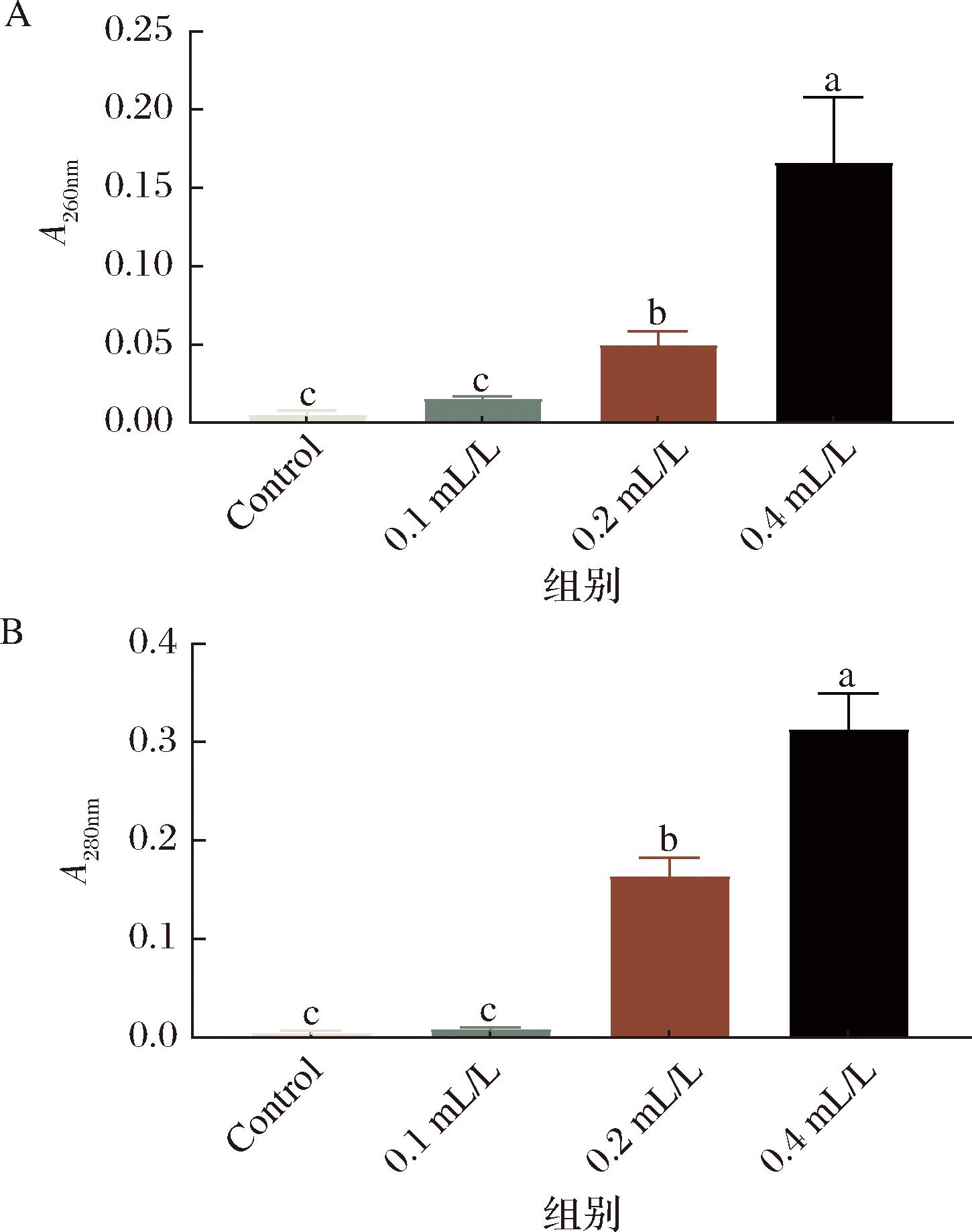
a-A260nm;b-A280nm
图7 E24 N处理尖孢炭疽菌对核酸和蛋白质泄露的影响
Fig.7 Effects of E24 N on nucleotide and protein leakage of Colletotrichum acutatum
2.5.3 PI染色观察结果
PI不能穿透完整细胞膜但可以穿透破损细胞膜进入细胞内部和核酸结合发红色荧光,所以通常用PI染色法探究细胞膜完整性。如图8所示,对照组尖孢炭疽菌菌丝和孢子均出现明显红色荧光,处理组菌丝和孢子出现了强烈红色荧光并且荧光强度随E24 N浓度增加而逐渐增强,说明E24 N处理尖孢炭疽菌完整性被破坏。根据图9计算得到0.1、0.2、0.4 mL/L E24 N溶液处理组的细胞膜完整性率分别为(85.66±2.08)%、(69.35±5.15)%、(30.73±2.17)%显著低于对照组(99.96±0.53)%(P<0.05)。由此可见E24 N可破坏尖孢炭疽菌细胞膜的完整性,并与E24 N浓度呈正相关。
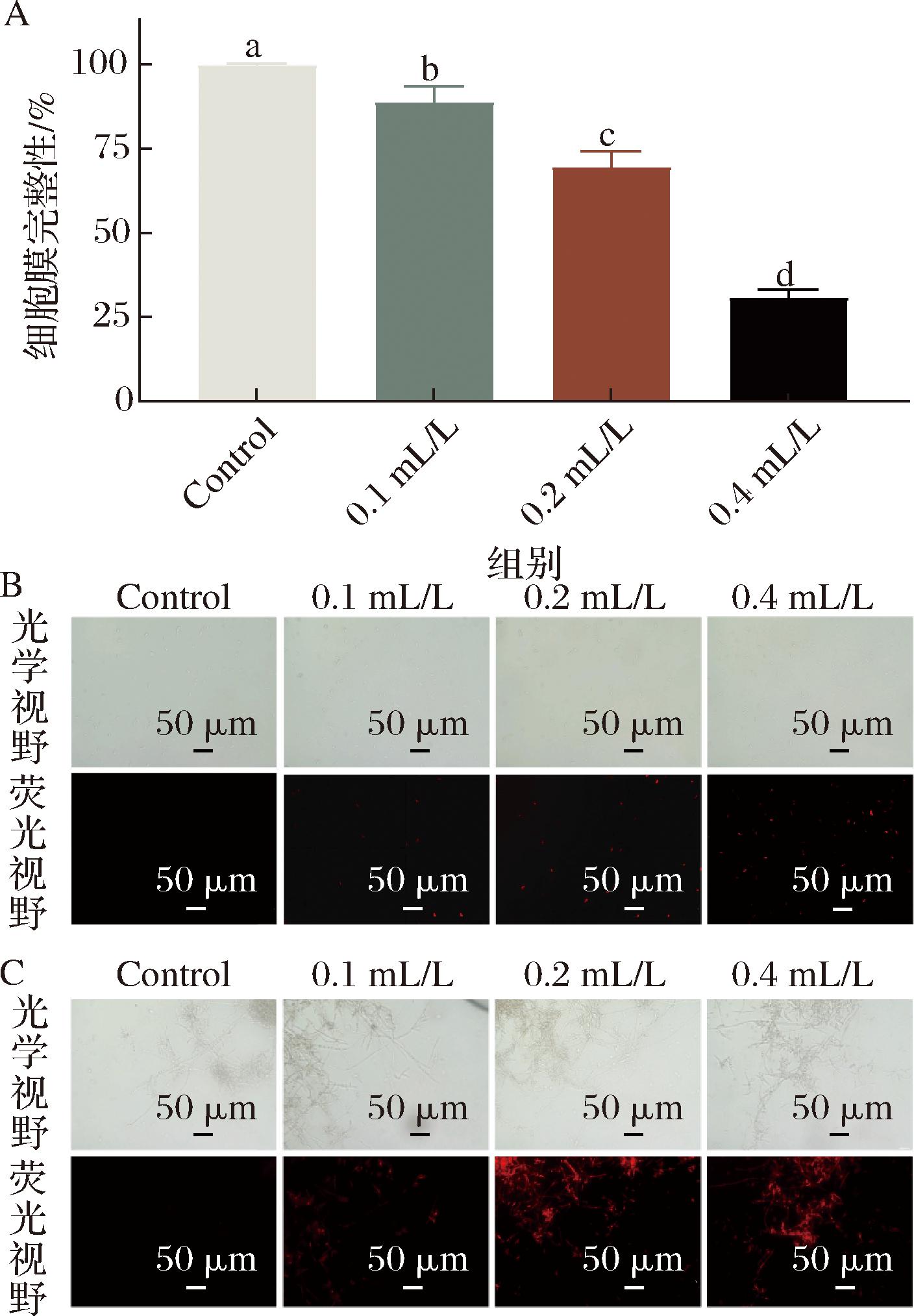
A-不同浓度E24 N溶液处理尖孢炭疽菌孢子细胞膜完整性;B-不同浓度E24 N溶液处理尖孢炭疽菌孢子PI染色图;C-不同浓度E24 N溶液处理尖孢炭疽菌菌丝PI染色图
图8 E24 N处理尖孢炭疽菌对细胞膜的影响
Fig.8 Effects of E24 N on the cell membrane integrity of C.acutatum
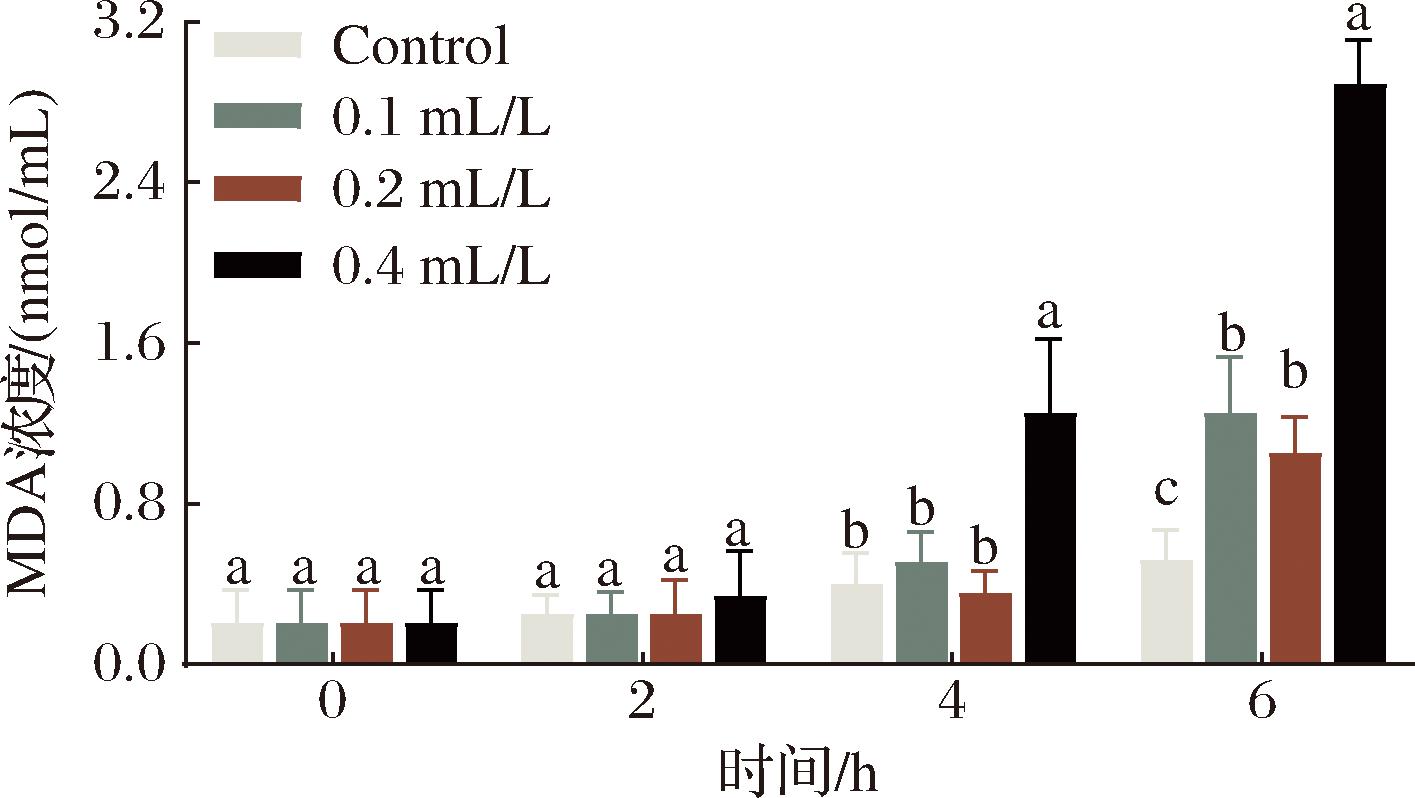
图9 E24 N处理尖孢炭疽菌对MDA含量影响
Fig.9 Effects of E24 N on MDA of Colletotrichum acutatum
2.6 E24 N处理尖孢炭疽菌对MDA含量影响
MDA作为脂质过氧化反应的终产物,其浓度的升高通常被视为细胞内氧化应激水平增强的生物标志物。细胞内MDA含量的增加可能与脂质过氧化过程中产生的ROS积累有关,进而导致细胞膜脂质的过氧化,这一过程可能会损害细胞膜的结构完整性和生物学功能。如图9所示尖孢炭疽菌在0.4 mL/L E24 N溶液处理4 h后细胞类MDA含量的积累显著高于对照组(P<0.05),在6 h时处理组MDA含量全部显著高于对照组(P<0.05),其中,0.4 mL/L E24 N溶液处理的菌丝MDA的浓度是对照组浓度的2.67倍。说明E24 N处理显著提高尖孢炭疽菌细胞中MDA含量的积累。
2.7 E24 N对尖孢炭疽菌活性氧水平影响
DCFH-DA穿过细胞膜进入尖孢炭疽菌胞内后,能够被胞内累积的ROS氧化而产生绿色荧光,并且ROS含量与荧光强度呈正相关。如图10所示,在显微镜荧光视野下,对照组未有绿色荧光现象产生,而处理组在荧光显微镜下呈现绿色荧光,且荧光强度与E24 N浓度呈正相关。说明E24 N处理会促进尖孢炭疽菌ROS水平的增加,促进细胞损伤。
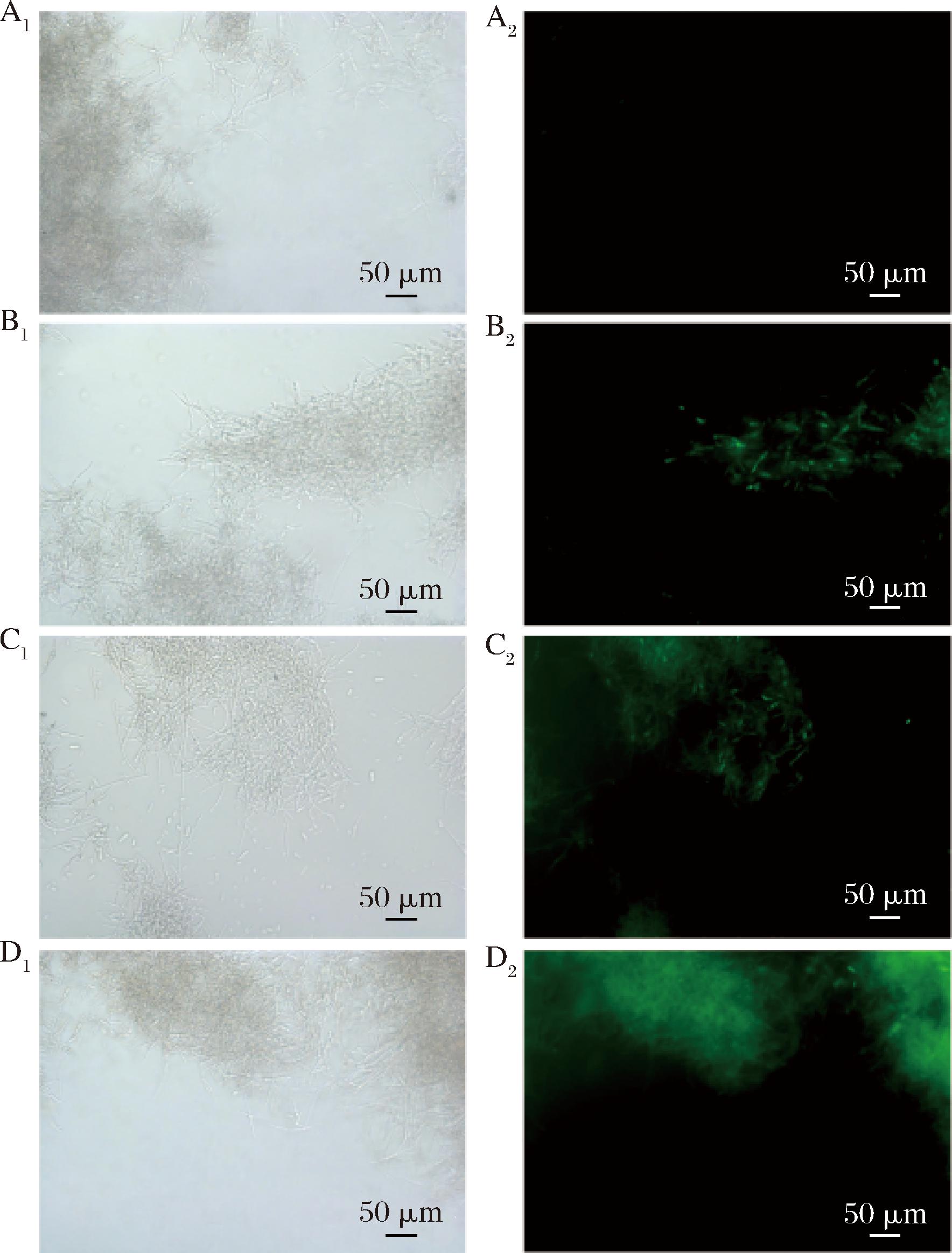
A-Control;B-0.1 mL/L溶液E24 N处理;C-0.2 mL/L E24 N溶液处理;D-0.4 mL/L E24 N溶液处理
图10 E24 N处理尖孢炭疽菌对ROS含量影响
Fig.10 Effects of E24 N on accumulated ROS ontents of C.acutatum
注:下标1:明场;下标2:暗场。
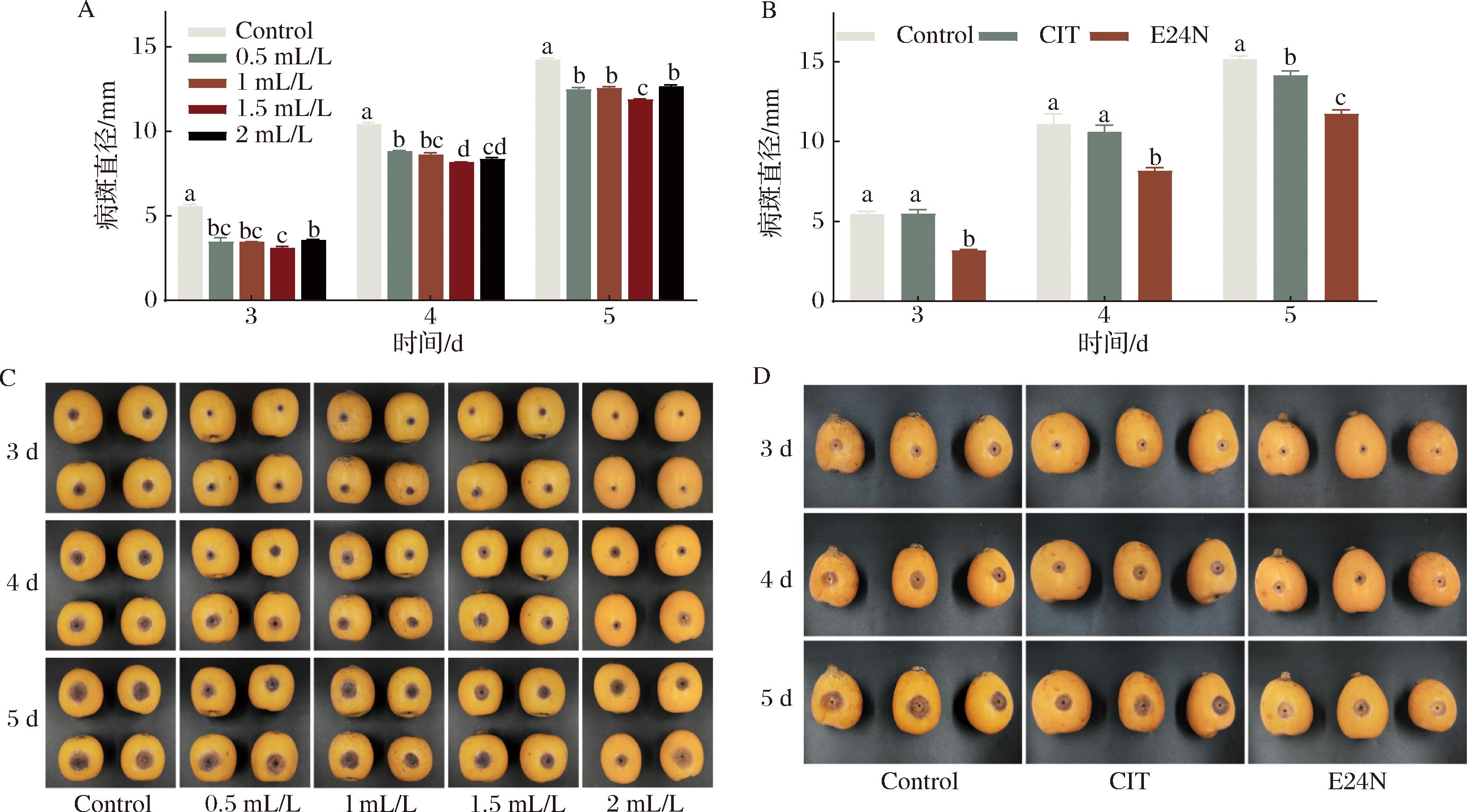
A-不同浓度E24 N溶液处理枇杷果实病斑直径;B-1.5 mL/L CIT溶液和E24 N溶液处理枇杷果实病斑直径; C-不同浓度E24 N溶液处理枇杷果实;D-1.5 mL/L CIT溶液和E24 N溶液处理枇杷果实
图11 E24 N处理枇杷果实发病情况
Fig.11 Effect of E24 N treatment on incidence of anthracnose in loquat fruit
2.8 E24 N处理对炭疽菌侵染果实发病情况的影响
采用同孔接种方法观察E24 N处理对炭疽菌侵染果实的抑制作用并对比E24 N与CIT抑菌效果,如图11所示,不同浓度的E24 N溶液对果实尖孢炭疽菌的抑菌效果存在差异,培养5 d后对照组病斑直径为14.22 mm,而0.5、1、1.5、2 mL/L E24 N溶液处理分别为12.47、12.54、11.86、12.66 mm与对照组具有显著性(P<0.05),且浓度为1.5 mL/L E24 N溶液对尖孢炭疽菌侵染的枇杷果实抑菌效果最好。如图11-B通过对比E24 N和CIT处理枇杷5 d后测量果实病斑直径,未经处理的对照组病斑直径为15.14 mm,CIT处理的枇杷果实病斑直径为14.13 mm,而E24 N处理的枇杷果实病斑直径为11.74 mm,仅为对照组的77.54%(P<0.05)、CIT处理组的84.28%(P<0.05),说明E24 N可以显著抑制枇杷果实尖孢炭疽菌的生长,抑制效果优于CIT。
3 讨论
本研究发现E24 N有效地抑制了枇杷尖孢炭疽菌的菌落扩张和菌丝生长,且E24 N的抑制作用与其浓度呈正相关。0.4 mL/L E24 N溶液处理能够显著抑制尖孢炭疽菌的菌丝生长(P<0.05),并且在12 h内完全抑制孢子的萌发。这些结果与ZHANG等[8]研究发现E24 N浓度为0.2 mL/L可以完全抑制固体培养基上柑橘指状青霉的生长报道一致。
SEM和TEM是观察尖孢炭疽菌表面形态和细胞超微结构变化的有效手段[16]。研究结果表明,E24 N处理尖孢炭疽菌导致细胞形态异常、细胞质膜破坏和细胞器降解,且随着E24 N浓度升高细胞损坏程度也随之严重。当E24 N处理尖孢炭疽菌时SEM观察到尖孢炭疽菌的破坏严重,菌丝出现明显的干瘪和褶皱,细胞严重变形;TEM观察到尖孢炭疽菌细胞质和细胞器缺失严重,细胞质中有大量的细胞质融合,细胞内容物出现明显渗漏情况,细胞边缘模糊。OUYANG等[17]在研究中也观察到类似结果,经反-2-己烯醛处理的柑橘地霉菌菌丝体表面变得起皱并严重扭曲、收缩和塌陷,而对照组菌丝体形状规则,厚度均匀,表面光滑、饱满。总之,SEM和TEM结果表明,E24 N对尖孢炭疽菌造成细胞损伤(如细胞膜、细胞质和细胞器),从而抑制菌丝生长。
细胞膜在维持真菌细胞内环境平衡和功能中扮演关键角色,其完整性对于细胞稳态、物质代谢、能量转换和信号传导至关重要[18]。研究表明,细胞膜是众多脂肪醛类抗真菌剂的作用靶点,例如肉桂醛[19]和CIT[20]。荧光染料PI,作为一种细胞膜完整性的指示剂,能够穿透受损的细胞膜并发出红色荧光,用于评估抗真菌效果[21]。实验观察显示,E24 N处理显著增强了尖孢炭疽菌的PI染色荧光,表明细胞膜完整性受损。细胞膜损伤导致电解质、核酸和蛋白质等细胞成分泄漏,从而促进培养基的电导率、A260nm和A280nm值升高[22]。经E24 N处理后,细胞膜被破坏,菌丝体胞外相对电导率显著上升(P<0.05),且随着处理浓度的升高和处理时间的延长,菌丝体细胞内核酸和蛋白质发生外泄,处理组在A260nm和A280nm吸光度显著高于对照组(P<0.05)。这些结果进一步证实了E24 N对尖孢炭疽菌细胞结构的破坏作用,这与PI染色、SEM和TEM观察结果一致。
LI等[23]提出,抗真菌药物可能通过诱导MDA和ROS积累引起氧化应激破坏细胞膜完整性。MDA是一种具有细胞毒性的物质,能够引起蛋白质、核酸等生命大分子的交联聚合,从而对细胞造成损伤[23]。胞内活性氧触发细胞膜中核酸和不饱和脂肪酸等生物大分子的脂质过氧化反应,产生有毒性的脂质过氧化产物,扰乱细胞膜组成平衡,导致膜流动性和渗透性变化,改变离子传输,并抑制生物代谢[24]。通过监测MDA和ROS产量来评估膜脂过氧化程度[25]。本研究观察到E24 N处理尖孢炭疽菌MDA含量显著高于对照组(P<0.05),在活性氧测定中,处理组产生明显的绿色荧光,说明E24 N可诱导细胞膜脂质过氧化的积累,严重影响细胞膜的功能和活力。
4 结论
本研究揭示了E24 N处理抑制枇杷果实尖孢炭疽菌生长从而降低枇杷果实发病率的机制,0.4 mL/L E24 N溶液处理能够显著抑制尖孢炭疽菌的菌丝生长,并且在12 h内完全抑制孢子的萌发。此外,E24 N处理还导致尖孢炭疽菌细胞膜的破坏,增加了细胞的通透性,引发活性氧的积累和脂质过氧化反应,这些变化共同导致了菌丝体内外环境的失衡,从而影响菌丝体的正常生理功能。使用E24 N处理枇杷果实可延缓枇杷采后炭疽病发病进程。这些发现为进一步开发和应用E24 N作为绿色化学防治剂提供了一定的支持,并为枇杷果实采后病害管理提供了新的策略。
[1] DHIMAN A, SUHAG R, THAKUR D, et al.Current status of loquat (Eriobotrya japonica Lindl.):Bioactive functions, preservation approaches, and processed products[J].Food Reviews International, 2022, 38(sup1):286-316.
[2] YAN F, CAI T, WU Y Y, et al.Physiological and transcriptomics analysis of the effect of recombinant serine protease on the preservation of loquat[J].Genomics, 2021, 113(6):3750-3761.
[3] YAN F, LI C H, YE X L, et al.Antifungal activity of lipopeptides from Bacillus amyloliquefaciens MG3 against Colletotrichum gloeosporioides in loquat fruits[J].Biological Control, 2020, 146:104281.
[4] WU W X, LIU Y, HUANG X Q, et al.First report of anthracnose caused by Colletotrichum nymphaeae on loquat fruit in China[J].Plant Disease, 2018, 102(1):243.
[5] SHAH H M S, KHAN A S, SINGH Z, et al.Postharvest biology and technology of loquat (Eriobotrya japonica Lindl.)[J].Foods, 2023, 12(6):1329.
[6] ALI M, AHMED A, AHMAD SHAH S W, et al.Effect of silver nanoparticle coatings on physicochemical and nutraceutical properties of loquat during postharvest storage[J].Journal of Food Processing and Preservation, 2020, 44(10):e14808.
[7] CAI Z H, HUANG W N, ZHONG J H, et al.Methyl jasmonate-loaded composite biofilm sustainably alleviates chilling lignification of loquat fruit during postharvest storage[J].Food Chemistry, 2024, 444:138602.
[8] ZHANG X, DENG Q, GAO X Q, et al.Fatty acid metabolism and C9 aldehyde biosynthesis are involved in ε-poly-l-lysine-induced citrus fruit resistance to Penicillium digitatum[J].Pesticide Biochemistry and Physiology, 2023, 196:105614.
[9] 周丹丹, 王卓, 邢梦珂, 等.植物精油抑制炭疽菌及对枇杷采后炭疽病与品质的影响[J].食品科学, 2017, 38(19):212-217.ZHOU D D, WANG Z, XING M K, et al.Inhibitory effect of plant essential oils on Colletorichum acutatum and postharvest anthracnose and quality of loquat fruits[J].Food Science, 2017, 38(19):212-217.
[10] 虞铭霞, 韦莹莹, 黄铮铮, 等.水蜜桃主要病原真菌分离鉴定及肉桂精油对其抑制作用[J].食品工业科技, 2024, 45(13):124-131.YU M X, WEI Y Y, HUANG Z Z, et al.Isolation and identification of the main fungal pathogens of peach fruit and the antifungal effect of cinnamon essential oil on these pathogens[J].Science and Technology of Food Industry, 2024, 45(13):124- 131.
[11] ZHANG J H, TIAN H, SUN H L, et al.Antifungal activity of trans-2-hexenal against Penicillium cyclopium by a membrane damage mechanism[J].Journal of Food Biochemistry, 2017, 41(2):e12289.
[12] 翁甜, 王昱晴, 龙超安.香叶醇对柑橘酸腐病菌的抑菌机制[J].食品科学, 2023, 44(1):14-21.WENG T, WANG Y Q, LONG C A.Inhibitory mechanism of geraniol against Geotrichum citri-aurantii in Citrus[J].Food Science, 2023, 44(1):14-21.
[13] WANG W J, LIU S, DENG L L, et al.Control of Citrus post-harvest green molds, blue molds, and sour rot by the cecropin a-melittin hybrid peptide BP21[J].Frontiers in Microbiology, 2018, 9:2455.
[14] MI T T, LUO D L, LI J K, et al.Carvacrol exhibits direct antifungal activity against stem-end rot disease and induces disease resistance to stem-end rot disease in kiwifruit[J].Physiological and Molecular Plant Pathology, 2023, 127:102065.
[15] LIU Y, LEI X M, DENG B, et al.Methionine enhances disease resistance of jujube fruit against postharvest black spot rot by activating lignin biosynthesis[J].Postharvest Biology and Technology, 2022, 190:111935.
[16] WANG Y, LIU X Y, CHEN T, et al.Antifungal effects of hinokitiol on development of Botrytis cinerea in vitro and in vivo[J].Postharvest Biology and Technology, 2020, 159:111038.
[17] OUYANG Q L, SHI S W, LIU Y M, et al.Inhibitory mechanisms of trans-2-hexenal on the growth of Geotrichum citri-aurantii[J].Journal of Fungi, 2023, 9(9):930.
[18] DELATTIN N, CAMMUE B P, THEVISSEN K.Reactive oxygen species-inducing antifungal agents and their activity against fungal biofilms[J].Future Medicinal Chemistry, 2014, 6(1):77-90.
[19] WEI J, BI Y, XUE H, et al.Antifungal activity of cinnamaldehyde against Fusarium sambucinum involves inhibition of ergosterol biosynthesis[J].Journal of Applied Microbiology, 2020, 129(2):256-265.
[20] CAO J J, LIU H, WANG Y, et al.Antimicrobial and antivirulence efficacies of citral against foodborne pathogen Vibrio parahaemolyticus RIMD2210633[J].Food Control, 2021, 120:107507.
[21] LIU S Q, DU Y L, ZHANG D Y, et al.Aluminum sulfate inhibits green mold by inducing chitinase activity of Penicillium digitatum and enzyme activity of Citrus fruit[J].Food Control, 2022, 136:108854.
[22] TAO N G, OUYANG Q L, JIA L.Citral inhibits mycelial growth of Penicillium italicum by a membrane damage mechanism[J].Food Control, 2014, 41:116-121.
[23] LI W S, YUAN S Z, LI Q Q, et al.Methyl p-coumarate inhibits black spot rot on jujube fruit through membrane damage and oxidative stress against Alternaria alternata[J].Postharvest Biology and Technology, 2018, 145:230-238.
[24] XIN Z T, OUYANG Q L, WAN C P, et al.Isolation of antofine from Cynanchum atratum BUNGE (Asclepiadaceae) and its antifungal activity against Penicillium digitatum[J].Postharvest Biology and Technology, 2019, 157:110961.
[25] OUYANG Q L, TAO N G, ZHANG M L.A damaged oxidative phosphorylation mechanism is involved in the antifungal activity of citral against Penicillium digitatum[J].Frontiers in Microbiology, 2018, 9:239.