根据国际稀有糖协会(International Society of Rare Sugars,ISRS)的定义,稀有糖是自然界中罕见的单糖及其衍生物[1-3]。D-阿洛酮糖作为一种独特的稀有糖,其甜度可达到蔗糖的70%,但能量仅为蔗糖的3%,因此,在食品和制药行业中得到广泛应用[4-6]。此外,D-阿洛酮糖已被美国食品药品监督管理局(Food and Drug Administration,FDA)认定为“一般认为安全”(Generally Recognized as Safe,GRAS)的物质,这进一步显示其巨大的市场潜力[7-8]。
有研究团队开创性地提出了Izumoring策略,通过差向异构酶可以实现所有稀有己糖的生物合成[9]。通过D-阿洛酮糖-3-差向异构酶,已成功实现从D-果糖到D-阿洛酮糖的高效转化[10-12]。尽管利用果糖生产D-阿洛酮糖具有转化率较高的优势,然而,甘油在生物合成中有巨大的潜力。甘油作为生产生物柴油过程中的主要副产物,当前存量庞大且价格低廉[13]。因此,如何通过生物转化技术提升甘油的价值已成为科研领域的热点研究方向[14]。近年来,基于醛缩酶利用甘油合成稀有糖的方法已逐渐崭露头角,拓展了生物合成D-阿洛酮糖策略[8, 15]。醛缩酶能够催化供体(酮)和受体(醛)之间的立体选择性醛醇反应,从而合成稀有糖,这为稀有糖的合成提供了新的途径[16-19]。
在醛缩酶家族中,磷酸二羟丙酮依赖型醛缩酶已成为生产稀有糖方法中最受关注的醛缩酶。其中以L-鼠李糖树胶-1-磷酸醛缩酶(L-rhamnulose-1-phosphate aldolase,RhaD)作为研究对象,在大肠杆菌(Escherichia coli)、枯草芽孢杆菌(Bacillus subtilis)以及谷氨酸棒状杆菌中均有报道可以生成稀有糖[17,20-22]。然而,RhaD在利用D-甘油醛生产D-阿洛酮糖时,会生成更高比例的D-山梨糖。例如在大肠杆菌与枯草芽孢杆菌中D-山梨糖与D-阿洛酮糖的生成比例分别为1.2∶1(质量比,下同)[17]和2.2∶1[21]。较高比例的D-山梨糖不仅增加了后续分离纯化的成本,也阻碍了D-阿洛酮糖的工业化进程。因此,开发一种能够高效生产D-阿洛酮糖且生成较少副产物D-山梨糖的醛缩酶,对于推动其工业化生产具有重要意义。
L-墨角藻糖-1-磷酸醛缩酶(L-fuculose-1-phosphate aldolase,FucA)作为另一种重要的磷酸二羟丙酮依赖型醛缩酶[23-24],在以D-甘油醛为底物时可以生成D-阿洛酮糖,尽管同样伴有副产物D-山梨糖的生成,但其更倾向于生成D-阿洛酮糖,D-山梨糖与D-阿洛酮糖的生成比例为1∶8.4[25]。然而,目前关于FucA的研究局限于纯酶级联反应,这一方法涉及到多种酶的表达与纯化,增加了反应成本,不利于工业化生产。而全细胞生物催化具有多种优势,包括催化效率高、成本较低以及操作便利,这使得全细胞催化成为生产稀有糖的重要方法。目前通过基于RhaD醛缩酶全细胞系统可以实现D-阿洛酮糖、D-山梨糖、L-果糖等稀有糖的高效生产[17,21,26]。因此,探索基于FucA醛缩酶全细胞进行生产D-阿洛酮糖显得尤为重要。
在本课题组前期工作中,已在大肠杆菌和枯草芽孢杆菌中成功构建基于RhaD醛缩酶的高效全细胞合成稀有糖系统,用于D-阿洛酮糖和D-山梨糖的生产[17,21]。作为GRAS级微生物,枯草芽孢杆菌因其非致病性以及清晰的遗传背景,在工业应用中备受青睐[27-28]。然而,基于FucA的D-阿洛酮糖全细胞合成系统在枯草芽孢杆菌中尚未实现。
在生物合成中,启动子对基因转录水平具有重要影响,因此启动子的优化至关重要。随着启动子工程技术的不断发展,已在枯草芽孢杆菌中鉴定出多种组成型启动子进行异源蛋白的高效表达[29-31]。本研究致力于构建基于FucA醛缩酶以甘油为底物合成D-阿洛酮糖的系统,并对不同组成型启动子(包括Pylb、PlytR、P43、PsucA和Pveg)进行了评估,且对全细胞反应中双细胞的比例进行优化。同时,优化了全细胞转化的最佳反应条件,包括温度、pH、全细胞浓度及甘油浓度。最终,通过全细胞甘油补料策略,进一步提高了D-阿洛酮糖的产量。
1 材料与方法
1.1 材料与试剂
1.1.1 培养基
LB培养基(g/L):酵母提取物5,蛋白胨10,氯化钠10,琼脂粉20(固体平板),pH 7.0。
改良TB培养基(g/L):酵母提取物24,蛋白胨12,K2HPO4 16.4,KH2PO4 2.31,pH 7.0。
1.1.2 试剂
限制性核酸内切酶、DNA聚合酶,宝日医生物技术有限公司;PCR产物纯化试剂盒、胶回收试剂盒、质粒提取试剂盒等,生工生物工程股份有限公司;同源重组酶,爱博泰克生物科技有限公司;D-阿洛酮糖、D-山梨糖,东京化成工业株式会社;D-甘油醛,西格玛奥德里奇贸易有限公司。
1.1.3 菌株和质粒
本实验所用到的菌株和质粒分别见表1和表2。
表1 实验所用到的菌株
Table 1 Strains used in this study

注:BS-0n为本文构建的第n个菌株;aldO代表合成醛醇氧化酶(alditol oxidase,AldO)的基因;yqaB代表合成果糖-1-磷酸酶(fructose-1-phosphatase,YqaB)的基因。
菌株 基因型来源B.subtilis 168trpC2本实验室[21]BS-01B.subtilis 168含有质粒pP43NMK-Pylb-fucA-yqaB本研究BS-02B.subtilis 168含有质粒pP43NMK-PlytR-fucA-yqaB本研究BS-03B.subtilis 168含有质粒pP43NMK-P43-fucA-yqaB本研究BS-04B.subtilis 168含有质粒pP43NMK-PsucA-fucA-yqaB本研究BS-05B.subtilis 168含有质粒pHT43-Pveg-fucA-yqaB本研究BS-06B.subtilis 168含有质粒pHT43-Pveg-aldO本实验室[21]BS-07B.subtilis 168含有质粒pHT43-Pveg-aldO-Pveg-fucA-yqaB本研究
表2 实验所用的质粒
Table 2 Plasmids used in this study
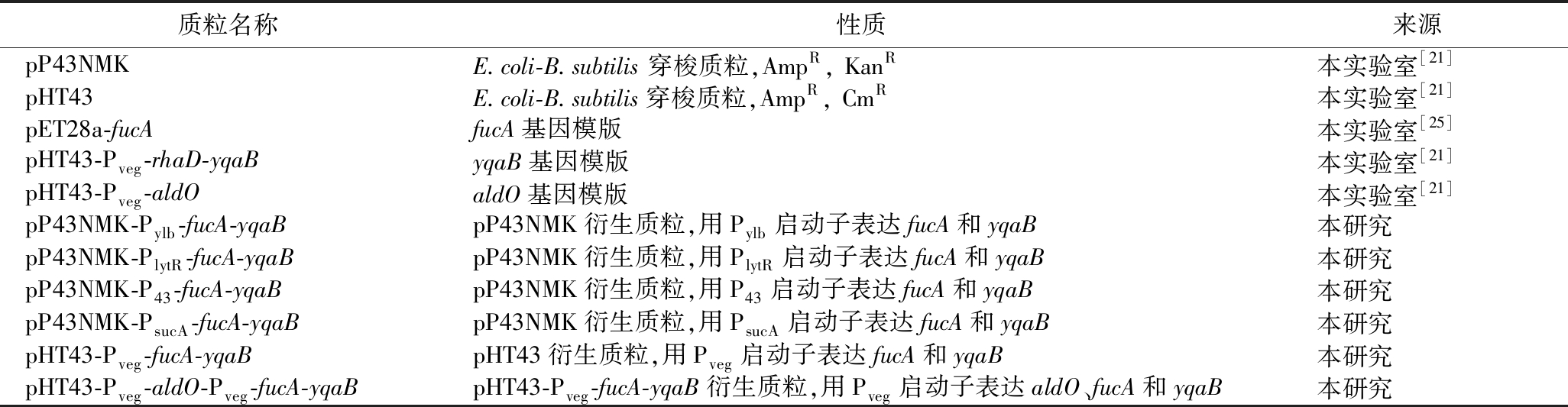
质粒名称性质来源pP43NMKE.coli-B.subtilis 穿梭质粒,AmpR, KanR本实验室[21]pHT43E.coli-B.subtilis穿梭质粒,AmpR, CmR本实验室[21]pET28a-fucAfucA基因模版本实验室[25]pHT43-Pveg-rhaD-yqaByqaB基因模版本实验室[21]pHT43-Pveg-aldOaldO基因模版本实验室[21]pP43NMK-Pylb-fucA-yqaBpP43NMK衍生质粒,用Pylb启动子表达fucA和yqaB本研究pP43NMK-PlytR-fucA-yqaBpP43NMK衍生质粒,用PlytR启动子表达fucA和yqaB本研究pP43NMK-P43-fucA-yqaBpP43NMK衍生质粒,用P43启动子表达fucA和yqaB本研究pP43NMK-PsucA-fucA-yqaBpP43NMK衍生质粒,用PsucA启动子表达fucA和yqaB本研究pHT43-Pveg-fucA-yqaBpHT43衍生质粒,用Pveg启动子表达fucA和yqaB本研究pHT43-Pveg-aldO-Pveg-fucA-yqaBpHT43-Pveg-fucA-yqaB衍生质粒,用Pveg启动子表达aldO、fucA和yqaB本研究
1.2 仪器与设备
2695高效液相色谱系统、2414示差检测器,美国沃特世公司;Aminex HPX-87H有机酸柱、C1000 PCR仪器,美国伯乐生命科学研究公司;5200Multi Western blot成像仪,中国天能科技。
1.3 实验方法
1.3.1 质粒构建
来源于嗜热栖热菌(Thermus thermophilus)HB8的fucA基因从质粒pET28a-fucA进行PCR扩增,来源于大肠杆菌的yqaB基因从质粒pHT43-Pveg-rhaD-yqaB进行PCR扩增,aldO基因来源于天蓝色链霉菌(Streptomyces coelicolor)A3。对于启动子Pylb、PlytR、P43、PsucA和Pveg均从枯草芽孢杆菌基因组进行PCR扩增。
通过PCR扩增的fucA和yqaB片段使用胶回收试剂盒纯化后,通过重叠PCR将fucA与yqaB用RBS(GGAAAGGAGGAATTGAGAC)进行连接,获得fucA-yqaB共表达片段。载体pP43NMK使用BamHⅠ和PstⅠ进行双酶切,胶回收后得到线性化载体。使用同源重组的方法将不同的启动子片段(Pylb、PlytR、P43和PsucA)以及fucA-yqaB共表达片段组装到线性化载体中,分别获得重组质粒pP43NMK-Pylb-fucA-yqaB、pP43NMK-PlytR-fucA-yqaB、pP43NMK-P43-fucA-yqaB和pP43NMK-PsucA-fucA-yqaB。由于启动子Pveg在pP43NMK质粒中不表达,而在pHT43质粒可以正常表达,因此需要构建pHT43-Pveg-fucA-yqaB质粒[21]。对于构建pHT43-Pveg-fucA-yqaB,使用限制性内切酶KpnⅠ和BamHⅠ对载体pHT43进行双酶切,随后将Pveg启动子片段和fucA-yqaB共表达片段组装到线性化载体中,得到重组质粒pHT43-Pveg-fucA-yqaB。对于构建pHT43-Pveg-aldO-Pveg-fucA-yqaB质粒,首先从pHT43-Pveg-aldO质粒中对Pveg-aldO片段进行PCR扩增,然后使用限制性内切酶SacⅠ对pHT43-Pveg-fucA-yqaB进行线性化,最后通过同源重组将Pveg-aldO片段组装到线性化pHT43-Pveg-fucA-yqaB载体中,得到重组质粒pHT43-Pveg-aldO-Pveg-fucA-yqaB。所有重组质粒都在金唯智生物科技有限公司进行测序验证。
1.3.2 枯草芽孢杆菌全细胞制备
将重组枯草芽孢杆菌接种到LB液体培养基中过夜培养,随后按照1%接种量接种到50 mL改良TB培养基中。培养条件为37 ℃、220 r/min。培养16 h后,离心(4 000×g、5 min、4 ℃)去上清液收集全细胞。
对于全细胞转化,使用PBS溶液(KH2PO4 0.24 g/L、Na2HPO4 1.44 g/L、KCl 0.2 g/L、NaCl 8 g/L、pH 7.5)对收集的全细胞重悬洗涤2次。全细胞反应体系如下:将150 g/L的湿细胞重悬于改良M9缓冲液(KH2PO4 3.0 g/L、Na2HPO4·7H2O 12.8 g/L、MgSO40.24 g/L、NH4Cl 1.0 g/L、NaCl 0.5 g/L、CaCl2 11.1 mg/L、pH 6.5),同时加入50 g/L的甘油作为唯一碳源和底物。全细胞反应条件为30 ℃、220 r/min,反应时间为3 d。反应结束后,使用HPLC分析上清液,计算D-阿洛酮糖产量。
1.3.3 枯草芽孢杆菌全细胞制备
全细胞反应条件对产量的影响至关重要,探究全细胞反应温度、pH、全细胞浓度以及甘油浓度对D-阿洛酮糖产量的影响。首先探究反应温度(20、25、30、35、40 ℃)对全细胞产糖量的影响。在此基础上,探究不同pH(6.0、6.5、7.0、7.5、8.0和8.5)对产量的影响。随后优化产糖系统中全细胞质量浓度(25、50、100、150、200、400 g/L)。最后,进行甘油浓度优化,测定甘油质量浓度分别在25、50、100、150、200 g/L时的D-阿洛酮糖产量。
1.3.4 全细胞甘油补料策略
在全细胞转化过程中,在250 mL摇瓶中加入20 mL全细胞进行生物催化,摇瓶中全细胞质量浓度为150 g/L,甘油的初始质量浓度为50 g/L。为了在生物转化过程中保持较高的甘油浓度,实验组在补料转化的第3天额外添加甘油。而批次转化作为对照组,在整个反应期间没有额外添加甘油。
1.4 分析方法
HPLC系统使用有机酸柱进行产物检测。流动相为5 mmol/L硫酸,流速为0.4 mL/min,柱温箱温度为60 ℃。检测器为示差折光检测器,检测器温度为35 ℃。
2 结果与分析
2.1 在枯草芽孢杆菌中构建D-阿洛酮糖合成途径
在枯草芽孢杆菌中合成D-阿洛酮糖的路径如图1所示。具体步骤如下:首先,由AldO催化甘油转化为D-甘油醛;随后,D-甘油醛与内源生成的磷酸二羟丙酮在FucA的催化作用下进行缩合反应,生成稀有糖-1-磷酸;最终,稀有糖-1-磷酸在YqaB的催化下进行去磷酸化,生成D-阿洛酮糖和D-山梨糖。为了验证FucA和YqaB在D-阿洛酮糖生产系统中的催化效能,使用不同组成型启动子来表达FucA和YqaB(分别命名为BS-01~BS-05)。根据BS-05菌株的Western blot结果,确认FucA和YqaB蛋白均得到了高效表达(图2-a)。随后,对重组菌株进行全细胞转化实验,通过添加50 g/L甘油和5 g/L D-甘油醛来评估其生产D-阿洛酮糖的能力。HPLC结果显示,成功检测到D-阿洛酮糖和D-山梨糖的生成,且D-山梨糖与D-阿洛酮糖的生成比例约为1∶12(图2-b),这与先前报道的纯酶反应结果类似。从HPLC数据(图2-c)可知,BS-01~BS-05菌株均能产生D-阿洛酮糖,其中BS-05菌株的产量最高,达到0.50 g/L。
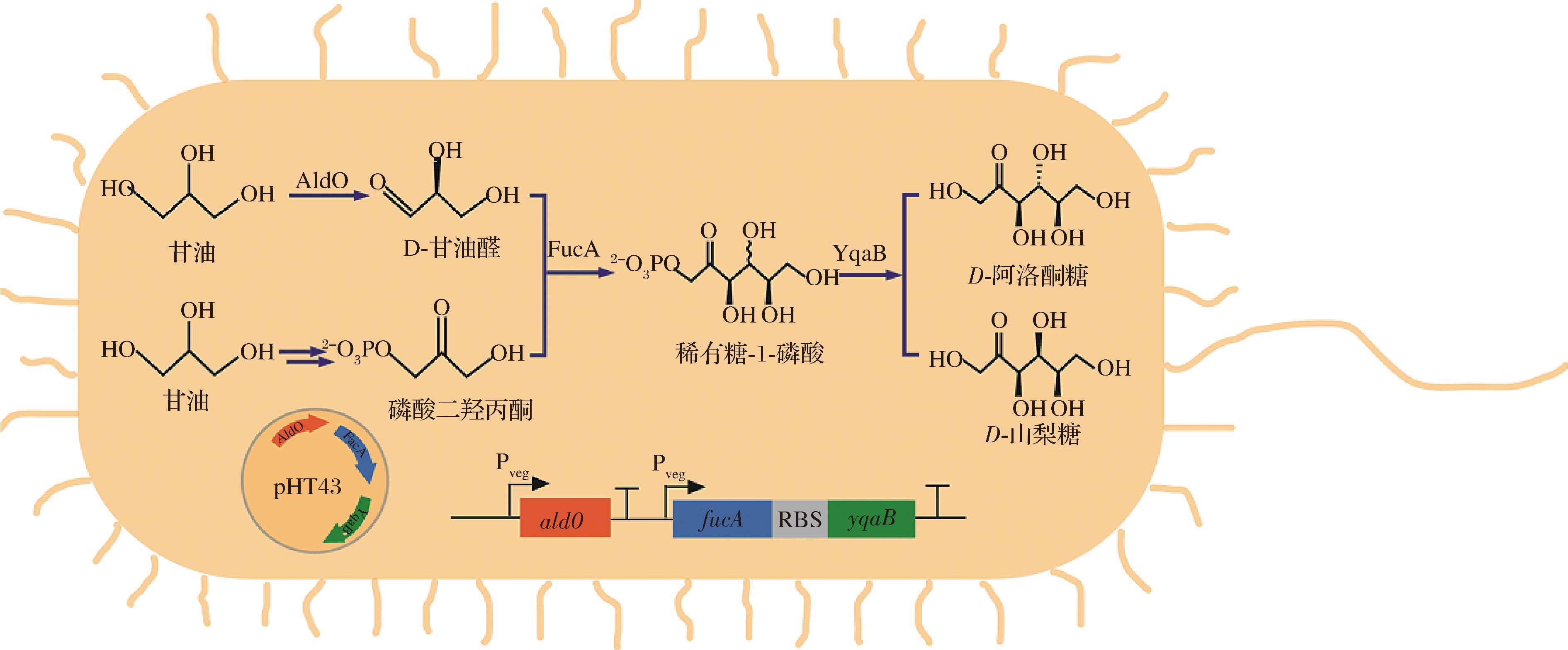
图1 枯草芽孢杆菌利用甘油生产D-阿洛酮糖的合成路线图
Fig.1 The synthetic route for D-allulose from glycerol in B.subtilis
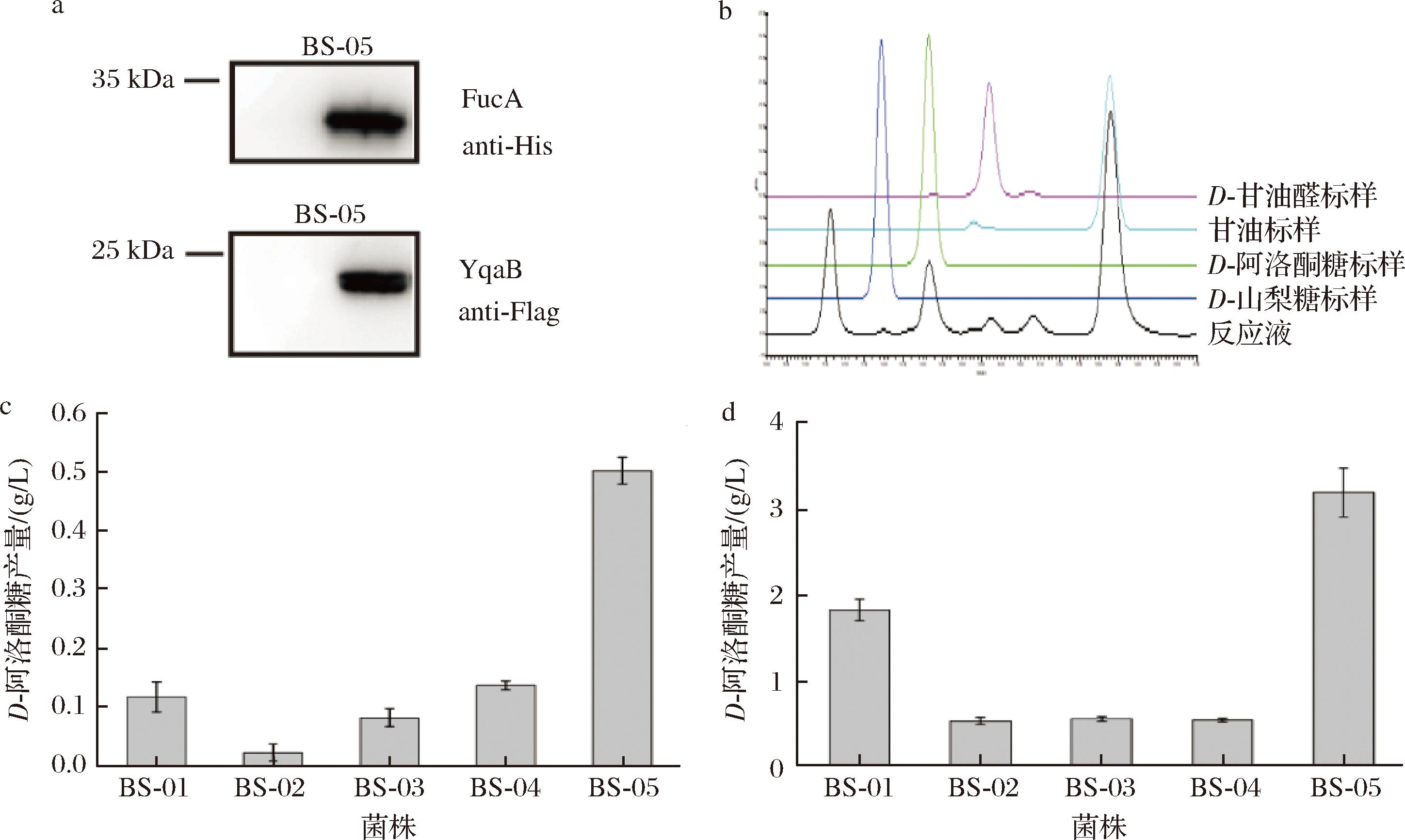
a-FucA、YqaB Western blot检测;b-HPLC结果;c-测试外加D-甘油醛生产D-阿洛酮糖的能力;d-测试双细胞组合催化生产D-阿洛酮糖的能力
图2 FucA醛缩酶在枯草芽孢杆菌中表达及活性测定
Fig.2 The expression and activity detection of FucA in B.subtilis
鉴于D-甘油醛价格高昂,不利于工业化应用,期望在枯草芽孢杆菌中通过异源表达AldO实现从甘油到D-甘油醛的生成。根据前期研究结果[21],已在枯草芽孢杆菌(在本研究中命名为BS-06)中利用Pveg启动子成功表达了AldO用来生成D-甘油醛。将BS-06菌株分别与BS-01~BS-05菌株(比例为1∶1,总细胞质量浓度为200 g/L)进行双细胞组合催化反应,其中甘油质量浓度为50 g/L。如图2-d所示,当BS-05与BS-06菌株组合时,D-阿洛酮糖的产量最高,达到了3.19 g/L,同时甘油的转化率为6.4%。这些结果表明,已经成功在枯草芽孢杆菌中构建基于FucA生产D-阿洛酮糖的合成途径。
2.2 双细胞组合催化策略合成D-阿洛酮糖
为了进一步提高D-阿洛酮糖的产量,对BS-05与BS-06的组合比例进行研究,测试不同组合比例对D-阿洛酮糖产量的影响。具体而言,BS-05与BS-06的比例分别为4∶1、2∶1、1∶1、1∶2和1∶4的条件下进行全细胞催化。如图3所示,当BS-05与BS-06的比例为1∶2时,D-阿洛酮糖的产量达到最高,即3.60 g/L。进一步分析发现,当BS-05与BS-06的比例偏高时,D-阿洛酮糖的产量相对较低。这可能是由于产糖系统中用于生产D-甘油醛的BS-06菌株比例不足,导致D-甘油醛的供应无法满足D-阿洛酮糖的合成需求,从而限制了产量的提升。相反,当BS-05与BS-06的比例偏低时,虽然BS-06菌株数量增多,D-甘油醛的产量会有所增加,但过量的D-甘油醛却可能对细胞产生潜在的毒性作用不利于产糖系统稳定,同时由于缺少合成D-阿洛酮糖细胞也会降低整个合成系统的产糖能力。因此,为了构建一个高效且健康的产糖系统,需要对BS-05与BS-06的比例进行精确优化。这一发现证明了可以通过调整双细胞比例提高D-阿洛酮糖产量。
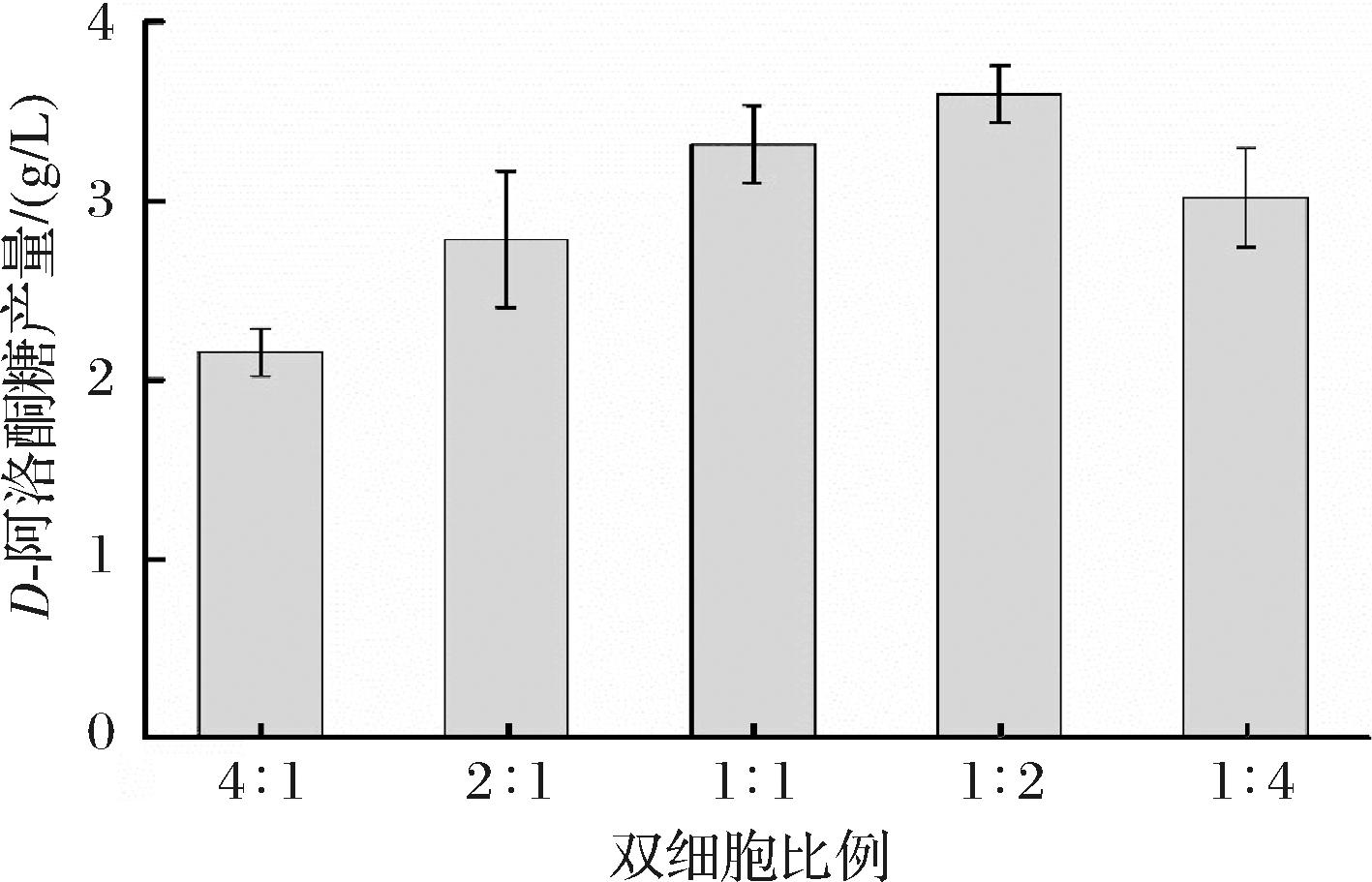
图3 优化双细胞比例对D-阿洛酮糖产量的影响
Fig.3 The impact of optimizing the ratio of dual cells on the titer of D-allulose
2.3 单质粒共表达策略催化合成D-阿洛酮糖
为了简化枯草芽孢杆菌培养过程以及全细胞催化过程,尝试将AldO、FucA和YqaB整合至单一质粒进行表达。如图4-a所示,将Pveg-aldO表达盒插入到pHT43-Pveg-fucA-yqaB的SacⅠ限制性酶切位点,成功构建重组质粒pHT43-Pveg-aldO-Pveg-fucA-yqaB。随后,将该质粒转入到枯草芽孢杆菌中获得重组菌株BS-07。最后,通过HPLC测定BS-07全细胞产糖性能。如图4-b所示,发现在全细胞转化的第3天,D-阿洛酮糖的产量最高,为3.50 g/L,同时甘油的转化率为7.0%。通过在单质粒上进行多基因共表达可以简化培养过程以及全细胞反应体系,有利于工业化生产。
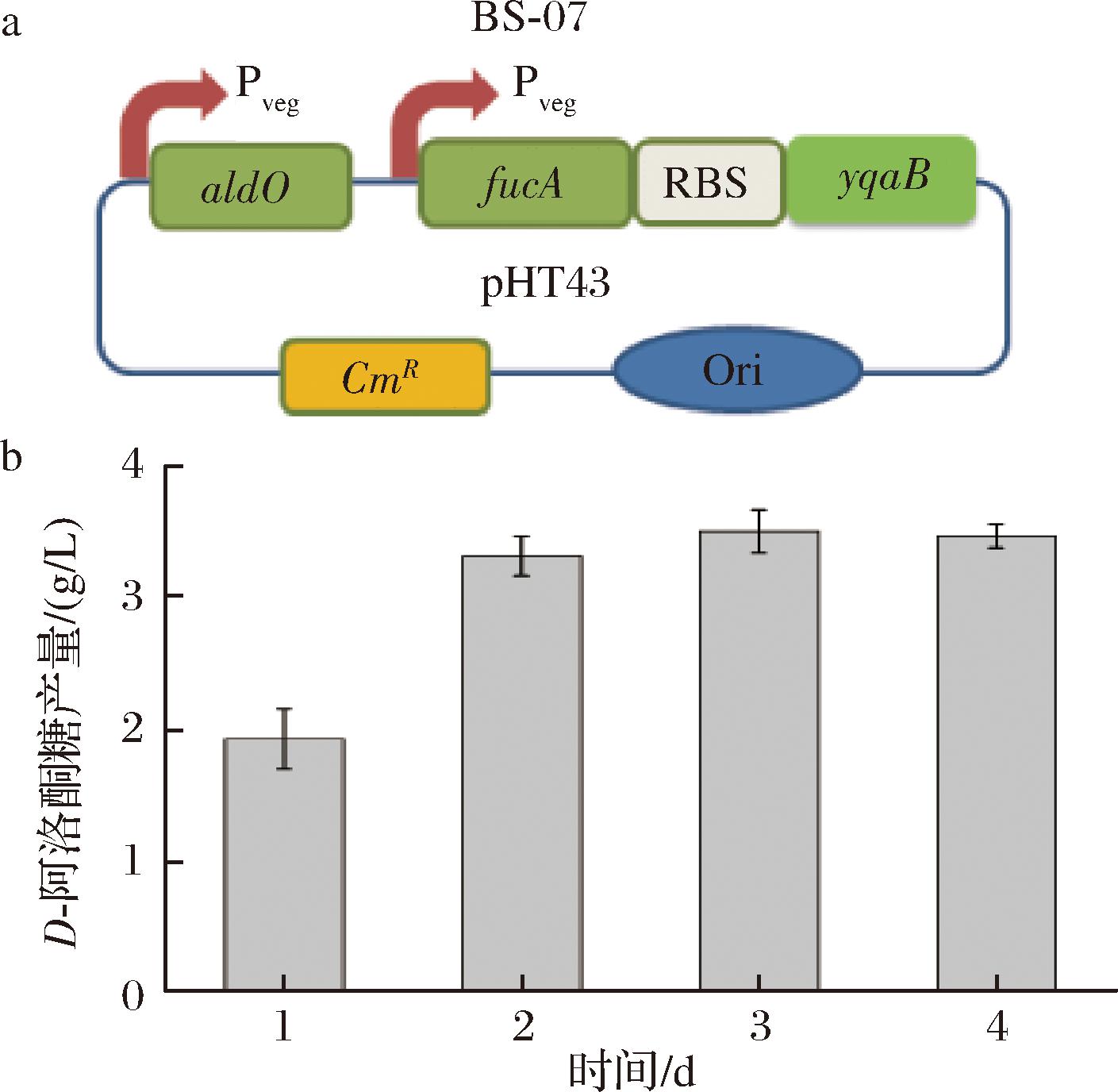
a-单细胞质粒构建;b-单细胞催化合成D-阿洛酮糖的产量
图4 单细胞催化合成D-阿洛酮糖策略
Fig.4 The strategy of D-allulose biosynthesis using single whole-cell conversion
注:RBS:核糖体结合位点;CmR:氯霉素抗性基因;Ori:复制原点。
2.4 全细胞反应条件优化
为进一步提升D-阿洛酮糖的产量,探究了全细胞反应中的4个重要因素:温度、pH、全细胞浓度以及甘油浓度。
首先,评估了不同温度(20、25、30、35、40 ℃)对D-阿洛酮糖产量的影响。如图5-a所示,当温度设定为30 ℃时,D-阿洛酮糖的产量最高,达到3.20 g/L。过高或过低的温度均导致产量下降,表明生物转化过程中需要适中的温度条件。因此,选定30 ℃作为后续实验的温度条件。
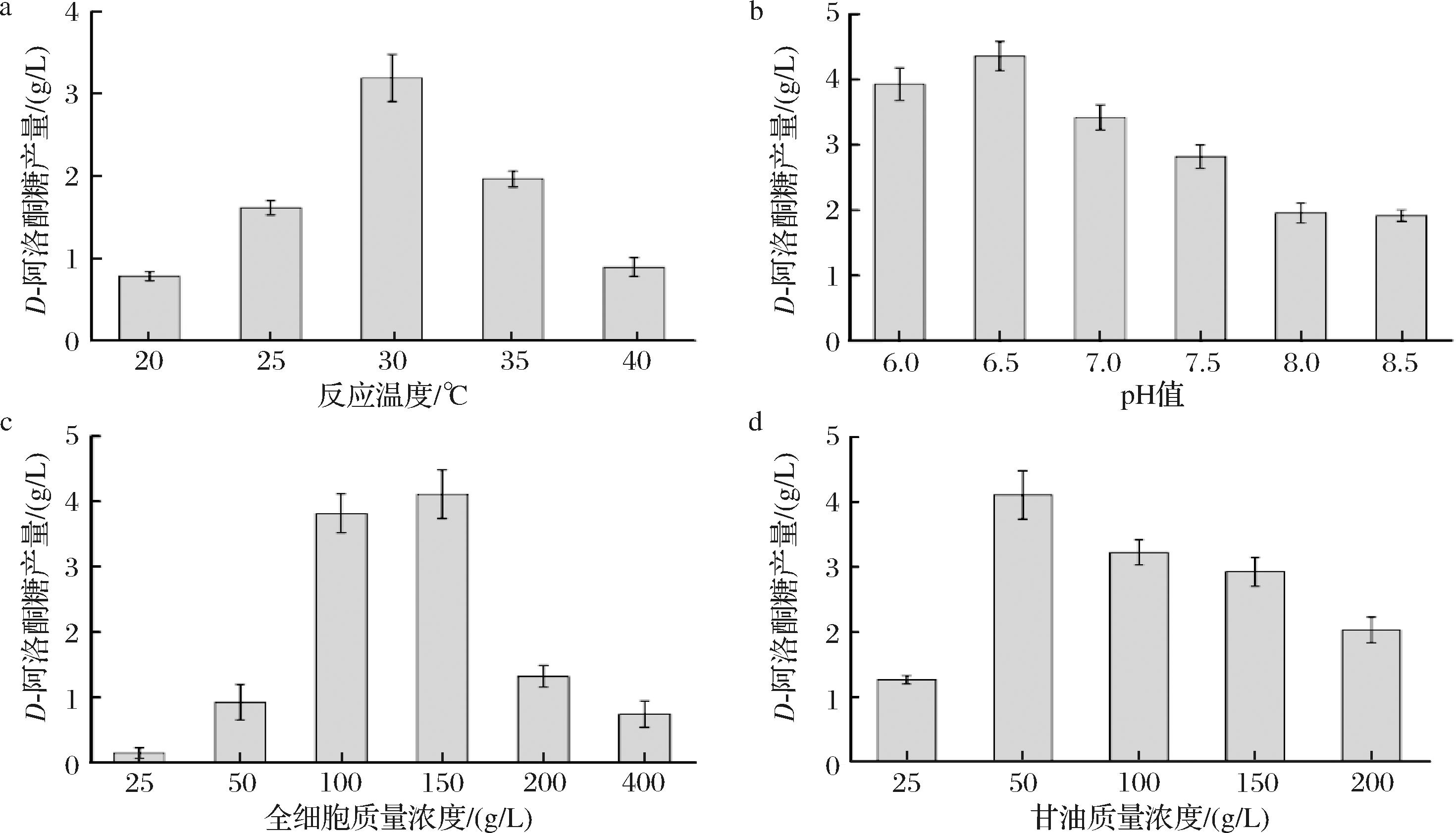
a-反应温度;b-反应pH;c-全细胞质量浓度;d-甘油质量浓度
图5 全细胞反应条件优化
Fig.5 Optimization of the conditions of whole-cell conversion
接着,探究了不同pH(6.0、6.5、7.0、7.5、8.0、8.5)对D-阿洛酮糖产量的影响。如图5-b所示,当全细胞反应的pH值为6.5时,D-阿洛酮糖的产量最高,达到4.36 g/L。值得注意的是,当反应环境偏碱性时,产量显著下降,这可能是由于碱性条件抑制了AldO的活性,从而降低了产糖效率。因此,选择pH 6.5作为后续实验的pH。
随后,考察了不同全细胞质量浓度(25、50、100、150、200、400 g/L)对D-阿洛酮糖产量的影响。如图5-c所示,当全细胞质量浓度为150 g/L时,D-阿洛酮糖的产量最高,为4.11 g/L。当全细胞浓度过低时,由于参与产物合成的细胞数量不足,导致产量受限;而当全细胞浓度过高时,会生成过量的D-甘油醛从而造成细胞损伤,同时由于全细胞浓度过高导致大量的甘油被用于代谢,从而降低其产糖能力。因此,选择150 g/L作为后续实验的全细胞质量浓度。
最后,分析了不同甘油质量浓度(25、50、100、150、200 g/L)对D-阿洛酮糖产量的影响。结果表明(图5-d),当甘油质量浓度为50 g/L时,D-阿洛酮糖的产量最高,为4.21 g/L。甘油作为全细胞的合成底物和能量来源,其浓度过低时无法满足D-阿洛酮糖的合成需求;而甘油浓度过高则可能导致D-甘油醛的过量积累,影响产糖系统的稳定性。因此,选择50 g/L作为后续实验的条件。
综上所述,通过细致的优化,确定了全细胞反应中的最佳条件,为进一步提高D-阿洛酮糖的产量奠定了坚实基础。
2.5 全细胞甘油补料策略
在全细胞生产D-阿洛酮糖的过程中,由于甘油同时被用于细胞代谢和D-阿洛酮糖合成底物,因此在生产后期,往往会出现甘油不足的情况。为了克服这一限制,尝试在催化后期中补充甘油,用来提高D-阿洛酮糖的产量。在本研究中,选择BS-07作为出发菌株进行全细胞转化反应。通过2种转化方式进行比较:a)全细胞批次转化,即在整个反应过程中没有额外添加甘油;b)全细胞补料转化,即在反应过程中补加甘油。
如图6-a所示,在全细胞批次转化实验中,由于反应后期(大约3 d后)甘油几乎耗尽,因此D-阿洛酮糖的产量几乎不再增加,最终产量为4.15 g/L,同时甘油的转化率为8.3%。这一结果表明,在反应后期,由于甘油的不足限制了D-阿洛酮糖产量的进一步提升。而对于全细胞补料转化(如图6-b所示),随着反应的进行,甘油质量浓度在第3天降至4.02 g/L。此时,向反应体系中加入甘油,使甘油质量浓度提升至约为20 g/L。与批次转化相比,补料转化在后期能够持续生产D-阿洛酮糖,最终D-阿洛酮糖的产量达到了5.25 g/L,同时检测到副产物D-山梨糖的产量为仅为0.44 g/L,低浓度的副产物有利于D-阿洛酮糖的分离纯化。在补料转化实验中,甘油的转化率为7.9%,尽管与对照组相比略微降低,但D-阿洛酮糖的产量却提高了26.5%。同时与已报道的基于RhaD全细胞催化甘油生产D-阿洛酮糖的方法相比,本研究实现的D-阿洛酮糖产量与大肠杆菌全细胞(3.59 g/L)相比提高了46%[17];尽管这一产量尚未达到枯草芽孢杆菌生产D-阿洛酮糖的水平(8.34 g/L),但是由于RhaD的立体选择性,同时产生了18.34 g/L的D-山梨糖[21],D-山梨糖浓度是本研究(0.44 g/L)的42倍,大量的D-山梨糖增加了D-阿洛酮糖的分离与纯化难度。因此,采用基于FucA全细胞催化甘油生产D-阿洛酮糖展现出了更加广阔的应用前景。
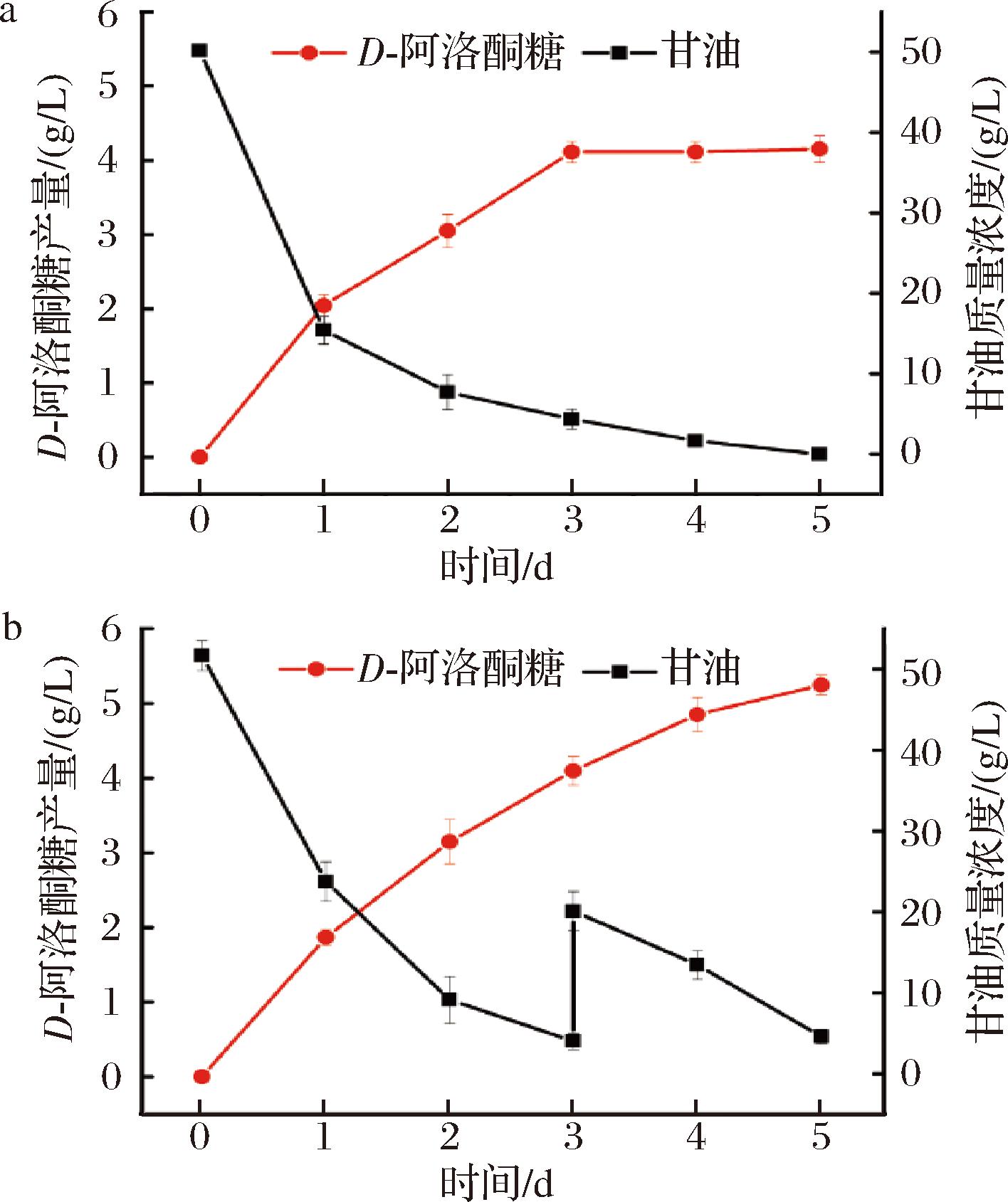
a-批次转化;b-补料转化
图6 BS-07全细胞转化生产D-阿洛酮糖
Fig.6 Whole-cell conversion of BS-07 strain for D-allulose production
这一结果表明,通过甘油补料策略,可以有效地解决全细胞转化过程中甘油不足的问题,从而提高D-阿洛酮糖的产量。这一发现为进一步优化全细胞转化过程和提高D-阿洛酮糖产量提供了有效的方法。
3 结语
本研究基于枯草芽孢杆菌的全细胞转化技术,成功构建了一个食品级D-阿洛酮糖的制备平台。研究初期,通过优化醛缩酶FucA启动子显著提升D-阿洛酮糖的产量。为了解决双细胞组合催化产量低的问题,对不同比例的双细胞进行了评估和优化。为了简化双细胞转化系统,构建了AldO、FucA和YqaB单质粒共表达的全细胞转化系统,该系统在单一细胞内即可实现D-阿洛酮糖的生物合成。在此基础上,全面优化了全细胞反应条件,包括确定了最适反应温度(30 ℃)、pH(6.5)、全细胞质量浓度(150 g/L)以及甘油质量浓度(50 g/L)。另外,通过甘油补料策略,有效解决了全细胞转化后期底物甘油不足的问题。最终D-阿洛酮糖的产量提高了26.5%,达到了5.25 g/L,且副产物D-山梨糖的质量浓度仅为0.44 g/L。
综上所述,本研究提供了一种新颖且实用的枯草芽孢杆菌转化甘油生产D-阿洛酮糖的方法,为食品级D-阿洛酮糖的生物制造领域开辟了新的研究路径,展现出广阔的应用前景与工业价值。另外,值得注意的是,由于醛缩酶的反应特性,当加入不同的醛受体时能够生产不同的产品,这大大增加基于L-墨角藻糖-1-磷酸醛缩酶枯草芽孢杆菌全细胞转化系统的应用场景。
[1] HOSSAIN A, YAMAGUCHI F, MATSUO T, et al.Rare sugar D-allulose:Potential role and therapeutic monitoring in maintaining obesity and type 2 diabetes mellitus[J].Pharmacology &Therapeutics, 2015, 155:49-59.
[2] ZHANG W L, ZHANG T, JIANG B, et al.Enzymatic approaches to rare sugar production[J].Biotechnology Advances, 2017, 35(2):267-274.
[3] MIJAILOVIC N, NESLER A, PERAZZOLLI M, et al.Rare sugars:Recent advances and their potential role in sustainable crop protection[J].Molecules, 2021, 26(6):1720.
[4] MATSUO T, SUZUKI H, HASHIGUCHI M, et al.D-psicose is a rare sugar that provides no energy to growing rats[J].Journal of Nutritional Science and Vitaminology, 2002, 48(1):77-80.
[5] ZHANG W L, YU S H, ZHANG T, et al.Recent advances in D-allulose:Physiological functionalities, applications, and biological production[J].Trends in Food Science &Technology, 2016, 54:127-137.
[6] XIA Y, CHENG Q Q, MU W M, et al.Research advances of D-allulose:An overview of physiological functions, enzymatic biotransformation technologies, and production processes[J].Foods, 2021, 10(9):2186.
[7] CHEN Z, GAO X D, LI Z J.Recent advances regarding the physiological functions and biosynthesis of D-allulose[J].Frontiers in Microbiology, 2022, 13:881037.
[8] LI A M, CAI L, CHEN Z, et al.Recent advances in the synthesis of rare sugars using DHAP-dependent aldolases[J].Carbohydrate Research, 2017, 452:108-115.
[9] GRANSTRÖM T B, TAKATA G, TOKUDA M, et al.Izumoring:A novel and complete strategy for bioproduction of rare sugars[J].Journal of Bioscience and Bioengineering, 2004, 97(2):89-94.
[10] LI Z J, HU Y F, YU C, et al.Semi-rational engineering of D-allulose 3-epimerase for simultaneously improving the catalytic activity and thermostability based on D-allulose biosensor[J].Biotechnology Journal, 2024, 19(8):e2400280.
[11] LI W, ZHU Y Y, JIANG X L, et al.One-pot production of D-allulose from inulin by a novel identified thermostable exoinulinase from Aspergillus piperis and Dorea sp.D-allulose 3-epimerase[J].Process Biochemistry, 2020, 99:87-95.
[12] GUO Q, ZHENG L J, LUO X, et al.Engineering Escherichia coli for D-allulose production from D-fructose fermentation[J].Journal of Agricultural and Food Chemistry, 2021, 69(45):13578-13585.
[13] MOHAN RAJ S, RATHNASINGH C, JUNG W C, et al.Effect of process parameters on 3-hydroxypropionic acid production from glycerol using a recombinant Escherichia coli[J].Applied Microbiology and Biotechnology, 2009, 84(4):649-657.
[14] PARK E J, KIM M, KONG D S, et al.Improvement of 1,3-propanediol production from glycerol using formate as an intermediary metabolite for NADH regeneration in Klebsiella oxytoca[J].Biomass and Bioenergy, 2024, 186:107261.
[15] DEAN S, GREENBERG W, WONG C H.Recent advances in aldolase-catalyzed asymmetric synthesis[J].Advanced Synthesis &Catalysis, 2007, 349(8-9):1308-1320.
[16] LI Z J, LI F, CAI L, et al.One-pot multienzyme synthesis of rare ketoses from glycerol[J].Journal of Agricultural and Food Chemistry, 2020, 68(5):1347-1353.
[17] CHEN Z, LI Z J, LI F, et al.Characterization of alditol oxidase from Streptomyces coelicolor and its application in the production of rare sugars[J].Bioorganic &Medicinal Chemistry, 2020, 28(10):115464.
[18] WANG W, YANG J G, SUN Y X, et al.Artificial ATP-free in vitro synthetic enzymatic biosystems facilitate aldolase-mediated C-C bond formation for biomanufacturing[J].ACS Catalysis, 2020, 10(2):1264-1271.
[19] LI Z J, HE B B, GAO Y H, et al.Synthesis of D-sorbose and D-psicose by recombinant Escherichia coli[J].Journal of Carbohydrate Chemistry, 2015, 34(6):349-357.
[20] YANG J G, ZHU Y M, MEN Y, et al.Pathway construction in Corynebacterium glutamicum and strain engineering to produce rare sugars from glycerol[J].Journal of Agricultural and Food Chemistry, 2016, 64(50):9497-9505.
[21] FEI K Q, SHEN L Q, GAO X D, et al.Multienzyme cascade synthesis of rare sugars from glycerol by Bacillus subtilis whole cells[J].Biotechnology Journal, 2024, 19(12):e202400539.
[22] GAO Y H, CHEN Z, NAKANISHI H, et al.Highly efficient synthesis of rare sugars from glycerol in endotoxin-free ClearColi by fermentation[J].Foods, 2023, 12(16):3078.
[23] GARRABOU X, CALVERAS J, JOGLAR J, et al.Highly efficient aldol additions of DHA and DHAP to N-Cbz-amino aldehydes catalyzed by L-rhamnulose-1-phosphate and L-fuculose-1-phosphate aldolases in aqueous borate buffer[J].Organic &Biomolecular Chemistry, 2011, 9(24):8430-8436.
[24] LOU X R, ZHANG J Y, LIU S M, et al.Structural characterization of an L-fuculose-1-phosphate aldolase from Klebsiella pneumoniae[J].Biochemical and Biophysical Research Communications, 2022, 607:15-19.
[25] LI Z J, CAI L, QI Q S, et al.Synthesis of rare sugars with L-fuculose-1-phosphate aldolase (FucA) from Thermus thermophilus HB8[J].Bioorganic &Medicinal Chemistry Letters, 2011, 21(17):5084-5087.
[26] CHEN Z, LI Z J, LI F, et al.Cascade synthesis of rare ketoses by whole cells based on L-rhamnulose-1-phosphate aldolase[J].Enzyme and Microbial Technology, 2020, 133:109456.
[27] FERRANDO J, FILLUELO O, ZEIGLER D R, et al.Barriers to simultaneous multilocus integration in Bacillus subtilis tumble down:Development of a straightforward screening method for the colorimetric detection of one-step multiple gene insertion using the CRISPR-Cas9 system[J].Microbial Cell Factories, 2023, 22(1):21.
[28] MARCINIAK B C, TRIP H, VAN-DER VEEK P J, et al.Comparative transcriptional analysis of Bacillus subtilis cells overproducing either secreted proteins, lipoproteins or membrane proteins[J].Microbial Cell Factories, 2012, 11:66.
[29] CUI W J, HAN L C, CHENG J T, et al.Engineering an inducible gene expression system for Bacillus subtilis from a strong constitutive promoter and a theophylline-activated synthetic riboswitch[J].Microbial Cell Factories, 2016, 15(1):199.
[30] YANG S, DU G C, CHEN J, et al.Characterization and application of endogenous phase-dependent promoters in Bacillus subtilis[J].Applied Microbiology and Biotechnology, 2017, 101(10):4151-4161.
[31] ZHOU C Y, YE B, CHENG S, et al.Promoter engineering enables overproduction of foreign proteins from a single copy expression cassette in Bacillus subtilis[J].Microbial Cell Factories, 2019, 18(1):111.