鼠李糖乳酪杆菌是公认的益生菌[1],它具有多种对人体有益的生物学特性和功能,如耐酸性与耐胆汁性、附着能力和抗菌性[2]。同时,鼠李糖乳酪杆菌具有调节肠道菌群平衡,提高免疫活性,降低血清胆固醇、抗氧化、抗肿瘤、抗病毒等多种生理功能[3-4]。但目前的研究主要集中于鼠李糖乳酪杆菌对人类益生效果的影响,对于其作为发酵剂和益生菌的制备和保存技术还未受到足够的关注。
为了便于保存、运输和使用益生菌,保护菌株和制备成相应的菌剂已成为研究的热点。但目前市场上菌株的保存普遍存在活菌含量低、菌株稳定性不佳等问题。直投式发酵剂具有活力高、发酵周期短等特点,常应用于食品工业的生产[5]。其中,冷冻干燥是一种有效保存菌种和制备的直投式发酵剂方法之一。然而,在该方法下,益生菌仍会出现一定死亡比例[6]。其原因主要是菌株在预冻过程中冰晶造成的机械损伤,以及低温使得菌体内酶活性降低以及酶发挥作用延迟,进而可能改变代谢通路[7]。这些损伤使得发酵剂中菌株的存活率降低,造成生产成本增加以及产品质量不稳定等问题[8]。因此,提高益生菌的冷冻存活率是益生菌产品研发的关键技术。据报道,有2种主要策略可以最大限度地减少由冷冻引起的不良细胞损伤。第1种策略是添加外源保护剂和调整冻干工艺,例如二糖、多糖、氨基酸和抗氧化剂[9-10]。但由于不同菌种间存在生物学差异,因此需针对特定菌株进行评估和调整。第2种策略是通过诱导主动反应来使细菌适应冷冻应激。通过调节环境条件(温度、pH、培养基成分),可以激活特定的代谢途径,从而改变细胞成分[11-12]。目前,研究表明,细菌在面临胁迫环境之前,给予其一定的适应性处理,会阻止细菌的死亡。这是一种适应性反应表达所诱导的保护作用,对细胞的生存很有利[8]。例如植物乳植杆菌通过冷应激提高了其冷冻存活率[13]。而目前尚缺少有关鼠李糖乳酪杆菌在环境胁迫下保护作用的研究报道。
其中,从保加利亚自制酸奶中分离得到的鼠李糖乳酪杆菌B6,已报道该菌株具有体外免疫调节活性[14]以及在发酵乳中可以产生潜在的生物活性肽[15]等功能。因此,本研究以该菌株为研究对象,首先探究不同保护剂对鼠李糖乳酪杆菌保护效果,选择最优冻干保护剂。其次,以低温作为预处理条件,希望找到提高菌体耐冷冻能力的冷应激方法,为获得存活率和糖代谢关键酶活性高、稳定性好的鼠李糖乳酪杆菌的冷冻干燥方法提供技术支持。
1 材料与方法
1.1 材料与试剂
鼠李糖乳酪杆菌B6(Lacticaseibacillus rhamnosus CGMCC 13310)分离自保加利亚自制酸奶。MRS肉汤培养基(生化试剂BR)、琼脂粉(生化试剂BR),德国MERCK公司;5-羧基荧光素二乙酸酯(5-carboxyfluorescein diacetate,cFDA)、碘化丙啶(propidium iodide,PI)、二甲基亚砜(dimethyl sulfoxide, DMSO)均为分析纯,SIGMA-ALDRICH公司;葡萄糖、蔗糖、乳糖、麦芽糊精、山梨醇、甘露醇、脱脂乳、柠檬酸三钠均为分析纯,生工生物工程(上海)股份有限公司;乳酸脱氢酶检测试剂盒,北京索莱宝生物公司。
1.2 仪器与设备
Bug Box DUAL厌氧培养箱,英国Jouan S.A公司;SPECORD可见光分光光度计,德国耶拿分析仪器股份公司;BX60荧光显微镜,OLYMPUS公司;Labconco FreeZone真空冷冻干燥机,美国LABCONCO公司;CytoFLEX流式细胞仪,美国BECKMAN公司。
1.3 实验方法
1.3.1 活菌计数
采用琼脂平板计数法对L.rhamnosus B6进行计数,取0.5 mL菌液,加入到4.5 mL无菌去离子水中,混合均匀后依次进行10倍的稀释。取适当稀释的菌液采用倒平板的方法,以MRS培养基为介质进行计数。待平板充分凝固后,在37 ℃培养箱中培养48 h,计数菌落数为30~300的平板。
1.3.2 冷冻干燥
将L.rhamnosus B6以2%的比例接种至50 mL的MRS液体培养基中,37 ℃培养,24 h后离心(5 000 r/min,10 min,25 ℃)取菌体,无菌水洗2次后,加入等体积的灭菌冻干保护剂,然后分装至10 mL的离心管中,每支3 mL。置于-80 ℃深冷冰箱预冻2 h,然后进行冷冻干燥。
1.3.3 冷冻干燥存活率的测定
将冷冻干燥后的菌粉用等体积的无菌水进行复水,进行冻干前后的活菌数测定。采用公式(1)计算冷冻干燥存活率:
存活率![]()
(1)
式中:No,冷冻干燥前活菌数;Nt,冷冻干燥后活菌数。
采用流式细胞仪对活/死细胞比例进行定量分析,参照HANSEN等[16]的方法对细胞进行双重染色,并做相应修改。使用DMSO配制cFDA和PI的工作溶液,使其浓度分别为2.5 mmol/L和0.8 mmol/L,然后置于-20 ℃下备用。将样品用pH 7.0的PBS缓冲液进行稀释,调节菌浓度至106cells/mL。进行双重染色时,先将2 μL cFDA加入到1 mL稀释的细菌悬浮液中,然后将样品置于30 ℃恒温培养箱中孵育15 min。在加入2 μL PI后,混合物在30 ℃下再孵育15 min。所有样品均避光孵育,孵育完成后立即用于流式细胞分析。
1.3.4 冻干保护剂的选择
根据张国强[17]和徐颖等[18]的研究结果,从葡萄糖、蔗糖、乳糖、麦芽糊精、山梨醇、甘露醇、脱脂乳(100 g/L)中进行冻干保护剂的筛选,进行冷冻干燥,计算冻干存活率。冻干存活率最高的确定为后续实验所用冻干保护剂。
1.3.5 冷应激处理
进行冷冻干燥前的处理,取1份已加入冻干保护剂后的样品直接置于-80 ℃深冷冰箱预冻2 h后进行冷冻干燥,其余分别于4 ℃和10 ℃条件下进行1、2、3、4 h的冷应激处理,然后再放入-80 ℃预冻2 h后进行冷冻干燥。冷冻干燥结束后进行冻干存活率的测定。
1.3.6 酸化能力的测定
将复水样品以0.5%的接种量接种至脱脂乳(100 g/L)中,取样测定初始pH值,然后置于37 ℃培养箱中培养12 h,取样测pH值。
1.3.7 乳酸脱氢酶活性的测定
在冻干保护剂为脱脂乳的情况下,为了从复水样品中获得菌体,采用0.2 mol/L的柠檬酸三钠溶解酪蛋白,然后离心得菌体。按照乳酸脱氢酶试剂盒的说明书,测定冷冻干燥后L.rhamnosus B6的乳酸脱氢酶活性。
1.3.8 细胞膜完整性的测定
对细胞进行双重染色,然后立即在荧光显微镜下进行观察,无需进一步预处理。
1.4 数据处理
使用SPSS 26.0软件进行数据分析,实验重复3次,显著性分析采用Duncan检验。使用Prism 8软件进行绘图。关于数据显著性分析结果的说明:即相同字母表示无显著差异,不同字母表示有显著差异(P<0.05)。
2 结果与分析
2.1 不同冻干保护剂对L.rhamnosus B6存活率的影响
本研究选择7种不同的物质作为菌株B6冷冻干燥时的保护剂,其中包括1种单糖(葡萄糖)、2种二糖(蔗糖和乳糖)、1种多糖(麦芽糊精)、2种多元醇(山梨醇和甘露醇)和1种混合物(脱脂乳)。不同冻干保护剂对L.rhamnosus B6存活率的影响如图1所示。当添加不同的冻干保护剂时,L.rhamnosus B6的存活率有显著差异(P<0.05)。其中,当使用脱脂乳作为保护剂时L.rhamnosus B6的存活率最高,达到了(79.30±0.86)%,显著高于其他保护剂的存活率(P<0.05)。脱脂乳是含有大分子(乳清和酪蛋白)和糖类的混合物,在发酵剂工业中被广泛用作冻干保护剂。它可通过稳定细胞膜成分防止细胞损伤,并为细胞提供蛋白质保护涂层[19]。此外,脱脂乳还可以在冻干产品中形成多孔结构,使其更容易进一步再水合[20]。然而,葡萄糖和甘露醇的保护效果最差,L.rhamnosus B6的冻干存活率不到10%。可能因为葡萄糖的玻璃化转变温度较低,所以冻干保护效果差。综上所述,选择脱脂乳作为后续实验的冻干保护剂。
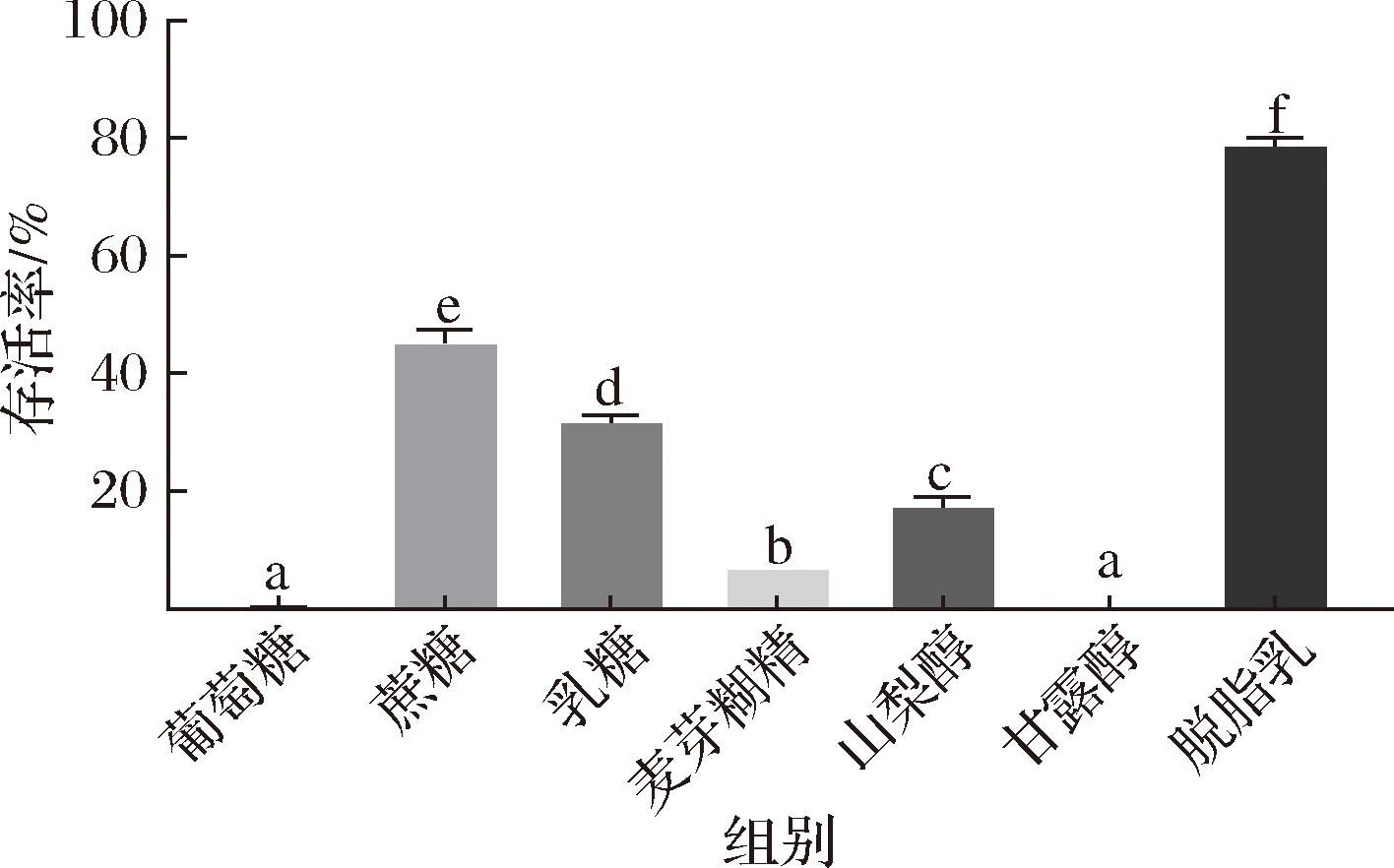
图1 不同冻干保护剂对L.rhamnosus B6冷冻干燥后存活率的影响
Fig.1 Effect of different freeze-drying protectants on the survival rate of L.rhamnosus B6 after freeze-drying
注:不同小写字母表示差异显著(P<0.05)(下同)。
2.2 冷应激对L.rhamnosus B6冻干存活率的影响
在最佳保护剂下,对L.rhamnosus B6进行不同条件的冷应激处理,然后再进行冷冻干燥。冻干存活率测定结果如图2所示,4 ℃与10 ℃的冷应激处理可不同程度地提高冷冻干燥后B6的存活率。在4 ℃下,菌株B6的冻干存活率随着冷应激处理时间的延长呈现先上升后下降的趋势。当4 ℃下处理2 h时,冷冻干燥后的菌株B6存活率最高,达到了(97.94±1.1)%。与未冷应激对照组相比,具有显著性差异(P<0.05)。这与LIU等[13]用冷应激方法提高植物乳杆菌K25的冻干存活率的结果相似。这可能是因为微生物能够通过调节生理代谢来适应环境的变化,提高微生物在冷冻干燥过程中抵御恶劣环境的能力,从而提高它们的存活率[21]。但并不是所有菌株都能通过冷胁迫增加冷冻抗性,如罗伊氏乳杆菌I5007在4 ℃胁迫下的冷冻干燥存活率仅为14.24%,与未冷应激组相比存活率显著降低。另外,不同的菌株它们的冷应激温度也是有差异的,如LIU等[13]研究表明最适冷应激温度为10 ℃,可显著增加植物乳植杆菌在冷冻中的抗性。这可能是因为菌种不同引起的差异。因此,在最佳保护剂下对B6进行冷应激处理,可使菌体获得较高的冻干存活率。
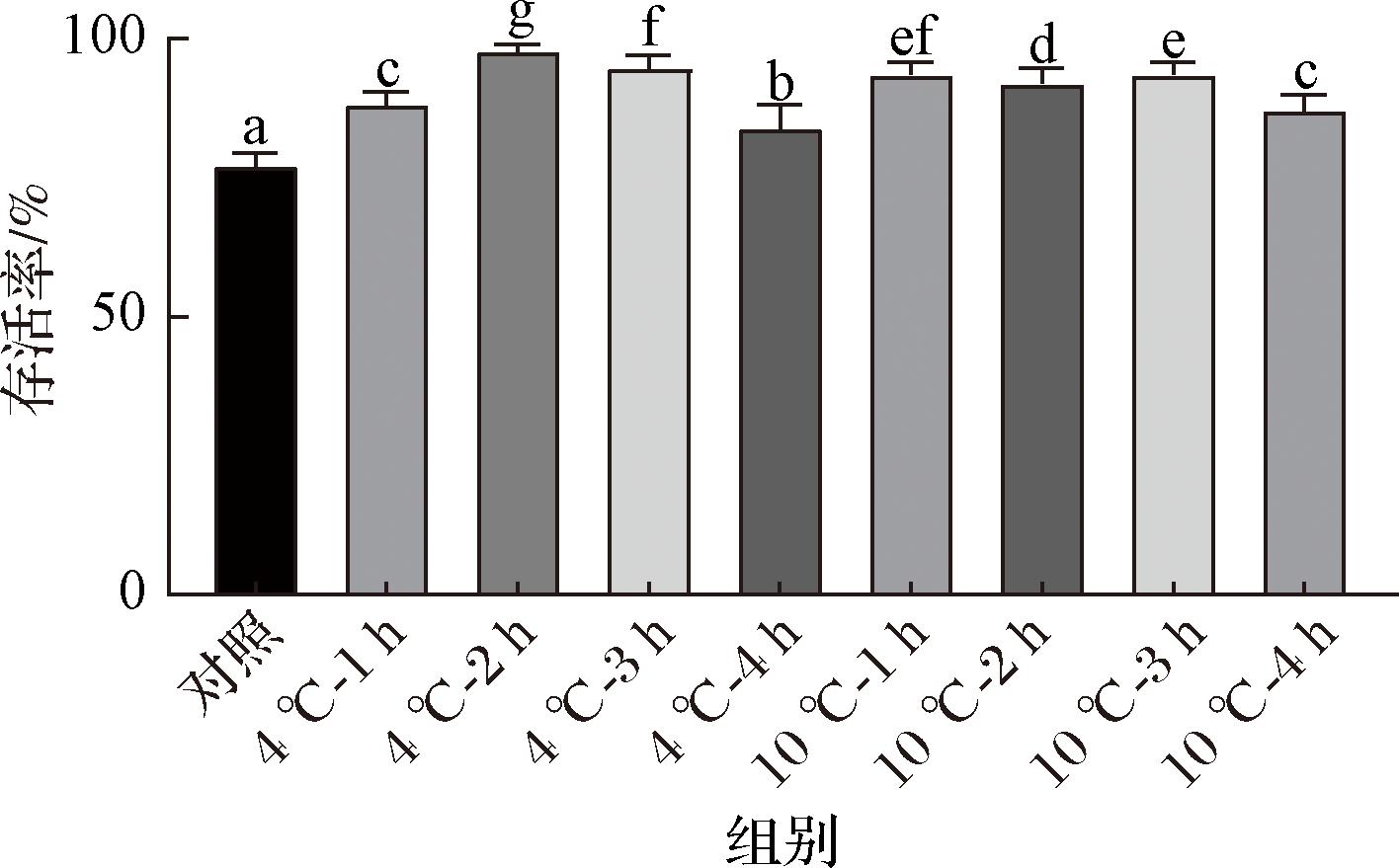
图2 不同冷应激处理方式对L.rhamnosus B6冷冻干燥后存活率的影响
Fig.2 Effect of different cold stress treatments on the survival rate of L.rhamnosus B6 after freeze-drying
另外,本研究发现,4 ℃冷应激2 h的条件下提高L.rhamnosus B6冷冻干燥存活率的效果优于其他处理时间(1、3、4 h)或温度(10 ℃)。推测有几方面的原因。首先,细菌在面临胁迫环境之前,给予一定的适应性处理,会激活保护机制,阻止细胞死亡。这种适应性反应可能包括增强细胞膜完整性、维持酶活性等,从而增强细胞对冷冻干燥过程中产生的损伤的抵抗力[8]。4 ℃是一个较低的温度,可以诱导冷应激反应,但不至于过低以致细胞无法适应。4 ℃的冷应激可能是触发这种应激反应机制的最适温度,2 h的处理时间则可能是足以诱导出最大应激反应效应但又不会对细胞造成过度损伤的时间点。而少于2 h的处理可能未能提供足够的时间来充分激活这些保护机制,超过2 h则可能导致保护机制的衰减或适应性疲劳。其次,本研究中的L.rhamnosus B6在4 ℃下处理2 h表现出最佳的冷应激响应效果,这可能与其自身的生理特性和代谢途径有关。例如,冷应激可能促进细菌合成更多的多糖、氨基酸等保护性物质,这些物质在冷冻干燥过程中可以起到稳定细胞结构、保护细胞膜和酶活性的作用[13]。然而,过长的冷应激处理时间可能会扰乱细胞的正常代谢途径,导致细胞能量代谢失衡,从而降低存活率。
2.3 流式细胞仪分析冷应激对L.rhamnosus B6冷冻干燥后的影响
为了相对准确地分析活/死细胞的比例,采用双重染色方法,将活细胞染成紫色,死细胞染成蓝色以进行区分。图3-a、图3-b和图3-c分别为未经染色的流式细胞图谱和PI、cFDA单染的流式细胞图谱。由图3可知,未经染色细胞位于P4区域,cFDA染色的细胞位于P2区域,PI染色的细胞则位于P3区域。
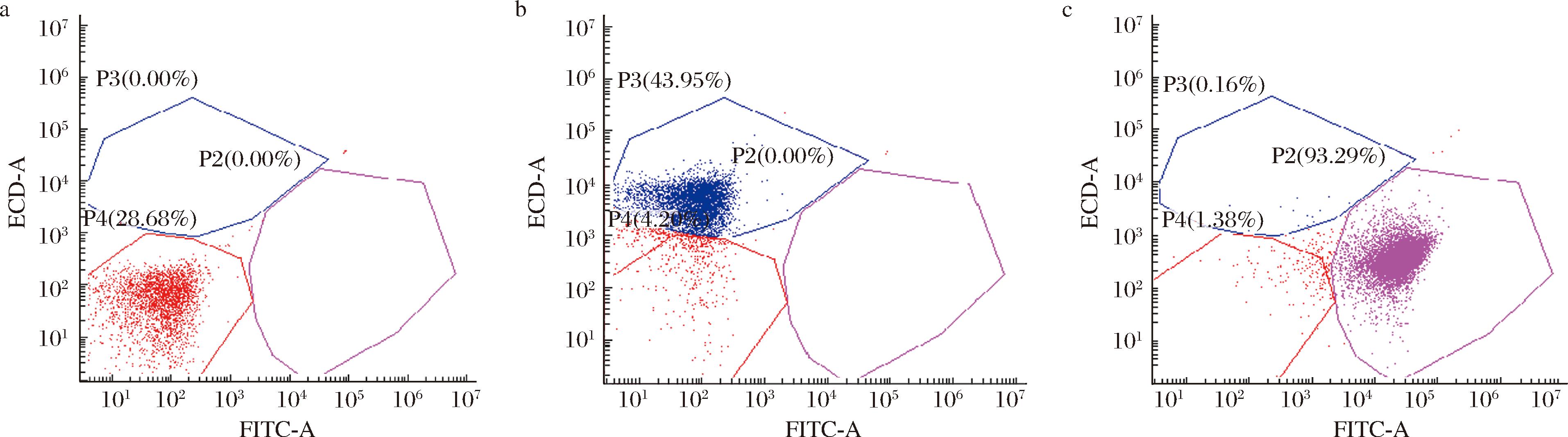
a-未经染色;b-PI染色;c-cFDA染色
图3 未经染色和PI和cFDA单染流式细胞图谱
Fig.3 The flow cytometry histograms for unstained cells and cells stained singly with PI or cFDA
用PI/cFDA双重染色进行死/活细胞的区分,结果如图4所示。PI和cFDA荧光标记的群体在空间上呈现不同的分布,第一块区域位于左下象限(P4),荧光强度小于103,对应于未经染色的细胞,所占比例不到1%;PI标记的细胞位于左上方区域(P3),代表死亡细胞;而cFDA标记的细胞则位于右下方区域(P2),对应于活细胞。
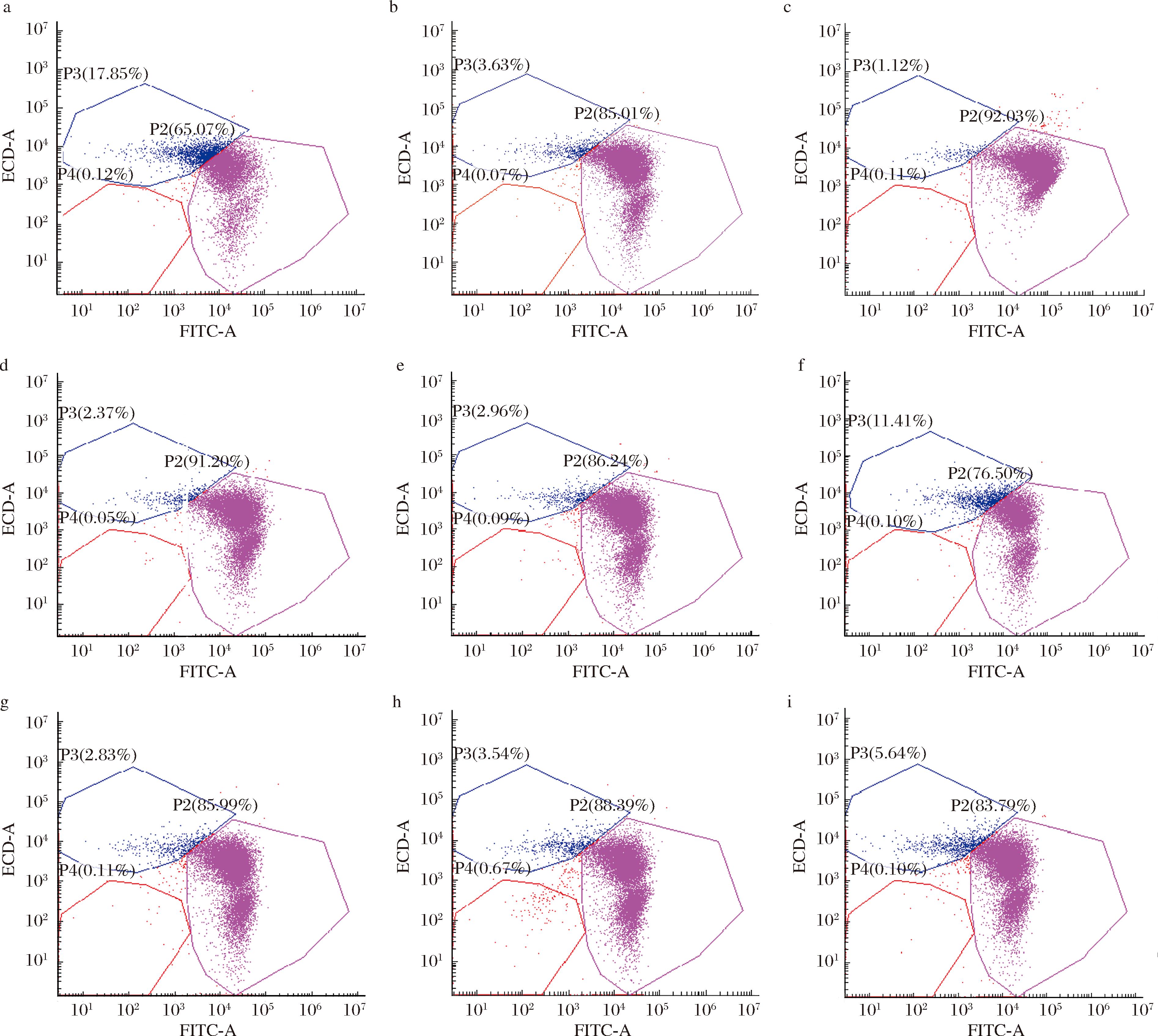
a-未经冷应激处理直接冷冻干燥的流式图谱;b-4 ℃处理1 h;c-4 ℃处理2 h;d-4 ℃处理3 h;e-4 ℃处理4 h;f-10 ℃处理1 h; g-10 ℃处理2 h;h-10 ℃处理3 h;i-10 ℃处理4 h
图4 经不同冷应激处理方法后冷冻干燥的L.rhamnosus B6细胞的流式图谱
Fig.4 Flow cytometry profiles of L.rhamnosus B6 cells after freeze-drying with various cold stress treatment methods
未经冷应激处理直接冷冻干燥L.rhamnosus B6的PI/cFDA双重染色图如图4-a所示。结果可知,直接冷冻干燥的L.rhamnosus B6死细胞比例为17.85%,活细胞比例为65.07%。而经4 ℃应激和10 ℃应激后的B6,冷冻干燥后活细胞的比例均有不同程度地提高,从65.07%升高至76.53%~92.03%(图4-b~图4-i)。其中,以4 ℃处理2 h时活细胞比例最高,为92.03%(图4-c),是对照组存活率的1.41倍。本研究结果和上述冻干存活率测定结果趋势一致。此外,无论是选择4 ℃还是10 ℃进行冷应激处理,随着处理时间的延长,活细胞所占百分比均呈现先上升后下降的趋势。结果说明冷应激能够在冷冻干燥过程中对乳酸菌提供保护,且适当的4 ℃冷应激2 h处理方式更有效。这可能是因为乳酸菌常处于复杂的生长环境,使得乳酸菌在面临胁迫时产生了保护,即乳酸菌在暴露低温胁迫期间所诱导的分子机制能够保护细胞免受致死性攻击[13]。这种保护机制使得乳酸菌在胁迫处理后能够更好地抵抗冷冻干燥过程中的各种损伤。
2.4 冷应激对L.rhamnosus B6酸化能力的影响
冷冻干燥过程中的脱水会对细胞造成不同程度的结构损伤,但仅通过平板计数和流式细胞仪评估冷应激对L.rhamnosus B6活性保护的能力有局限性。乳酸菌通过将碳水化合物代谢产物转化为乳酸,降低食品的pH值,从而抑制其他微生物的生长[22]。因此,对冷冻干燥后的乳酸菌进行酸化测定可提供细菌修复损伤的能力和冷冻干燥后活性恢复的情况。菌株冷冻干燥并复水后,发酵脱脂乳12 h,测定发酵液中pH值,结果如图5所示。4 ℃和10 ℃冷应激处理后的菌体酸化能力均高于未冷应激处理的对照组,这一结果与细胞存活率存在一定正相关。4 ℃冷应激处理2 h时,菌体的产酸能力最强,比其他胁迫的保护方式更有效。此外,结果可知4 ℃冷应激处理的产酸能力均高于10 ℃冷应激处理,表明不同冷应激处理下冻干菌体的酸化能力存在一定差异。同时,未经冷应激的菌株B6冷冻干燥后产酸能力受到显著影响。这可能是因为冷冻干燥的脱水过程使得乳酸菌的细胞膜受到损伤,以及酶活性下降,使得乳酸菌在冷冻干燥后的产酸能力受到影响。经过冷应激处理后的乳酸菌酸化能力与原始菌株相近,说明用冷应激的前处理方式保护冷冻干燥乳酸菌的活性是很有必要的。
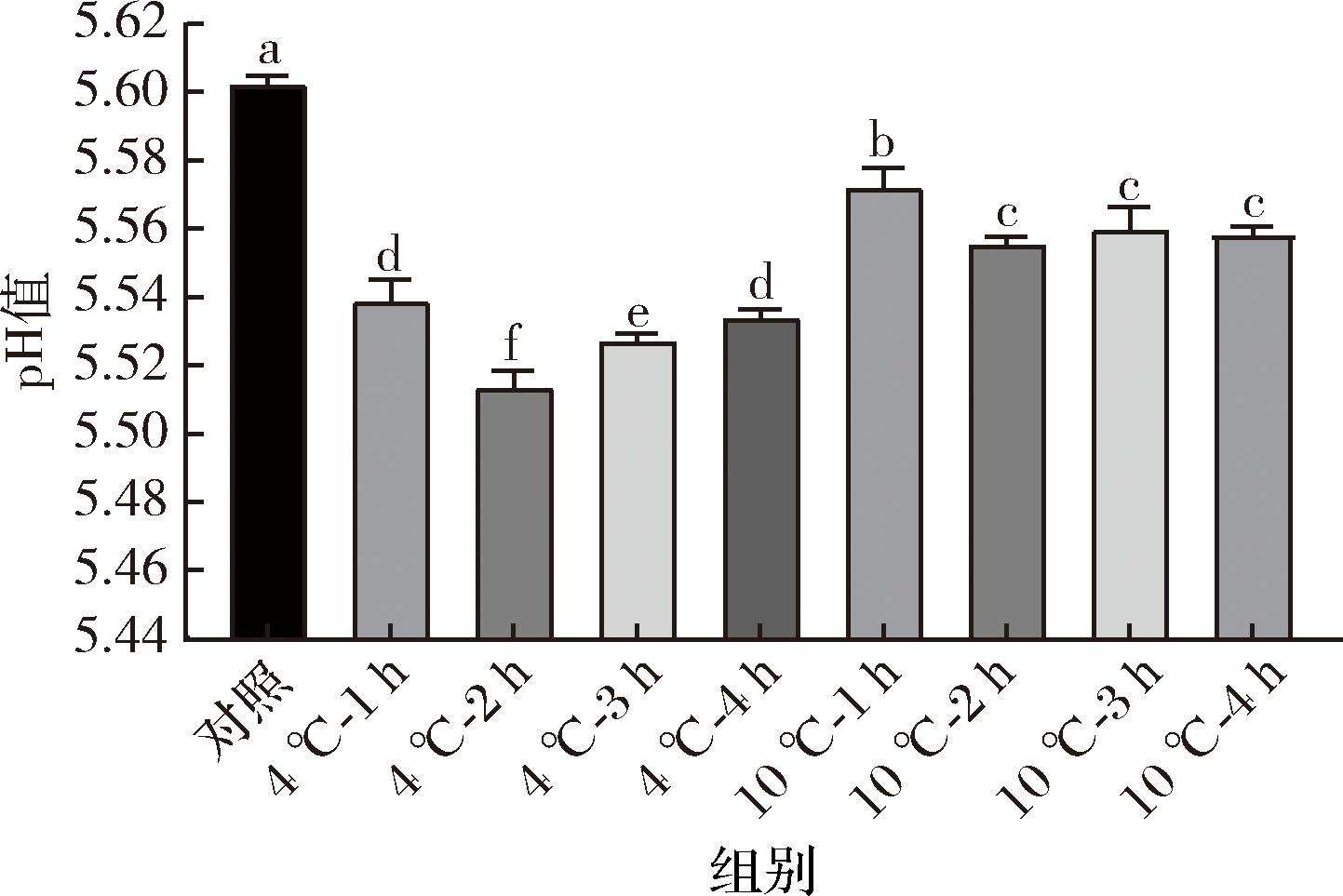
图5 不同冷应激处理对冷冻干燥B6酸化能力的影响
Fig.5 Effect of different cold stress treatments on acidification ability of freeze-dried strain B6
2.5 冷应激对L.rhamnosus B6冷冻干燥后乳酸脱氢酶活性的影响
研究发现细胞内酶的活性决定了细菌的物质、能量代谢和生长速度。而冷冻干燥会导致一些乳酸菌的酶活性显著降低。其中,乳酸脱氢酶(lactic dehydrogenase,LDH)在乳酸菌的能量代谢过程中扮演着关键角色,LDH活性可以直观地表征经冷冻干燥处理后细胞的代谢活性[23]。因此选择LDH进一步阐述冷应激对乳酸菌冷冻干燥的活性保护作用。如图6所示,未冷应激的对照组菌株B6的LDH活性约为0.018 U/104 cell,而冷应激处理后的冻干B6的LDH活性均显著高于对照组。经过4 ℃冷应激处理2 h的LDH活性明显高于其他处理组(P<0.05),并且LDH活性与存活率(图3和图4)的变化一致,表明存活率的提高与LDH有关。经过4 ℃冷应激处理2 h的保护效果与未应激和其他冷应激方式均具有显著性水平(P<0.05)。这可能由于少于2 h的处理未能充分保护LDH活性,而超过2 h的处理导致LDH活性的过度消耗或结构损伤。另一方面LDH在乳酸菌的能量代谢过程中扮演着关键角色。乳酸菌主要通过糖酵解途径将葡萄糖等糖类转化为丙酮酸,然后LDH催化丙酮酸转化为乳酸这一反应[24]。因此,LDH活性的大小反映了菌株的产酸能力,与上述酸化能力结果一致,进一步说明冷应激能够保护LDH活性从而恢复冷冻干燥L.rhamnosus B6的酸化能力。
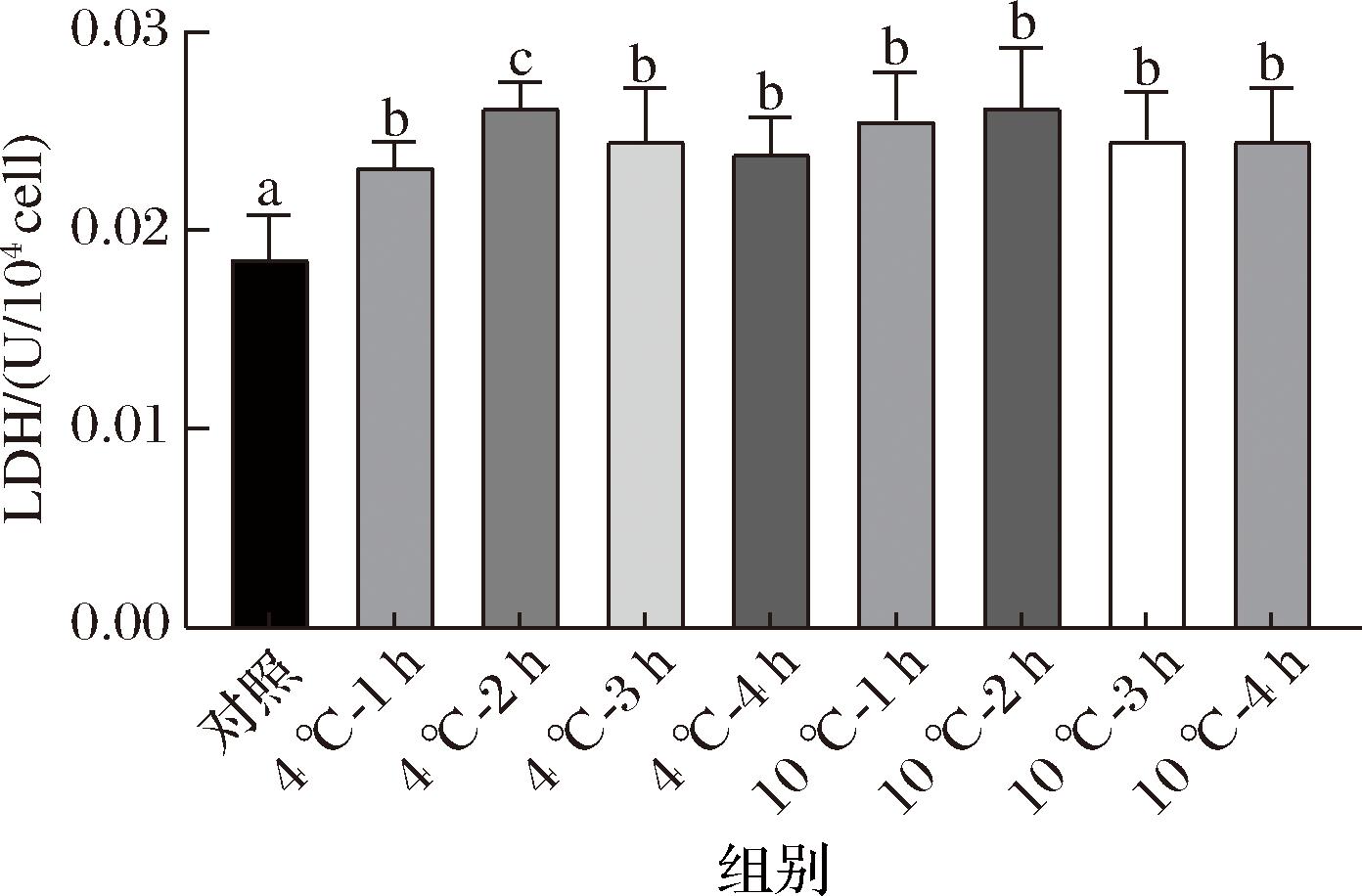
图6 不同冷应激处理对冷冻干燥B6乳酸脱氢酶活性的影响
Fig.6 Effects of different cold stress treatments on the activity of lactate dehydrogenase of freeze-dried strain B6
2.6 冷应激对L.rhamnosus B6冷冻干燥后细胞膜完整性的影响
细胞膜在维持细胞内环境稳定方面具有重要作用,细胞膜作为一种半透性膜,可将胞内物质与外界阻隔开,能防止物质随意进出细胞。细胞与胞外环境发生物质、能量与信息的交换,才能维持细胞的正常生存[25]。因此,细胞膜的完整性能较好地反映菌体的生理活性。采用cFDA和PI对细胞进行双重染色,利用荧光显微镜观察冷冻干燥对菌体细胞膜的损伤情况。在细胞浓度相同的情况下,与cFDA结合发出绿色荧光的细胞数量越多表示膜的完整性越高,当在荧光显微镜下观察到细胞发出红色荧光时,代表细胞膜完整性遭到破坏。
未经应激处理的冷冻干燥L.rhamnosus B6细胞膜完整性如图7所示,发红色荧光的细胞数相较于发绿色荧光细胞数多,说明大部分菌体冷冻干燥后的细胞膜完整性被破坏,该结果与杨婕等[25]研究结果一致。这是因为在冷冻干燥前的预冻阶段,细胞内及周围的水形成大量冰晶。冰晶的形成会使细胞膜损伤,导致膜结构被破坏[25]。此外,冷冻干燥时,细胞外冰晶的形成还会增加胞外介质中的溶质浓度。溶质的低温浓缩会诱导水从胞内介质向胞外介质输送,从而导致细胞脱水和细胞损伤[26]。
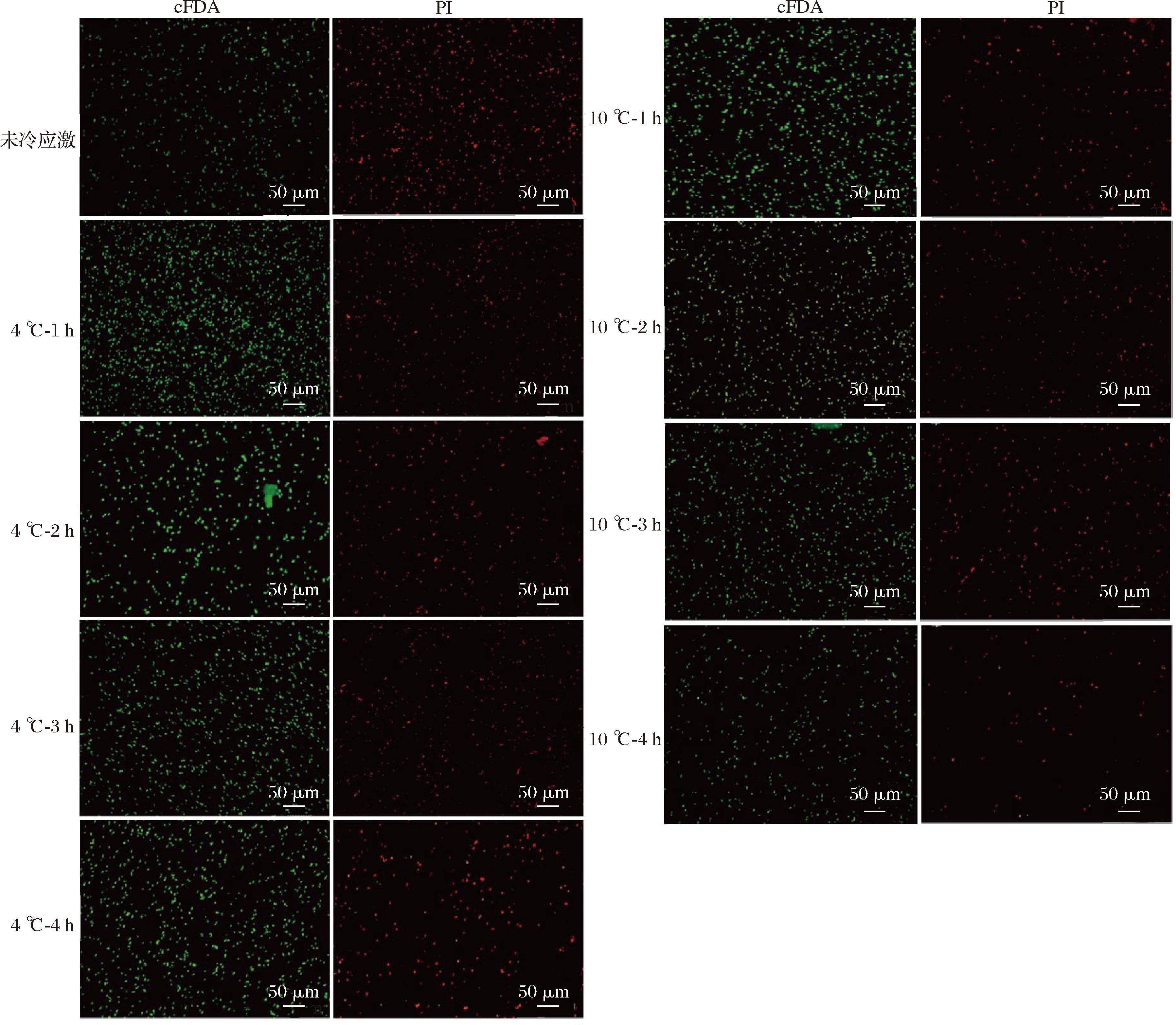
图7 不同冷应激处理方法对L.rhamnosus B6冷冻干燥后膜完整性的影响
Fig.7 Effects of different cold stress treatment methods on membrane integrity of L.rhamnosus B6 after freeze-drying
注:cFDA是一种荧光染料,当它与细胞结合时,会发出绿色荧光,发出绿色荧光的细胞数量越多,表示膜的完整性越高; PI是另一种荧光染料,当细胞膜完整性遭到破坏时,它能够进入细胞内部并发出红色荧光。
然而,经4 ℃和10 ℃冷应激处理后的菌株发绿色荧光的细胞数明显增多(图7),表明L.rhamnosus B6的细胞膜完整性提高。结果说明低温冷应激也有利于保持细胞膜的完整性,从而提高了冷冻干燥菌体的活力。同时,上述结果显示冷应激后菌体的乳酸脱氢酶的活性损失较少,说明细胞通透性维持的较好,这与细胞膜完整性的结果相符。这是因为乳酸菌对复杂环境有一套防御机制,以避免突然暴露于不利环境时细胞死亡[27]。冷应激处理可以触发其防御机制,从而增加其在冷冻干燥时的抵抗能力。由此可知,冷冻干燥前对L.rhamnosus B6进行冷应激处理有利于维持细胞膜的完整性,保护细胞膜的功能。
本研究的结果表明4 ℃下2 h的冷应激处理能够显著提高L.rhamnosus B6的冷冻干燥存活率,这可能与其触发的应激反应机制、对细胞膜的保护作用、对细胞内酶活性的调控以及对细胞代谢途径的调控有关。而其他处理时间可能由于未能充分激活这些保护机制,或导致保护机制的衰减或适应性疲劳,因此存活率低于4 ℃冷应激2 h的效果。
3 结论
在制备直投式发酵剂及菌种需要长期保藏时,常用方法为冷冻干燥。本研究探究了冻干保护剂和冷应激对L.rhamnosus B6的活性影响,旨在为提高L.rhamnosus B6的加工性能。首先对7种不同的冻干保护剂进行筛选,结果表明当使用100 g/L脱脂乳作保护剂时,菌株B6的冻干存活率最高。接着分别在4 ℃和10 ℃下对L.rhamnosus B6分别进行1、2、3、4 h的冷应激处理,提高冷冻干燥后L.rhamnosus B6的存活率并保护其活性。结果表明在4 ℃处理2 h时,冷冻干燥后的菌株B6存活率最高,达到了97.94%。2种应激处理方式与对照组相比能够提高酸化能力,保护LDH酶活性,很好地维持细胞膜完整性,有效保护乳酸菌冷冻干燥后的活力。研究结果表明冷应激为提高乳杆菌的冷冻干燥存活率提供一种新方法,也为高活性LAB发酵剂的生产提供实验依据。
[1] DRONKERS T M G, OUWEHAND A C, RIJKERS G T.Global analysis of clinical trials with probiotics[J].Heliyon, 2020, 6(7):e04467.
[2] TRIPATHI P, BEAUSSART A, ALSTEENS D, et al.Adhesion and nanomechanics of pili from the probiotic Lactobacillus rhamnosus GG[J].ACS Nano, 2013, 7(4):3685-3697.
[3] GUO M Y, LIU H J, YU Y T, et al.Lactobacillus rhamnosus GG ameliorates osteoporosis in ovariectomized rats by regulating the Th17/Treg balance and gut microbiota structure[J].Gut Microbes, 2023, 15(1):2190304.
[4] LESER T, BAKER A.Molecular mechanisms of Lacticaseibacillus rhamnosus, LGG® probiotic function[J].Microorganisms, 2024, 12(4):794.
[5] 王玲. 优良植物乳杆菌A7直投式发酵剂的制备与应用[D].银川:宁夏大学, 2023.WANG L.Preparation and application of direct vat set starter of the fine lactiplantibacillus plantarum A7[D].Yinchuan:Ningxia University, 2023.
[6] YANG H, HUANG P, HAO L Y, et al.Enhancing viability of dried lactic acid bacteria prepared by freeze drying and spray drying via heat preadaptation[J].Food Microbiology, 2023, 112:104239.
[7] 苗维娜, 赵亮.冷冻干燥影响乳酸菌发酵活力机制的研究进展[J].食品工业科技, 2022, 43(21):36-44.MIAO W N, ZHAO L.Research progress on the mechanism of freeze-drying affecting the fermentation activity of lactic acid bacteria[J].Science and Technology of Food Industry, 2022, 43(21):36-44.
[8] GAGNETEN M, PASSOT S, CENARD S, et al.Mechanistic study of the differences in lactic acid bacteria resistance to freeze- or spray-drying and storage[J].Applied Microbiology and Biotechnology, 2024, 108(1):361.
[9] CUI S M, HU M Y, SUN Y Y, et al.Effect of trehalose and lactose treatments on the freeze-drying resistance of lactic acid bacteria in high-density culture[J].Microorganisms, 2023, 11(1):48.
[10] CHENG Z Y, YAN X, WU J Y, et al.Effects of freeze drying in complex lyoprotectants on the survival, and membrane fatty acid composition of Lactobacillus plantarum L1 and Lactobacillus fermentum L2[J].Cryobiology, 2022, 105:1-9.
[11] WANG R X, SUN R Y, YANG Y, et al.Effects of salt stress on the freeze-drying survival rate of Lactiplantibacillus plantarum LIP-1[J].Food Microbiology, 2022, 105:104009.
[12] GAO X W, KONG J, ZHU H K, et al.Lactobacillus, Bifidobacterium and Lactococcus response to environmental stress:Mechanisms and application of cross-protection to improve resistance against freeze-drying[J].Journal of Applied Microbiology, 2022, 132(2):802-821.
[13] LIU S L, MA Y M, ZHENG Y, et al.Cold-stress response of probiotic Lactobacillus plantarum K25 by iTRAQ proteomic analysis[J].Journal of Microbiology and Biotechnology, 2020, 30(2):187-195.
[14] HAN J, XIA W, WANG D Q, et al.Characterization of an exopolysaccharide synthesized by Lacticaseibacillus rhamnosus B6 and its immunomodulatory activity in vitro[J].International Journal of Biological Macromolecules, 2024, 264(Pt 1):130576.
[15] ZHANG X, ZHENG Y R, LIU Z M, et al.Insights into characteristic metabolites and potential bioactive peptides profiles of fresh cheese fermented with three novel probiotics based metabolomics and peptidomics[J].Food Chemistry:X, 2024, 21:101147.
[16] HANSEN G, JOHANSEN C L, MARTEN G, et al.Influence of extracellular pH on growth, viability, cell size, acidification activity, and intracellular pH of Lactococcus lactis in batch fermentations[J].Applied Microbiology and Biotechnology, 2016, 100(13):5965-5976.
[17] 张国强. 酒酒球菌胁迫诱导抗冷冻干燥机制研究[D].杨凌:西北农林科技大学, 2013.ZHANG G Q.Mechanism study of stress induced resistance to freeze-drying on Oenococcus oeni[D].Yangling:Northwest A&F University, 2013.
[18] 徐颖, 贺黎, 吕嘉枥, 等.富硒鼠李糖乳杆菌稳定性及其冻干保护剂研究[J].中国食品学报, 2020, 20(9):102-108.XU Y, HE L, LYU J L, et.al.Studies on stability of selenium-enriched Lactobacillus rhamnosus and its lyophilized protectant[J].Journal of Chinese Institute of Food Science and Technology, 2020, 20(9):102-108.
[19] MONTEL MENDOZA G, PASTERIS S E, OTERO M C, et al.Survival and beneficial properties of lactic acid bacteria from raniculture subjected to freeze-drying and storage[J].Journal of Applied Microbiology, 2014, 116(1):157-166.
[20] 严涛, 朱建国, 姜甜, 等.高密度发酵乳酸菌抗冻性影响因素分析[J].食品研究与开发, 2018, 39(17):209-213.YAN T, ZHU J G, JIANG T, et.al.Study on influencing factors of anti-freezing of high-density fermentation lactic acid bacteria[J].Food Research and Development,2018, 39(17):209-213.
[21] 张佳, 韩瑨, 吴正钧, 等.乳酸菌抗冷胁迫作用研究进展[J].食品工业科技, 2022, 43(4):463-469.ZHANG J, HAN J, WU Z J, et al.Research progress in the cold resistance of lactic acid bacteria[J].Science and Technology of Food Industry, 2022, 43(4):463-469.
[22] 贾爽. 产细菌素乳酸菌对酸豆奶后酸化的影响及其细菌素性质研究[D].上海:上海海洋大学, 2022.JIA S.Effect of bacteriocin-producing lactic acid bacteria on post-acidification of fermented soymilk and its bacteriocin properties[D].Shanghai:Shanghai Ocean University, 2022.
[23] ICHINOSE R, FUKUDA Y, YAMASAKI-YASHIKI S, et al.Suppression of lactate production of Lactobacillus reuteri JCM1112 by co-feeding glycerol with glucose[J].Journal of Bioscience and Bioengineering, 2020, 129(1):110-115.
[24] 许黎明, 蒋国凤, 伍新龄, 等.鼠李糖乳杆菌L-乳酸脱氢酶的生物信息学分析和基因克隆[J].食品工业科技, 2023, 44(11):153-162.XU L M, JIANG G F, WU X L, et al.Bioinformatics analysis and gene cloning of L-lactate dehydrogenase from Lactobacillus rhamnosus[J].Science and Technology of Food Industry, 2023, 44(11):153-162.
[25] 杨婕, 郭金凤, 李宝坤, 等.酸-冷交互胁迫对保护冷冻干燥发酵乳杆菌活性的作用[J].食品科学, 2020, 41(2):101-106.YANG J, GUO J F, LI B K, et al.Cryoprotective effect of acid-cold cross stress on Lactobacillus fermentum[J].Food Science, 2020, 41(2):101-106.
[26] MENEGHEL J, PASSOT S, DUPONT S, et al.Biophysical characterization of the Lactobacillus delbrueckii subsp.bulgaricus membrane during cold and osmotic stress and its relevance for cryopreservation[J].Applied Microbiology and Biotechnology, 2017, 101(4):1427-1441.
[27] 公丕民. 保加利亚乳杆菌喷雾干燥过程中损伤机制及保护方法研究[D].哈尔滨:哈尔滨工业大学, 2019.GONG P M.Injury mechanism and protection methods of spray-dried Lactobacillus Bulgaricus[D]. Harbin:Harbin Institute of Technology, 2019.