禾谷镰刀菌(Fusarium graminearum)是引发小麦、大麦等作物赤霉病的主要致病菌[1]。禾谷镰刀菌不仅严重影响作物的产量和质量,还能产生脱氧雪腐镰刀菌烯醇(deoxynivalenol,DON)等真菌毒素,严重威胁食品安全和人畜健康[2]。目前,在生产上仍主要使用化学杀菌剂防治赤霉病和DON污染,但随着病原菌抗性的增加,防治效率逐渐降低[3]。因此,深入研究禾谷镰刀菌的生物学特性和致病机理,挖掘关键致病基因,将有助于开发新型杀菌剂、制定有效的防控策略,保障食品安全。
在侵染寄主过程中,植物病原真菌会产生大量胞外分泌蛋白,以适应环境、促进自身生长并干扰植物防御机制[4]。这些分泌蛋白可参与病原真菌与寄主间的相互作用,在侵染、定殖和扩展等致病过程中具有重要功能[5]。小分子富含半胱氨酸蛋白(small secreted cysteine-rich proteins,SSCRPs)是一类氨基酸数目<300,富含半胱氨酸(≥4)的胞外分泌蛋白[6]。作为效应子,植物病原菌SSCRPs可以诱导或抑制寄主植物的免疫反应,从而参与致病过程,如黑粉病菌(Tilletia horrida)的ThSCSP_14可以激活本氏烟草(Nicotiana benthamiana)的防御反应,在黑粉病菌和寄主互作中发挥关键作用[7];大丽轮枝菌(Verticillium dahliae)的VdSCP27和VdSCP126可以抑制N.benthamiana免疫反应,当其双缺失后V.dahliae对N.benthamiana和陆地棉(Gossypium hirsutum)的致病力显著下降[8]。
尽管SSCRPs已在多种植物病原菌中被广泛报道,但在禾谷镰刀菌中尚未见相关研究。通过全基因组分析,在禾谷镰刀菌PH-1中预测到了190个SSCRPs;这些蛋白绝大部分被注释为假定蛋白,具体生物学功能还不清楚[9]。FGSG_10443含有67个氨基酸,半胱氨酸数量为6,序列比对显示其为副里氏木霉(Trichoderma parareesei)SSCRP蛋白(OTA04651.1)的同源蛋白。本研究通过构建FGSG_10443基因的敲除突变体和回补突变体,考察FGSG_10443在禾谷镰刀菌的生长发育、环境胁迫响应、DON生物合成以及致病性等方面的作用,为深入探究禾谷镰刀菌的致病机制,防治赤霉病和DON污染提供借鉴和参考。
1 材料与方法
1.1 材料
1.1.1 菌株和质粒
禾谷镰刀菌野生型菌株PH-1、载体pCB1003(含潮霉素磷酸转移酶基因HPH)、载体pFL2由上海市农业科学院农产品质量标准与检测技术研究所提供。FGSG_10443基因敲除突变体ΔFGSG_10443和回补突变体FGSG_10443C通过本试验获得。供试小麦为“济麦22”和“阜麦13”。
1.1.2 培养基
PDA培养基,国药集团化学试剂有限公司;LB培养基,上海生工生物工程有限公司。羧甲基纤维素钠(carboxymethyl cellulose,CMC)培养基、单端孢霉烯生物合成诱导(trichothecene biosynthesis induction,TBI)培养基和胡萝卜培养基等的配制方法见镰刀菌实验室手册。
1.1.3 试剂和仪器
2×Rapid Taq Master Mix,南京诺唯赞生物科技股份有限公司;潮霉素、G418,北京索莱宝科技有限公司;胶回收、质粒提取试剂盒、本研究所用引物(表1),上海生工生物工程有限公司。
表1 本研究使用的引物序列
Table 1 Sequences of primers used in this study

引物序列 5′-3′ 用途FGSG_10443-1FAGTGCCCTTGATGCAAACAAFGSG_10443-2RTTGACCTCCACTAGCTCCAGCCAAGCCCATGTATGGCTTGCTCCCCA扩增FGSG_10443上游片段FGSG_10443-3FGAATAGAGTAGATGCCGACCGCGGGTTGGTCAAGATGGCGTGGGATTFGSG_10443-4RACTGGGTCTGCGACAATGAG扩增FGSG_10443下游片段FGSG_10443-5FGCACTCGTTATGCACCAACTFGSG_10443-6RAGAGCTGCTAGTAGGCCTCGFGSG_10443敲除转化子和回补转化子的鉴定FGSG_10443-7FAACACGAATAAGAAGCAGGTFGSG_10443-8RGCATTTTCACATCCTGGATGHYG-DownGCTGATCTGACCAGTTGCHYG-UpGTCGATGCGACGCAATCGTFGSG_10443敲除转化子的鉴定HYG-FGGCTTGGCTGGAGCTAGTGGAGGTCAAHYG-RAACCCGCGGTCGGCATCTACTCTATTCHY-RGTATTGACCGATTCCTTGCGGTCCGAAYG-FGATGTAGGAGGGCGTGGATATGTCCT扩增HPH片段FGSG_10443C-FGATAAGCTTGATATCGAATTCCGATCTCTGTCAGCCCGGATFGSG_10443C-RTCCCCCGGGCTGCAGGAATTCAGTATGACACGCCGGAGAAG回补片段的扩增M13-FGTAAAACGACGGCCAGTM13-RCAGGAAACAGCTATGACFGSG_10443回补转化子的鉴定
Milli-Q超纯水仪,美国Millipore公司;SHHB-D6000 SeriaLs霉菌培养箱,上海般诺生物科技有限公司;Centrifge 5424R低温冷冻离心机,德国Eppendorf公司;T100 PCR仪、PowerPac Sub Ce11 GT电泳仪、Gel Doc XR凝胶成像仪,美国Bio-Rad公司;TRIPLE·QUADTM 5500三重四极杆质谱仪,美国AB SCIEX公司;BH-2奥林巴斯显微镜,日本奥林巴斯公司;Ni-E荧光显微镜,日本尼康公司。
1.2 试验方法
1.2.1 基因敲除突变体的构建
依据同源重组的原理,采用split-marker PCR和聚乙二醇(polyethylene glycol,PEG)介导原生质体转化的方法对禾谷镰刀菌FGSG_10443基因进行敲除[10]。从NCBI数据库(https://www.ncbi.nlm.nih.gov/)中获得基因FGSG_10443的编码区序列及其上下游序列,并设计引物(表1)。以野生型菌株PH-1基因组DNA为模板,使用引物FGSG_10443-1F/FGSG_10443-2R和FGSG_10443-3F/FGSG_10443-4R分别扩增FGSG_10443上下游各1.0 kb左右的片段L1和L2;以pCB1003为模板,用引物HYG-F/HY-R和YG-F/HYG-R扩增HPH的分片段H1和H2。将片段L1和H1,以及L2和H2进行重叠PCR,得到融合片段L1H1和L2H2。通过原生质体转化方法将L1H1和L2H2转至PH-1中,潮霉素抗性筛选获得敲除突变株ΔFGSG_10443。提取ΔFGSG_10443的基因组DNA,FGSG_10443-5F/FGSG_10443-6R检测FGSG_10443,FGSG_10443-7F/HYG-Down和HYG-Up/FGSG_10443-8R分别检测上、下游重组片段,HYG-F/HYG-R检测潮霉素基因,验证FGSG_10443是否被成功敲除。
1.2.2 回补突变体的构建
以PH-1基因组DNA为模板,使用引物FGSG_10443C-F/FGSG_10443C-R,扩增含有自身启动子和终止序列的FGSG_10443基因片段,连接入pFL2构建重组质粒,原生质体法转化至敲除突变体ΔFGSG_10443,G418抗性筛选,获得回补菌株FGSG_10443C。提取回补菌株的基因组DNA,用M13-F/FGSG_10443-6R和M13-R/FGSG_10443-5F验证FGSG_10443基因是否插入成功。
1.2.3 菌落形态和生长速率测定
将PH-1、ΔFGSG_10443和FGSG_10443C分别接种到PDA培养基,28 ℃活化3~5 d后,在菌落边缘位置打7 mm菌块,并分别接种到PDA培养基,28 ℃下黑暗培养5 d,十字交叉法记录菌落直径并计算生长速率。每个菌株设置3个重复。
1.2.4 分生孢子形态与产量测定
将活化好的各菌株转接至CMC培养基,25 ℃,200 r/min,黑暗培养3 d,滤布过滤除去菌丝,收集孢子液,光学显微镜下计数分生孢子数量,计算产孢量。每个菌株设置3个重复。
1.2.5 有性生殖
将活化好的各菌株转接于含胡萝卜培养基的60 mm培养皿中,25 ℃培养至菌丝长满整个平板。加入1 mL 1 g/L吐温-20溶液,并将表面的气生菌丝压平,置于黑光灯下光暗交替(12 h/12 h)培养14 d,观察子囊壳发育情况以及子囊和子囊孢子形态。每个菌株设置3个重复。
1.2.6 胁迫因子敏感性测定
将活化好的各菌株分别转接于含0.2 g/L刚果红、0.2 g/L十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、1 mol/L NaCl和1 g/L H2O2的PDA培养基,25 ℃培养5 d后测量菌落直径并计算菌丝生长抑制率。每个菌株设置3个重复。
1.2.7 DON产量测定
将活化好的各菌株转接于PDA培养基,28 ℃黑暗培养7 d后,取培养物55 ℃烘干粉碎,乙腈∶水(84∶16,体积比)提取DON毒素,0.22 μm滤膜过滤,超高效液相色谱-串联质谱(ultra high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)测定[11]。将各菌株孢子悬浮液(2×105个孢子/mL)接种于TBI产毒培养基,25 ℃摇床180 r/min,培养3 d,取培养液适量稀释,0.22 μm滤膜过滤,UPLC-MS/MS测定。
1.2.8 致病力测定
麦穗接种法:选择扬花期的田间小麦(‘阜麦13’),于麦穗中下部位置的小穗花药处,分别接种20 μL各菌株的孢子悬浮液(2×105个孢子/mL)。接种后,每天早晚各喷水1次,14 d后观测发病情况并统计每穗染病籽粒比例。每个菌株接种15株麦穗。
胚芽鞘接种法:将小麦种子(‘济麦22’)用体积分数为75%乙醇进行表面消毒,室温保湿培养3 d后,剪掉胚芽鞘尖端,伤口分别覆盖浸润各菌株孢子悬浮液(2×105个孢子/mL)的无菌滤纸。25 ℃光照培养箱中95%相对湿度光暗交替(12 h/12 h)培养7 d后,观察致病结果并测量病斑长度。每个菌株接种15株小麦幼苗。
1.2.9 数据分析
使用Origin 2024软件完成绘图。采用SPSS 20进行数据分析,通过独立样本t检验和单因素方差分析进行显著性差异分析,P<0.05为具有统计意义。
2 结果与分析
2.1 FGSG_10443同源蛋白及系统进化树分析
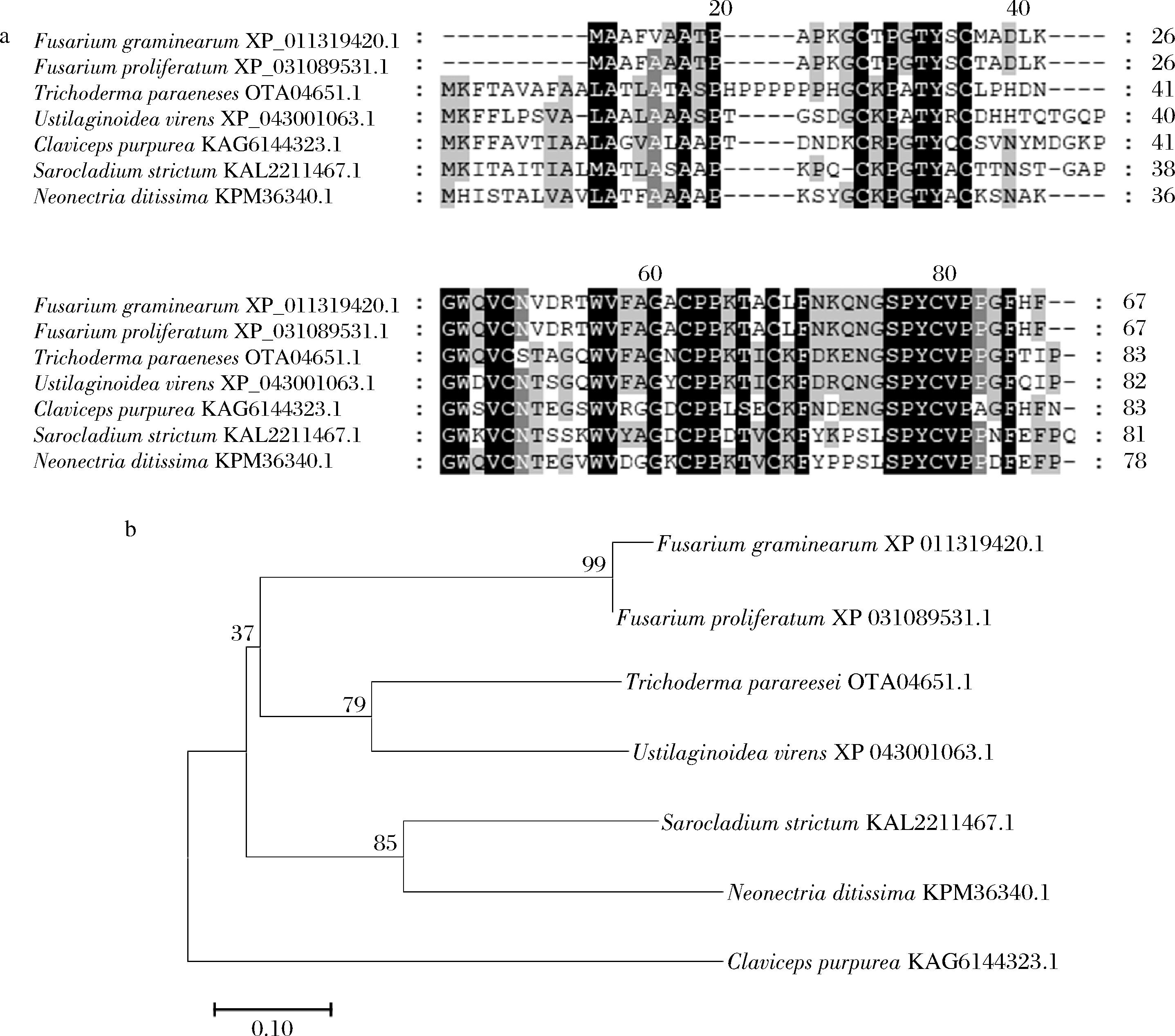
禾谷镰刀菌FGSG_10443为假定蛋白,不含N端信号肽和跨膜结构域,亚细胞定位预测工具ProtComp v9.0(http://www.softberry.com/berry.phtml topic=protcompan&group=programs&subgroup=proloc)显示其为胞外分泌蛋白(score=9.6),效应子预测工具EffectorP(https://effectorp.csiro.au)显示其为效应子蛋白(100.0%)。为探究FGSG_10443的系统演化关系,将其与T.parareesei、稻曲病菌(Ustilaginoidea virens)、紫麦角菌(Claviceps purpurea)、紧密帚枝霉(Sarocladium strictum)、迪氏新赤壳菌(Neonectria ditissima)、层出镰刀菌(Fusarium proliferatum)等真菌中的同源蛋白进行多序列比对分析,结果显示不同类真菌中FGSG_10443同源蛋白的氨基酸序列具有较高的保守性(图1-a)。利用MEGA 11.0软件对上述真菌的同源蛋白进行系统发育分析,结果显示,禾谷镰刀菌FGSG_10443与F.proliferatum同源蛋白(XP_031089531.1)亲缘关系最近,其次为T.parareesei同源蛋白(OTA04651.1),与C.purpurea同源蛋白(KAG6144323.1)亲缘关系最远(图1-b)。系统进化树的分支和节点数值表明FGSG_10443同源蛋白在各类真菌中具有较高的同源性和保守性,且其进化关系符合物种间的亲缘关系。
a-多重序列比对分析;b-系统发育分析
图1 FGSG_10443同源蛋白的多重序列比对和系统发育分析
Fig.1 Multiple sequence alignment and phylogenetic analysis of FGSG_10443 ortholog proteins
2.2 FGSG_10443敲除突变体和回补突变体的构建与鉴定
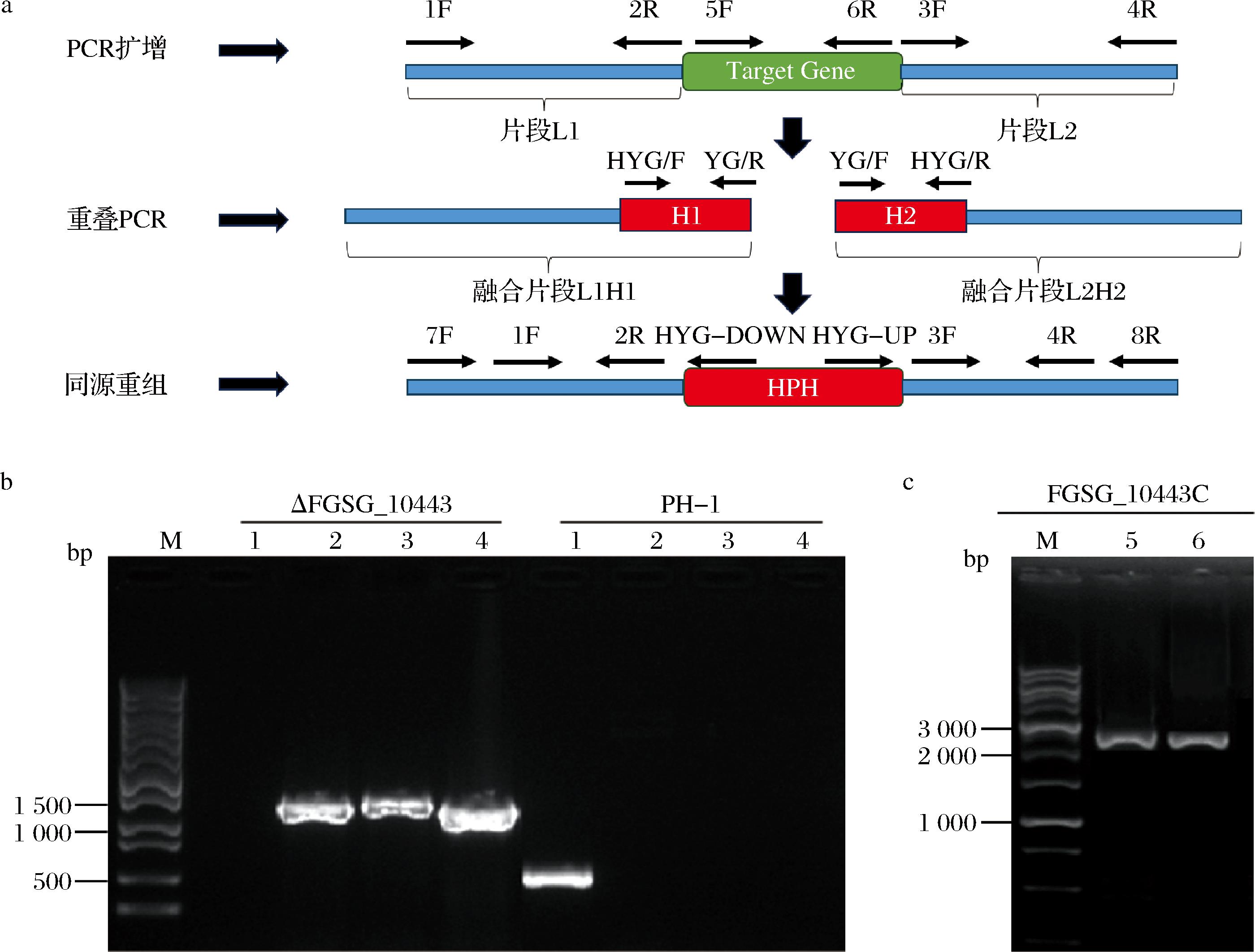
本实验采用split-marker PCR构建基因敲除融合片段,通过PEG介导的原生质体转化和体内同源重组得到抗潮霉素的阳性转化子(图2-a)。对筛选到的转化子进行PCR验证,结果显示(图2-b),野生型PH-1仅FGSG_10443基因可以扩增出条带(泳道1);而阳性转化子中可扩增到FGSG_10443上游-HPH上游融合片段(泳道2)、HPH下游-FGSG_10443下游融合片段(泳道3)以及潮霉素抗性基因HPH(泳道4),但无法扩增到FGSG_10443基因(泳道1)。因此,阳性转化子中FGSG_10443基因已被HPH所置换,即成功构建敲除突变体ΔFGSG_10443。
a-基因敲除原理;b-FGSG_10443基因敲除转化子的PCR鉴定;c-FGSG_10443基因回补转化子的PCR鉴定
图2 FGSG_10443基因敲除突变体和回补突变体的构建及鉴定
Fig.2 Construction and identification of FGSG_10443 deletion mutants and complementation strains
注:泳道M:Marker;泳道 1:引物FGSG_10443-5F/FGSG_10443-6R;泳道2:引物FGSG_10443-7F/HYG-DOWN;泳道3:引物HYG-UP/FGSG_10443-8R;泳道4:引物HYG-F/HYG-R;泳道5:M13-F/FGSG_10443-6R;泳道6:M13-R/FGSG_10443-5F。

a-菌落形态;b-分生孢子;c-子囊壳形态;d-子囊孢子
图3 FGSG_10443在禾谷镰刀菌生长和发育过程中的作用
Fig.3 The role of FGSG_10443 in the fungal growth and development of F.graminearum
为验证ΔFGSG_10443的功能缺陷是由于FGSG_10443基因缺失引起,将含有FGSG_10443的pFL2重组载体转化入ΔFGSG_10443的原生质体,G418筛选得到阳性转化子。对阳性转化子使用M13-F/FGSG_10443-6R和M13-R/FGSG_10443-5F进行PCR验证。结果显示(图2-c),2对引物均可以扩增出FGSG_10443基因(泳道5、6),证明成功获得回补突变体FGSG_10443C。
2.3 FGSG_10443基因缺失降低禾谷镰刀菌分生孢子产量
将PH-1、ΔFGSG_10443和FGSG_10443C分别接种到PDA培养基,测定菌落形态和生长速率。结果显示(图3-a,表2),基因FGSG_10443被敲除后,禾谷镰刀菌可以正常生长和菌丝发育;与野生型和回补突变体相比,敲除突变体菌株ΔFGSG_10443的菌落形态、菌落直径和生长速率均无显著性差异。因此,FGSG_10443不参与禾谷镰刀菌的生长发育调控。
表2 FGSG_10443基因敲除突变体的生长速率和孢子产量
Table 2 Growth rate and spore production of FGSG_10443 deletion mutant

菌株生长速率/ mm/d 孢子产量/ 106个/mL PH-121.19±0.79a2.39±0.88aΔFGSG_1044321.00±0.90a1.67±0.72bFGSG_10443C21.16±0.75a2.11±1.45a
注:数据为“平均值±标准差”。同列不同字母表示经独立t检验,P<0.05时差异显著(下同)。
分生孢子是禾谷镰刀菌无性繁殖阶段的产物,也是其传播和感染植物的主要载体之一。将野生型、敲除和回补突变体菌株接种到在CMC培养基诱导产生分生孢子。培养3 d后,虽然分生孢子的形态、大小和隔膜数均无明显差异(图3-b),但ΔFGSG_10443产孢量较野生型PH-1下降了30.13%(表2)。FGSG_10443C回补菌株的产孢量与PH-1一致。因此,FGSG_10443基因在禾谷镰刀菌分生孢子的产生中发挥了一定作用。
2.4 FGSG_10443基因缺失不影响禾谷镰刀菌的有性生殖
为探究FGSG_10443在有性生殖时期的作用,将PH-1、ΔFGSG_10443和FGSG_10443C分别接种到胡萝卜培养基。黑光灯诱导培养14 d后,可见ΔFGSG_10443产生黑色粒状的子囊壳,且子囊壳的大小、形态和数量与PH-1及FGSG_10443C相比无明显差异(图3-c)。压开子囊壳,观察子囊和子囊孢子形态,发现PH-1、ΔFGSG_10443和FGSG_10443C三者无明显差异(图3-d)。因此,FGSG_10443并未参与禾谷镰刀菌的有性生殖过程。
2.5 FGSG_10443基因缺失影响禾谷镰刀菌抗细胞膜和氧化应激胁迫能力
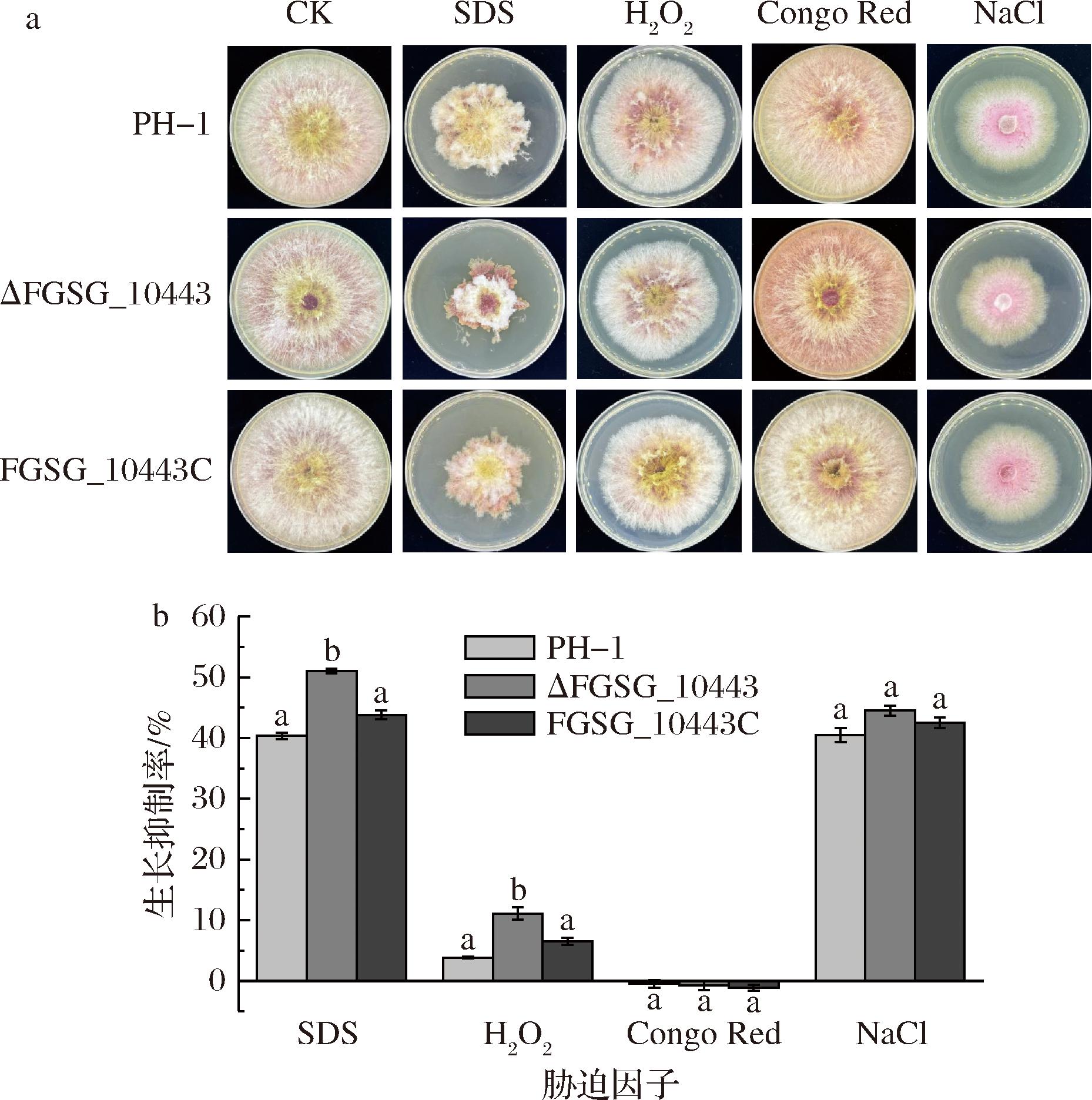
在与宿主的相互作用过程中,病原菌的存活依赖于它们克服宿主防御机制和适应环境的能力。为探索FGSG_10443基因是否参与禾谷镰刀菌对环境胁迫因子的响应,本研究分别考察了ΔFGSG_10443在细胞膜胁迫(0.2 g/L SDS)、氧化应激胁迫(1 g/L H2O2)、细胞壁胁迫(0.2 g/L刚果红)和渗透压胁迫(1 mol/L NaCl)等条件下的生长情况。如图4所示,SDS和H2O2胁迫下,ΔFGSG_10443的菌落生长抑制率显著高于野生型PH-1和回补突变体FGSG_10443C,而对刚果红和NaCl胁迫ΔFGSG_10443较野生型未表现显著性差异。因此,FGSG_10443的缺失导致禾谷镰刀菌对细胞膜胁迫和氧化应激胁迫敏感性增强。
a-菌落形态;b-菌丝生长抑制情况
图4 FGSG_10443基因缺失对禾谷镰刀菌环境胁迫敏感性的影响
Fig.4 Effect of FGSG_10443 deletion on the sensitivity of F.graminearum to environmental stress
注:同一处理的不同小写字母表示差异显著(P<0.05)(下同)。
2.6 FGSG_10443基因缺失不影响禾谷镰刀菌DON产量
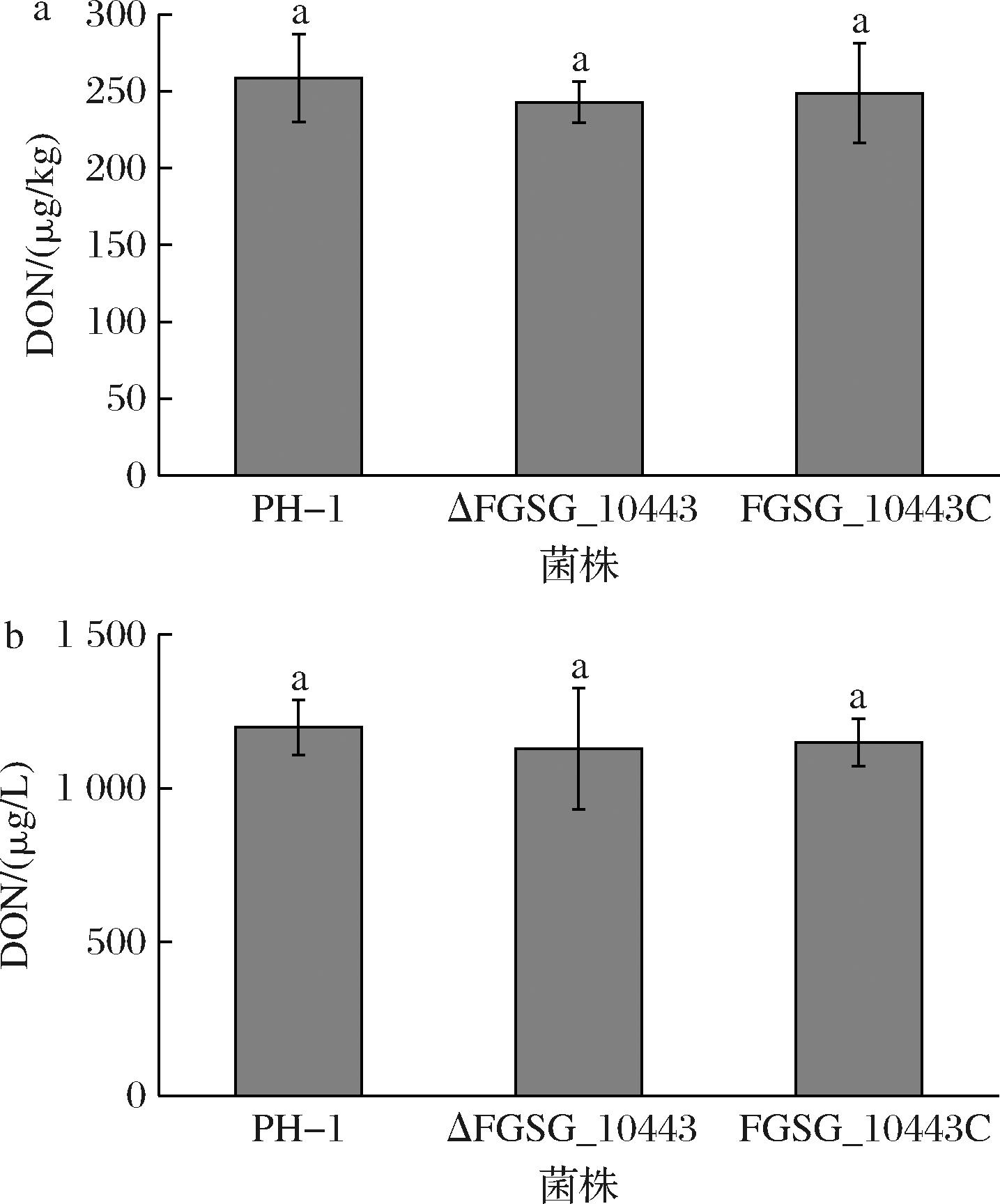
为探究FGSG_10443在禾谷镰刀菌合成DON中的作用,将菌株接种到PDA培养基上培养7 d后,UPLC-MS/MS检测结果表明ΔFGSG_10443的DON产量相比于PH-1和FGSG_10443C没有显著变化(图5-a)。进一步用TBI培养基诱导产毒,结果同样显示ΔFGSG_10443与PH-1和FGSG_10443C的DON合成量无显著差异(图5-b)。因此,FGSG_10443基因的缺失不影响DON的生物合成。
a-PDA培养基;b-TBI培养基
图5 FGSG_10443基因缺失对禾谷镰刀菌DON生物合成的影响
Fig.5 Effect of FGSG_10443 deletion on DON biosynthesis of F.graminearum
2.7 FGSG_10443基因缺失降低禾谷镰刀菌的致病力
为分析FGSG_10443在禾谷镰刀菌侵染小麦过程中的作用,将PH-1、ΔFGSG_10443和FGSG_10443C的分生孢子液分别接种至小麦胚芽鞘和扬花期麦穗上进行致病力测定。结果显示,3种菌株均能侵染小麦胚芽鞘产生褐色的坏死病斑(图6-a),但ΔFGSG_10443形成的病斑长度显著减小,与PH-1相比降低了66.24%(图6-b)。类似的,田间麦穗接种结果也显示ΔFGSG_10443的致病力显著下降,仅在接种部位和临近的小穗处发病,而野生型PH-1和回补突变体FGSG_10443C可以从接种点往上下两侧扩展造成明显的赤霉病病症(图6-c);与野生型PH-1相比,ΔFGSG_10443的染病籽粒显著减少了70.05%(图6-d)。因此,FGSG_10443在禾谷镰刀菌的侵染过程中发挥着重要的作用。
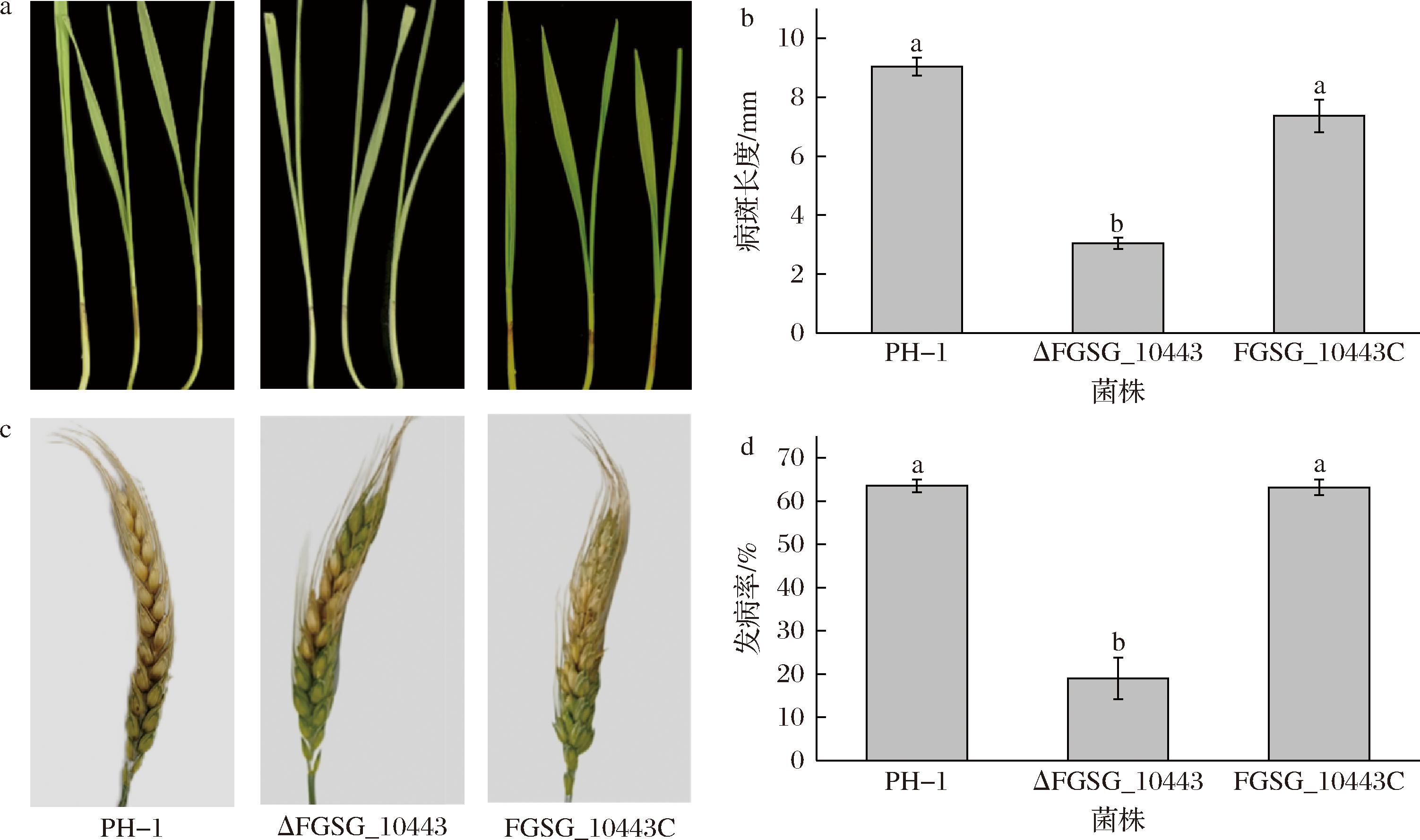
a-小麦胚芽鞘感染情况;b-小麦胚芽鞘的病斑长度;c-小麦穗感染情况;d-小麦穗的发病率
图6 FGSG_10443基因缺失对禾谷镰刀菌致病性的影响
Fig.6 Effect of FGSG_10443 deletion on the pathogenicity of F.graminearum
3 讨论
在侵袭宿主过程中,病原真菌会分泌若干小分子蛋白,以调节宿主生理状态,抑制或干扰宿主防御反应,从而为病原菌的侵染和繁殖创造有利条件[12]。作为一类常见的效应因子,SSCRPs凭借其富含的半胱氨酸之间形成的二硫键,维持三维结构的稳定,从而在恶劣环境中保持活性,有效抵抗宿主植物的防御机制,参与病原菌与宿主的互作过程[6]。目前,SSCRPs已在诸多植物病原真菌中获得了鉴定,如小麦矮化腥黑穗病菌(Tilletia controversa)的TcSCP_9014[13],U.virens的SCRE1和SCRE2[14],玉米黑粉菌(Ustilago maydis)的Cce1[15],绿色木霉(Trichoderma virens)的Alt a 1[16]等,它们也被证实在病原菌侵染宿主过程中发挥了重要作用。然而,目前尚未见关于禾谷镰刀菌SSCRPs具体生物学功能的研究报道。
禾谷镰刀菌FGSG_10443被注释为假定蛋白,序列分析发现其为副里氏木霉(T.parareesei)SSCRP蛋白(OTA04651.1)的同源蛋白,进化树分析显示FGSG_10443同源蛋白的进化关系与物种进化趋势一致,表明具有较高的同源性和保守性。本研究利用了基因敲除和回补技术初步研究了FGSG_10443基本生物学功能,发现FGSG_10443基因被敲除后,禾谷镰刀菌的菌丝生长和孢子形态没有受到影响,但孢子产量显著下降,与胶孢炭疽菌(Colletotrichum gloeosporioides)分泌蛋白CgCP1和BAS2的结果一致[17-18]。在有性生殖方面,FGSG_10443基因的缺失不影响子囊壳的产生,与野生型相比,子囊和子囊孢子的形态与数量均没有显著差异。因此,FGSG_10443对于禾谷镰刀菌的生长发育和有性繁殖并不是必需的,但在产孢过程中可能发挥了一定的作用。
在抗环境胁迫方面,与野生型PH-1相比,FGSG_10443敲除突变体对SDS和H2O2表现出更高的敏感性,说明对细胞膜和氧化应激胁迫的抵抗能力发生了变化;而对刚果红和NaCl胁迫未表现明显差异。类似的,大丽轮枝菌VdSCP23的缺失并不影响病原菌对渗透胁迫(NaCl和山梨醇)和细胞壁胁迫(刚果红和钙荧光白)的耐受[8];而SCR96对恶疫霉菌(Phytophthora cactorum)的氧化应激胁迫耐受是必需的,当其缺失后,H2O2完全抑制了菌株的生长[19]。在病原菌侵染过程中,植物会触发一系列早期免疫反应,其中即包括活性氧(reactive oxygen species,ROS)的产生,ROS不仅可以直接杀死病原菌,还可以作为信号分子诱导气孔关闭和系统获得抗性等其他免疫反应[20]。因此,病原菌对宿主产生的ROS的耐受能力也是决定能否成功定殖和扩增的关键因素[21],而FGSG_10443基因缺失导致的对氧化应激等胁迫的高敏感性可能会影响禾谷镰刀菌的致病力。
与多种植物病原真菌SSCRPs类似,FGSG_10443缺失后禾谷镰刀菌对小麦麦穗和胚芽鞘的致病性均明显降低。作为主要的毒力因子,DON毒素在禾谷镰刀菌的侵染过程中具有非常重要的作用[22],但在PDA培养基和TBI诱导培养基上,ΔFGSG_10443的DON产量未出现显著下降,说明突变体致病力的下降与DON合成能力无关。在禾谷镰刀菌中,尚未见关于SSCRPs的研究,但分泌蛋白Fg02685被报道不参与禾谷镰刀菌的生长发育,但可以增加胼胝质的堆积、ROS的积累和防御基因的表达,从而触发植物免疫反应,参与禾谷镰刀菌的侵染过程[23];效应子Fg03600被证明是禾谷镰刀菌的重要毒力因子,它可以靶向小麦叶绿体与质子梯度调节蛋白TaPGRL1互作,抑制植物循环电子传递链并增加光合作用衍生的ROS[24];孤儿分泌蛋白OPS24虽然不影响禾谷镰刀菌生长和产毒,但可结合小麦TaSnRK1α激酶,调控植物对病原菌的防御机制,从而促进赤霉病的发展[25]。因此,FGSG_10443可能同样通过调节植物免疫反应和防御机制从而在禾谷镰刀菌的致病过程中发挥重要作用,但其具体作用靶点和分子调控机制还需要进一步深入研究。
本研究利用基因敲除技术初步探究了禾谷镰刀菌FGSG_10443的生物学功能,探究了其在菌丝生长、有性和无性生殖、抗胁迫能力、DON生物合成和致病性等方面的作用。结果发现,FGSG_10443基因缺失对禾谷镰刀菌菌丝营养生长、有性生殖和产毒等方面没有显著影响,但会影响分生孢子的产量和对氧化应激等胁迫的敏感性,同时导致致病力显著下降。后续研究中将继续挖掘和鉴定FGSG_10443在小麦中的作用位点和靶标蛋白,深入探讨其在禾谷镰刀菌调控植物免疫反应和防御机制等方面的作用,进一步解析其致病分子机理,从而为防治禾谷镰刀菌引起的赤霉病提供借鉴和参考。
[1] GUO L,ZHAO G Y,XU J R,et al.Compartmentalized gene regulatory network of the pathogenic fungus Fusarium graminearum[J].New Phytologist,2016,211(2):527-541.
[2] PAUDEL B,PEDERSEN C,YEN Y,et al.Fusarium graminearum virus-1 strain FgV1-SD4 infection eliminates mycotoxin deoxynivalenol synthesis by Fusarium graminearum in FHB[J].Microorganisms,2022,10(8):1484.
[3] CHEN Y,WANG J,YANG N,et al.Wheat microbiome bacteria can reduce virulence of a plant pathogenic fungus by altering histone acetylation[J].Nature Communications,2018,9:3429.
[4] WANG W J,DENG Z H,WU H Y,et al.A small secreted protein triggers a TLR2/4-dependent inflammatory response during invasive Candida albicans infection[J].Nature Communications,2019,10:1015.
[5] 韩长志,许僖.植物病原丝状真菌分泌蛋白及CAZymes的研究进展[J].南京林业大学学报(自然科学版),2017,41(5):152-160.HAN C Z,XU X.Advance in functional research of secreted protein and CAZymes in plant pathogenic filamentous fungus[J].Journal of Nanjing Forestry University (Natural Sciences Edition),2017,41(5):152-160.
[6] WANG D,TIAN L,ZHANG D D,et al.Functional analyses of small secreted cysteine-rich proteins identified candidate effectors in Verticillium dahliae[J].Molecular Plant Pathology,2020,21(5):667-685.
[7] SHU X Y,XU D Z,JIANG Y Q,et al.Functional analyses of a small secreted cysteine-rich protein ThSCSP14 in Tilletia horrida[J].International Journal of Molecular Sciences,2022,23(23):15042.
[8] WANG J,WANG D,JI X B,et al.The Verticillium dahliae small cysteine-rich protein VdSCP23 manipulates host immunity[J].International Journal of Molecular Sciences,2023,24(11):9403.
[9] LU S W,EDWARDS M C.Genome-wide analysis of small secreted cysteine-rich proteins identifies candidate effector proteins potentially involved in Fusarium graminearum-wheat interactions[J].Phytopathology,2016,106(2):166-176.
[10] WANG G H,WANG C F,HOU R,et al.The AMT1 arginine methyltransferase gene is important for plant infection and normal hyphal growth in Fusarium graminearum[J].PLoS One,2012,7(5):e38324.
[11] 钱沈安,胡政,于伊楠,等.1-辛烯-3-醇对禾谷镰刀菌的抑制活性及作用机理[J].食品科学,2023,44(18):93-101.QIAN S A,HU Z,YU Y N,et al.Inhibition activity and mechanism of 1-octen-3-ol on the growth and deoxynivalenol biosynthesis of Fusarium graminearum[J].Food Science,2023,44(18):93-101.
[12] WERNET N,WERNET V,FISCHER R.The small-secreted cysteine-rich protein CyrA is a virulence factor participating in the attack of Caenorhabditis elegans by Duddingtonia flagrans[J].PLoS Pathogens,2021,17(11):e1010028.
[13] DU Z Z,WENG H,JIA H Y,et al.Characterization of a small cysteine-rich secreted effector,TcSCP9014,in Tilletia controversa[J].Plants,2024,13(11):1523.
[14] ZHANG N,YANG J Y,FANG A F,et al.The essential effector SCRE1 in Ustilaginoidea virens suppresses rice immunity via a small peptide region[J].Molecular Plant Pathology,2020,21(4):445-459.
[15] SEITNER D,UHSE S,GALLEI M,et al.The core effector Cce1 is required for early infection of maize by Ustilago maydis[J].Molecular Plant Pathology,2018,19(10):2277-2287.
[16] KUMAR R,MUKHERJEE P K.Trichoderma virens Alt a 1 protein may target maize PR5/thaumatin-like protein to suppress plant defence:An in silico analysis[J].Physiological and Molecular Plant Pathology,2020,112:101551.
[17] WANG W F,AN B,FENG L P,et al.A Colletotrichum gloeosporioides cerato-platanin protein,CgCP1,contributes to conidiation and plays roles in the interaction with rubber tree[J].Canadian Journal of Microbiology,2018,64(11):826-834.
[18] AN B,WANG W F,GUO Y F,et al.Bas2 is required for conidiation and pathogenicity of Colletotrichum gloeosporioides from Hevea brasiliensis[J].International Journal of Molecular Sciences,2018,19(7):1860.
[19] CHEN X R,LI Y P,LI Q Y,et al.SCR96,a small cysteine-rich secretory protein of Phytophthora cactorum,can trigger cell death in the Solanaceae and is important for pathogenicity and oxidative stress tolerance[J].Molecular Plant Pathology,2016,17(4):577-587.
[20] HONG X F,QI F,WANG R,et al.Ascorbate peroxidase 1 allows monitoring of cytosolic accumulation of effector-triggered reactive oxygen species using a luminol-based assay[J].Plant Physiology,2023,191(2):1416-1434.
[21] GAO M J,HE Y,YIN X,et al.Ca2+ sensor-mediated ROS scavenging suppresses rice immunity and is exploited by a fungal effector[J].Cell,2021,184(21):5391-5404.e17.
[22] WU C X,CHEN H L,YUAN M Y,et al.FgAP1σ is critical for vegetative growth,conidiation,virulence,and DON biosynthesis in Fusarium graminearum[J].Journal of Fungi,2023,9(2):145.
[23] XU Q,HU S,JIN M X,et al.The N-terminus of a Fusarium graminearum-secreted protein enhances broad-spectrum disease resistance in plants[J].Molecular Plant Pathology,2022,23(12):1751-1764.
[24] JIN M X,HU S,WU Q,et al.An effector protein of Fusarium graminearum targets chloroplasts and suppresses cyclic photosynthetic electron flow[J].Plant Physiology,2024,196(4):2422-2436.
[25] JIANG C,HEI R N,YANG Y,et al.An orphan protein of Fusarium graminearum modulates host immunity by mediating proteasomal degradation of TaSnRK1α[J].Nature Communications,2020,11:4382.