酱油是以大豆、小麦等为原料,以曲霉为主酿造菌,经制曲、发酵过程得到富含氨基酸、有机酸等具备丰富滋味和香气的传统调味品。氨基酸态氮和全氮是酱油的关键技术和经济指标,一方面影响酱油的风味,一方面决定酱油的成本。近年来,随着人民生活水平的日益提升,酱油的消费总量逐年增加,消费者对酱油的品质也有了更高的要求。为满足市场需求,酱油行业需要持续优化酱油酿造工艺,提升生产稳定性和酱油品质。
酱油的酿造常包括原料处理、制曲、发酵、压榨、精制等阶段,其中制曲是影响酿造酱油品质的核心阶段。我国酿造酱油的菌种多为米曲霉,制曲是米曲霉孢子在经前处理的黄豆和小麦原料上充分生长并分泌丰富酶系的过程,制得的成曲富含蛋白酶、淀粉酶、纤维素酶和谷氨酰胺酶等多种酶类[1]。制曲过程米曲霉的生长情况决定了液态发酵的初始酶活性水平、底物状态和微生物群落结构,直接影响了发酵过程酶促反应水平及微生物生命活动对大分子碳源、氮源的分解、转化情况,决定了酱油的风味和品质[2]。酿造酱油在制曲阶段添加的米曲霉为孢子状态,在制曲过程会经历孢子萌发期、菌丝生长期、旺盛产酶期和孢子着生期。米曲霉的孢子萌发通常需要5~10 h,而原料、环境中引入的细菌可在米曲霉萌发阶段快速繁殖[3]。若制曲条件控制不佳,细菌过度繁殖,会抑制米曲霉的生长,成曲整体酶活性降低、pH值降低,酱油的氨基酸态氮和全氮指标降低,风味不佳。因此,制曲阶段质量控制的关键期在前期,米曲霉越早成为体系的优势菌就能越快反抑制细菌的生长,制曲体系的稳定性就越高[4],对应的成曲质量和酱油品质就越高。
现有研究多通过菌种选育、制曲工艺调整来促进米曲霉在制曲前期的旺盛生长[5-7],但如何利用不同阶段特性来提升制曲质量的研究尚未见报道。为避免制曲前期米曲霉孢子萌发阶段细菌的过度繁殖对制曲质量引起的下降,本研究利用米曲霉自身的生长特性,将不同状态的米曲霉混合制曲,研究孢子萌发期、菌丝生长期和旺盛产酶期米曲霉曲料的适当混合对制曲过程和成曲质量的影响,以期提升制曲过程的质量稳定性,从而提升酱油的氨氮、全氮等关键质量指标。进一步探究酱油中蛋白质和氨基酸的组成情况,为酱油行业制曲质量优化和原料利用率的再提升提供理论基础和研究思路。
1 材料与方法
1.1 材料与试剂
大豆、小麦、食盐,市售;米曲霉(Aspergillus oryzae)HT.AS1208,海天(高明)调味食品有限公司保藏;酿造促进液,海天(高明)调味食品有限公司自研自制。
NaH2PO4、Na2HPO4、NaOH、H2SO4、三氯乙酸、福林试剂、干酪素、酪氨酸(均为分析级),国药集团有限公司。
1.2 仪器与设备
9系列自动滴定仪,瑞士万通中国有限公司;L-3000 全自动氨基酸分析仪,江苏华美辰仪器科技有限公司;KDN-08C凯氏定氮仪,上海仪电分析仪器有限公司;Multiskan FC酶标仪,赛默飞世尔科技有限公司;SBA-40E生物传感分析仪,济南延和生物科技有限公司;PH100生物显微镜,凤凰光学股份有限公司;HPS-250恒温培养箱,哈尔滨市东联电子技术开发有限公司。
1.3 实验方法
1.3.1 酿造酱油的制备方法
1.3.1.1 制曲方法
以黄豆和小麦为原料,小麦焙炒、黄豆蒸煮后冷却。对照组:按原料(黄豆和小麦)质量的0.5%接入米曲霉曲精,三者混匀入曲盘制曲。实验组:取1/4的原料接入总曲精量1/4的米曲霉,在30 ℃条件下培养得到不同状态的米曲霉培养物,最后将不同状态的米曲霉培养物与剩余3/4的原料和米曲霉曲精混匀,入圆盘制曲。根据米曲霉培养物培养时间的不同分为3个组别:孢子萌发期组培养6 h(AK-6 h)、菌丝生长期组培养 15 h(AK-15 h) 以及旺盛产酶期组培养 25 h(AK-25 h)。入曲盘后培养温度控制在 30~40 ℃,培养17 h至曲料大量结块后进行第1次松曲,第1次松曲后一直保持培养温度为30 ℃;根据曲料结团情况在25 h进行第2次松曲,制曲50 h出曲,得到成曲。
1.3.1.2 发酵方法
将成曲与18 °Bé的盐水以1∶2的质量比均匀混合,于30 ℃下恒温发酵120 d,发酵过程每隔5 d搅拌一次,发酵结束后过滤即得到酱油原油。
1.3.2 曲料酶活性的测定
曲料粗酶液的提取:曲料粉碎后过筛,取60目筛下物和100目筛上物10 g溶于200 mL超纯水中,40 ℃、180 r/min振荡4 h,过滤取上清液备用。
中性、酸性和碱性蛋白酶活性的测定:参照GB/T 23527.1—2023《酶制剂质量要求 第1部分:蛋白酶制剂》测定,其中中性、酸性和碱性蛋白酶的溶剂 pH 值分别为7.5、3.0和10.5。
α-淀粉酶活性的测定:参照GB 1886.174—2024《食品安全国家标准 食品添加剂 食品工业用酶制剂》测定。
1.3.3 曲料pH值的测定
曲料粉碎后过筛,取60目筛下物和100目筛上物40 g溶于160 mL纯水中,25 ℃、180 r/min振荡10 min,过滤取上清液快速用pH计检测。
1.3.4 曲料菌落总数的测定
参照GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法进行检测和计算。
1.3.5 酱油理化指标的测定
氨基酸态氮和总酸参照GB/T 18186—2000《酿造酱油》的方法,使用自动电位滴定仪进行测定。全氮参照GB 5009.5—2016《食品安全国家标准 食品中蛋白质的测定》中凯氏定氮法使用凯氏定氮仪进行测定。谷氨酸含量:将酱油稀释至生物传感分析仪测定范围内直接测定。游离氨基酸和肽分布分别参照GB/T 22492—2008《大豆肽粉》中游离氨基酸含量的测定和肽相对分子质量分布的方法进行测定。
1.4 数据分析
利用Excel进行“平均值±标准差”计算,使用Origin 2021进行数据可视化,使用SPSS软件进行显著性分析(P<0.05)。
2 结果与分析
2.1 不同状态米曲霉混合制曲对制曲质量的影响
2.1.1 对制曲过程pH的影响
酱油的制曲是以黄豆、小麦为原料,以米曲霉为主酿造菌的微生物生命活动,该过程对蛋白质、碳水化合物进行了初步分解,并产生了相应的酶[8]。环境中的乳酸菌、大肠菌群、芽孢等均会在制曲过程繁殖,若米曲霉孢子迅速萌发成为体系的优势菌,则细菌的生长会受到抑制。乳酸菌这类产酸菌的生命活动会降低曲料的pH,而芽孢和米曲霉等会利用曲料中的有机酸且会分解氨基酸生成氨或胺使pH上升[9]。如图1所示,曲料pH呈先降低后升高最后基本稳定的趋势。制曲前期曲料pH的降低主要由乳酸菌代谢产有机酸引起,随着pH的逐渐降低,乳酸菌的生命活动也会逐步受到抑制。在制曲15 h左右达到最低值后pH逐步提升,这与米曲霉孢子萌发后生命活动对曲料中有机酸的消耗及代谢产氨有关。不同状态米曲霉混合制曲会提升制曲15 h的曲料pH,培养6、15 h曲料混合制曲组在制曲过程pH均比对照高,可能与处于孢子萌发期和菌丝生长期的米曲霉在制曲前期成为体系优势菌、大量消耗有机酸或者抑制产酸菌的生命活动有关。
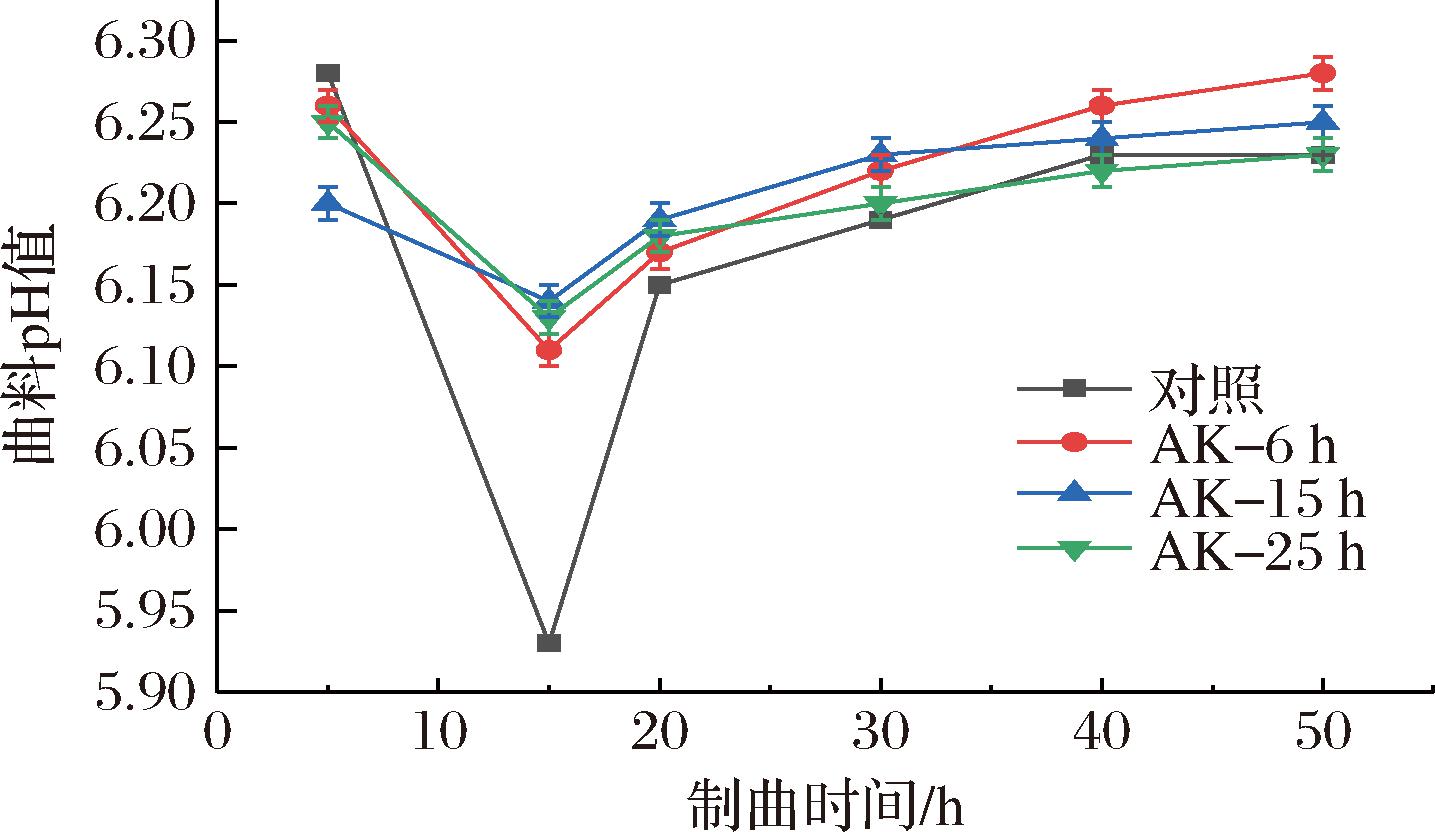
图1 制曲过程pH的变化情况
Fig.1 Changes in pH during the koji-making process
2.1.2 对制曲过程中性蛋白酶活性的影响
米曲霉是一类可高效产酶且酶系丰富的真菌,大部分米曲霉产中性蛋白酶活性最强[10]。在制曲过程可通过监测中性蛋白酶活性的变化来判断米曲霉的生长状态,从而优化制曲和出曲时间。如图2所示,制曲15 h米曲霉已开始产酶,此时已有菌丝长出,曲料轻微发白;在制曲20~30 h,米曲霉产中性蛋白酶活性效率最高,此阶段米曲霉的菌丝旺盛生长,曲料产热和发白加剧。40 h后产酶效率大幅放缓,米曲霉进入产孢期,曲料开始由黄转绿,中性蛋白酶活性缓慢达到最高值,若继续制曲,中性蛋白酶活性有降低趋势。
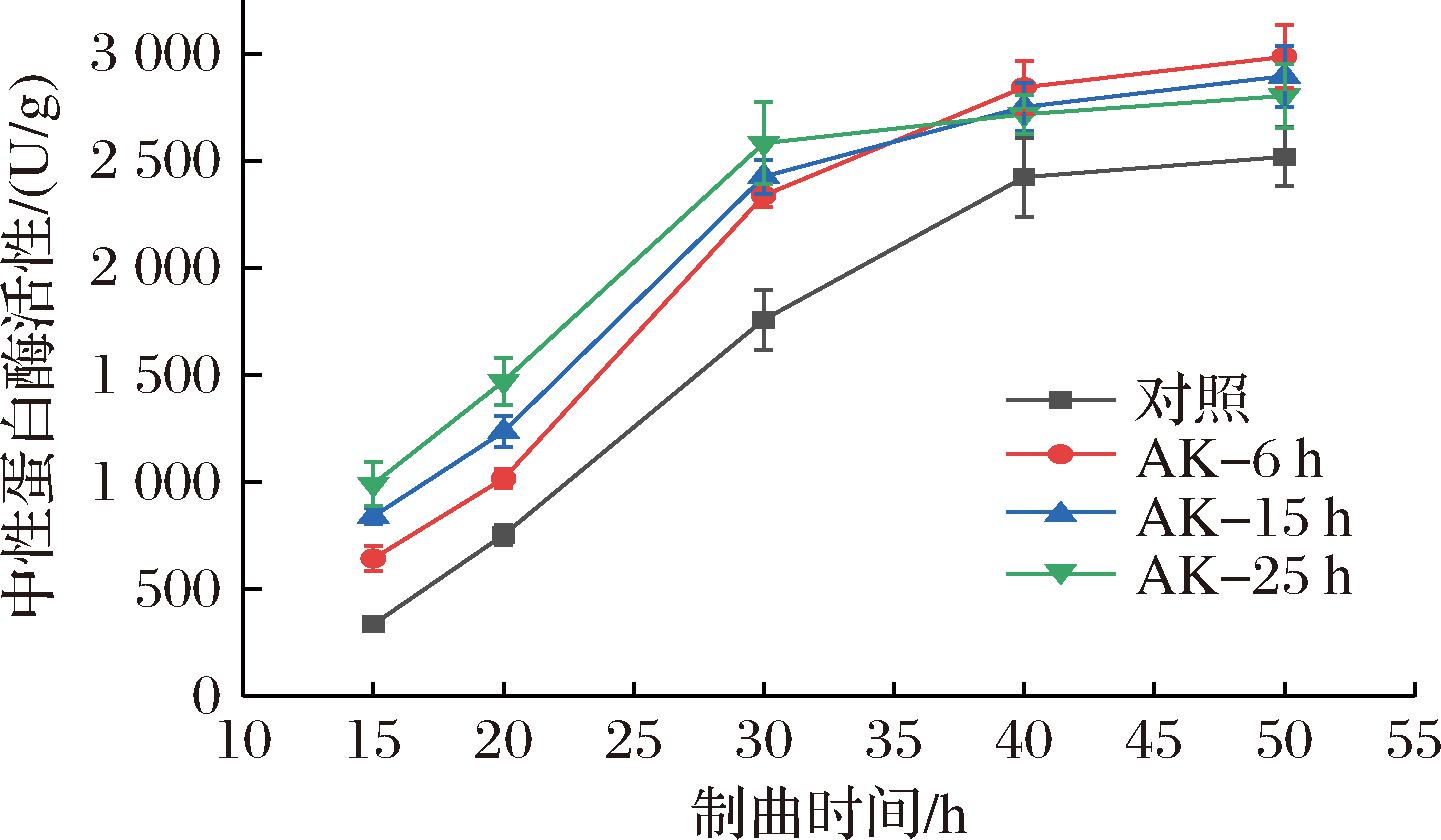
图2 制曲过程中性蛋白酶活性的变化情况
Fig.2 Changes in neutral protease activity during the koji-making process
培养6、15、25 h曲料混合制曲均能提升制曲过程曲料的中性蛋白酶活性,制曲前期酶活性提升与不同阶段曲料自身引入的中性蛋白酶活性有关,制曲后期酶活性提升说明不同阶段曲料的混合制曲促进了整个制曲体系的产酶。在制曲30 h时,培养25 h曲料混合制曲中性蛋白酶活性最高,而制曲结束时培养25 h混合制曲中性蛋白酶活性提升幅度不及培养6、15 h的组别,可能与培养25 h时曲料酶活性达到最高值后开始降低有关。而培养6 h曲料混合制曲在制曲30 h时中性蛋白酶活性最低,制曲50 h时酶活性最高,说明处于孢子萌发期曲料的混合制曲更有利于提升成曲的中性蛋白酶活性。
2.1.3 对成曲酶活性的影响
制曲是酿造酱油的核心阶段之一,以米曲霉为代表的主酿造菌及环境微生物通过生长代谢积累一定的风味前体物质并产生丰富的酶系和足量的酶活性,成曲酶系水平直接影响发酵效率和质量[11]。如图3所示,蛋白酶与原料蛋白质的分解有关,在一定程度上影响了酱油的氨基酸态氮和全氮水平;该菌种对应成曲蛋白酶活性相较于淀粉酶活性更具优势,其中中性蛋白酶活性最高,其次是碱性蛋白酶和酸性蛋白酶。不同状态米曲霉混合制曲可以提升成曲的酸性、中性、碱性蛋白酶和α-淀粉酶活性,除碱性蛋白酶外均具备显著性差异(P<0.05);培养6 h曲料混合制曲组的提升幅度最高,酸性和中性蛋白酶活性分别提升了19.6%、18.5%,蛋白酶活性达4 044 U/g,α-淀粉酶活性提升了31.1%。
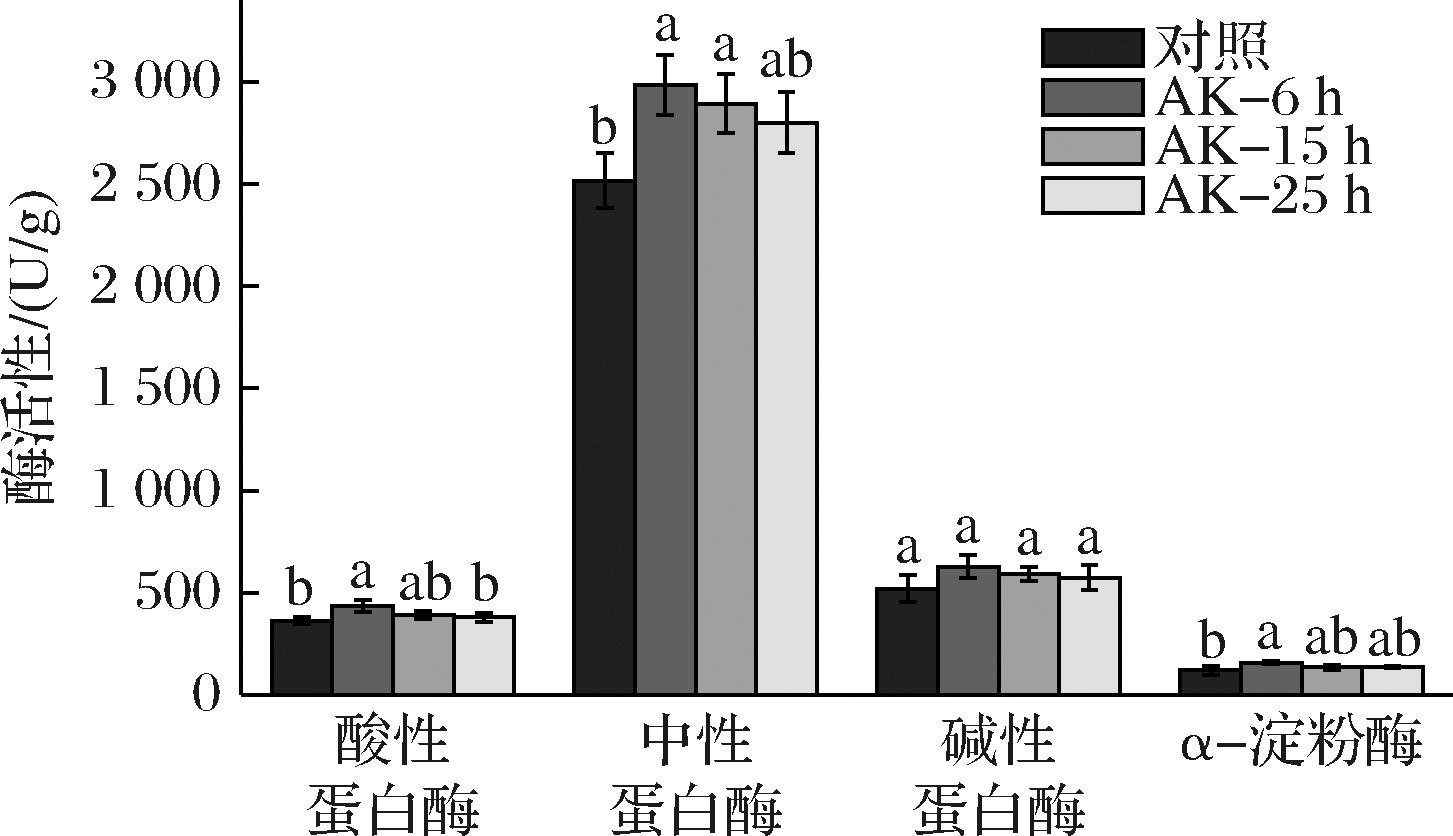
图3 不同状态米曲霉混合制曲对成曲酶活性的影响
Fig.3 Effect of mixed koji-making with A.oryzae in different growth stages on the enzyme activity in mature koji
注:不同字母表示差异显著(P<0.05)(图4同)。
2.1.4 对成曲菌落总数的影响
成曲菌落总数是评价制曲质量的关键指标,主酿造菌-米曲霉与环境中的微生物在制曲过程中存在竞争抑制,米曲霉旺盛生长时其他微生物的生命活动会受到抑制,成曲菌落总数低[12]。而乳酸菌、芽孢菌等微生物旺盛生长时会反抑制米曲霉的菌丝生长和产酶,表现为成曲pH值、酶活性低,菌落总数高。如图4所示,混合制曲会在一定程度上降低成曲的菌落总数,成曲菌落总数整体降低了1个数量级,无显著性差异。但混合制曲菌落总数的降低与制曲过程pH的提升,可以互相证明混合制曲在一定程度上抑制了制曲过程产酸菌的生长,同时成曲酶活性的提升又进一步证明了米曲霉得到了旺盛的生长。推测混合制曲提升了制曲前期活性状态米曲霉的量,与细菌形成竞争抑制,进而促进了体系中米曲霉的旺盛生长。
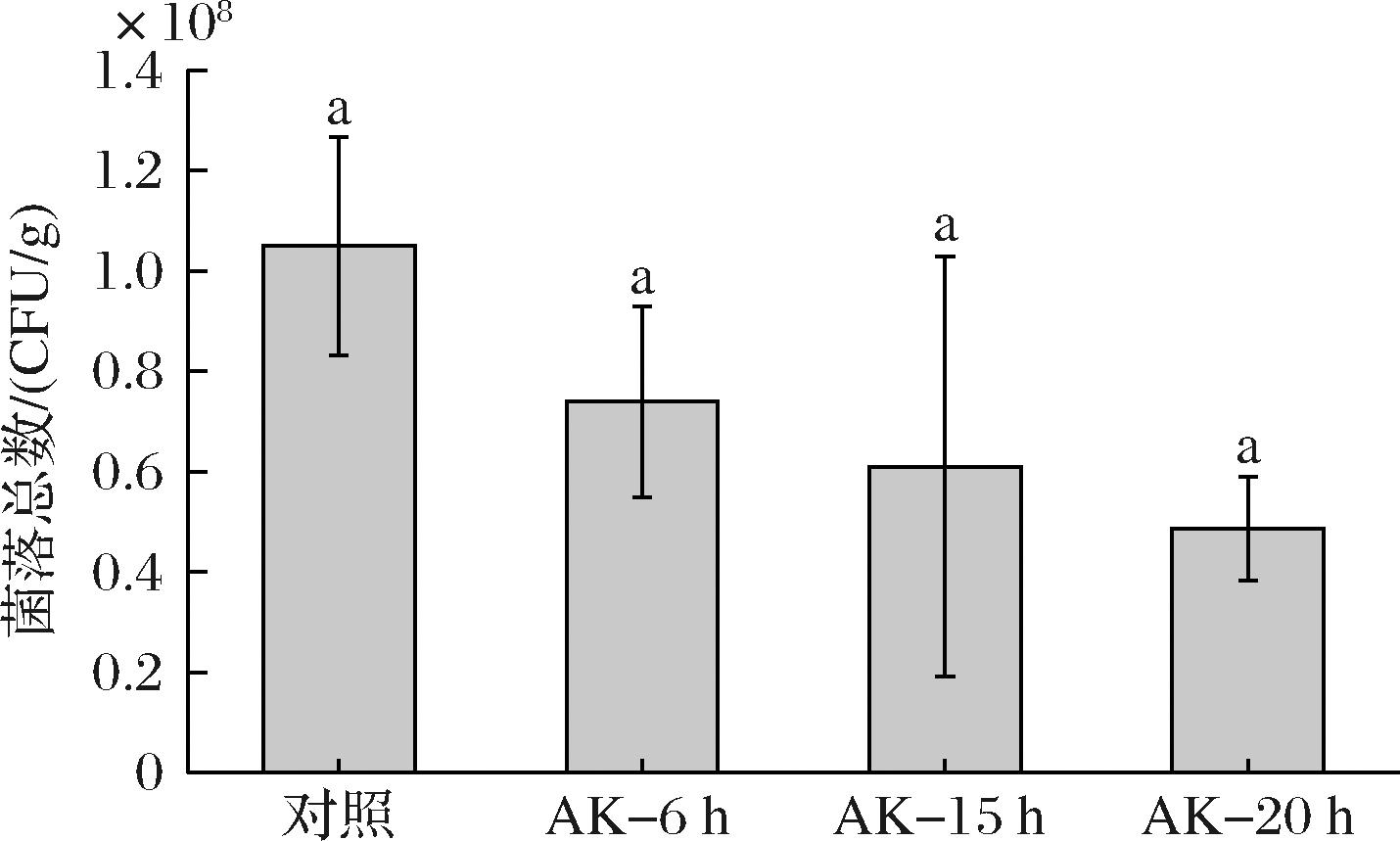
图4 不同状态米曲霉混合制曲对成曲菌落总数的影响
Fig.4 Effect of mixed koji-making with A.oryzae in different growth stages on the total microbial colony count in mature koji
2.2 不同状态米曲霉混合制曲对发酵质量的影响
2.2.1 对发酵过程氨基酸态氮的影响
如图5所示,氨基酸态氮的增幅随发酵时间的延长逐渐放缓,发酵100 d时氨基酸态氮的含量已达峰值,继续延长发酵时间,含量基本维持不变。氨基酸态氮在发酵前期大量生成,第20天体系氨基酸态氮的含量已达发酵结束时的70%,这与发酵前期体系处于高酶活性水平有关。不同状态米曲霉混合制曲可以提升发酵过程氨基酸态氮的含量,在发酵20 d时提升了0.01~0.05 g/100 mL,而在发酵结束时提升了0~0.03 g/100 mL,发酵前期提升幅度大而发酵后期提升幅度缩小。氨基酸态氮的提升在发酵前期幅度最高,推测与其促进了制曲过程的氨基酸态氮生成、提升了成曲酶活性有关;此外,在发酵中后期体系酶活性大幅降低,微生物的生命活动进一步促进氨基酸态氮的生成,逐步缩小了差距[10]。培养6、15 h曲料混合制曲组发酵80 d时其氨基酸态氮已与对照到期指标持平,可通过不同状态米曲霉混合制曲的方式缩短发酵时间。
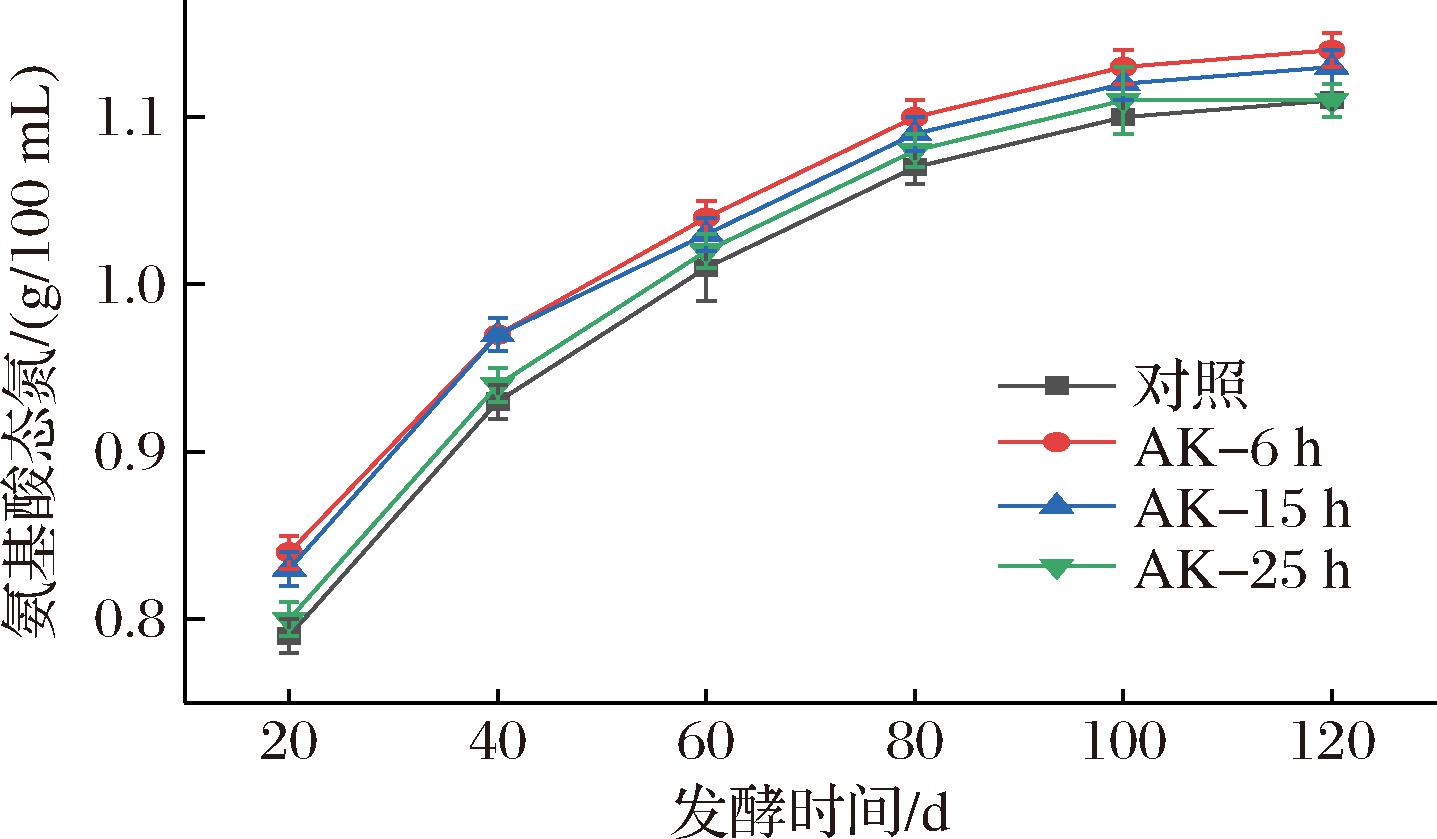
图5 发酵过程氨基酸态氮的变化情况
Fig.5 Changes in amino acid nitrogen during fermentation
2.2.2 对酱油指标的影响
酱油的发酵过程利用制曲阶段生成的酶协同微生物的生命活动将原料进一步分解为多种小分子风味物质[13]。氨基酸态氮和全氮是酱油关键的经济和技术指标,其含量越高说明原料蛋白质经液态发酵过程被分解得越充分。谷氨酸是酱油中的关键鲜味氨基酸,在一定程度上可以反映酱油的鲜味情况[14]。如表1所示,培养6、15 h曲料混合制曲组能提升酱油的氨基酸态氮、全氮和谷氨酸,且具备显著性差异(P<0.05)。其中培养6 h曲料混合制曲时整体提升效果最佳,氨基酸态氮、全氮和谷氨酸含量分别提升了0.03 g/100 mL、0.06 g/100 mL和0.5 g/L,提升比分别为2.7%、3.3%和5.3%。该组别成曲整体酶活性高,发酵氮指标高,不同状态米曲霉混合制曲以孢子萌发期的混合制曲为佳。
表1 不同状态米曲霉混合制曲对酱油理化指标的影响
Table 1 Effect of mixed koji-making with A.oryzae in different growth stages on the physicochemical indicators of soy sauce

控制氨基酸态氮/ g/100mL 全氮/ g/100mL 谷氨酸/ g/L 对照1.11±0.01b1.84±0.02b9.4±0.1bAK-6h1.14±0.01a1.90±0.02a9.9±0.1aAK-15h1.13±0.01a1.86±0.01a9.7±0.1abAK-25h1.11±0.01b1.85±0.01b9.4±0.1b
注:同列不同字母表示差异显著(P<0.05)。
2.2.3 对酱油肽分布的影响
根据以上结论,已知培养6 h混合制曲组的酱油氨基酸态氮相比于对照提升0.03 g/100 mL,而全氮提升了0.06 g/100 mL,即有一半的氮以寡肽或多肽的形式存在。进一步明确了酱油的肽分布情况,由表2可知,酱油中99.5%以上的肽(包括氨基酸)分子质量<2 000 Da,分子质量<500 Da的达95%。氨基酸的分子质量在75~204 Da,即1~6个氨基酸组成的短肽占酱油中总蛋白质含量的95%。不同分子质量的肽段贡献不同的风味特征[15],其中分子质量<500 Da的易与鲜味受体结合,主要贡献鲜味味感[16];而分子质量>500 Da的肽段常与浓厚感相关联。不同状态米曲霉混合制曲组的酱油在全氮提升的基础上,500 Da及以上分子质量的占比从4.59%提升至4.68%,酱油的浓厚感会有一定程度的增强。
表2 酱油中肽分布情况
Table 2 Distribution of peptides in soy sauce
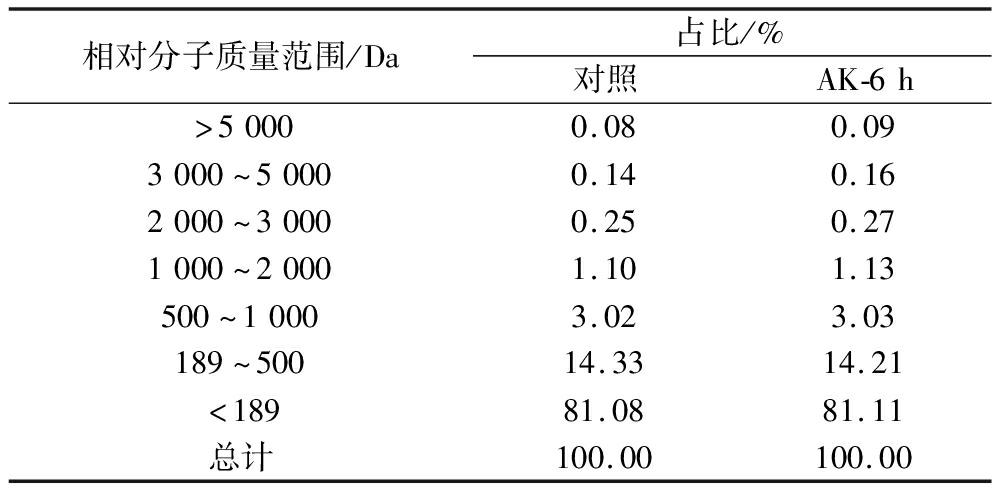
相对分子质量范围/Da占比/%对照AK-6h>50000.080.093000~50000.140.162000~30000.250.271000~20001.101.13500~10003.023.03189~50014.3314.21<18981.0881.11总计100.00100.00
2.2.4 对酱油游离氨基酸的影响
酱油中游离氨基酸的形成主要有原料蛋白质酶解和微生物代谢2种途径,大豆和小麦中的蛋白质通过蛋白酶(包括内肽酶和外肽酶)的作用逐步水解为氨基酸,原料中富含的谷氨酰胺可经谷氨酰胺酶分解为具有鲜味的谷氨酸;同时乳酸菌、酵母等微生物的生命活动通过脱羧、转氨等反应也能生成各类氨基酸[17]。经制曲、发酵工序得到的酱油其游离氨基酸组成情况见表3,谷氨酸和天冬氨酸这2种鲜味氨基酸含量最高,其总含量占总氨基酸的27%以上。不同状态米曲霉混合制曲培养6 h混合制曲组可将酱油的总游离氨基酸提升0.27 g/100 g,提升比达5.2%。
表3 酱油游离氨基酸组成情况
Table 3 Amino acid composition in soy sauce
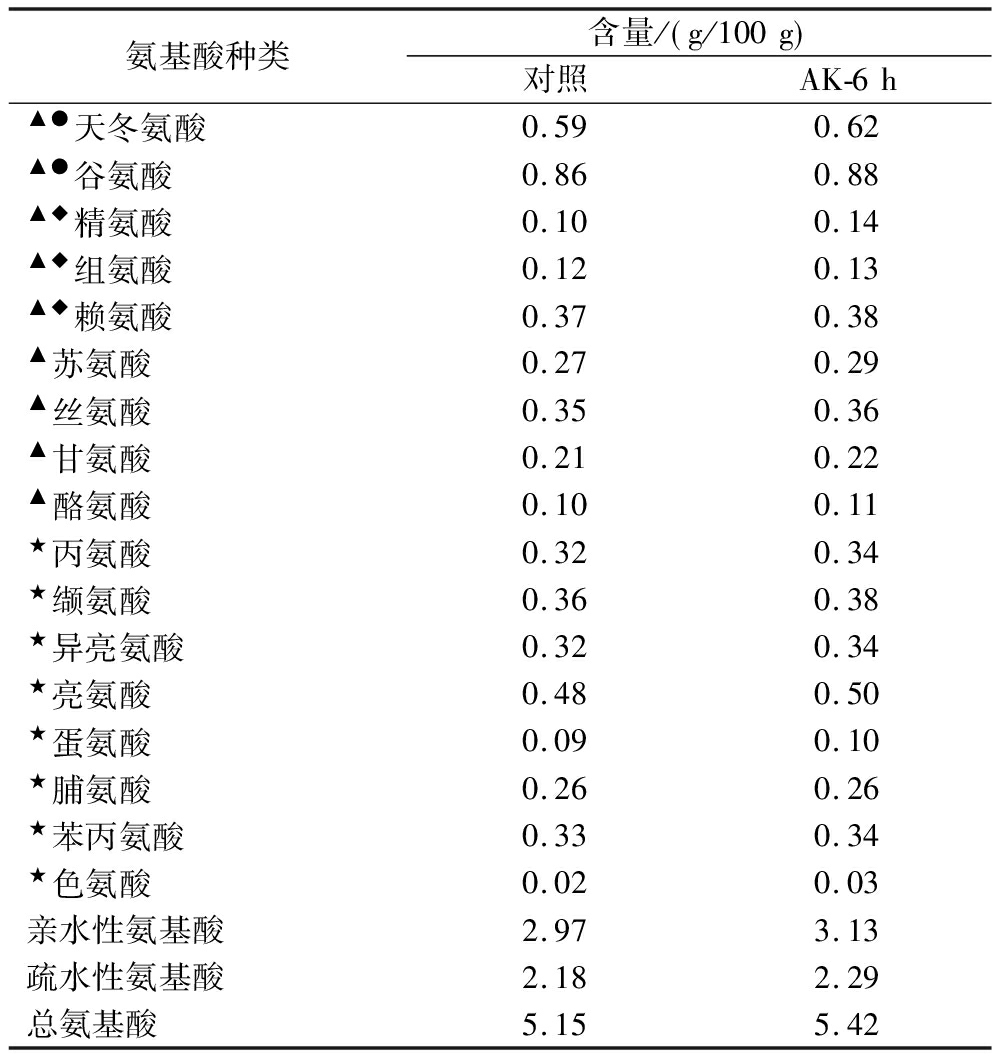
氨基酸种类含量/ g/100g 对照AK-6h▲●天冬氨酸0.590.62▲●谷氨酸0.860.88▲◆精氨酸0.100.14▲◆组氨酸0.120.13▲◆赖氨酸0.370.38▲苏氨酸0.270.29▲丝氨酸0.350.36▲甘氨酸0.210.22▲酪氨酸0.100.11★丙氨酸0.320.34★缬氨酸0.360.38★异亮氨酸0.320.34★亮氨酸0.480.50★蛋氨酸0.090.10★脯氨酸0.260.26★苯丙氨酸0.330.34★色氨酸0.020.03亲水性氨基酸2.973.13疏水性氨基酸2.182.29总氨基酸5.155.42
注:★代表疏水性氨基酸,▲代表亲水性氨基酸,◆代表碱性氨基酸,●代表酸性氨基酸。
蛋白质因组成氨基酸的亲、疏水特性呈现不同的溶解度和三级结构,疏水性氨基酸因其疏水特性在蛋白质结构中多包埋在内部,暴露在外部时会降低蛋白质的溶解性,至发酵结束也有大量的疏水性氨基酸得不到分解。而亲水性氨基酸多分布在蛋白质表面,参与形成酶切活性位点,提升蛋白质的溶解度[18]。酸性氨基酸(天冬氨酸、谷氨酸)、碱性氨基酸(精氨酸、组氨酸和赖氨酸)以及中性氨基酸(苏氨酸、丝氨酸、甘氨酸、酪氨酸)均属于亲水性氨基酸;而丙氨酸、缬氨酸、异亮氨酸、亮氨酸、蛋氨酸、脯氨酸、苯丙氨酸和色氨酸属于疏水性氨基酸。表3中酱油的游离氨基酸中亲水性氨基酸含量较多,这与亲水性氨基酸更易被酶切有关。不同状态米曲霉混合制曲可以提升酱油的亲水和疏水性氨基酸,分别提升了0.16、0.11 g/100 g,蛋白质内部的疏水性氨基酸游离出来,说明酱油中的原料蛋白质被进一步降解。
3 结论
该研究将不同状态的米曲霉混合制曲,确认了孢子萌发期(制曲6 h)、菌丝生长期(制曲15 h)和旺盛产酶期(制曲25 h)米曲霉的适当添加对制曲和发酵质量的影响,发现不同状态米曲霉的混合制曲会在一定程度上提升成曲和酱油的质量。处于孢子萌发期曲料与常规曲料混合制曲,成曲总蛋白酶活性可达4 044 U/g;酸性和中性蛋白酶活性分别提升19.6%和18.5%,α-淀粉酶活性提升31.1%。成曲pH提升,而菌落总数降低,这与制曲过程米曲霉旺盛生长抑制产酸菌的生命活动有关。发酵80 d时酱油的氨基酸态氮已与传统发酵120 d指标持平,发酵结束氨基酸态氮、全氮和谷氨酸分别提升了0.03 g/100 mL、0.06 g/100 mL 和0.5 g/L。不同状态米曲霉混合制曲不仅可以加速氨基酸态氮的生成,也可以提升发酵结束氮指标,实际生产应用中可基于需求通过不同状态米曲霉混合制曲的方式来缩短发酵时间或者提升酱油原料利用率。处于孢子萌发期曲料的混合制曲可将酱油500 Da及以上分子质量的肽段占比从4.59%提升至4.68%,还将酱油的亲水和疏水性氨基酸含量分别提升了0.16、0.11 g/100 g,表明该方法可在一定程度促进原料蛋白质的进一步降解。本文研究了不同状态米曲霉混合制曲对酿造酱油关键阶段的影响,为酱油得率再提升以及加速酱油的酿造提供了理论基础和实践思路。
[1] DING C F,MENG M,JIANG Y Y,et al.Improvement of the quality of soy sauce by reducing enzyme activity in Aspergillus oryzae[J].Food Chemistry,2019,292:81-89.
[2] YAN Y Z,QIAN Y L,JI F D,et al.Microbial composition during Chinese soy sauce koji-making based on culture dependent and independent methods[J].Food Microbiology,2013,34(1):189-195.
[3] TAN G L,HU M,LI X L,et al.Microbial community and metabolite dynamics during soy sauce koji making[J].Frontiers in Microbiology,2022,13:841529.
[4] LIU Y H,SUN G R,LI J Y,et al.Starter molds and multi-enzyme catalysis in koji fermentation of soy sauce brewing:A review[J].Food Research International,2024,184:114273.
[5] LIANG Y C,PAN L,LIN Y.Analysis of extracellular proteins of Aspergillus oryzae grown on soy sauce koji[J].Bioscience,Biotechnology and Biochemistry,2009,73(1):192-195.
[6] LI X,ZHANG Y,LIU Y,et al Co-cultutre of Aspergillus oryzae and Zygosaccharomyces rouxii enhance umami taste in soy sauce[J].Journal of Agricultural and Food Chemistry,2023,71(12):4921-4932.
[7] CHEN Z Y,FENG Y Z,CUI C,et al.Effects of koji-making with mixed strains on physicochemical and sensory properties of Chinese-type soy sauce[J].Journal of the Science of Food and Agriculture,2015,95(10):2145-2154.
[8] ZHANG L L,XIONG S J,DU T H,et al.Effects of microbial succession on the dynamics of flavor metabolites and physicochemical properties during soy sauce koji making[J].Food Bioscience,2023,53:102636.
[9] 包启安.酱油科学与酿造技术[M].北京:中国轻工业出版社,2011.BAO Q A.Soy Sauce Science and Brewing Technology[M].Beijing:China Light Industry Press,2011.
[10] 吴日帮,陈晨,方博文,等.米曲霉蛋白酶基因与酶学特性研究进展[J].中国酿造,2024,43(4):8-13.WU R B,CHEN C,FANG B W,et al.Research progress on genes and enzymatic characteristics of proteases from Aspergillus oryzae[J].China Brewing,2024,43(4):8-13.
[11] 王丽娜,汪卓,高原,等.添加江蓠对酱油制曲及成曲品质的影响[J].食品与发酵工业,2024,50(10):40-47.WANG L N,WANG Z,GAO Y,et al.Effect of Gracilaria on soy sauce koji-making and its quality[J].Food and Fermentation Industries,2024,50(10):40-47.
[12] HAN D M,CHUN B H,FENG T Y,et al.Dynamics of microbial communities and metabolites in Ganjang,a traditional Korean fermented soy sauce,during fermentation[J].Food Microbiology,2020,92:103591.
[13] ZHAO C,ZHANG Y X,LI S S,et al.Impacts of Aspergillus oryzae 3.042 on the flavor formation pathway in Cantonese soy sauce koji[J].Food Chemistry,2024,441:138396.
[14] KONG Y,ZHANG L L,ZHANG Y Y,et al.Evaluation of non-volatile taste components in commercial soy sauces[J].International Journal of Food Properties,2018,21(1):1854-1866.
[15] ZHUANG M Z,LIN L Z,ZHAO M M,et al.Sequence,taste and umami-enhancing effect of the peptides separated from soy sauce[J].Food Chemistry,2016,206:174-181.
[16] JU Y J,SUN L T,ZHANG X D,et al.Fractionation,identification and umami characteristics of flavor peptides in natural brewed soy sauce[J].Food Chemistry,2023,425:136501.
[17] HUANG Z K,FENG Y Z,ZENG J,et al.Six categories of amino acid derivatives with potential taste contributions:A review of studies on soy sauce[J].Critical Reviews in Food Science and Nutrition,2024,64(22):7981-7992.
[18] AFTABUDDIN M,KUNDU S.Hydrophobic,hydrophilic,and charged amino acid networks within protein[J].Biophysical Journal,2007,93(1):225-231.