豆豉是我国传统的发酵豆制品,已有数千年的历史。豆豉源于中国,其历史可追溯到战国时期[1],《楚辞》中已出现豆豉,在汉代时期豆豉的制作已经初具规模。最初,豆豉被用于保存大豆,随着时间的推移,它逐渐发展为一种风味独特的调味品,成为中国各地料理中的重要组成部分。豆豉不仅承载着悠久的饮食文化,其独特的营养功效更在当代食品研究领域引发广泛关注。豆豉含有丰富的蛋白质、可溶性糖、氨基酸和维生素B族,能够补充人体所需的营养[2]。此外,豆豉发酵过程中形成的活性成分,如不饱和脂肪酸(unsaturated fatty acid,UFA)和纤溶酶,已被证实具有代谢调节功能,前者有助于调节血脂、降低胆固醇水平,后者可用于治疗和预防血栓形成,在食品或医药领域具有广阔的应用前景[3]。根据豆豉所用发酵剂的类型不同,我国豆豉可分为真菌型豆豉和细菌型豆豉两大类。霉菌是真菌型豆豉的主要发酵剂,而细菌型豆豉的发酵剂主要是枯草芽孢杆菌。目前,湖南浏阳地区的浏阳豆豉、广东阳江地区的阳江豆豉都是经曲霉发酵而成的,重庆永川豆豉的发酵使用毛霉,它们是国内典型的霉菌型豆豉[4],而印度尼西亚丹贝则是经根霉发酵制成的[5]。云南、贵州、四川、山东等地区的豆豉以细菌型为主[6]。通常来说,发酵剂的类型对豆豉风味物质的形成起着决定性作用[7]。因此,不同地区的豆豉风味存在明显差异[8]。
枯草芽孢杆菌(Bacillus subtilis)是一类常见的革兰氏阳性细菌,广泛用于发酵豆制品。枯草芽孢杆菌具有很强的蛋白酶、脂肪酶和淀粉酶合成能力[7],可分解大豆中的蛋白质、脂类和淀粉,生成氨基酸、脂肪酸等小分子物质,是形成发酵豆制品风味的关键组分[6]。然而,在豆制品的发酵过程中易产生酪胺,该物质对人体的健康有潜在的危害,大量摄入会引起偏头痛、恶心等症状[9]。目前,已有多种可控制发酵豆制品酪胺的方法,其中微生物法因其高效且对发酵豆制品品质影响较小的特点而被广泛应用[10]。已有研究表明,多株芽孢杆菌具有酪胺降解能力,已用于豆酱和纳豆等发酵豆制品酪胺的控制[11]。与此同时,实验室前期从水豆豉中筛选出一种可高效降解酪胺的枯草芽孢杆菌T2,该菌株能够有效降低细菌型豆豉的酪胺含量,且其能够提高豆豉的活性物质含量和抗氧化活性[12]。然而目前关于酪胺降解菌株对发酵豆制品风味品质影响的研究甚少,阻碍对枯草芽孢杆菌T2在豆豉发酵中应用适宜性的综合评价。基于此,本研究以枯草芽孢杆菌T2为出发菌株,采用氨基酸分析仪、电子鼻和气相色谱-质谱联用仪系统分析枯草芽孢杆菌T2发酵豆豉过程中游离氨基酸(free amino acids,FAAs)、游离脂肪酸(free fatty acids,FFAs)和挥发性物质的变化,综合解析该菌株对豆豉风味形成的影响规律,为酪胺降解菌株在豆豉发酵中的应用奠定基础。
1 材料与方法
1.1 材料与试剂
大豆采购于广东省广州市天河区当地市场;枯草芽孢杆菌(B.subtilis)T2保存于实验室[12];LB培养基(g/L):10 蛋白胨、5 酵母粉、10 NaCl,pH=7.0;
盐酸、5-磺基水杨酸、石油醚、KOH、无水甲醇,天津大茂化学试剂公司;环己酮,上海阿拉丁生化科技股份有限公司;碳粉,天津华盛化学试剂有限公司;正己烷,国药集团化学试剂有限公司。以上试剂均为分析纯。
1.2 仪器与设备
BBS-DDC无菌超净操作台,济南鑫贝生物技术有限公司;SPX-250B-Z型培养箱,上海博讯实业有限公司;LC-20AT高效液相色谱、UV-1800紫外可见分光光度计,日本岛津公司;L8900全自动氨基酸分析仪,日本Hitachi公司;SPME装置和DVB/CAR/PDMS萃取头,美国Supelco公司;7890-5977B-ODP气相色谱-质谱联用仪(GC-MS),美国Agilent公司;PEN3便携式电子鼻系统电子鼻(包含10个传感器阵列,具体见表2),德国AIRSENSE公司。
1.3 实验与方法
1.3.1 发酵剂的制备
将枯草芽孢杆菌T2在LB固体平板划线,随后转接LB液体培养,37 ℃、180 r/min振荡培养,测定OD600值为4.0作为种子液。
1.3.2 样品制作
将500 g优质饱满的黄豆清洗后在1 000 mL蒸馏水中浸泡12 h,直到黄豆表皮无皱纹,121 ℃蒸煮20 min,然后冷却至室温。以3%(体积分数)的接种量接种至冷却的黄豆基质,摇匀后在37 ℃静置发酵,每隔6 h摇匀,防止发酵基质核心温度过高。分别在0、5、10、15 d收集样品,分别标记为DC-0、DC-5、DC-10和DC-15,将样品储藏在-20 ℃以供后续分析。
1.4 FAAs的测定
参考ZHANG等[13]的方法并做适当修改。称取样品于离心管中,加入0.02 mol/L的盐酸后涡旋混合,提取FAAs。取上清液加入2 mL石油醚进行脱脂,吸取下层溶液加入150 g/L的5-磺基水杨酸溶液涡旋混合,10 000 r/min离心10 min,上清液加入适量碳粉进行脱色,12 000 r/min离心15 min,上清液过0.22 μm滤膜后用氨基酸分析仪测定。为了比较鉴定出来的FAAs在发酵过程中的呈味情况,根据味道贡献特性,FAAs可分为鲜、甜、苦和无味四类[4],详细分类见表1。
表1 FAAs分类
Table 1 Classification of FAAs
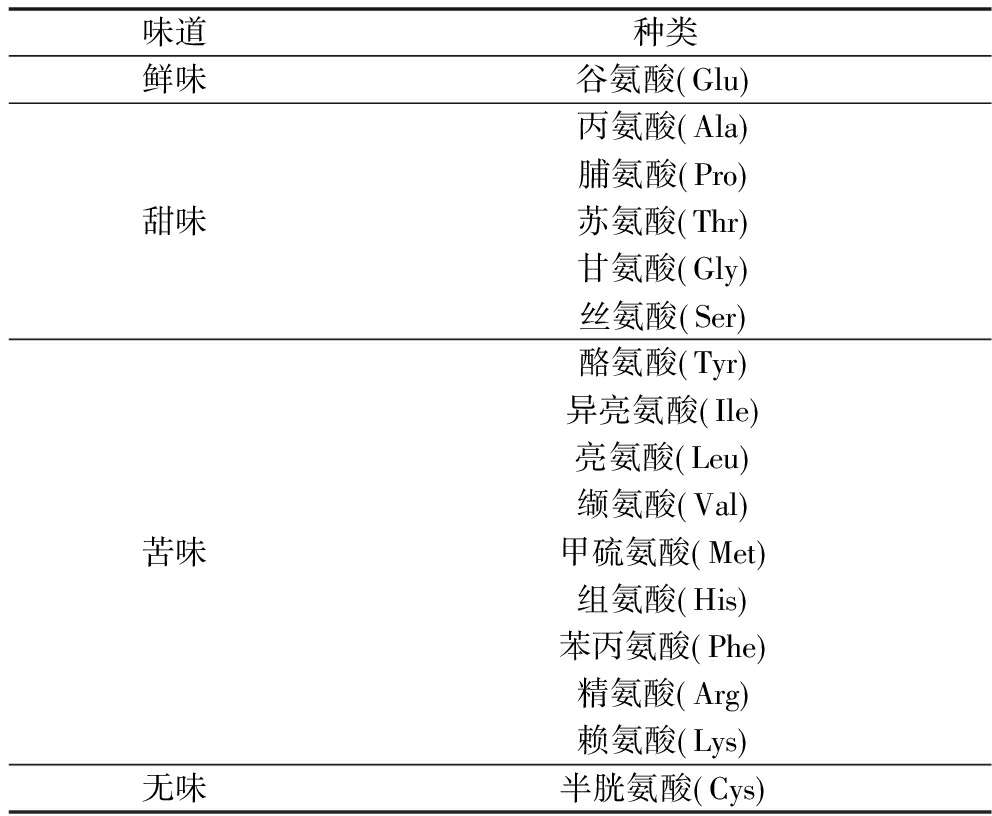
味道种类鲜味谷氨酸 Glu 甜味丙氨酸 Ala 脯氨酸 Pro 苏氨酸 Thr 甘氨酸 Gly 丝氨酸 Ser 苦味酪氨酸 Tyr 异亮氨酸 Ile 亮氨酸 Leu 缬氨酸 Val 甲硫氨酸 Met 组氨酸 His 苯丙氨酸 Phe 精氨酸 Arg 赖氨酸 Lys 无味半胱氨酸 Cys
1.5 FFAs的测定
参考谢艳华等[14]的方法并做适当修改。称取样品后加入正己烷50 ℃振荡120 min催化样品,随后加入等量KOH-无水甲醇溶液在50 ℃振荡2 h得到脂肪酸甲酯,用0.22 μm的滤膜过滤后测定。
色谱条件:DB-WAX色谱柱(30 m×0.25 μm×0.25 μm);进样口温度260 ℃,分流比20∶1;载气He,流速1 mL/min;程序升温:起始温度 80 ℃,保持1 min,然后以5 ℃/min升至200 ℃,保持1 min,最后以10 ℃/min升至230 ℃,保持18 min。
质谱条件:EI离子源,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围为40~400 m/z,间隔0.4 s,阈值100。
1.6 电子鼻分析
称取不同发酵阶段的豆豉样品置于50 mL密封进样瓶中,40 ℃水浴加热40 min后开始检测。PEN3电子鼻运行参数:气体流量0.4 L/min;分析采样时间120 s,时间间隔1 s,清洗时间120 s,传感器归零时间10 s,样品准备时间5 s,操作环境温度26 ℃。传感器检测对应物质种类见表2。
表2 PEN3电子鼻传感器所对应的香气类型
Table 2 Aroma types corresponding to sensors contained in the PEN3 electronic nose
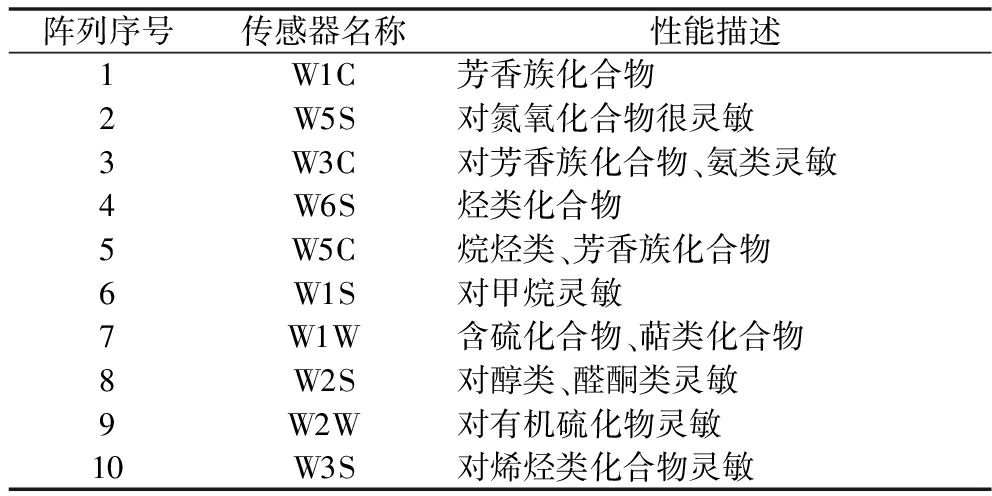
阵列序号传感器名称性能描述1W1C芳香族化合物2W5S对氮氧化合物很灵敏3W3C对芳香族化合物、氨类灵敏4W6S烃类化合物5W5C烷烃类、芳香族化合物6W1S对甲烷灵敏7W1W含硫化合物、萜类化合物8W2S对醇类、醛酮类灵敏9W2W对有机硫化物灵敏10W3S对烯烃类化合物灵敏
1.7 挥发性物质分析
参考LAN等[15]的方法,稍作修改。采用SPME提取豆豉中的挥发性化合物,内标物为1 mg/mL的环己酮。准确称取豆豉,置于顶空瓶中。萃取针在250 ℃下老化15 min,样品在60 ℃的温度下平衡15 min,然后将萃取针插入样品的顶空瓶内进行萃取。萃取温度60 ℃,萃取时间30 min,随后萃取针在250 ℃下解析5 min。
色谱条件:DB-5MS气相色谱柱(30 m×0.25 μm×0.25 μm)。采用非分流进样方式,进样口温度250 ℃,载气He,流速1.5 mL/min。升温程序如下:40 ℃维持3 min,然后以3 ℃/min升至105 ℃,然后以5 ℃/min升至150 ℃,最后以10 ℃/min升至250 ℃并维持15 min。
质谱条件:电离方式EI,电离能量70 eV,离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围40~400 m/z。
1.8 数据处理
所有实验处理和分析均重复3次,结果以“平均值±标准差”表示;采用Origin 2024与SIMCA 13.0绘图;数据处理运用SPSS 27.0软件进行显著性分析。
2 结果与分析
2.1 豆豉发酵过程中FAAs的变化
FAAs对发酵豆豉的风味特征至关重要,它们是微生物生长和代谢的主要氮源,部分蛋白质被枯草芽孢杆菌肽酶和蛋白酶水解形成肽和各种FAAs[16]。氨基酸经脱氨、脱羧等反应后,可形成酸类、醇类、酯类等风味物质[6],进而影响豆豉的风味特性。由图1可知,DC-5、DC-10和DC-15组的FAAs总含量均高于DC-0组,并随着发酵时间的延长,蛋白质不断降解成FAAs,其整体含量一直在逐渐增加。
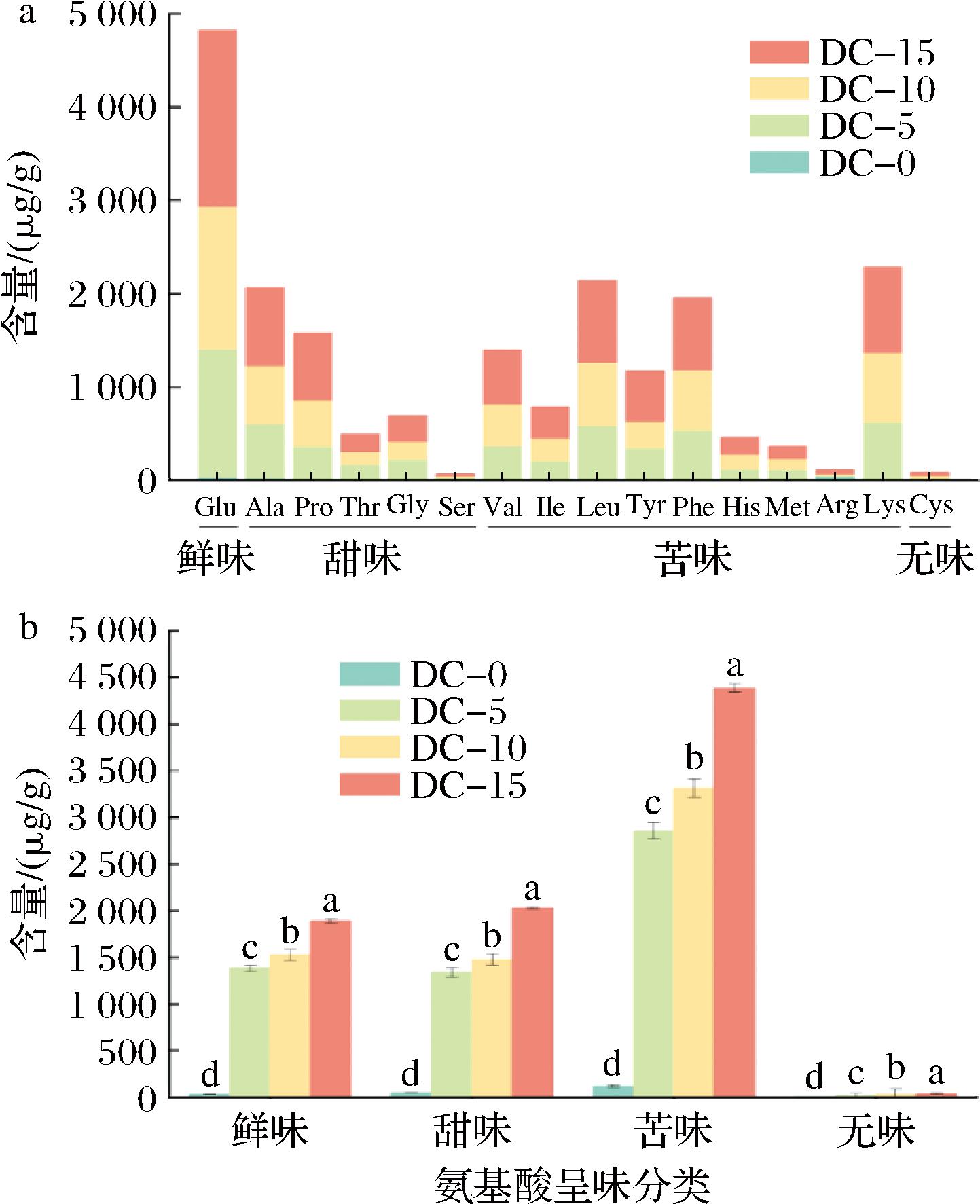
a-组成变化;b-种类的变化
图1 豆豉发酵过程中FAAs组成和种类的变化
Fig.1 Changes in FAAs composition and species during Douchi fermentation
谷氨酸(Glu)是鲜味氨基酸,也是豆豉样品中含量最高的FAA,它在豆豉发酵过程中呈逐渐上升趋势(图1-a),DC-15组的Glu含量为1 887.2 μg/g,是DC-0组的68倍,占DC-15组总FAAs含量的22.6%,这可能与枯草芽孢杆菌T2中谷氨酰胺酶活性较高有关[17]。丙氨酸(Ala)、脯氨酸(Pro)、苏氨酸(Thr)、甘氨酸(Gly)和丝氨酸(Ser)是甜味氨基酸,由图1-a可知,4组发酵豆豉样品的Ala含量均为最高,其次是Pro。在DC-15组,Ala和Pro的含量分别达832.8、716.2 μg/g。此外,甜味氨基酸的总含量在豆豉发酵过程中也呈上升趋势(图1-b)。苦味氨基酸中,赖氨酸(Lys)的含量最高,DC-15组的Lys含量达924.7 μg/g,其次是亮氨酸(Leu)、苯丙氨酸(Phe)、缬氨酸(Val)、酪氨酸(Tyr)、异亮氨酸(Ile)、组氨酸(His)、甲硫氨酸(Met)和精氨酸(Arg),这些FAAs是发酵豆制品中常见的苦味氨基酸[18]。半胱氨酸(Cys)为豆豉样品中的无味氨基酸,其含量较少(37.8 μg/g),在豆豉发酵过程中与鲜味、甜味和苦味氨基酸含量的变化趋势一样,呈现逐渐上升趋势。
总的来看,豆豉发酵15 d后苦味氨基酸的总含量最高,占总FAAs的52.6%,甜味和鲜味氨基酸的总含量相近,分别占总FAAs的24.3%和22.6%,无味氨基酸含量最少。YANG等[10]用枯草芽孢杆菌S2-2菌株作为发酵剂来发酵豆豉,发现甜味氨基酸(37.0%)和苦味氨基酸(23.0%)是豆豉主要的呈味氨基酸。
2.2 豆豉发酵过程中FFAs的变化
FFAs是豆豉风味的重要组分,它们主要在豆豉发酵过程中产生。豆豉发酵过程中,大豆的游离脂肪被微生物合成的脂肪酶降解,生成短链脂肪酸(如醋酸、乳酸、丁酸等)和长链脂肪酸。脂肪酸不仅是豆豉风味的重要组分,还是其他豆豉风味物质的前体物[10]。在豆豉发酵中后期,脂肪酸经过酯化反应,形成具有芳香味的酯类物质。为了全面揭示枯草芽孢杆菌T2对细菌型豆豉风味物质形成的影响规律,对经枯草芽孢杆菌T2发酵豆豉过程中FFAs组成的变化进行了分析。根据碳链中双键的数量和位置,FFAs可分为饱和脂肪酸(saturated fatty acid,SFA)、单不饱和脂肪酸(monounsaturated fatty acid,MUFA)和多不饱和脂肪酸(polyunsaturated fatty acids,PUFA)[10]。由图2可知,在豆豉发酵过程中共检测到10种脂肪酸,其中十五烷酸(C15∶0)、棕榈酸(C16∶0)、二十一烷酸(C21∶0)、山嵛酸(C22∶0)、二十三烷酸(C23∶0)和木蜡酸(C24∶0)是SFA;油酸(C18∶1,n9)和二十碳一烯酸(C20∶1,n9)是MUFA;α-亚麻酸(C18∶3,n3)和亚油酸(C18∶2,n6)是PUFA。从总体来看,在豆豉整个发酵过程中UFA的总相对含量是远高于SFA,且PUFA占主导地位(图2-b)。从FFA单体来看C16∶0、C18∶1,n9、C18∶2,n6和C18∶3,n3是豆豉的主要FFA,它们占据了样品总脂肪酸相对含量的90%以上,与YANG等[10]的研究结果相似。
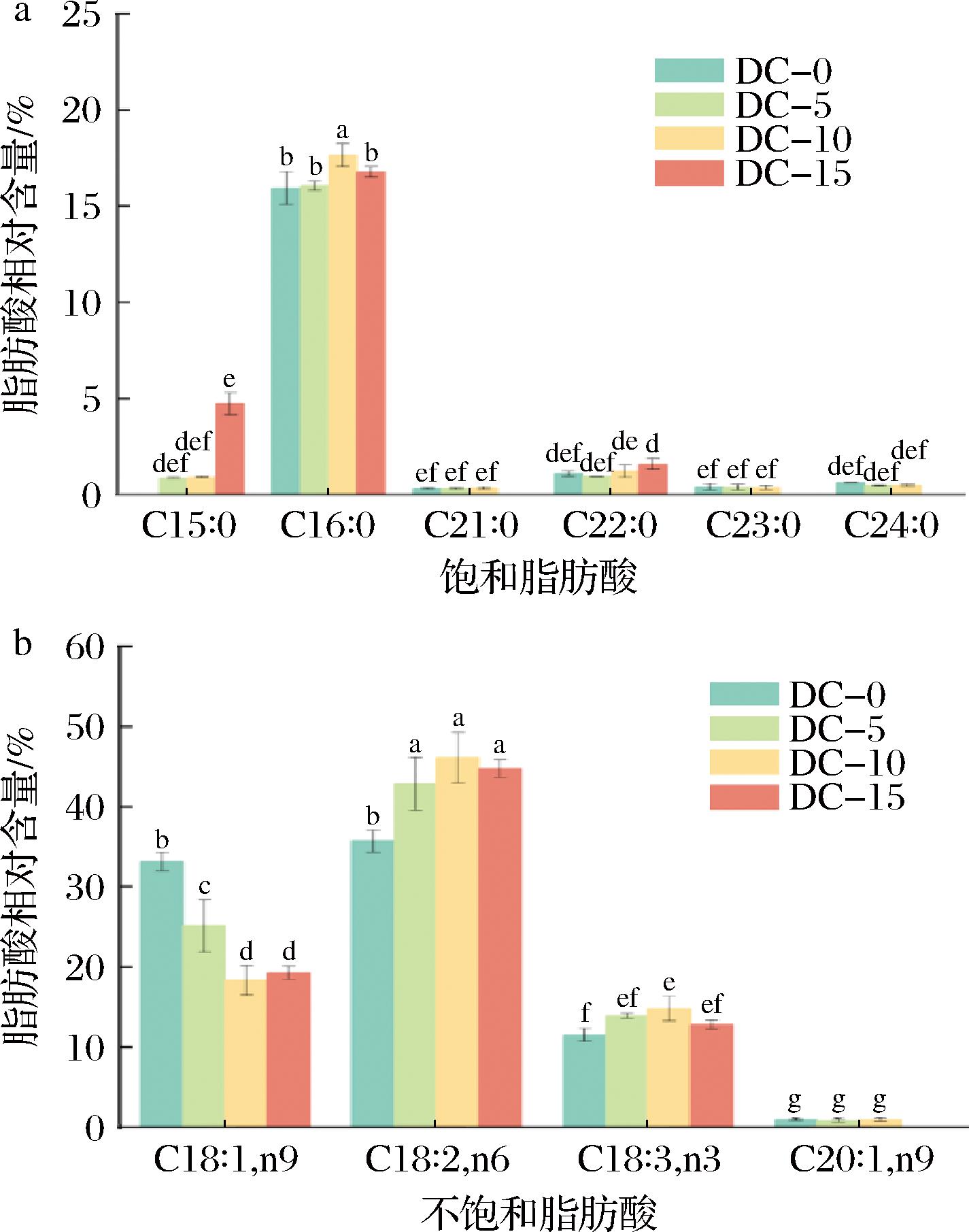
a-SFA;b-UFA
图2 豆豉发酵过程中SFA和UFA组成变化
Fig.2 Changes in the compositions of SFA and UFA during Douchi fermentation
注:不同小写字母代表所有样品之间的显著性差异(P<0.05)。
从SFA来看,C16∶0相对含量最高,DC-10组C16∶0的相对含量显著高于DC-0、DC-5和DC-15组。豆豉发酵后期C16∶0相对含量的下降可能是因为C16∶0被枯草芽孢杆菌T2产生的酶分解所造成的[19]。豆豉发酵过程中C15∶0的相对含量呈上升趋势,DC-15组的C15∶0相对含量显著高于DC-0组,可能是由于部分UFA转化为SFA导致其相对含量增加。DC-0和DC-5组的C22∶0相对含量在DC-15组有所增加。另外C21∶0、C23∶0和C24∶0这些较长的SFA含量在DC-0到DC-10均保持在较低水平,说明豆豉发酵对这些SFA的产生影响较小。
与DC-0组相比,DC-5组的C18∶1,n9相对含量下降6.7%,而DC-5组壬醛的含量升高1.9 μg/100 g。DC-10组和DC-15组的C18∶1,n9相对含量趋于稳定,壬醛的相对含量也再未出现上升趋势。有文献表明,在豆豉发酵过程中,C18∶1,n9会被氧化成多种氢过氧化物,随后被转化为壬醛等醛类物质[20]。C18∶3,n3和C18∶2,n6是营养价值较高的两种PUFA[10],它们在经枯草芽孢杆菌T2发酵的豆豉中也有检出。由图2-b可知,DC-0组的PUFA相对含量是远低于其他3组的,这表明豆豉发酵过程中会产生PUFA。但在发酵后期,豆豉样品中的PUFA相对含量出现下降,这可能与脂肪酶和脂肪氧化酶氧化或降解有关[20]。总体来看,豆豉样品中的UFA相对含量随着发酵时间的增加而增加,说明枯草芽孢杆菌T2发酵豆豉过程中会产生UFA,进而提升豆豉的营养品质。
2.3 豆豉发酵过程中挥发性风味物质的分析
2.3.1 豆豉发酵电子鼻分析
电子鼻作为一种常见的风味分析仪器,常用于检测食品中的挥发性物质。本研究采用了包含10个不同传感器的电子鼻阵列对发酵豆豉样品的挥发性风味物质组成进行了初步分析。由图3-a可知,不同发酵时间的豆豉样品对传感器W5S、W1S、W2S、W1W和W2W均表现出较高的响应值,且随着发酵时间的延长响应值逐渐增长,这表明豆豉经枯草芽孢杆菌T2发酵的过程中大量产生了氮氧化物、甲烷、醇类物质、醛酮类物质及硫化物,形成了豆豉独特的风味特征。随后,对电子鼻数据进行主成分分析(principal component analysis,PCA)以综合分析发酵豆豉各时间点挥发性风味物质组成的差异。如图3-b 所示,PC1和PC2的累积方差贡献率为 91.4%,表明它们能够有效反映不同样本的风味特征信息。DC-15组主要集中在x正半轴区域,而DC-0、DC-5和DC-10组主要集中在在x负半轴区域,说明DC-15组和其他组的挥发性风味物质组成存在显著差异。DC-5和DC-10组在第三象限,而DC-0组在第一象限,因此可以得出结论DC-5和DC-10组的挥发性风味物质组成最为相似。
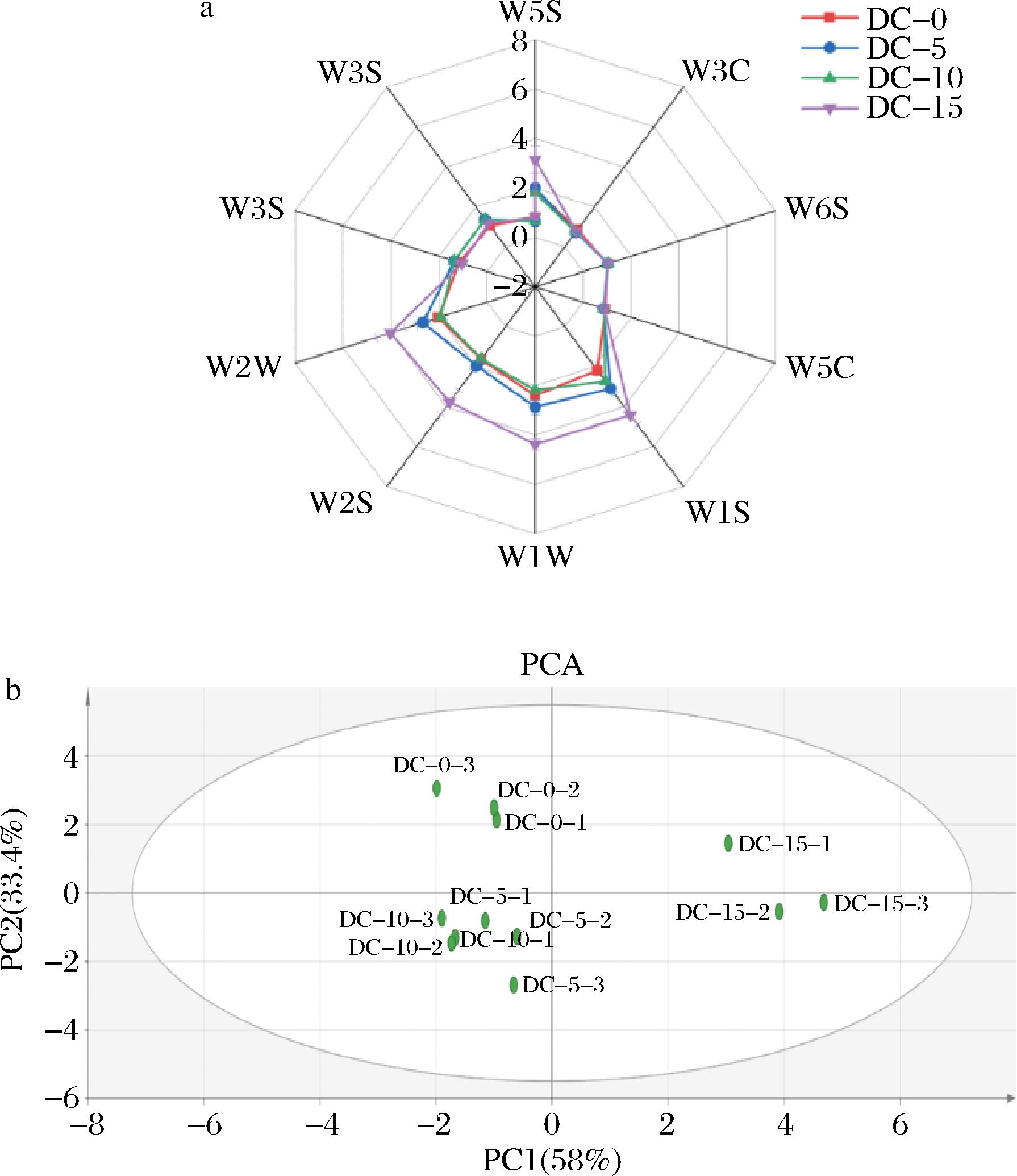
a-雷达图;b-PCA得分图
图3 发酵豆豉电子鼻的雷达图和PCA得分图
Fig.3 Radar map and PCA scoring plot of fermented Douchi
2.3.2 GC-MS分析
为了进一步明确枯草芽孢杆菌T2对发酵过程中挥发性风味的影响,基于GC-MS系统解析了豆豉发酵过程中挥发性风味物质组成的变化。根据挥发性风味物质的峰保留时间和峰面积建立了豆豉不同发酵阶段挥发性物质的总离子流图(图4),峰面积的大小对应风味物质含量的多少。豆豉样品中检测到的挥发性风味化合物的保留时间主要集中在10~25 min 和30~33 min。从图4中可以看出,DC-0组和其他样品组的离子流图存在明显差异,DC-5、DC-10和DC-15组的总离子流图相似,但图4中反映出峰面积之间有差异,这表明不同发酵阶段豆豉样品的挥发性物质组成和含量是存在差异的,需要进一步分析。
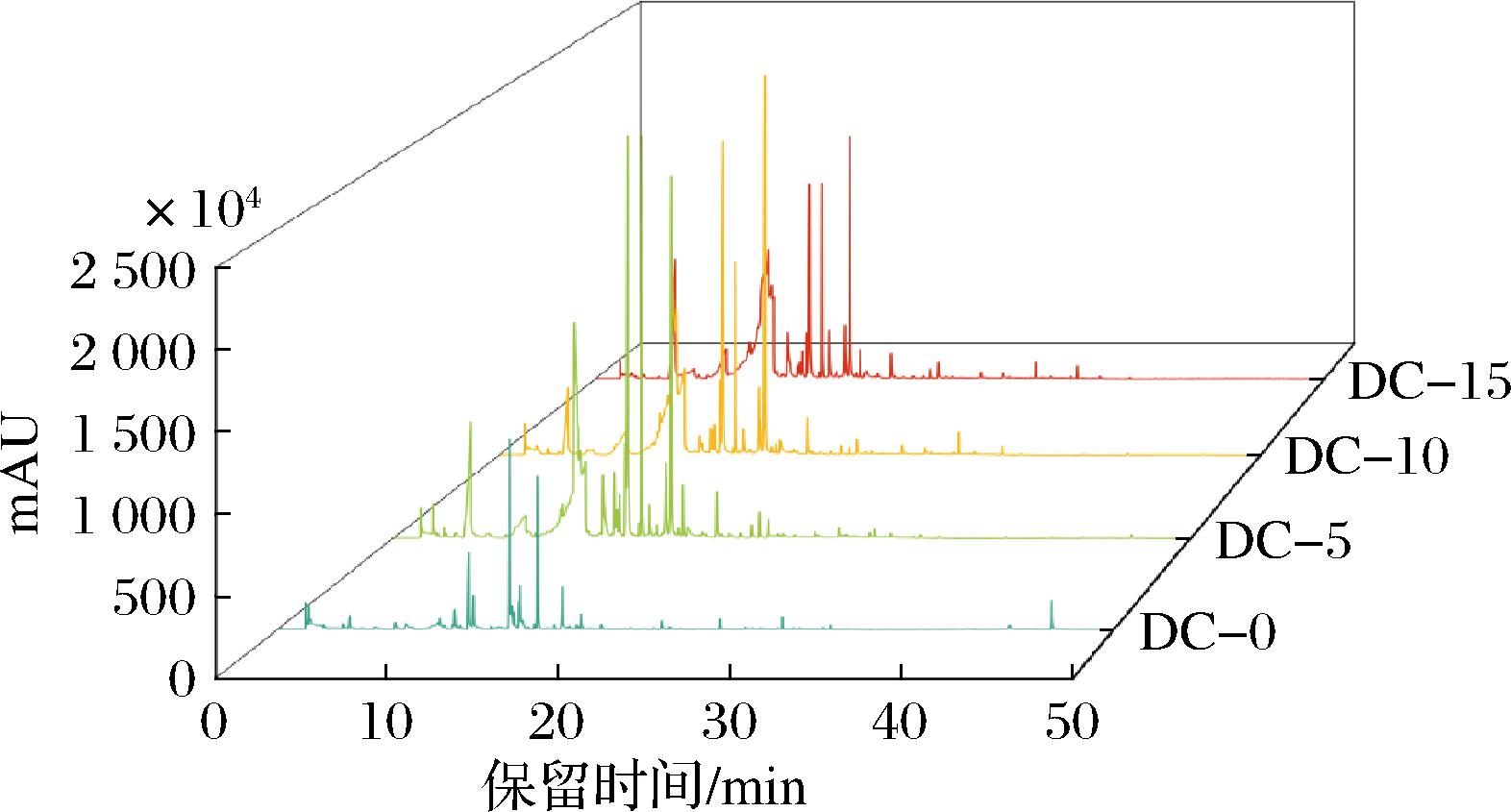
图4 豆豉发酵过程中的挥发性物质的总离子流图
Fig.4 Total ion chromatogram of volatiles during Douchi fermentation
为了深入解析不同发酵阶段豆豉样品挥发性风味物质组成的差异,对各个离子峰进行定性和定量分析。根据表3可以统计得到,豆豉发酵样品种共定性出37个挥发性风味物质,其中醇类化合物4种、醛类化合物7种、酸类化合物3种、吡嗪类化合物7种、烯类化合物2种、呋喃类化合物2种、芳香烃化合物4种和酯类化合物3种。吡嗪类和酸类物质较为丰富,含量较高的化合物是2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、四甲基吡嗪、D-柠檬烯、乙酸、2-甲基丁酸和1-辛烯-3-醇。DC-0、DC-5、DC-10和DC-15组检测到的挥发性风味物质数量分别为20、29、30和29。DC-0组检测到的挥发性风味物质主要为大豆原料蒸煮后存在的成分。与DC-0组相比,DC-5组的挥发性风味物质种类明显增加,主要表现为吡嗪类物质的增加。与DC-5组相比,DC-10和DC-15组的挥发性风味物质种类均有所下降,其中DC-15组的下降较为显著。
表3 豆豉发酵过程中的挥发性风味物质的组成变化
Table 3 Changes of volatile components content in Douchi during fermentation

香气序号保留时间/minCAS号风味成分含量/ μg/100g DC-0DC-5DC-10DC-15VIP值12.8267-66-3三氯甲烷6.5±0.3a4.5±0.4b2.1±0.5c2.7±0.1c0.92423.23590-86-33-甲基丁醛—5.6±0.1a3.3±0.1b6.0±0.1a0.99233.943208-16-02-乙基呋喃12.1±1.2a———0.92045.5264-19-7乙酸—89.1±5.2b87.6±4.1b283.1±8.9a1.04455.83108-88-3甲苯8.4±1.1a2.4±0.1b——0.90267.0766-25-1己醛17.8±1.0a2.7±0.1b——0.90879.0279-31-22-甲基丙酸—42.9±4.5c91.6±5.3b138.1±4.3a0.959810.97111-71-7庚醛7.1±1.7a———0.909911.40123-32-02 5-二甲基吡嗪—495.9±7.1a433.6±5.3b233.9±6.5c1.01251011.7596-48-0丁内酯51.4±4.4a———0.9041112.12116-53-02-甲基丁酸—110.3±3.5b296.8±5.8a326.9±7.1a0.9271213.18100-52-7苯甲醛12.0±0.8d74.0±2.4b21.9±2.2c83.5±0.1a1.1151313.903391-86-41-辛烯-3-醇201.4±5.2a135.6±1.6b114.3±1.9c105.6±3.0d0.9041414.203777-69-32-戊基呋喃25.3±0.6b28.5±0.8a20.5±0.8c26.2±0.2ab1.2221514.48589-98-03-辛醇22.8±1.3a———0.9201614.54123-66-0己酸乙酯50.4±1.0a47.0±0.1ab41.0±0.7b29.3±0.3c0.9731714.7314667-55-12 3 5-三甲基吡嗪—276.8±9.1b334.7±3.53a226.5±8.8c0.9551815.41527-84-4对伞花烃6.5±0.1a7.4±0.6a2.7±1.1c4.7±0.8b1.0421915.575989-27-5D-柠檬烯152.3±3.7b169.1±3.1a77.8±1.6d119.7±6.7c1.082
续表3

香气序号保留时间/minCAS号风味成分含量/ μg/100g DC-0DC-5DC-10DC-15VIP值2015.89100-51-6苯甲醇—5.4±0.6a6.1±0.8a2.5±0.5b1.0472116.08122-78-1苯乙醛2.1±0.3c18.7±0.6b19.7±0.4b46.5±2.0a1.0282216.4813925-05-82-甲基-5-异丙基吡嗪——4.8±0.1a4.0±0.2b1.0072316.5599-85-4γ-松油烯5.9±0.1b7.0±0.6a3.2±0.16c7.2±0.3a1.1342416.8298-86-2苯乙酮——1.9±0.2b4.2±0.2a0.9772517.16713360-65-13-乙基-2 5-二甲基吡嗪——18.4±1.4a16.0±1.3a0.9902617.471124-11-4四甲基吡嗪—207.4±4.7b243.9±8.3a188.1±6.9b0.9362718.19124-19-6壬醛24.9±4.3a26.8±0.8a15.2±1.0b18.3±1.8b0.9382818.6360-12-8苯乙醇———19.9±1.2a1.1592918.82118-71-8麦芽酚—8.4±1.2b9.1±0.2b16.3±0.5a0.9393020.3217398-16-22 3 5-三甲基-6-乙基吡嗪—31.0±2.1a24.9±2.0b23.7±0.3b0.9553121.32101-41-7苯乙酸甲酯—2.3±0.3a1.5±0.2b—1.1213221.8291-20-3萘3.4±0.1b5.7±0.2a3.8±0.2b4.4±0.2b1.0033322.50106-32-1辛酸乙酯3.6±0.8c8.5±0.8a6.5±0.3b4.0±0.2c1.0763423.00112-31-2癸醛15.8±0.8a14.3±0.5a4.5±0.1c8.5±0.2b0.9903524.49101-97-3苯乙酸乙酯—3.1±0.001a1.5±0.5c2.5±0.2b0.9923625.22125186-38-12-乙酰基-3 4 6-三甲基吡嗪—1.1±0.2a0.9±0.4a—1.0793729.8863796-70-1 E -6 10-二甲基-5 9-十一碳二烯-2-酮1.4±0.7b3.6±0.13a1.4±0.7b1.5±0.5b1.010
注:—表示未检出,不同的小写字母代表不同样品之间的显著性差异(P<0.05)。
2,5-二甲基吡嗪、2,3,5-三甲基吡嗪和四甲基吡嗪是发酵豆豉中主要的吡嗪类化合物,通常具有坚果、烘烤、焦香的风味[21]。豆制品发酵过程中吡嗪类物质主要通过发酵剂产生的酶催化而成的,Thr经脱氨和脱羧反应生成氨基丙酮,氨基丙酮再通过脱氢最终形成2,5-二甲基吡嗪。Thr和葡萄糖在酶催化下会生成2,3,5-三甲基吡嗪[22]。豆豉发酵过程中,糖酵解途径将豆豉中的糖类代谢生成乙偶姻,后者与蛋白质降解产生的游离氨或氨基酸经酶促缩合及非酶促环化反应,最终生成四甲基吡嗪[21,23-24]。经枯草芽孢杆菌T2发酵的豆豉中也存在多种吡嗪类物质,其中DC-5组的2,5-二甲基吡嗪最高(495.9 μg/100 g),DC-10组的2,3,5-三甲基吡嗪(334.7 μg/100 g)和四甲基吡嗪(243.9 μg/100 g)含量最高。DAJANTA等[25]以枯草芽孢杆菌发酵剂发酵大豆,也发现2,5-二甲基吡嗪和2,3,5-三甲基吡嗪是发酵样品的主要挥发性风味物质。CHEN等[26]发现经纳豆枯草芽孢杆菌发酵的豆粉在其发酵前中期检测到吡嗪类化合物,且其含量在发酵前中期呈快速上升趋势,这与本研究结果相似。
在豆豉的发酵过程中,乙酸和2-甲基丁酸是两种常见的挥发性有机酸,它们主要通过微生物代谢生成,具有重要的风味和香气特征。KENOG等[17]提到乙酸可能来源于Ala、Gly和Ser。乙酸具有较强的酸味,它能够影响豆豉的整体口感和风味。乙酸在DC-0组未检测到,但在DC-5、DC-10和DC-15组均有检出,且其在发酵过程中总体呈上升趋势。2-甲基丁酸属于支链短链脂肪酸,它主要是通过支链氨基酸降解形成的。豆豉发酵过程中,Val经转氨酶、脱氢酶催化形成2-甲基丁酸[27-28]。2-甲基丁酸的含量在豆豉发酵过程中呈不断上升的趋势,DC-5、DC-10和DC-15组的2-甲基丁酸含量分别为110.3、296.8、326.9 μg/100 g。CHEN等[29]发现2-甲基丁酸与发酵食品中的“汗味”密切相关,因此2-甲基丁酸的存在丰富了豆豉的风味。YANG等[10]也发现乙酸和2-甲基丁酸是豆豉主要的挥发性有机酸。豆豉中的豆腥味来源于醛类化合物,PUFA经过系列催化后被转化为醛类物质,从而产生样品含有豆腥味[30]。己醛对豆腥味贡献最大,DC-0组的己醛含量为17.8 μg/100 g,但己醛在DC-10组中未被检出,表明豆豉样品的豆腥味减弱。枯草芽孢杆菌将大豆中的苯丙氨酸通过酶促反应转化为苯甲醛、苯乙醛和苯乙酮[27],苯甲醛可赋予豆豉焦糖味,苯乙醛则具有蜂蜜香气。与DC-0组相比,DC-5组的苯甲醛和苯乙醛含量分别是之前的6.2倍和8.9倍,但随着发酵时间的增加其含量均呈降低的趋势。
1-辛烯-3-醇通常在植物的代谢或发酵过程中产生,主要通过亚油酸的自氧化和脂氧合酶催化生成,是脂质氧化的标志物[24]。1-辛烯-3-醇具有鲜明的蘑菇香味,被认为是一种典型的“蘑菇味”成分[31],它会增加发酵食品的香气层次。DC-0组的1-辛烯-3-醇含量最高(201.4 μg/g),随着发酵的进行逐渐减少,DC-15组的1-辛烯-3-醇含量为105.6 μg/g,比DC-0组降低了47.6%。1-辛烯-3-醇通常在煮制和蒸煮大豆过程中出现[25],由于本研究所用的大豆经过高温灭菌,因此DC-0组的1-辛烯-3-醇含量最高,而随着发酵的进行可能与其他物质相互作用而逐渐降低。
2.3.3 正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)
本研究采用OPLS-DA方法对不同发酵阶段豆豉的挥发性风味变化进一步区分。图5-a可直观显示不同发酵阶段豆豉挥发性风味物质组成之间的差异,同一组别发酵豆豉之间较为聚集,说明OPLS-DA的拟合程度较好。从图5-a可以看出,DC-0组和DC-5组与其他2组差异明显,但DC-10组和DC-15组二者较为接近,说明DC-10组和DC-15组挥发性风味物质组成差异较小[32]。OPLS-DA中的自变量拟合指数(R2x)为0.968,因变量拟合指数(R2y)为0.994,模型预测指数(Q2)为0.975,表明模型具有良好的可靠性[10],并且样本之间可以区分彼此。在进行OPLS-DA时,模拟200次可以提高模型的可靠性、稳定性。经过200 次排列测试进行模型交叉验证分析,以验证模型的可靠性(图5-b)。R2和Q2的截距分别为0.333和-1.02,R2接近0且Q2的截距<0,符合模型应具有较低随机性的要求,表明模型的拟合不是随机造成的,证明OPLS-DA 模型可靠。根据VIP值,共筛选出16种P值<0.05、VIP>1的挥发性风味物质,其中苯乙醇VIP值最大,为1.159。苯乙醇在DC-15组的含量增加,苯乙醇的来源主要通过Phe代谢和植物次生代谢产物的生物合成,具有植物、玫瑰和蜂蜜的味道[33],对豆豉的风味具有贡献作用。其余VIP值>1的化合物中包括2-戊基呋喃、γ-松油烯、苯甲醛、D-柠檬烯、乙酸、苯乙醛、2,5-二甲基吡嗪等。综上所述,OPLS-DA数据适用于本研究,这种方法不仅能有效区分不同发酵阶段的挥发性化合物,还能确定对区分发酵阶段贡献较大的特征化合物[34]。
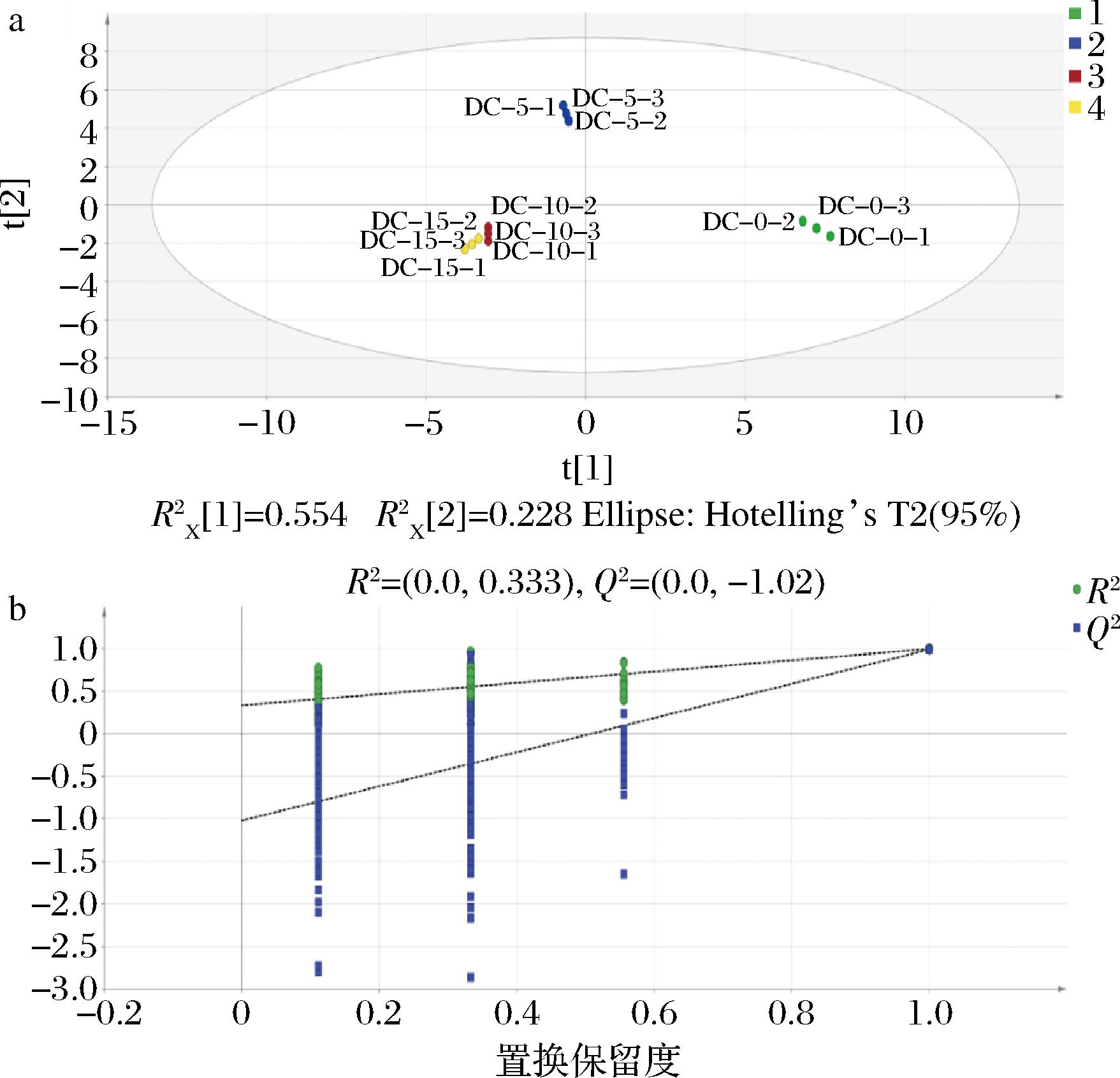
a-OPLS-DA得分图;b-模型置换检验图
图5 豆豉发酵过程中的挥发性物质的OPLS-DA得分图和模型置换检验图
Fig.5 OPLS-DA score plot and permutation test plot of volatiles during Douchi fermentation
2.4 相关性分析
研究各项指标经过标准化处理(Z-score),正值表示物质在对应豆豉发酵天数相对富集,负值表示豆豉发酵时间相对减少。基于Pearson相关系数,聚类热图(图6)展示了枯草芽孢杆菌T2发酵过程中豆豉风味物质(非挥发性物质和挥发性风味物质)与豆豉发酵时间之间的相关性。豆豉发酵过程中,DC-5和DC-10组的风味物质组成较为相似,DC-15组比DC-0组更接近DC-5和DC-10组,这与电子鼻的数据一致。挥发性风味物质主要在发酵的前中期大量产生,而非挥发性物质在整个发酵阶段均呈上升趋势。由于前期枯草芽孢杆菌中的蛋白酶、脂肪酶和淀粉酶等催化蛋白质、脂肪和糖类生成FAAs、FFAs和糖类,随后经过酶促反应、美拉德反应等过程进一步生成吡嗪类、醛类、酯类等挥发性风味物质。随着发酵的进行,由于豆豉中的部分风味物质前体物减少,导致挥发性风味物质的含量也出现下降趋势。发酵后期时吡嗪类、醛类、酯类进一步降低,部分酸类和醇类产生,同时脂肪酸含量也出现降低,进而综合影响豆豉的风味品质。总的来看,发酵10 d时,豆豉的FAAs含量、FFAs的相对含量以及挥发性风味物质的种类和含量均处于较高水平,因此发酵10 d是枯草芽孢杆菌T2发酵豆豉的最佳发酵时间。

图6 豆豉发酵过程中的中挥发性和非挥发性风味物质之间的聚类图
Fig.6 Cluster chart between volatile and non-volatile flavour substances during the fermentation
3 结论
在本研究中,不同发酵阶段豆豉样品的风味物质组成存在明显差异。豆豉发酵过程中,FAAs总含量在整个发酵过程中一直呈上升趋势,苦味、鲜味和甜味FAAs的总含量占总FAAs含量的90%以上。发酵5 d和发酵10 d豆豉样品的风味物质组成相似,它们均含有较高含量的2,5-二甲基吡嗪、2,3,5-三甲基吡嗪、四甲基吡嗪、α-亚麻酸和亚油酸,且这些风味物质的含量在发酵前中期均呈上升趋势。发酵15 d豆豉样品的风味物质种类较少,且部分对豆豉风味贡献较大的挥发性风味物质含量有所下降。发酵10 d是枯草芽孢杆菌T2发酵豆豉的最佳发酵周期,该发酵时间点的豆豉样品中风味物质种类较多,豆豉的整体风味较好。以上研究结果可为酪胺降解菌株-枯草芽孢杆菌T2在豆豉发酵中的应用提供依据。
[1] 王琴.传统豆豉粑产川芎嗪菌株优选及其发酵特性研究[D].贵阳:贵州大学,2023.WANG Q.Study on the screening and fermentation characteristics of tetramethylpyrazine-producing strains in traditional fermented douchiba[D].Guiyang:Guizhou University,2023.
[2] WANG D H,YANG Y P,WANG Z,et al.High levels of branched chain fatty acids in nātto and other Asian fermented foods[J].Food Chemistry,2019,286:428-433.
[3] HU Y L,YU D,WANG Z T,et al.Purification and characterization of a novel,highly potent fibrinolytic enzyme from Bacillus subtilis DC27 screened from Douchi,a traditional Chinese fermented soybean food[J].Scientific Reports,2019,9:9235.
[4] LI A J,YANG G,WANG Z R,et al.Comparative evaluation of commercial Douchi by different molds:Biogenic amines,non-volatile and volatile compounds[J].Food Science and Human Wellness,2024,13(1):434-443.
[5] SJAMSURIDZAL W,KHASANAH M,FEBRIANI R,et al.The effect of the use of commercial tempeh starter on the diversity of Rhizopus tempeh in Indonesia[J].Scientific Reports,2021,11:23932.
[6] 王浩宇.细菌型豆豉的发酵工艺优化及风味品质形成研究[D].重庆:西南大学,2022.WANG H Y.Study on process optimization and flavor quality formation of bacteria fermented Douchi[D].Chongqing:Southwest University,2022.
[7] LIU S J,ZHAO L J,LI M Y,et al.Probiotic Bacillus as fermentation agents:Status,potential insights,and future perspectives[J].Food Chemistry:X,2024,22:101465.
[8] LI Z,ZHENG M Z,ZHENG J S,et al.Bacillus species in food fermentations:An underappreciated group of organisms for safe use in food fermentations[J].Current Opinion in Food Science,2023,50:101007.
[9] JAGUEY-HERN NDEZ Y,AGUILAR-ARTEAGA K,OJEDA-RAMIREZ D,et al.Biogenic amines levels in food processing:Efforts for their control in foodstuffs[J].Food Research International,2021,144:110341.
NDEZ Y,AGUILAR-ARTEAGA K,OJEDA-RAMIREZ D,et al.Biogenic amines levels in food processing:Efforts for their control in foodstuffs[J].Food Research International,2021,144:110341.
[10] YANG P P,WANG Q,YANG Y R,et al.Effects of enhanced fermentation with high-yielding strains of Tetramethylpyrazine on flavor quality of Douchiba[J].Food Chemistry:X,2025,25:102037.
[11] KIM S Y,KIM H E,KIM Y S.The potentials of Bacillus licheniformis strains for inhibition of B.cereus growth and reduction of biogenic amines in cheonggukjang (Korean fermented unsalted soybean paste)[J].Food Control,2017,79:87-93.
[12] CHEN Y T,LUO W S,FU M Q,et al.Effects of selected Bacillus strains on the biogenic amines,bioactive ingredients and antioxidant capacity of Shuidouchi[J].International Journal of Food Microbiology,2023,388:110084.
[13] ZHANG L,CHE Z M,XU W Z,et al.Dynamics of physicochemical factors and microbial communities during ripening fermentation of Pixian Doubanjiang,a typical condiment in Chinese cuisine[J].Food Microbiology,2020,86:103342.
[14] 谢艳华,陈力力,谢靓,等.不同菌种发酵对豆豉游离脂肪酸构成的影响[J].中国酿造,2017,36(3):80-84.XIE Y H,CHEN L L,XIE J,et al.Effect of starter cultures on free fatty acid composition of Douchi[J].China Brewing,2017,36(3):80-84.
[15] LAN L,WANG J X,WANG S Y,et al.Correlation between microbial community succession and flavor substances during fermentation of Yongchuan Douchi[J].Food Bioscience,2023,56:103192.
[16] DU Y L,SHIM S M,WANG L,et al.Impact of Monascus purpureus combined with Lactobacillus plantarum and Saccharomyces cerevisiae fermentation on nutritional and flavor characteristics of Pyropia yezoensis[J].Food Chemistry,2025,472:142973.
[17] KEONG L Y E,TOH M,LU Y Y,et al.Biotransformation of okara (soybean residue) through solid-state fermentation using probiotic Bacillus subtilis and Bacillus coagulans[J].Food Bioscience,2023,55:103056.
[18] GUO Q Y,PENG J B,ZHAO J J,et al.Correlation between microbial communities and volatile flavor compounds in the fermentation of Semen Sojae Praeparatum[J].LWT,2024,198:116009.
[19] SHAO X F,WANG H H,SONG X Y,et al.Effects of different mixed starter cultures on microbial communities,taste and aroma compounds of traditional Chinese fermented sausages[J].Food Chemistry:X,2024,21:101225.
[20] MATHATHEERANAN P,WONGPRASERT T,NA NAN T,et al.Volatile profiles and aroma-active components of Northern Thai fermented soybean (Thua nao) produced from controlled and uncontrolled fermentations[J].International Journal of Gastronomy and Food Science,2023,33:100763.
[21] LARROCHE C,BESSON I,GROS J B.High pyrazine production by Bacillus subtilis in solid substrate fermentation on ground soybeans[J].Process Biochemistry,1999,34(6-7):667-674.
[22] ZHANG L J,CAO Y L,TONG J N,et al.An alkylpyrazine synthesis mechanism involving L-threonine-3-dehydrogenase describes the production of 2,5-dimethylpyrazine and 2,3,5-trimethylpyrazine by Bacillus subtilis[J].Applied and Environmental Microbiology,2019,85(24):e01807-e01819.
[23] WANG S Q,CHANG Y,LIU B,et al.Characterization of the key aroma-active compounds in Yongchuan Douchi (fermented soybean) by application of the sensomics approach[J].Molecules,2021,26(10):3048.
[24] LIU Y,SONG H L,LUO H Z.Correlation between the key aroma compounds and gDNA copies of Bacillus during fermentation and maturation of natto[J].Food Research International,2018,112:175-183.
[25] DAJANTA K,APICHARTSRANGKOON A,CHUKEATIROTE E.Volatile profiles of thua nao,a Thai fermented soy product[J].Food Chemistry,2011,125(2):464-470.
[26] CHEN X F,LU Y L,ZHAO A Q,et al.Quantitative analyses for several nutrients and volatile components during fermentation of soybean by Bacillus subtilis natto[J].Food Chemistry,2022,374:131725.
[27] KAI M.Diversity and distribution of volatile secondary metabolites throughout Bacillus subtilis isolates[J].Frontiers in Microbiology,2020,11:559.
[28] MAOZ I,LEWINSOHN E,GONDA I.Amino acids metabolism as a source for aroma volatiles biosynthesis[J].Current Opinion in Plant Biology,2022,67:102221.
[29] CHEN Z F,WU Y J,TONG S Q,et al.Characterization of the key aroma compounds of soybean flavor in fermented soybeans with Bacillus subtilis BJ3-2 by gene knockout,gas chromatography-olfactometry-mass spectrometry,and aroma addition experiments[J].Fermentation,2024,10(8):409.
[30] WANG B,ZHANG Q,ZHANG N,et al.Insights into formation,detection and removal of the beany flavor in soybean protein[J].Trends in Food Science &Technology,2021,112:336-347.
[31] CHEN Q C,XU Y X,WU P,et al.Aroma impact compounds in Liuyang Douchi,a Chinese traditional fermented soya bean product[J].International Journal of Food Science &Technology,2011,46(9):1823-1829.
[32] 范鑫洋,张香美,刘程鹏,等.酿酒酵母Y-8对发酵香肠品质与风味的影响[J].食品科学,2024,45(7):119-126.FAN X Y,ZHANG X M,LIU C P,et al.Effect of Saccharomyces cerevisiae Y-8 on the quality and flavor of fermented sausages[J].Food Science,2024,45(7):119-126.
[33] KIM J S,PARK S E,KIM E J,et al.Investigation of metabolite differences in green coffee beans fermented with various microbes[J].LWT,2022,172:114202.
[34] ZHANG X R,HUANG X Y,AHETO J H,et al.Comparable analysis of flavor compounds and quality assessment of fermented bean curd using HS-SPME-GC/MS and colorimetric sensor array[J].Food Bioscience,2024,60:104291.