乳酸菌在发酵时利用碳水化合物产生乳酸,降低发酵体系pH值,抑制腐败菌的生长,在发酵工业中发挥重要作用。然而,乳酸菌常温下易失活,需通过冷冻干燥技术来延长保存期[1]。冷冻干燥通过低温冻结,在真空条件下升华除去水分[2],最大限度地保持乳酸菌的生物活性和稳定性,使其在干燥后仍保持较高的存活率,且便于应用和保存运输。但是在冻干时乳酸菌会受到冰晶形成、细胞膜损伤等不利因素的影响[3]。因此,选择合适的冻干保护剂至关重要[4]。
冻干保护剂能够保护乳酸菌在冷冻干燥过程中免受损伤[5],海藻糖在细胞外形成保护层,维持细胞结构的稳定性[6];蔗糖通过提高细胞膜的流动性防止冰晶形成[7];丙三醇和山梨醇可渗透到细胞内部,提高细胞膜的流动性,减少冰晶损伤[8];脱脂乳粉含多种蛋白质和乳糖,在细胞表面形成保护层并提供营养支持[9];但是单一冻干保护剂的保护效果有限,因此实际应用中常采用复配保护剂[10],通过多种机制协同作用,提高乳酸菌的存活率[11]。例如,将糖类和多元醇类保护剂组合使用可在细胞内外形成保护层,维持细胞的结构和功能[12]。有研究表明,添加3% L-谷氨酸钠、5%麦芽糖和5%脱脂牛奶的复合保护剂,使发酵乳杆菌 BLHN3冻干后的活菌数达1.48×1011 CFU/g[13]。
苹果渣是苹果加工的副产物,营养丰富但利用率低,大量堆积造成资源浪费和环境污染[14]。目前,乳酸菌发酵是苹果渣资源化利用的有效途径之一。本研究通过单因素试验和响应面试验从糖类、多元醇类、混合物类冻干保护剂中筛选优化复配冻干保护剂的组合,制备复合乳酸菌冻干菌剂。将其应用于苹果渣发酵中,测定发酵苹果渣的微生物组成和营养物质含量变化,拓展其在食品、饲料、农业等领域的应用。促进乳酸菌和苹果渣资源的高效利用,推动农副产品相关产业的可持续发展。
1 材料与方法
1.1 材料与试剂
乳酸菌:屎肠球菌(Enterococcus faecium)Y-5、罗伊氏粘液乳杆菌(Lactobacillus reuteri)Y-8、副干酪乳酪杆菌(Lacticaseibacillus paracasei)Y-9、植物乳植杆菌(Lactiplantibacillus plantarum)Y-10、嗜酸乳杆菌(Lactobacillus acidophilus)Y-16、副干酪乳酪杆菌(Lacticaseibacillus paracasei)Y-22、植物乳植杆菌(Lactiplantibacillus plantarum)Y-25、发酵粘液乳杆菌(Limosilactobacillus fermentum)Y-29。
试剂:海藻糖、蔗糖、乳糖、丙三醇、山梨醇、甘露醇、脱脂乳粉、酵母浸粉、糊精,上海麦克林生化科技有限公司;MRS液体培养基,北京陆桥技术股份有限公司。
发酵苹果渣基质:苹果渣、豆粕、糖蜜的质量比为6∶3∶1,料液比为1∶2(g∶mL)。
1.2 仪器与设备
D2S2-LC100压力蒸汽灭菌锅,山东新华医疗器械有限公司;SPX-80B电热恒温培养箱,上海坤天实验仪器有限公司;TM3000台式扫描电镜,日立(中国)有限公司;FOSS ANALYTICAL A/S凯氏定氮仪,丹麦福斯仪器分析公司;F800粗纤维测定仪,上海力晶科学仪器有限公司;LGJ-12A真空冷冻干燥机,四环福瑞科仪科技发展有限公司。
1.3 实验方法
1.3.1 乳酸菌生长特性研究
乳酸菌活化后,调节OD600值为0.5,接种至MRS液体培养基中,37 ℃培养24 h,每隔2 h取样,用酶标仪测定OD600值,绘制生长曲线;用pH计测定pH值,绘制产酸曲线。
1.3.2 乳酸菌耐酸能力测定
用1 mol/L的HCl溶液调节MRS液体培养基的初始pH值为3.0、4.0、5.0,接种OD600值为0.5的乳酸菌菌液,用酶标仪测定0、24 h的OD600值,筛选具有耐酸能力的乳酸菌。
1.3.3 复合乳酸菌冻干菌剂工艺流程
筛选出具有耐酸能力的乳酸菌,在MRS液体培养基中37 ℃培养18 h后,调节菌液OD600值为1.5,8 000 r/min离心10 min收集菌泥,按料液比1∶1(g∶mL)加入生理盐水混匀;将3株乳酸菌菌液按照体积比1∶1∶1比例涡旋混匀,再次离心收集菌泥;按照体积比1∶2对照组加入生理盐水(乳酸菌活菌数为8.0×109 CFU/mL),处理组加入冻干保护剂,冷冻干燥后得到复合乳酸菌冻干菌剂。
冻干机条件设置:冷阱温度-60 ℃;预冻阶段,真空度1 000 Pa,时间5 h;主干燥阶段,真空度1~5 Pa,干燥时间24 h;解析干燥阶段,真空度1~5 Pa,干燥时间2 h。
1.3.4 单一冻干保护剂对复合乳酸菌冻干存活率的影响
探究糖类、多元醇类、混合物类冻干保护剂添加量对复合乳酸菌冻干存活率的影响。糖类保护剂种类和添加量(质量分数,下同):蔗糖、乳糖、海藻糖(0%、5%、10%、15%、20%、25%);多元醇类保护剂种类和添加量:丙三醇、山梨醇、甘露醇(0%、2%、4%、6%、8%、10%)、混合物类保护剂种类和添加量:脱脂乳粉、酵母菌粉、糊精(0%、5%、10%、15%、20%、25%)。
冻干存活率按公式(1)计算:
(1)
式中:D,冻干存活率,%;A1,冷冻干燥后活菌数,CFU/mL;A2,冷冻干燥前活菌数,CFU/mL。
1.3.5 响应面法优化复合乳酸菌冻干保护剂配比
运用Box-Behnken中心组合试验设计原理,选择海藻糖、丙三醇和脱脂乳粉3个因素,以冻干存活率为响应值,设计三因素三水平响应面分析试验优化复合乳酸菌冻干保护剂的组合配比。各因素水平编码如表1所示。
表1 响应面试验因素水平表
Table 1 Response surface test factors and levels
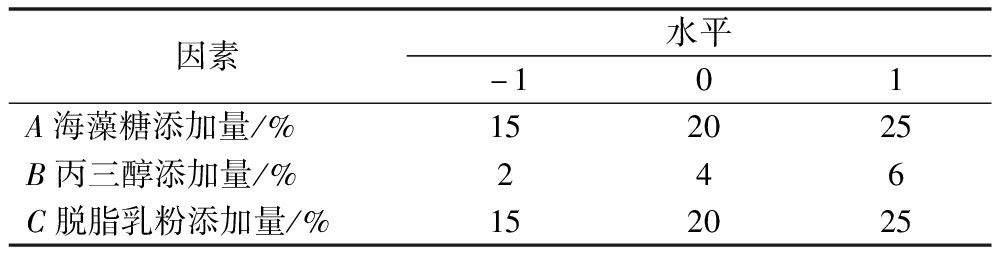
因素水平-101A海藻糖添加量/%152025B丙三醇添加量/%246C脱脂乳粉添加量/%152025
1.3.6 扫描电镜观察复合乳酸菌冻干菌剂形态
复合乳酸菌冻干菌剂用双面胶固定于样品台,在真空喷涂仪内喷金后,使用台式扫描电镜在不同放大倍数和视野中观察样品的微观形态并记录。
1.3.7 复合乳酸菌冻干菌剂在发酵苹果渣中的应用
制备好的复合乳酸菌冻干菌剂按照2 g/100 g添加至苹果渣发酵基质中,在25、37 ℃温度下,测定发酵过程中0~7 d的pH值,判断发酵终点,对发酵结束后的样品进行微生物多样性和营养物质的测定。
1.3.7.1 发酵苹果渣的pH值和活菌数测定
发酵过程中每24 h取样,每次取5 g发酵样品于45 mL无菌水中混匀,静置30 min后取上清液,用pH计测定0~7 d发酵产物的pH值。同时对发酵样品进行梯度稀释,选取合适的稀释梯度在MRS固体培养基上平板涂布37 ℃静置培养48 h,记录乳酸菌的活菌数。
1.3.7.2 发酵苹果渣的微生物多样性分析
采用高通量测序检测发酵样品与未发酵样品中的微生物多样性,比较样品中的微生物群体在门水平和属水平上的丰度差异,探究复合乳酸菌冻干菌剂在苹果渣发酵基质中的生长情况。
1.3.7.3 发酵苹果渣的营养物质测定
水分含量测定参照GB/T 6435—2014《饲料中水分的测定》;粗蛋白含量测定参照GB/T 6432—2018《饲料中粗蛋白的测定 凯氏定氮法》;粗纤维含量测定参照GB/T 6434—2022《饲料中粗纤维的含量测定》;粗脂肪含量测定参照GB/T 6433—2006《饲料中粗脂肪的测定》,分析比较发酵苹果渣中营养物质含量变化。
1.3.8 数据分析
实验数据采用“平均值±标准差”表示,利用Origin 2022和SPSS 26.0软件进行数据处理和方差分析,进行Duncan显著性检验(P<0.05)。
2 结果与分析
2.1 乳酸菌的生长特性研究
生长曲线展示了乳酸菌在培养过程中的生长繁殖动态变化,产酸曲线是乳酸菌在生长过程中培养液中pH值的变化趋势,通过二者可以了解乳酸菌的生长速率和不同生长阶段的特点。由图1-a可知,Y-22的生长启动速度慢,10 h后进入生长对数期,18 h时才进入生长稳定期。其他乳酸菌在4 h后进入生长对数期,14 h时进入生长稳定期,24 h乳酸菌的OD600值为0.99~1.80。MRS液体培养基初始pH值为6.30,随着乳酸菌的生长繁殖,Y-22在8 h后进入快速产酸期,其他菌株在4 h后就进入快速产酸期,pH值迅速下降。Y-16的pH值稳定在4.30;Y-9、Y-10、Y-25的pH值稳定在4.10;Y-5、Y-8、Y-22、Y-29的pH值稳定在4.60。这时营养物质耗尽,繁殖速度下降,产酸速率减缓,OD600值和pH值逐渐平稳。在培养24 h后,培养液中OD600值和pH值的差异是由菌株特性以及代谢产物积累等多种因素共同作用的结果。

a-生长曲线;b-产酸曲线
图1 乳酸菌的生长曲线和产酸曲线
Fig.1 Growth and acid production curves of lactic acid bacteria
2.2 乳酸菌耐酸能力的测定
由表2可知,在初始pH值为5.0的MRS液体培养基中8株乳酸菌均可以生长繁殖,此时pH值处于乳酸菌的适宜生长范围内。随着初始pH值下降为4.0,Y-10和Y-16几乎不生长;初始pH值继续下降至3.0时,Y-9、Y-25、Y-29仍然能生长繁殖,而其他菌株已不能生长。结果表明,这3株乳酸菌具有耐酸能力,其菌体对强酸环境表现出良好的适应性,在极端酸性环境下继续生长繁殖。因此,选择Y-9、Y-25、Y-29菌株进行后续试验。
表2 乳酸菌在不同pH值的MRS液体培养基中0 h和24 h的OD600值
Table 2 OD600 values of lactic acid bacteria at 0 h and 24 h in MRS liquid medium at different pH values

菌株名称pH5.0pH4.0pH3.00h24h0h24h0h24hY-50.085±0.0030.774±0.0090.067±0.0010.177±0.0030.063±0.0020.079±0.001Y-80.083±0.0010.998±0.0050.063±0.0050.277±0.0110.068±0.0030.080±0.003Y-90.085±0.0030.909±0.0100.067±0.0010.654±0.0040.066±0.0040.376±0.002Y-100.081±0.0030.839±0.0230.071±0.0020.096±0.0020.071±0.0020.097±0.002Y-160.087±0.0030.471±0.0020.064±0.0010.082±0.0010.065±0.0010.073±0.002Y-220.084±0.0020.926±0.0040.067±0.0010.484±0.0080.064±0.0040.117±0.002Y-250.081±0.0010.978±0.0060.070±0.0030.500±0.0040.069±0.0010.149±0.006Y-290.086±0.0030.814±0.0130.067±0.0020.894±0.0190.063±0.0020.237±0.001
2.3 单一冻干保护剂对复合乳酸菌冻干存活率的影响
如图2所示,糖类冻干保护剂中的海藻糖,多元醇类冻干保护剂中的丙三醇和混合物类冻干保护剂中的脱脂乳粉保护效果显著优于与其他冻干保护剂。与添加量为0%的对照组相比,海藻糖添加量为15%、20%、25%时,丙三醇添加量为2%、4%、6%时,脱脂乳粉添加量为15%、20%、25%时,显著提高了乳酸菌的冻干存活率。海藻糖属于双糖,具有强大的水合作用,能够与水分子结合,增强抗冷冻脱水能力[15];丙三醇具有亲水性和吸湿性,在冻干过程中保持乳酸菌中的水分,防止其脱水失活[16];脱脂乳粉在细菌体外形成致密的保护膜[17],从而提高复合乳酸菌的冻干存活率。
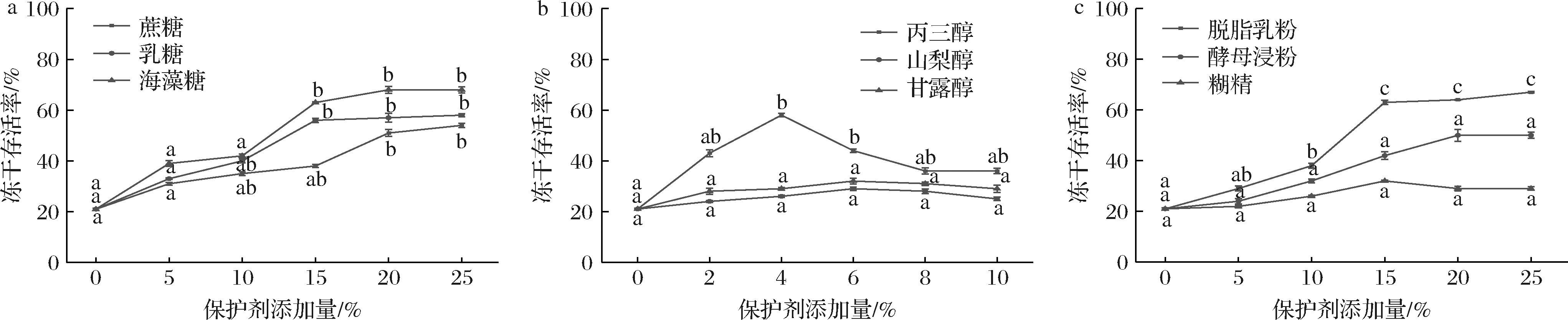
a-糖类;b-多元醇类;c-混合物类
图2 冻干保护剂对复合乳酸菌冻干存活率的影响
Fig.2 Effect of freeze-drying protectants on the freeze-drying survival of lactic acid bacteria complexes
2.4 响应面法优化复合乳酸菌冻干保护剂的配比
2.4.1 响应面结果及方差分析
复配冻干保护剂响应面设计与结果分析如表3所示。以冻干存活率为响应值,利用 Design Expert 12 软件对试验结果进行整理分析,得到二次多元回归模型为:冻干存活率(Y)=0.87+0.011A+0.025B+0.004C-0.003AB-0.025AC+0.028BC-0.064A2-0.071B2-0.024C2。
表3 响应面设计方案及结果
Table 3 Response surface design program and results
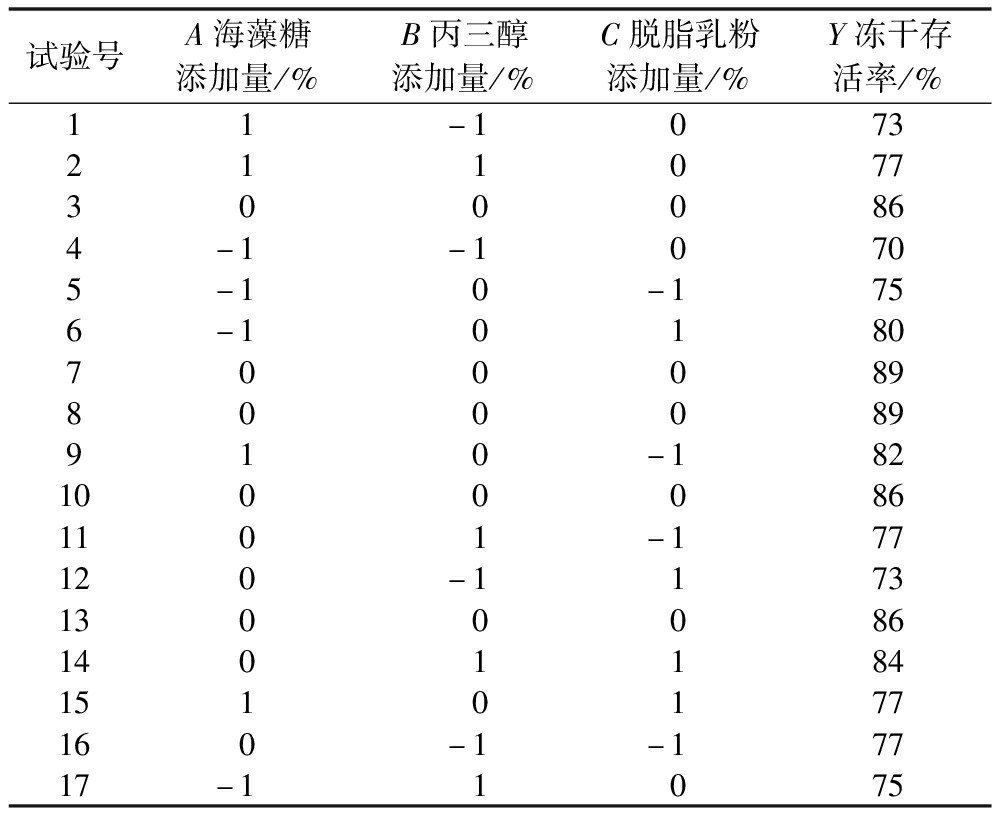
试验号A海藻糖添加量/%B丙三醇添加量/%C脱脂乳粉添加量/%Y冻干存活率/%11-10732110773000864-1-10705-10-1756-10180700089800089910-18210000861101-177120-1173130008614011841510177160-1-17717-11075
回归模型的方差分析结果如表4所示。由方差分析可知,回归模型极显著(P<0.000 1),失拟项不显著(P=0.880 7>0.05),相关系数R2=0.978 1,矫正系数![]() 说明该模型可靠,能较好的预测复配冻干保护剂对复合乳酸菌冻干存活率的影响。结果表明影响复合乳酸菌冻干存活率的3个因素的顺序为丙三醇添加量>海藻糖添加量>脱脂乳粉添加量。
说明该模型可靠,能较好的预测复配冻干保护剂对复合乳酸菌冻干存活率的影响。结果表明影响复合乳酸菌冻干存活率的3个因素的顺序为丙三醇添加量>海藻糖添加量>脱脂乳粉添加量。
表4 回归模型方差分析
Table 4 Analysis of variance for regression model
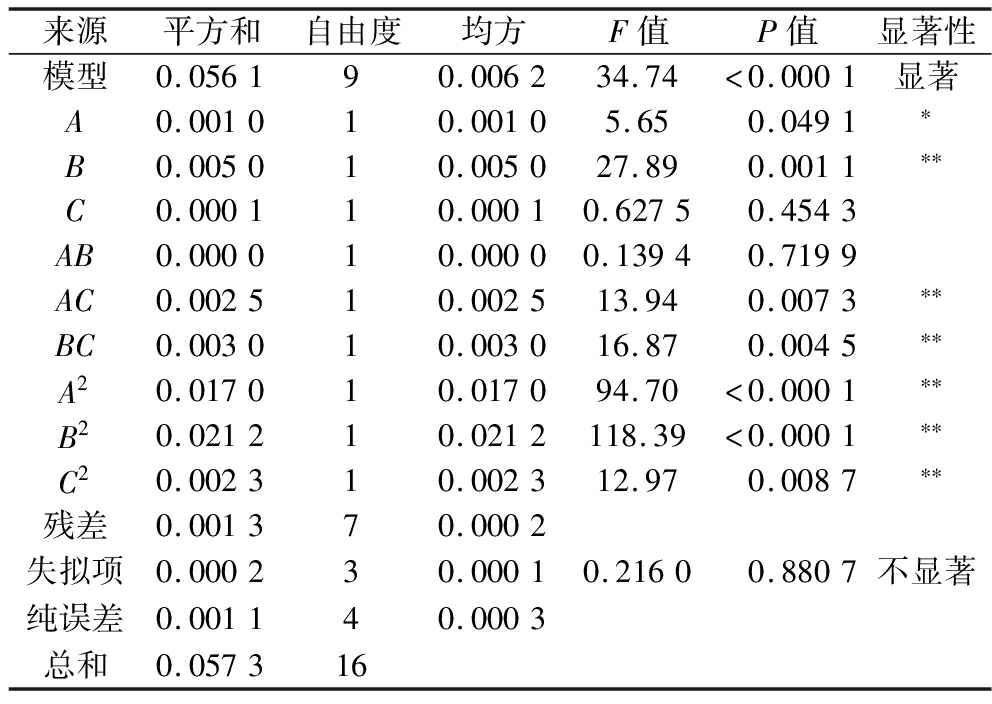
来源平方和自由度均方F值P值显著性模型0.056190.006234.74<0.0001显著A0.001010.00105.650.0491∗B0.005010.005027.890.0011∗∗C0.000110.00010.62750.4543AB0.000010.00000.13940.7199AC0.002510.002513.940.0073∗∗BC0.003010.003016.870.0045∗∗A20.017010.017094.70<0.0001∗∗B20.021210.0212118.39<0.0001∗∗C20.002310.002312.970.0087∗∗残差0.001370.0002失拟项0.000230.00010.21600.8807不显著纯误差0.001140.0003总和0.057316
注:P<0.01为极显著,用**表示;P<0.05为显著,用*表示。
2.4.2 等高线图和曲面图
二维等高线图和三维曲面图反映出海藻糖添加量、丙三醇添加量和脱脂乳粉添加量三因素之间的两两交互作用对复合乳酸菌冻干存活率的影响。若等高线是圆形,则表示两因素间交互作用不显著;若为椭圆形,则表示两因素间交互作用显著。
由图3可知,海藻糖添加量一定时,冻干存活率随着丙三醇添加量的增加先升高后降低,等高线为圆形,说明海藻糖添加量和丙三醇添加量之间交互作用不显著(P>0.05)。海藻糖添加量、丙三醇添加量一定时,冻干存活率随着脱脂乳粉添加量的增加先升高后降低,等高线为椭圆形,表明海藻糖添加量和脱脂乳粉添加量、丙三醇添加量和脱脂乳粉添加之间交互作用显著。
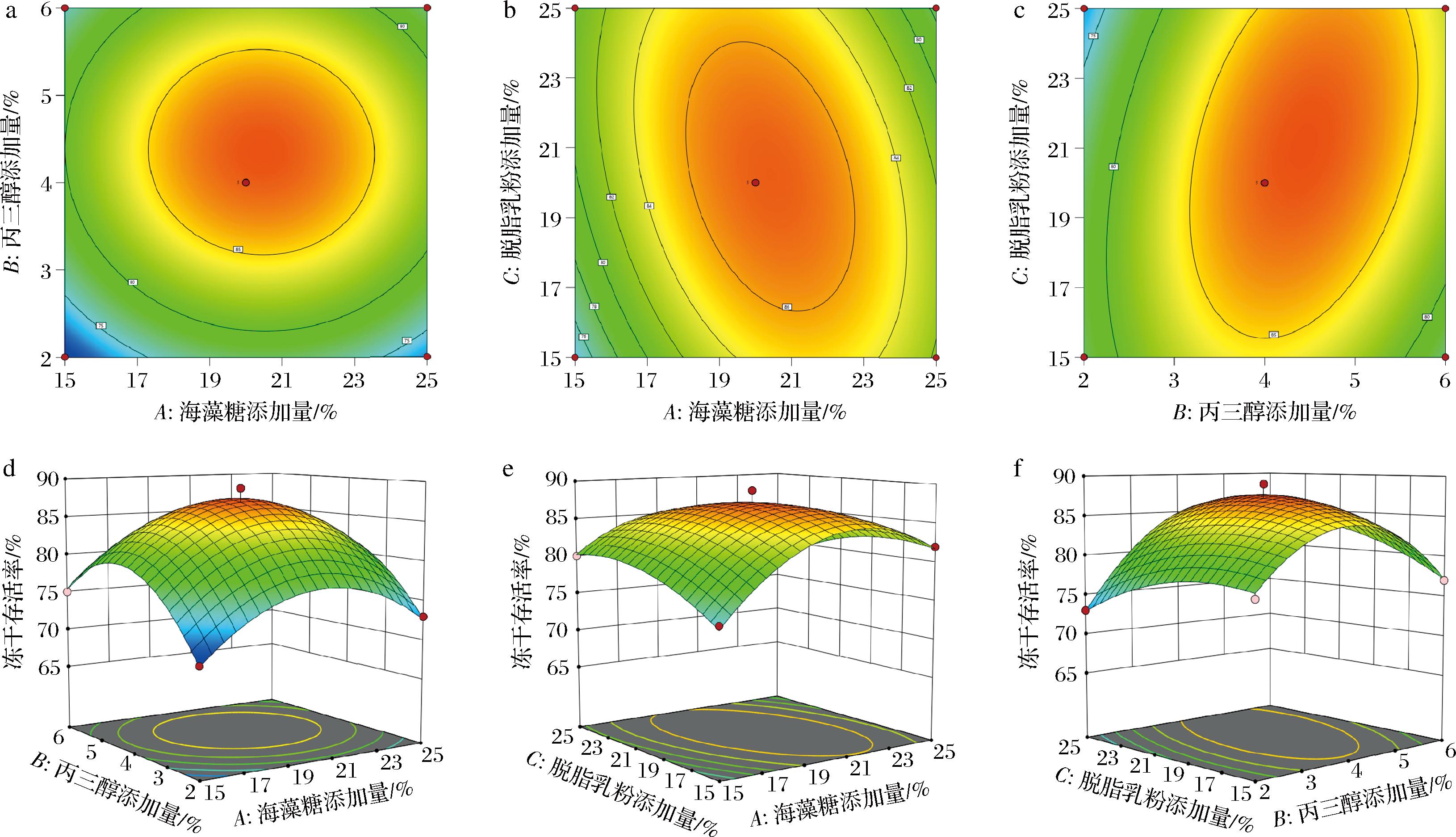
a-海藻糖-丙三醇添加量对冻干存活率的等高线图;b-海藻糖-脱脂乳粉添加量对冻干存活率的等高线图;c-丙三醇-脱脂乳粉添加量对冻干存活率的等高线图;d-海藻糖-丙三醇添加量对冻干存活率的响应面图;e-海藻糖-脱脂乳粉添加量对冻干存活率的响应面图;f-丙三醇-脱脂乳粉添加量对冻干存活率的响应面图
图3 各因素间交互作用的等高线图和三维曲面图
Fig.3 Contour maps and three-dimensional surface maps of interactions between factors
2.4.3 回归模型验证试验
回归模型优化得到的冻干保护剂的最优配比为:海藻糖添加量20.2%,丙三醇添加量4.4%,脱脂乳粉添加量20.8%,预测冻干存活率理论值为87.5%。验证试验结果表明菌剂中乳酸菌的冻干存活率达到89%,证明此模型可靠有效,此复配冻干保护剂对乳酸菌起到很好的保护效果。
2.5 扫描电镜观察复合乳酸菌冻干菌剂微观结构
如图4所示,添加生理盐水的对照组中乳酸菌疏松多孔,细菌皱缩,表面粗糙,没有完整的保护屏障;添加复配保护剂的处理组中复配保护剂将乳酸菌菌体包裹,形成致密光滑的保护膜,表面平整,结构稳定。表明添加复配保护剂有效减少了低温和冷冻干燥环境对乳酸菌菌体造成的破坏,在冻干时起到较好的保护效果,提高了复合乳酸菌的冻干存活率。然而,关于复配保护剂在保护层厚度的定量分析和分子水平上的保护机制,仍需进一步深入研究。

a-添加生理盐水(2 000×);b-添加生理盐水(5 000×);c-添加生理盐水(8 000×);d-添加复配保护剂(2 000×);e-添加复配保护剂(5 000×);f-添加复配保护剂(8 000×)
图4 复合乳酸菌冻干菌剂扫描电镜图
Fig.4 Scanning electron microscopy of freeze-dried lactic acid bacteria complexes
2.6 复合乳酸菌冻干菌剂在发酵苹果渣中的应用
2.6.1 发酵苹果渣的pH值和活菌数的测定
如图5-a所示,添加复合乳酸菌冻干菌剂后,25 ℃ 与37 ℃条件下发酵样品的pH值相差较大,均在发酵1~4 d呈现出下降趋势,第4天之后pH值趋于稳定。25 ℃和37 ℃发酵温度下样品pH值分别下降至3.66和3.37,显著低于未发酵样品。不同发酵温度下pH值的差异,可能是在25 ℃条件下,部分乳酸菌的生物活性降低,生长受到抑制所导致的。如图5-b所示,25与37 ℃条件下发酵苹果渣中乳酸菌的活菌数呈现先升高后下降的趋势,在发酵第4天达到峰值,分别为(8.60±0.10)、(8.69±0.02)lg CFU/g,显著高于第0天的活菌数[(7.48±0.12)lg CFU/g]。因此,选择苹果渣基质的发酵时间为4 d。
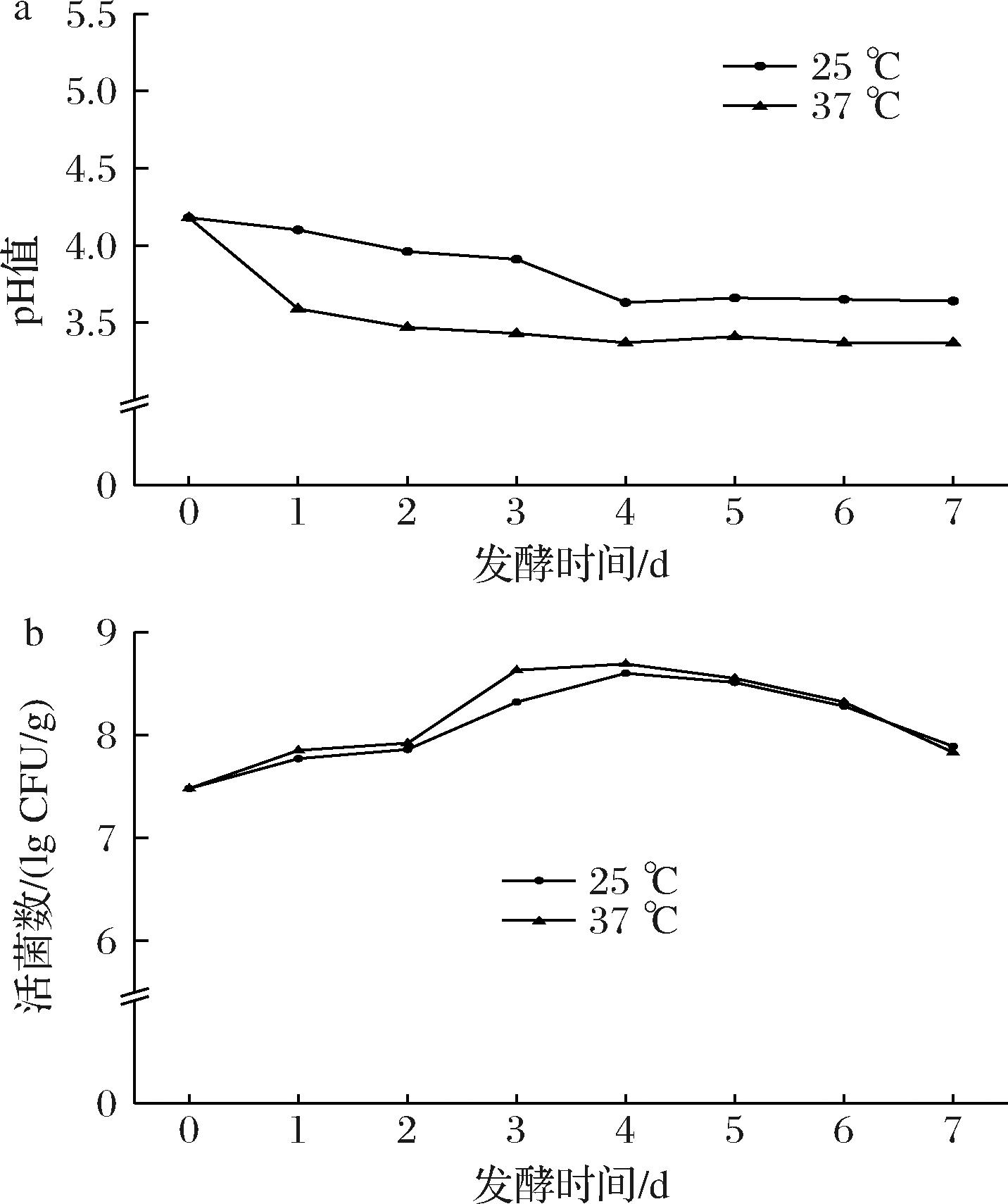
a-pH值;b-活菌数
图5 发酵苹果渣0~7 d的pH值和活菌数
Fig.5 The pH value and number of viable bacteria for fermented apple pomace for 0-7 days
2.6.2 发酵苹果渣的微生物多样性分析
不同温度下发酵第4天样品与未发酵的样品在门水平和属水平上分析前十细菌群落结构分布,结果表明发酵样品中各菌属的丰度发生了明显变化。如图6所示,在门水平上,未发酵(CON)组中优势菌群为蓝藻门(Cyanobacteria)和变形菌门(Proteobacteria),相对丰度分别为76%和23%。25 ℃和37 ℃发酵组中,优势菌群演变为厚壁菌门(Firmicutes),相对丰度分别为89%和95%,显著高于CON组(0.12%);同时抑制了蓝藻门(Cyanobacteria)和变形菌门(Proteobacteria)的增殖。在属水平上,与CON组相比,25 ℃发酵组中粘液乳杆菌属(Limosilactobacillus,丰度为64%)、乳酪杆菌属(Lacticaseibacillus,15%)、乳植杆菌属(Lactiplantibacillus,10%)的丰度显著升高,粘液乳杆菌增殖为优势菌群;37 ℃发酵组中粘液乳杆菌属(Limosilactobacillus,35%)、乳酪杆菌属(Lacticaseibacillus,38%)、乳植杆菌属(Lactiplantibacillus,22%)的丰度显著升高,乳酪乳杆菌属和粘液乳杆菌属为优势菌群。这一结果表明乳酸由于自身代谢特性的差异,根据发酵温度对底物中营养物质进行竞争和高效利用,实现快速增殖并占据优势地位,同时抑制蓝藻门和变形菌门的生长[18]。这种抑制作用不仅减少了潜在致病菌和腐败菌的滋生,还提高发酵苹果渣的品质[19]。
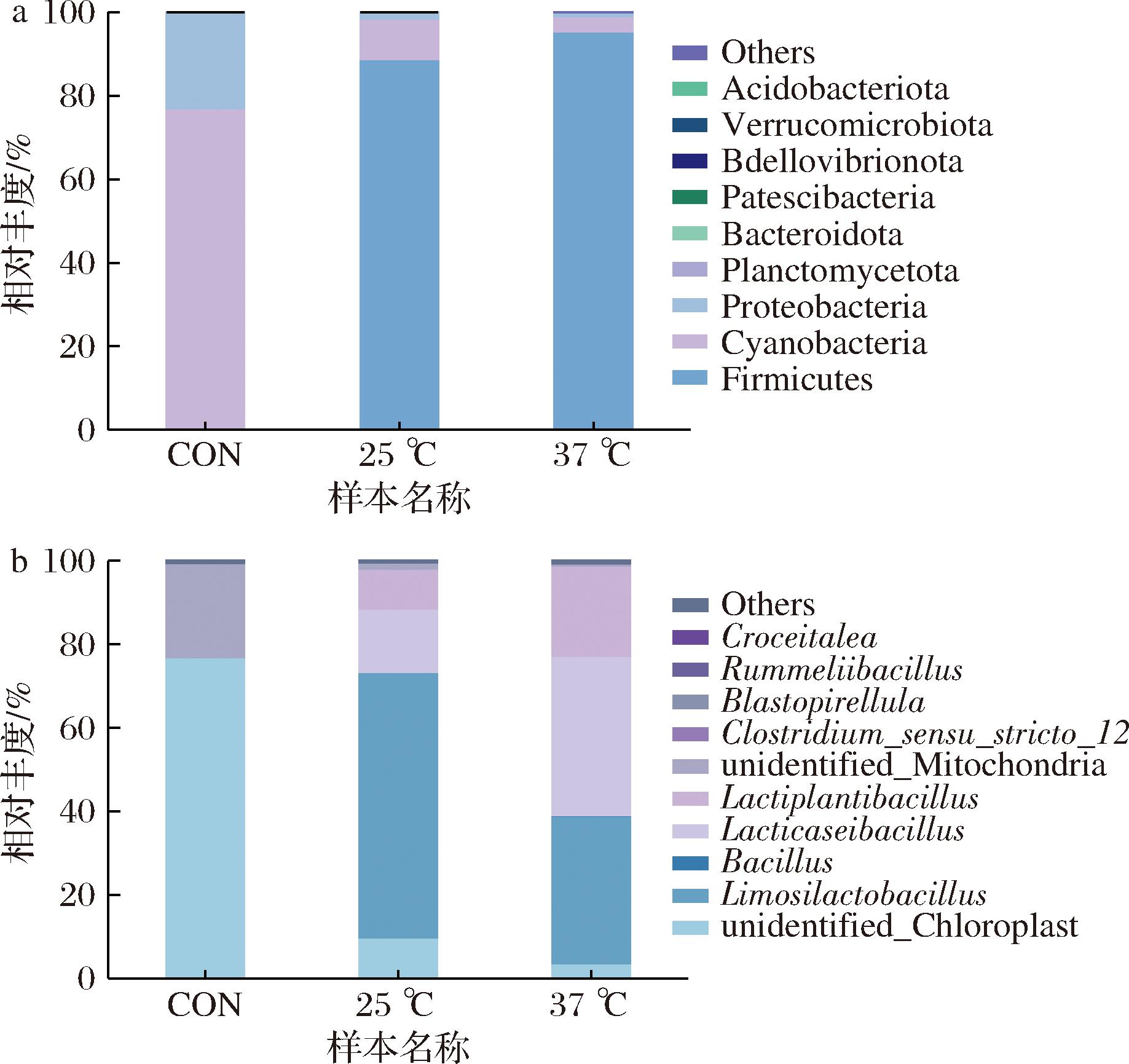
a-门水平;b-属水平
图6 门水平和属水平上不同样品的菌群相对丰度
Fig.6 Relative abundance of flora in different samples at the phylum and genus level
2.6.3 发酵苹果渣的营养物质测定
由表5可知,与CON相比,25 ℃和37 ℃发酵样品的水分含量显著下降,由于乳酸菌在发酵过程中的生长繁殖消耗水分,以及发酵时部分水分自然蒸发导致的。粗纤维含量显著下降,发酵过程中产生了酶,将粗纤维分解为小分子的糖类和其他有机酸,同时乳酸菌发酵产生的有机酸降低了发酵环境的pH值,进一步促进粗纤维的降解。粗蛋白含量显著上升,可能是发酵过程促进了大分子的蛋白质向小分子蛋白和肽类的转化,提高了粗蛋白的含量。粗脂肪含量无显著变化,可能由于冻干菌剂中乳酸菌不具备产脂肪酶的能力,在发酵时主要以碳水化合物为能量来源,集中于对糖类物质的代谢,对脂肪的代谢能力较弱导致的。
表5 营养物质测定结果 单位:%
Table 5 Nutrients measurement results

指标CON25℃37℃水分59.10±0.0226a52.02±0.0088b53.44±0.0078b粗纤维27.22±0.0113a18.17±0.0114b17.11±0.0106b粗蛋白21.19±0.0060a21.26±0.0040b23.15±0.0031b粗脂肪1.37±0.0044a1.03±0.0020a1.28±0.0008a
注:不同小写字母表示显著性差异(P<0.05)。
3 结论
本文首先制备了具有高活性的植物乳植杆菌、副干酪乳酪杆菌和发酵粘液乳杆菌的复合乳酸菌冻干菌剂,其次探究了其在发酵苹果渣中的应用效果。通过单因素和响应面试验筛选优化保护效果好的冻干保护剂组合。结果表明,在复配保护剂组合为20.2%海藻糖、4.4%丙三醇、20.8%脱脂乳粉时进行冷冻干燥,在冻干过程中复配保护剂形成光滑致密的保护层,将乳酸菌包裹在其中提高了冻干存活率,得到的冻干菌剂中活菌数达到2.0×109 CFU/g,冻干存活率达到89%。后续还需进一步从分子层面揭示复配冻干保护剂在冻干过程中对乳酸菌的保护机制。将制备好的冻干菌剂添加到苹果渣发酵基质中,植物乳植杆菌、副干酪乳酪杆菌和发酵粘液乳杆菌能够充分利用苹果渣基质中的营养物质生长繁殖,在25 ℃和37 ℃的发酵温度下演变成为优势菌群,同时降低发酵基质的pH值,抑制腐败菌的生长;显著降低粗纤维含量至18.17%和17.11%;显著提高粗蛋白含量至21.26%和23.15%,有效改善苹果渣基质中的营养成分。综上所述,本研究可以为制备高活性复合乳酸菌冻干菌剂及其在发酵苹果渣中的应用提供理论依据。
[1] CHEN P,TAN W,CHENG H,et al.The protective effect of freezing temperatures on different lactic acid bacteria and its mechanism[J].LWT,2025,215:117226.
[2] PERALTA G H,BERET V,BÜRGI M,et al.Impact of media culture,freeze-drying and storage conditions on preservation of Lacticaseibacillus paracasei 90:Viability and metabolic potential as a secondary culture in semi-hard cheese[J].International Dairy Journal,2023,147:105763.
[3] LIU L,XIE S S,ZHU Y D,et al.Sodium carboxymethyl celluloses as a cryoprotectant for survival improvement of lactic acid bacterial strains subjected to freeze-drying[J].International Journal of Biological Macromolecules,2024,260:129468
[4] NGUYEN T H,KIM J S,KWON H J,et al.The effect of a glutathione (GSH)-containing cryo-protectant on the viability of probiotic cells using a freeze-drying process[J].Fermentation,2023,9(2):187.
[5] WANG H Q,HUANG T,LIU K L,et al.Protective effects of whey protein hydrolysate on Bifidobacterium animalis ssp.lactis Probio-M8 during freeze-drying and storage[J].Journal of Dairy Science,2022,105(9):7308-7321.
[6] MAJIDZADEH HERAVI R,GHIASVAND M,REZAEI E,et al.Assessing the viability of three Lactobacillus bacterial species protected in the cryoprotectants containing whey and maltodextrin during freeze-drying process[J].Letters in Applied Microbiology,2022,74(4):505-512.
[7] STEFANELLO R F,NABESHIMA E H,IAMANAKA B T,et al.Survival and stability of Lactobacillus fermentum and Wickerhamomyces anomalus strains upon lyophilisation with different cryoprotectant agents[J].Food Research International,2019,115:90-94.
[8] MA W L,LI Y H,KANG W L,et al.Synergistic combination of cryoprotectants improved freeze-dried survival rate and viable counts of Lactiplantibacillus plantarum[J].International Journal of Dairy Technology,2024,77(2):348-357.
[9] ROMYASAMIT C,SAENGSUWAN P,BOONSERM P,et al.Optimization of cryoprotectants for freeze-dried potential probiotic Enterococcus faecalis and evaluation of its storage stability[J].Drying Technology,2022,40(11):2283-2292.
[10] WANG G Q,LUO L Y,DONG C,et al.Polysaccharides can improve the survival of Lactiplantibacillus plantarum subjected to freeze-drying[J].Journal of Dairy Science,2021,104(3):2606-2614.
[11] TIAN Y,HE Z Y,HE L P,et al.Effect of freeze-dried protectants on the survival rate and fermentation performance of fermented milk’s directed vat set starters[J].Cryobiology,2024,114:104811.
[12] GUL L B,CON A H,GUL O.Storage stability and sourdough acidification kinetic of freeze-dried Lactobacillus curvatus N19 under optimized cryoprotectant formulation[J].Cryobiology,2020,96:122-129.
[13] 左梦楠,刘伟,全琦,等.保护剂对发酵乳杆菌BLHN3冻干存活率的影响[J].中国食品学报,2024,24(8):178-186.ZUO M N,LIU W,QUAN Q,et al.Effects of cryoprotectant to freeze-dried survival rate of Lactobacillus fermentum BLHN3[J].Journal of Chinese Institute of Food Science and Technology,2024,24(8):178-186.
[14] ZHANG F,WANG T,WANG X,et al.Apple pomace as a potential valuable resource for full-components utilization:A review[J].Journal of Cleaner Production,2021,329:129676.
[15] CHENG Z Y,YAN X,WU J Y,et al.Effects of freeze drying in complex lyoprotectants on the survival,and membrane fatty acid composition of Lactobacillus plantarum L1 and Lactobacillus fermentum L2[J].Cryobiology,2022,105:1-9.
[16] KARUNNANITHY V,ABDUL RAHMAN N H B,ABDULLAH N A H,et al.Effectiveness of lyoprotectants in protein stabilization during lyophilization[J].Pharmaceutics,2024,16(10):1346.
[17] LI X M,CHE L H,WU Y,et al.An effective strategy for improving the freeze-drying survival rate of Lactobacillus curvatus and its potential protective mechanism[J].Food Bioscience,2024,58:103794.
[18] 汤佩芬,李三要.水稻秸秆发酵饲料中微生物群落结构与功能分析[J].中国饲料,2023(16):81-84.TANG P F,LI S Y.Analysis of microbial community structure and function in rice straw fermented feed[J].China Feed,2023(16):81-84.
[19] 何家俊,赵国强,李莉,等.纤维素酶对玉米秸秆与酒糟混合青贮营养成分、发酵品质、瘤胃体外降解率及微生物多样性的影响[J].动物营养学报,2023,35(5):3190-3200.HE J J,ZHAO G Q,LI L,et al.Effects of cellulase on nutrients,fermentation quality,rumen degradation rate in vitro and microbial diversity of mixed silage of corn straw and distiller’s grains[J].Chinese Journal of Animal Nutrition,2023,35(5):3190-3200.
[20] BODZEN A,JOSSIER A,DUPONT S,et al.Design of a new lyoprotectant increasing freeze-dried Lactobacillus strain survival to long-term storage[J].BMC Biotechnology,2021,21(1):66.
[21] DI L J,MA W L,KANG W L,et al.Synergistic combination of cryoprotectants for high freeze-dried survival rate and viable cell counts of Streptococcus thermophilus[J].Drying Technology,2023,41(9):1444-1453.
[22] YUSTE A,AROSEMENA E L,CALVO M  .Study of the probiotic potential and evaluation of the survival rate of Lactiplantibacillus plantarum lyophilized as a function of cryoprotectant[J].Scientific Reports,2021,11:19078.
.Study of the probiotic potential and evaluation of the survival rate of Lactiplantibacillus plantarum lyophilized as a function of cryoprotectant[J].Scientific Reports,2021,11:19078.
[23] LEE J,JI Y R,CHO Y,et al.Effects of lyoprotectant and encapsulated Lactobacillus acidophilus KBL409 on freeze-drying and storage stability[J].LWT,2023,182:114846.
[24] PRATIWI R D,ZANJABILA S.Lyoprotectants for Lactobacillus brevis B144 and their capability to maintain the expression of surface layer protein[J].IOP Conference Series:Earth and Environmental Science,2023,1255(1):012065.
[25] TUYEN D T,THANG L V,BOUKHAREV G.Effects of freezing treatments and protective agents on the stability of Weissella cibaria TSL24.10 after freeze-drying[J].Moscow University Biological Sciences Bulletin,2022,77(4):272-278.