南瓜(Cucurbita moschata)是一种广泛种植的葫芦科植物,按起源可划分为中国南瓜、印度南瓜和美洲南瓜。其形态多样,从扁圆形到长筒形不等,果实颜色呈现绿、黄、红等多种色调,且富含多糖、胡萝卜素、维生素及矿物质等营养成分,兼具食用与药用价值[1-2]。南瓜目前的加工形式以初级产品为主,包括脱水南瓜条、粗制南瓜粉等,贵州织金县通过切片烘干技术生产脱水南瓜条,使产品附加值显著提升,彰显出深加工的巨大潜力[3]。
近年来,随着功能食品研究的深入,南瓜多糖因其抗氧化[4]、免疫调节及益生元活性[5]备受关注。目前,国内外研究已证实乳酸菌发酵可显著提升南瓜制品的功能特性。彭兴兴[6]利用植物乳植杆菌和嗜酸乳杆菌(Lactobacillus acidophilus,LA)复合益生菌发酵南瓜汁,发现其总酚含量提升37.2%,抗氧化活性增强;SUN等[7]研究结果表明植物乳植杆菌发酵可生成5~10 kDa的小分子多糖,显著促进双歧杆菌增殖;王芬[5]从南瓜中分离出10~20 kDa多糖组分,其对肠道益生菌的增殖率达152.3%,证实南瓜多糖益生元潜力。然而现有研究多聚焦于多种益生菌复配技术、风味特性调控机制、生物活性增效策略上,菌株特异性对多糖结构影响的研究尚未系统报告。微生物发酵技术作为调控多糖结构与功能特性的重要手段,为南瓜的深加工提供了新思路。有研究表明,乳酸菌发酵可选择性降解多糖链,改变其单糖组成及分子质量分布,进而有效改善南瓜多糖的理化性质与生物活性[8]。鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus,LR)作为第三代益生菌代表菌株,能通过特异性黏附定植于肠黏膜,调节肠道菌群构成并增强黏膜免疫屏障功能。TUOMOLA等[9]通过比较实验证实,LR对人类回肠糖蛋白的亲和力显著优于其他乳酸菌株。LA具有高效产酸能力,李子叶等[10]发现使用LA发酵酸奶时,其产酸速度显著高于唾液链球菌热亚种并且显著提升了酸奶的抗氧化活性。
本研究以LR、LA发酵南瓜汁为研究对象,系统探究2种乳酸菌在发酵过程中的生长特性,并采用离子色谱和高效凝胶渗透色谱技术深入解析发酵对南瓜多糖结构特征的差异性影响,为开发具有特定功能活性的发酵南瓜制品提供关键理论依据。
1 材料与方法
1.1 材料与试剂
LR(活菌数为3.24×108 CFU/g)、LA(活菌数为1.58×108 CFU/g),华南理工大学食品科学与工程学院保存菌种;南瓜汁,广州达桥食品设备有限公司提供,-20 ℃冻藏。
1.2 仪器与设备
ICS 5000+离子色谱系统,配有CarboPacTM PA1(250 mm×4.0 mm)液相色谱柱、UltiMate3000高效液相色谱仪,配有OHpak SB-805 HQ(300 mm×8 mm)和OHpak SB-803 HQ(300 mm×8 mm)凝胶排阻色谱柱,美国Thermo公司;5430R低温高速离心机,德国Eppendorf公司;OPTILAB T-rex示差显示器、DAWN HELEOS-Ⅱ激光光散射检测器,美国Wyatt公司;雷磁pHS-25型pH计,上海仪电科学仪器股份有限公司。
1.3 实验方法
1.3.1 样品制备
将LR、LA以106 CFU/g的接种量加入稀释2倍的南瓜汁中,分别在0、4、12、24、48 h取样,10 000 r/min离心3 min,吸取上清液转移至离心试管中,使用0.1 mol/L NaNO3水溶液(含质量分数0.02% NaN3)将样品稀释到总糖为1 mg/mL,并通过孔径为0.45 μm的过滤器过滤后上机检测。
1.3.2 理化指标测定
参照GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》,采用平板计数法测定活菌数;采用pH计测定pH;参照NY/T 2742—2015《水果及制品可溶性糖的测定3,5-二硝基水杨酸比色法》测定还原糖含量;参照NY/T 1676—2023《食用菌中粗多糖的测定 分光光度法》测定总糖含量,每个样品平行测定3次。
1.3.3 离子色谱条件
采用CarboPacTM PA1(250×4.0 mm)液相色谱柱,进样量为10 μL。流动相A为超纯水溶液,流动相B为100 mmol/L NaOH溶液,流速1.0 mL/min,柱温30 ℃。洗脱梯度:0 min A相/B相(95∶5,体积比,下同),15 min A相/B相(0∶100),25 min A相/B相(0∶100),40 min A相/B相(95∶5),60 min A相/B相(95∶5)[11]。
1.3.4 凝胶色谱条件
液相系统为UltiMate3000,示差显示器为OPTILAB T-rex,激光光散射检测器为DAWN HELEOS-Ⅱ。采用凝胶排阻色谱柱OHpak SB-805 HQ(300 mm×8 mm)和OHpak SB-803 HQ(300 mm×8 mm)串联,测量范围为1~1 000 kDa。柱温45 ℃,进样量100 μL,流动相A(质量分数0.02% NaN3,0.1 mol/L NaNO3),流速0.6 mL/min,洗脱梯度:等度75 min[12-13]。
1.4 数据分析
每组实验均设3次重复,利用Chromeleon软件处理离子色谱数据,利用软件ASTRA 6.1处理凝胶色谱数据,利用IBM SPSS Statistics 25软件进行显著性分析,分析方法为单因素分析法(ANOVA)的LSD和Duncan检验,P<0.05时表明数据之间存在显著性差异,显著性从大到小排序,用a、b、c、d、e表示,用Origin 2025软件绘图。
2 结果与分析
2.1 两种乳酸菌发酵南瓜汁中生长特性分析
如图1-a所示,发酵0~4 h,2种乳酸菌处于适应期,发酵4~12 h,2种乳酸菌均快速增殖,LR活菌数由初始的6.41 lg CFU/mL 增长至8.03 lg CFU/mL,LA活菌数由6.47 lg CFU/mL增长至7.49 lg CFU/mL。至发酵终点,LR活菌数显著高于LA,分别为8.20、7.25 lg CFU/mL,表明LR更适应南瓜汁发酵环境。
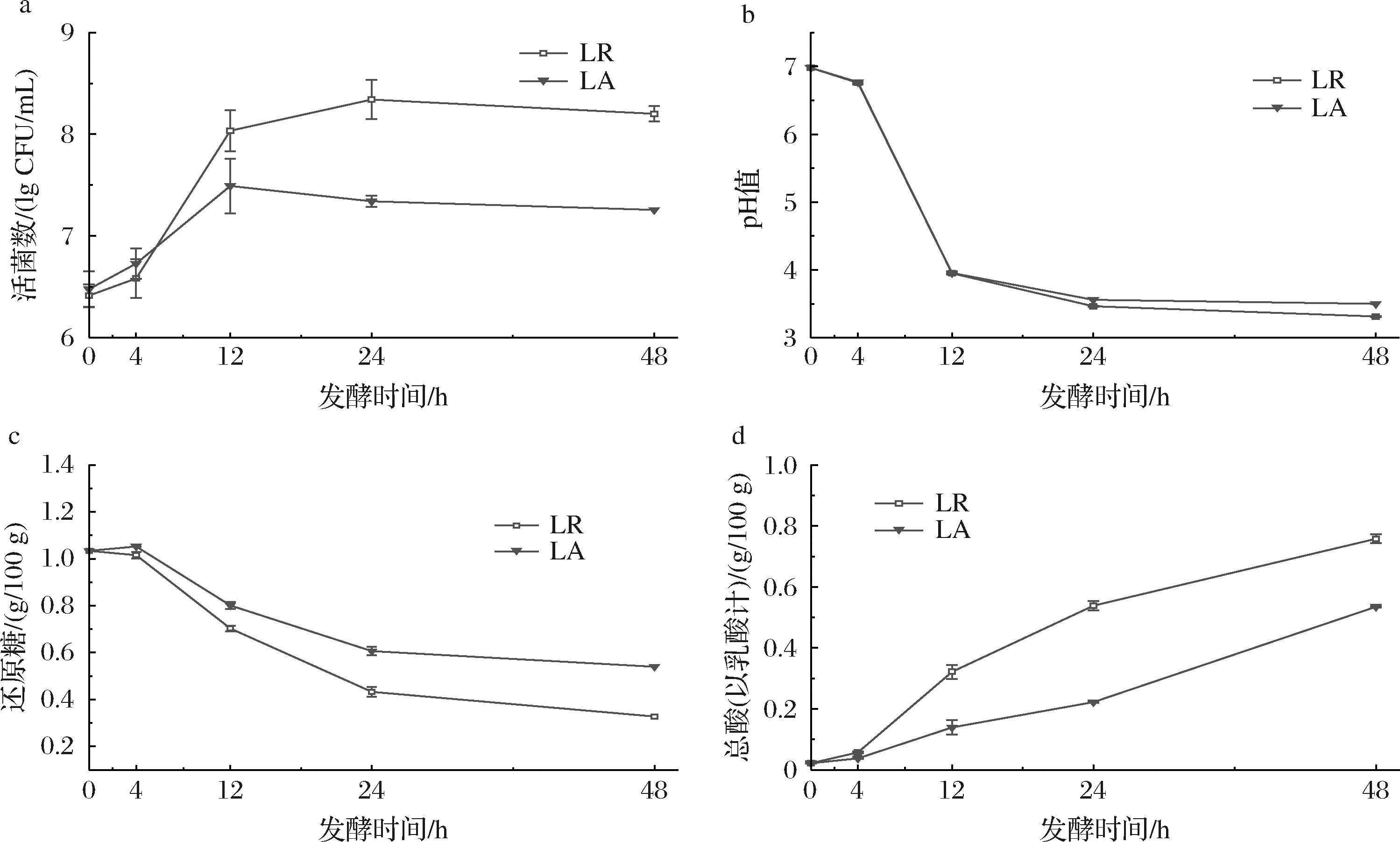
a-活菌数;b-pH值;c-还原糖含量;d-总酸含量
图1 两种乳酸菌发酵南瓜汁生长特性
Fig.1 Growth characteristics of two lactic acid bacteria in fermented pumpkin juice
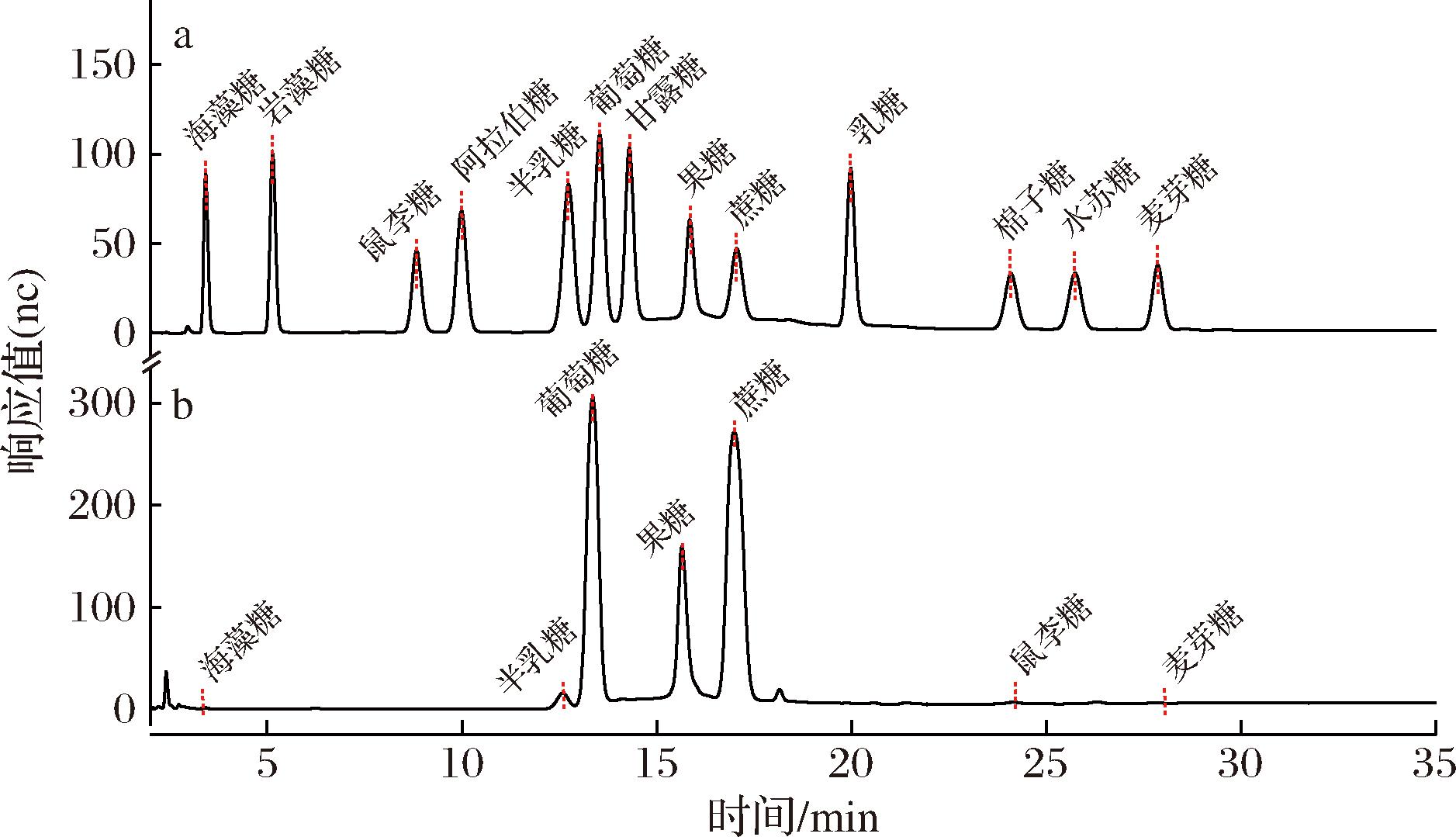
a-标准品图谱;b-南瓜多糖图谱
图2 南瓜汁多糖及标准品图谱
Fig.2 The chromatogram of pumpkin polysaccharides and reference standards
在发酵过程中,乳酸菌代谢糖类物质生成乳酸等有机酸,导致体系pH值下降。如图1-b和图1-c所示,pH值与还原糖含量的动态变化与活菌数增长高度关联。在乳酸菌快速生长期(4~12 h),还原糖消耗速率快,pH值快速下降,2种乳酸菌发酵南瓜汁的pH值均从初始的6.98降至4.00以下,进入稳定生长期(12 h后),还原糖消耗速率趋缓,pH值呈现缓慢下降趋势,发酵终期时,LR和LA发酵南瓜汁pH值分别为3.31、3.35。
2种乳酸菌在产酸能力上有所差异,如图1-d所示,整个发酵过程中,总酸含量随发酵时间的延长而持续增加,发酵前后相比,LR产酸总量(0.74 g/100 g)显著高于LA产酸总量(0.51 g/100 g)。这2种乳酸菌在南瓜中的生长特性与彭兴兴[6]使用益生菌发酵南瓜结果一致。
2.2 两种乳酸菌发酵南瓜汁过程中糖组分变化研究
通过对比图2-a标准品图谱与图2-b样品图谱发现,南瓜汁中检测到的糖类成分包括:海藻糖、半乳糖、葡萄糖、甘露糖、蔗糖、棉子糖、麦芽糖。其中,葡萄糖、果糖和蔗糖的色谱峰强度显著高于其他糖类,保留时间也相对较长,说明南瓜汁中的多糖主要由这3种糖及其构成的单元组成。
2.2.1 LR发酵南瓜汁过程中糖组分变化
根据糖组分含量大小,将南瓜汁糖类分为2组进行分析。如图3-a所示,棉子糖和麦芽糖的初始含量为56.39、33.90 μg/mL,且在整个发酵过程中均无显著性差异,表明LR几乎不利用这2种糖源。在发酵0~4 h,海藻糖含量显著上升,从7.23 μg/mL增至28.29 μg/mL,提示在适应期LR可能通过自我保护机制主动合成海藻糖,吴敏[14]的研究说明海藻糖含有大量羟基,能与菌体表面的自由基结合,将乳酸菌包埋,减少与外界环境的接触。然而,在发酵4~12 h,乳酸菌进入对数生长期,LR对单糖和寡糖的利用增强,海藻糖含量显著下降,至发酵末期降至0.69 μg/mL。甘露糖含量呈缓慢下降趋势,发酵0~24 h消耗速率很慢,含量仅减少5.91 μg/mL,发酵24~48 h含量减少13.87 μg/mL,降幅是前期的2.3倍。
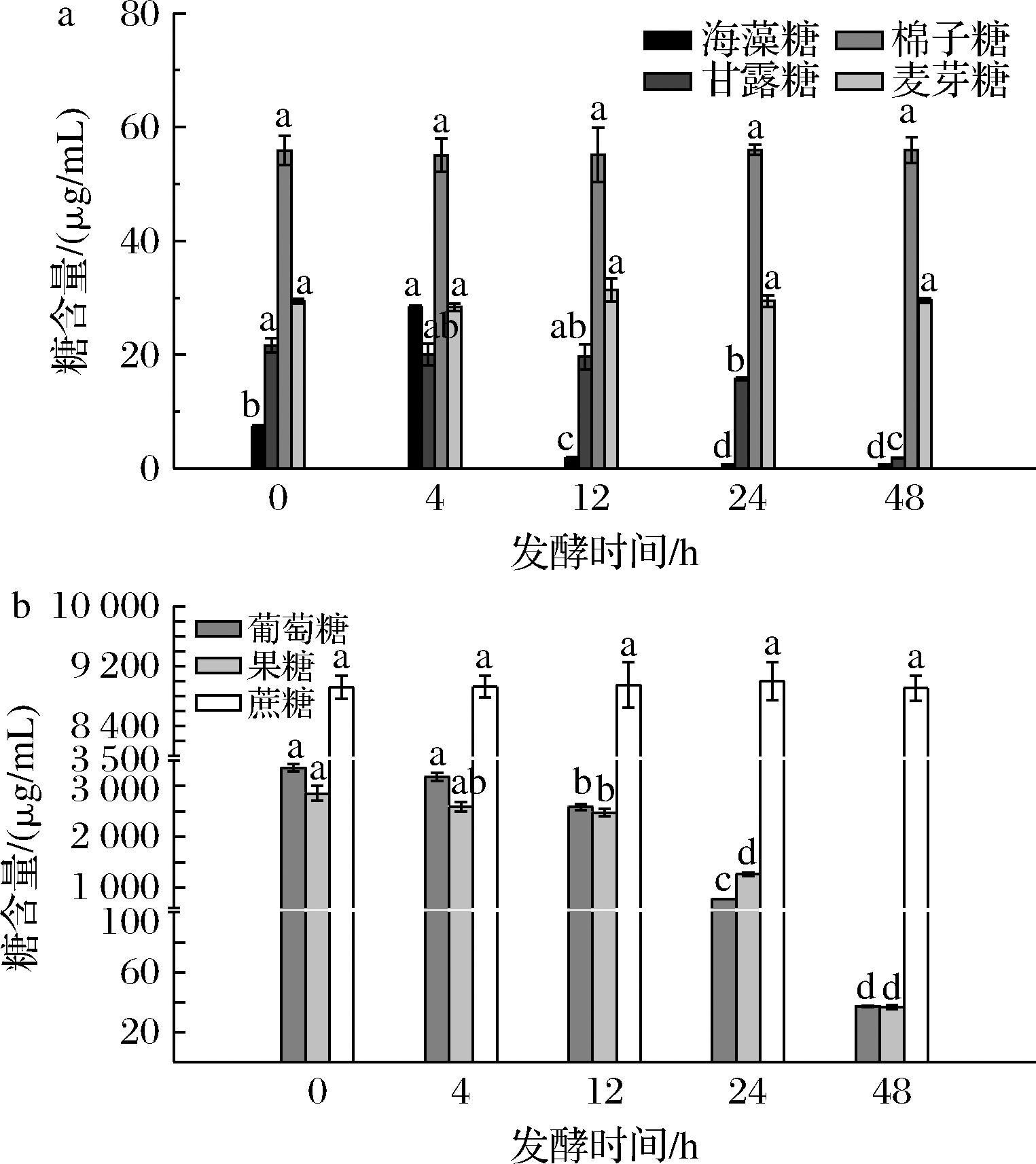
a-海藻糖、甘露糖、棉子糖、麦芽糖含量;b-葡萄糖、果糖、蔗糖含量
图3 LR发酵南瓜汁过程中糖组分变化
Fig.3 Sugars contents changes of pumpkin juice by LR fermentation
注:图中不同小写字母表示显著性差异(P<0.05)(下同)。
如图3-b所示,蔗糖含量在整个发酵过程无显著性变化。葡萄糖和果糖被显著消耗,利用率分别达98.89%、98.71%。前24 h快速生长期内,葡萄糖和果糖含量分别大幅下降2 584.69、1 587.03 μg/mL,发酵后24 h,消耗持续但幅度减小,含量分别下降735.70、1 227.06 μg/mL,此时甘露糖作为一种补充糖源被利用[15]。
2.2.2 LA发酵南瓜汁过程中糖组分变化
如图4-a所示,棉子糖初始含量为56.39 μg/mL,且在整个发酵过程中,棉子糖含量没有显著性变化,这与LR发酵组表现一致,表明2种菌株均缺乏α-半乳糖苷酶活性,无法利用棉子糖。麦芽糖含量在发酵0~4 h显著上升,从29.37 μg/mL增至35.00 μg/mL,其上升可能源于葡萄糖在转糖苷酶作用下的聚合[16]或低聚糖的降解[17]。发酵4~48 h麦芽糖含量保持稳定,可能与发酵后期LA对葡萄糖需求增加,葡萄糖合成麦芽糖速率减缓有关。
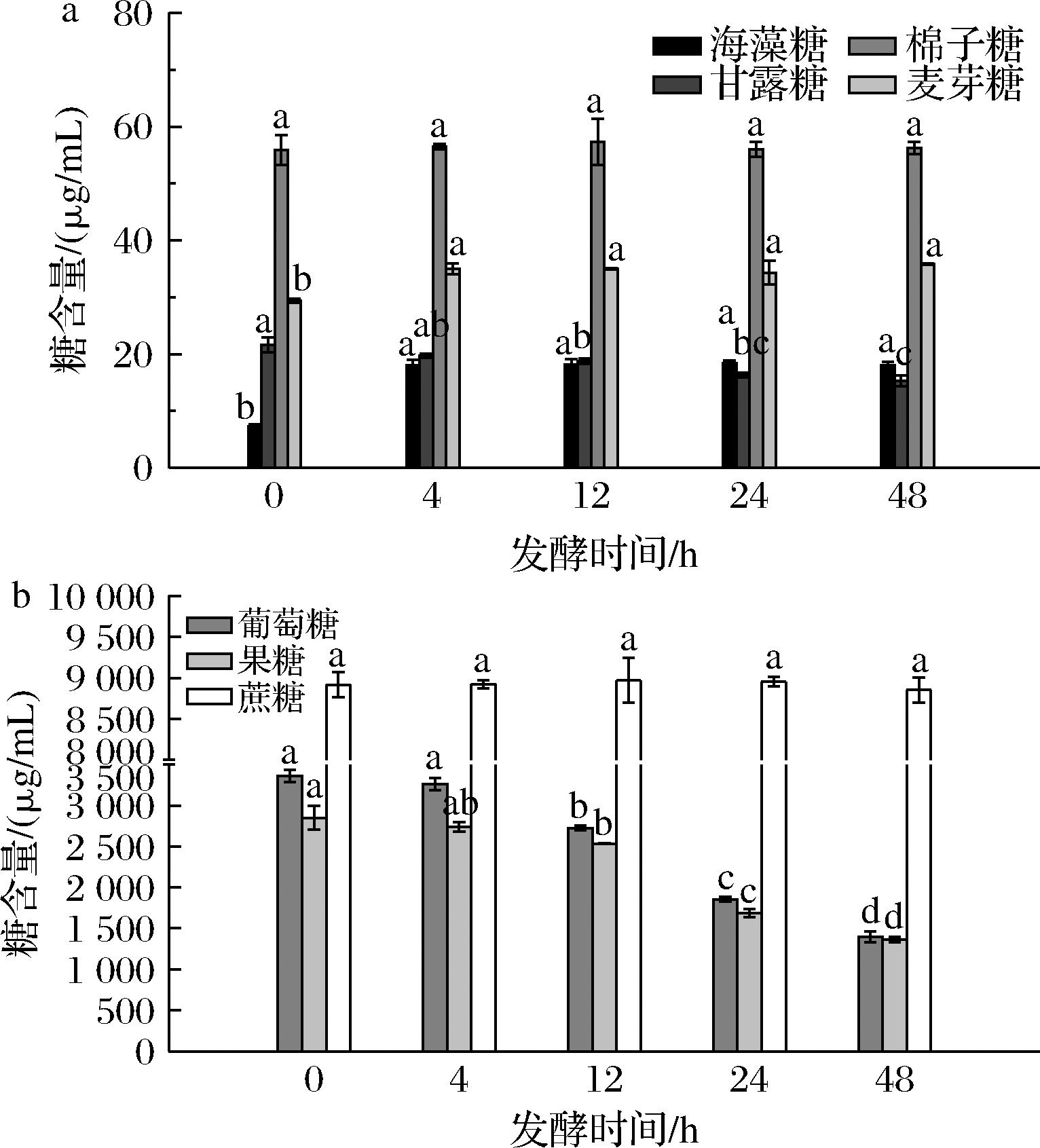
a-海藻糖、甘露糖、棉子糖、麦芽糖含量;b-葡萄糖、果糖、蔗糖含量
图4 LA发酵南瓜汁过程中糖组分变化
Fig.4 Sugars contents changes of pumpkin juice by LA fermentation
海藻糖的变化趋势与麦芽糖相似,发酵0~4 h有上升趋势,发酵4~48 h保持稳定,发酵初期含量为7.27 μg/mL,发酵末期含量为17.98 μg/mL,增加了19%。值得注意的是,LA发酵使海藻糖积累,含量为发酵前的147.22%,可能与LA在适应期通过合成海藻糖维持胞内渗透压的独特机制有关[18]。甘露糖含量呈缓慢下降趋势,消耗率为29.54%,仅为LR组的1/3。
如图4-b所示,蔗糖初始含量为8 924.77 μg/mL,且在发酵全过程无显著变化,而葡萄糖和果糖均被消耗,且葡萄糖被消耗更多。发酵0~12 h,葡萄糖含量迅速下降18.83%,果糖含量则缓慢下降11.06%。在发酵12~48 h,2种单糖的消耗速率相近,葡萄糖含量降低48.75%,果糖含量降低46.28%。发酵终期,葡萄糖和果糖的含量分别剩余1 396.84、1 362.01 μg/mL。
2.2.3 两种乳杆菌发酵南瓜汁糖组分变化对比
LR和LA作为乳酸菌中2种重要菌株,其发酵代谢模式的差异直接影响产品的风味、营养价值和健康益处,还对发酵工艺的优化具有重要意义。葡萄糖、果糖、甘露糖和麦芽糖是影响产品甜度和口感的关键糖类,葡萄糖和果糖是乳酸菌代谢的主要碳源。甘露糖在自然界中以游离状态或与其他单糖结合形成二糖、多糖的形式存在,在某些植物中,多以半乳糖-甘露糖聚糖的形式存在。麦芽糖是一种二糖,由两分子α-D-葡萄糖通过α-(1,4)-糖苷键组成,它的水解和转化过程会涉及到更复杂的酶促反应和微生物代谢途径。对比2种乳酸菌在发酵过程中对这些糖类的利用和转化,有助于深入理解其在食品发酵中的作用机制。
如图5所示,LR对葡萄糖、果糖的利用率高达98.89%和98.71%,显著高于LA的58.40%和52.24%。这是由于LR拥有高效葡萄糖特异性磷酸转移酶系统(phosphotransferase system,PTS),能快速将葡萄糖通过糖酵解途径生成丙酮酸,进而转化为乳酸[19]。DEUTSCHER等[20]的研究表明在葡萄糖充足时,LA的PTS中的Hpr转运蛋白易被磷酸化抑制,导致LA葡萄糖利用率不高。LR对甘露糖的消耗量也显著高于LA。这与LEE等[21]以甘露糖作为底物用乳酸菌发酵生产乳酸研究结果一致,LR消耗甘露糖能力较强。2种乳酸菌均优先利用葡萄糖,其次是果糖,再是甘露糖,这归因于单糖容易被获取和利用,可快速供能。
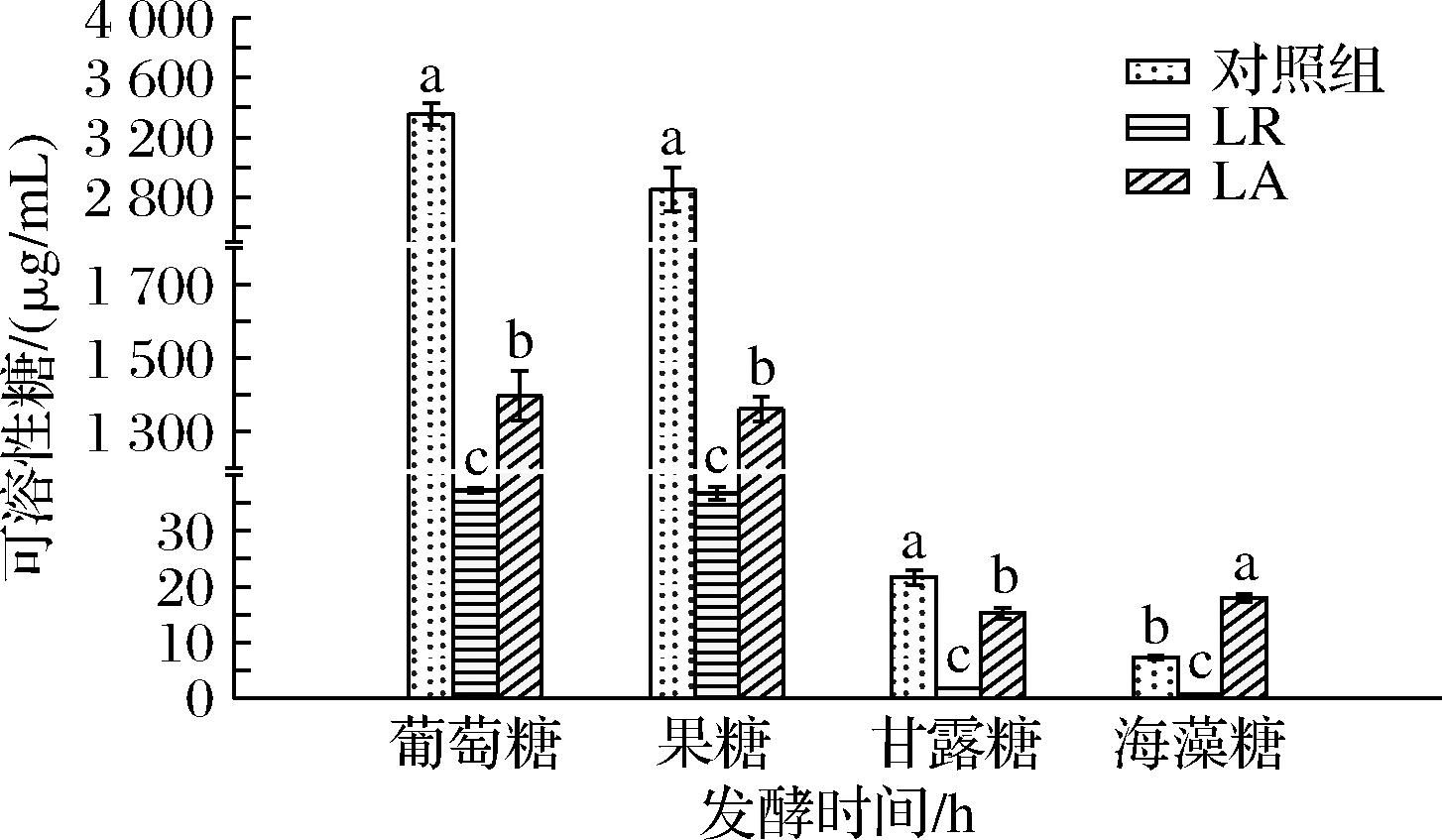
图5 两种乳酸菌发酵南瓜汁糖组分变化对比
Fig.5 Changes of sugar contents in pumpkin juice fermented by two lactic acid bacteria
海藻糖是一种二糖,由2个葡萄糖分子通过α-(1,1)-糖苷键连接而成,这种结构使得海藻糖在化学上十分稳定,不易被水解。2种乳酸菌在利用海藻糖上表现出显著差异,LA发酵使海藻糖积累147.22%,而LR组则减少90.45%,这种代谢差异可能与LA在高葡萄糖环境下为维持糖类平衡而促进海藻糖合成有关,LR则通过海藻糖酶特异性水解α-(1,1)-糖苷键生成两分子葡萄糖[22]。
2.3 两种乳酸菌发酵南瓜汁多糖分子质量变化研究
2.3.1 LR发酵南瓜汁多糖分子质量分布变化
如图6所示,发酵初始南瓜多糖分子质量呈宽分布,范围在28~5 100 kDa,其中100~500 kDa组分占比最高,为32%。值得关注的是,在发酵0~4 h过程中,LR合成了5 100~5 700 kDa超高分子质量多糖,占1%,推测是LR在此阶段合成了胞外多糖。有研究表明,LR能够通过wel基因簇的高表达驱动葡萄糖基转移酶延长多糖链生成胞外多糖[23]。同期,2 700~5 100 kDa多糖占比增至41%,仅次于1 100~2 700 kDa占比43%的多糖,而500 kDa以下的多糖减少,表明LR在适应期优先利用小分子糖作为即时能源,同时启动胞外多糖合成储备碳源。发酵4~12 h,此阶段对应乳酸菌的对数生长期,大分子糖逐渐被降解,100~500 kDa组分成为占比最多的组分,占比41%。在发酵后期12~48 h,多糖持续降解产生18~28 kDa新片段,占比10%,分子质量显著高于高活性益生元的标准区间(<20 kDa),LR发酵末期残留>500 kDa占比11%。
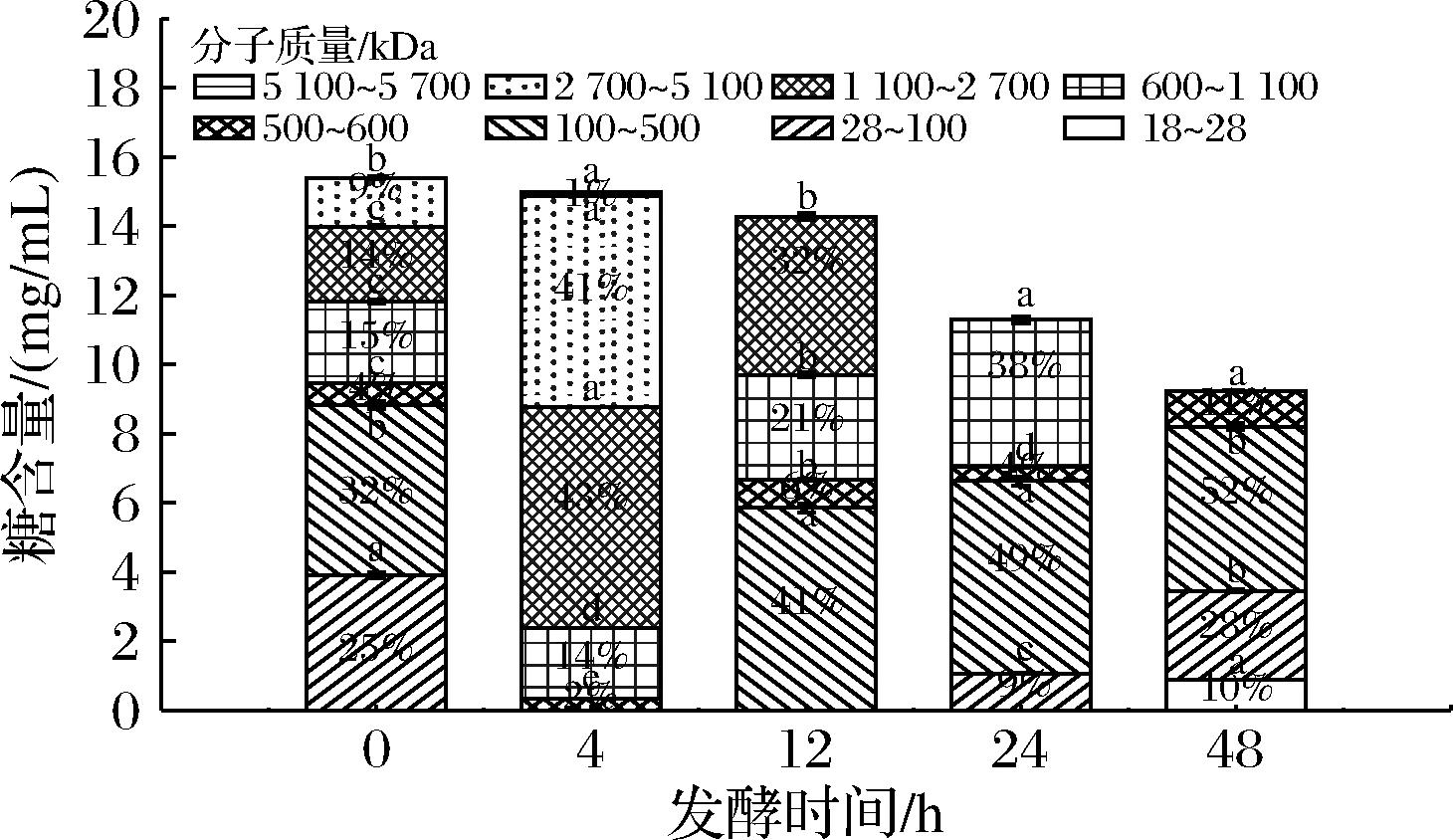
图6 LR发酵南瓜汁多糖分子质量分布变化
Fig.6 Changes of the molecular weight distribution in pumpkin juice fermented by LR
2.3.2 LA发酵南瓜汁多糖分子质量分布变化
如图7所示,LA对南瓜多糖呈现高效阶段性降解的特征。发酵0~4 h,分子质量>1 100 kDa大分子多糖被快速降解,促使100~500 kDa区间内的多糖占比从32%跃升至74%。发酵4~24 h,多糖链进一步断裂,500~600 kDa组分被完全降解,10~500 kDa区间的多糖逐步转变成更小片段,生成占比30%的8~18 kDa的小分子多糖以及占比12%的18~28 kDa的糖。值得注意的是,8~18 kDa区间与王芬[5]报道的南瓜益生元活性核心分子质量(10~20 kDa)高度吻合。发酵24~48 h,体系pH值降至3.35导致各类降解酶的活性降低,大分子糖利用速率降低。此阶段LA生长依赖于8~18 kDa的多糖,该组分占比从30%降至5%。LA发酵南瓜汁多糖分子质量显著低于植物乳植杆菌发酵南瓜汁的产物[7],该特性可能源于LA的基组中含有丰富的多糖降解酶基因,能够高效降解南瓜多糖[24]。
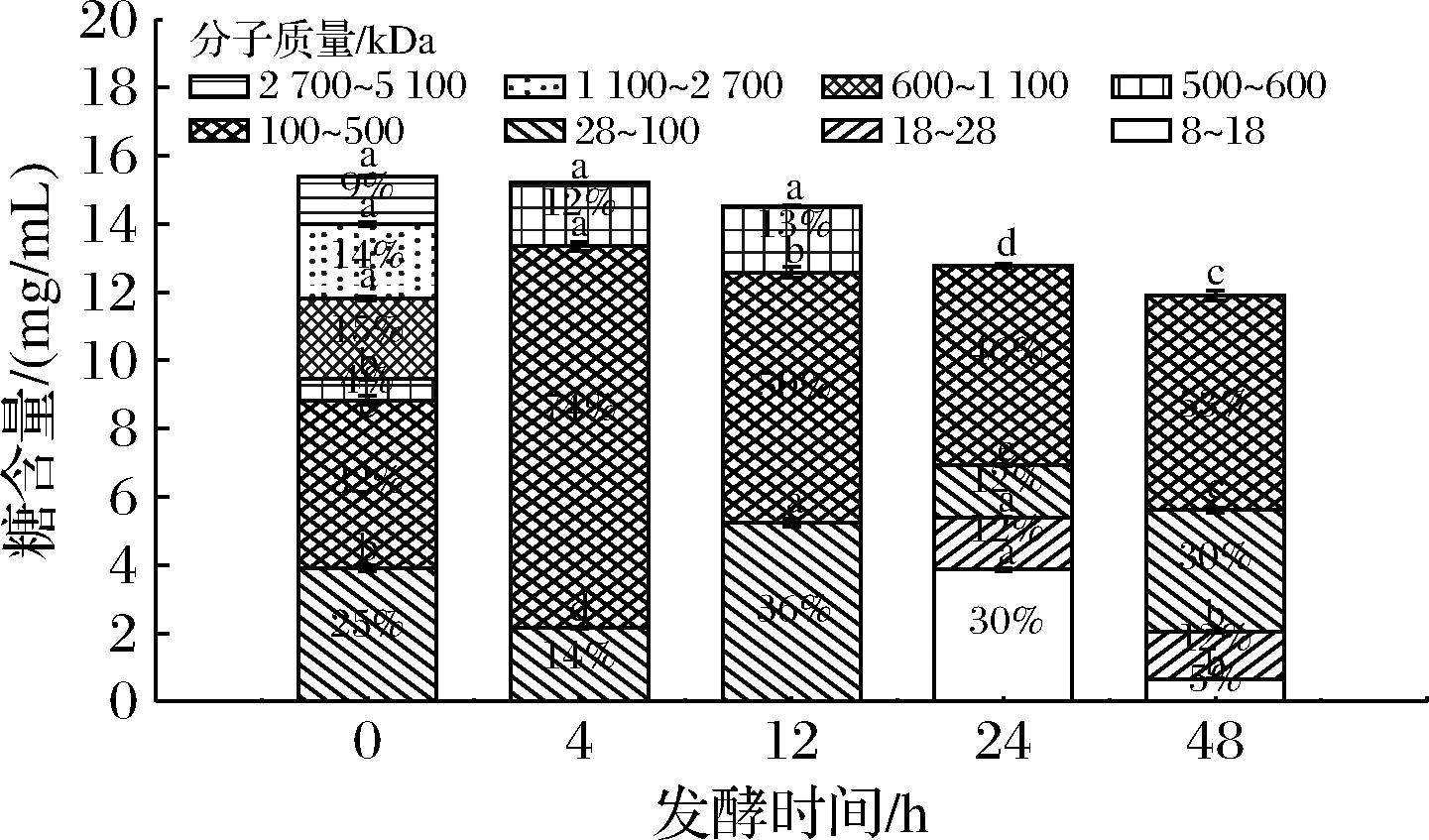
图7 LA发酵南瓜汁多糖分子质量分布变化
Fig.7 Changes of the molecular weight distribution in pumpkin juice fermented by LA
2.3.3 两种乳杆菌发酵南瓜汁多糖分子质量分布变化对比
对比图6和图7,可以发现2种乳酸菌在发酵南瓜汁过程中展现出有显著差异的多糖分子质量调控模式。发酵0~4 h,LR在非胁迫条件下主动合成5 100~5 700 kDa超高分子质量胞外多糖,使得>500 kDa组分占比达98%。同期LA快速降解大分子多糖,分子质量>1 100 kDa的组分被快速降解,分子质量>500 kDa的组分骤降至12%。这种现象表明了2种菌株之间代谢的差异性,LR通过合成胞外多糖增强环境缓冲能力,LA则依赖高活性多糖降解酶降解大分子糖类[23]。该LA可能具有较高活性的淀粉酶,LEE等[25]使用淀粉作为唯一碳源探究不同乳酸菌生长情况,发现LA生长代谢能力最佳。
发酵4~48 h,二者虽持续降解多糖,但产物特征显著分化,LA在4~24 h生成了30%的8~18 kDa片段,LR仅产生10%的18~28 kDa片段。至发酵末期,LA优先利用自产8~18 kDa片段,LR则因降解不完全,86%的组分分子质量>500 kDa,可为植物基酸奶增稠提供独特价值。
3 结论
本研究系统揭示了LR与LA发酵对南瓜多糖结构的差异化调控机制。LR具有更广泛的糖类利用能力,优先高效利用葡萄糖、果糖及麦芽糖,这种高效的单糖利用特性使LR有潜力成为开发低糖或无糖南瓜饮品的理想菌株。LA对单糖的利用效率较低,但能分泌高活性的多糖降解酶,因而具备更强的大分子多糖降解能力,发酵制品富集小分子多糖,有定向调控肠道菌群的潜力。研究还突破性发现LR在非碳源胁迫条件下合成5 100~5 700 kDa超高分子质量胞外多糖,与之形成鲜明对比的是LA展现出卓越的降解能力,0~4 h内分子质量>1 100 kDa组分降解率达88%。2种乳酸菌的代谢差异为南瓜发酵食品的功能定制化提供了新策略,可通过复配菌种或阶段发酵工艺协同优化产品营养特性。
[1] 中国科学院中国植物志编辑委员会.中国植物志(第73卷第1分册)[M].北京:科学出版社,1986.Editorial Committee of Flora of China,Chinese Academy of Sciences.Flora of China (Vol.73,No.1)[M].Beijing:Science Press,1986.
[2] 魏登,徐洪飞,张东娜,等.南瓜籽壳纳米纤维素制备工艺研究[J].现代食品,2020,26(12):100-102;105.WEI D,XU H F,ZHANG D N,et al.Study on preparation technology of nanocellulose in pumpkin seed shell[J].Modern Food,2020,26(12):100-102;105.
[3] 黄杏.织金南瓜香飘海外[N].贵州日报,2022-05-16(4).HUANG X.Zhinjin pumpkin fragrace spreads abroad[N].Guizhou Daily,2022-05-16(4).
[4] GAO X F,YANG Z E,HUANG L T,et al.Protective effects of pumpkin polysaccharide hydrolysates on oxidative stress injury and its potential mechanism-Antioxidant mechanism of pumpkin polysaccharide hydrolysates[J].International Journal of Biological Macromolecules,2023,241:124423.
[5] 王芬.南瓜多糖的分离纯化、结构鉴定及其生物活性研究[D].镇江:江苏大学,2021.WANG F.Isolation,purification,structural characterization and biological activity of pumpkin polysaccharides[D].Zhenjiang:Jiangsu University,2021.
[6] 彭兴兴.乳酸菌发酵南瓜浆的研究[D].广州:华南理工大学,2016.PENG X X.Study on lactic acid bacteria fermentation of pumpkin pulp[D].Guangzhou:South China University of Technology,2016.
[7] SUN X,ZHANG Y,LI F,et al.Effects of lactic acid bacteria fermentation on chemical compounds,antioxidant capacities and hypoglycemic properties of pumpkin juice[J].Food Bioscience,2022,50:102126.
[8] 韩亚楠,李晓娟,王珣,等.南瓜多糖结构特征、改善糖尿病作用的机制及影响因素研究进展[J].食品工业科技,2024,45(21):378-386.HAN Y N,LI X J,WANG X,et al.Research progress on the structural characteristics of pumpkin polysaccharide,mechanism and influencing factors of ameliorating diabetes mellitus[J].Science and Technology of Food Industry,2024,45(21):378-386.
[9] TUOMOLA E M,OUWEHAND A C,SALMINEN S J.The effect of probiotic bacteria on the adhesion of pathogens to human intestinal mucus[J].FEMS Immunology and Medical Microbiology,1999,26(2):137-142.
[10] 李子叶,李柏良,关嘉琪,等.嗜酸乳杆菌KLDS 1.0901对酸奶发酵特性及抗氧化活性的影响[J].食品研究与开发,2019,40(22):49-56.LI Z Y,LI B L,GUAN J Q,et al.Effect of Lactobacillus acidophilus KLDS 1.0901 on characteristics and antioxidant activity of fermented yoghurt[J].Food Research and Development,2019,40(22):49-56.
[11] GANGOLA M P,JAISWAL S,KHEDIKAR Y P,et al.A reliable and rapid method for soluble sugars and RFO analysis in chickpea using HPAEC-PAD and its comparison with HPLC-RI[J].Food Chemistry,2014,154:127-133.
[12] HU T,HUANG Q L,WONG K,et al.Structure,molecular conformation,and immunomodulatory activity of four polysaccharide fractions from Lignosus rhinocerotis Sclerotia[J].International Journal of Biological Macromolecules,2017,94:423-430.
[13] CHEN P L,YOU Q X,LI X,et al.Polysaccharide fractions from Fortunella margarita affect proliferation of Bifidobacterium adolescentis ATCC 15703 and undergo structural changes following fermentation[J].International Journal of Biological Macromolecules,2019,123:1070-1078.
[14] 吴敏.鼠李糖乳杆菌NCUH061012高密度培养及菌剂制备关键技术研究[D].南昌:南昌大学,2024.WU M.Study on key technologies of high-density cultivation and bacterial agent preparation of Lacticaseibacillus rhamnosus NCUH061012[D].Nanchang:Nanchang University,2024.
[15] SAKAI K,KISHIDA K,MATSUMOTO S,et al.Three distinct metabolic phases of polychlorinated biphenyls/biphenyl degrader Acidovorax sp.KKS102 in nutrient broth[J].Bioscience,Biotechnology,and Biochemistry,2024,88(3):305-315.
[16] 董美宏.嗜热毁丝霉α-葡萄糖苷酶的异源表达及酶学性质研究[D].济南:山东大学,2022.DONG M H.Heterologous expression and enzymatic properties of α-glucosidase from Myceliophthora thermophila[D].Jinan:Shandong University,2022.
[17] 宋佳锟.乳酸菌发酵对于老面性质及馒头品质的影响[D].无锡:江南大学,2015.SONG J K.Effect of lactic acid bacteria fermentation on the properties of sourdough and the quality of steamed bread[D].Wuxi:Jiangnan University,2015.
[18] YANG Y X,WANG R X,WANG J G.Advances in the protective mechanism of trehalose on lactic acid bacteria[J].Food Science,2021,42(24):1-9.
[19] 张明,代青梅,任发政,等.鼠李糖乳杆菌乳饮料发酵工艺[J].食品与发酵工业,2015,41(7):104-108.ZHANG M,DAI Q M,REN F Z,et al.Study on the process of fermented milk containing Lactobacillus rhamnosus[J].Food and Fermentation Industries,2015,41(7):104-108.
[20] DEUTSCHER J,FRANCKE C,POSTMA P W.How phosphotransferase system-related protein phosphorylation regulates carbohydrate metabolism in bacteria[J].Microbiology and Molecular Biology Reviews,2006,70(4):939-1031.
[21] LEE J,BAE J,SHIN H,et al.Improved recovery of mannitol from Saccharina japonica under optimal hot water extraction and application to lactic acid production by Lacticaseibacillus rhamnosus[J].GCB Bioenergy,2024,16(7):e13166.
[22] 保国裕,常国炜.海藻糖的特性、应用及制备[J].甘蔗糖业,2024,53(6):67-74.BAO G Y,CHANG G W.Characterization,application and preparation of trehalose[J].Sugarcane and Canesugar,2024,53(6):67-74.
[23] 李盛钰,赵玉娟,张雪,等.鼠李糖乳杆菌JAAS8胞外多糖生物合成基因的克隆及生物信息学分析[J].食品科学,2011,32(17):292-296.LI S Y,ZHAO Y J,ZHANG X,et al.Cloning and bioinformatic analysis of exopolysaccharide biosynthesis genes from Lactobacillus rhamnosus JAAS8[J].Food Science,2011,32(17):292-296.
[24] 彭明芳,李培骏,单杨,等.比较基因组揭示广西酸菜乳杆菌碳水化合物活性酶谱[J].食品与发酵工业,2021,47(4):68-73.PENG M F,LI P J,SHAN Y,et al.Comparative genome analysis of carbohydrate activity enzymes zymogram of Lactobacillus from Guangxi pickle[J].Food and Fermentation Industries,2021,47(4):68-73.
[25] LEE H,GILLILAND S,CARTER S.Amylolytic cultures of Lactobacillus acidophilus:Potential probiotics to improve dietary starch utilization[J].Journal of Food Science,2001,66(2):338-344.