随着人们对食品安全和环境保护问题的日益关注,制备安全可降解的可食用包装膜成为研究热点。可食用膜是以天然可食用的大分子(多糖、蛋白质、脂质)为基质,通过分子间相互作用力交织,增添辅助交联剂,形成的一层具有优良物理性能、生物降解性的薄膜[1],并且可以加入各种天然功能性物质,丰富膜的功能特性,在食品包装工业中展现出了巨大的潜力和应用价值。
明胶(gelatin,GEL)因其优良的成膜性和生物相容性,常用作制备可降解的食用膜[2]。然而,单一材料制备而成的可食用膜存在机械强度相对较低、阻隔性能不足以及抗氧化性较弱等问题,实际应用受到限制。研究发现多糖、脂质、蛋白质等2种或2种以上的材料相互融合在一起成膜相较于单一成分的膜,往往有着更好的物理性能以及良好的阻隔性能[3]。壳聚糖(chitosan,CS)具有良好的抗菌性能和生物降解性,在酸性环境下,水溶液会展现出高度的黏稠性,形成易于溶解的胶体溶液。此外,CS所固有的游离氨基还具备清除果蔬内活性自由基的能力[4]。所以,在单一GEL成膜基础上,添加CS对GEL进行复合交联,以期增强复合膜的机械性能、阻水性能、抑菌性能。肉桂精油(cinnamon essential oils,CEO)作为功能性成分,含有大量的醛类和酚类化合物[5],具备优良的抑菌性和抗氧化性,常应用于食品包装领域。目前,已有研究表明,膜液中含10 g/L肉桂精油制备的明胶膜可以作为食品包装材料,通过降低微生物腐败和脂质氧化来保持食品的品质[6]。谷氨酰胺转氨酶(transglutaminase,TG)作为一种酶交联剂,可以与成膜基质形成共价键得到三维交联网架结构,有效改善蛋白质热稳定性、保水性和凝胶能力[7]。从而增强可食用膜的结构和性能。
基于此,本研究以GEL和CS作为成膜基质,CEO为功能性成分,构建绿色安全的可食用膜,并且探究TG和CEO的添加对可食用膜结构和性能的影响。并通过微观结构、红外光谱、X-射线、机械性能、水溶性、抗氧化性能以及抑菌性能等指标,分析可食用膜结构和性能,揭示TG和CEO对可食用膜理化性质和成膜机制的影响。
1 材料与方法
1.1 材料与预处理
1.1.1 材料与试剂
CEO(纯度≥98%),宁波谱兰特生物科技有限公司;CS、GEL,河南奇华利生物科技有限公司;甘油、TG,北京索莱宝科技有限公司;DPPH、ABTS,上海源叶生物科技有限公司;大肠杆菌(Escherichia coli,ATCC 25922)、金黄色葡萄球菌(Staphylococcus aureus ATCC 29213),河南城建学院健康食品生物制造团队。
1.1.2 主要仪器
010-1SA型电热恒温鼓风干燥箱,上海掌动医疗科技有限公司;T25 digital ULTRA-TURRAX分散机,德国IKA公司;sigma3-30k高速冷冻离心机,德国sigma离心机有限公司;PEI inspect F50扫描电子显微镜,铂悦仪器(上海)有限公司;PerkinElmer Frontier傅里叶变换红外光谱仪,铂金埃尔莫股份有限公司;WSC-S色差计,上海仪电物理光学仪器有限公司;HS-TGA-103 热重分析仪,上海合晟科技有限公司;TMS-PRO质构仪,美国FTC公司;JC2000D接触角测量仪,上海坤诚科学仪器有限公司。
1.2 实验方法
1.2.1 可食用膜制备
称取2 g GEL、5 g CS、3 g甘油溶于400 mL蒸馏水中,60 ℃搅拌(12 000 r/min),使其充分溶解。将上述溶液分成4组。GEL-CS组;GEL-CS-CEO-TG组:加入占溶液总量10 g/L的TG,3 g CEO;GEL-CS-TG组:加入占溶液总量10 g/L的TG;GEL-CS-CEO组:加入3 g CEO。4组膜液高速搅拌(10 min,12 000 r/min)后静置12 h,分别倒入直径为120 mm的平皿中,置于65 ℃烘箱干燥7 h,冷却后揭膜。
1.2.2 厚度测定
参考GB/T 6672—2001《塑料薄膜和薄片 厚度测定 机械测量法》并稍作调整,使用螺旋测微器测量可食用膜上任意5个点,取平均值。
1.2.3 机械性能测定
参考SUN等[8]的方法,将膜剪裁成1 cm×6 cm的矩形片,采用质构仪测定,测试条件为:称重传感器为25 N;探头:A/MTG;初始夹距:20 mm;拉伸速率:2 mm/s。采用公式(1)、公式(2)测定膜拉伸强度(tensile strength,TS)和最大断裂伸长率(elongation at break,EB)。
(1)
式中:TS,拉伸强度,MPa;F,断裂时承受的最大张力,N;L,膜的厚度,mm;M,膜的宽度,mm。
(2)
式中:EB,断裂伸长率,%;L,膜断裂时伸长的长度,mm;L0,膜的原始长度,mm。
1.2.4 水蒸气透过量(water vapor permeability,WVP)
参考FAUZAN等[9]的方法。用膜密封含有10 mL蒸馏水的锥形瓶口,将锥形瓶放入含有变色硅胶的干燥瓶中。24 h后,记录硅胶的质量变化。WVP按公式(3)计算。
(3)
式中:t,间隔时间,h;Δm,t时间内的质量增量,g;A,膜透水蒸气的面积,m2;WVP,水蒸气透过量,g/(m2·24 h)。
1.2.5 颜色测定
参考ZOLFAGHARI等[10]的方法并稍作修改。由分光色度计测量可食用膜的L*(亮度)、a*(正红色-负绿色)和b*(正黄色-负蓝色)。色差值(ΔE)和色度(C)根据以公式(4)和公式(5)计算。
(4)
(5)
式中:L*、a*和b*是膜的颜色值;测量标准白板得![]() 和
和![]()
1.2.6 水接触角测定
将3 μL蒸馏水滴在膜表面,采用接触角测定仪测量膜水接触角[11]。
1.2.7 水敏感性
参考NEMATI等[12]的方法并稍作修改。称取可食用膜初始质量记为m0,在105 ℃下干燥至恒重,称重记为m1。将干燥的可食用膜转移到装有蒸馏水的烧杯中,25 ℃密封保存2 h,然后用滤纸脱水,称重记为m2。在105 ℃下将水饱和可食用膜再次脱水至恒重,以获得最终干质量m3。采用公式(6)、公式(7)、公式(8)分别计算水分含量、溶解度和溶胀率。
水分含量![]()
(6)
溶解度![]()
(7)
溶胀率![]()
(8)
1.2.8 X-射线衍射(X-ray diffraction,XRD)分析
在40 kV和40 mA条件下使用Cu-Kα射线,扫描范围(2θ)5°~65°,步长0.02°,扫描速度5°/min。
1.2.9 傅里叶变换红外光谱分析
扫描范围为4 000~650 cm-1,分辨率为4 cm-1。
1.2.10 热稳定性分析
在50~600 ℃范围内,以10 ℃/min的速度测定膜的热稳定性。
1.2.11 扫描电子显微镜分析
使用扫描电子显微镜在15~20 kV的加速电压下观察膜的表面和横截面。
1.2.12 抑菌性能分析
评估膜对大肠杆菌和金黄色葡萄球菌的抑菌性能。称取0.2 g膜浸入15 mL LB培养液中(含有105 CFU/mL细菌培养物),37 ℃下恒温培养。于12 h和24 h吸取样品,560 nm处检测光密度[13]。
1.2.13 抗氧化性能分析
参考LIN等[14]的方法。用体积分数为95%的乙醇配制0.2 mmol/L DPPH溶液。将0.5 g膜置于10 mL蒸馏水中振荡24 h,6 000 r/min离心10 min,取50 μL上清液与120 μL DPPH溶液混合,室温避光30 min,517 nm处测量吸光度。以DPPH溶液作为对照组,DPPH自由基清除率计算如公式(9)所示。
DPPH自由基清除率![]()
(9)
式中:A0,对照的吸光度;A,薄膜样品的吸光度。
将7 mmol/L ABTS溶液和2.45 mmol/L K2S2O8溶液等比例混合,25 ℃避光16 h。用PBS稀释ABTS溶液使其在734 nm处吸光度为0.70±0.02,即为ABTS-无水乙醇自由基预备液。将0.5 g膜置于10 mL蒸馏水中振荡24 h,6 000 r/min离心10 min,将30 μL上清液和170 μL ABTS-无水乙醇自由基预备液混合,25 ℃避光反应30 min。以ABTS-无水乙醇自由基预备溶液作为对照组,734 nm处测量吸光度。ABTS阳离子自由基清除率计算如公式(10)所示。
ABTS阳离子自由基清除率![]()
(10)
式中:A0,对照的吸光度;A,可食用膜样品的吸光度。
1.2.14 脂质氧化测定
参照ZHOU等[15]的方法,将黑鱼鱼片处理成30 g的片状,用5 cm×5 cm的膜包裹。暴露于空气的鱼片作为空白对照。4 ℃储存,每2 d测定1次脂质氧化程度。
1.3 数据处理
所有实验重复3次,实验结果用“平均值±标准差”表示。采用SPSS 25.0统计软件进行方差分析(ANOVA),Origin 2021绘图。P<0.05为差异显著。
2 结果与分析
2.1 机械性能
如图1所示,与GEL-CS膜相比,GEL-CS-TG、GEL-CS-CEO膜的机械强度有所提高。GEL-CS-CEO-TG膜的机械强度达到最大,TS为(4.21±0.29) MPa,EB为(80±2.22) %。这可能是因为在TG的催化下,GEL与CS的交联程度提高[16]。此外,CEO中的酚羟基可以与GEL中的羰基形成氢键或共价键,与CS中的羟基或氨基产生氢键作用,形成更为致密的三维网络结构,从而提高膜的TS和EB[17]。
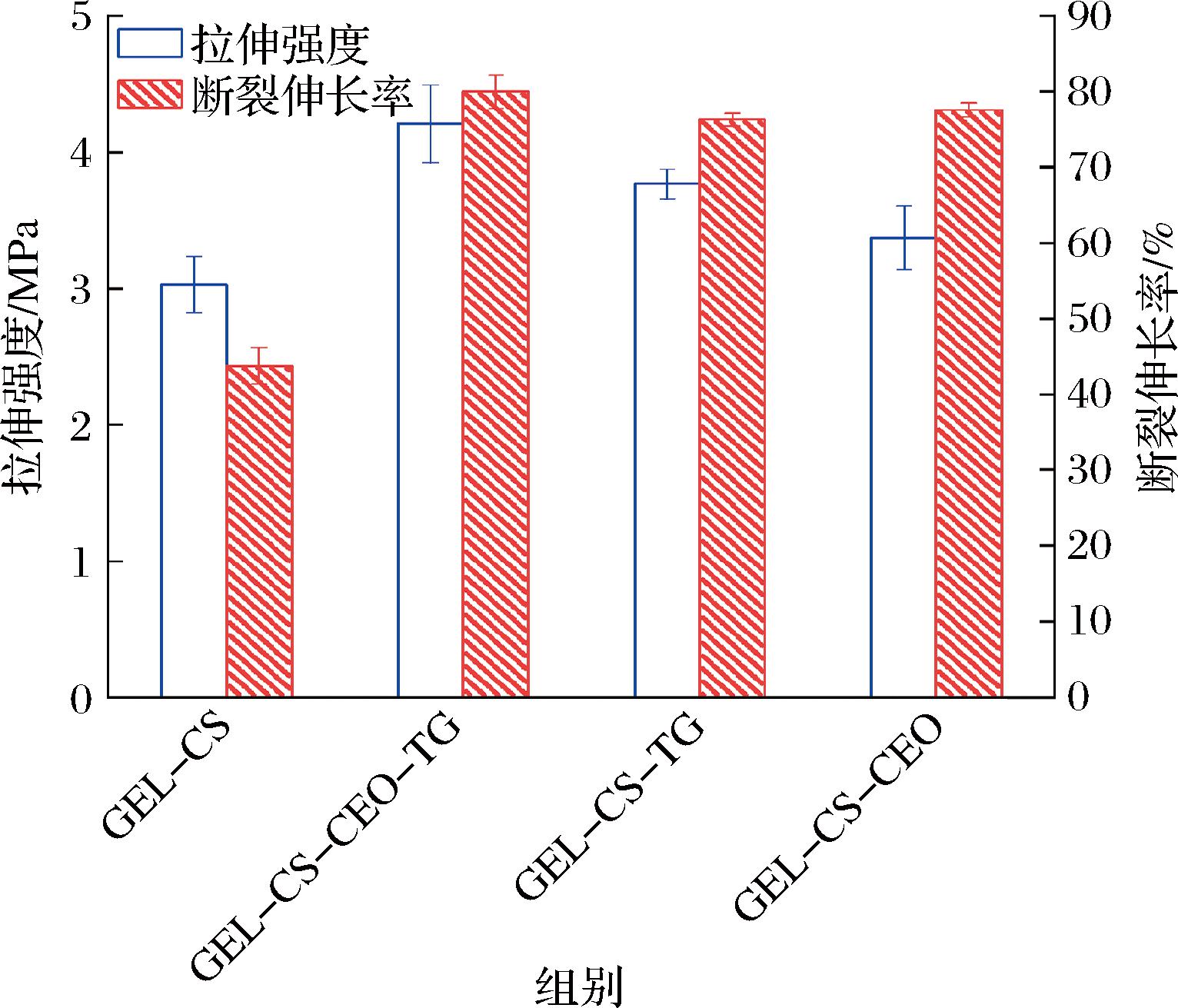
图1 可食用膜的机械性能
Fig.1 Mechanical properties of edible films
2.2 水蒸气透过量
膜水蒸气透过量与厚度有关,是膜物理性质的重要指标。如图2所示,GEL-CS-TG膜和GEL-CS-CEO膜的厚度与水蒸气透过量均未发生显著变化。GEL-CS-CEO-TG膜的厚度变化不显著,但是水蒸气透过量显著降低(P<0.05),这可能是由于同时添加TG和CEO,增强了膜中的共价键相互作用以及分子之间的网络交联,网络结构更加紧密,抑制了水分的渗透[17]。此外,CEO形成的疏水层降低水分的移动速率,有利于阻隔水分迁移[18]。
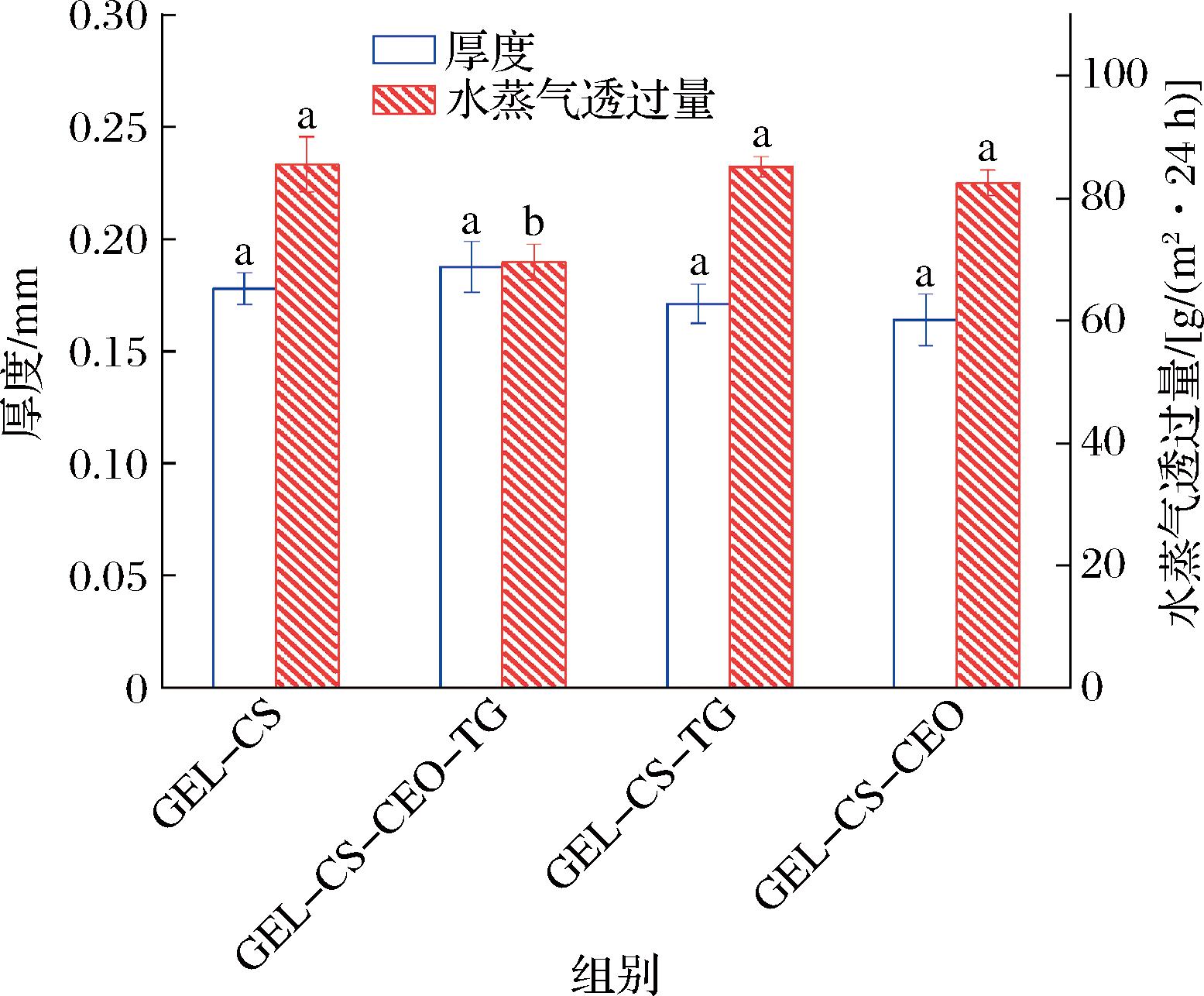
图2 可食用膜的厚度及水蒸气透过量
Fig.2 Thickness and water vapor permeability of edible films
注:同一指标不同小写字母表示差异显著(P<0.05)(下同)。
2.3 颜色分析
根据表1结果可知,TG和CEO的添加对膜颜色有影响。GEL-CS-TG膜L*值低于GEL-CS膜,膜颜色更深,GEL-CS-CEO膜的颜色变化更为显著(P<0.05)。GEL-CS-CEO组L*值变化最大(P<0.05),从-9.27降低至-16.85,这可能是因为CEO中的酚醛类物质导致可食用膜颜色变深,变暗[19]。而GEL-CS-CEO-TG膜的a*、b*、E、C值变化较其他膜更加明显(P<0.05),a*由-11.07降低到-31.58,b*值由49.37升高至74.19,颜色参数发生变化的原因可能是同时加入CEO和TG而导致的光散射[20]。
表1 可食用膜的颜色参数
Table 1 Color parameters of edible films

样品L∗a∗b∗ECGEL-CS-9.27±0.22a-11.07±0.41b49.37±0.14c119.70±0.21c50.60±0.13cGEL-CS-CEO-TG-11.12±0.41c-31.58±0.86d74.19±0.50a137.14±0.16a80.64±0.78aGEL-CS-TG-9.88±0.24b9.98±1.56a47.70±0.36d119.23±0.15d48.75±0.24dGEL-CS-CEO-16.85±0.21d-24.75±0.30c61.45±0.20b133.88±0.05b66.25±0.28b
注:同列小写字母不同表示组内差异显著(P<0.05)。
2.4 水接触角
接触角与可食用膜表面润湿性有关,接触角>65°表示膜表面为疏水性,而接触角<65°表示膜表面为亲水性[21]。由图3可知,GEL-CS膜的水接触角为61°,表面为亲水性。GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜的水接触角分别为80°、82°和81°,表明GEL-CS-TG、GEL-CS-CEO-TG和GEL-CS-CEO膜均为疏水表面,这可能是因为CEO具备疏水特性,引发了膜内部水分比例的减少,进而减缓了膜中水分含量的下降,也可能是因为在TG的催化下,GEL的结构打开,疏水基团暴露并交联[22]。

图3 不同基质对可食用膜水接触角的影响
Fig.3 Effect of different substrates on the contact angle meter of edible film
2.5 水敏感性
可食用膜的水敏感性与可食用膜厚度、亲水基团数量、膜内部结构和膜间的甘油含量有关[23]。如图4所示,与GEL-CS膜相比,GEL-CS-TG膜、GEL-CS-CEO膜、GEL-CS-CEO-TG膜的水分含量、水溶性和溶胀率均显著降低(P<0.05),这可能是因为TG改变了水分子与基质之间的结合机制,羟基分子与水分子间的连接减少,也可能是TG提高膜基质交联度,使膜水溶性降低,从而增加了可食用膜的耐水性[22]。此外,CEO含有疏水基团,影响可食用膜基质亲水性基团与水分子的相互作用[24]。
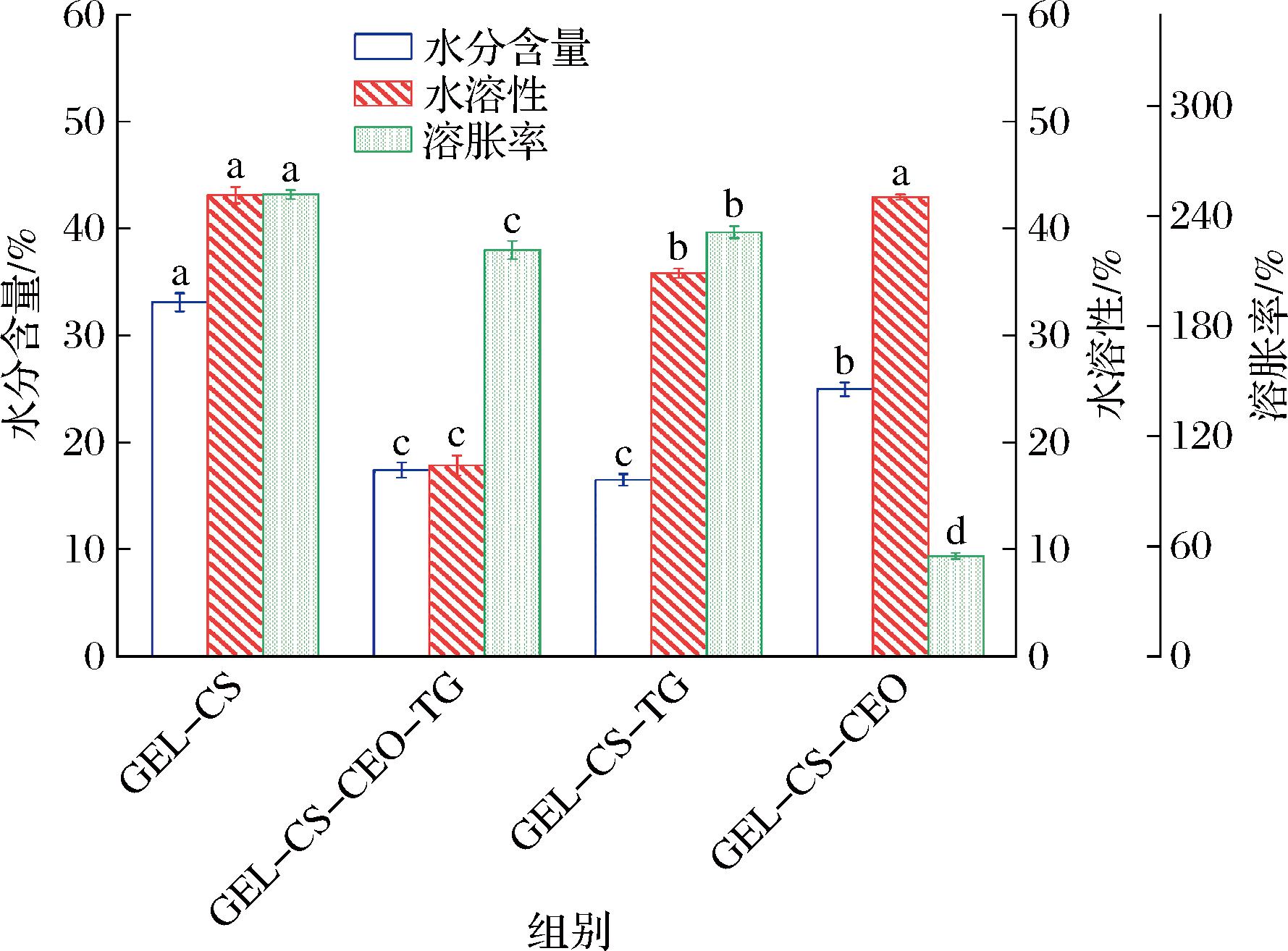
图4 可食用膜的水敏感性
Fig.4 Water content,water solubility and swelling rate of edible films
2.6 XRD分析
如图5所示,GEL-CS膜在2θ角处出现了7.82°、8.32°、11.36°、18.12°、20.54°和22.76°的衍射峰,这与GEL、CS的结晶状态一致[25]。GEL-CS-TG膜中上述衍射峰强度降低或消失,说明TG与GEL、CS之间形成了相互作用。GEL-CS-CEO膜峰形变得细窄尖锐,表明CEO的加入增强了膜的结晶度[26]。此外,GEL-CS-CEO-TG膜未观察到其他的衍射峰,这表明CEO和TG能够很好地与成膜基质融合,进一步证明了CEO和TG与2种基质之间的良好相容性。
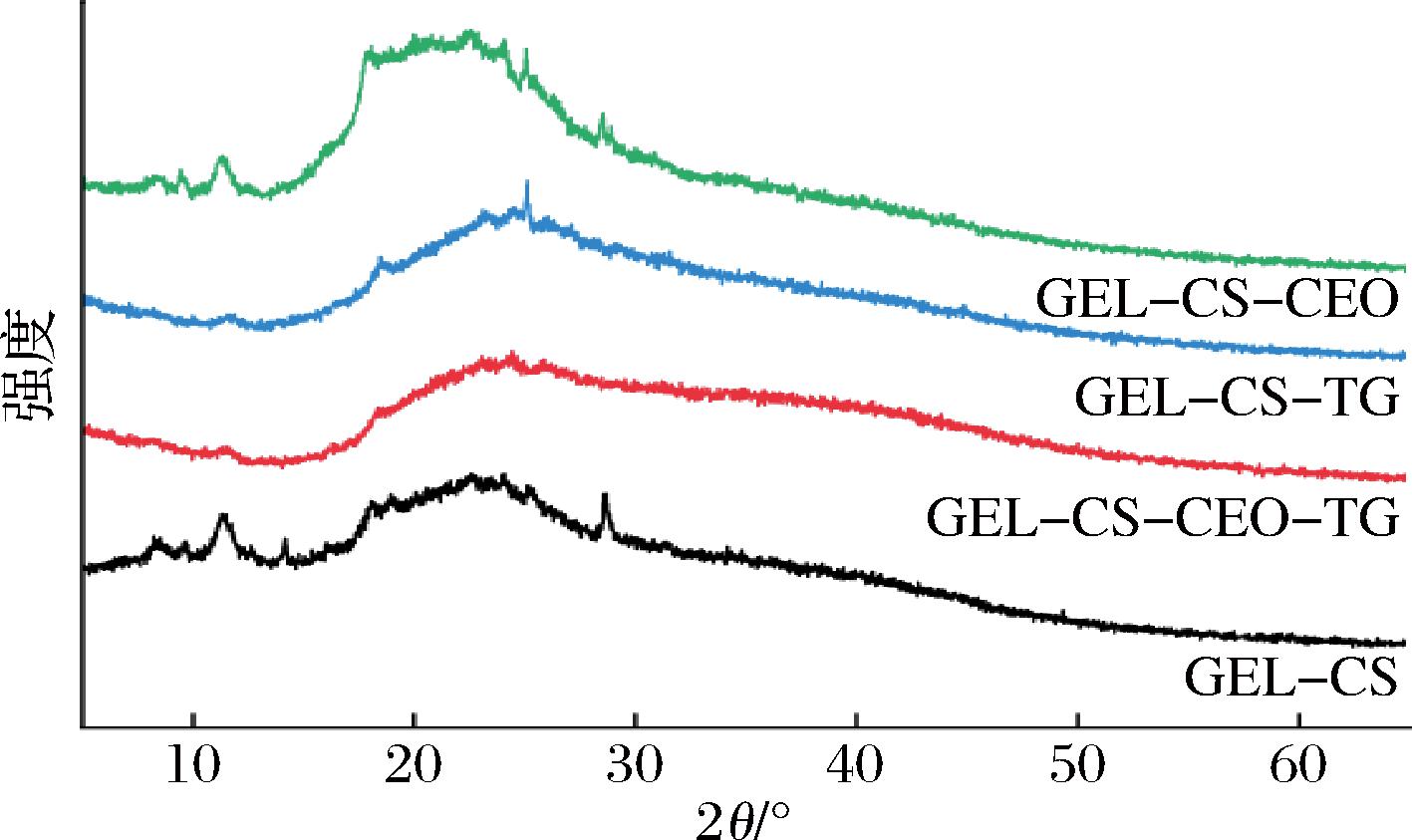
图5 可食用膜X-射线衍射图
Fig.5 X-ray diffraction of edible films
2.7 傅里叶变换红外光谱分析
如图6所示,GEL-CS膜在3 285 cm-1处出现一个宽且钝的吸收峰,属于O—H基团和N—H基团的拉伸振动。在2 929 cm-1处的峰与C—H的对称与非对称振动有关,位于1 632 cm-1为C![]() O的伸缩振动(酰胺I带),位于1 532 cm-1为C—N的伸缩振动和N—H的弯曲振动(酰胺Ⅱ带)[27],位于1 028 cm-1处对应于C—O—C拉伸振动。4种膜峰形基本相同,GEL-CS-TG膜在1 632 cm-1(酰胺Ⅰ带)和1 532 cm-1(酰胺Ⅱ带)处的吸收峰向低波方向移动,说明TG催化酰基发生转移,膜基质发生交联。GEL-CS-CEO膜O—H和N—H的伸缩振动峰略向高频段偏移,由3 285 cm-1上升至3 298 cm-1,这可能是由于CS的氨基与CEO中的羟基形成了分子间交联[17]。GEL-CS-CEO-TG膜在1 632、1 532 cm-1处的吸收峰移至1 628、1 525 cm-1,其特征峰主要是由C
O的伸缩振动(酰胺I带),位于1 532 cm-1为C—N的伸缩振动和N—H的弯曲振动(酰胺Ⅱ带)[27],位于1 028 cm-1处对应于C—O—C拉伸振动。4种膜峰形基本相同,GEL-CS-TG膜在1 632 cm-1(酰胺Ⅰ带)和1 532 cm-1(酰胺Ⅱ带)处的吸收峰向低波方向移动,说明TG催化酰基发生转移,膜基质发生交联。GEL-CS-CEO膜O—H和N—H的伸缩振动峰略向高频段偏移,由3 285 cm-1上升至3 298 cm-1,这可能是由于CS的氨基与CEO中的羟基形成了分子间交联[17]。GEL-CS-CEO-TG膜在1 632、1 532 cm-1处的吸收峰移至1 628、1 525 cm-1,其特征峰主要是由C![]() O 和N—H的弯曲振动引起的,表明GEL的氨基酸残基在酶催化下与CEO相互作用。1 028 cm-1处的峰值强度降低,这可能是因为CEO和TG与CS的羟基和氨基形成氢键。这些结果表明CEO和TG可以影响膜基质之间的相互作用。
O 和N—H的弯曲振动引起的,表明GEL的氨基酸残基在酶催化下与CEO相互作用。1 028 cm-1处的峰值强度降低,这可能是因为CEO和TG与CS的羟基和氨基形成氢键。这些结果表明CEO和TG可以影响膜基质之间的相互作用。

图6 可食用膜红外光谱图
Fig.6 Infrared spectrum of edible films
2.8 热重分析
各种膜热重分析如图7所示。膜的热分解可以分为3个阶段。在第1个阶段中主要是由于膜中残留水分挥发而引起的重量损失,这与水蒸气透过量的表现一致。第2个阶段是膜中甘油逐步分解导致重量降低[28]。第3个阶段与膜分子间作用力或分子之间氢键的破坏有关,温度升高打破薄膜稳定结构导致重量降低。此外,不同膜之间的质量损失没有较大差异,且随着温度的升高,重量保留率趋于稳定。值得注意的是,GEL-CS膜的质量保留率略高于其他3种膜。因此,CEO和TG对GEL-CS膜基质的热稳定性影响较小。
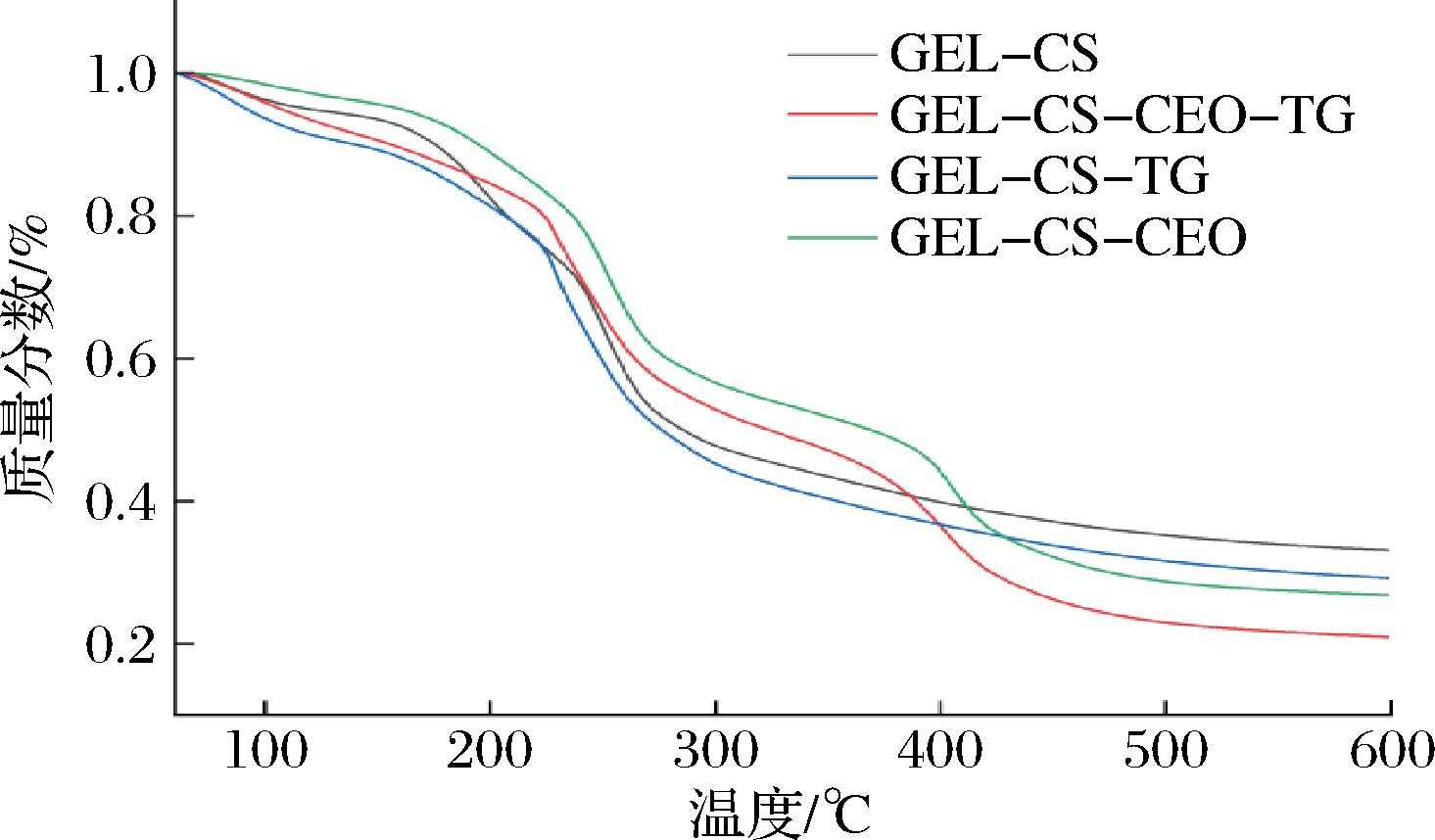
图7 可食用膜热重分析图
Fig.7 Thermogravimetric analysis diagram of edible films
2.9 膜抗氧化活性分析
抗氧化能力是评定包装材料性能的一个重要指标,常通过DPPH自由基和ABTS阳离子自由基的清除能力评估。如图8所示,GEL-CS组表现出一定的清除自由基能力,这可能是因为CS中固有的游离氨基具备清除自由基的能力[4]。当添加TG后,GEL-CS-TG膜的DPPH自由基和ABTS阳离子自由基清除能力均有所增加(P<0.05),这可能是因为TG促进可食用膜三维网络形成,赋予可食用膜更优的抗氧化性能。此外,与GEL-CS相比,GEL-CS-CEO-TG膜的DPPH自由基清除率提高了146%,ABTS阳离子自由基清除率提高了23%。这可能是因为CEO中的酚羟基具有较强的供氢能力,与膜网络中的碳氢分子形成稳定的氢键[17],也可能是因为CEO在膜中释放活性物质,赋予可食用膜抗氧化性能。
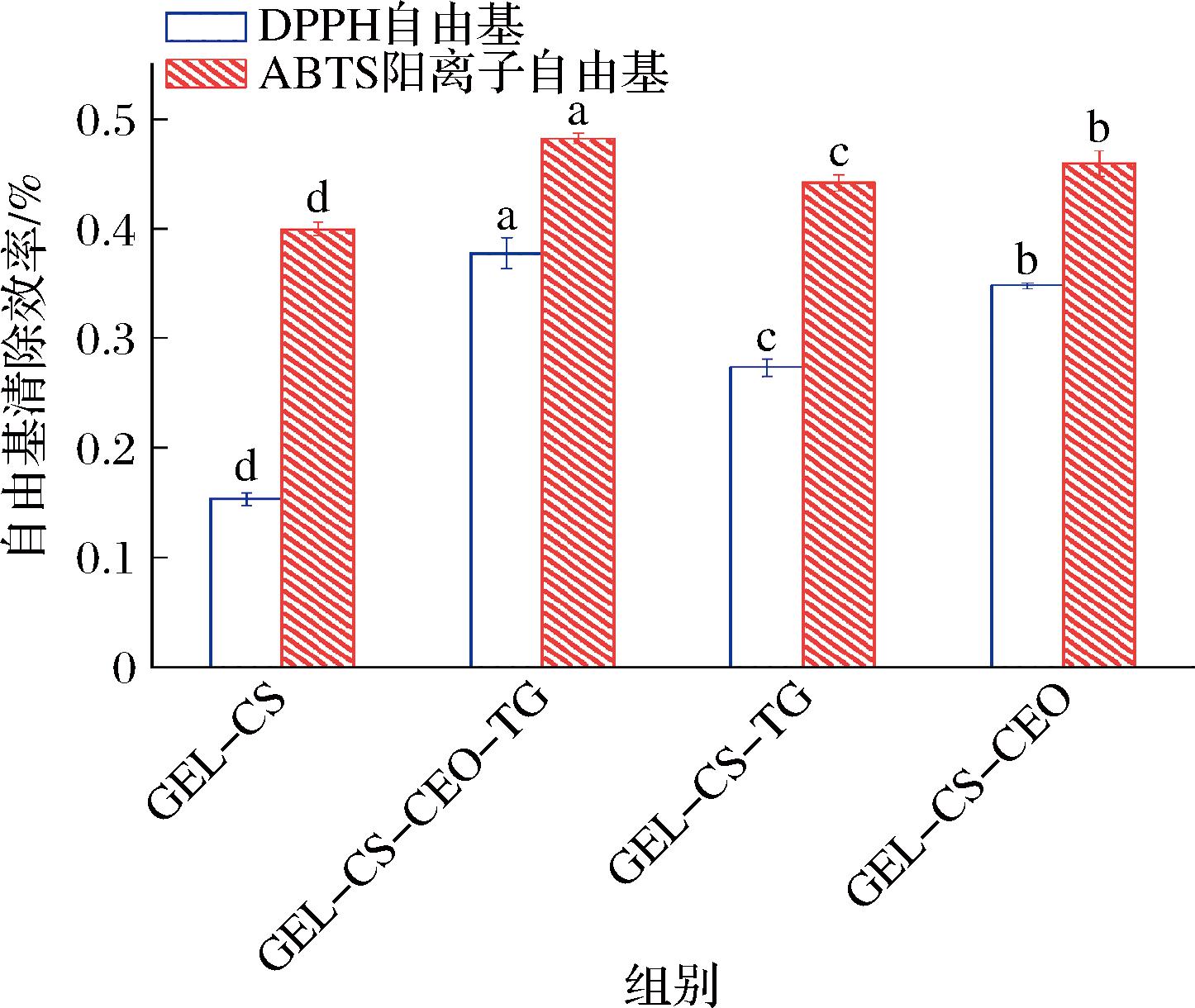
图8 可食用膜的抗氧化活性
Fig.8 Antioxidant activity of edible films
2.10 扫描电子显微镜分析
从图9中可以清晰地观察到膜的表面结构和横截面形态。GEL-CS膜的表面粗糙,横截面没有明显的空隙以及裂缝。GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜扫描电子显微镜结果与GEL-CS膜基本相似。这表明TG和CEO与GEL-CS具有很高的相容性。GEL-CS-TG膜表面出现褶皱,横截面更加均匀致密,这可能是因为在TG的作用下,膜基质交联过度导致可食用膜表面起皱。与GEL-CS膜相比,GEL-CS-CEO膜的表面更光滑,但横截面出现一些空隙,这可能是由于CEO在膜中聚集,分散不均匀的原因[29]。GEL-CS-CEO-TG膜表面光滑,横截面出现由于TG交联过度形成的褶皱以及精油聚集形成的空隙。此外,由于膜基质的物理性质不同,也可能会导致膜变得粗糙起皱[30]。这些形态结构的改变,与上文中水敏感性分析的结果相一致。

a-不同膜表面(50 μm);b-不同膜横截面(50 μm)
图9 可食用膜表面和横截面扫描电镜图
Fig.9 Scanning electron microscope images of the surface and cross-section of edible films
2.11 抑菌活性
如图10所示,GEL-CS膜抑菌效果较差,这是因为CS成为膜形态时,活性氨基隐藏,从而降低CS本身的抗菌活性[31]。与GEL-CS相比,GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜对两种细菌的抑菌活性均显著提高(P<0.05),这可能是因为在TG和CEO的作用下,膜交联更加致密,特别是在只添加CEO的膜中,24 h后,与GEL-CS相比,GEL-CS-CEO膜的大肠杆菌抑菌性能提高了68%,金黄色葡萄球菌的抑菌性能提高49%,这可能是因为精油中的酚类化合物和亲脂性官能团扰乱细胞质膜或使细胞内容物凝固,从而抑制微生物生长,具有较好的抑菌效果[32]。此外,添加CEO的膜对金黄色葡萄球菌的抑制作用大于大肠杆菌,这是因为革兰氏阳性菌对精油更加敏感,革兰氏阴性菌表面的脂多糖形成了一个渗透性屏障,可以阻止疏水化合物进入细菌细胞。
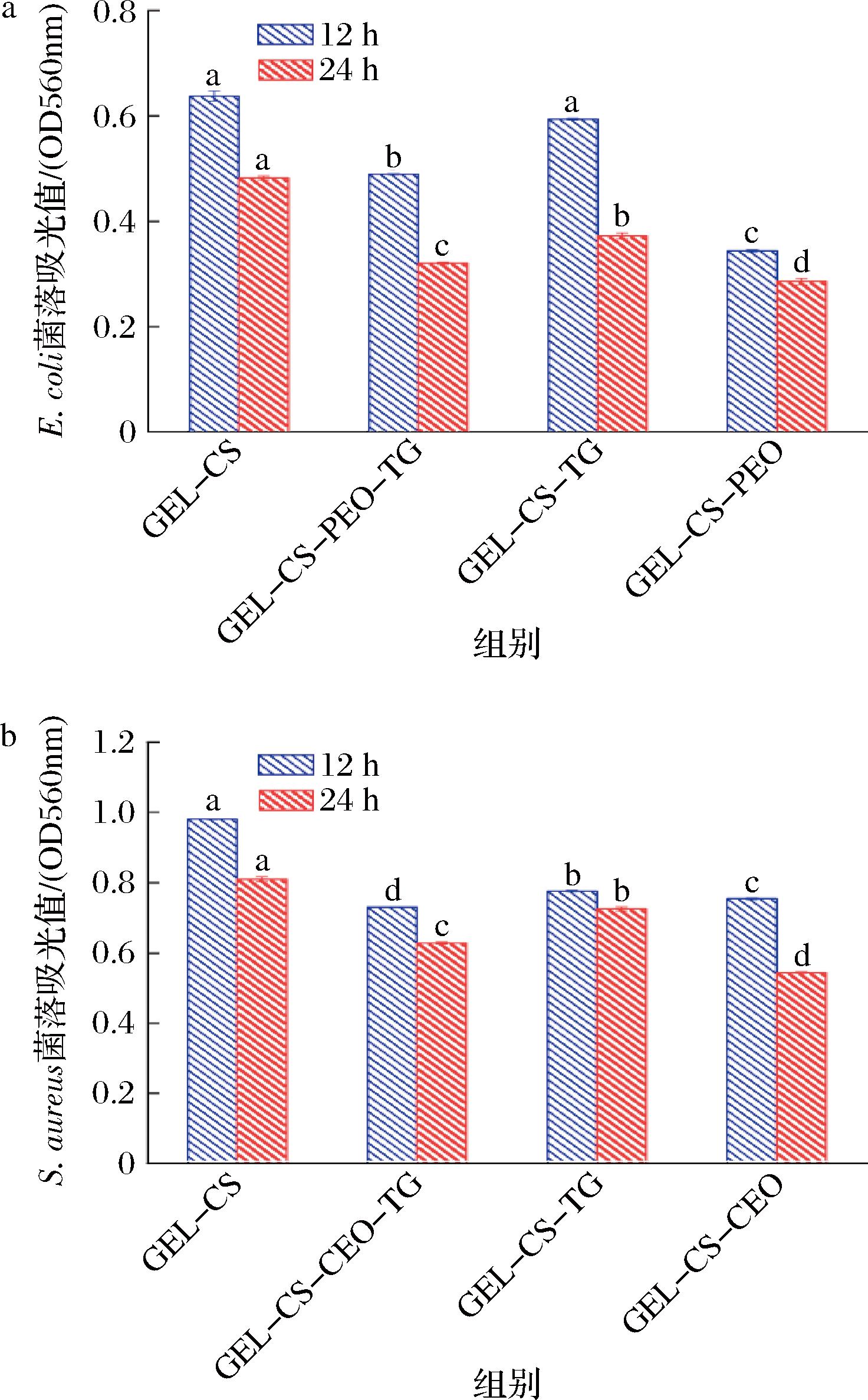
a-大肠杆菌;b-金黄色葡萄球菌
图10 可食用膜在12 h和24 h条件下大肠杆菌和金黄色葡萄球菌的比浊吸光值
Fig.10 Turbidimetric absorbance values of edible films for E. coli and S. aureus at 12 and 24 h
2.12 脂质氧化分析
硫代巴比妥酸(thiobarbituric acid reactive substances,TBARS)值反映了含脂食品中脂质过氧化的程度,一般认为鱼肉中的TBARS值超过1 mg/kg不可接受。如图11所示,由于黑鱼不饱和脂肪酸含量高易氧化,贮藏前4 d,鱼肉TBARS值增长趋势平缓,之后空白组鱼肉TBARS迅速增加,在第4天后达到阈值(1 mg/kg)。而GEL-CS组在6 d时接近阈值,GEL-CS-TG组和GEL-CS-CEO组在第8天仍未达到阈值,说明CEO和TG的添加可以增强了膜的性能,这可能与CEO本身所具有的抗氧化活性物质有关[6],也可能是因为在TG的作用下,可食用膜交联度增加,内部结构紧密,具有更高的阻隔性能,从而表现出更好的降低脂质氧化的效果。特别是GEL-CS-CEO-TG膜,可以延缓黑鱼鱼肉脂质氧化4~5 d,具有良好的保鲜效果。
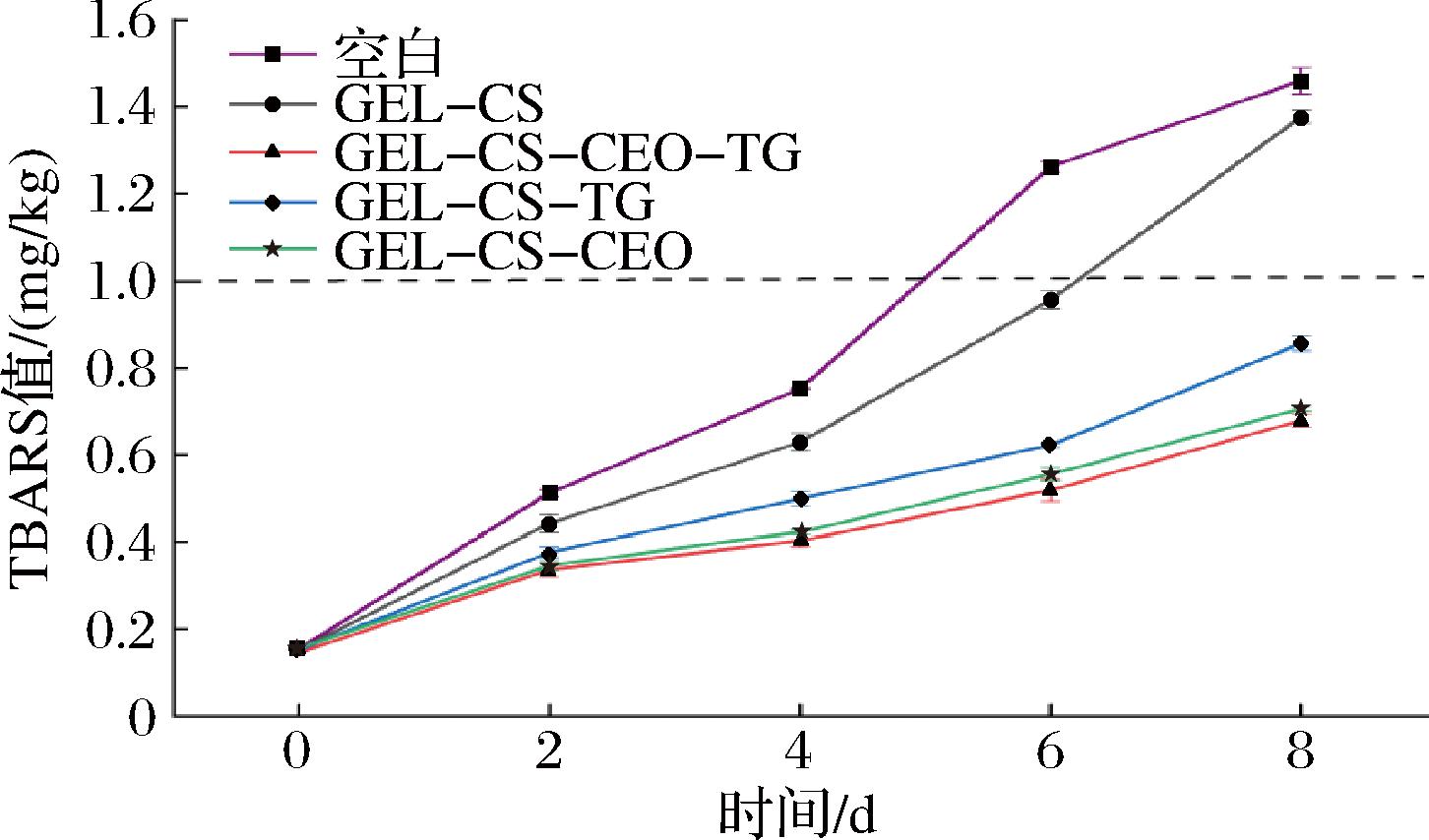
图11 可食用膜对黑鱼鱼肉脂质氧化的影响
Fig.11 Effects of edible films on lipid oxidation in black fish flesh
3 结论
选用安全无毒的GEL和CS作为复合基质,CEO为功能性成分,TG作为酶交联剂添加至膜基质中制备膜。结果显示,添加TG、CEO后膜的综合性能更优。与GEL-CS膜相比,GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜的物理性能均显著提升(P<0.05),GEL-CS-CEO-TG膜的机械性能最优,TS达到4.21 MPa。GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜均为疏水膜,且具有致密的分子结构和表面纹理结构,CEO、TG与膜基质具有良好互容性。GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜抗氧化性能均显著提高(P<0.05)。与空白组相比,GEL-CS-TG、GEL-CS-CEO和GEL-CS-CEO-TG膜可以延缓鱼肉脂质氧化,其中GEL-CS-CEO-TG膜将黑鱼鱼肉的保存时间延长了4~5 d。综上,本研究为可食用食品包装膜的研发提供了一定的理论基础和数据支撑。
[1] CHEN W,LI X Y,ZHANG W G,et al.Physicochemical properties,photostability,and digestive characteristics of natural emulsion system fabricated by recombinant rice bran oil bodies for lutein ester delivery[J].Food Hydrocolloids,2024,156:110270.
[2] YOUNIS H G R,ABDELLATIF H R S,YE F Y,et al.Tuning the physicochemical properties of apple pectin films by incorporating chitosan/pectin fiber[J].International Journal of Biological Macromolecules,2020,159:213-221.
[3] RAWAT R,SAINI C S.A novel biopolymeric composite edible film based on sunnhemp protein isolate and potato starch incorporated with clove oil:Fabrication,characterization,and amino acid composition[J].International Journal of Biological Macromolecules,2024,268:131940.
[4] ZHANG X,LIU J,YONG H M,et al.Development of antioxidant and antimicrobial packaging films based on chitosan and mangosteen (Garcinia mangostana L.) rind powder[J].International Journal of Biological Macromolecules,2020,145:1129-1139.
[5] 杜易潼,王颖,薛婉玉,等.樟科植物精油的研究进展[J].食品科学,2023,44(13):346-359.DU Y T,WANG Y,XUE W Y,et al.Research progress on essential oils from Lauraceae plants[J].Food Science,2023,44(13):346-359.
[6] KIM H,BEAK S E,SONG K B.Development of a hagfish skin gelatin film containing cinnamon bark essential oil[J].LWT,2018,96:583-588.
[7] BIGI A,COJAZZI G,PANZAVOLTA S,et al.Mechanical and thermal properties of gelatin films at different degrees of glutaraldehyde crosslinking[J].Biomaterials,2001,22(8):763-768.
[8] SUN J,WANG L Y,CHEN H,et al.Preparation and application of edible film based on sodium carboxymethylcellulose-sodium alginate composite soybean oil body[J].Coatings,2023,13(10):1716.
[9] FAUZAN H R,NINGRUM A,SUPRIYADI S.Evaluation of a fish gelatin-based edible film incorporated with Ficus carica L.leaf extract as active packaging[J].Gels,2023,9(11):918.
[10] ZOLFAGHARI A,BAZARGANI-GILANI B,AGHAJANI N.Edible film based on corn zein containing dill extract and essential oil/β-cyclodextrin inclusion complex:Shelf life enhancement of common carp fillet[J].Food Science &Nutrition,2023,11(7):4275-4288.
[11] LUCIANO C G,RODRIGUES M M,LOURENÇO R V,et al.Bi-layer gelatin film:Activating film by incorporation of “pitanga” leaf hydroethanolic extract and/or nisin in the second layer[J].Food and Bioprocess Technology,2021,14(1):106-119.
[12] NEMATI V,HASHEMPOUR-BALTORK F,SADAT GHARAVI-NAKHJAVANI M,et al.Application of a whey protein edible film incorporated with cumin essential oil in cheese preservation[J].Coatings,2023,13(8):1470.
[13] YUAN L Y,FENG W,ZHANG Z,et al.Effect of potato starch-based antibacterial composite films with thyme oil microemulsion or microcapsule on shelf life of chilled meat[J].LWT,2021,139:110462.
[14] LIN D R,ZHENG Y,WANG X,et al.Study on physicochemical properties,antioxidant and antimicrobial activity of okara soluble dietary fiber/sodium carboxymethyl cellulose/thyme essential oil active edible composite films incorporated with pectin[J].International Journal of Biological Macromolecules,2020,165:1241-1249.
[15] ZHOU X Y,LIU X L,LIAO W Y,et al.Chitosan/bacterial cellulose films incorporated with tea polyphenol nanoliposomes for silver carp preservation[J].Carbohydrate Polymers,2022,297:120048.
[16] 倪乙丹,周泉城,李娅婕,等.基于酪氨酸酶交联的豌豆蛋白-绿原酸-壳聚糖复合膜的构建及相关品质分析[J].食品科学,2024,45 (21):271-279. NI Y D,ZHOU Q C,LI Y J,et al.Construction and characterization of pea protein-chlorogenic acid-chitosan composite film based on tyrosinase crosslinking[J].Food Science,2024,45(21):271-279.
[17] BENBETTAÏEB N,KARBOWIAK T,BRACHAIS C H,et al.Coupling tyrosol,quercetin or ferulic acid and electron beam irradiation to cross-link chitosan-gelatin films:A structure-function approach[J].European Polymer Journal,2015,67:113-127.
[18] LIU Z Y,GE X J,LU Y,et al.Effects of chitosan molecular weight and degree of deacetylation on the properties of gelatine-based films[J].Food Hydrocolloids,2012,26(1):311-317.
[19] SHAO X R,SUN H T,JIANG R P,et al.Physical and antibacterial properties of corn distarch phosphate/carboxymethyl cellulose composite films containing tea polyphenol[J].Journal of Food Processing and Preservation,2020,44(4):e14401.
[20] ZHOU X,ZHAO J L,ZHAO X,et al.Oil bodies extracted from high-oil soybeans (Glycine max) exhibited higher oxidative and physical stability than oil bodies from high-protein soybeans[J].Food &Function,2022,13(6):3271-3282.
[21] NORAJIT K,KIM K M,RYU G H.Comparative studies on the characterization and antioxidant properties of biodegradable alginate films containing ginseng extract[J].Journal of Food Engineering,2010,98(3):377-384.
[22] KARBOWIAK T,DEBEAUFORT F,VOILLEY A.Importance of surface tension characterization for food,pharmaceutical and packaging products:A review[J].Critical Reviews in Food Science and Nutrition,2006,46(5):391-407.
[23] ABDIN M,EL-BELTAGY A E,EL-SAYED M E,et al.Production and characterization of sodium alginate/gum Arabic based films enriched with Syzygium cumini seeds extracts for food application[J].Journal of Polymers and the Environment,2022,30(4):1615-1626.
[24] AKHTAR H M S,RIAZ A,HAMED Y S,et al.Production and characterization of CMC-based antioxidant and antimicrobial films enriched with chickpea hull polysaccharides[J].International Journal of Biological Macromolecules,2018,118:469-477.
[25] FENG M Y,YU L,ZHU P T,et al.Development and preparation of active starch films carrying tea polyphenol[J].Carbohydrate Polymers,2018,196:162-167.
[26] ALMASI H,AZIZI S,AMJADI S.Development and characterization of pectin films activated by nanoemulsion and Pickering emulsion stabilized marjoram (Origanum majorana L.) essential oil[J].Food Hydrocolloids,2020,99:105338.
[27] KHARROUBI M,BELLALI F,KARRAT A,et al.Preparation of Teucrium polium extract-loaded chitosan-sodium lauryl sulfate beads and chitosan-alginate films for wound dressing application[J].AIMS Public Health,2021,8(4):754-775.
[28] SUN J,WANG L Y,CHEN H,et al.Enhancing biodegradable packaging:The role of tea polyphenols in soybean oil body emulsion films[J].Coatings,2025,15(2):162.
[29] LAVINIA M,HIBARTURRAHMAN S N,HARINATA H,et al.Antimicrobial activity and application of nanocomposite coating from chitosan and ZnO nanoparticle to inhibit microbial growth on fresh-cut papaya[J].Food Research,2019,4(2):307-311.
[30] JRIDI M,ABDELHEDI O,SALEM A,et al.Physicochemical,antioxidant and antibacterial properties of fish gelatin-based edible films enriched with orange peel pectin:Wrapping application[J].Food Hydrocolloids,2020,103:105688.
[31] KATAN T,KARGL R,MOHAN T,et al.Solid phase peptide synthesis on chitosan thin films[J].Biomacromolecules,2022,23(3):731-742.
[32] LIN D R,WU Z J,HUANG Y C,et al.Physical,mechanical,structural and antibacterial properties of polyvinyl alcohol/oregano oil/graphene oxide composite films[J].Journal of Polymers and the Environment,2020,28(2):638-646.