2-苯乙醇(2-phenylethanol,2-PE)是一种具有玫瑰香气的芳香醇,广泛应用于食品、日化及医药领域。目前其生产主要依赖化学合成与天然提取,但前者因反应条件苛刻及副产物有毒限制了应用,后者则因植物原料提取效率低导致成本高昂[1]。相较之下,微生物转化法因反应温和、环境友好且产量可控,成为研究热点。
鲁氏接合酵母(Zygosaccharomyces rouxii)常用于酱油发酵产香,适配规模化生产。其耐高盐高渗[2-4]与强酸强碱[5]的优秀抗逆性,使其在高底物浓度下可保持较高的活性,能够适应工业化高底物浓度或极端环境。也一定程度规避了当前代谢工程改造合成2-PE[6-8]的主流模式菌株如酿酒酵母[9]、地衣芽孢杆菌[10]和大肠杆菌[11]等所面临的产物毒性问题[12]。
当前生物合成2-PE主要围绕莽草酸途径(shikimate pathway)与艾氏途径(Ehrlich pathway)。通过构建从头合成途径[13-16]或强化艾氏途径[6,7,9,11]提高酿酒酵母、大肠杆菌等菌株的2-PE产量,而Z.rouxii基因组中存在天然高活性苯丙酮酸脱羧酶和醇脱氢酶,L-苯丙氨酸(L-phenylalanine,L-Phe)转化2-PE的能力优异,是高产2-PE的潜力菌种。然而,目前针对Z.rouxii合成2-PE的研究仍较匮乏,其代谢调控机制与工艺优化潜力尚未充分挖掘。本研究结合发酵优化与转录组分析,通过单因素试验优化培养基,并选取不同氮源培养下的Z.rouxii进行转录组测序,在转录水平上验证了L-Phe可显著提高艾氏途径通量以增加2-PE产量。最终在发酵罐水平优化2-PE发酵工艺,通过pH调控与补料发酵得到2-PE产量4.10 g/L(如图1)。本研究不仅填补了Z.rouxii合成2-PE的研究缺口,更通过耐受性优势与工艺结合,为突破现有菌种的毒性限制和复杂代谢负担提供了新思路,推动生物法2-PE向绿色高效工业化生产迈进。
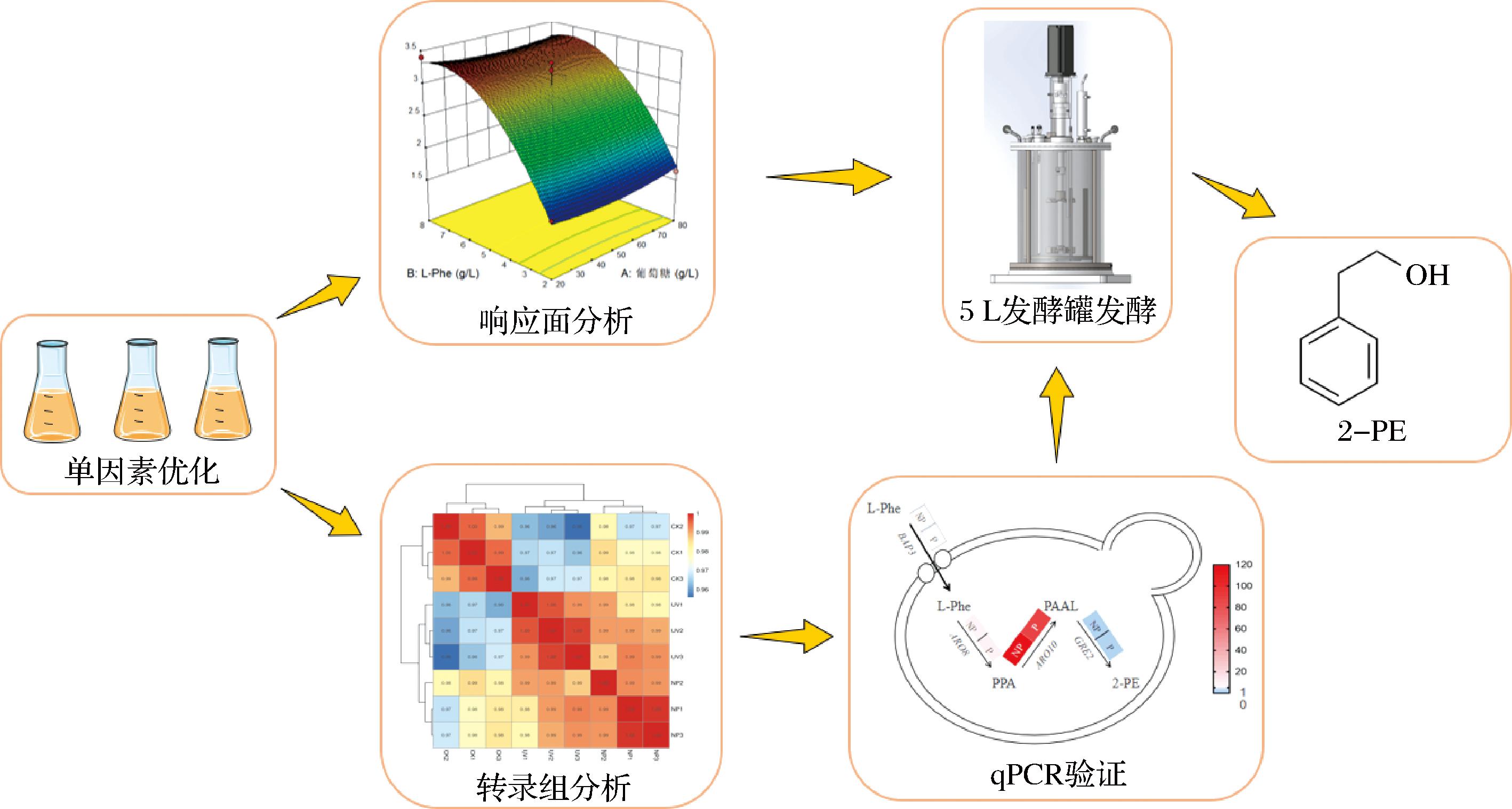
图1 Z.rouxii 2-PE发酵优化与转录组分析
Fig.1 Optimization of 2-phenylethanol fermentation and transcriptomic analysis of Z.rouxii
1 材料与方法
1.1 材料与仪器
Z.rouxii CBS732,保藏于湖北工业大学发酵工程教育部重点实验室。
葡萄糖、蔗糖、(NH4)2SO4、MgSO4·7H2O、K2HPO4(均为分析纯),国药集团化学试剂有限公司;蛋白胨、酵母浸粉(生化试剂),安琪酵母股份有限公司;L-Phe、维生素B1(分析纯),麦克林试剂有限公司;酵母基础氮源(yeast nitrogen base,YNB),美国Becton Dickinson;2-PE(色谱级),西格玛奥德里奇贸易有限公司;总RNA提取试剂盒,天根生化科技有限公司。
ProFlex Base PCR仪,德国Eppendorf公司;QuanStudio 3实时荧光定量PCR系统、NanoDrop OneC微量UV-Vis分光光度计、UltiMate 3000高效液相色谱,赛默飞世尔科技有限公司;YXQ-75SII立式压力蒸汽灭菌器,上海博迅医疗生物仪器有限公司;AL104电子分析天平,梅特勒-托利多(上海)有限公司;HNY-211B全温摇床,天津欧诺仪器仪表有限公司;Centrifuge 5804 R高速中等通量台式离心机,德国Eppendorf公司;V-1300紫外可见分光光度计,上海美析仪器有限公司;FiveEasy Plus FP20 pH计,梅特勒-托利多(上海)有限公司;Applikon ez2-Control 5 L生物反应器,瑞典Getinge医疗科技公司。
1.2 培养基
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基(g/L):20葡萄糖、20蛋白胨、10酵母粉,固体培养基添加2%琼脂粉。
2-PE发酵培养基(g/L):30葡萄糖、8蔗糖、1.7 YNB、4.5 (NH4)2SO4、0.5 MgSO4·7H2O。
1.3 单因素优化
在2-PE发酵培养基基础上,针对氮源[(NH4)2SO4、L-Phe]、碳源(葡萄糖、蔗糖、果糖)、无机盐(MgSO4·7H2O、K2HPO4)、YNB[无(NH4)2SO4]进行优化。
设置L-Phe为唯一氮源(0、2、4.5、6、8、10 g/L),再探究双氮源对2-PE产量影响。碳源优化选择葡萄糖(20、30、60、100、150 g/L)、果糖(质量浓度同葡萄糖)、蔗糖(质量浓度同葡萄糖);无机盐选择MgSO4·7H2O[17](0、0.2、0.4、0.6、0.8、1 g/L)与K2HPO4[18](0、0.5、1、2、3、4 g/L);YNB优化质量浓度为0、0.7、1.2、1.7、2.2、2.7 g/L。取48 h样品测定生物量以及2-PE质量浓度。
1.4 L-Phe与2-PE的测定
取2 mL发酵液,4 ℃、12 000 r/min离心5 min,取上清液,稀释后通过0.22 μm微孔滤膜过滤,用于测定发酵液中2-PE与L-Phe。2-PE与L-Phe的液相色谱分析条件相同:C18色谱柱,甲醇(色谱级)和纯水混合液(体积比6∶4)为流动相,流速0.6 mL/min,进样量10 μL,柱温30 ℃,紫外吸收波长210 nm,以各自的标准样品绘制标准曲线,通过标准曲线计算2-PE和L-Phe质量浓度。
1.5 测序数据质控与分析
原始测序数据经FastQC(V0.10.1)进行质量评估,经Cutadapt(V1.9.1)剔除低质量序列(<20),获得高质量质控数据用以后续分析。使用Illumina HiSeq测序平台进行数据处理分析,在建立不同氮源培养基培养的Z.rouxii转录组数据库后,对数据进行全面分析注释,以(NH4)2SO4为单一氮源生长的Z.rouxii为对照组,双氮源与单一L-Phe培养的Z.rouxii为实验组。主要研究原始序列质量评估、参考基因比对分析、基因表达水平分析[19-20]。
1.6 荧光定量PCR实验
通过总RNA提取试剂盒提取RNA。经Nanodrop检测RNA浓度和质量;使用4×gDNA wiper Mix,42 ℃孵育2 min去除基因组DNA。5×HiScript Ⅱ QRT SuperMix将RNA逆转录为cDNA。以逆转录的cDNA为模板,使用ChamQ universal SYBR qPCR Master Mix试剂配成相应体系,在实时荧光定量PCR仪中进行PCR扩增。其中ENO1为内参基因,计算方法为2-ΔΔt,使用的引物见表1。
表1 qPCR所用引物
Table 1 Primers used in qPCR

基因引物名称序列ENO1ENO1-FGTAAGAAGCAATACGGTCCATENO1-RTCAGAAGAAGCACAGTCCATGRE2GNP1-FGCTGATAAGGATGCTGTCTGNP1-RAGGACCGAACACAAGAACBAP3BAP3-FTCTGCCTATGGTGTCTTCTBAP3-RTTGCTTGCTTGTGTTCTTCARO8ARO8-FCTAATCTAATGACACGACCTTCARO8-RTCTTGGTGTAGGTGATGGTARO10ARO10-FTCTTGGTGTAGGTGATGGTARO10-RTTGAAGTTGTGCTGGATAGT
1.7 发酵罐培养
将活化至对数期(OD600≈10)的Z.rouxii以2%(体积分数)接种量接入5 L发酵罐,发酵周期72 h。发酵参数控制为:30 ℃,300 r/min,通气量0.3 L/min。21 h补料葡萄糖和L-Phe,发酵期间每3 h取样分别测定OD600值、2-PE产量、L-Phe残留量。
2 结果与分析
2.1 Z.rouxii产2-PE的培养基优化
2.1.1 氮源的优化
(NH4)2SO4为唯一氮源时,Z.rouxii主要消耗葡萄糖从头合成2-PE,其生物合成途径复杂,且存在多种反馈抑制因子,2-PE的产量低[21]。而L-Phe作为氮源时,Z.rouxii通过艾氏途径产2-PE,优于(NH4)2SO4驱动的莽草酸途径。因此,本节主要研究产2-PE的最佳L-Phe质量浓度,并探究有机氮源与无机氮源共存时2-PE的产量是否受影响。
由图2可知,L-Phe质量浓度在4.5~10 g/L时,2-PE产量接近,但随着L-Phe质量浓度增加,其转化效率降低,且高质量浓度L-Phe对生物量有潜在抑制趋势。因此L-Phe最佳质量浓度为4.5 g/L。
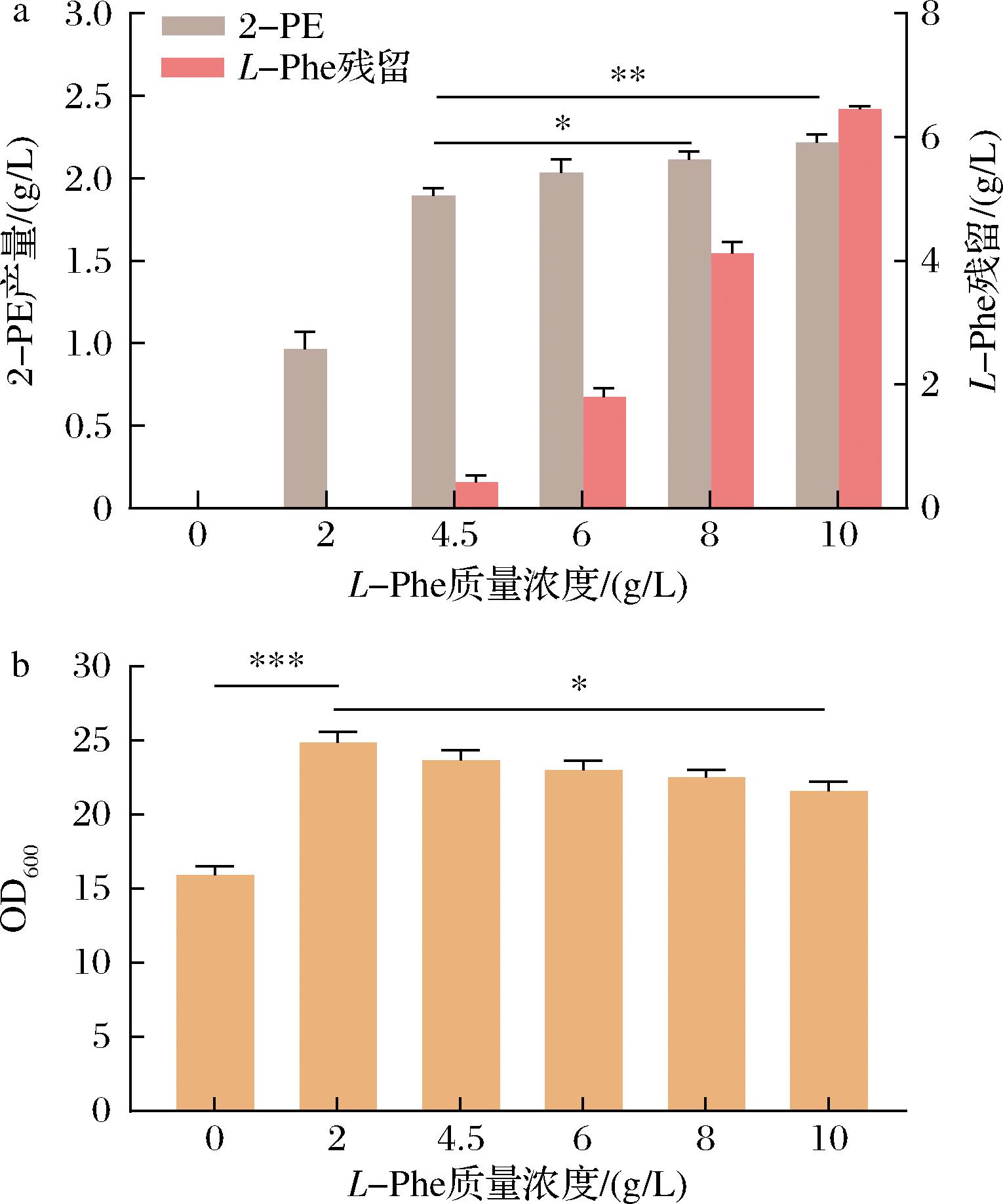
a-2-PE产量;b-Z.rouxii生物量
图2 不同质量浓度L-Phe对2-PE产量与Z.rouxii生物量的影响
Fig.2 Impact of L-Phe levels on 2-PE production and Z.rouxii biomass
注:*表示差异显著(P<0.05),**表示差异非常显著(P<0.01),***表示差异极显著(P<0.001)(下同)。
(NH4)2SO4会推动Z.rouxii进行莽草酸途径合成2-PE,因此观察在4.5 g/L L-Phe条件下额外补充(NH4)2SO4(0、2.25、4.5、6.75、9 g/L,)对2-PE的影响如图3所示。通过单因素方差分析可知,添加(NH4)2SO4会触发氮阻遏现象,显著降低生物量和2-PE产量,尤其在高质量浓度时表现明显[22]。因此选择最终氮源条件:4.5 g/L L-Phe。

图3 附加不同质量浓度(NH4)2SO4对Z.rouxii发酵的影响
Fig.3 Effect of adding different concentrations of ammonium sulfate on the fermentation of Z.rouxii
注:对照组设置为4.5 g/L (NH4)2SO4为唯一氮源,其他组为4.5 g/L L-Phe条件下附加的(NH4)2SO4质量浓度。
2.1.2 碳源的优化
Z.rouxii为嗜果糖菌株[23],且除葡萄糖、果糖和蔗糖外其余糖类发酵时2-PE产量较低[18,24-25],因此选用果糖、蔗糖与葡萄糖进行碳源优化。
从图4可知,3种碳源在适宜的质量浓度下都有最大2-PE产量,随着碳源质量浓度增大,生物量以及2-PE产量都逐渐下降,可能是高质量浓度糖对酵母菌株产生了胁迫,细胞膜功能发生变化后产生一系列生理反应[26]导致2-PE产量下降。
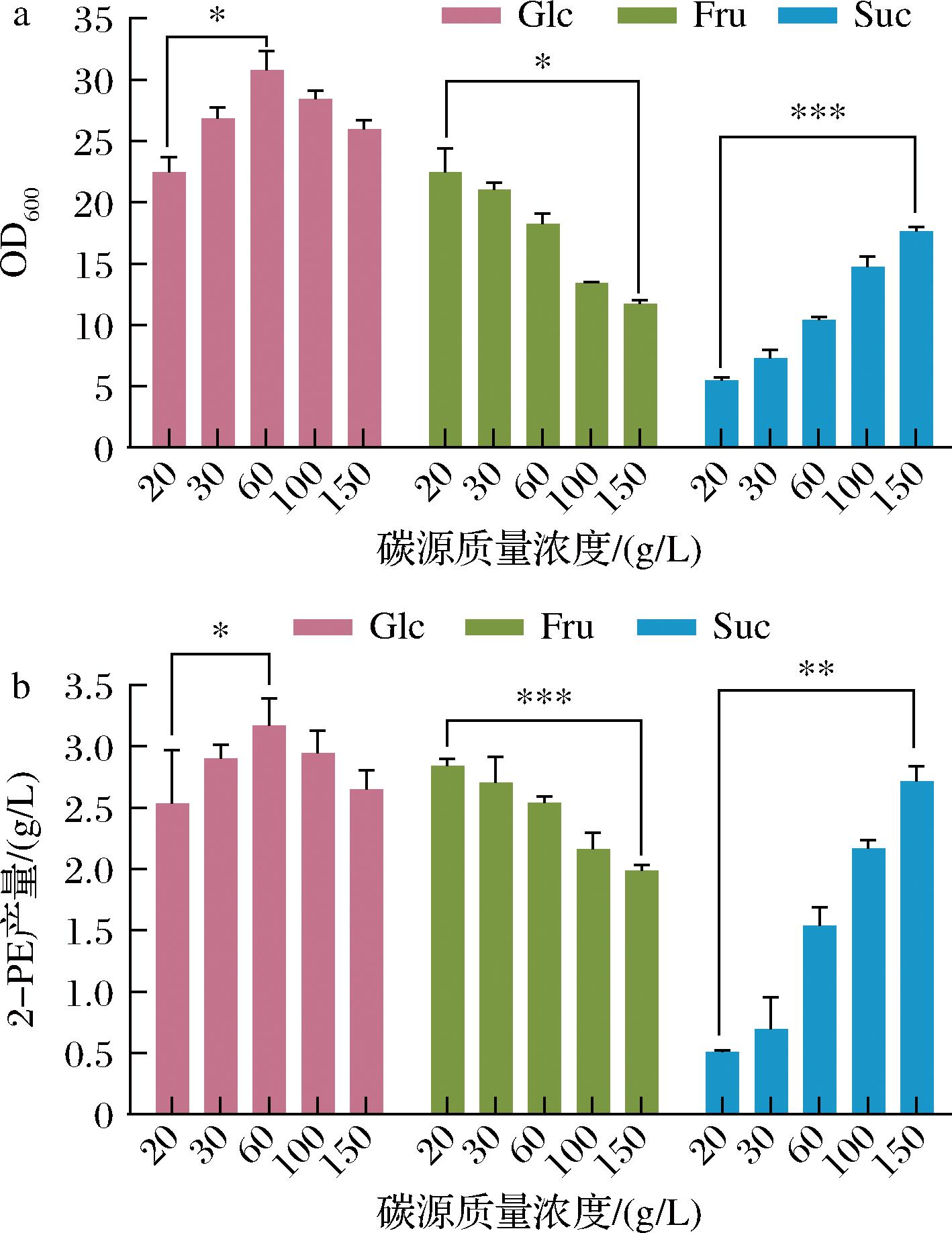
a-Z.rouxii生物量;b-2-PE产量
图4 不同碳源下Z.rouxii生长与产2-PE情况
Fig.4 Growth and 2-PE production by Z.rouxii under different carbon sources
经one-way ANOVA方差检验后,3种碳源的浓度差均对酵母的生物量以及2-PE的产量产生显著影响(P<0.05)。虽利用葡萄糖时显著性不及利用果糖和蔗糖,但葡萄糖为唯一碳源时,其最大生物量以及2-PE产量都高于利用果糖和蔗糖。果糖在20 g/L时有最大产量,比相同质量浓度葡萄糖的产量高出12.1%,但随着葡萄糖质量浓度增至60 g/L,产量反超果糖11%,推测Z.rouxii对果糖的响应比葡萄糖快,但葡萄糖的转化上限更高。相比之下,蔗糖在150 g/L下产量才跟果糖持平,且不及葡萄糖最大产量。综合考虑生物量和2-PE产量,最终选择葡萄糖作为发酵的唯一碳源,质量浓度在60 g/L。
2.1.3 YNB的优化
YNB即酵母氮源基础,由氮源、微量元素、维生素及无机盐等复配而成,主要为酵母菌培养提供无氨基氮源和生长因子。2.1.1节中发现(NH4)2SO4对2-PE的合成有一定阻遏作用,因此选用无氨基酸无(NH4)2SO4的YNB进行优化。
无氨基酸无(NH4)2SO4的YNB对Z.rouxii的发酵影响如图5所示。随着YNB质量浓度增大,生物量和2-PE均是先增加后降低,在1.7 g/L时2-PE产量达到最大值。分析可知YNB的质量浓度对2-PE的发酵影响非常显著(P<0.01),YNB最佳质量浓度为1.7 g/L。
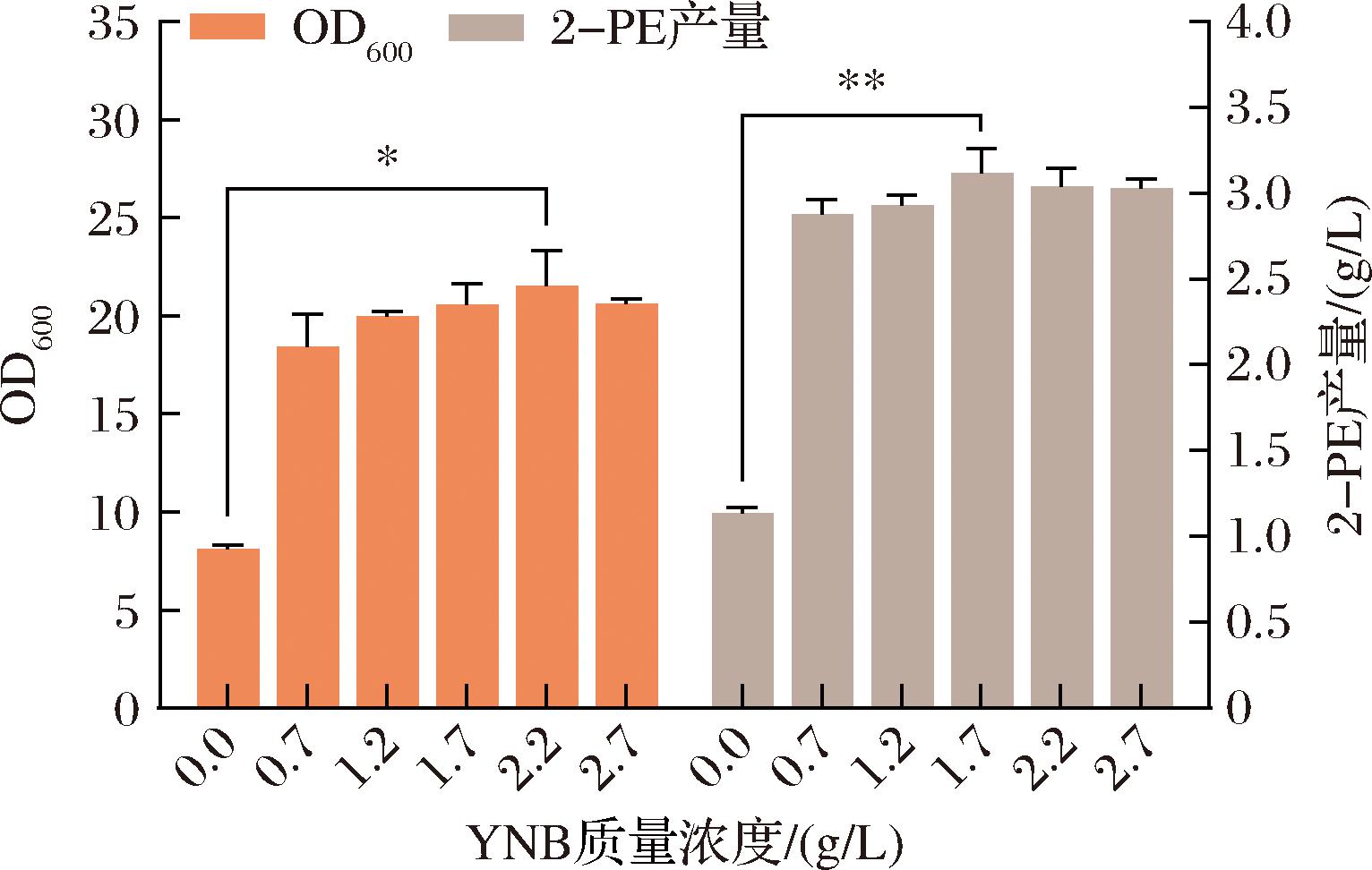
图5 不同YNB质量浓度对Z.rouxii发酵2-PE的影响
Fig.5 Effects of different YNB concentrations on the fermentation of 2-PE by Z.rouxii
2.1.4 无机盐的优化
酵母在生长发育过程中,其体内各种代谢途径与内环境的稳定需要金属离子维持。在Z.rouxii体内,某些关键途径如糖酵解途径、三羧酸循环及某些氨基酸的产生需要Mg2+作为重要酶激活剂;而其内环境的稳定主要依赖K+离子提供中性pH缓冲条件和部分酶反应环境[24]。因此,选择MgSO4·7H2O与K2HPO4进行优化。
不同质量浓度MgSO4·7H2O对2-PE产量以及生物量的影响如图6-a所示,在0.8 g/L时2-PE产量达到最高。分析可知MgSO4·7H2O对生物量无显著影响,但对2-PE产量影响非常显著(P<0.01)。K2HPO4对2-PE产量以及生物量的影响如图6-b所示,其质量浓度的改变对生物量影响不大,但对2-PE产量呈负相关,推测中性pH环境不利于合成2-PE(P<0.001)。因此后续发酵不添加K2HPO4。
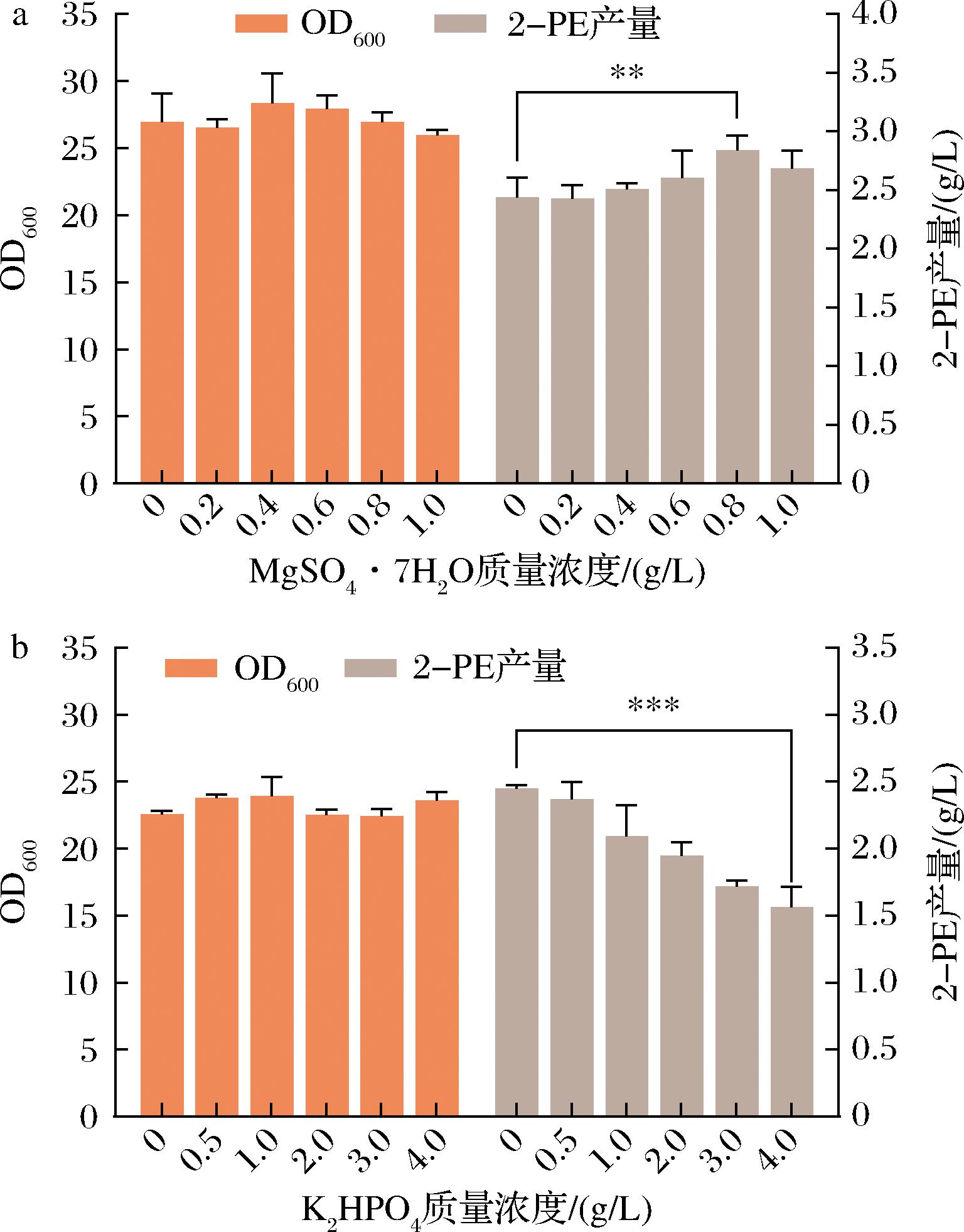
a-MgSO4·7H2O;b-K2HPO4
图6 无机盐对Z.rouxii生长与2-PE产量的影响
Fig.6 Impact of inorganic salts on Z.rouxii growth and 2-PE yield
2.1.5 响应面试验
为确定产2-PE的最佳培养基组成,在单因素试验基础上,选取对实验结果影响较大的因素:葡萄糖、L-Phe、MgSO4·7H2O为考察对象,采用响应面试验中Box-Behnken设计,以2-PE产量为因变量设计三因素三水平进行实验。实验结果见表2,该模型差异极显著(P<0.001),失拟项P值为0.864 8,(>0.05表示并不显著),在调整后,RAdj2=90.21%表明该模型能解释90.21%的关键因子对产2-PE的影响,模型构建较成功。但在因子影响上除了L-Phe极为显著,其他因子均不显著,且交互作用较弱,说明L-Phe对Z.rouxii合成2-PE的影响远远大于其他因素,也说明了该酵母对艾氏途径的响应程度高。
表2 回归方差分析及显著性检验
Table 2 Regression analysis of variance and significance test
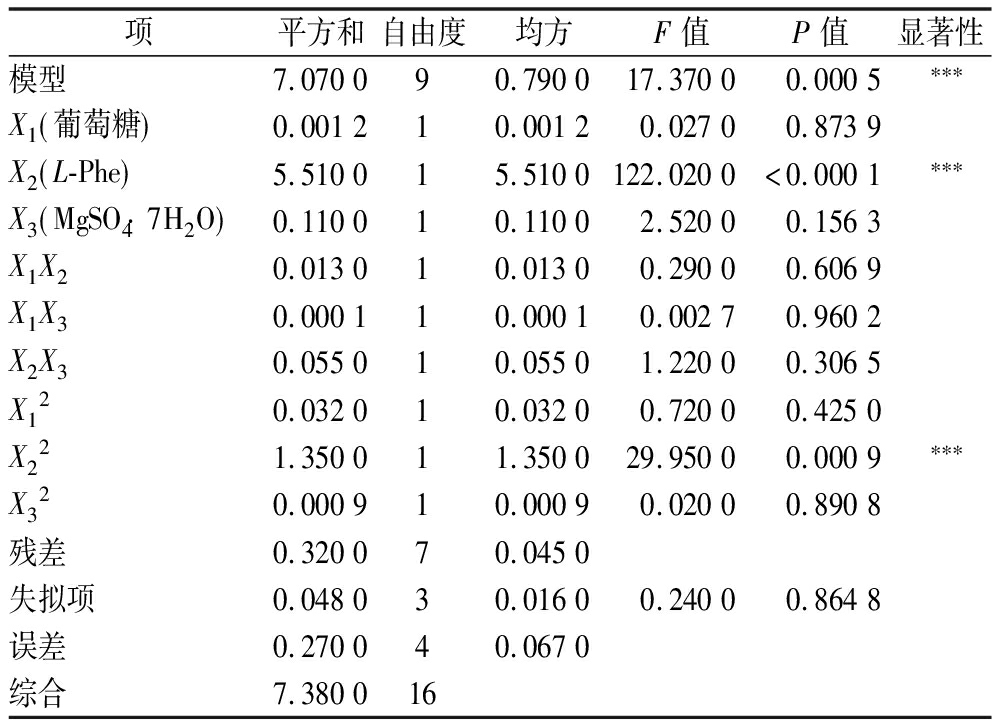
项平方和自由度均方F值P值显著性模型7.070090.790017.3700 0.0005∗∗∗X1 葡萄糖 0.001210.00120.02700.8739X2 L-Phe 5.510015.5100122.0200<0.0001∗∗∗X3 MgSO4 7H2O 0.110010.11002.52000.1563X1X20.013010.01300.29000.6069X1X30.000110.00010.00270.9602X2X30.055010.05501.22000.3065X120.032010.03200.72000.4250X221.350011.350029.95000.0009∗∗∗X320.000910.00090.02000.8908残差0.320070.0450失拟项0.048030.01600.24000.8648误差0.270040.0670综合7.380016
注:*表示差异显著(P<0.05),***表示差异极显著(P<0.001);R2=95.71%,RAdj2=90.21%。
两因素交互作用见图7,从图7-a可知,虽然葡萄糖与L-Phe的交互作用响应面呈抛物线曲面,但等高线呈直线,说明交互作用有响应,但交互作用较弱,MgSO4·7H2O与L-Phe的交互作用与此类似。而图7-b可得葡萄糖与MgSO4·7H2O交互作用的响应面有些许弯曲,等高线稀疏且呈抛物线,交互作用较弱。
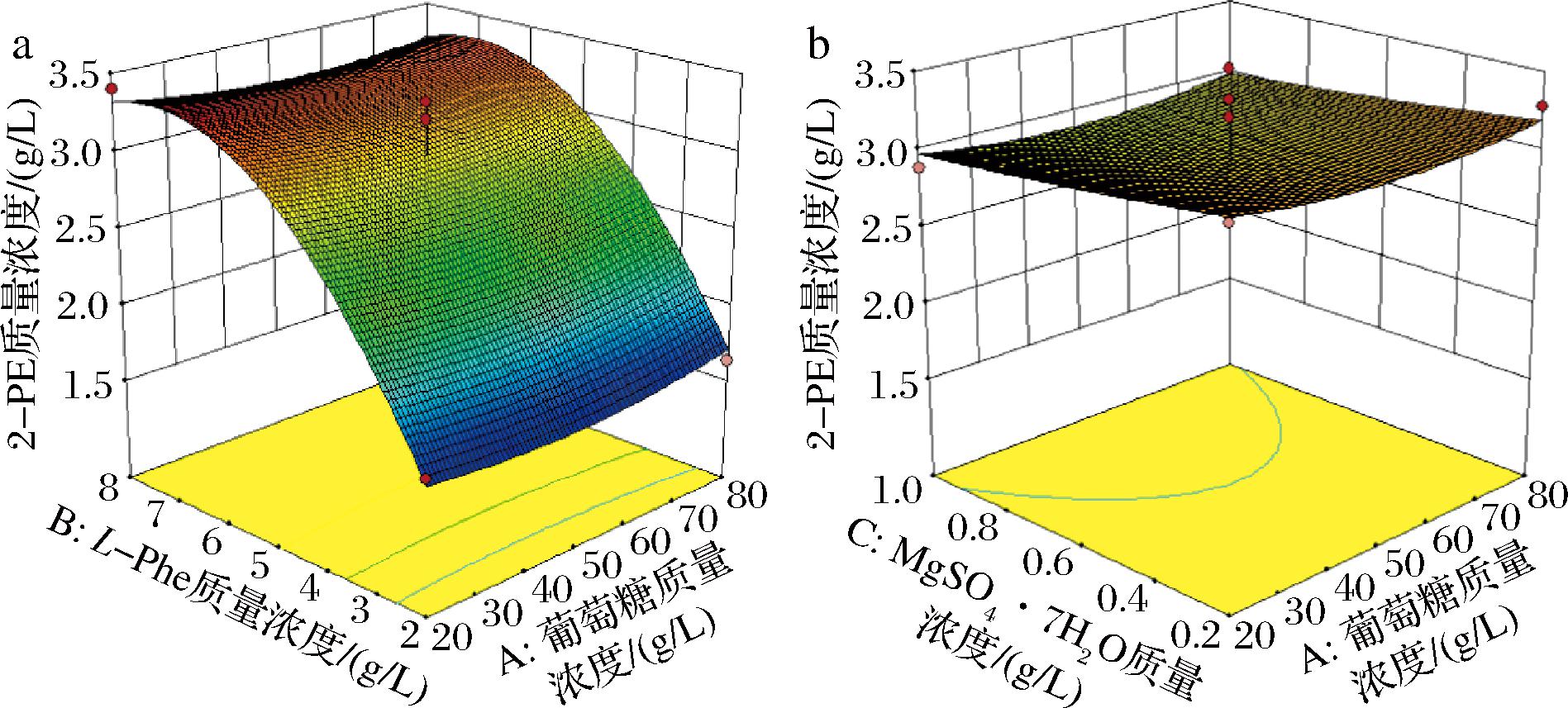
a-葡萄糖与L-Phe交互对2-PE产量影响;b-MgSO4·7H2O与葡萄糖交互对2-PE产量影响
图7 响应面分析各因素对2-PE产量的影响
Fig.7 Response surface analysis of factors influencing 2-PE production
虽然模型构建显著(P=0.000 5<0.001),但总体相互作用较弱,可能是L-Phe影响过大,其余条件影响有限,或是选择的因素梯度跨度较小,造成图7没有达到预期的凹凸状。但也能预测一个最佳的培养基组成,图中响应面最高点即为最佳值,也是对应的最佳工艺条件。预测最佳培养基组成:60 g/L葡萄糖、6.6 g/L L-Phe、0.71 g/L MgSO4·7H2O以及未参与设计的YNB质量浓度为1.7 g/L,理论产量为3.48 g/L,经过试验验证产量为3.35 g/L,与理论值较为贴近,符合预测,并且与优化前2.42 g/L相比提升了38.4%。
2.2 不同氮源培养下Z.rouxii的转录水平分析
2.2.1 差异表达基因分析
结合单因素优化与响应面,发现影响Z.rouxii产2-PE最显著因素为L-Phe。因此,设置3组不同氮源组成的培养基并取生长至对数期的Z.rouxii样品进行转录组测序。3组不同氮源培养分别记为:CK、NP、UV,培养基组分如表3。
表3 CK、NP 和 UV 组培养基成分 单位:g/L
Table 3 Media components in CK,NP,and UV groups

葡萄糖蔗糖YNBL-苯丙氨酸 NH4 2SO4MgSO4 7H2OCK3081.7—4.50.5NP3081.72.50.90.5UV3081.74.5—0.5
注:—表示培养基中不添加该成分。
在对不同氮源组基因表达量定量分析后,对检测结果采用DESeq2软件按照差异显著性标准(差异基因表达变化2倍以上且q value(fdr,Padj)<=0.05)进行筛选。不同氮源处理条件样品基因显著性差异表达上下调数量结果如图8。CK_vs_NP对比组共39个显著差异表达基因,其中上调23个,下调16个基因;在CK_vs_UV对比组间共54个显著差异表达基因,包括上调26个,下调28个;而NP_vs_UV对比组只有3个显著差异表达基因,包括1个上调基因2个下调基因。数据表明在(NH4)2SO4与L-Phe分别作为唯一氮源时转录差异最显著,且对比CK_vs_NP以及NP_vs_UV两组的差异基因数可看出添加一定质量浓度L-Phe作为氮源后,差异表达基因数量显著增加,而添加(NH4)2SO4作为氮源对差异基因表达不显著,这也可能与本研究NP组中添加的(NH4)2SO4质量浓度较低有关。对于差异基因的分析也可作为后续研究的一条思路。
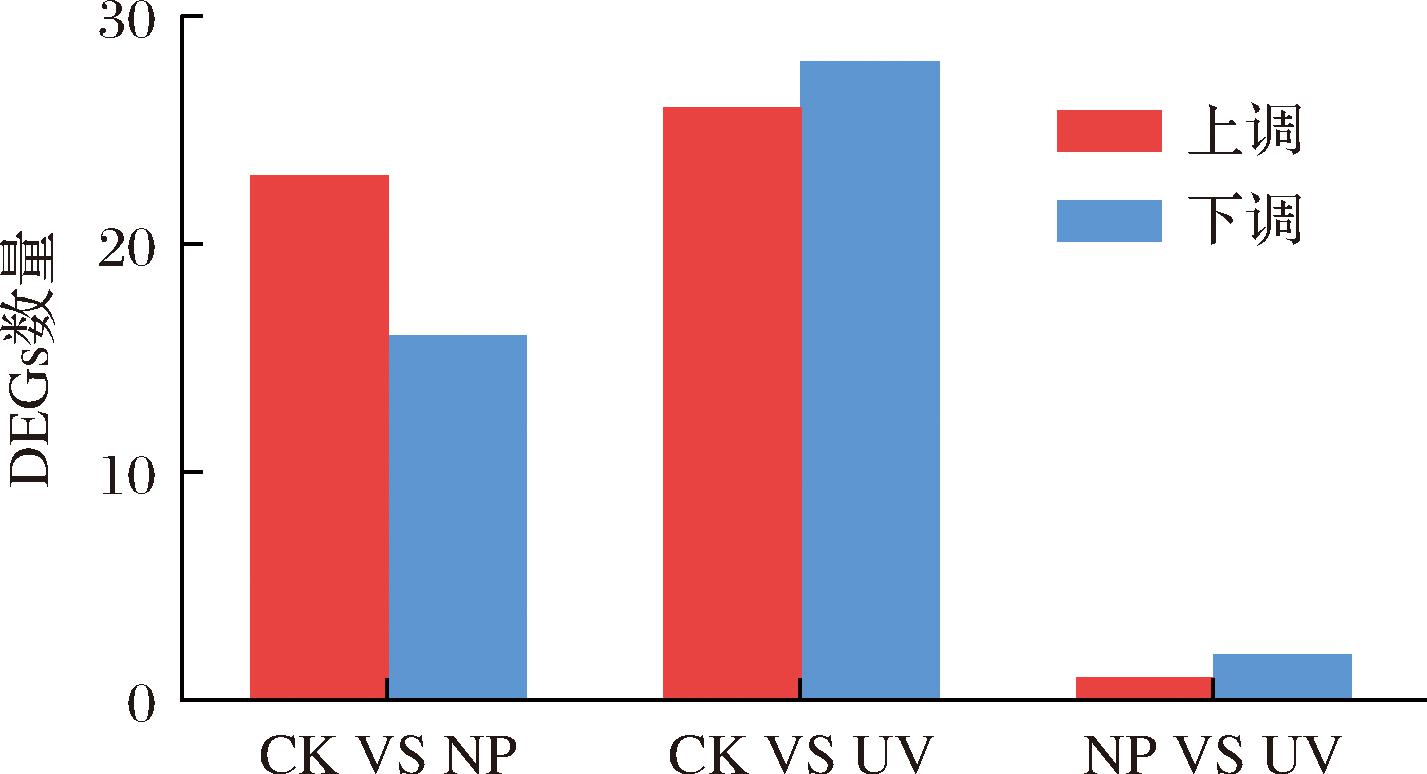
图8 不同样品差异比较基因表达的上下调情况统计
Fig.8 Statistical analysis of up-down-regulation of gene expression in different samples
火山图分析表现了基因表达水平差异的分布状况,可从中筛选出差异表达最为显著的基因进行后续研究。如图9,CK_vs_NP、CK_vs_UV两个对比组之间个别上调基因(如ARO8、ARO10、BAP3等)与CK_vs_UV少许下调基因(如FTR1、ADH2等)-lg(qvalue)值较大,表明这些基因对不同氮源处理的响应值较高;NP_vs_UV组之间差异基因少且差异显著程度弱于前2个对比组,主要为一些相对保守蛋白基因。
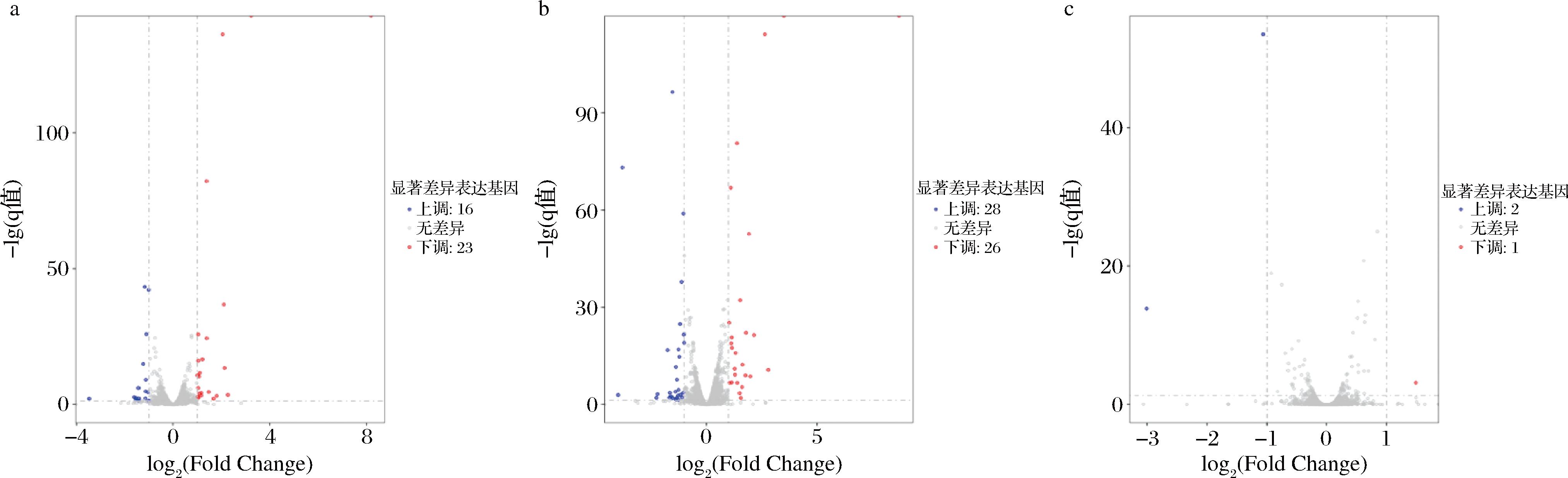
a-CK_vs_NP差异基因;b-CK_vs_UV差异基因;c-NP_vs_UV差异基因
图9 各比较组间的差异基因火山图
Fig.9 Differential gene volcano map among comparison groups
通过Venn分析展示了各比较组间的差异表达基因的重叠关系,反映出各组间特有以及共有基因的数量关系。如图10,3组共67个差异基因,其中NP_vs_UV组3个差异基因包含于CK_vs_UV组,表明添加L-Phe后,一定质量浓度的(NH4)2SO4对其影响较小,与上述结果一致;而CK_vs_NP与CK_vs_UV两组共有基因26个,其中有4个基因(ARO8、ARO10、BAP3、MUC1)显著上调,2个基因(FTR1、GRE2)显著下调;有13个基因独属于CK_vs_NP组,和25个基因独属于CK_vs_UV组,这38个基因虽也有差异,但相较共有的26个基因,显著程度略显不足。总体结果表明共有基因差异表达程度更高,只添加L-Phe与只添加(NH4)2SO4样本对比差异基因数量以及显著程度更大。
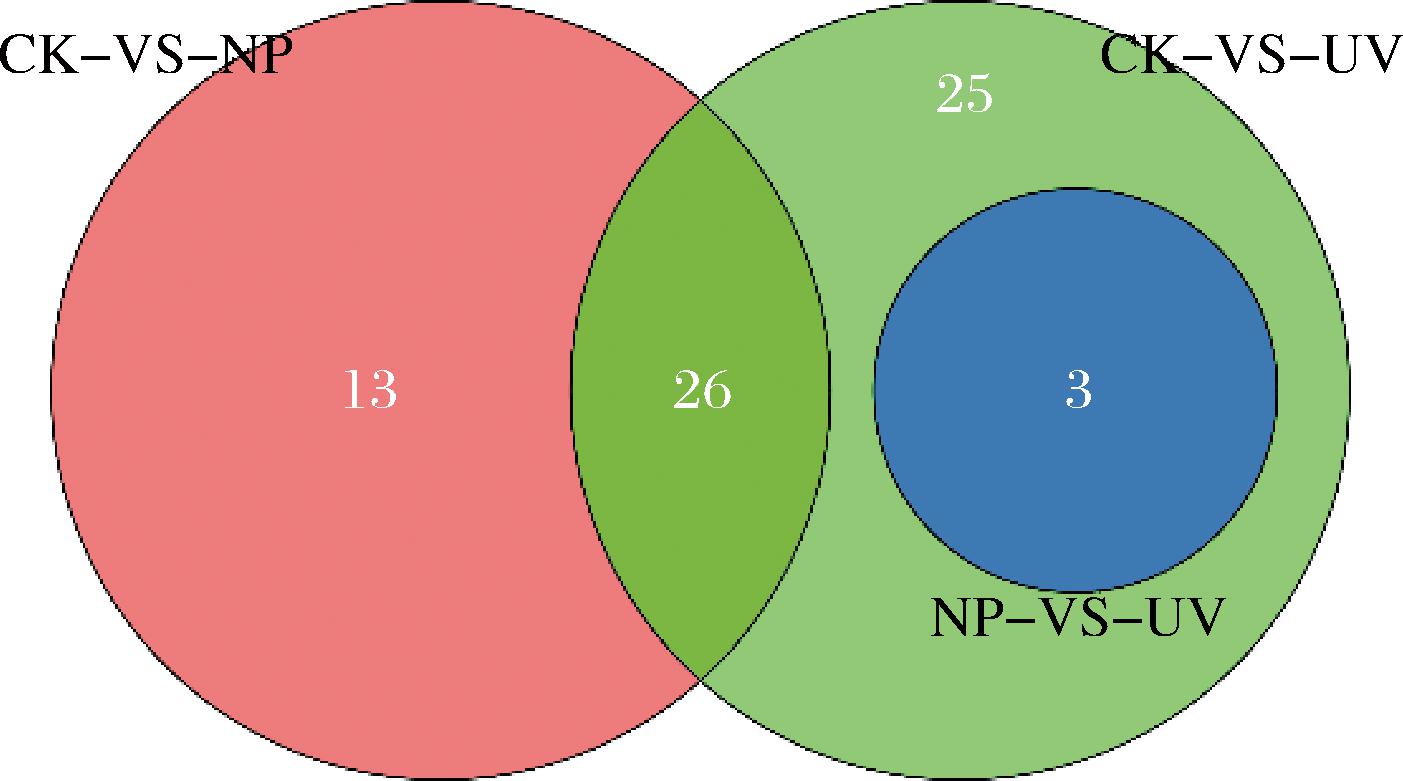
图10 不同氮源组差异基因的韦恩图分析
Fig.10 Venn diagram analysis of differential genes in comparison groups with different nitrogen sources
2.2.2 GO功能注释和富集分析
由于CK_vs_UV组差异表达基因多且较显著性,因此后续主要围绕CK_vs_UV组进行分析。
为深入了解(NH4)2SO4或L-Phe为氮源时差异基因的生物学功能,将上述得到的DEGs跟GO数据库进行比对注释,进行富集分析。对于CK_vs_UV比较组,注释结果如图11-a所示,主要涉及到细胞组分和生物过程2个方面,大多数差异基因注释到膜的组成部分(11个)、跨膜转运过程(7个)、氧化还原过程(6个)这些方面。通过GO富集分析,结果如图11-b所示,显著富集在跨膜转运过程、膜的组成成分、氨基酸跨膜转运蛋白活性、氨基酸跨膜转运过程以及天冬氨酸型内肽酶活性上。
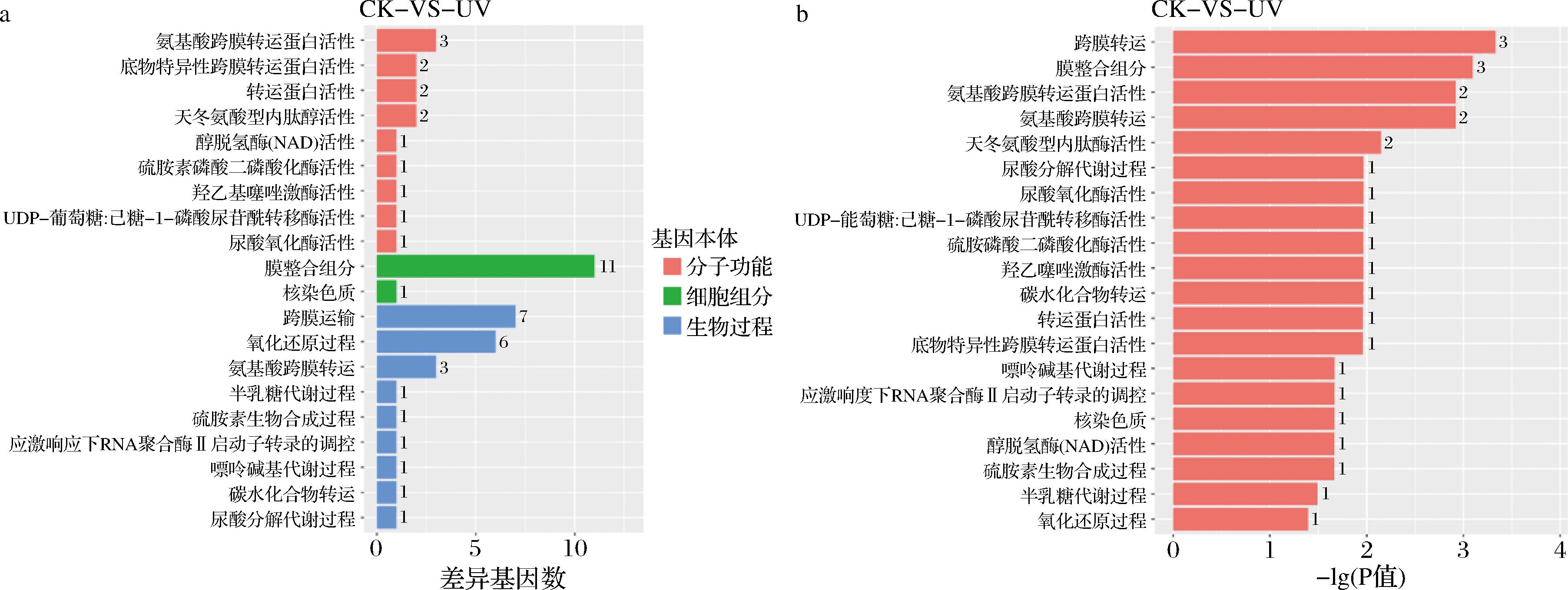
a-CK_vs_UV差异基因分类;b-CK_vs_UV差异基因GO富集分析
图11 CK_vs_UV 组的GO差异基因统计以及富集分析
Fig.11 GO analysis of DEGs and enrichment (CK vs UV)
2.2.3 KEGG富集分析
酵母的生物学功能主要通过不同基因相互协调发挥作用,为进一步分析差异基因在代谢通路上的作用,本研究通过KEGG数据库比对将各组得到的差异基因进行富集分析,找出差异表达基因在所有代谢通路上显著富集的通路,同时确定差异表达基因参与的最主要生化代谢途径和信号转导途径。在CK_vs_UV组中,富集的通路发生一定改变,结果如图12所示,除了跟CK_vs_NP组已有的相同富集通路(泛醌和其他萜类醌生物合成、酪氨酸代谢、色氨酸代谢、苯丙氨酸和酪氨酸以及色氨酸生物合成、苯丙氨酸代谢、内质网中的蛋白质加工、N-甘氨酸生物合成、酵母内的MAPK信号通路、糖酵解/糖原异生信号通路、赖氨酸生物合成、脂肪酸降解、半胱氨酸和甲硫氨酸代谢、次级代谢产物的生物合成、抗生素的生物合成、氨基酸的生物合成、ABC转运蛋白以及2-氧代羧酸代谢),还独有以下代谢通路:缬氨酸和亮氨酸以及异亮氨酸降解、硫胺素代谢、嘌呤代谢、过氧化物酶体、半乳糖代谢、脂肪酸代谢、咖啡因代谢、不饱和脂肪酸的生物合成、氨基糖和核苷酸糖代谢以及α-亚麻酸代谢。其中咖啡因代谢、脂肪酸降解、α-亚麻酸代谢、酪氨酸代谢和苯丙氨酸代谢这些通路显著富集。涉及到咖啡因代谢的一个相关基因主要是将三甲基尿酸转化为三甲基尿囊素,而三甲基尿酸与咖啡因的代谢比率通常被作为作为生物标志物来描述CYP3A活性的变异性,CYP3A是一种很重要的CYP450酶系,因此主要还是跟氧化还原相关[27]。α-亚麻酸涉及到生物膜中一些膜结合酶的活性,因此该通路与细胞膜的结合功能发生一定的变化[28]。
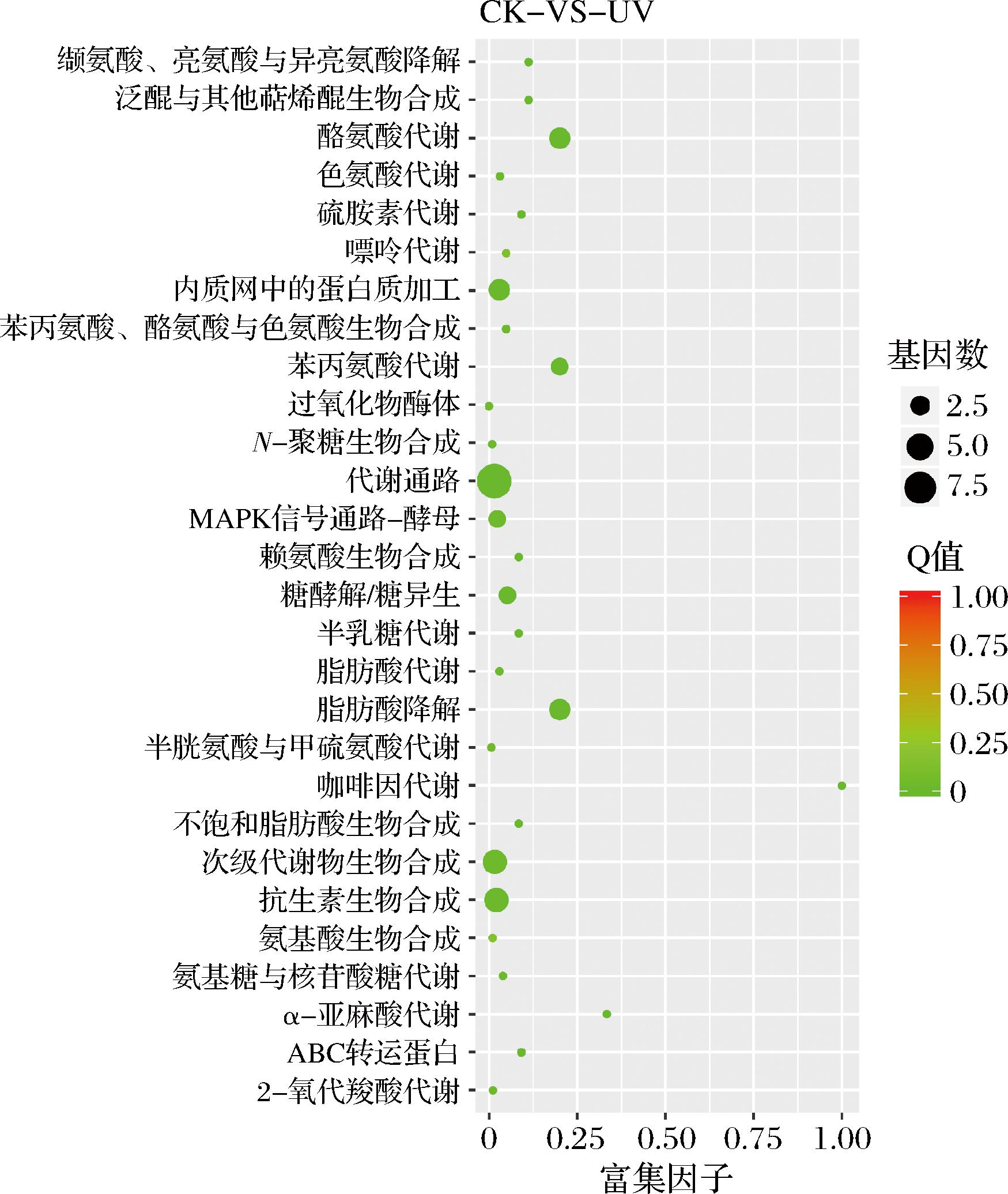
图12 CK_vs_UV 组差异基因的 KEGG 富集分析
Fig.12 KEGG enrichment analysis of differential genes in CK_vs_UV group
2.2.4 实时荧光定量PCR验证
为进一步验证转录组测序的结果,筛选了艾氏途径中产2-PE的4个相关基因(BAP3、ARO8、ARO10、GRE2)进行实时荧光定量PCR验证。如图13-a所示,在L-Phe作为氮源时,除了GRE2(苯乙醛还原酶)的基因表达量下降,BAP3(负责转运氨基酸)、ARO8(芳香族氨基酸氨基转移酶)、ARO10(苯丙酮酸脱羧酶)3个基因表达量都有大幅上升,与转录组测序结果一致。从代谢通路上分析,由图13-b可知,苯丙氨醇转化为苯乙醛的关键基因表达量远高于该途径上其他基因,尤其是苯乙醛转化2-PE的GRE2基因。因此,后续提高2-PE产量的关键可能需要针对GRE2进行研究。同时,还需要关注负责氨基酸转运的BAP3与将L-Phe转化PPA的ARO8基因。
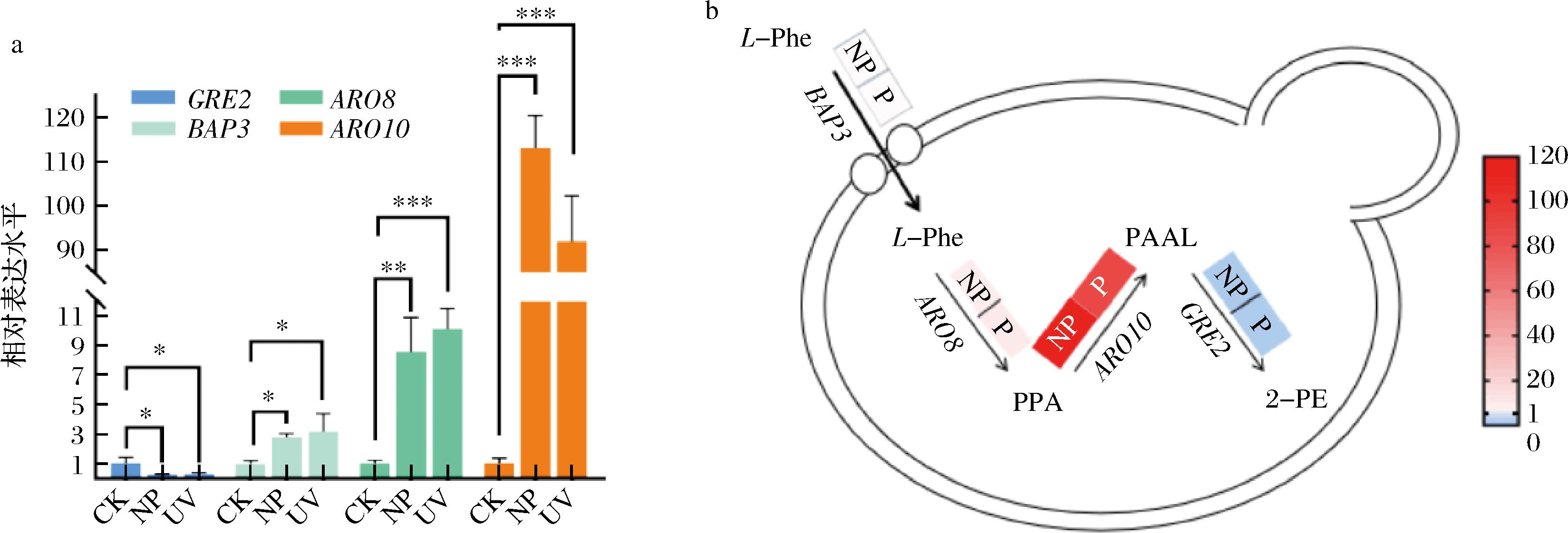
a-不同氮源培养下关键基因的相对表达水平;b-L-phe为氮源时2-PE合成途径上关键基因相对表达水平
图13 在不同氮源培养基上与添加L-phe后2-PE合成途径上各基因表达水平
Fig.13 Expression levels of genes in the 2-PE biosynthetic pathway under different nitrogen source media and L-Phe supplementation
2.3 发酵罐水平补料发酵2-PE
前期研究主要基于摇瓶进行发酵而得到最佳优化条件,为验证其在发酵罐水平是否具备可复制性。在5 L发酵罐中对发酵工艺进行优化,主要针对pH调控与碳氮源补料。
以300 r/min、30 ℃和通气量0.3 L/min进行发酵。前期发酵罐培养中发现,在21 h时罐内碳氮源几乎消耗殆尽,因此在21 h时对葡萄糖与L-Phe进行补料。此外,还发现Z.rouxii在发酵过程中产生大量酸性物质抑制其生长,因此筛选其最适发酵pH为5,此时2-PE有最高产量。由图14可知,此时OD600最高32,2-PE产量也从优化后摇瓶3.35 g/L的滴度增至4.1 g/L,涨幅约22.4%。可以确定摇瓶内产量受限是由于Z.rouxii在发酵过程中pH过低与营养物质不足导致后期菌株生长以及目标代谢产物受限,当控制恒定pH后,生物量和2-PE产量均有一定增加。
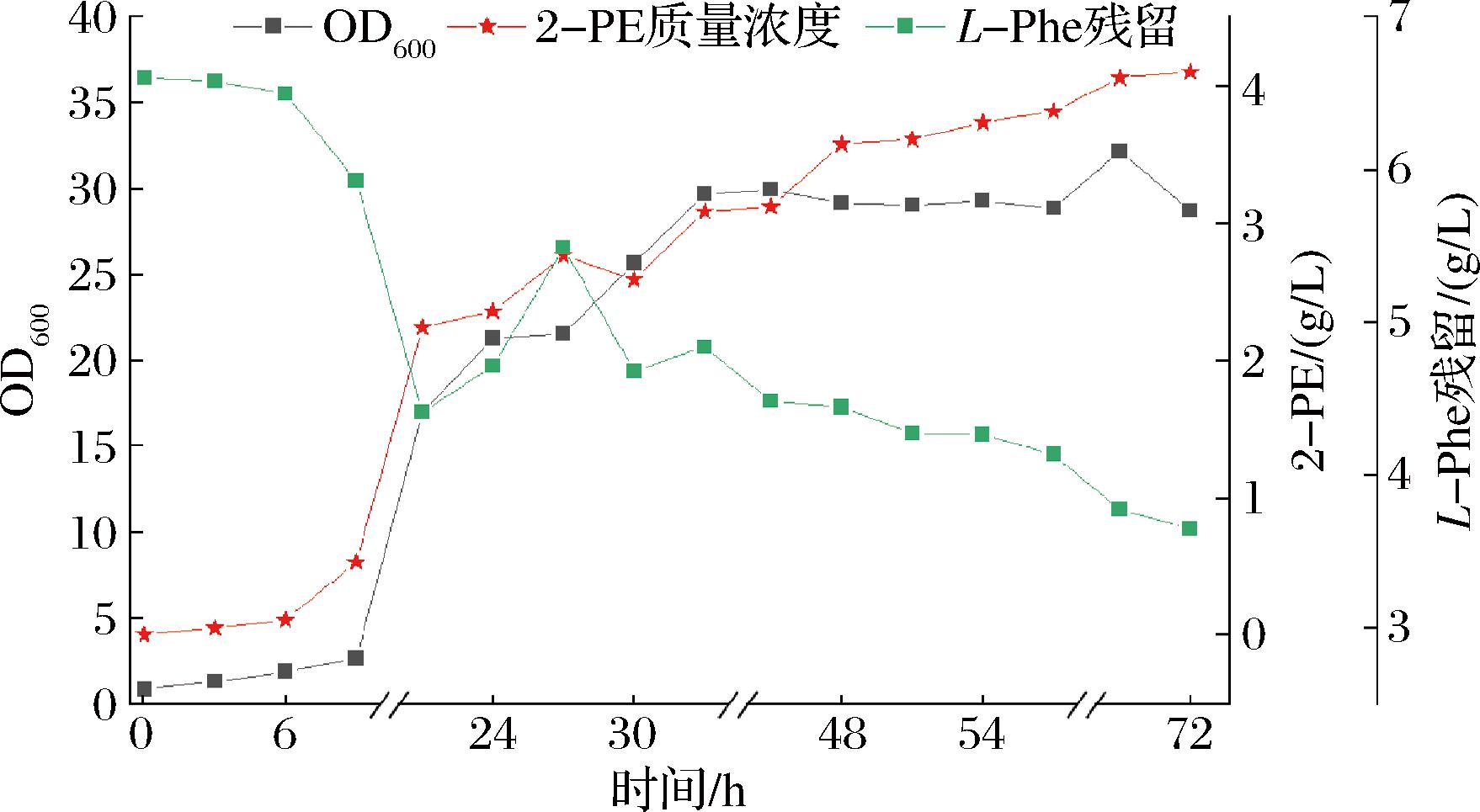
图14 调控pH并补料发酵产2-PE
Fig.14 pH-controlled and fed-batch fermentation for 2-PE production
3 讨论
本研究通过系统优化Z.rouxii的发酵条件,结合转录组分析,揭示了L-Phe通过艾氏途径驱动2-苯乙醇合成的核心机制。研究发现,L-Phe作为氮源时显著上调艾氏途径基因(ARO8、ARO10、BAP3),促进苯乙醛前体的高效合成,而(NH4)2SO4则通过氮阻遏效应抑制代谢活性。响应面模型进一步验证了L-Phe对2-PE产量的主导作用,最优培养基条件下摇瓶产量达3.35 g/L,较初始条件提升38.4%。然而,转录组与qPCR结果表明,苯乙醛还原酶基因(GRE2)表达下调,导致苯乙醛向2-PE的转化效率受限,成为产量提升的关键瓶颈。这一发现与已有研究中GRE2作为限速酶的角色一致[29],未来需通过基因编辑或启动子优化增强其表达。
在发酵罐中,通过补料策略与pH控制,2-PE产量进一步增至4.10 g/L,较摇瓶提升70.8%。这表明规模化生产中环境调控对维持菌株代谢活性至关重要。然而,响应面模型中因子交互作用较弱,可能因实验梯度设计不足或L-Phe的压倒性影响所致。此外,转录组分析虽揭示了跨膜转运与氧化还原过程的富集,但对α-亚麻酸代谢等次要通路的调控机制仍需深入探索。
本研究挖掘了2-PE生物合成的新资源,为Z.rouxii生产2-PE的工业化应用提供了理论支持,但仍有一些关键值得深入研究:如通过代谢工程强化GRE2活性,平衡前体合成与产物转化;解析高糖胁迫下细胞膜功能的动态响应机制;开发多因素动态调控模型以优化发酵工艺。未来研究可结合合成生物学与系统代谢工程,构建高效合成2-PE的细胞工厂,从而推动生物法在香料与食品工业中的广泛应用。
[1] 卞一凡,刘姝晗,张贝萌,等.微生物合成2-苯乙醇研究进展[J].中国生物工程杂志,2022,42(8):128-136.BIAN Y F,LIU S H,ZHANG B M,et al.Advances in microbial synthesis of 2-phenylethanol[J].China Biotechnology,2022,42(8):128-136.
[2] WANG D K,HE Z X,LIU M M,et al.Exogenous fatty acid renders the improved salt tolerance in Zygosaccharomyces rouxii by altering lipid metabolism[J].LWT,2023,177:114579.
[3] FENG J P,MA W Y,MA Z B,et al.GhNHX3D,a vacuolar-localized Na+/H+ antiporter,positively regulates salt response in upland cotton[J].International Journal of Molecular Sciences,2021,22(8):4047.
[4] 钱莹,宋娜,高志明.鲁氏接合酵母盐胁迫适应机制及组学研究方法进展[J].生物技术,2022,32(6):779-786.QIAN Y,SONG N,GAO Z M.Advances in salt stress adaptation mechanism and omics research methods of Zygosaccharomyces rouxii[J].Biotechnology,2022,32(6):779-786.
[5] 徐莹,姜维,何晓霞.耐盐性鲁氏酵母的研究进展[J].中国酿造,2009,28(10):1-4.XU Y,JIANG W,HE X X.Research progress on salt-tolerant Zygosaccharomyces rouxii[J].China Brewing,2009,28(10):1-4.
[6] ZHU N Q,XIA W J,WANG G L,et al.Engineering Corynebacterium glutamicum for de novo production of 2-phenylethanol from lignocellulosic biomass hydrolysate[J].Biotechnology for Biofuels and Bioproducts,2023,16(1):75.
[7] ZHAN Y Y,SHI J,XIAO Y,et al.Multilevel metabolic engineering of Bacillus licheniformis for de novo biosynthesis of 2-phenylethanol[J].Metabolic Engineering,2022,70:43-54.
[8] QIAN T,WEI W P,DONG Y X,et al.Metabolic engineering of the oleaginous yeast Yarrowia lipolytica for 2-phenylethanol overproduction[J].Bioresource Technology,2024,411:131354.
[9] HASSING E J,DE GROOT P A,MARQUENIE V R,et al.Connecting central carbon and aromatic amino acid metabolisms to improve de novo 2-phenylethanol production in Saccharomyces cerevisiae[J].Metabolic Engineering,2019,56:165-180.
[10] XU H,LI Z,LI L Y,et al.Sustainable production of 2-phenylethanol from agro-industrial wastes by metabolically engineered Bacillus licheniformis[J].LWT,2023,173:114414.
[11] WANG G L,WANG M Y,YANG J C,et al.De novo synthesis of 2-phenylethanol from glucose by metabolically engineered Escherichia coli[J].Journal of Industrial Microbiology and Biotechnology,2023,49(6):kuac026.
[12] HUA D L,XU P.Recent advances in biotechnological production of 2-phenylethanol[J].Biotechnology Advances,2011,29(6):654-660.
[13] GUO D Y,ZHANG L H,KONG S J,et al.Metabolic engineering of Escherichia coli for production of 2-phenylethanol and 2-phenylethyl acetate from glucose[J].Journal of Agricultural and Food Chemistry,2018,66(23):5886-5891.
[14] ZHU L H,WANG J H,XU S,et al.Improved aromatic alcohol production by strengthening the shikimate pathway in Saccharomyces cerevisiae[J].Process Biochemistry,2021,103:18-30.
[15] KONG S J,PAN H,LIU X Y,et al.De novo biosynthesis of 2-phenylethanol in engineered Pichia pastoris[J].Enzyme and Microbial Technology,2020,133:109459.
[16] GU Y,MA J B,ZHU Y L,et al.Engineering Yarrowia lipolytica as a chassis for de novo synthesis of five aromatic-derived natural products and chemicals[J].ACS Synthetic Biology,2020,9(8):2096-2106.
[17] 梅建凤,闵航,吕镇梅.利用酵母细胞生物催化合成2-苯乙醇[J].催化学报,2007,28(11):993-998.MEI J F,MIN H,LYU Z M.Biocatalytic synthesis of 2-phenylethanol by yeast cells[J].Chinese Journal of Catalysis,2007,28(11):993-998.
[18] 贾薇,白岩岩,冯杰,等.樟芝发酵产2-苯乙醇的条件优化[J].食用菌学报,2016,23(1):47-52.JIA W,BAI Y Y,FENG J,et al.Optimization of selected growth parameters affecting 2-phenylethanol production in submerged cultures of Taiwanofungus camphoratus[J].Acta Edulis Fungi,2016,23(1):47-52.
[19] MORTAZAVI A,WILLIAMS B A,MCCUE K,et al.Mapping and quantifying mammalian transcriptomes by RNA-Seq[J].Nature Methods,2008,5(7):621-628.
[20] LI J G,WANG Y L,WANG L Q,et al.Integration of transcriptomic and proteomic analyses for finger millet[Eleusine coracana (L.) Gaertn.]in response to drought stress[J].PLoS One,2021,16(2):e0247181.
[21] 严伟,高豪,蒋羽佳,等.2-苯乙醇生物合成的研究进展[J].合成生物学,2021,2(6):1030-1045.YAN W,GAO H,JIANG Y J,et al.Research progress in 2-phenylethanol production through biological processes[J].Synthetic Biology Journal,2021,2(6):1030-1045.
[22] DAI J,XIA H L,YANG C L,et al.Sensing,uptake and catabolism of L-phenylalanine during 2-phenylethanol biosynthesis via the Ehrlich pathway in Saccharomyces cerevisiae[J].Frontiers in Microbiology,2021,12:601963.
[23] LEANDRO M J,CABRAL S,PRISTA C,et al.The high-capacity specific fructose facilitator ZrFfz1 is essential for the fructophilic behavior of Zygosaccharomyces rouxii CBS 732T[J].Eukaryotic Cell,2014,13(11):1371-1379.
[24] 陆军.微生物转化L-苯丙氨酸生成2-苯乙醇的研究[D].无锡:江南大学,2008.LU J.Biotransformation of L-phenylalanine to 2-phenylethanol by microorganism[D].Wuxi:Jiangnan University,2008.
[25] 唐育岐,刘天明,赵修报,等.高产2-苯乙醇酵母菌株的筛选及培养基优化[J].中国食品添加剂,2012,23(3):137-142.TANG Y Q,LIU T M,ZHAO X B,et al.Screening of high-yield yeast strains for 2-phenylethanol land its medium optimization[J].China Food Additives,2012,23(3):137-142.
[26] 王虎玄,代春吉,孙宏民.高糖胁迫下鲁氏接合酵母细胞膜生理应答机制研究[J].陕西科技大学学报,2020,38(6):40-47.WANG H X,DAI C J,SUN H M.Physiological mechanism of cell membrane response to high sugar stress in Zygosaccharomyces rouxii[J].Journal of Shaanxi University of Science &Technology,2020,38(6):40-47.
[27] 韩燕祯,王相际,杨朔鹏,等.咖啡因及其代谢物的检测及应用研究进展[J].化学研究与应用,2020,32(5):689-695.HAN Y Z,WANG X J,YANG S P,et al.Recent advances on the detection and application of caffeine and its metabolites[J].Chemical Research and Application,2020,32(5):689-695.
[28] 吴俏槿,杜冰,蔡尤林,等.α-亚麻酸的生理功能及开发研究进展[J].食品工业科技,2016,37(10):386-390.WU Q J,DU B,CAI Y L,et al.Research development of alpha-linolenic acid[J].Science and Technology of Food Industry,2016,37(10):386-390.
[29] DAI J,LI K,SONG N,et al.Zygosaccharomyces rouxii,an aromatic yeast isolated from chili sauce,is able to biosynthesize 2-phenylethanol via the shikimate or Ehrlich pathways[J].Frontiers in Microbiology,2020,11:597454.