糠麸是由农作物加工所得的主要副产物[1],如小麦、稻米和玉米的外层残留物,是生物转化和高值化利用的重要原料,在我国有着广泛的来源。这种廉价的原料主要被用作饲料、发酵辅料或用于提取有益成分,但其综合利用率却不足20%,其富含多糖、膳食纤维、蛋白质以及矿物质等营养成分[2]。糠麸常作为生物燃料的饲料和原料,而食品用途较少。通过微生物对糠麸进行改性,可以改善其成分特性,提升生物利用率[3]。TU等[4]的研究显示,松褐孔菌对麦麸进行固态发酵后,增强了其加工性能。虽然生产量大,但利用率仍然较低。近年来,糠麸多糖因其独特的生物活性而备受关注,在增强免疫力、抗氧化、降血糖等方面展现出显著效果,成为食品科学和生物医药领域的研究热点。
灰树花是属于担子菌亚门、树花菌属的食药两用真菌,享有“食用菌王子”及“华北人参”之称[5],是一类富含蛋白质、碳水化合物、膳食纤维的功能性真菌。研究发现,灰树花是一种中温型、好氧、喜光的木腐菌,其菌丝生长温度范围较宽,最适宜的生长温度为15~20 ℃[6]。由于灰树花营养价值高,富含多糖、蛋白质、维生素和矿物质,故对人体健康有显著保健作用[7],在食品加工过程中,灰树花能利用海棠果,制得酸甜可口、风味良好的饮品,从而保持食品新鲜口感与营养价值[8],而在工业化生产中,灰树花能利用米糠、麸皮等廉价农副产物,高效转化为高附加值产品[9]。多糖在抗氧化、调节免疫、抗肿瘤、抗病毒、控制血糖等方面展现卓越生物活性[7]。(研究表明,麸皮作为氮源的发酵培养基中,灰树花的胞内多糖和总多糖产量最高[10]。灰树花多糖在抗辐射、抗氧化、降血糖、抗肿瘤和抗人类免疫缺陷病毒(human immunodeficiency virus,HIV)等方面展现显著生物活性。)在DPPH自由基清除实验中,灰树花发酵米糠麸皮多糖表现优异,清除能力随浓度升高而增强,高浓度下清除率可达90%以上[11]。深入研究灰树花发酵糠麸多糖的结构组成及抗氧化活性,可为灰树花资源的深度开发提供理论依据,并推动相关保健品开发与应用[12]。
在抗氧化研究中,斑马鱼模型因高通量、低成本及基因相似性优势,被广泛应用于抗氧化剂功效评价。斑马鱼被认为是一种新兴模式生物,与人类的基因组有87%的相似性,且易于饲养观察[13]。利用甲萘醌诱导斑马鱼产生氧化应激反应,并结合荧光染色观察活性氧含量,斑马鱼模型能直观评估抗氧化剂效能[14]。实验中,抗氧化剂组斑马鱼荧光强度较模型对照组明显减弱,表明抗氧化剂具有降低活性氧水平效果。因此,本研究利用灰树花对糠麸进行发酵,分析未发酵糠麸多糖(unfermented bran polysaccharide,UBP)和发酵糠麸多糖(fermented bran polysaccharides,FBP)的结构组成及抗氧化活性,为灰树花菌丝体的开发及广泛应用提供参考价值。
1 材料与方法
1.1 材料与试剂
灰树花菌种,中国工业微生物菌种保藏中心;米糠、小麦麸皮、栎木屑,购自市场;蛋白胨,天津市北辰方正试剂厂;2,2-偶氮二(2-甲基丙基咪)二盐酸盐[2,2′-azobis(2-methylpropionamidine) dihydrochloride,AAPH]、2,7-二氯荧光黄双乙酸盐(2′,7′-dichlorofluorescein diacetate,DCFH-DA)、1,3-双(二苯膦)丙烷[1,3-Bis(diphenylphosphino)propane,DPPP]、吖啶橙(acridine orange,AO)、二甲基亚砜(dimethyl sulfoxide,DMSO),上海阿拉丁生化科技股份有限公司;其他均为分析纯,国药集团化学试剂有限公司。
1.2 仪器与设备
1200液相色谱仪、1260 InfinityⅡ MDS凝胶渗透色谱仪,Agilent公司;Nicolet iS5N傅里叶变换红外光谱仪,Thermo公司;JSM-840扫描电镜仪,JEOL公司;奥林巴斯szx7光学显微镜,Evident公司;Model eclipse Ts2R-FL荧光倒置显微镜,日本尼康公司。
1.3 实验方法
1.3.1 发酵时间对糠麸多糖含量的影响
糠麸固态培养基(%):麸皮及米糠35、栎木屑25.2、葡萄糖4、KH2PO4 0.15、MgSO4 0.15、蛋白胨0.5,pH=5.5蒸馏水80,接种菌球10[15]。于28 ℃、RH 80%培养箱中培养。
根据实验室前期研究[15]确定发酵时间。将种子液接种至糠麸固态培养基中,在28 ℃、RH 80%的恒温培养箱中培养,分别在0、3、5、7、9、11、13、15 d取样,每个时间点取3个平行,共24个样本。
1.3.2 UBP与FBP制备
各称取0.1 g未发酵糠麸及发酵糠麸料,加入16 mL蒸馏水,30 min 80 ℃水浴锅加热,取出后,冷却,4 000 r/min 10 min离心,得到未发酵糠麸水提物及发酵糠麸水提物,通过旋转蒸发仪进行浓缩,60 ℃烘干,随后用4倍体积的体积分数为95%乙醇,4 ℃下沉淀12 h,沉淀进行冷冻干燥,获得UBP和FBP。
1.3.3 多糖含量测定
采用苯酚-硫酸法[16]测定:将未发酵糠麸水提物及发酵糠麸水提物按照体积比(1∶20)进行稀释。取0.5 mL稀释液,与0.5 mL蒸馏水、0.5 mL体积分数为6%苯酚及2.5 mL H2SO4反应,冷却20 min后,490 nm处测OD值。
1.3.4 UBP 与FBP理化特性分析
1.3.4.1 单糖组成分析
通过PMP柱前衍生HPLC测定。称取适量UBP与FBP样品于水解管中,加2 mol/L 三氟乙酸1 mL,充氮,110 ℃烘箱中水解5 h,取出后冷却至室温,取0.5 mL于4 mL离心管中,调pH 至中性;向4 mL离心管中加入 0.2 mL 0.3 mol/L NaOH,0.4 mL PMP甲醇溶液,充氮,70 ℃水浴 60 min,取出后冷却至室温,加 0.2 mL 0.3 mol/L 盐酸,加水定容到 2 mL,加1.5 mL氯仿,振荡摇匀后静置分层,弃去下层氯仿,如此反复萃取3次,水层过 0.45 μm 滤膜,利用高效液相色谱系统测定。
1.3.4.2 分子质量测定
用凝胶渗透色谱法(gel permeation chromatography,GPC)测定[17] UBP与FBP样品的分子质量。
1.3.4.3 红外光谱分析
采用KBr压片法,并利用红外光谱仪对UBP和FBP样品进行检测[18]。
1.3.4.4 扫描电镜分析
将UBP和FBP撒在黏有导电胶的样品台上,用洗耳球吹扫黏在表面的样品,喷金后,在扫描电镜下观察,设置扫描电压为10 kV,在500倍下观测。
1.3.5 抗氧化能力的测定
1.3.5.1 斑马鱼喂养及胚胎收集
基于AAPH诱导的斑马鱼氧化应激模型进行试验。AB野生型斑马鱼购于国家斑马鱼资源中心,在(28.0±0.5) ℃、14 h光照,10 h黑暗下饲养,每日饲喂丰年虫,并换1/3水,保持充氧,定期监测水质。
胚胎收集:实验前一晚上,雌∶雄条数比为1∶2置入孵化箱,将其隔离至10~12 h黑暗环境后合并,通过光照刺激进行产卵,30~60 min 后将胚胎收集,用蒸馏水清洗3次以上,于干净烧杯中备用。
1.3.5.2 抗氧化UBP与FBP浓度的确定
根据陈秋燕等[19]方法确定安全浓度。在光学显微镜下,选择健康并处于6~8 hpf阶段的斑马鱼胚胎,放置于24孔细胞培养板中,每孔2 mL不同质量浓度UBP和 FBP 培养液(6.25、12.5、25、50、100 μg/mL)以及等量的空白组(蒸馏水),每个浓度8个重复,每个重复15~20枚胚胎。将 24孔板放培养箱 (28.0±0.5) ℃孵化,每隔24 h更换1次培养液,每隔12 h在显微镜下观察胚胎发育状况至72 h,统计胚胎死亡率及孵化率。从60 hpf 开始记录仔鱼心率,每个重复组随机挑选6 尾仔鱼,计数其在1 min内的心跳次数。
1.3.5.3 AAPH氧化诱导模型优化
与1.3.5.2节同理。根据 UBP与FBP的浓度结果,选择 6.25、12.5、25 μg/mL的FBP和UBP溶液进行该实验,每个质量浓度6个重复,每个重复20枚胚胎。将溶液分别加入到不同的孔中孵育1 h后,在胚中加入0.5 mol/L AAPH溶液,培养24 h。未经任何处理培养的胚胎作为对照。培养24 h后,用蒸馏水冲洗胚胎,每隔12 h更换1次蒸馏水,统计胚胎死亡率及孵化率。从60 hpf 开始记录仔鱼心率,并采集其侧面,测量各组仔鱼的卵黄囊面积。每个重复组随机挑选 8 尾仔鱼,计数其在1 min内的心跳次数。卵黄囊面积利用Image J进行测量。直至72 hpf,采用孵化的斑马鱼仔鱼进行后续的细胞内活性氧(reactive oxygen species,ROS)产生、细胞死亡和脂质过氧化的检测。
1.3.5.4 UBP与FBP对斑马鱼胚胎ROS生成率、细胞死亡率及脂质过氧化率的影响
将72 hpf斑马鱼仔鱼转移到24孔板中,并用20 μg/mL DCF-DA、7 μg/mL AO和25 μg/mL DPPP溶液处理。(28±1) ℃黑暗中处理1、0.5、1 h。用蒸馏水冲洗仔鱼,并用3-氨基苯甲酸乙酯甲磺酸酯麻醉,于荧光显微镜下捕获荧光照片,利用Image J 软件测荧光强度,以空白对照组为标准计算各处理组的相对荧光强度。ROS生成率、细胞死亡率、脂质过氧化率计算如公式(1)所示:
ROS生成率/细胞死亡率/脂质过氧化率![]()
(1)
1.4 数据处理
采用Excel 2019进行数据汇总处理,所有试验均重复3次,数据以“平均值±标准差”表示,采用SAS 9.2单因素方差分析(analysis of variance,ANOVA)用于处理数据,对于有显著差异的处理,采用Tukey检验比较其平均值。显著性水平设定为 P<0.05,并通过 Originpro 2021 C软件进行作图。
2 结果与分析
2.1 发酵时间对糠麸多糖含量的影响
发酵时间对FBP含量的影响复杂而精细,涉及微生物活动、生物化学变化及物质代谢的动态平衡。如图1所示,发酵时间0 d,FBP含量为86.56 mg/g,为未发酵初始状态;发酵3 d,含量降至59.43 mg/g,由于灰树花生长消耗营养物质,从而导致FBP含量显著降低;随着发酵时间的逐渐增加,灰树花利用糠麸转化积累生物活性物质增多,导致FBP含量明显增加,在发酵13 d时,达到最大,为126.93 mg/g;但发酵15 d急剧降至59.07 mg/g,因发酵时间过长导致微生物过度消耗营养,产生不利代谢产物。因此,适当发酵时间能提升FBP含量和品质。故后续试验均用发酵13 d的固态培养基进行。
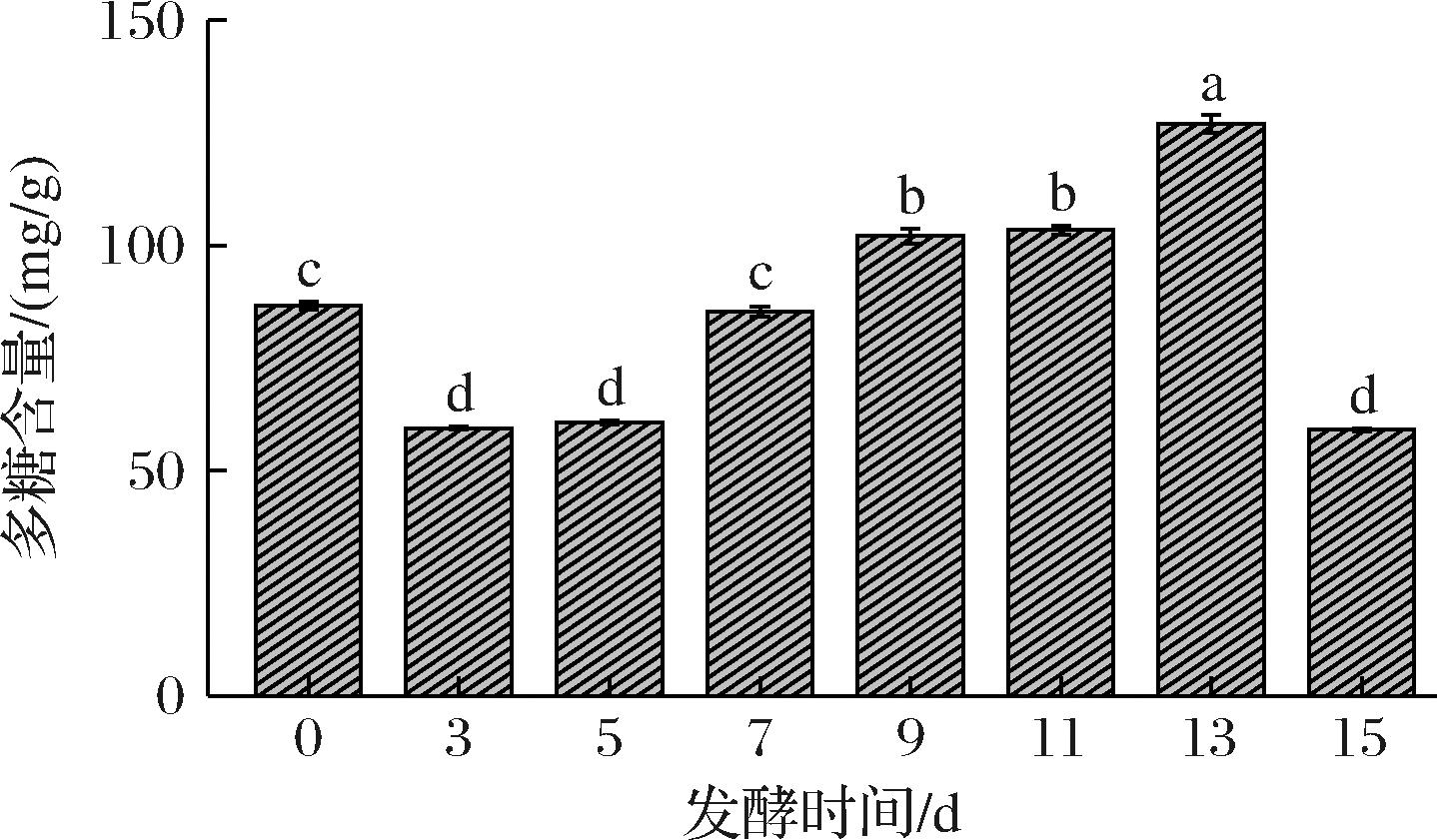
图1 发酵时间对糠麸多糖含量的影响
Fig.1 Effect of fermentation time on polysaccharide content of bran
注:不同小写字母表示差异显著(P<0.05)。
2.2 UBP与FBP的单糖组成及分子质量
利用GPC和HPLC方法,对比UBP与FBP的分子质量及单糖组成。UBP分子质量为10.77 kDa,FBP则增至24.07 kDa。单糖组成分析如表1所示,多种单糖在发酵中变化显著。甘露糖在FBP中比例由UBP的1.64%升至4.72%,表明发酵促进甘露糖积累。由于甘露糖的氢原子供体能力,使得其占比高的多糖表现出显著的DPPH自由基清除效果及羟自由基清除活性。氨基葡萄糖亦增加,从0.21%至0.43%。核糖、鼠李糖、葡萄糖醛酸在FBP中比例均高于UBP,分别增长0.89%、0.35%、0.47%。而氨基葡萄糖、核糖、鼠李糖和葡萄糖醛酸比例的增加,使其形成特定的糖苷键和空间构型,增强了多糖的稳定性和抗降解性,协同抵御自由基的侵袭。半乳糖醛酸则略有下降,差异微小。葡萄糖作为主要单糖,发酵后占比从51.94%提升至60.56%,成为FBP中最丰富单糖,使其还原性特征在抗氧化反应中发挥重要作用。相反,半乳糖、木糖、阿拉伯糖比例在发酵后下降,分别降低1.30%、8.14%、8.05%。此外,FBP中检出岩藻糖,而UBP中未检出,由于其丰富的硫酸基团结构使岩藻糖在清除自由基过程中发挥重要作用,进一步证明发酵对单糖组成的深远影响。
表1 UBP与FBP的单糖组成及分子质量
Table 1 Monosaccharide composition and molecular weight of UBP and FBP
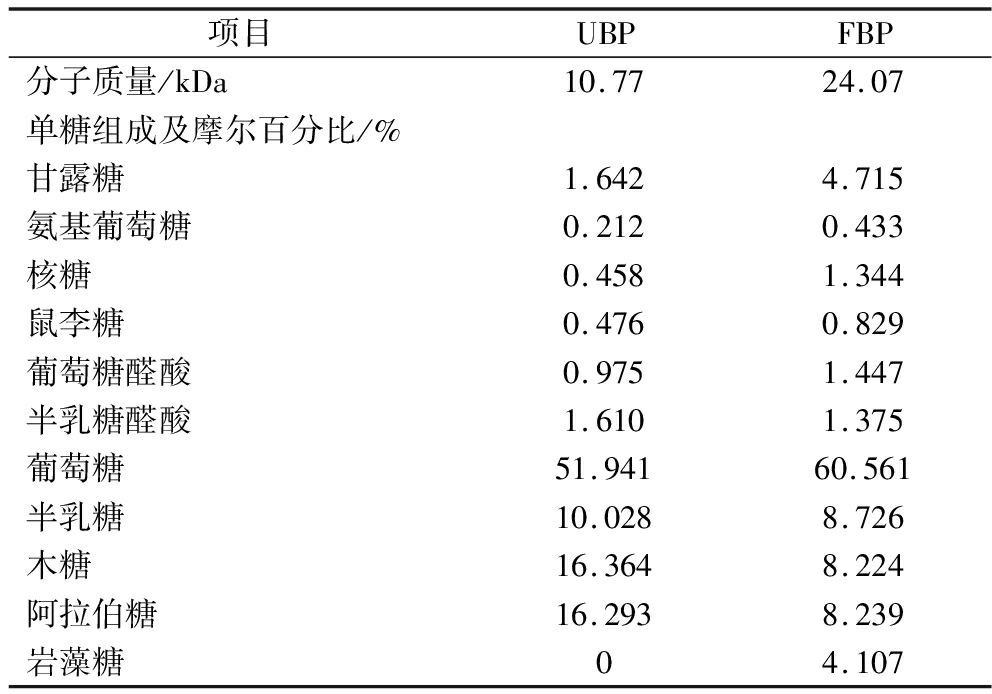
项目UBPFBP分子质量/kDa10.7724.07单糖组成及摩尔百分比/%甘露糖1.6424.715氨基葡萄糖0.2120.433核糖0.4581.344鼠李糖0.4760.829葡萄糖醛酸0.9751.447半乳糖醛酸1.6101.375葡萄糖51.94160.561半乳糖10.0288.726木糖16.3648.224阿拉伯糖16.2938.239岩藻糖04.107
2.3 UBP与FBP傅里叶变换红外光谱特征
UBP与FBP的红外光谱数据对比,显现了两者在分子结构上的差异,为探究其理化性质及潜在应用提供了线索。红外光谱分析能够揭示物质分子的振动能级跃迁,反映分子内部结构。UBP与FBP透过率的光谱图各自呈现独特的随波数变化曲线,展示了不同波数下的吸收特性,并揭示了发酵对糠麸粗多糖分子结构的显著影响。由图2可见,FBP及UBP的红外光谱特征相似,均具有多处多糖特征吸收峰。在2种多糖的红外光谱中,波数范围3 500~3 000 cm-1处出现一宽峰,这是O—H和分子内或分子间氢键的伸缩振动吸收峰[20],3 000~2 900 cm-1处有吸收峰,表明有糖类—CH2或—CH3的C—H伸缩振动和弯曲振动[21];1 652.65 cm-1处强的吸收峰是糖苷部分C![]() O伸缩振动吸收峰[22]。在1 400 cm-1左右较尖的吸收峰是 C—H变角振动吸收[23];在1 150~1 000 cm-1范围内的强吸收峰归属于糖环上C—O—C或C—OH的不对称振动,是常见的吡喃糖环内酯和羟基的共振吸收峰,为吡喃糖的特征吸收峰,表明糖链存在吡喃糖构型[24]。以上这些是糖类物质的特征吸收峰,从而确定这2种物质均是多糖,综上所述,这些吸收峰表明 FBP和UBP 是一类含有丰富羟基、羰基、多酚和芳香环结构的多糖,具有典型的多糖特征。
O伸缩振动吸收峰[22]。在1 400 cm-1左右较尖的吸收峰是 C—H变角振动吸收[23];在1 150~1 000 cm-1范围内的强吸收峰归属于糖环上C—O—C或C—OH的不对称振动,是常见的吡喃糖环内酯和羟基的共振吸收峰,为吡喃糖的特征吸收峰,表明糖链存在吡喃糖构型[24]。以上这些是糖类物质的特征吸收峰,从而确定这2种物质均是多糖,综上所述,这些吸收峰表明 FBP和UBP 是一类含有丰富羟基、羰基、多酚和芳香环结构的多糖,具有典型的多糖特征。
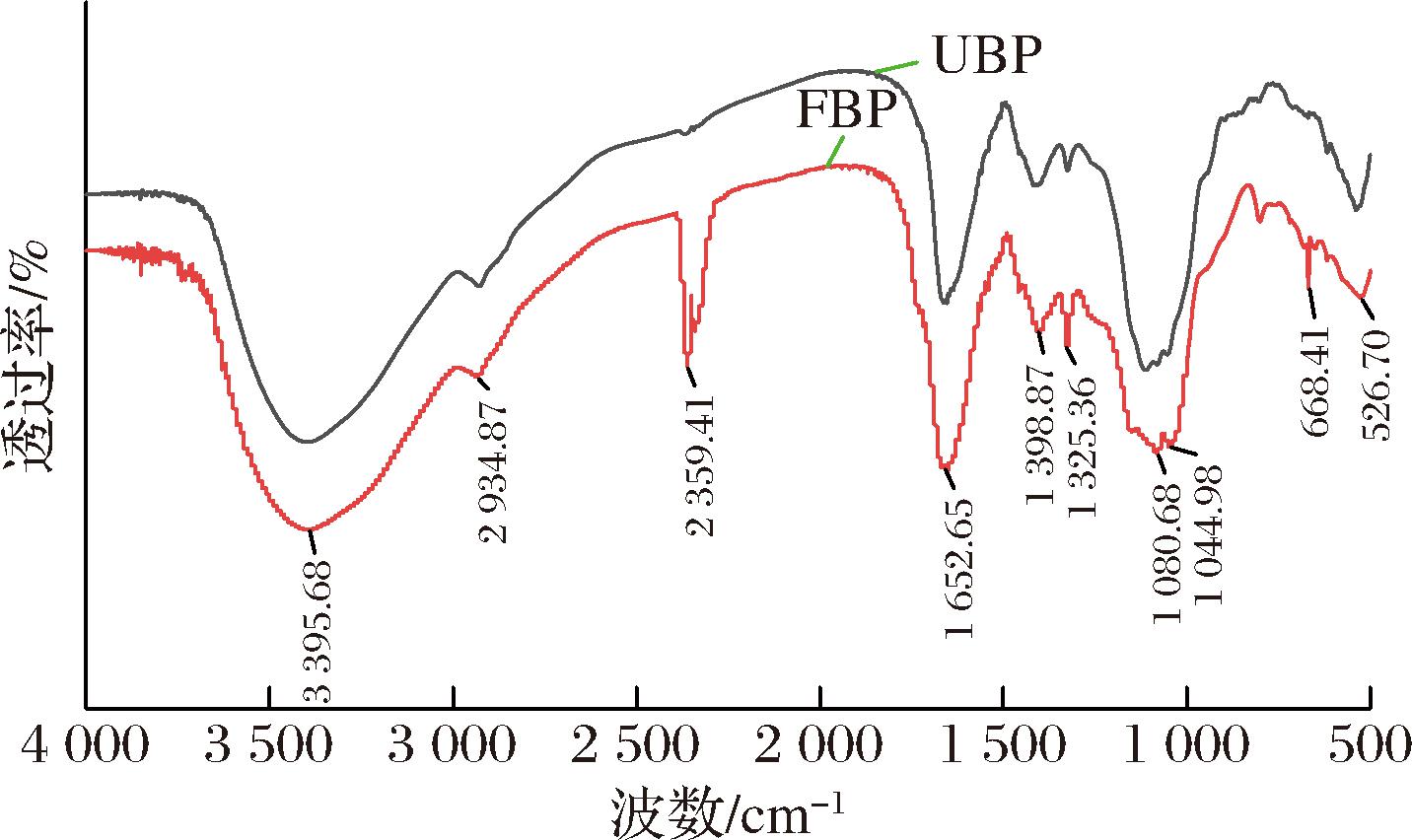
图2 UBP和FBP的傅里叶变换红外光谱图
Fig.2 FT-IR spectra of UBP and FBP
2.4 UBP与FBP的扫描电镜结果
图3-a1和图3-a2分别表示在7 500×和10 000×下观察的UBP,可以看到不规则和细小颗粒状结构组成,表面光滑,孔洞松散,孔径小,有类似海绵结构且具有一定程度凹陷。图3-b1和图3-b2表示在7 500×和10 000×下观察FBP,在不同放大倍数下,发酵后的糠麸多糖表面较为粗糙,立体结构疏松,孔洞较多,互相交联连接且表面积增大。

a1、a2-UBP扫描电镜图;b1、b2-FBP扫描电镜图
图3 UBP和FBP的扫描电镜图
Fig.3 Scanning electron microscopy analysis of UBP and FBP
2.5 UBP与FBP的抗氧化最适浓度筛选
如图4所示,观察空白对照组发现,添加UBP、FBP的斑马鱼胚胎组均无死亡且孵化率为100%。心率上,添加UBP、FBP的胚胎组均为141.6 次/min,表明基础状态下两者心率相近。
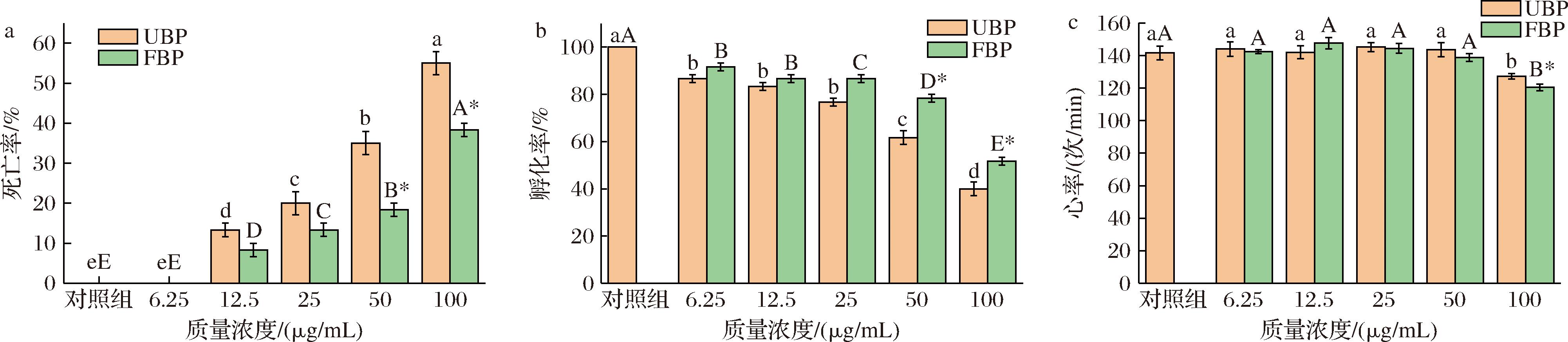
a-斑马鱼胚胎死亡率;b-孵化率;c-心跳速率
图4 筛选最佳安全浓度
Fig.4 Screening the optimal safe concentration
注:小写字母表示不同质量浓度UBP与空白对照组之间存在显著差异(P<0.05),大写字母表示不同质量浓度FBP与空白对照组之间存在显著差异(P<0.05),相同标签表示差异不显著(P>0.05),*表示UBP与FBP之间存在显著差异(P<0.05)。
由图4-a可知,与空白对照组相比,胚胎死亡率随质量浓度的升高逐渐增加,表明UBP和FBP对于斑马鱼胚胎造成的伤害存在着明确的质量浓度相关性,其中UBP所导致的胚胎死亡率显著高于FBP组(P<0.05)。在6.25 μg/mL质量浓度下,胚胎死亡率几乎为0%,而在50 μg/mL时,UBP组胚胎死亡率达到35.00%,FBP组则为18.33%;当质量浓度升至100 μg/mL时,胚胎死亡率均超过40%。图4-b显示,与空白对照组相比,UBP和FBP的不同浓度对胚胎的孵化率有显著影响。当质量浓度达到50 μg/mL时,FBP组在孵化率方面具有明显的优越性,显著高于UBP组(P<0.05)。图4-c可知,与空白对照组相比,当质量浓度为6.25~50 μg/mL时,FBP与同等浓度的UBP对仔鱼心率没有明显差异。而与对照组及100 μg/mL UBP相比,FBP在相同浓度下显著降低斑马鱼的心率(P<0.05)。
因此,当UBP和FBP的质量浓度为6.25 μg/mL,对斑马鱼胚胎的发育未造成明显损伤,而当质量浓度达到50、100 μg/mL,则导致胚胎死亡率增加、孵化率降低及心跳减缓,显著影响斑马鱼胚胎的发育,对斑马鱼胚胎的发育显示出明显的损害作用。基于上述试验结果,选择6.25、12.5、25 μg/mL的UBP与FBP进行后续抗氧化活性评价。
2.6 UBP与FBP对 AAPH 诱导的斑马鱼氧化应激模型的保护作用评价
与空白对照组相比,AAPH诱导组的斑马鱼胚胎死亡率、孵化率、心率以及卵黄囊面积差异显著,确定AAPH诱导对斑马鱼产生氧化应激效应,故AAPH诱导的斑马鱼氧化应激模型建立成功。如图5-a所示,与空白对照组相比,AAPH诱导组斑马鱼胚胎死亡率升高至46.67%。当斑马鱼胚胎暴露于FBP、UBP与AAPH协同诱导的溶液中时,胚胎死亡率随暴露质量浓度的升高逐渐降低,且当质量浓度为25 μg/mL时,UBP组胚胎死亡率显著高于FBP组(P<0.05),同时在此浓度下,FBP显著改善 AAPH诱导导致的胚胎死亡(P<0.05),存活率高达75%,证明FBP对 AAPH诱导的斑马鱼胚胎具有有效的保活作用,且呈剂量依赖性。而FBP和UBP组均对AAPH导致的死亡率有缓解作用(P<0.05)。
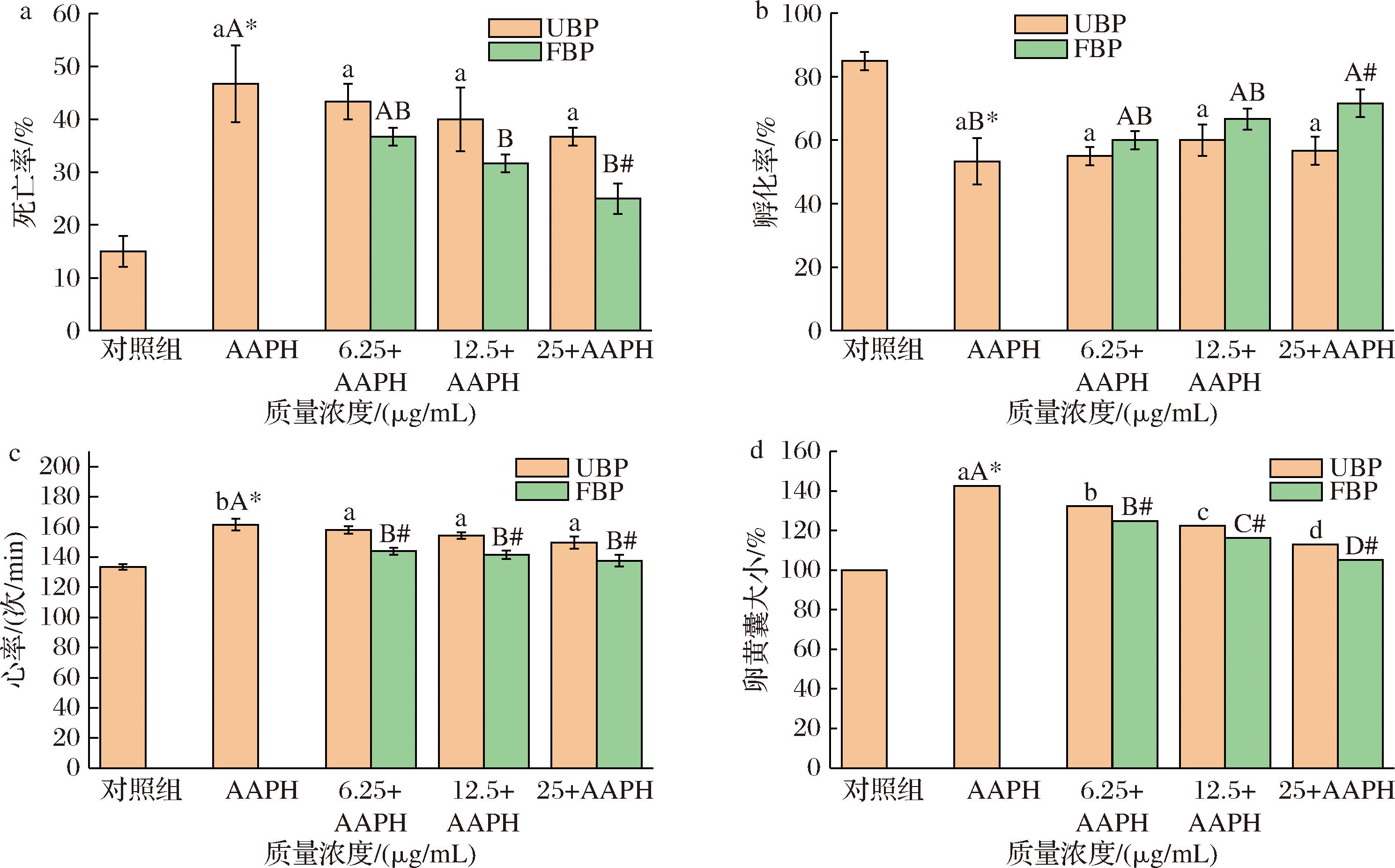
a-胚胎死亡率;b-孵化率;c-心跳速率;d-卵黄囊大小
图5 不同质量浓度UBP与FBP对AAPH诱导的斑马鱼胚胎死亡率、孵化率、心跳速率、卵黄囊大小的影响
Fig.5 Effects of different concentrations of UBP and FBP on AAPH-induced zebrafish embryo mortality,hatching rate,heartbeat rate,and yolk sac size
注:*表示对照组与AAPH处理组差异显著(P<0.05);不同小写字母表示不同质量浓度UBP与AAPH组之间差异显著(P<0.05);不同大写字母表示不同质量浓度 FBP与AAPH组之间差异显著(P<0.05);含有相同标签表示差异不显著(P>0.05);#表示UBP与FBP差异显著(P<0.05)(下同)。
由图5-b可知,与空白对照组相比,AAPH诱导组斑马鱼孵化率显著降低至53.33%。与AAPH诱导组相比,FBP、UBP组的斑马鱼胚胎随质量浓度的增加,孵化率不断提高,在质量浓度为25 μg/mL时,FBP组斑马鱼胚胎孵化率大于UBP组(P<0.05),且在此质量浓度下,FBP显著抑制AAPH诱导导致的胚胎孵化率降低(P<0.05),使得孵化率提高至71.67%。
斑马鱼仔鱼心率统计结果,如图5-c,在AAPH诱导作用下,斑马鱼仔鱼心率大幅度提升至对照组的161.50%(P<0.05)。相比之下,在3个不同浓度的FBP实验组中,AAPH所引起的心率升高均被显著抑制(P<0.05)。其中,最佳FBP质量浓度为25 μg/mL,在此质量浓度下,能有效地降低心率并使之接近于没有添加任何药物的对照组(P>0.05)。实验结果表明,FBP对 AAPH诱导斑马鱼模型产生的氧化应激具有良好的保护作用。
如图5-d所示,斑马鱼胚胎在AAPH诱导下发育减缓,营养物质消耗减少,卵黄囊明显异常肿大,达到空白对照组斑马鱼的1.4倍。而在UBP与FBP预孵育处理的实验组中,卵黄囊大小随着质量浓度增加呈剂量依赖性减小,尤其在最高质量浓度25 μg/mL时,FBP组与AAPH诱导组有显著差异。
2.7 不同质量浓度UBP与FBP对AAPH诱导的斑马鱼胚胎体内ROS生成率的影响
ROS是一类具有化学活性的分子,包括超氧阴离子、羟自由基以及过氧化氢,它们是新陈代谢过程中产生的自然副产品[25]。ROS引发的氧化应激会损害生物分子的功能,从而导致细胞死亡和组织损伤。由图6可知,与对照组相比,AAPH诱导的斑马鱼ROS产生量显著提升(P<0.05),ROS生成率达150.24%。不同质量浓度的UBP处理组(6.25、12.5、25 μg/mL)显著降低ROS生成水平,分别降低了17.39%、34.44%和41.11%。所有浓度的FBP均降低斑马鱼体内ROS生成水平,分别降至92.30%、82.90%和79.60%。此外,在全部浓度下,FBP处理斑马鱼的ROS产量显著低于UBP。这些结果表明,UBP和FBP处理后ROS产生量减少,且FBP的保护作用大于UBP。
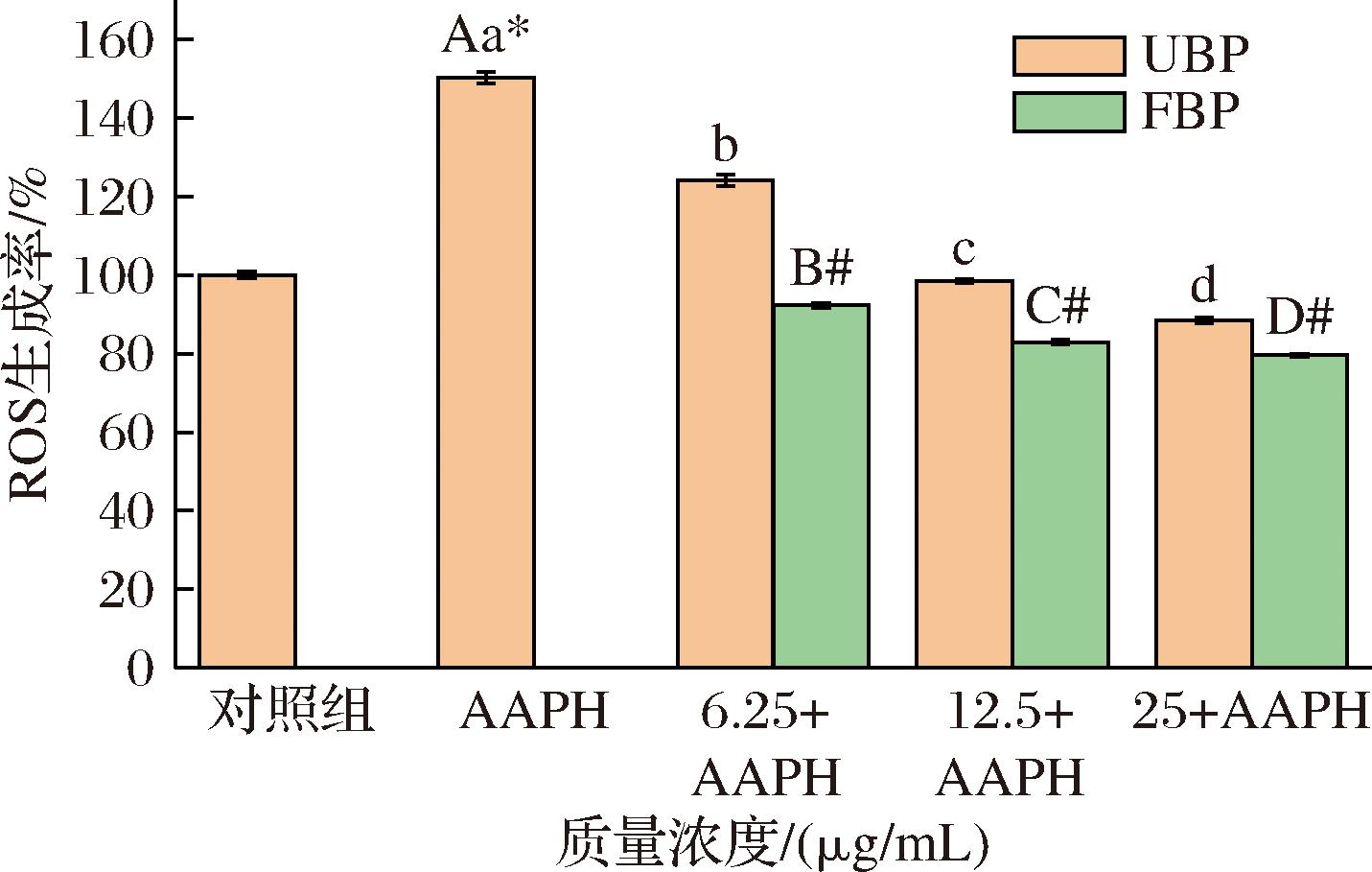
图6 不同质量浓度UBP和FBP对AAPH诱导的斑马鱼体内ROS生成率的影响
Fig.6 Effects of different concentrations of UBP and FBP against AAPH-induced ROS production in zebrafish
2.8 不同质量浓度UBP与FBP对 AAPH诱导的斑马鱼胚胎体内细胞死亡的影响
AO是一种核酸选择性荧光阳离子染料,通常通过插层或静电吸引与DNA和RNA相互作用,用于鉴定凋亡细胞。如图7所示,对照组斑马鱼中AO的存在表明细胞死亡是发育过程中正常的生理过程。与对照组相比,AAPH组处理的斑马鱼细胞死亡率增加到119.97%(P<0.05)。在6.25~25 μg/mL范围内,FBP和UBP均能显著降低AAPH诱导的细胞凋亡现象,且呈剂量依赖性,当质量浓度达到6.25、25 μg/mL时,FBP对斑马鱼细胞死亡率降低作用明显强于UBP组(P<0.05)。此外,FBP处理的斑马鱼细胞死亡水平(92.19%、80.54%和76.96%)低于UBP(96.82%、85.42%和80.99%)。结果表明,FBP对AAPH诱导的斑马鱼仔鱼细胞死亡有较好地抑制作用。
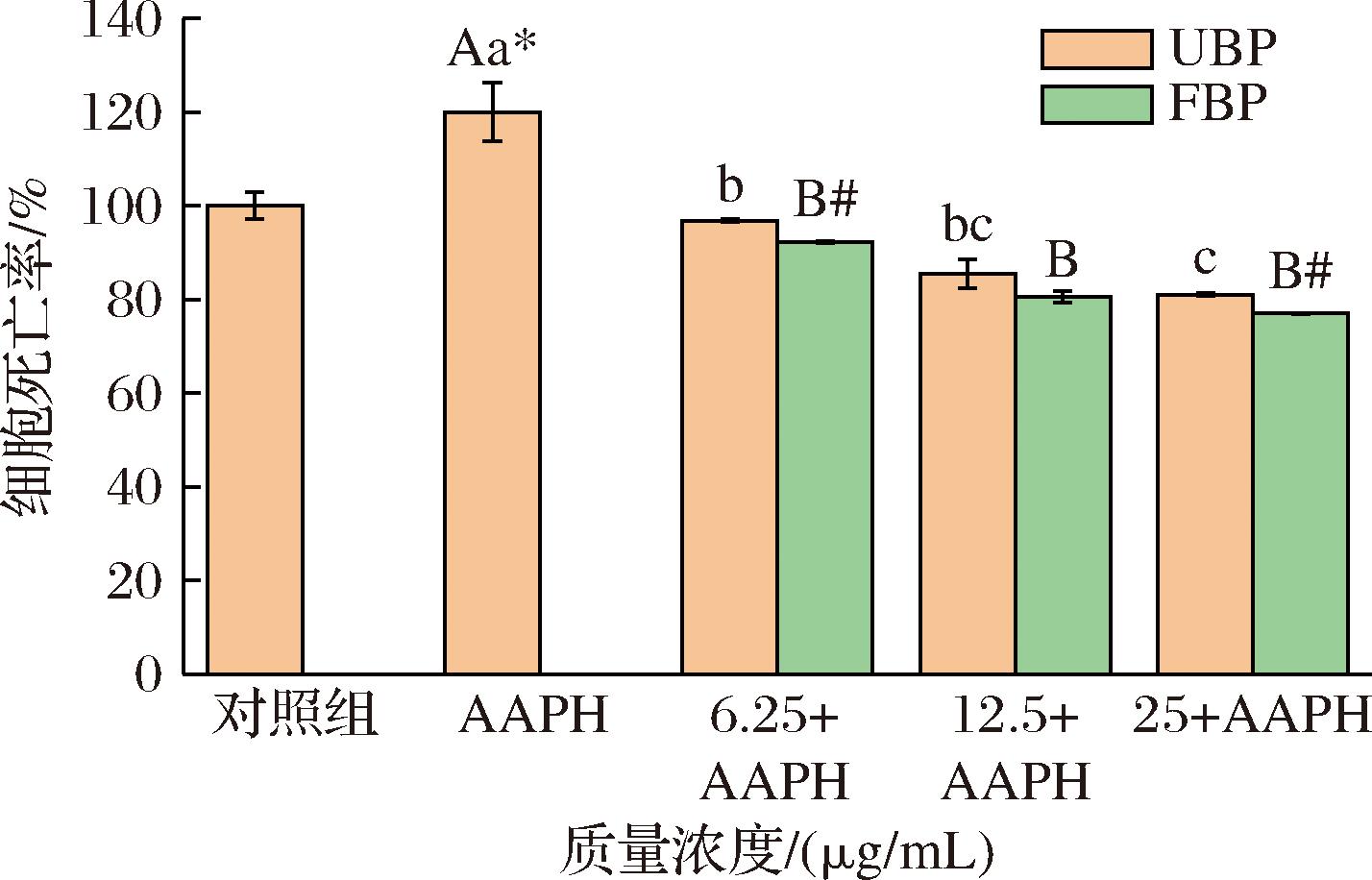
图7 不同质量浓度UBP和FBP对AAPH诱导的斑马鱼体内细胞死亡的影响
Fig.7 Effects of different mass concentrations of UBP and FBP against AAPH-induced cell death in zebrafish
2.9 不同质量浓度UBP与FBP对AAPH诱导的斑马鱼胚胎体内脂质过氧化的影响
DPPP能够穿透细胞膜,通过脂质过氧化反应生成的氢过氧化物引发氧化反应,从而产生荧光DPPP氧化物[26]。如图8所示,与对照组相比,AAPH处理后的斑马鱼脂质过氧化水平显著提高(121.94%)。在不同质量浓度(6.25、12.5、25 μg/mL)下,UBP和FBP组均减少AAPH诱导产生的脂质过氧化,且这种效果呈现出浓度依赖性。所有质量浓度的FBP暴露的斑马鱼脂质过氧化水平(91.14%、78.27%、66.49%)均低于UBP(104.98%、84.95%、79.49%),而当质量浓度达到6.25 μg/mL时,FBP对斑马鱼脂质过氧化的抑制作用显著优于UBP组(P<0.05)。上述结果表明,UBP和FBP均能抑制脂质过氧化,且FBP对脂质过氧化的保护效果优于UBP。
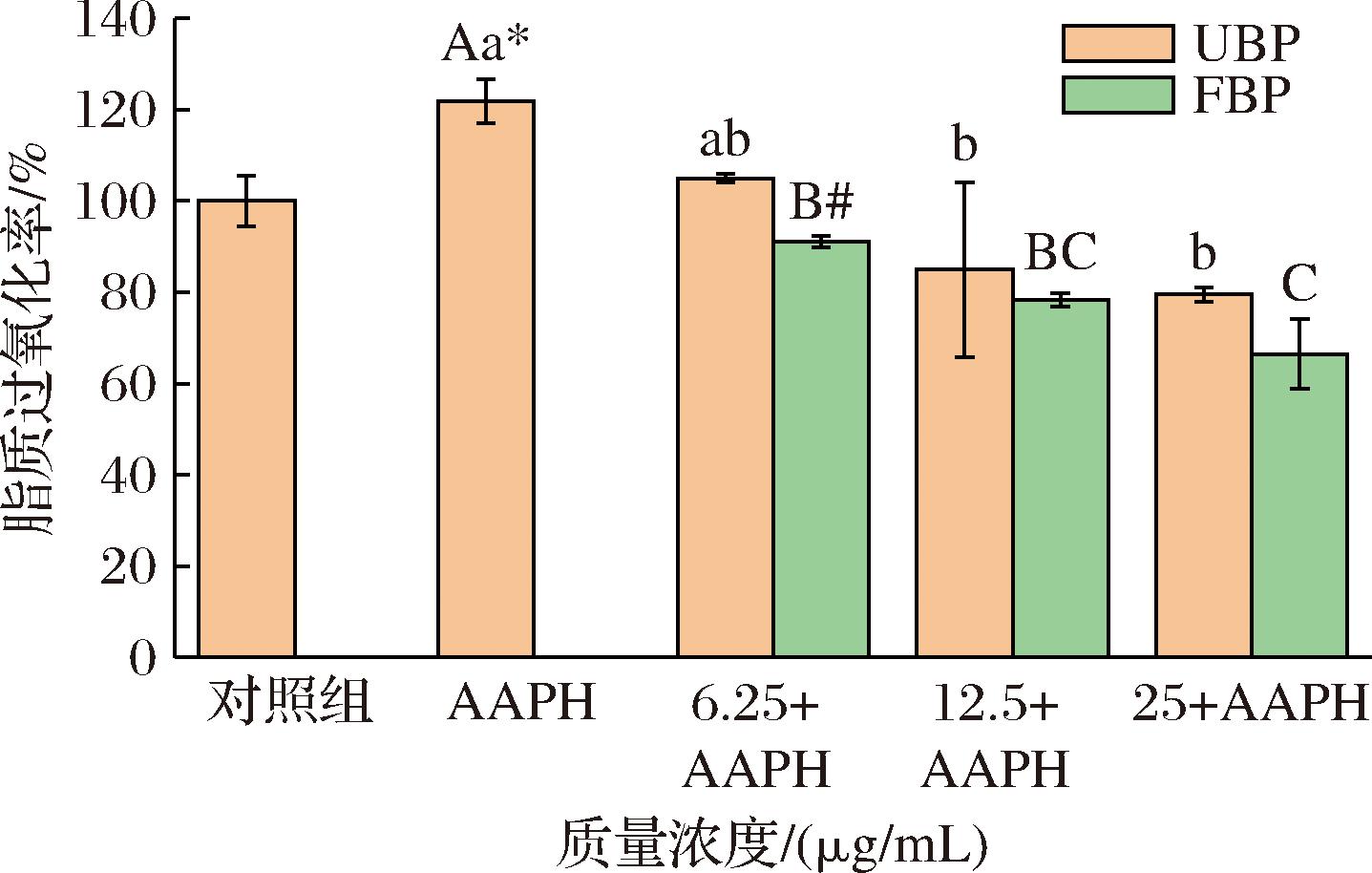
图8 不同质量浓度UBP和FBP对AAPH诱导的斑马鱼体内脂质过氧化的影响
Fig.8 Effects of different mass concentrations of UBP and FBP against AAPH-induced lipid peroxidation in zebrafish
3 讨论
糠麸多糖是一类从谷物外层的糠麸中提取的天然多糖[27],作为一种天然的生物大分子,具有多种健康益处,近年来受到营养学和食品科学领域的广泛关注。研究表明,糠麸多糖具有显著的免疫调节作用,能够增强机体的免疫力,帮助人体抵抗外界病原体的侵袭[11]。它还具有良好的抗氧化性能,能够清除体内自由基,减缓细胞老化过程,保护生物大分子免受氧化损伤,维护身体健康。在消化系统方面,糠麸多糖富含膳食纤维,能够促进肠道蠕动,增加粪便体积,改善便秘情况,有助于维持肠道健康[28]。糠麸多糖还能作为益生元,为肠道内的有益菌提供营养,促进肠道菌群平衡,提升肠道的免疫功能。此外,糠麸多糖的来源广泛、成本低廉,且加工过程中对环境友好,符合可持续发展的理念。开发利用糠麸多糖有助于提升农产品的附加值,还能为食品、医药、化妆品等行业提供新的原料选择,推动相关产业的创新发展。在糠麸多糖的发酵过程中,灰树花作为一种白腐真菌,能产特定的酶,从而将底物降解为糖类[1],因此,其生长代谢活动对糠麸中的多糖含量及品质起到了关键调控作用。发酵时间作为影响多糖含量的关键因素[29],对多糖的积累具有显著影响。本研究精确控制发酵周期,详细探讨不同发酵时间对糠麸多糖含量的动态变化,揭示微生物活动与多糖之间的复杂关系。未发酵糠麸多糖含量为86.56 mg/g,此阶段多糖含量相对较低。随着发酵进行,至第3天,灰树花生长代谢活动消耗大量营养物质,FBP含量下降至59.43 mg/g,这一变化与微生物生长初期营养需求相吻合。随后,发酵时间延长,灰树花利用糠麸中碳源和氮源进行生物转化,从而促使合成、积累多糖。发酵至第13天,FBP含量达到峰值,为126.93 mg/g,这一结果与张海燕等[30]、张子珩等[31]研究相符,表明真菌在特定发酵条件下,多糖产量在发酵中期达到最高。当发酵时间进一步延长至15 d,微生物过度消耗营养并产生不利代谢产物,FBP含量急剧下降至59.07 mg/g,这与LUO等[32]、LI等[33]观察到长时间发酵导致多糖降解现象一致。确定发酵13 d为糠麸产多糖含量积累最优时间,为后续试验提供最佳固态培养基。
扫描电镜观察显示,UBP呈不规则细小颗粒状,表面光滑,孔洞松散;FBP则具粗糙、疏松立体结构,孔洞增多且互相交联,表面积显著增大[34-35]。许欣[36]在研究中添加特定菌种发酵豆粕,发现发酵后多糖样品表面形态更粗糙,孔洞结构增加,与本研究FBP变化趋势一致。陈怡[37]报道发酵过程中多糖分子质量增加及单糖组成改变,均有助于提升多糖活性。本研究中,FBP分子质量由UBP的10.77 kDa增至24.07 kDa,单糖组成方面,发酵导致葡萄糖比例大幅上升,成为FBP主要单糖。葡萄糖具还原性,能有效清除体内自由基,维护细胞的稳定性和完整性,为机体提供坚实的抗氧化屏障,是抗氧化反应的关键[38]。此外,甘露糖、氨基葡萄糖、核糖、鼠李糖和葡萄糖醛酸等单糖比例增加,它们或形成特定糖苷键、空间构型,协同增强FBP抗氧化能力。甘露糖和鼠李糖增加多糖支链度,提高空间位阻,有效阻止自由基进攻[39];氨基葡萄糖和葡萄糖醛酸引入氨基、羧基等官能团,增强多糖亲水性和电荷性,促进与其他抗氧化成分相互作用,构建强大抗氧化网络[40],从而证明了灰树花发酵对多糖理化特性的积极影响。灰树花发酵显著改变了多糖的分子结构和单糖组成,赋予了其卓越的抗氧化能力,这对多糖在食品、药品及化妆品等领域的广泛应用具有深远意义。
葡萄糖常作为抗氧化反应的重要因素,由于其具较高的还原性,醛基直接作用于自由基,从而还原成稳定分子。梁双敏等[41]通过研究松茸粗多糖,将其分离纯化出3种多糖组分,四者进行对比,发现松茸多糖抗氧化活性显著高于其他多糖组分,是由于松茸粗多糖中葡萄糖含量较高,有利于氢键形成,从而增强多糖清除自由基的能力。商佳琦等[42]通过评估5种食用菌多糖的结构特征,发现葡萄糖对DPPH自由基清除能力有显著影响,但对超氧阴离子的清除作用较弱。徐顺高[43]亦对树舌灵芝多糖的单糖组成及抗氧化功能进行研究,发现葡萄糖与甘露糖比例较高的多糖具有更好的抗氧化活性。而本研究中,FBP的葡萄糖含量高达60.56%,故FBP可能具有更强的抗氧化功能。而甘露糖、氨基葡萄糖、核糖、鼠李糖和葡萄糖醛酸等单糖比例的增加,是FBP抗氧化能力提升的另一支柱。它们形成特定的糖苷键和空间构型,增强了多糖的稳定性和抗降解性,协同抵御自由基的侵袭。甘露糖和鼠李糖的增加,使自由基难以接近多糖核心结构,有效阻止氧化反应发生。FBP具有更大的分子质量和更丰富的还原性单糖,这些特性使其能够高效清除自由基、抑制脂质过氧化,从而保护细胞免受氧化损伤。具体而言,FBP中的葡萄糖等还原性单糖能直接与自由基反应,将其还原为稳定分子,阻断氧化应激链式反应。而FBP更大的分子质量则意味着其拥有更多活性位点,能与自由基等氧化剂更有效结合,进一步增强其抗氧化能力。此外,发酵过程还可能为FBP赋予了特殊的生物活性成分或结构特征,进一步提升了其抗氧化活性。
实验结果表明,FBP在抗氧化功能上显著优于UBP。在AAPH诱导斑马鱼氧化应激模型中,FBP处理的斑马鱼胚胎死亡率显著降低,并提高孵化率、稳定心率[44]。FBP还能抑制活性氧生成,降低脂质过氧化率和细胞死亡率,体现其抵抗氧化应激优势。闫志惠等[45]用斑马鱼模型评估不同来源多糖抗氧化能力,发现特定发酵处理的多糖降低氧化应激损伤更优。林源等[46]亦用斑马鱼模型研究多糖对氧化应激相关基因表达影响,证实多糖抗氧化机制。本研究中,FBP浓度增加,抗氧化效果逐渐显现,25 μg/mL时达峰值,显著减少活性氧生成,脂质过氧化率、细胞死亡率降低。这些结果与斑马鱼模型其他研究相符,证明FBP抗氧化卓越性能。为全面评估FBP抗氧化能力,本研究将其与未处理的多糖进行比较。结果显示,FBP在降低斑马鱼胚胎死亡率、提高孵化率、稳定心率及抑制活性氧生成等方面均优于未发酵多糖。
鉴于发酵后的FBP展现的显著抗氧化优势,其作为天然抗氧化剂的应用前景极为广阔[47]。FBP源于天然真菌灰树花协同处理下的多糖,安全无毒且可食用,契合现代消费者对健康绿色产品的追求。
4 结论
综上所述,加入灰树花FBP在抗氧化活性方面展现出显著优势,其结构组成与UBP存在显著差异,且在斑马鱼模型中的抗氧化效果明显优于UBP。FBP有效抑制ROS及脂质过氧化,减少细胞死亡,保护斑马鱼胚胎免受氧化应激损害。鉴于FBP的天然来源、安全无毒及显著抗氧化活性,其在食品、药品及化妆品等领域应用前景广阔。未来,随着研究的深入和技术进步,FBP有望成为重要的天然抗氧化剂,为人类健康事业做出更大贡献。
[1] 刘伟民,余昭玮.以米糠、麸皮为基质的灵芝液态发酵动力学模型研究[J].食品工业科技,2020,41(15):113-118;128.LIU W M,YU Z W.Study on the kinetic model of Ganoderma lucidum liquid fermentation in rice bran and wheat bran substrate[J].Science and Technology of Food Industry,2020,41(15):113-118;128.
[2] 余昭玮.灵芝菌株诱变及新菌株液态发酵米糠麸皮全料的研究[D].镇江:江苏大学,2019.YU Z W.Study on the mutagenesis of Ganoderma lucidum and liquid fermention of new strain in rice bran and wheat bran media[D].Zhenjiang:Jiangsu University,2019.
[3] 刘伟民,徐立平,郭春梅,等.灰树花在米糠培养基上固态发酵产多糖研究[J].食品科学,2010,31(23):238-242.LIU W M,XU L P,GUO C M,et al.Solid fermentation of Grifola frondosa in rice bran medium for grifolan production[J].Food Science,2010,31(23):238-242.
[4] TU J,ZHAO J,LIU G H,et al.Solid state fermentation by Fomitopsis pinicola improves physicochemical and functional properties of wheat bran and the bran-containing products[J].Food Chemistry,2020,328:127046.
[5] 刘博,毕研丽,杨丽梅,等.灰树花多糖纳米乳的制备及其对H9亚型禽流感病毒与常见细菌抑制效果的评估[J].中国预防兽医学报,2024,46(8):856-862.LIU B,BI Y L,YANG L M,et al.Preparation of nanoemulsion from polysaccharides of Grifola frondosa and evaluation of its inhibition effect on H9 subtype avian influenza virus and common bacteria[J].Chinese Journal of Preventive Veterinary Medicine,2024,46(8):856-862.
[6] GALI M,
M, ILERDŽI
ILERDŽI ,VUKOJEVI
,VUKOJEVI J,et al.Agro-forestry residues valorization by ligninosome of Grifola frondosa[J].Wood Research,2021,66(4):657-665.
J,et al.Agro-forestry residues valorization by ligninosome of Grifola frondosa[J].Wood Research,2021,66(4):657-665.
[7] KARIYAWASAM K.Studies on the effects of edible mushroom Grifola frondosa on intestinal homeostasis[D].Morioka:Iwate University,2020.
[8] 王鑫磊,周聪,高保军,等.灰树花海棠果发酵饮料研制及其抗疲劳活性研究[J].中国酿造,2022,41(12):52-55.WANG X L,ZHOU C,GAO B J,et al.Development and anti-fatigue activity of fermented Grifola frondosa crabapple beverage[J].China Brewing,2022,41(12):52-55.
[9] S NCHEZ
NCHEZ  J,MONTOYA S.Assessment of polysaccharide and biomass production from three white-rot fungi by solid-state fermentation using wood and agro-industrial residues:A kinetic approach[J].Forests,2020,11(10):1055.
J,MONTOYA S.Assessment of polysaccharide and biomass production from three white-rot fungi by solid-state fermentation using wood and agro-industrial residues:A kinetic approach[J].Forests,2020,11(10):1055.
[10] 袁丹丹.鱼腥草提取物促灰树花胞外多糖合成及其调节慢性酒精性胃炎的研究[D].贵阳:贵州大学,2024.YUAN D D.Study on promoting exopolysaccharide synthesis of Grifola frondosa Houttuynia cordata Thunb extract and regulating chronic alcoholic gastritis[D].Guiyang:Guizhou University,2024.
[11] 杨卫卫.发酵米糠麸皮的灰树花选育、灰树花多糖的结构表征及体外生物活性的研究[D].镇江:江苏大学,2021.YANG W W.Breeding of Grifola frondosa fermented rice bran and wheat bran,and structural characterization and activity of Grifola frondosa polysaccharides[D].Zhenjiang:Jiangsu University,2021.
[12] 郑越,杜涓,刘娜,等.灰树花功能性成分及其生物活性的研究进展[J].中国饲料,2024(15):167-173.ZHENG Y,DU J,LIU N,et al.Research progress on functional components and biological activities of Grifola frondosa[J].China Feed,2024(15):167-173.
[13] DEDHIA N,MARATHE S J,SINGHAL R S.Food polysaccharides:A review on emerging microbial sources,bioactivities,nanoformulations and safety considerations[J].Carbohydrate Polymers,2022,287:119355.
[14] KHAN I U,JAMIL Y,KHAN A,et al.Pichia pastoris mediated digestion of water-soluble polysaccharides from cress seed mucilage produces potent antidiabetic oligosaccharides[J].Pharmaceuticals,2024,17(6):704.
[15] 孙英.灰树花漆酶发酵工艺优化及其协同益生菌降解木质素的研究[D].呼和浩特:内蒙古农业大学,2021.SUN Y.Study on optimization of fermentation process of Grifola frondosa laccase and its synergistic degradation of lignin by probiotics[D].Hohhot:Inner Mongolia Agricultural University,2021.
[16] 何永超,刘雅敏,朱艳慧,等.苯酚-硫酸显色法测定炙甘草汤的总多糖含量研究[J].中医学报,2013,28(4):547-549.HE Y C,LIU Y M,ZHU Y H,et al.Content determination of total polysaccharides in roasted liquorice decoction by phenol-sulfuric acid method[J].China Journal of Chinese Medicine,2013,28(4):547-549.
[17] 张燕.沙棘叶多糖的酶解工艺优化、体外生物活性及理化性质研究[D].呼和浩特:内蒙古农业大学,2024.ZHANG Y.Optimization of enzymatic hydrolysis process,functional properties and physicochemical properties of polysaccharide from Hippophae rhamnoides L.leaves[D].Hohhot:Inner Mongolia Agricultural University,2024.
[18] WU D T,LIU W,HAN Q H,et al.Physicochemical characteristics and antioxidant activities of non-starch polysaccharides from different kiwifruits[J].International Journal of Biological Macromolecules,2019,136:891-900.
[19] 陈秋燕,王瑞芳,王园,等.基于斑马鱼模型评价发酵对麦麸多糖抗氧化活性的影响[J].中国粮油学报,2022,37(12):35-43.CHEN Q Y,WANG R F,WANG Y,et al.Evaluation on effects of fermentation on antioxidant activity of wheat bran polysaccharide based on zebrafish model[J].Journal of the Chinese Cereals and Oils Association,2022,37(12):35-43.
[20] 张磊.玉米秸秆半纤维素的分离提取和结构分析及玉米芯水解残渣活性炭的制备[D].济南:齐鲁工业大学,2016.ZHANG L.Extraction and characterization of hemicelluloses from corn stalks and preparation of activated carbon from corncob hydrolysis residue[D].Jinan:Qilu University of Technology,2016.
[21] CUI Z H,GUO Z Q,MIAO J H,et al.The genus Cynomorium in China:An ethnopharmacological and phytochemical review[J].Journal of Ethnopharmacology,2013,147(1):1-15.
[22] 韩润平,邹卫华,张敬华,等.谷壳的差热红外扫描电镜分析及对铜铅离子的生物吸附研究[J].环境科学学报,2006,26(1):32-39.HAN R P,ZOU W H,ZHANG J H,et al.Characterization of chaff and biosorption of copper and lead ions from aqueous solution[J].Acta Scientiae Circumstantiae,2006,26(1):32-39.
[23] MANRIQUE G D,LAJOLO F M.FT-IR spectroscopy as a tool for measuring degree of methyl esterification in pectins isolated from ripening papaya fruit[J].Postharvest Biology and Technology,2002,25(1):99-107.
[24] LI Z R,WANG B,CHI C F,et al.Purification and characterization of an antioxidant glycoprotein from the hydrolysate of Mustelus griseus[J].International Journal of Biological Macromolecules,2013,52:267-274.
[25] PARK J W,PARK J H,LEE H,et al.Penilumamide,a novel SIRT1 activator,protects UVB-induced photodamages in HaCaT cells[J].Journal of Toxicology and Environmental Health,Part A,2025,88(3):106-121.
[26] KONG Y Q,WANG L,JEON Y J,et al.In vitro and in vivo antioxidant activities of a fucose-rich fucoidan isolated from Saccharina japonica[J].Journal of Applied Phycology,2023,35(1):353-364.
[27] 杨泉,张潮桓,郭翠华,等.糠麸类饲料粗纤维与中性洗涤纤维含量关系的研究[J].山东畜牧兽医,2024,45(11):12-13;15.YANG Q,ZHANG C H,GUO C H,et al.Study on the relationship between the content of crude fiber and neutral detergent fiber in bran feed[J].Shandong Journal of Animal Science and Veterinary Medicine,2024,45(11):12-13;15.
[28] 王海荣,王园,安晓萍,等.草食家畜功能性糠麸多糖生物饲料添加剂的开发与产业化.内蒙古农业大学,KCBJ2018009[Z].2022-05-20.WANG H R,WANG Y,AN X P,et al.Development and industrialization of functional bran polysaccharide biological feed additive for herbivorous livestock.Inner Mongolia Agricultural University,KCBJ2018009[Z].2022-05-20.
[29] 岳佳新,王强强,孟令瑜,等.岩藻多糖-油菜花粉-南瓜籽油育发复方对雄激素性脱发模型小鼠毛发生长的影响及其作用机制[J].世界临床药物,2022,43(4):411-417;424.YUE J X,WANG Q Q,MENG L Y,et al.Effects of fucoidan-pollen of Brassica campestris-pumpkin seed oil-1 on hair growth in androgenic alopecia model mice and its mechanisms of action[J].World Clinical Drugs,2022,43(4):411-417;424.
[30] 张海燕,康三江,袁晶,等.不同菌种组合对沙棘酵素发酵过程中理化指标及活性物质变化的影响[J].食品安全质量检测学报,2023,14(16):268-276.ZHANG H Y,KANG S J,YUAN J,et al.Effects of different strains on changes of physicochemical indexs and bioactive components of seabuckthorn Jiaosu during fermentation process[J].Journal of Food Safety &Quality,2023,14(16):268-276.
[31] 张子珩,庄苏,张瑜,等.4种谷物加工副产物的体外发酵特性及细胞壁多糖降解规律[J].畜牧与兽医,2022,54(4):25-32.ZHANG Z H,ZHUANG S,ZHANG Y,et al.The in vitro fermentation kinetics and cell wall polysaccharide degradation of 4 grain by-products[J].Animal Husbandry &Veterinary Medicine,2022,54(4):25-32.
[32] LUO Y,ZHAO Z J,CHEN H J,et al.Dynamic analysis of physicochemical properties and polysaccharide composition during the pile-fermentation of post-fermented tea[J].Foods,2022,11(21):3376.
[33] LI X,PENG B,CHEUNG P C,et al.Depolymerized non-digestible sulfated algal polysaccharides produced by hydrothermal treatment with enhanced bacterial fermentation characteristics[J].Food Hydrocolloids,2022,130:107687.
[34] 郝苗苗.富硒甘薯叶的综合利用及差异蛋白组学分析[D].沈阳:辽宁大学,2022.HAO M M.Comprehensive utilization and differential proteomic analysis of Selenium-enriched sweet potato leaves[D].Shenyang:Liaoning University,2022.
[35] 熊雯宇,何君强,刘斌.灰树花水上清液中不同极性提取物的功能成分及其抗氧化活性[J].中国食品学报,2023,23(12):302-310.XIONG W Y,HE J Q,LIU B.Functional components and antioxidant activities of different polarities extracts from the supernatant of Grifola frondosa[J].Journal of Chinese Institute of Food Science and Technology,2023,23(12):302-310.
[36] 许欣.豆粕高温菌酶协同发酵工艺研究[D].武汉:华中农业大学,2020.XU X.Study on high temperature fermentation of soybean meal by bacterial and enzymatic cooperation[D].Wuhan:Huazhong Agricultural University,2020.
[37] 陈怡.‘红实2号’猕猴桃多糖提取优化及后熟过程中结构特征、体外生物活性变化规律的研究[D].雅安:四川农业大学,2023.CHEN Y.Optimization of polysaccharide extraction from kiwifruit ‘Hongshi No.2’ and study of its structural characteristics and in vitro bioactivity during post-ripening[D].Ya’an:Sichuan Agricultural University,2023.
[38] 林军,李高阳,黄帆,等.分级醇沉紫薯多糖抗氧化活性与稳定性[J].食品与机械,2022,38(3):189-196.LIN J,LI G Y,HUANG F,et al.Antioxidant and stability of polysaccharides from purple sweet potato by fractional alcohol precipitation[J].Food &Machinery,2022,38(3):189-196.
[39] 白云洲.低压蒸制对刺参多糖组成、结构及活性的影响[D].大连:大连海洋大学,2023.BAI Y Z.Effect of low-pressure steaming on the composition,structure and activities of polysaccharides in Apostichopus japonicus[D].Dalian:Dalian Ocean University,2023.
[40] SONG B,YE J Q,SOSSAH F L,et al.Assessing the effects of different agro-residue as substrates on growth cycle and yield of Grifola frondosa and statistical optimization of substrate components using simplex-lattice design[J].AMB Express,2018,8(1):46.
[41] 梁双敏,国琦,葛长荣,等.松茸粗多糖的提取工艺优化、单糖组成及体外抗氧化活性[J].云南农业大学学报(自然科学),2024,39(2):108-118.LIANG S M,GUO Q,GE C R,et al.Optimization extraction,monosaccharide composition and antioxidant activity in vitro of polysaccharide from Tricholoma matsutake[J].Journal of Yunnan Agricultural University (Natural Science),2024,39(2):108-118.
[42] 商佳琦,邹丹阳,滕翔宇,等.5种食用菌多糖的结构特征及抗氧化活性对比[J].食品工业科技,2020,41(15):77-83;89.SHANG J Q,ZOU D Y,TENG X Y,et al.Structural characterization and antioxidant activity of five kinds of edible fungus polysaccharides[J].Science and Technology of Food Industry,2020,41(15):77-83;89.
[43] 徐顺高.乙酰化树舌灵芝子实体多糖抗氧化和缓解2型糖尿病小鼠损伤的作用[D].泰安:山东农业大学,2021.XU S G.Antioxidation and alleviative effects of acetylated Ganoderma applanatum fruit body polysaccharides on type 2 diabetic mice injury abstract[D].Tai’an:Shandong Agricultural University,2021.
[44] VIEIRA T F,CORR A R C G,PERALTA R A,et al.An overview of structural aspects and health beneficial effects of antioxidant oligosaccharides[J].Current Pharmaceutical Design,2020,26(16):1759-1777.
A R C G,PERALTA R A,et al.An overview of structural aspects and health beneficial effects of antioxidant oligosaccharides[J].Current Pharmaceutical Design,2020,26(16):1759-1777.
[45] 闫志惠,范蓓,李琳,等.基于氧化应激对手性三唑类杀菌剂诱导斑马鱼毒性效应的研究进展[J].食品安全质量检测学报,2023,14(13):193-202.YAN Z H,FAN B,LI L,et al.Advances in oxidative stress-based adversarial triazole fungicide induced toxic effects in Danio rerio[J].Journal of Food Safety &Quality,2023,14(13):193-202.
[46] 林源,柳莹莹,张秋萍,等.新霉素通过氧化应激介导的细胞凋亡诱导斑马鱼胚胎发育毒性[C].中国毒理学会第十一次全国毒理学大会论文集.北京:中国毒理学会,2024:73-74.LIN Y,LIU Y Y,ZHANG Q P,et al.Neomycin induces developmental toxicity of zebrafish embryo through oxidative stress-mediated apoptosis[C].Proceedings of the 11th National Congress of Toxicology of the Chinese Society of Toxicology.Beijing:Chinese Society of Toxicology,2024:73-74.
[47] BAMIGBADE G B,SUBHASH A J,AL-RAMADI B,et al.Gut microbiota modulation,prebiotic and bioactive characteristics of date pomace polysaccharides extracted by microwave-assisted deep eutectic solvent[J].International Journal of Biological Macromolecules,2024,262:130167.