花生(Arachis hypogaea L.)属豆科一年生草本植物,为世界四大油料作物之一,具有较高的食用价值和经济价值。我国是花生生产和消费大国,种植面积高达467万hm2,品种超过50种[1]。花生含有超过24%的蛋白质,相比其他植物蛋白,抗营养因子含量低,氨基酸结构合理[2],易被人体消化吸收,是一种营养价值较高的植物蛋白。花生蛋白中约有63%为球蛋白,是花生的主要蛋白质[3],其对花生蛋白的性质和功能有较大影响。
脂肪氧合酶(lipoxygenase,LOX)是广泛存在于动植物、真菌和细菌体内的一种酶,可直接催化含顺,顺-戊二烯结构的多不饱和脂肪酸,通过分子内加氧,形成具有共轭双键的氢过氧化衍生物[4]。这些氢过氧化物及其次生产物可以作为中间物质,诱导蛋白质氧化[5-6],从而影响蛋白质的功能性质和营养价值。已有研究表明,多酚等天然化合物对LOX活性具有抑制作用,如儿茶素能显著抑制LOX对β-伴大豆球蛋白的氧化作用并提高其消化率[7],咖啡酸、绿原酸等多酚通过调控LOX活性来干预大豆蛋白的氧化等[8-9],然而目前关于LOX诱导亚油酸催化花生蛋白氧化的相关研究较少,多酚对花生球蛋白氧化的干预作用也尚不明确。
因此,为探究多酚对LOX诱导花生球蛋白氧化的抑制作用,本文以常见的9种多酚为研究对象,探究其对LOX催化亚油酸氧化花生球蛋白的干预作用,以期为花生蛋白在贮藏和加工过程中的抗氧化研究提供一些理论依据。
1 材料与方法
1.1 材料与试剂
花生,云南昆明市场;阿魏酸(ferulic acid,FA)、橙皮素(hesperetin,H)、杨梅素(myricetin,M)、儿茶素(catechin,CA)、迷迭香酸(rosemary acid,R)、绿原酸(chlorogen,CH)、姜黄素(curcumin,CU)、槲皮素(quercetin,Q)、没食子酸(gallic,G)、8-苯胺-1-萘磺酸(8-anilino-1-naphthalenesulfonic acid,ANS)、LOX、吐温-60,上海源叶生物科技有限公司;三羟甲基氨基甲烷[tri(hydroxymethyl)aminomethane,Tris],上海阿法埃莎化学有限公司;2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH),上海阿拉丁生化科技股份有限公司;PBS,北京索莱宝科技有限公司;邻苯二甲醛(1,2-benzenedicarboxaldehyde,OPA),上海展云化工有限公司;亚油酸(linoleic acid,LA),上海金世顿公司。其他试剂均为国产分析纯。
1.2 仪器与设备
3K15多功能高速冷冻离心机,美国Sigma公司;UV-2600紫外-可见分光光度计,北京泰科仪器;Lumina荧光分光光度计、ModulyoD真空冷冻干燥机,赛默飞世尔科技公司;FJ200-SH型数显高速分散均质机,上海标本模型厂制造。
1.3 实验方法
1.3.1 花生球蛋白的制备
参照张雪春等[10]的方法,略作修改,花生仁经石油醚脱脂后过60目筛,以料液比1∶10(g∶mL)与Tris溶液(0.05 mol/L,pH 7.9)混合,30 ℃水浴搅拌提取1 h,于4 ℃、4 000 r/min离心10 min,取上清液与0.05 mol/L NaHSO3溶液按料液比1∶15(g∶mL)混合,调节pH值为6.4,相同条件离心30 min,取沉淀,水洗离心2~3次,冻干后为花生球蛋白。
1.3.2 氧化模型及多酚干预模型的建立
参照焦铭[7]的方法建立分组如下:空白组(arachin,ARA):取1.5 g LA于容量瓶中,加入1 mL 5 mol/L NaOH溶液,再加入0.2 mol/L,pH 9.0的硼酸缓冲液10 mL及2滴吐温-60,摇匀后将0.05 mg/mL的花生球蛋白溶液与LA以体积比85∶15充分混合,孵育6 h,再冰浴20 min,冻干为ARA组;氧化组(oxidative group,OX):0.05 mg/mL花生球蛋白溶液与LA溶液按体积比85∶15充分混合后,加入5 000 U/mL LOX溶液,同等条件下孵育、冰浴、冷冻干燥为OX组;多酚组:分别将9种浓度为10 μmol/mL的多酚溶液与0.05 mg/mL的花生球蛋白溶液按照体积比1∶1混合后,按OX的操作制备复合物样品。
1.3.3 羰基含量的测定
参照HUANG等[11]的方法,取1 mL蛋白液,加入3 mL 10 mol/L DNPH溶液,避光静置1 h,每10 min加入3 mL质量分数20%的三氯乙酸溶液,10 000 r/min离心20 min,用体积比1∶1的乙酸乙酯和乙醇混合液洗涤沉淀,再加入6 mL 6 mol/L的盐酸胍溶液,于37 ℃环境下水浴15 min,再5 000 r/min离心15 min,取上清液于370 nm处测定吸光值。羰基的分子吸光系数22 000 mol/cm。
1.3.4 游离氨基的测定
参照SUN等[12]的方法有所改动,取400 μL的待测液与3 mL OPA试剂,充分混合后室温下反应2 min,然后测量340 nm处的吸光度,在400 μL水中加入3 mL OPA试剂反应2 min作为空白。用L-亮氨酸制成的标准曲线计算。
1.3.5 内源荧光光谱的测定
参照SPONTON等[13]的方法,用0.01 mol/L PBS(pH 7.9)制备0.3 mg/mL的蛋白质溶液,并通过0.45 μm的水膜进行测量。荧光光谱激发波长为290 nm,扫描波长为300~400 nm,激发和发射狭缝宽度为5 nm,电压为500 mV。
1.3.6 表面疏水性的测定
参照YONGSAWATDIGUL等[14]用ANS荧光探针法测量蛋白质的表面疏水性。用0.01 mol/L PBS(pH 7.9)制备质量浓度为0.005、0.01、0.02、0.05、0.1、0.2、0.5 mg/mL的蛋白质溶液和8 mmol/L的ANS溶液,取20 μL ANS溶液加入到3 mL蛋白溶液中,充分混合,然后于470 nm处迅速测量荧光强度。以蛋白质质量浓度为横坐标、荧光强度为纵坐标作图,曲线的初始斜率即为蛋白样品的表面疏水性。
1.3.7 浊度的测定
参照WANG等[15]的方法将每个样品分别溶解于10 mmol/L、pH 7.0的PBS中,室温下振荡5 min后,在600 nm处记录吸光度值以表征浊度值。
1.4 统计分析
所有实验均进行3次平行实验,采用Excel、Origin 2021、IBM SPSS Statistics 26对数据进行处理、显著性分析(P<0.05)、方差分析和绘图。
2 结果与分析
2.1 多酚对花生球蛋白羰基的影响
羰基是广泛用于评价蛋白质氧化程度的指标之一。蛋白质发生氧化反应时,侧链部分氨基酸易被转化成羰基基团,从而导致蛋白质羰基含量的增加。如图1所示,与ARA相比,OX的羰基含量显著上升(P<0.05),说明LOX催化亚油酸氧化生成氢过氧化物及次级产物,从而促进了花生球蛋白的氧化生成羰基,这与赵婕[16]对LOX诱导大豆蛋白氧化的研究结果一致。与OX相比,9种多酚的添加均可降低花生球蛋白的羰基含量,其中H、G两种多酚的抑制效果最为显著(P<0.05),分别使羰基含量下降87.4%、90.2%,接近于ARA。氧化体系经多酚干预后羰基含量之所以降低,可能是由于多酚和LOX通过氢键作用形成稳定的复合物,抑制其对亚油酸的催化氧化,从而减少氢过氧化物及次级产物的形成,使氧化体系中羰基含量下降[17]。
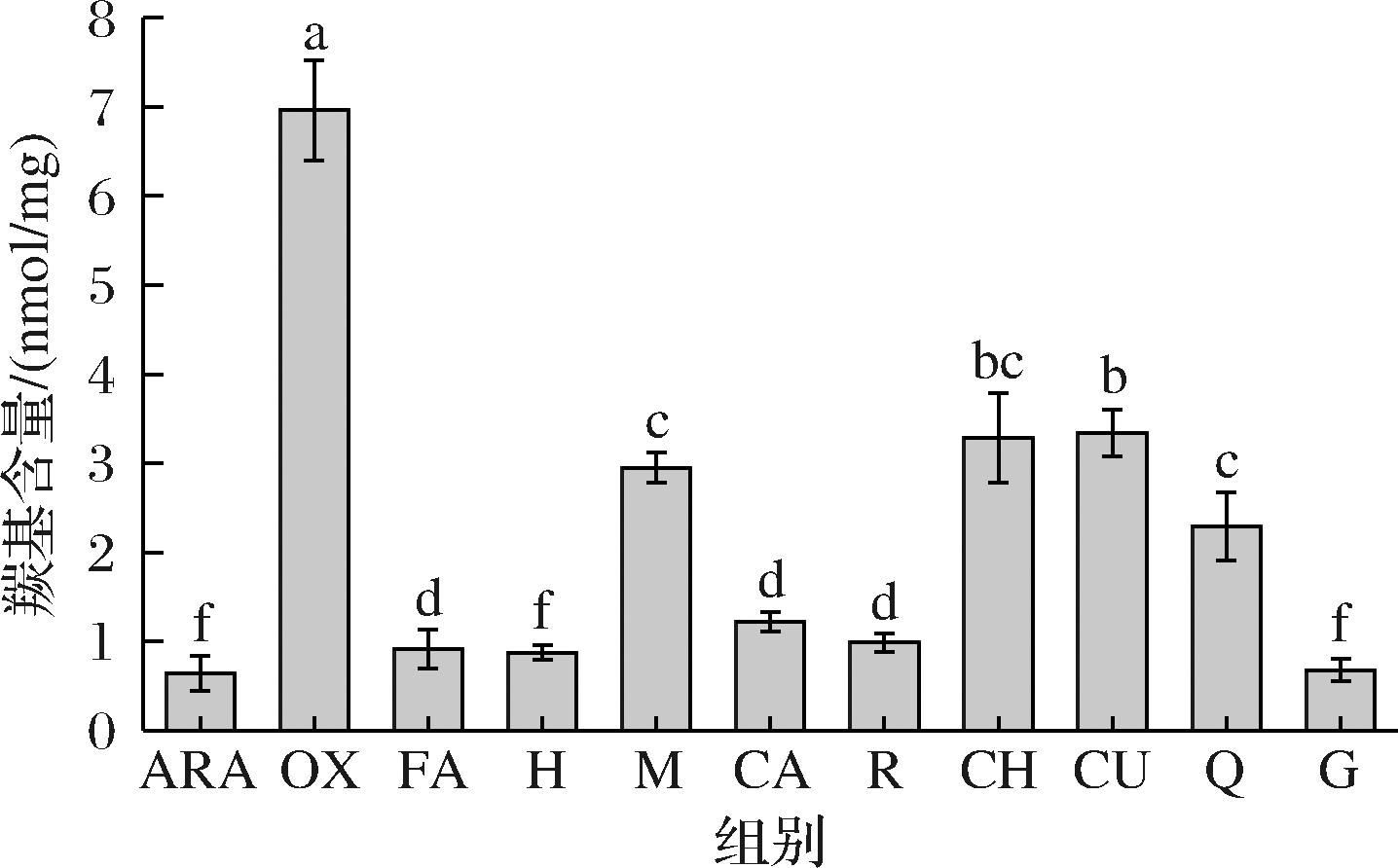
图1 多酚对LOX催化亚油酸氧化花生球蛋白羰基的影响
Fig.1 Effect of polyphenols on the carbonyl content of arachin oxidized by LOX-linoleic acid
注:不同小写英文字母表示差异显著(P<0.05)(下同)。
2.2 多酚对花生球蛋白游离氨基的影响
游离氨基的变化能一定程度上反映蛋白质结构的变化。如图2所示,相比ARA,OX的游离氨基含量显著下降,可能是因为花生球蛋白中含有—NH—或—NH2的氨基酸侧链参与了羰基的形成,这与羰基变化趋势相呼应(图1)。经9种多酚干预后,花生球蛋白的游离氨基呈不同程度的上升或下降趋势,其中M、CH上升最为明显,分别增大了0.092、0.119 nmol/mg[18]。而儿茶素使游离氨基下降最明显,可能是儿茶素在有氧条件下易氧化成醌,然后与花生球蛋白侧链发生共价作用形成C—S和C—N键[19]。不同种类的多酚对氧化体系中花生球蛋白的作用存在一定差异,从而影响其游离氨基的含量[20]。
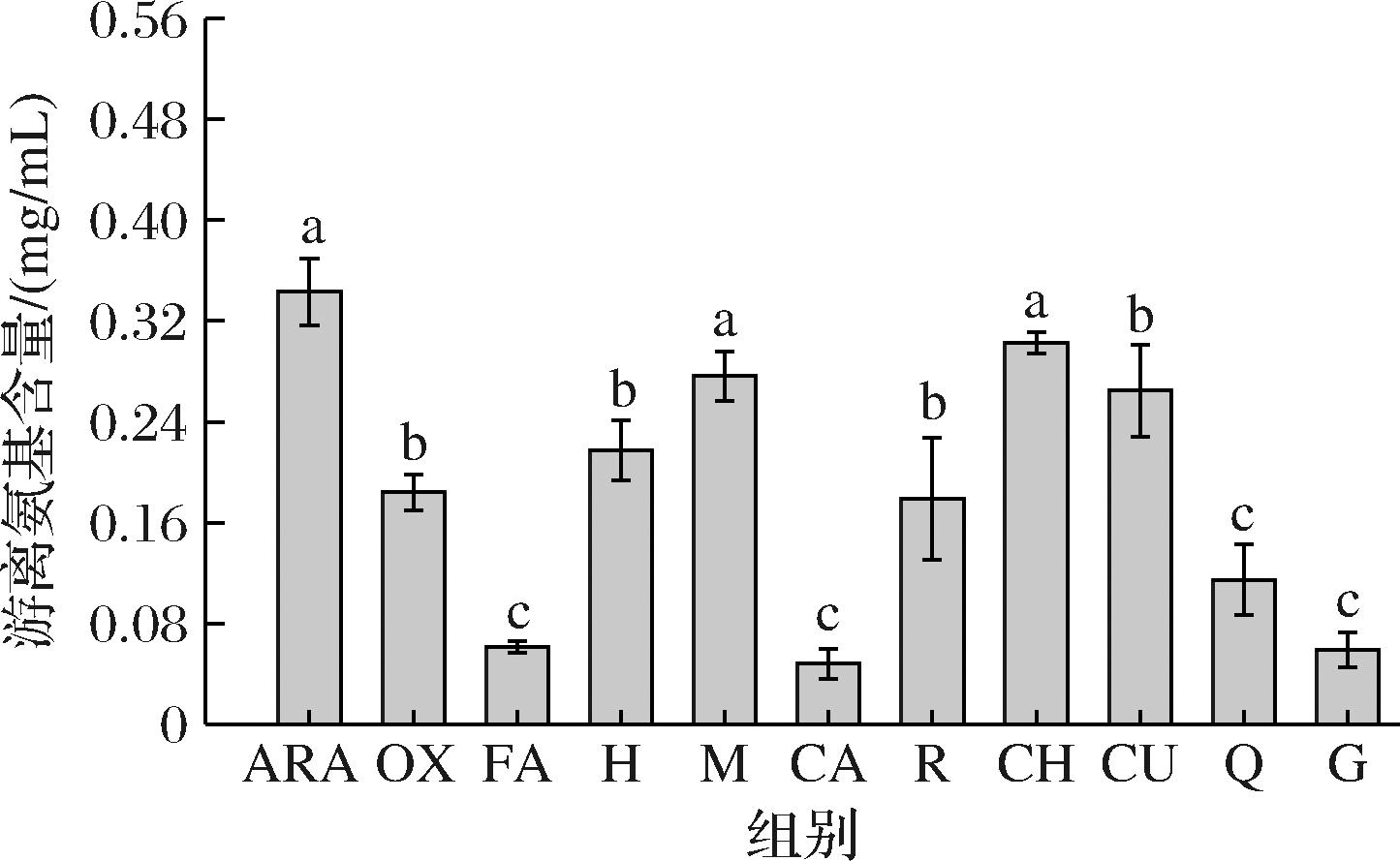
图2 多酚对LOX催化亚油酸氧化花生球蛋白游离氨基的影响
Fig.2 Effect of polyphenols on free amino groups of arachin oxidized by LOX-linoleic acid
2.3 多酚对花生球蛋白荧光光谱的影响
蛋白质在荧光光谱290 nm处强度可以一定程度上反映色氨酸残基的变化[21]。如图3所示,与ARA相比,OX的荧光强度降低且荧光峰位λmax显著红移,可能是花生球蛋白在LOX催化亚油酸氧化过程中,色氨酸残基逐渐暴露在外部环境中,被氧化为过氧自由基。经9种多酚干预后,相比OX荧光强度皆明显下降,其中CH的荧光强度最低,可能是多酚和花生球蛋白结合后,发生荧光猝灭所致[22]。多酚组的荧光峰位λmax皆显著蓝移,其中H和CH最为明显,可能是多酚的芳香环与花生球蛋白的色氨酸残基发生了共价交联和聚集[23]。荧光光谱的改变进一步证实了多酚的加入使花生球蛋白的结构发生变化。
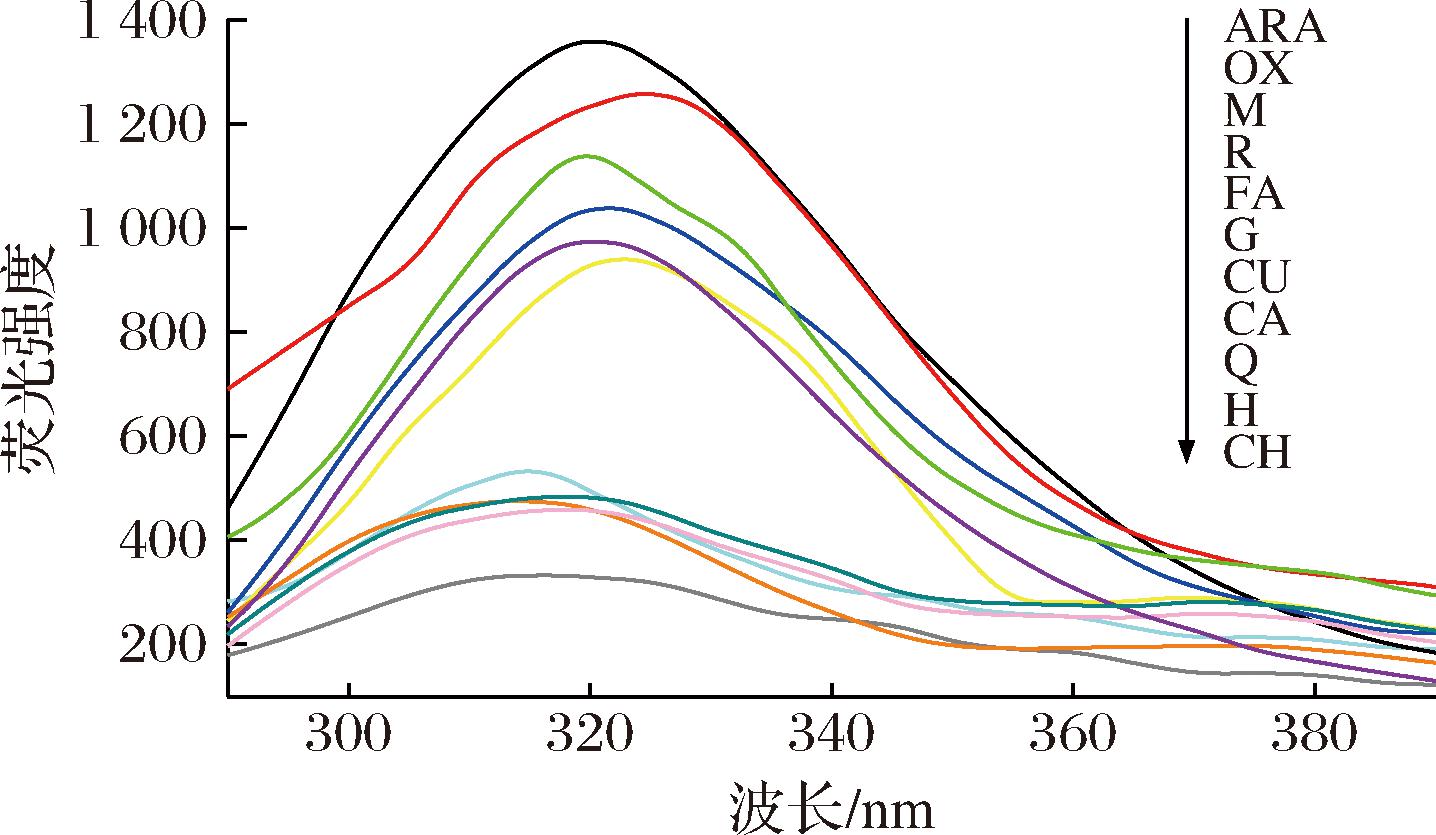
图3 多酚对LOX催化亚油酸氧化花生球蛋白内源荧光的影响
Fig.3 Effect of polyphenols on endogenous fluorescence of arachin oxidized by LOX-linoleic acid
2.4 多酚对花生球蛋白表面疏水性的影响
表面疏水性可反映暴露于蛋白质表面的疏水基团分布情况,并对蛋白质的性质有较大影响[24]。如图4所示,与ARA相比,OX的表面疏水性明显下降(P<0.05),可能是氧化使花生球蛋白的结构逐渐展开,并进一步在疏水作用和二硫键的作用下重新聚集,发生疏水坍塌[19],从而导致表面疏水性下降。经9种多酚干预后,花生球蛋白的表面疏水性有不同程度的上升或下降,其中CA使蛋白质表面疏水性有所上升,这可能是由于花生球蛋白的聚集体与多酚结合后解聚,内部疏水基团暴露,导致表面疏水性增加[25]。
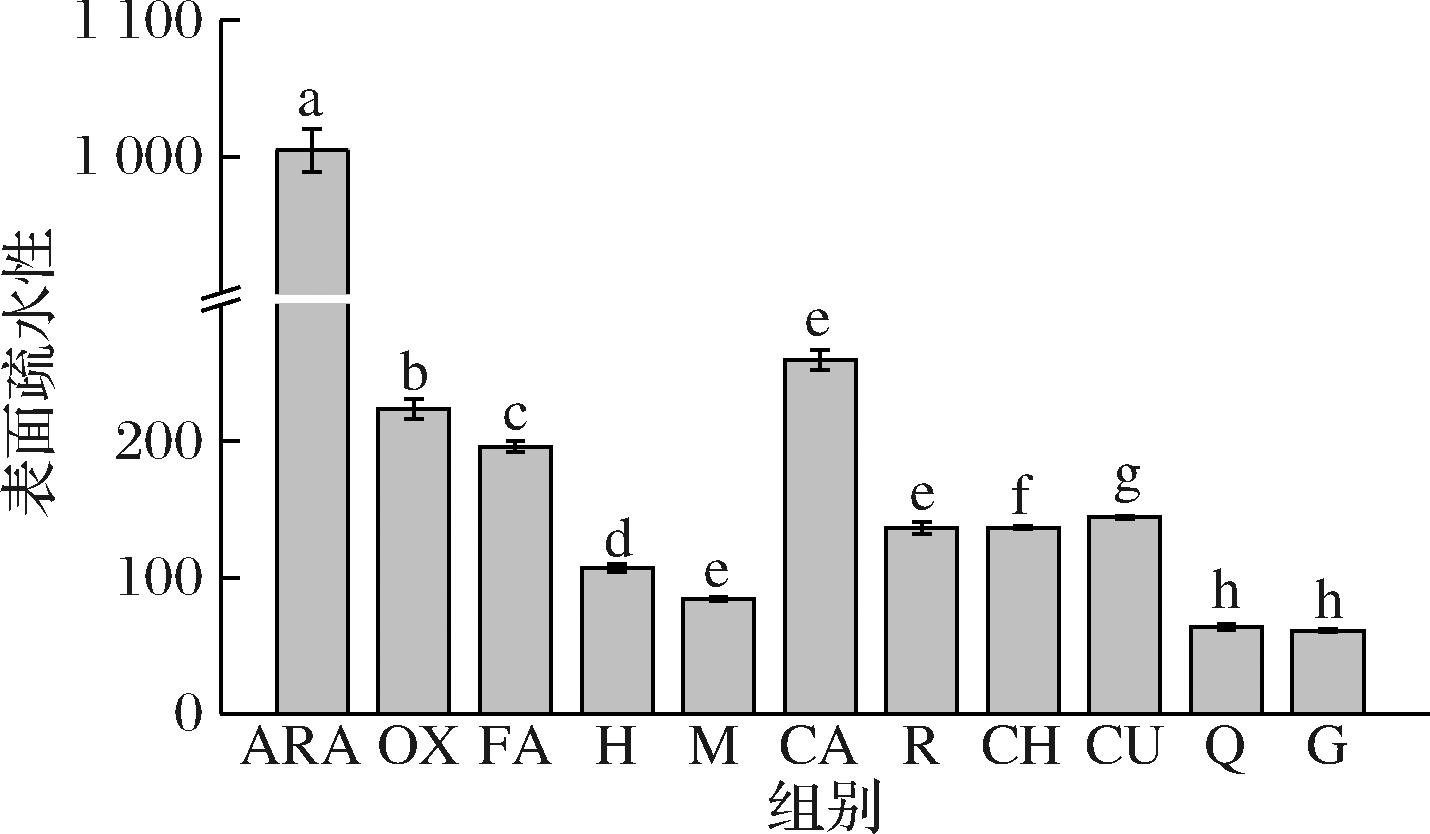
图4 多酚对LOX催化亚油酸氧化花生球蛋白表面疏水性的影响
Fig.4 Effect of polyphenols on the surface hydrophobicity of arachin oxidized by LOX-linoleic acid
2.5 多酚对花生球蛋白浊度的影响
浊度是衡量蛋白质聚集和结合程度的常用指标,一般情况下,蛋白质浊度值越高意味着蛋白聚集度越高[26]。如图5所示,与ARA相比,OX浊度略有上升,这表明LOX催化氧化会使体系中的大分子聚集体含量升高;而添加9种多酚之后,花生球蛋白的浊度值相比OX皆明显上升,其中M和H的升幅最大,这可能是由于花生球蛋白与多酚络合形成偶联物发生絮凝,导致其溶解度下降[25]。
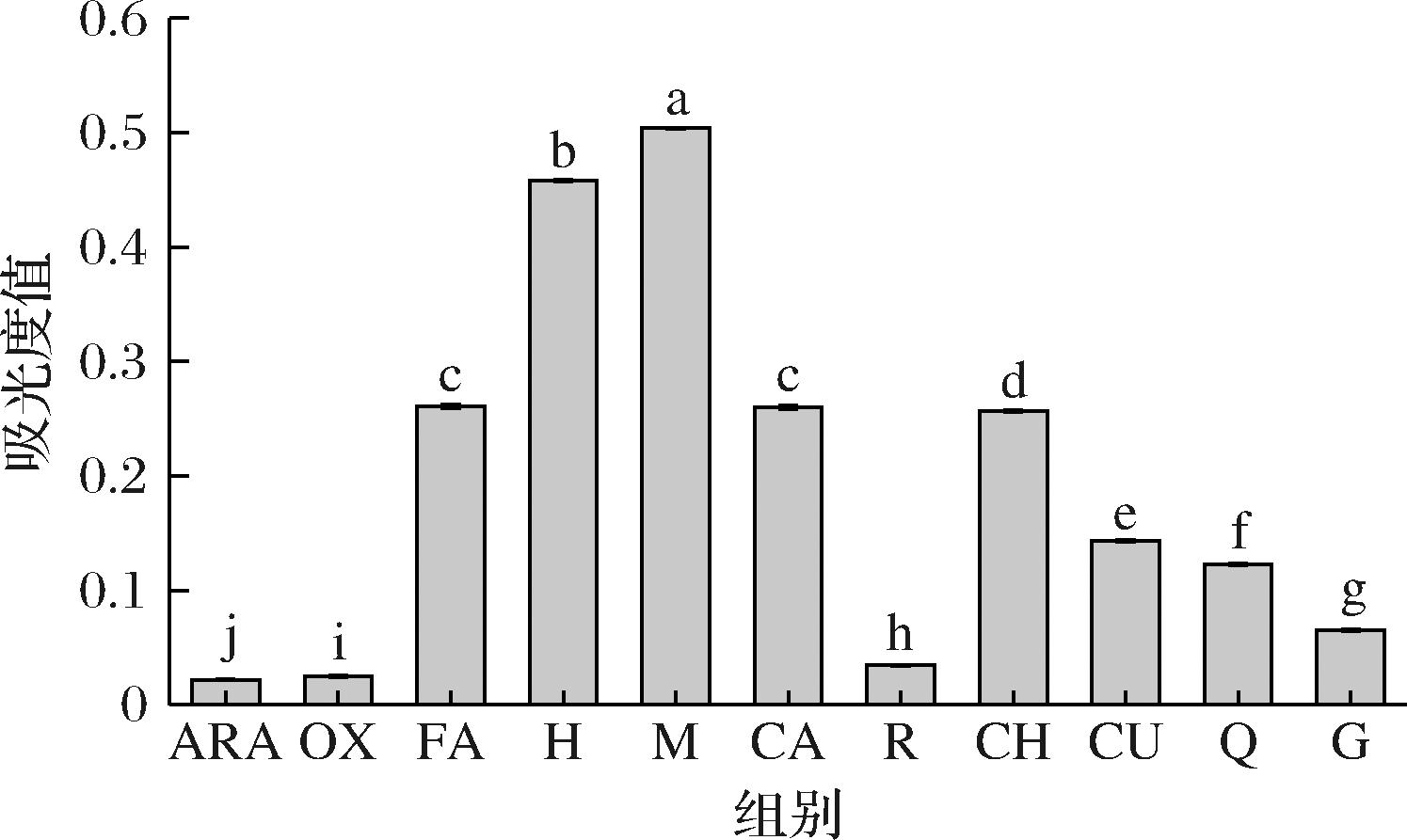
图5 多酚对LOX催化亚油酸氧化花生球蛋白浊度的影响
Fig.5 Effect of polyphenols on turbidity of arachin oxidized by LOX-linoleic acid
2.6 主成分分析
主成分分析常用于分析组间样本的整体分布趋势和不同组间样本的差异,样本在主成分分析图中与ARA越接近,则越相似。由图6-a可知,PC1的贡献率为43.1%,PC2的贡献率为38.0%,前2个主成分的累积贡献率达81.1%,表明前2个主成分能代表样本的变化。图6-b显示OX距ARA最远,说明花生球蛋白经LOX催化亚油酸氧化后结构和性质发生了明显变化,而经9种多酚干预后,各多酚组更靠近ARA,说明多酚干预可抑制花生球蛋白的氧化。这些多酚在主成分坐标图上可以分为3组,其中第1组(CH、H和R)与ARA最近,原因可能是CH、H、R结构中的特定官能团(如邻二酚羟基、酯键)使它们有效抑制LOX或清除自由基,因此蛋白氧化程度低,更接近ARA,说明这3种多酚的干预对花生球蛋白的氧化抑制效果最好。干预效果次之的是CA、G和FA组,与OX最近的是CU、M和Q组。CA、G和FA虽然羟基较多,但其部分羟基结构发生甲基化或糖基化,导致其活性降低。对于CU、M和Q,由于其结构中的共轭体系或羟基取代位置,虽然本身抗氧化能力强,但在反应体系中溶解度低,或不能有效接触LOX,导致其干预氧化的效果最差。综上,主成分分析图的分布反映了多酚结构对其抗氧化机制(如清除自由基、抑制LOX活性),以及与蛋白结合保护等的综合影响,进一步说明多酚干预可在一定程度上降低花生球蛋白的氧化进程[27]。
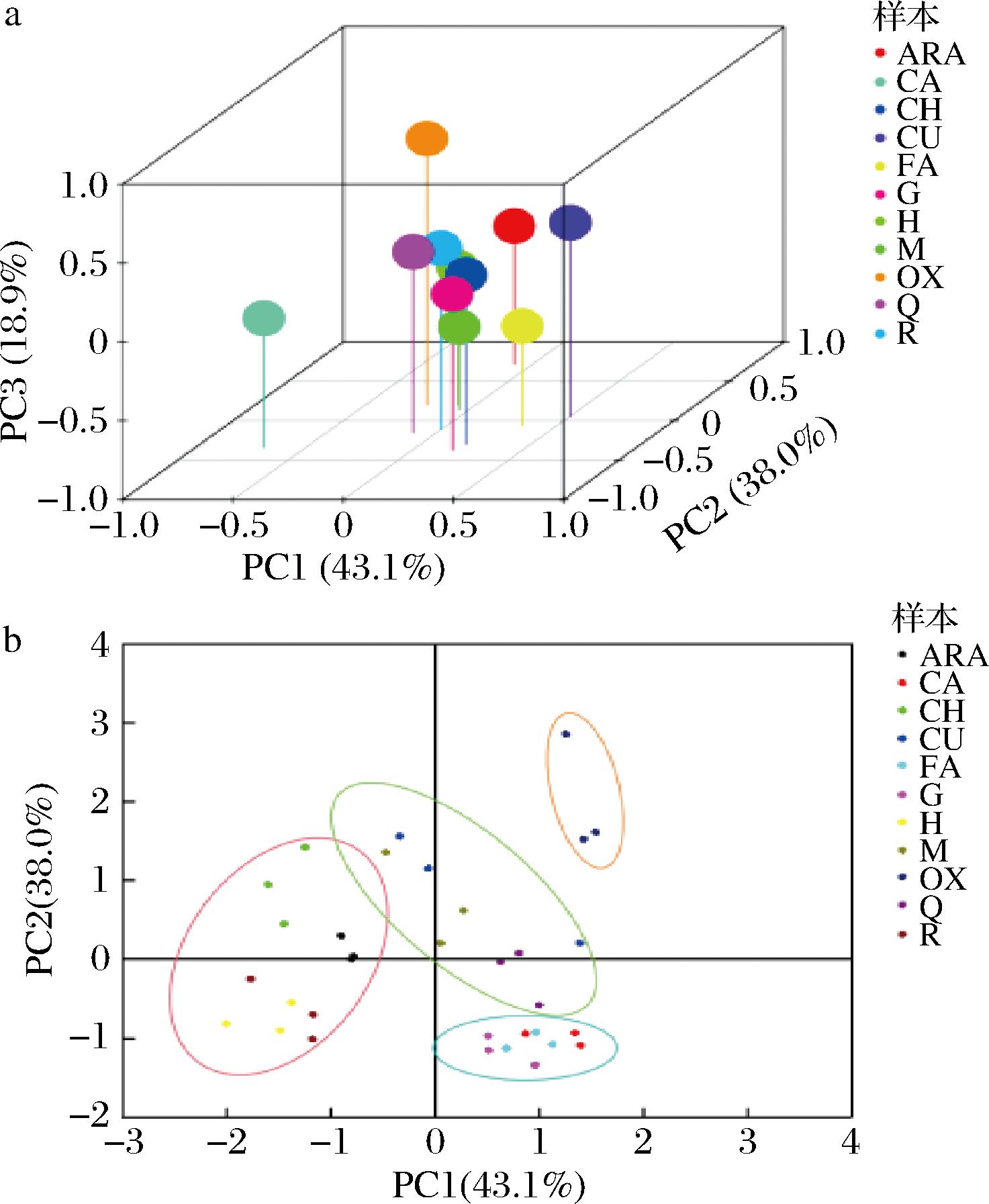
a-主成分分析三维图;b-主成分分析二维图
图6 主成分分析图
Fig.6 PCA plot
3 结论与讨论
本文通过建立LOX催化亚油酸诱导的花生球蛋白氧化模型,系统研究了9种常见多酚对花生球蛋白氧化的干预作用。研究结果表明,花生球蛋白经氧化后羰基含量和浊度增高,氨基含量和表面疏水性降低,荧光强度降低且发生红移。多酚的干预可以显著改善氧化对花生球蛋白的羰基、内源荧光和浊度的影响,且不同多酚的干预趋势基本上是一致的,即多酚可使氧化蛋白的羰基含量下降,荧光强度降低且发生蓝移;浊度因发生络合而增大,氨基含量和表面疏水性不同程度地上升或下降。从主成分分析来看,CH、H和R干预后的氧化花生球蛋白在所测定指标上最接近ARA,这与李实等[28]的研究结果一致。原因可能是从结构上来看,CH、H和R含有邻苯二酚、酯键或双酚酸结构,其中邻苯二酚结构可通过螯合LOX活性中心的Fe2+直接抑制LOX活性,酯键则可能通过空间位阻阻碍亚油酸底物与LOX结合,双酚酸结构可稳定花生球蛋白β-折叠构象,减少LOX催化的蛋白氧化位点暴露,从而显著降低羰基含量降低蛋白质氧化程度,使蛋白性质更接近ARA;CA、G和FA虽羟基较多,但其结构上的羟基甲基化或高极性导致其活性降低,使其对蛋白氧化干预作用受限。对于CU、M和Q,虽然它们本身具备抗氧化能力,但受限于自氧化倾向或羟基分散分布等原因,导致其抗氧化效果较弱。对花生球蛋白的各测定指标进行关联性分析,结果表明,羰基含量与游离氨基含量呈负相关,表面疏水性与浊度呈正相关,说明多酚干预可通过调控疏水基团暴露从而抑制蛋白聚集。
上述结果表明,多酚干预蛋白质氧化的能力与其分子结构密切相关,其中邻苯二酚和疏水基团可能是抑制LOX及保护蛋白的关键基团,而多酚羟基上的甲氧基或共轭体系则可能削弱或干扰其活性。未来可利用分子对接明确多酚与LOX活性中心的结合模式,以解析多酚-LOX互作机制;开发多酚复配体系,通过协同效应提升其抗蛋白质氧化的效率;结合纳米包埋技术解决多酚溶解性与风味兼容性问题,进而提高多酚在花生乳、蛋白粉等加工中的应用;进一步利用体外消化和体内动物实验,以评估多酚干预后氧化蛋白的消化率变化及安全性。
综上,论文初步阐明了常见多酚对LOX诱导的亚油酸-花生球蛋白氧化体系的干预作用,为多酚等天然抗氧化剂在食品贮藏和加工中的应用及植物蛋白高值化利用提供了理论依据。
[1] 朱浩嘉.花生蛋白高抗氧化肽制备及其理化性质分析[D].长春:吉林农业大学,2020.ZHU H J,Preparation and physicochemical properties of high antioxidant peptides derived from peanut protein[D].Changchun:Jilin Agricultural University,2020.
[2] 李滢溪,张丽芬,赖少娟,等.花生蛋白稳定乳液研究进展及应用现状[J].食品研究与开发,2022,43(11):198-204.LI Y X,ZHANG L F,LAI S J,et al.Research progress and application status of peanut protein-based emulsions[J].Food Research and Development,2022,43(11):198-204.
[3] 崔颢凡,郭芹,李振源,等.花生蛋白组成与结构对其功能特性的影响[J].中国食品学报,2024,24(10):449-459.CUI H F,GUO Q,LI Z Y,et al.Effects of peanut protein composition and structure on its functional properties[J].Journal of Chinese Institute of Food Science and Technology,2024,24(10):449-459.
[4] 何婷,赵谋明,崔春.脂肪氧合酶的酶学特性及其活性抑制机理的研究进展[J].食品工业科技,2008,29(2):291-293;298.HE T,ZHAO M M,CUI C.Study on enzymatic properties and inhibition mechanism of lipoxygenase[J].Science and Technology of Food Industry,2008,29(2):291-293;298.
[5] FENG R F,ZHANG H J,DING N,et al.Effect of lipoxygenase-catalyzed linoleic acid oxidation and 4-hydroxy-2-nonenal on digestibility and gel properties of myofibrillar protein[J].Food Bioscience,2024,61:104882.
[6] 彭珠妮.脂质与蛋白质氧化对水煮牛肉陈腐味和质构特性的影响[D].南京:南京农业大学,2018.PENG Z N.Effect of lipid and protein oxidation on warm-over flavor and texture characteristic of braised beef[D].Nanjing:Nanjing Agricultural University,2018..
[7] 焦铭.儿茶素干预脂肪氧合酶催化亚油酸诱导大豆伴球蛋白氧化的作用机理研究[D].广州:华南理工大学,2018.JIAO M.Study on the mechanism of catechin intervention in lipoxygenase-catalyzed linoleic acid-induced soybean conglycinin oxidation[D].Guangzhou:South China University of Technology,2018.
[8] POOJARY M M,HELLWIG M,HENLE T,et al.Covalent bonding between polyphenols and proteins:Synthesis of caffeic acid-cysteine and chlorogenic acid-cysteine adducts and their quantification in dairy beverages[J].Food Chemistry,2023,403:134406.
[9] 赵谋明,焦铭,林恋竹,等.含邻苯二酚结构的植物多酚对脂肪氧合酶的抑制作用[J].中国食品学报,2020,20(6):57-64.ZHAO M M,JIAO M,LIN L Z,et al.Inhibitory effects of plant polyphenol with a catechol structure on the lipoxygenase[J].Journal of Chinese Institute of Food Science and Technology,2020,20(6):57-64.
[10] 张雪春,茹月蓉,程群,等.八种多酚与核桃蛋白相互作用的研究[J].食品与发酵工业,2022,48(12):97-104.ZHANG X C,RU Y R,CHENG Q,et al.Studies of interaction between eight polyphenols and walnut protein[J].Food and Fermentation Industries,2022,48(12):97-104.
[11] HUANG Y R,HUA Y F,QIU A Y.Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation[J].Food Research International,2006,39(2):240-249.
[12] SUN Q X,KONG B H,LIU S C,et al.Ultrasonic freezing reduces protein oxidation and myofibrillar gel quality loss of common carp (Cyprinus carpio) during long-time frozen storage[J].Foods,2021,10(3):629.
[13] SPONTON O E,PEREZ A A,CARRARA C,et al.Effect of limited enzymatic hydrolysis on linoleic acid binding properties of β-lactoglobulin[J].Food Chemistry,2014,146:577-582.
[14] YONGSAWATDIGUL J,SINSUWAN S.Aggregation and conformational changes of tilapia actomyosin as affected by calcium ion during setting[J].Food Hydrocolloids,2007,21(3):359-367.
[15] WANG Y H,WAN Z L,YANG X Q,et al.Colloidal complexation of zein hydrolysate with tannic acid:Constructing peptides-based nanoemulsions for Alga oil delivery[J].Food Hydrocolloids,2016,54:40-48.
[16] 赵婕.脂肪氧合酶催化亚油酸氧化对大豆分离蛋白体外胃消化影响机制研究[D].广州:华南理工大学,2021.ZHAO J.Study on the mechanism of linoleic acid oxidation catalyzed by lipoxygenase on gastric digestion of soybean protein isolate in vitro[D].Guangzhou:South China University of Technology,2021.
[17] XU Z R,DU H Y,MANYANDE A,et al.A comprehensive investigation on the interaction between jaceosidin,baicalein and lipoxygenase:Multi-spectroscopic analysis and computational study[J].Spectrochimica Acta Part A:Molecular and Biomolecular Spectroscopy,2024,304:123423.
[18] KEPPLER J K,SCHWARZ K,VAN DER GOOT A J.Covalent modification of food proteins by plant-based ingredients (polyphenols and organosulphur compounds):A commonplace reaction with novel utilization potential[J].Trends in Food Science &Technology,2020,101:38-49.
[19] ZHANG X Y,HUANG Y Y,MA R X,et al.Structural properties and antioxidant activities of soybean protein hydrolysates produced by Lactobacillus delbrueckii subsp.bulgaricus cell envelope proteinase[J].Food Chemistry,2023,410:135392.
[20] 王一郎,邹智芸,王以澄,等.不同种类植物多酚对冷藏牦牛肉糜肌原纤维蛋白氧化特性、功能特性及结构的影响[J].食品与发酵工业,2024,50(17):246-254.WANG Y L,ZOU Z Y,WANG Y C,et al.Effects of different plant polyphenols on MP oxidation characteristics,functional characteristics and structure of refrigerated yak mince[J].Food and Fermentation Industries,2024,50(17):246-254.
[21] 杨曦,程群,刘江,等.脂质自由基诱导氧化对花生蛋白功能特性的影响[J].食品与发酵工业,2020,46(10):87-91.YANG X,CHENG Q,LIU J,et al.Effect of lipid free radical-mediated oxidation on the functional properties of peanut proteins[J].Food and Fermentation Industries,2020,46(10):87-91.
[22] XU J H,HAO M H,SUN Q F,et al.Comparative studies of interaction of β-lactoglobulin with three polyphenols[J].International Journal of Biological Macromolecules,2019,136:804-812.
[23] SIMAT T,STEINHART H.Oxidation of free tryptophan and tryptophan residues in peptides and proteins[J].Journal of Agricultural and Food Chemistry,1998,46(2):490-498.
[24] JIA J J,GAO X,HAO M H,et al.Comparison of binding interaction between β-lactoglobulin and three common polyphenols using multi-spectroscopy and modeling methods[J].Food Chemistry,2017,228:143-151.
[25] DAI S C,LIAO P L,WANG Y L,et al.Soy protein isolate-catechin non-covalent and covalent complexes:Focus on structure,aggregation,stability and in vitro digestion characteristics[J].Food Hydrocolloids,2023,135:108108.
[26] YANG Y X,WANG Q M,LEI L,et al.Molecular interaction of soybean glycinin and β-conglycinin with (-)-epigallocatechin gallate induced by pH changes[J].Food Hydrocolloids,2020,108:106010.
[27] 蒋丙婷,郭言,尹可宏,等.4种多酚对丙二醛诱导花生球蛋白氧化的改善作用[J].中国粮油学报,2024,39(6):111-117.JIANG B T,GUO Y,YIN K H,et al.Ameliorating effect of 4 polyphenols against malondialdehyde-induced oxidation of arachin[J].Journal of the Chinese Cereals and Oils Association,2024,39(6):111-117.
[28] 李实,李云嵌,黄鑫,等.多酚对过氧自由基氧化花生球蛋白的干预效应[J].中国油脂,2023,48(8):104-109.LI S,LI Y Q,HUANG X,et al.Intervention effect of polyphenols on oxidation of arachin by peroxyl radicals[J].China Oils and Fats,2023,48(8):104-109.