作为人体第二大丰富的微量营养元素,锌对维持机体正常生理功能和健康状态至关重要。人体内锌一般可以作为各种酶的激活剂以及锌依赖蛋白的结构调节剂,并调节人体生长发育和正常生理功能[1]。全球范围内,锌元素的缺乏是一个普遍存在的问题,尤其是在发展中国家或地区。据统计,目前全球高达17%的人口面临锌摄入不足的风险,主要是由于日常饮食结构不平衡以及自身身体素质差导致的,缺锌人群主要包括贫困地区人群、素食者、老年人、孕妇或哺乳期妇女[2]。锌的缺乏可造成不同程度的健康危害,包括精神疾病、免疫紊乱、生理问题等;同时在不同生命阶段或不同性别人群中,锌缺乏也会引起从轻微脱发到病理性死亡等症状[3]。因此,适当补充锌对维持身体健康和预防相关疾病至关重要。然而人体不能自主合成微量元素锌,必须从日常膳食或补剂中获取,尤其当正常饮食无法满足需求时,其他补锌途径就变得更加重要。随着人们健康意识的提高,补锌产品的市场需求持续增长,因此,开发新型补锌功能性产品成为满足居民健康需求的重要途径。
锌补充剂有很多种类,其发展大致经历了3个阶段。第1代补充剂为无机锌盐(如ZnSO4、醋酸锌等),第2代为有机锌盐(如葡萄糖酸锌、乳酸锌等)。与这两代补充剂相比,新型螯合锌补充剂表现出更好的安全性、稳定性和高效性,具有更低的毒性并且在肠道中的吸收效果更好[4]。其中,多糖锌螯合物因其丰富的生物活性而受到广泛关注。多糖本身具有丰富的功能性基团(如羟基、羧基以及氨基等),能够与金属离子形成稳定的螯合物。通过化学合成法,研究者已成功制备出一系列具有独特功能的多糖锌螯合物。例如,山药多糖锌表现出抗糖尿病活性[5],浒苔多糖锌具有抗炎效果[6],而香菇多糖锌则显示出显著的体外抗氧化活性[7]。化学合成法不仅操作简便,且能够实现较高的锌离子螯合率。此外,该方法还可以选择不同来源的多糖作为原料,从而为锌多糖螯合物的多样化及相关研究领域的拓展提供广泛的可能性[8]。
从虎奶菇(Pleurotus tuber-regium,PTR)菌核中提取的超支化β-葡聚糖(P. tuber-regium hyperbranched β-glucan,PTR-HBG)是一种具有独特结构的大分子,主要由β-1,4-D-Glcp主链和β-1,6-D-Glcp支链构成,在O-6位形成分支(分支度63%~70%)[9]。PTR-HBG具有丰富的末端羟基和独特的三维球状构象,且在水溶液中表现出良好的单分散性[10],因此是理想的天然聚合物载体。LI等[11]利用PTR-HBG开发了具有良好生物相容性和稳定性的蘑菇β-葡聚糖涂层金纳米棒(mushroom β-glucan coated gold nanorods,AuNR-Glu),这种金纳米棒在癌症光热治疗中表现出色,显示了PTR-HBG作为聚合物载体的巨大潜力。此外,PTR-HBG还展现出多种生物活性,如降血糖、降血脂、抗肿瘤和增强免疫力等[12],使其在食品和营养保健领域具有广阔的应用前景。然而,尽管PTR-HBG具有诸多优点,目前基于此类超支化β-葡聚糖制备多糖锌螯合物的研究还鲜有报道。
因此,本研究以PTR-HBG为主要材料,采用简单的化学合成方法制备虎奶菇超支化β-葡聚糖-锌螯合体系(P. tuber-regium hyperbranched β-glucane-Zn,PTR-HBG-Zn),并探讨其作为新型锌补充剂的潜力。以螯合物中的锌含量为主要指标,通过单因素试验优化合成条件,进一步使用傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)、X-射线衍射(X-ray diffraction,XRD)、冷场发射扫描电子显微镜(field emission scanning electron microscopy,FESEM)和热重分析(thermal gravimetric analyzer,TGA)对最优合成条件下得到的PTR-HBG-Zn进行表征。同时,对凝胶化PTR-HBG-Zn的流变性能进行分析。在此基础上,通过体外模拟胃肠道消化对ZnSO4、葡萄糖酸锌和PTR-HBG-Zn的消化情况进行对比。研究结果不仅可为新型锌补充剂的开发提供理论基础和数据支持,也能为PTR-HBG的应用提供更多的可能性。
1 材料与方法
1.1 材料与试剂
NaOH(≥96%)、ZnSO4·7H2O(≥99%)、硼酸(H3BO3,≥99%)、KCl(≥99.5%),上海国药集团化学试剂有限公司;葡萄糖酸锌(98%)、锌试剂(≥85%)与模拟肠液,上海麦克林生化科技有限公司;人工胃液,上海源叶生物科技有限公司。
1.2 仪器与设备
VF20P4 Vivaflow 200系列100 kDa超滤膜,德国Sartorius公司;HWS28水浴锅,上海一恒科学仪器有限公司;SPARK TECAN酶标仪,上海科技集团有限公司;FreeZone®冻干机,美国LAΒCONCO公司;DAWN HELEOS 8+多角度激光散射凝胶排阻色谱系统,美国怀雅特技术公司;ZEN3700纳米粒度及Zeta电位分析仪,英国马尔文仪器有限公司;日立SU8100冷场发射扫描电子显微镜,日本株式会社日立高新技术;NEXUS傅里叶变换红外光谱分析仪,美国尼高力仪器公司;D8 X-射线衍射仪,德国布鲁克AXS有限公司;梅特勒TGA2全自动热重分析仪,瑞士梅特勒-托利多公司;MCR302旋转流变仪,奥地利安东帕公司。
1.3 实验方法
1.3.1 PTR-HBG的提取
根据CHEN等[10]建立的方法,使用1 mol/L NaOH溶液从虎奶菇菌核细胞壁中提取粗多糖,然后通过截留分子质量为100 kDa的超滤膜进行纯化,冷冻干燥后得到PTR-HBG。
1.3.2 PTR-HBG-Zn的制备
采用ZnSO4法制备PTR-HBG-Zn。将一定浓度的多糖溶液与ZnSO4溶液等体积混合,调节溶液pH,置于一定温度的水浴锅中恒温反应一定时间,反应完毕后于4 ℃放置48 h,10 000 ×g离心10 min,并加去离子水混匀洗涤,直到上清液中没有游离锌离子的存在,真空冷冻干燥得PTR-HBG-Zn粉末备用。
为确定反应产物中是否有残留的ZnSO4,将清洗后的PTR-HBG-Zn螯合物凝胶溶于1 mol/L NaOH溶液,超声处理1 h后在装有去离子水的烧杯中透析24 h,透析结束后取1 mL透析液滴加过量0.1 moL/L BaCl2溶液以检验凝胶网络中硫酸根的存在。
1.3.2.1 反应时间对锌含量的影响
将1 mL 0.25 mol/L ZnSO4溶液与等体积20 mg/mL多糖溶液混匀,调pH值至6,在40 ℃孵育不同时间(0.5、1、1.5、2、2.5、3 h)后,取出于4 ℃冰箱静置48 h,洗涤离心,沉淀冻干后测定锌含量。
1.3.2.2 反应pH对锌含量的影响
将1 mL 0.25 mol/L ZnSO4溶液与等体积20 mg/mL多糖溶液混匀,调节不同pH(3.5、4、4.5、5、5.5、6),在40 ℃孵育2 h后,取出于4 ℃冰箱静置48 h,洗涤离心,沉淀冻干后测定锌含量。
1.3.2.3 ZnSO4添加量对锌含量的影响
将1 mL不同初始浓度(0.1、0.15、0.2、0.25、0.3、0.35、0.4 mol/L)的ZnSO4溶液加入等体积的20 mg/mL多糖溶液中,pH值调至6,在40 ℃孵育2 h后,取出于4 ℃冰箱静置48 h,洗涤离心,沉淀冻干后测定锌含量。
1.3.2.4 反应温度对锌含量的影响
将1 mL 0.35 mol/L ZnSO4溶液加入1 mL 20 mg/mL多糖溶液中,pH值调至6,在不同温度(20、30、40、50、60、70 ℃)条件下孵育2 h后,取出于4 ℃冰箱静置48 h,洗涤离心,沉淀冻干后测定锌含量。
1.3.3 锌含量的测定
1.3.3.1 锌标准曲线绘制
参考杨秀峰[13]的方法测定锌的浓度,并稍作修改。依次吸取0.00、0.125、0.25、0.375、0.50、0.75 mL Zn2+标准溶液(0.044 g/L)置于10 mL离心管中,然后加入3 mL新配制的pH为8.8~9.0的硼酸-氯化钾缓冲液与250 μL新配制的锌试剂溶液(4 g/L),并用去离子水补齐至5 mL后摇匀,使锌离子质量浓度分别为0.00、0.25、0.50、0.75、1、1.5 mg/L,放置30 min,于620 nm 波长处测定吸光度。以5 mL体系中锌离子浓度(X,mg/L)为横坐标,吸光度(Y)为纵坐标,绘制标准曲线。测得标准曲线方程为Y=0.020 79X+0.074 3,R2=0.999 6。
1.3.3.2 PTR-HBG-Zn螯合物中锌含量测定
取样品溶于2 mL 0.1 mol/L HCl溶液中,90 ℃水浴加热1 h。加入2 mol/L NaOH溶液调节pH至中性,定容至10 mL,取稀释液至10 mL离心管中,加入3 mL硼酸-氯化钾缓冲液,250 μL锌试剂,加去离子水补齐至5 mL,混匀放置30 min后于620 nm处测吸光度代入标准曲线中,得5 mL体系中锌离子浓度C,按公式(1)计算螯合物中锌含量:
锌含量![]()
(1)
式中:ρ,5 mL体系中锌离子质量浓度,mg/L;m0,称取多糖锌质量,mg;V,在5 mL体系中待测样品溶液体积,mL。
1.3.4 PTR-HBG-Zn的结构与性质分析
1.3.4.1 分子质量及粒度、电位测定
分别采用多角度激光光散射凝胶色谱系统和纳米粒度及Zeta电位分析仪对样品重均分子量(Mw)和样品粒径(nm)、多分散指数(polydispersity index,PDI)以及Zeta电位(mV)等分子参数进行检测。
1.3.4.2 FTIR分析
取一定量的冻干样品置于玛瑙研钵中,与KBr混合后研磨并压成薄片,测定其红外光谱。扫描范围为4 000~400 cm-1。
1.3.4.3 XRD分析
通过X-射线衍射确定样品的结晶度等信息,取适量冻干样品平铺在玻璃样品台上,测试角度为5°~60°,扫描速率为5°/min。
1.3.4.4 FESEM分析
将冻干后得到的样品固定到导电胶上,吹去多余粉末,在真空喷镀仪内喷上金膜,观察并拍摄待测样品在300及3 000放大倍数下的表面形态图。
1.3.4.5 TGA
精确称取5 mg样品于Al2O3坩埚中,以N2作为样品的保护气体,加热速率10°/min,采集30~600 ℃的热失重数据。
1.3.4.6 流变性能分析
使用旋转流变仪测定样品的流变性能,在0.1~100 s-1的剪切速率内,对反应得到的凝胶样品进行稳态剪切试验。振荡扫描试验在0.1~100 rad/s的角频率内进行,应变为1%。
1.3.5 体外模拟胃肠道消化
模拟胃液消化阶段:将样品溶液(3 mg/mL)和人工胃液分别在37 ℃水浴锅中预热15 min,取5 mL样品溶液和等体积的人工胃液混合,并将pH值调节至2.5,在37 ℃,150 r/min条件下模拟消化2 h,并分别在0、30、60、90、120 min时取1 mL消化液10 000×g离心10 min,取上清液测定锌离子浓度(C0)。
模拟肠液消化阶段:先将人工小肠液在37 ℃水浴锅中预热15 min,胃部消化阶段结束后立即用0.1 mol/L NaOH溶液将消化物pH值调节至7.0,然后向5 mL消化物中加入5 mL预热人工小肠液,在37 ℃,150 r/min条件下模拟消化2 h,并分别在0、30、60、90、120 min时取1 mL消化液10 000 ×g离心10 min,取上清液测定锌离子浓度(C0)。
锌离子浓度测定采用紫外分光光度法(如1.3.3节)。分别取胃液和肠液消化不同时间的上清液,稀释一定倍数,测定其游离锌离子浓度。锌离子的溶解率按公式(2)计算:
溶解率![]()
(2)
式中:ρ0,模拟消化不同时间10 mL体系上清液中游离锌离子质量浓度,mg/L;ρ1,各模拟阶段反应起始时10 mL体系中样品锌离子质量浓度,mg/L。
1.4 统计分析
使用SPSS 28.0软件进行单因素方差分析,然后进行Tukey检验,显著性水平为P<0.05。使用Origin 2024绘制图表。
2 结果与分析
2.1 PTR-HBG-Zn的制备
从图1-a可以看出,在同一温度条件下随着反应时间的推移,PTR-HBG-Zn中锌含量在一定范围内浮动,在反应2 h时达到最大值(33.9±1.17)mg/g。当反应时间大于2 h时,螯合物中锌含量随着时间的延长略有下降,这可能是由于随着反应时间的延长,稳定性有所下降,部分螯合物出现了解离[14]。总的来说,反应时间对螯合物中的锌含量影响并不显著,故选择螯合物中锌含量最大时的反应时间(2 h)作为后续反应条件。
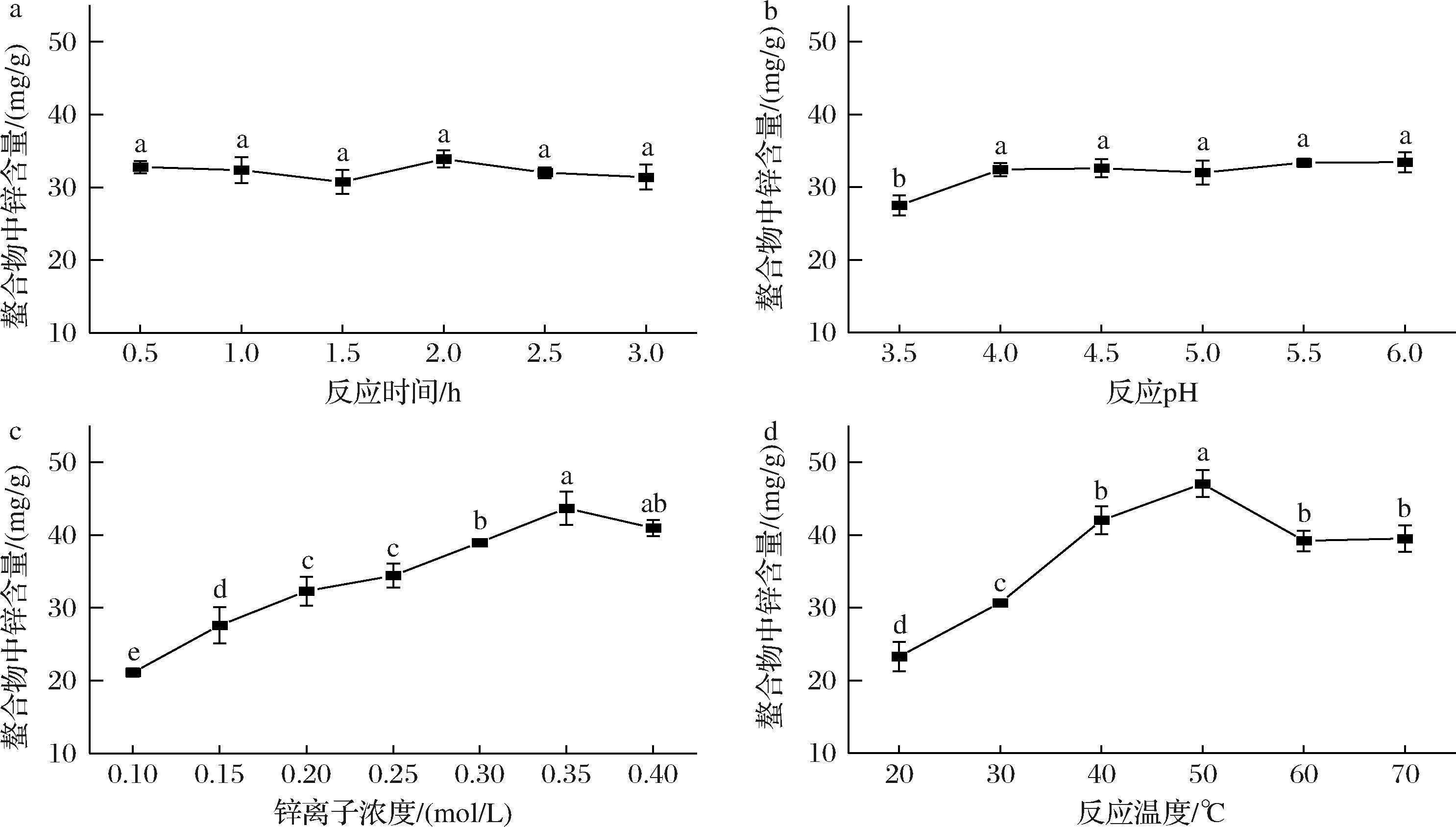
a-反应时间;b-反应pH;c-锌离子浓度;d-反应温度
图1 各因素对PTR-HBG-Zn螯合物中锌含量的影响
Fig.1 Influence of various reaction factors on the zinc content in PTR-HBG-Zn chelates
注:不同小写字母表示差异显著(P<0.05)(下同)。
如图1-b所示,当反应体系pH值从3.5增大到4时,螯合物中锌含量显著提升,这是由于pH过低时,反应体系中过多的H+会与Zn2+争夺有限的供电子基团,从而不利于螯合物的生成[15]。而后随着pH继续增加,螯合物中的锌含量趋于稳定,当反应体系pH值为6时,螯合物中锌含量达到最大值(33.43±1.38)mg/g。随着pH的进一步提高(pH≥7),体系中开始生成Zn(OH)2沉淀,沉淀的产生不利于PTR-HBG-Zn凝胶的形成以及与PTR-HBG-Zn的分离。由于PTR-HBG溶液在与ZnSO4溶液混匀后的pH值更接近于6,故选择pH = 6作为后续反应条件。
加入不同浓度的锌离子(0.1、0.15、0.2、0.25、0.3、0.35、0.4 mol/L,对应终浓度为0.05、0.075、0.1、0.125、0.15、0.175、0.2 mol/L)对PTR-HBG-Zn螯合物中锌含量的影响如图1-c所示,随着加入锌离子浓度的增加,螯合物中锌含量逐步提升,当加入锌离子浓度为0.35 mol/L时,锌含量达到最高值(43.67±2.27)mg/g;之后锌离子浓度的进一步提升则会导致PTR-HBG-Zn中的锌含量降低。这可能是由于当ZnSO4的浓度较低时,多糖中的活性基团(如—OH)与Zn2+结合的机会较少,结合率较低;而当ZnSO4的添加量继续增加过了一定值后,由于Zn2+浓度过大反而会导致其与多糖之间的静电作用增强,也会导致多糖配位基团与Zn2+的接触机会减少,从而导致结合率下降[16]。
由图1-d可知,随着反应体系温度从20 ℃逐渐升高到50 ℃,PTR-HBG对锌离子的螯合作用得到了显著的提升,并在50 ℃时锌含量达到最大值(47.06±1.85)mg/g,这是由于温度的提升,不仅更容易达到反应所需要的活化能,又增大了多糖与锌离子的碰撞频率,同时升温有助于糖链的打开从而提供更多与锌结合的部位,这些都有利于螯合物的生成[14]。随着反应温度的进一步升高,螯合物中锌含量显著降低,这与螯合是一个放热的过程有关,温度继续升高不利于放热反应的进行。
综合上述结果,选择加入锌离子浓度0.35 mol/L,在反应体系温度为50 ℃、pH值为6时反应2 h为既定最优反应条件并进行后续的实验。
2.2 PTR-HBG-Zn的物化性质
2.2.1 分子质量及粒径、电位
PTR-HBG及其锌螯合物的分子质量、粒径和电位等分子参数如表1所示。与Zn螯合后,PTR-HBG的Mw从3 113 kDa增加到6 293 kDa,同时,PTR-HBG-Zn也具有比PTR-HBG更大的粒径(84.85±0.56) nm和更集中的粒径分布(PDI=0.397),这表明金属离子的存在促进了多糖分子之间的交联[17]。此外,颗粒的表面电荷状态通常以Zeta电位为特征,它在锌螯合中起重要作用。PTR-HBG在结合锌离子后其Zeta电位绝对值从17.8 mV下降到10.6 mV,显示出PTR-HBG在螯合锌离子后稳定性有所下降且颗粒更容易发生聚集,这与多糖分子表面电荷的减少,从而导致颗粒之间的排斥力减弱有关[18]。
表1 PTR-HBG和PTR-HBG-Zn螯合物的分子质量及其粒径、PDI和Zeta电位
Table 1 The molecular weight,particle size,PDI,and Zeta potential of PTR-HBG and PTR-HBG-Zn chelates
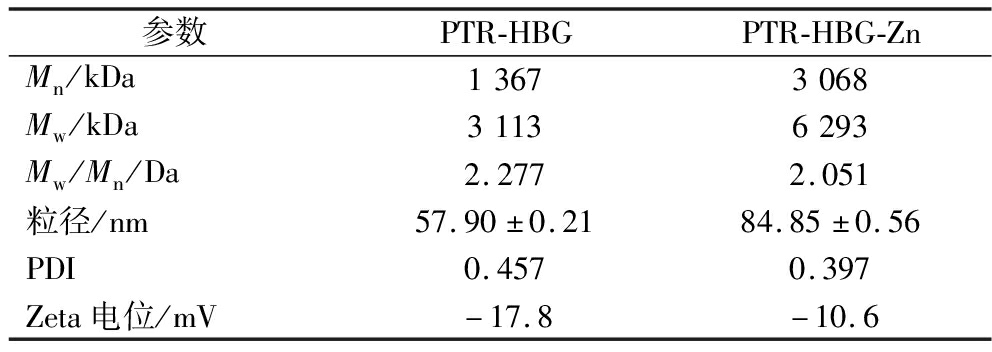
参数PTR-HBGPTR-HBG-ZnMn/kDa13673068Mw/kDa31136293Mw/Mn/Da2.2772.051粒径/nm57.90±0.2184.85±0.56PDI0.4570.397Zeta电位/mV-17.8-10.6
2.2.2 官能团分析
如图2所示,PTR-HBG和PTR-HBG-Zn具有典型的多糖红外峰:其中3 410 cm-1附近的强而宽的特征峰对应于多糖中丰富O—H的伸缩振动、2 890 cm-1左右的特征峰对应于C—H的伸缩振动、而在约1 635 cm-1处的峰与多糖中结合水的弯曲振动模式有关、1 000~1 100 cm-1的吸收峰是典型的吡喃糖环C—O—H及C—O—C的特征峰、以及900 cm-1左右是β-葡聚糖苷键的典型吸收峰。相较于PTR-HBG,PTR-HBG-Zn在417 cm-1附近出现了新的弱峰,这归因于Zn—O之间的相互作用[19]。同时PTR-HBG-Zn的O—H特征峰相对于PTR-HBG朝更高波数移动且波峰变宽,这进一步表明多糖上的羟基可能与锌离子发生了配位[20]。除此之外,其他的特征峰均发生了不同程度的红移,表明这些特征峰所对应的官能团振动频率降低,这可能是由于分子发生聚集或聚合,聚集体中的分子间作用力导致了红移现象的产生,PTR-HBG-Zn分子质量和粒径的增大可能也与这一现象的产生有关。
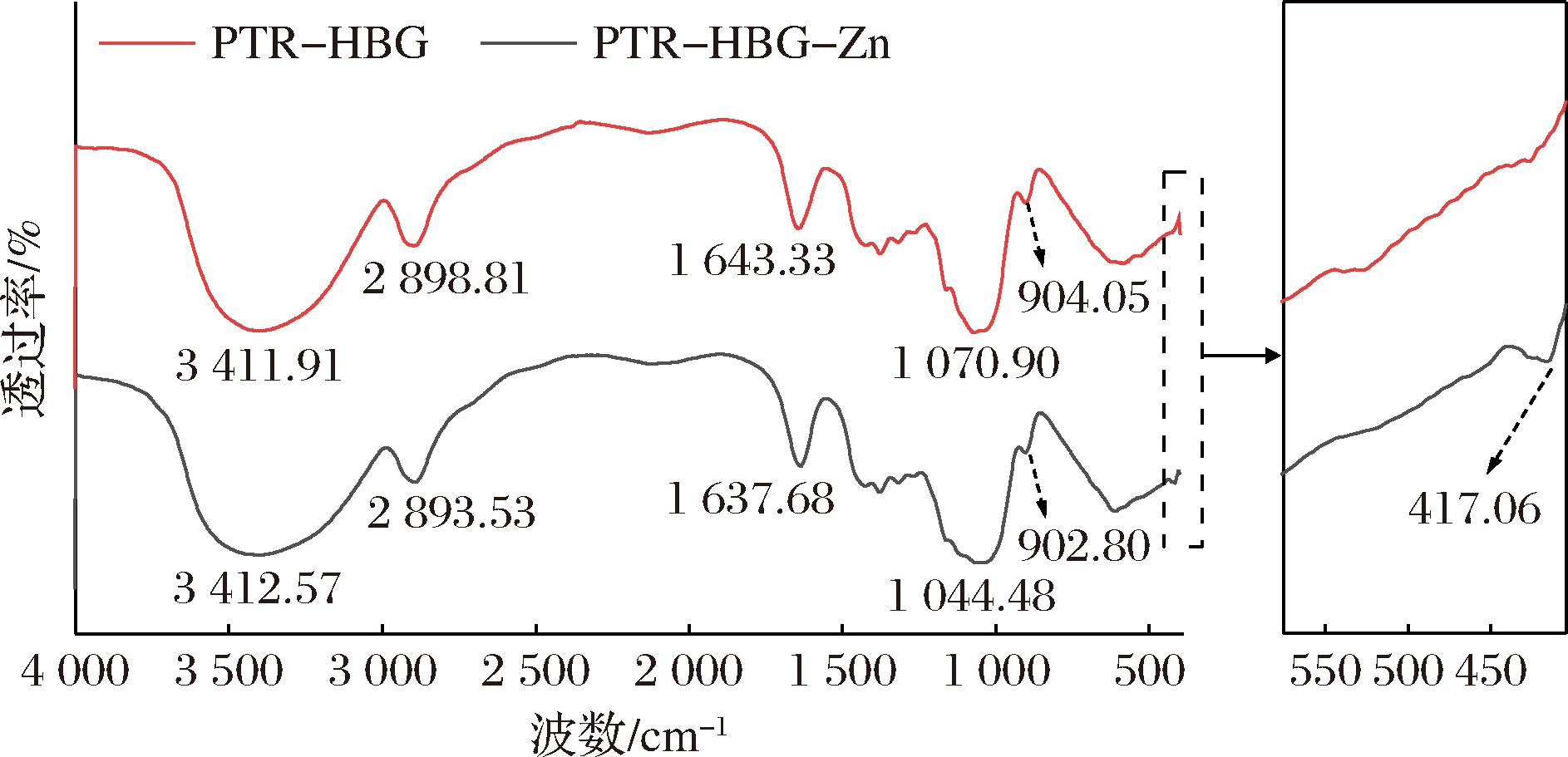
图2 PTR-HBG和PTR-HBG-Zn的傅里叶变换红外光谱图
Fig.2 Fourier transform infrared spectrum of PTR-HBG and PTR-HBG-Zn
2.2.3 晶体结构分析
根据XRD曲线衍射峰的位置与强度可判断样品的结晶或无定型性质(图3),在20°附近的宽衍射峰表明PTR-HBG为无定型形态。与锌螯合后,该衍射峰的强度并没有发生显著变化,谱图与PTR-HBG基本保持一致,表明锌离子的结合并没有改变原多糖的结晶度,这与ZHANG等[19]报道的贝母多糖-锌结晶度变化一致,这可能是由于多糖通常由成百上千个单糖通过糖苷键连接而成,化学结构复杂,锌的引入并不足以对多糖的结晶度产生太大的影响,所以多糖的无定型性质没有发生改变。
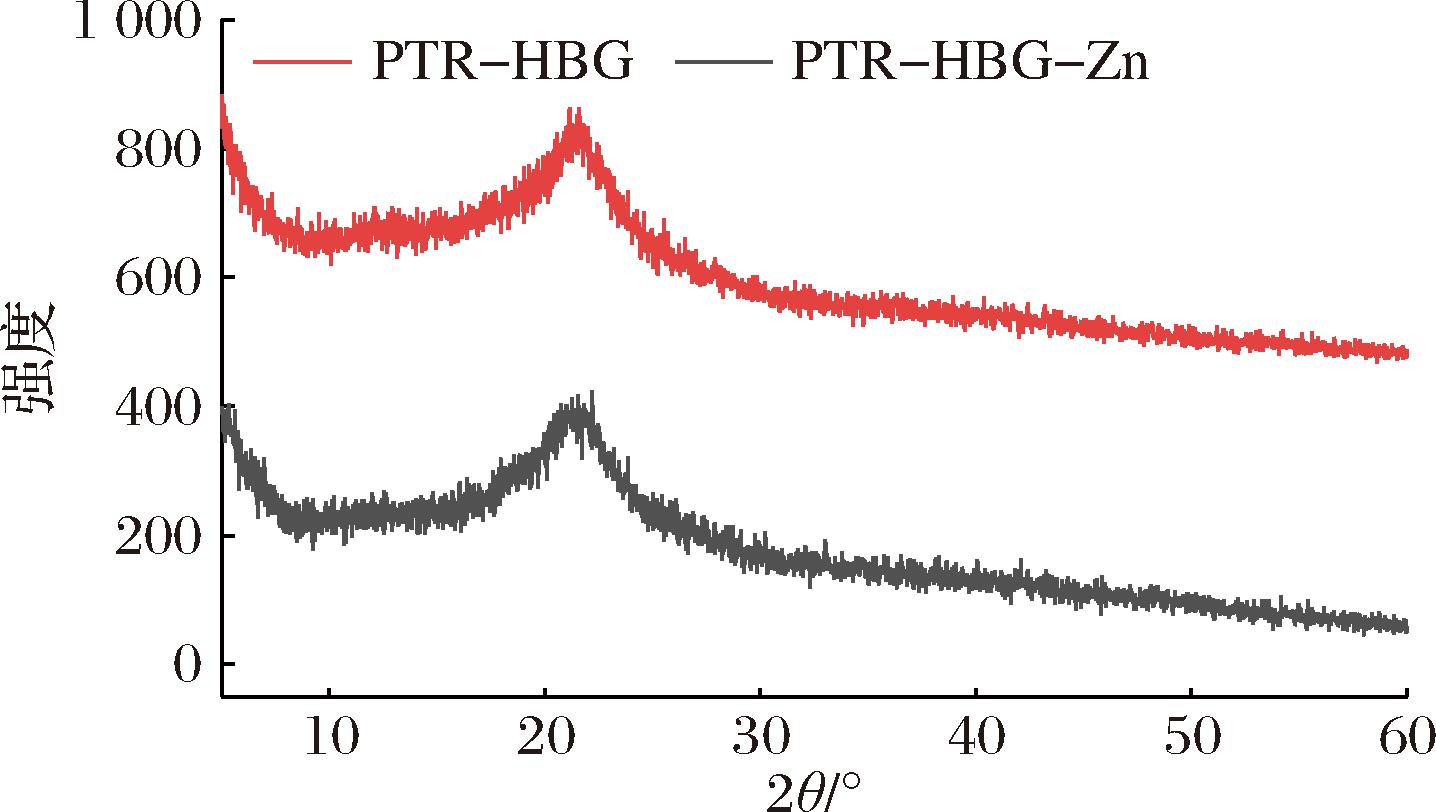
图3 PTR-HBG和PTR-HBG-Zn的X-射线衍射光谱图
Fig.3 X-ray diffraction spectrum of PTR-HBG and PTR-HBG-Zn
2.2.4 外观形貌分析
冷冻干燥后,PTR-HBG呈蓬松的白色絮状物(图4-a),而PTR-HBG-Zn为白色粉末(图4-d)。不同放大倍数下的FESEM图像提供了干燥多糖样品的微观形态特征,在放大300倍时观察到PTR-HBG表面呈现相对平滑、结构紧实的片状结构(图4-b),放大到3 000倍时仍可观察到片状结构的光滑表面(图4-c)。相比之下,在300倍下观察到PTR-HBG-Zn螯合物的表面粗糙,结构松散,并伴有均匀的孔隙,呈现蜂窝状(图4-e),放大到3 000倍时可观察到呈棱角状的孔隙边缘(图4-f)。这些结果说明,锌离子与多糖螯合后,导致了多糖表面形态的变化,蜂窝状结构也表明了凝胶网络的形成。此外,表面形态的差异通常与多糖链构象的变化密切相关,锌的引入可能导致了多糖分子结构的松散[17]。

a-PTR-HBG冻干粉末;b-PTR-HBG 300倍;c-PTR-HBG 3 000倍;d-PTR-HBG-Zn冻干粉末;e-PTR-HBG-Zn 300倍;f-PTR-HBG-Zn 3 000倍
图4 PTR-HBG和PTR-HBG-Zn的冻干粉末图和冷场发射扫描电镜图
Fig.4 Freeze-dried powder images and FESEM images of PTR-HBG and PTR-HBG-Zn
2.2.5 热稳定性分析
PTR-HBG和PTR-HBG-Zn的热重分析曲线(thermogravimetric curve,TG)和差示热重分析曲线(differential thermogravimetric curve,DTG)如图5所示。TG曲线显示了PTR-HBG和PTR-HBG-Zn在分解温度范围内的质量损失率变化,DTG曲线显示了PTR-HBG和PTR-HBG-Zn在分解温度范围内质量损失速率的变化。在TG曲线中,2种样品的热分解均包含2个阶段:在60 ℃左右的第一阶段主要是由于聚合物中水分和挥发物的损失(PTR-HBG和PTR-HBG-Zn在此阶段的质量损失率分别为8.16%和9.53%),第二阶段主要是由于样品的化学键和基本结构的热降解,PTR-HBG和PTR-HBG-Zn质量损失率分别为82.76%和57.82%,PTR-HBG-Zn在该阶段表现出更小的质量损失率。同时通过DTG曲线可以观察到PTR-HBG表现为2个吸热峰(图5-b),而PTR-HBG-Zn表现为3个吸热峰,第3个吸热峰的出现可能是由于锌取代了多糖羟基上的氢原子,从而导致了PTR-HBG和PTR-HBG-Zn结构和组成上的差异所致[5],同时PTR-HBG和PTR-HBG-Zn皆在第2个吸热峰时达到最大分解速率分别为2.5%/℃和0.8%/℃,此时对应的分解温度分别为324 ℃和243 ℃,表明锌的结合可能导致了PTR-HBG-Zn的糖链比PTR-HBG更容易受热分解。但总的来说,相对于PTR-HBG,PTR-HBG-Zn的质量损失率以及质量损失速率均显著降低,这可能与耐高温ZnO的生成有关[21]。
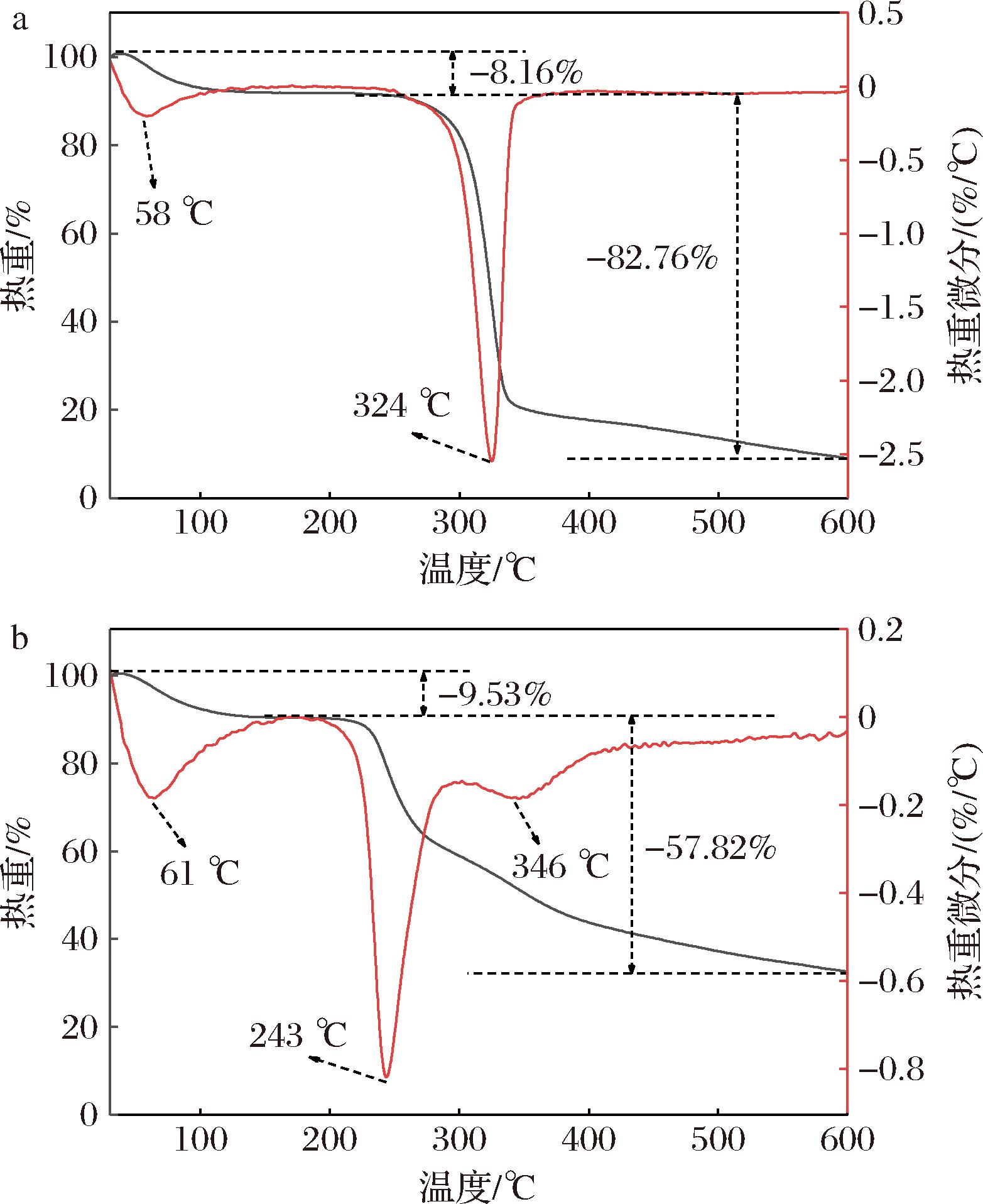
a-PTR-HBG;b-PTR-HBG-Zn
图5 PTR-HBG和PTR-HBG-Zn的热重分析
Fig.5 Thermogravimetric analysis of PTR-HBG and PTR-HBG-Zn
2.3 流变性能分析
与大部分其他多糖螯合锌补充剂不同的是,PTR-HBG在锌加入后会发生凝胶化。对凝胶化样品进行流变分析,结果表明,PTR-HBG-Zn随着剪切速率的增加表现出剪切稀化行为(图6-a),显著的剪切依赖性行为可归因于PTR-HBG-Zn中通过强的分子间和/或分子内相互作用而形成了交联网络[22]。由振幅扫描得到PTR-HBG-Zn的线性黏弹性区(0.1%~10%)(图6-b),选择应变为1%继续进行频率扫描,测试结果如图6-c所示。在测试的角频率范围内,当角频率逐渐增大时,PTR-HBG-Zn的储能模量G′始终大于损耗模量G″,并且在整个角频率范围内G′和G″之间没有交叉且保持平行,表现出弱凝胶行为,进一步表明了PTR-HBG-Zn中凝胶网络的形成[23]。凝胶的形成也提供了一种有别于其他多糖锌螯合物分离(如醇沉或透析)的途径。通过简单的清洗离心操作,即可实现对反应产物的分离以及未反应物的有效清除。这一过程不仅简化了操作步骤,还在一定程度上提高了多糖锌螯合物的制备效率。同时,该方法有助于减少乙醇等资源的消耗,从而更适合工业化生产的需求。此外,凝胶状的PTR-HBG-Zn可用于制备成如果冻、糖果等新型锌补充剂,既便于携带和食用,又能更好地满足现代快节奏生活中对补充剂便捷性的需求。
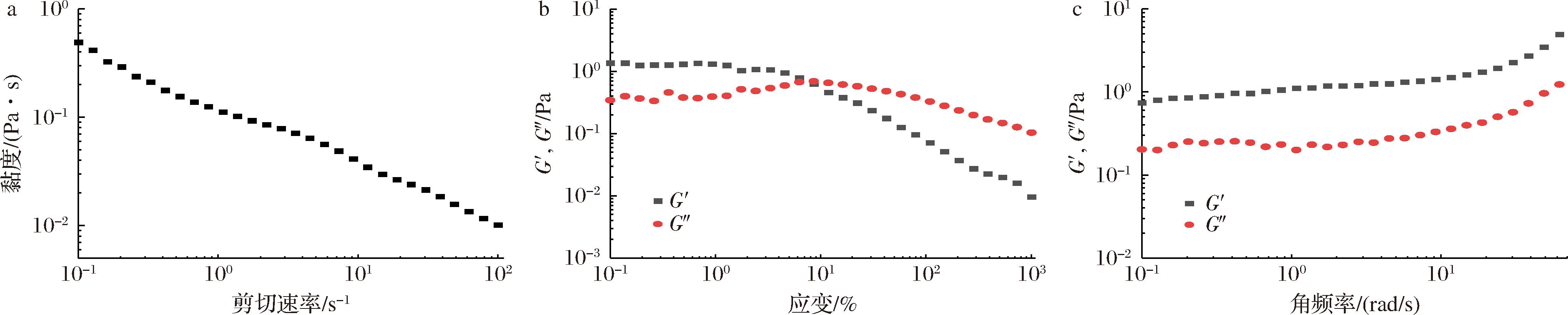
a-稳态剪切;b-振幅扫描;c-振荡扫描
图6 PTR-HBG-Zn的流变性能分析
Fig.6 Analysis of the rheological properties of PTR-HBG-Zn
2.4 体外模拟胃肠道消化
如图7所示,在整个胃消化阶段,PTR-HBG-Zn和葡萄糖酸锌的锌离子溶解率随时间的推移呈上升趋势(图7-a),而ZnSO4的锌离子溶解率较为稳定。PTR-HBG-Zn、ZnSO4以及葡萄糖酸锌中锌离子的溶解率在2 h后分别为(82.76±3.03)%、(89.21±1.04)% 和(83.42±0.76)%,均处于较高水平。总体结果表明,酸性环境有利于锌离子的溶解与释放。然而,在胃液酸性环境中,PTR-HBG-Zn和葡萄糖酸锌的锌溶解程度均显著低于ZnSO4,推测这是由于有机锌与螯合锌通过配位键结合,具有一定的抗胃液消化特性[15]。

a-模拟胃液消化;b-模拟肠液消化
图7 模拟胃肠消化对不同补锌剂溶解率的影响
Fig.7 Effects of simulated gastrointestinal digestion on the solubility of different zinc supplements
进入肠道消化阶段后,3个样品的锌离子溶解率均出现显著下降(图7-b)。PTR-HBG-Zn的溶解率在肠道中消化2 h后下降到(8.39±0.25)%,而ZnSO4以及葡萄糖酸锌的溶解率分别降至(1.98±0.20)%和(2.76±0.38)%。随着消化时间的延长,三者的溶解率均较为稳定。锌离子溶解率的显著下降可归因于弱碱性肠道环境中,释放出的Zn2+易与(OH-)反应生成Zn(OH)2等沉淀,阻碍了游离锌离子的存在。然而,尽管锌离子在肠道中溶解率普遍下降,PTR-HBG-Zn和葡萄糖酸锌的锌离子溶解率均高于ZnSO4,其中PTR-HBG-Zn的锌离子溶解率又显著高于葡萄糖酸锌。这一结果表明,螯合物中的锌在多糖的保护下,能够有效减少锌沉淀的生成,这对提高肠道内锌的生物利用度具有重要意义。锌沉淀的减少有助于提高锌在肠上皮细胞的吸收率[24]。因此,PTR-HBG-Zn在胃肠道中的稳定性和生物利用度优于ZnSO4和葡萄糖酸锌,具有作为新型锌补充剂的潜力。
3 结论
本研究通过单因素试验分析了不同反应条件对PTR-HBG-Zn的影响,确定了当反应时间2 h、pH 6、锌离子浓度0.35 mol/L、温度50 ℃时,产物PTR-HBG-Zn的锌含量为(47.06±1.85)mg/g,展现出较高的锌负载能力。结构表征显示,锌与多糖羟基配位,使PTR-HBG结构和形貌改变,但无定型形态未变。锌的加入使PTR-HBG发生凝胶化,流变测试证实了凝胶的形成。体外消化模拟实验表明,PTR-HBG-Zn在模拟肠液中的锌离子溶解率为(8.39±0.25)%,显著高于ZnSO4的(1.98±0.20)%和葡萄糖酸锌的(2.76±0.38)%,有助于提高锌的生物利用率,展现出作为锌补充剂的潜力。综上所述,PTR-HBG-Zn具有开发为新型锌补充剂的前景,未来需要通过更多动物和临床研究进一步验证其效果。
[1] GIBSON R S.Zinc deficiency and human health:Etiology,health consequences,and future solutions[J].Plant and Soil,2012,361(1-2):291-299.
[2] HAASE H,MOCCHEGIANI E,RINK L.Correlation between zinc status and immune function in the elderly[J].Biogerontology,2006,7(5-6):421-428.
[3] DUAN M P,LI T,LIU B,et al.Zinc nutrition and dietary zinc supplements[J].Critical Reviews in Food Science and Nutrition,2023,63(9):1277-1292.
[4] 史攀琪.小米糠多肽-锌螯合物的制备、结构表征与稳定性研究[D].太原:山西师范大学,2022.SHI P Q.Study on preparation,structure characterization and stability of millet bran derived peptide-zinc chelate[D].Taiyuan:Shanxi Normal University,2022.
[5] ZHANG Y,KHAN M Z H,YUAN T T,et al.Preparation and characterization of D.opposita Thunb polysaccharide-zinc inclusion complex and evaluation of anti-diabetic activities[J].International Journal of Biological Macromolecules,2019,121:1029-1036.
[6] FENG Y Y,WU Y Y,DUAN R,et al.Structural characterization and anti-inflammatory effects of Enteromorpha prolifera polysaccharide-Fe/Zn complexes[J].International Journal of Biological Macromolecules,2023,253:127166.
[7] 杜利月,赵新如,王飞.香菇多糖锌螯合物的制备及结构表征和体外抗氧化活性研究[J].食品安全质量检测学报,2023,14(4):290-298.DU L Y,ZHAO X R,WANG F.Preparation,structure characterization and in vitro antioxidant activity of lentinan-znic chelate[J].Journal of Food Safety &Quality,2023,14(4):290-298.
[8] 金鑫,孙雪琳,刘虹拴,等.蛹虫草提取物改善糖尿病肾病的药效及代谢组学[J].生物加工过程,2025,23(1):77-85.JIN X,SUN X L,LIU H S,et al.Pharmacodynamic and metabolomic studies of Cordyceps militaris extract in improving diabetic nephropathy[J].Chinese Journal of Bioprocess Engineering,2025,23(1):77-85.
[9] CHEN L,GE M D,ZHU Y J,et al.Structure,bioactivity and applications of natural hyperbranched polysaccharides[J].Carbohydrate Polymers,2019,223:115076.
[10] CHEN L,XU W W,LIN S L,et al.Cell wall structure of mushroom Sclerotium (Pleurotus Tuber Regium):Part 1.Fractionation and characterization of soluble cell wall polysaccharides[J].Food Hydrocolloids,2014,36:189-195.
[11] LI X J,ZHOU J J,LIU C R,et al.Stable and biocompatible mushroom β-glucan modified gold nanorods for cancer photothermal therapy[J].Journal of Agricultural and Food Chemistry,2017,65(43):9529-9536.
[12] TIMM T G,COSTA T M,ALBERTON M D,et al.Mushroom β-glucans:Application and innovation for food industry and immunotherapy[J].Applied Microbiology and Biotechnology,2023,107(16):5035-5049.
[13] 杨秀峰.玛咖多糖的提取及其金属复合物的制备、表征和生物活性研究[D].昆明:云南师范大学,2021.YANG X F.Extraction of polysaccharide from Maca and study on the preparation,and characterization and bioactivity of Maca polysaccharide metal complex[D].Kunming:Yunnan Normal University,2021.
[14] 董淑君,张禧庆,刘旭龙,等.南瓜皮多糖锌的制备及生物利用率研究[J].食品工业科技,2022,43(18):200-207.DONG S J,ZHANG X Q,LIU X L,et al.Preparation and bioavailability of pumpkin skin polysaccharide-zinc complex[J].Science and Technology of Food Industry,2022,43(18):200-207.
[15] 富天昕.绿豆多肽锌螯合物的制备和结构鉴定及生物利用率研究[D].大庆:黑龙江八一农垦大学,2020.FU T X.Preparation,structure identification and bioavailability of mungbean polypeptide zinc chelate[D].Daqing:Heilongjiang Bayi Agricultural University,2020.
[16] 龙瑞阳.毛木耳多糖提取、结构及其锌复合物制备与生物活性研究[D].广州:广州大学,2023.LONG R Y.Extraction,structure,preparation and biological activity of polysaccharides from Auricularia polytricha and their zinc compounds[D].Guangzhou:Guangzhou University,2023.
[17] JIA Y N,LI N N,WANG Q R,et al.Effect of Fe (Ⅲ),Zn (Ⅱ),and Cr (Ⅲ) complexation on the physicochemical properties and bioactivities of corn silk polysaccharide[J].International Journal of Biological Macromolecules,2021,189:847-856.
[18] WANG B,XIAO S,CHEN X Y,et al.Structural characterisation,gastrointestinal digestion stability and transepithelial transport study of casein peptide-zinc chelate[J].International Journal of Food Science &Technology,2022,57(5):2770-2778.
[19] ZHANG M,ZHAO H,SHEN Y,et al.Preparation,characterization and antioxidant activity evaluation in vitro of Fritillaria ussuriensis polysaccharide-zinc complex[J].International Journal of Biological Macromolecules,2020,146:462-474.
[20] 张铭冉,薛天睿,吕彬斐,等.卵黄高磷蛋白磷酸肽-锌螯合物的制备及其结构表征[J].食品与发酵工业,2025,51(9):230-238.ZHANG M R,XUE T R,LYU B F,et al.Preparation and structural characterization of phosvtin phosphopeptide peptide-zinc chelation[J].Food and Fermentation Industries,2025,51(9):230-238.
[21] 涂玲飞,陈迎丽,李焱,等.白及多糖锌的结构表征及其抗氧化活性评价[J].食品与发酵工业,2024,50(17):218-225;245.TU L F,CHEN Y L,LI Y,et al.Structure characterization and antioxidant activity of Bletilla striata polysaccharide-zinc[J].Food and Fermentation Industries,2024,50(17):218-225;245.
[22] CAI W D,QIU W Y,DING Z C,et al.Conformational and rheological properties of a quaternary ammonium salt of curdlan[J].Food Chemistry,2019,280:130-138.
[23] WANG H L,KE L J,DING Y N,et al.Effect of calcium ions on rheological properties and structure of Lycium barbarum L.polysaccharide and its gelation mechanism[J].Food Hydrocolloids,2022,122:107079.
[24] 冷雨佳.大豆肽锌螯合物的制备、螯合机理及其生物活性研究[D].郑州:河南工业大学,2022.LENG Y J.Study on preparation,chelation mechanism and biological activity of soybean peptide zinc chelates[D].Zhengzhou:Henan University of Technology,2022.