酪氨酸酶属于多酚氧化酶的一种,广泛存在于动植物及微生物体内,在黑色素生物合成过程和酶促褐变中起到十分关键的限速作用[1-2]。哺乳动物的皮肤、毛发和眼睛颜色主要受体内酪氨酸酶调节的黑色素决定。在正常情况下,适量的黑色素能在体内积累,保护皮肤和DNA免受紫外线、有毒化学物质、环境毒物等各种有害物质侵害。但黑色素异常积累可能会导致黄褐斑生成、诱发黑色素瘤等皮肤病、还与神经退行性疾病如帕金森症和阿尔兹海默病等有关[3-4]。因此,抑制酪氨酸酶的活性是解决黑色素过度沉积的最有效途径之一。目前已知生物活性肽具有良好的酪氨酸酶抑制活性和较高的安全性和易吸收性,因此开发酪氨酸酶抑制肽具有广阔的应用前景。酪氨酸酶抑制肽来源广泛,包括哺乳动物的乳汁、农产品以及水产品等[5]。JU等[6]以罗非鱼鳞片为原料,通过酶解、柱层析和EDTA洗脱得到具有金属铜离子螯合能力的高纯度多肽,5 mg/mL时对酪氨酸酶的抑制率为59.73%。YU等[7]对螺旋藻进行酶解等一系列分离纯化操作得到一种新的酪氨酸酶抑制肽,其IC50为1.04 mmol/L。杨欣[8]以飞蝗成虫雌虫为对象,进行蛋白提取、酶解得到飞蝗酪氨酸酶抑制肽,10 mg/mL时飞蝗多肽的酪氨酸酶抑制率(tyrosinase inhibition rate,TIA)为42.16%。
胶原蛋白肽具有抗氧化、抗菌、降压和促进皮肤新陈代谢等生物活性[9],与胶原蛋白相比,其多肽分子质量更低,更容易被人体消化吸收[10],由于其具有安全性高、代谢较快、专一性高等特性,在相关研究中获得了广泛的关注。目前根据肽类物质的分子量、极性、带电性等物理性质差异,常采用的分离纯化技术有:透析、层析、超滤、电泳等[11-13]。但在实际的分离纯化过程中,往往会采用多种方法联用的手段对多肽进行分离纯化。例如OLIVEIRA等[14]采用超滤和凝胶排阻色谱纯化废酵母自溶物中提取的多肽组分,并且经过联用技术纯化得到的肽段比原始肽段在降压、降胆固醇以及抗氧化性能上均有显著提高。孙强等[15]利用纳滤、超滤和液相层析系统对亚临界水制备的芝麻ACE抑制肽进行分离纯化,最终分离纯化得到的组分抑制ACE的IC50值最低仅需2.53 μg/mL。
牦牛骨胶原蛋白经酶解产生的多肽具有很多潜在的生物活性[16],例如具有调节肠道菌群和抗氧化等功效,刘春雨等[17]通过体外模拟胃肠消化及小鼠粪便菌群的厌氧发酵,探究牦牛骨胶原蛋白肽(yak bone collagen peptide,YBCP)对肠道菌群的调节作用,结果表明YBCP会促进肠道中有益菌的增殖,具有改善肠道功能和维护肠道微生态平衡的潜力。王子俊等[18]通过DPPH自由基清除能力、Fe2+螯合能力、羟自由基清除能力和ABTS阳离子自由基清除能力验证了4条牦牛骨胶原蛋白的抗氧化活性,但目前尚未见以YBCP抑制酪氨酸酶活性的相关研究报道,又因为当前市场普遍缺乏对YBCP构效关系、作用机制的深入研究,制约了牦牛骨源酪氨酸酶抑制肽相关功能性产品的开发,所以本文以牦牛骨胶原蛋白酶解物为原料,以TIA为主要指标依次通过超滤、DA201大孔树脂吸附树脂、葡聚糖凝胶层析技术分离纯化多肽得到TIA较高的组分,通过分析各组分的氨基酸组成和分子质量分布,对酪氨酸酶抑制肽的构效关系进行讨论。
1 材料与方法
1.1 材料与试剂
牦牛骨明胶、碱性蛋白酶(200 U/mg),四川瑞宝生物科技股份有限公司;牛血清白蛋白,成都市科隆化学品(成都)有限公司;L-酪氨酸(500 U/mL)、蘑菇多酚氧化酶,G-15葡聚糖凝胶,上海源叶生物科技有限公司;G-50葡聚糖凝胶,天津市津东天正精细化学试剂厂;DA201-C型大孔树脂,北京索莱宝科技有限公司;超滤离心管(3 000、10 000 Da),Millipore公司。
1.2 仪器与设备
TSKgel 2000 SWXL色谱柱,AOELAB公司;玻璃层析柱(2.60 mm×50.00 cm、1.00 mm×40.00 cm、1.60 mm×50.00 cm)、HL-2S恒流泵、层析图谱采集分析仪、自动部分收集器、HD-3紫外检测仪,上海沪西分析仪器厂有限公司;A300全自动氨基酸分析仪,德国MembraPure公司;318C+酶标仪,上海沛欧分析仪器公司;Waters 600高效液相色谱仪,美国沃特斯有限公司。
1.3 试验方法
1.3.1 胶原蛋白水解物的制备
采用碱性蛋白酶对牦牛骨胶原蛋白进行酶解(底物体积分数为2%,酶底比为7 000 U/g、pH 值为9.10、50 ℃酶解7 h),水解结束后,用沸水灭酶10 min,待温度冷却后,调节pH值至7.00后离心(6 000 r/min,10 min),取上清液,此条件下得到的胶原蛋白水解物命名为YBCP。
1.3.2 TIA
参考CHEN等[19]的方法并略作修改,按表1所示依次吸取样品溶液、PBS及L-酪氨酸于96孔板,混匀后于37 ℃下保温10 min,取出96孔板在相应位置加入酪氨酸酶溶液,混匀后同样条件继续反应10 min,立刻用酶标仪测定在475 nm的吸光值,分别为ODA、ODB、ODC、ODD,试验重复3次取平均值为样品TIA,酪氨酸酶抑制率计算如公式(1)所示:
(1)
表1 TIA测定方法
Table 1 Methods for measuring the inhibition rate of tyrosinase activity
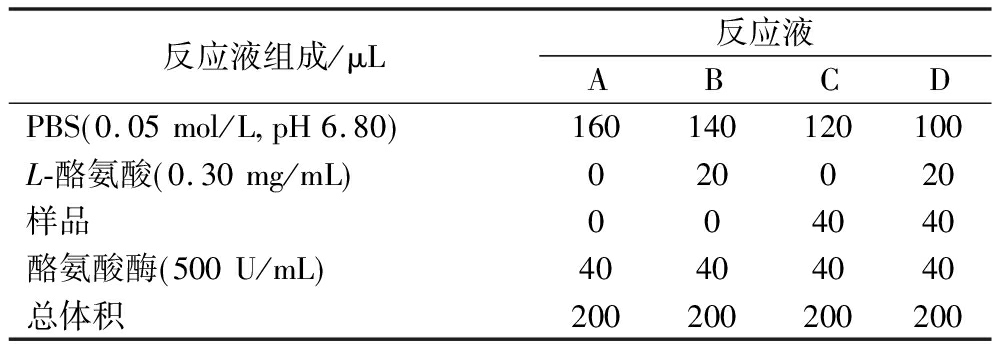
反应液组成/μL反应液ABCDPBS 0.05mol/L pH6.80 160140120100L-酪氨酸 0.30mg/mL 020020样品004040酪氨酸酶 500U/mL 40404040总体积200200200200
式中:X,酪氨酸酶抑制率,%。
1.3.3 胶原蛋白肽的超滤分析
将YBCP浓缩冻干并配置成10.00 mg/mL 的肽溶液,用10 kDa和3 kDa的超滤管进行分离处理,根据截留分子质量将胶原蛋白肽分成3个组分F1(>10 kDa)、F2(3~10 kDa)和F3(<3 kDa),收集的3个组分冷冻干燥备用,将F1、F2和F3配制成10.00 mg/mL 的溶液并测定TIA。
1.3.4 胶原蛋白肽的大孔树脂吸附
1.3.4.1 DA201-C大孔的吸附动力学试验
锥形瓶中加入10.00 g处理好的树脂,在无水乙醇中溶胀后用超纯水洗净,在锥形瓶中加入30.00 mL质量浓度为30.00 mg/mL的F3。将锥形瓶放入恒温振荡器中振荡8 h(20 ℃、150 r/min)。每小时取一次样,测定锥形瓶中液体的蛋白浓度,大孔树脂的吸附量和吸附率计算如公式(2)、公式(3)所示:
吸附率![]()
(2)
吸附量![]()
(3)
式中:ρ0,原液蛋白质质量浓度,mg/mL;ρ1,吸附液蛋白质质量浓度,mg/mL;V,吸附液体积,mL;m,干树脂质量,g。
1.3.4.2 不同洗脱剂对树脂静态解吸的影响
锥形瓶中加10.00 g 处理好的干树脂,在无水乙醇中溶胀后用超纯水洗净,在锥形瓶内加入30.00 mL 的F3(30.00 mg/mL),将锥形瓶放入恒温振荡器中振荡12 h(20 ℃、150 r/min);用滤纸过滤并用超纯水洗涤树脂。分别选用水、25.00%、50.00%、75.00% 和100.00%的乙醇溶液为洗脱剂加入锥形瓶,置于摇床中150 r/min 振荡24 h,测定解析液中的蛋白浓度,解吸率计算如公式(4)所示:
解吸率![]()
(4)
式中:ρ2,解吸液中蛋白质量浓度,mg/mL;V1,解吸液体积,mL;Q0,吸附量,mg;m0,树脂质量,g。
1.3.4.3 DA201-C大孔树脂对酶解液的动态解吸
在层析柱(1.00 cm×50.00 cm、床体积25.00 mL)中装入适量的大孔吸附树脂,将2.00 mL 20.00 mg/mL的F3 以1.50 mL/min 的上样流速流经层析柱,用体积分数为75.00%的乙醇为洗脱液,洗脱速度设置为1.50 mL/min。以A220=0.05为透过点,用紫外检测器检测洗脱液吸光度,收集并富集洗脱峰后冷冻干燥,测定各峰TIA。
1.3.4.4 蛋白质浓度的测定
配制不同浓度的牛血清白蛋白溶液,将40.00 μL不同浓度的蛋白溶液和160.00 μL双缩脲试剂加入96孔板中室温静置20 min,在540 nm处测定OD值并绘制双缩脲标准曲线。得到线性方程y=0.016 8x+0.038 4,R2=0.990 7。按上述方法测定样品中蛋白含量,根据标准曲线计算样液的蛋白浓度。
1.3.5 葡聚糖凝胶(SephadexG-50)柱层析
取适量冷冻干燥样品溶于超纯水,微孔滤膜过滤备用。用吸管将柱内凝胶上层蒸馏水吸出,保留一层薄液层。从柱子上端沿内壁加入多肽液后,打开柱底部旋塞缓慢放出液体,样液流至高出凝胶0.50 cm时往柱内加入2.00 mL 超纯水,用超纯水作为洗脱剂开始洗脱。上样质量浓度为60.00 mg/mL,上样量为1.00 mL,洗脱速度为1.00 mL/min,检测波长为220 nm,收集各峰组分并检测TIA。富集抑制活性最高峰组分,冷冻干燥待用。
1.3.6 葡聚糖凝胶(SephadexG-15)柱层析
SephadexG-15凝胶的处理同1.3.5节。取适量冷冻干燥后的样品,配置40.00 mg/mL的多肽溶液,洗脱速度0.50 mL/min,检测波长220 nm,上样量1.00 mL。
1.3.7 氨基酸组成测定
使用氨基酸自动分析仪检测氨基酸组成和含量。
1.3.8 多肽疏水值的计算
参考ZHANG等[20]的方法,计算如公式(5)所示:
(5)
Q=∑ΔQi
(6)
式中:A,100 g蛋白质中氨基酸含量,g;M,氨基酸摩尔质量,g/mol;∑A/Mi,氨基酸总物质的量,mol;fti,氨基酸侧链疏水性值,kJ/mol;Q,蛋白质疏水性值。
1.3.9 分子质量测定
采用高效液相排阻色谱法(high-performance size exclusion chromatography,HPSEC)对组分的分子质量分布进行分析。高效液相色谱:Waters 600(2487紫外检测器和M32工作站);色谱柱:TSK ge-l 2000 SWXL 300 mm×7.8 mm;检测波长:220 nm;相对分子质量标准品:杆菌酶(MW 1 450)、细胞色素C(MW 12 500)、乙氨酸-乙氨酸-酪氨酸-精氨酸(MW 451)及乙氨酸-乙氨酸-乙氨酸(MW189);流动相:V乙腈∶V水∶V三氟乙酸=450∶550∶1;流量:0.5 mL/min;柱温:30 ℃。
1.3.10 数据统计与分析
所有试验均重复3次,采用核酸蛋白检测系统和Origin 2021作图、Excel 2019计算和数据统计,数据处理后表现为“平均值±标准差”。
2 结果与分析
2.1 胶原蛋白肽的超滤分析
如表2所示,与YBCP相比,F1组分和F2组分的TIA大幅度降低,F3组分的TIA略有升高达到24.37%,由此看出酪氨酸酶抑制率与胶原蛋白肽的分子质量存在一定联系,多肽分子质量分布越低,酪氨酸酶抑制率就会越高,两者呈正相关关系。因此,本试验选取F3组分进行下一步大孔树脂分离纯化,以期获得TIA活性更高的组分。
表2 各超滤组分及YBCP的TIA活性
Table 2 TIA activities of each ultrafiltration component and YBCP

组分TIA/%YBCP22.49±0.97F113.55±0.71F216.29±1.26F324.37±1.14
2.2 胶原蛋白肽的大孔树脂吸附
2.2.1 DA201-C大孔的静态吸附动力学试验结果
DA201-C大孔树脂是一种由偶极矩很小的单体聚合的而成的具有网孔结构的非极性树脂,表面疏水性极强,大孔树脂巨大的比表面积和它的多孔结构共同决定了其对多肽的吸附能力[21-22]。DA201-C大孔树脂对YBCP的静态吸附能力如图1所示,大孔树脂对YBCP的吸附在3 h前上升较快,尤其是在1 h前吸附率增加迅速,在4 h后基本达到动态吸附平衡。吸附量为67.92 mg/g,吸附率为75.47%。说明DA201-C大孔树脂对牦牛胶原蛋白肽具有良好的吸附动力学特性,适用于对目标肽的分离纯化。
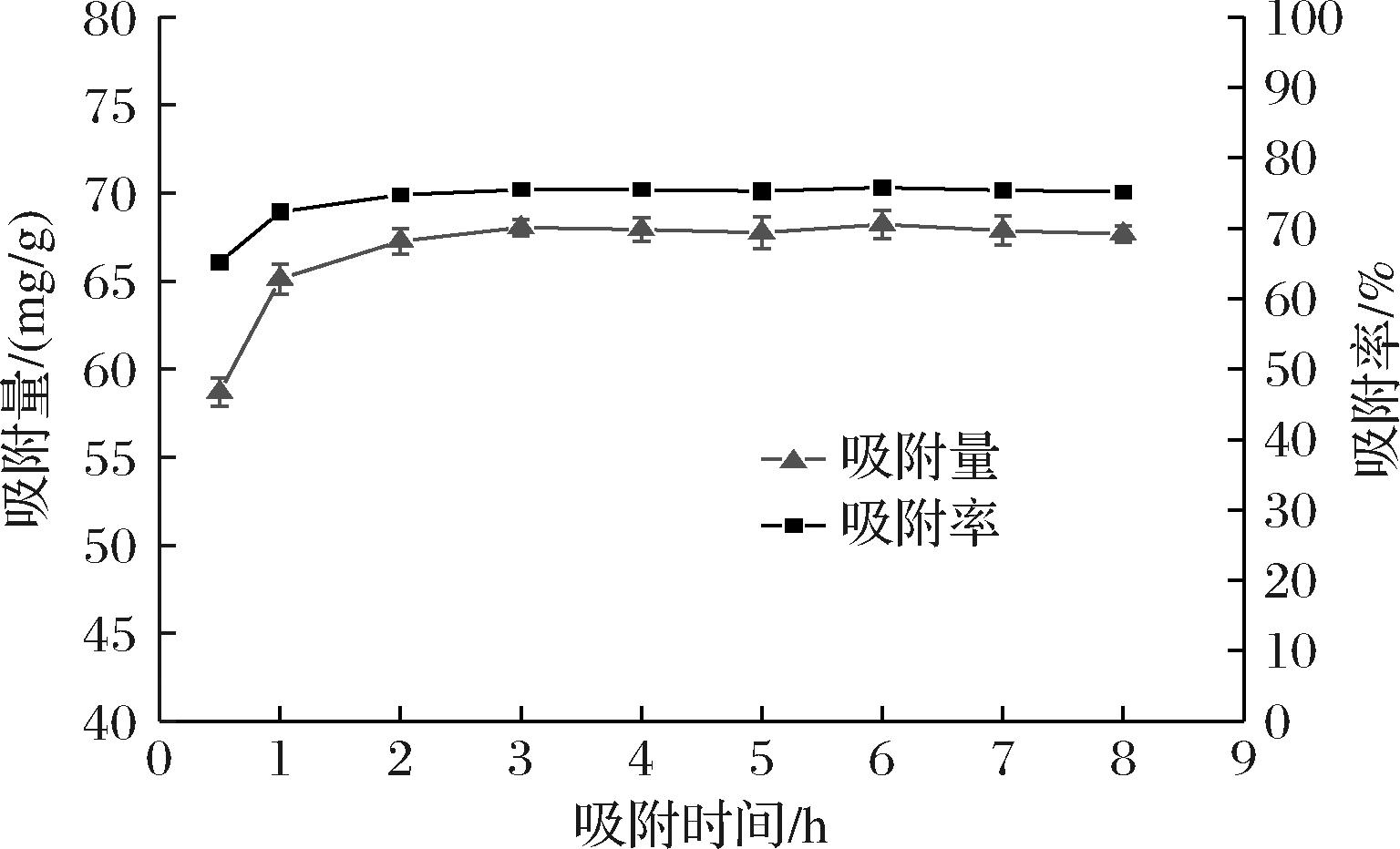
图1 DA201-C 大孔树脂静态吸附曲线
Fig.1 Static adsorption curve of DA201-C macroporous resin
2.2.2 DA201-C大孔树脂的静态解吸
大孔吸附树脂对分子的吸附能力相对较弱,主要是通过多肽的疏水基团与非极性吸附剂之间的范德华引力对多肽进行吸附,若想增加数值对待分离组分的吸附力或者使被吸附的组分解吸洗脱出来,只需要改变体系中的亲水平衡就能实现[23]。因为乙醇有解吸效果好、易于蒸馏回收且安全无毒等优点,常被选做大孔树脂的洗脱剂。如图2所示,用水作为解吸剂时,解吸率低至11.75%,效果并不理想;用乙醇溶液对树脂进行解吸时,随着乙醇体积分数的增加,解吸率上升。当乙醇体积分数为75.00%时解吸率最高,可达78.72%,但当乙醇的体积分数增加至95.00%时,解吸率开始下降,这是因为不同体积分数的乙醇溶液极性不同,与不同亲水—疏水性的肽段亲和力不同。乙醇体积分数增加,疏水性提高,对多肽组分中疏水性较大的肽段具有较强的亲和吸附作用,但乙醇溶液体积分数越高,极性越小,从而使树脂中醇溶性杂质增多,降低胶原蛋白肽的纯度,解吸效果减弱[21]。而75.00%的乙醇可能是因为极性与胶原蛋白肽的极性相比其他体积分数的乙醇更为接近,两者的范德华力也更大,所以洗脱效果更好。
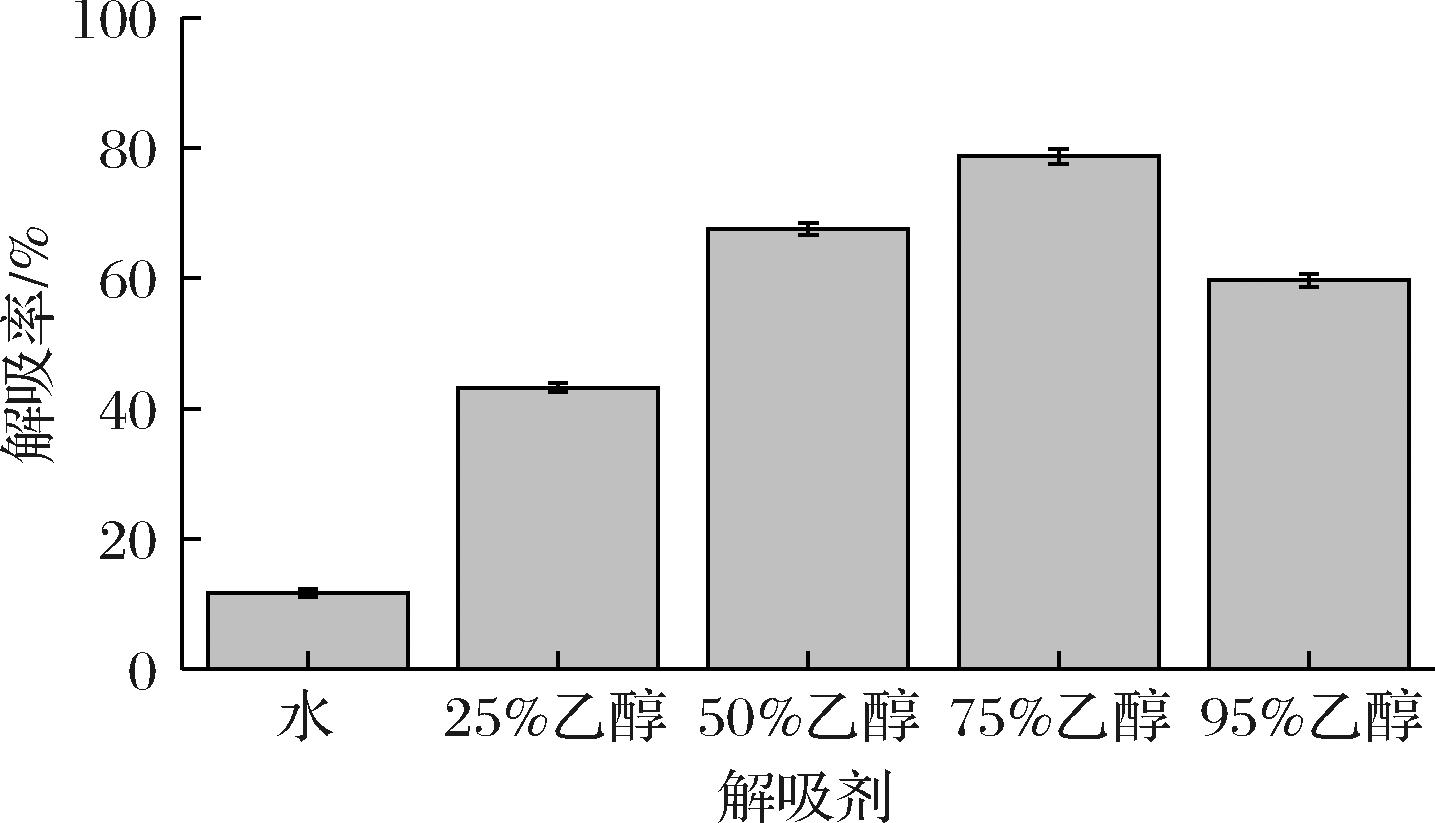
图2 不同解吸剂对胶原蛋白肽的解吸率
Fig.2 The desorption rate of collagen peptides by different desorption agents
2.2.3 DA201-C大孔树脂对酶解液的动态解吸
由图3色谱图可知,采用75.00%乙醇为洗脱剂时,乙醇通过减弱胶原蛋白肽非极性基团的疏水倾向,在上样后93 min左右逐渐将被大孔树脂所吸附的多肽洗脱出来,在130 min出现洗脱高峰,胶原蛋白肽在93~120 min 处被洗脱出来得到组分峰1。将峰1洗脱液收集并冷冻干燥,测定TIA。由表3可知,经过大孔树脂分离纯化后的胶原蛋白肽TIA达到26.67%,相比超滤后的YBCP抑制率只提高了2.50%左右,纯化效果并不理想。这可能是由于设置的上样流速过快造成的,树脂的吸附需要一个接触和扩散的过程,如果上样流速过快会导致树脂无法充分吸附酶解液就流出层析柱[24]。影响酶解液吸附效率的因素除了上样流速,还与上样液的质量浓度、洗脱流速等因素有关,后续会针对这些影响因素来设计相应的对比实验进行逐一优化。
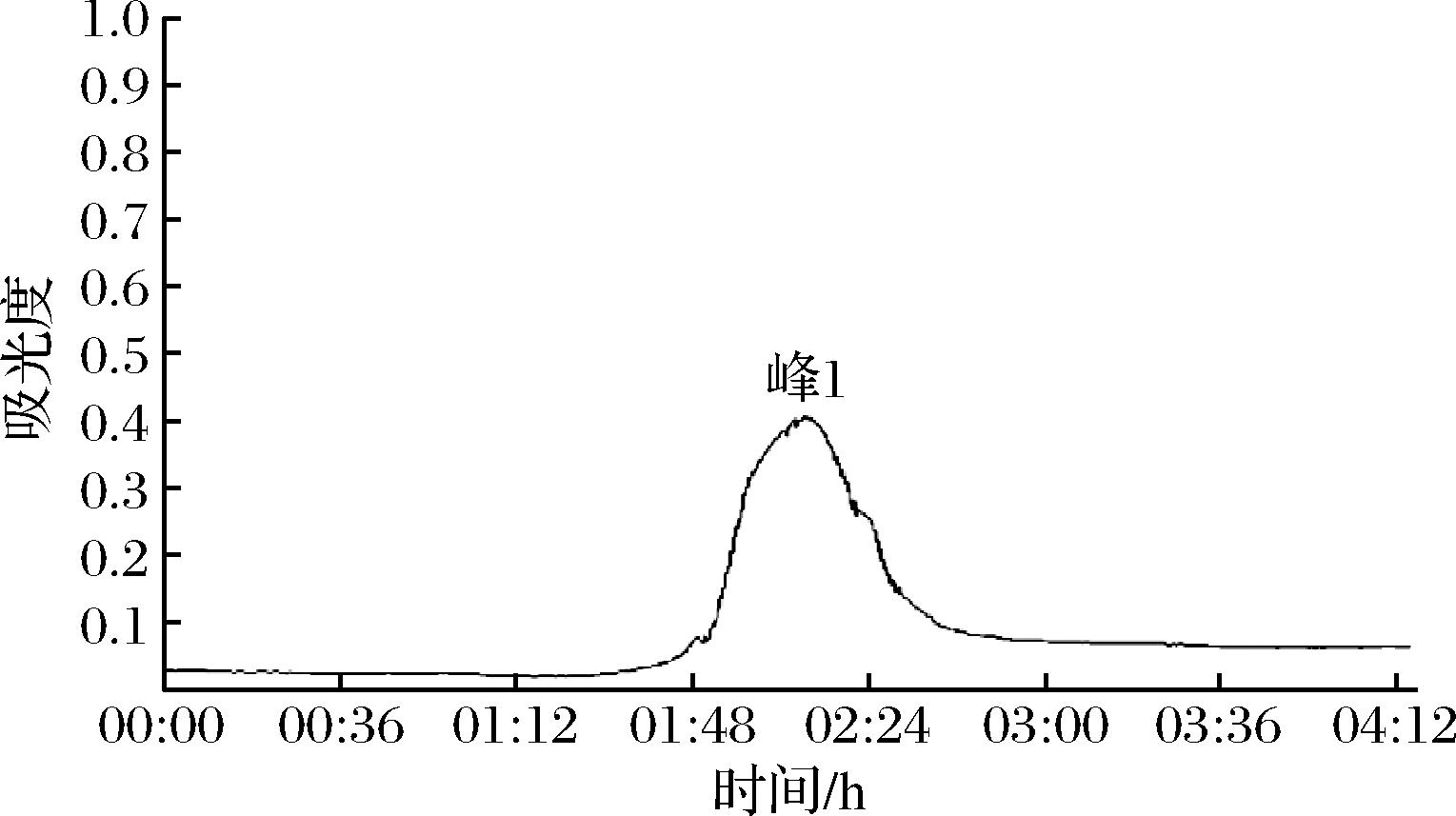
图3 胶原蛋白酶解液的大孔树脂分离图
Fig.3 Separation of macroporous resin from collagen hydrolysate
表3 超滤组分、大孔树脂、葡聚糖凝胶分离组分的TIA
Table 3 TIA of ultrafiltration fraction,macroporous resin,and dextran gel separation fraction
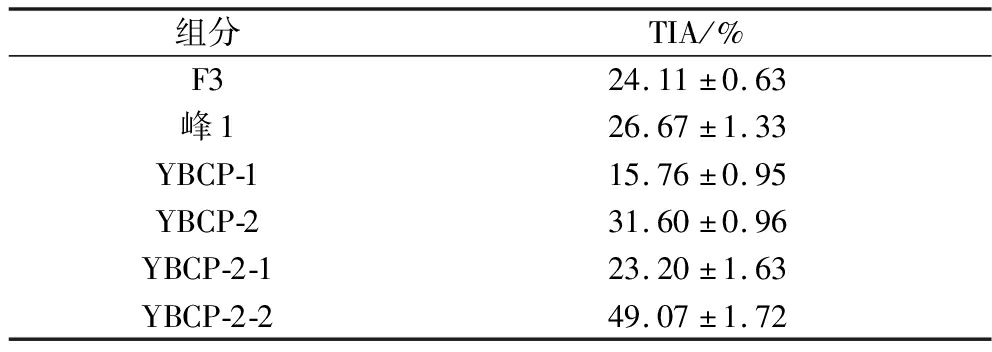
组分TIA/%F324.11±0.63峰126.67±1.33YBCP-115.76±0.95YBCP-231.60±0.96YBCP-2-123.20±1.63YBCP-2-249.07±1.72
2.3 SephadexG-50柱层析
由于葡聚糖凝胶颗粒呈立体网状结构,内部分布着大小不一的孔径,凝胶柱层析就是根据样品的不同分子质量对其进行分离纯化。因此用SephadexG-50葡聚糖凝胶对超滤后的胶原蛋白肽进行下一步分离,洗脱曲线如图4可知,用水作为洗脱剂,在220 nm检测波长下检测到2个较为明显的洗脱峰,按出峰顺序命名为YBCP-1和YBCP-2。经检测,YBCP-2的TIA最高,抑制率为31.60%,选择组分YBCP-2用SephadexG-15对其进行下一步分离纯化。
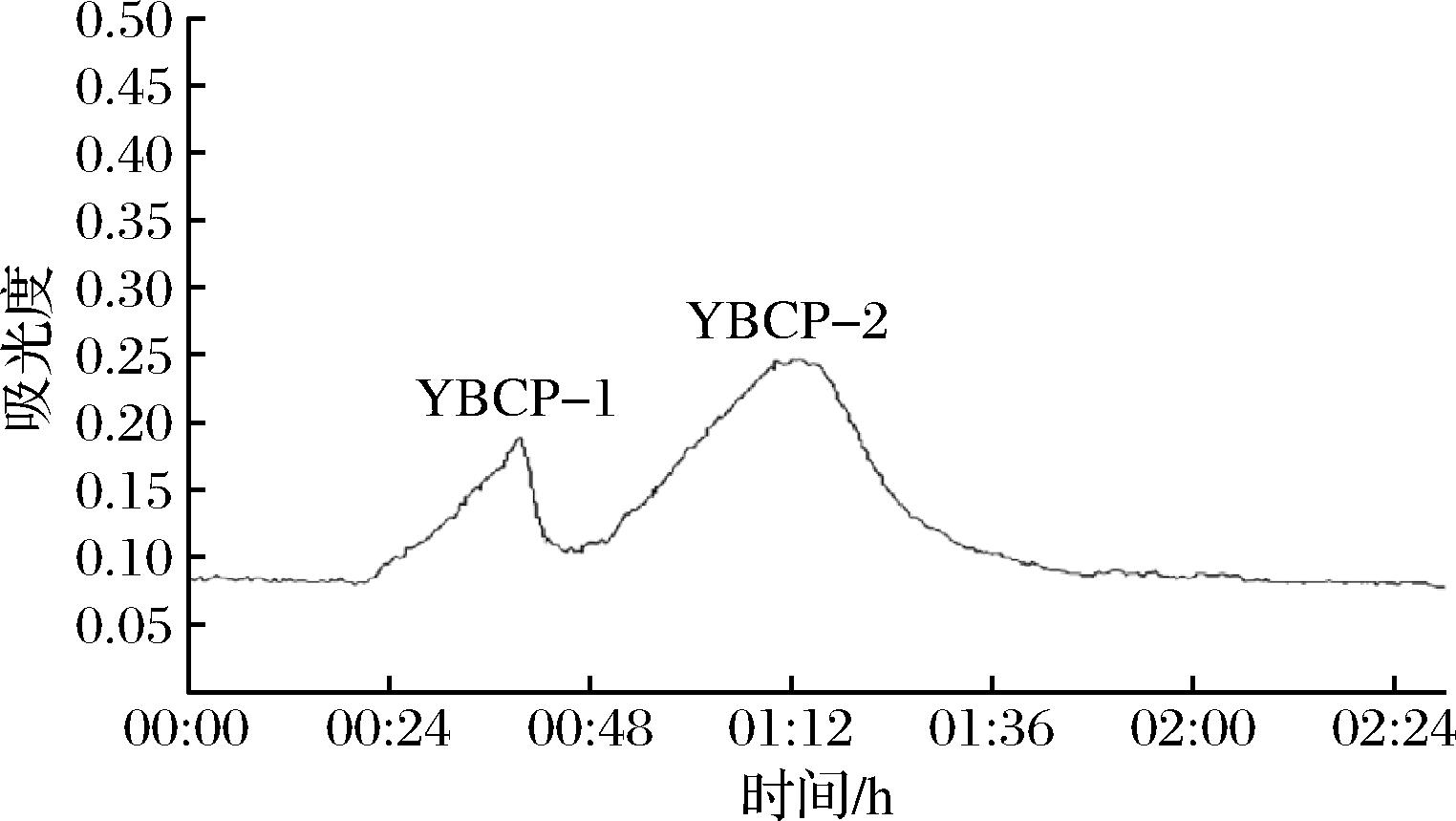
图4 胶原蛋白酶解液的SephadexG-50峰图
Fig.4 Peak plot of SephadexG-50 of collagen digest
2.4 SephadexG-15柱层析
如图5所示,组分YBCP-2经过SephadexG-15 凝胶层析后得到2个组分(YBCP-2-1和YBCP-2-2),其中YBCP-2-2对酪氨酸酶抑制活性显著高于其他组分,TIA高达49.07%,这可能是因为其相比于YBCP-2-1的分子质量更小,所以其抑制能力更高。分子质量是影响蛋白质水解物或活性多肽生物利用度的重要因素,由于YBCP-2-2的TIA更高且相对含量也更多,所以选择其作为后续研究对象。
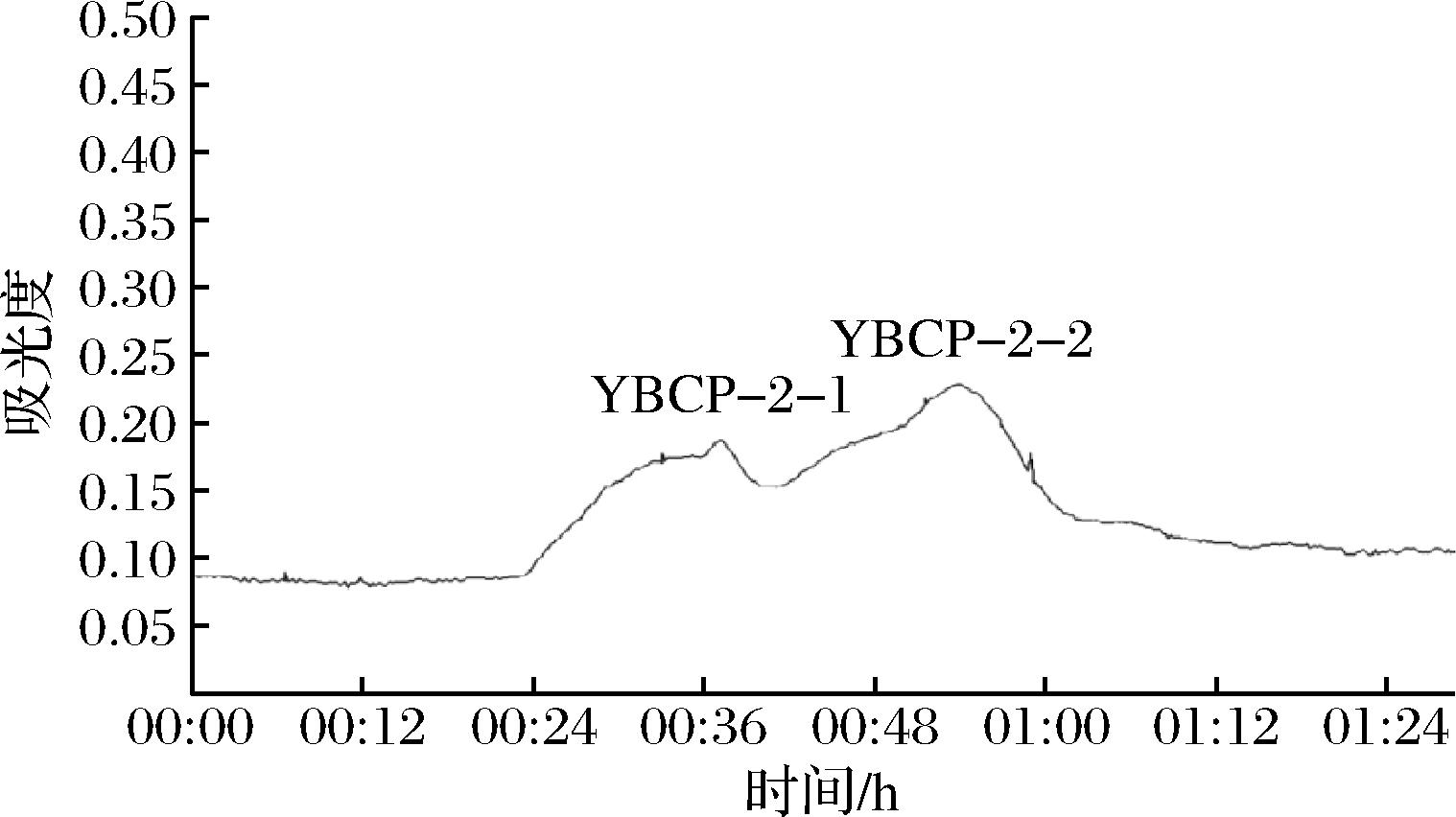
图5 胶原蛋白酶解液的SephadexG-15峰图
Fig.5 Peak plot of SephadexG-15 of collagen digest
2.5 氨基酸组成分析
对比YBCP与分离纯化后的2个组分YBCP-2-1和YBCP-2-2的氨基酸组成;由表4可知,与YBCP相比,经过多次纯化得到的组分氨基酸种类不变,氨基酸含量变化较大。总体来说分离纯化后的2个组分YBCP-2-2与YBCP-2-1中的疏水性氨基酸、芳香族氨基酸比原肽含量显著提高,极性氨基酸含量下降,3个组分的抗氧化性氨基酸比例则相差不大。其中YBCP-2-2这几种氨基酸种类含量分别占总体氨基酸的42.32%、10.04%、28.43%和63.45%,而YBCP-2-1这几种氨基酸则分别占其总氨基酸组成的46.54%、1.58%、27.11%和63.53%,芳香族氨基酸和极性氨基酸的含量明显少于YBCP-2-2,尤其是芳香族氨基酸少了8.46%,这些氨基酸在胶原蛋白肽的TI活性中起着十分重要的作用。
表4 各组分的氨基酸成分分析
Table 4 Amino acid composition analysis of each component
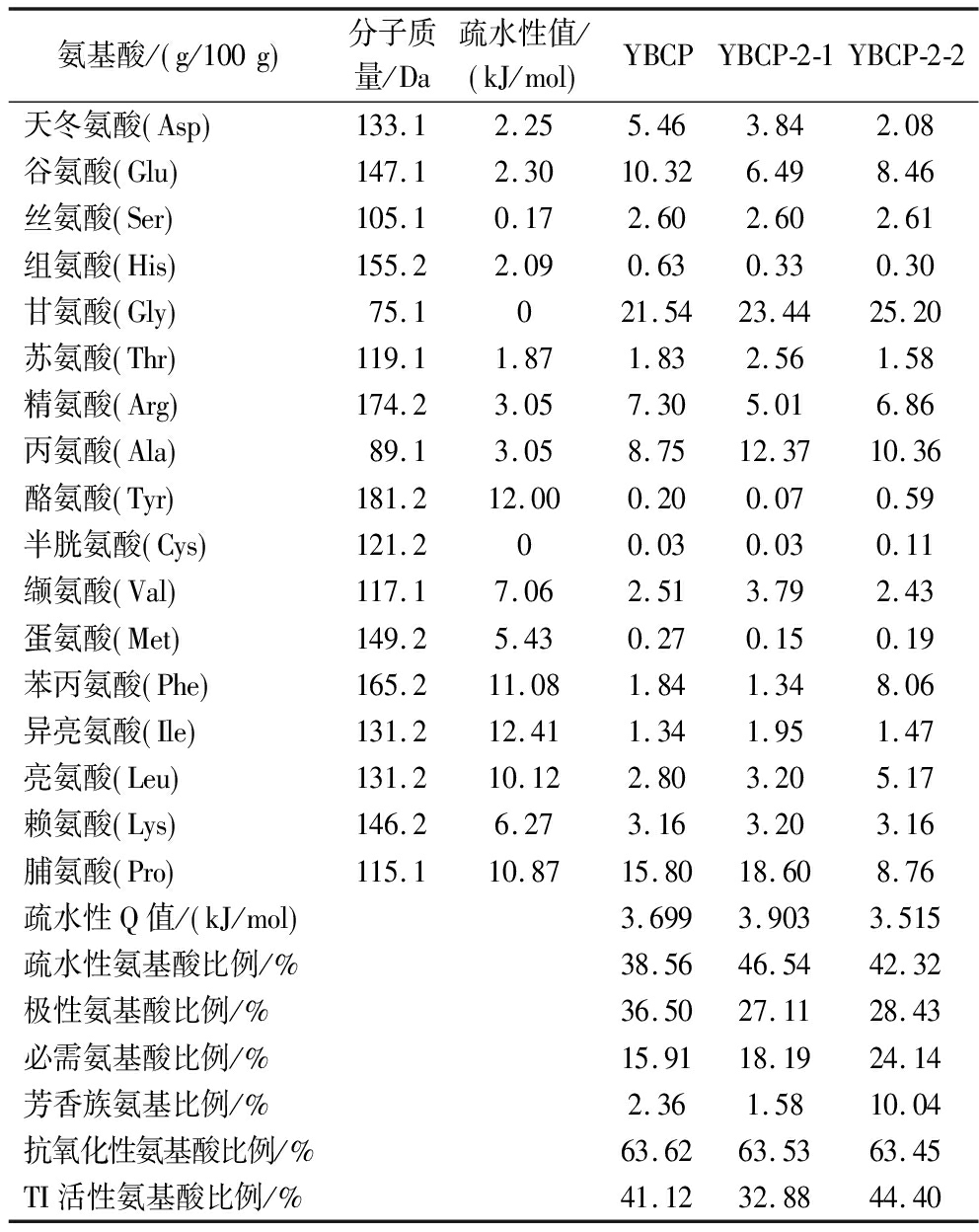
氨基酸/ g/100g 分子质量/Da疏水性值/ kJ/mol YBCPYBCP-2-1YBCP-2-2天冬氨酸 Asp 133.12.255.463.842.08谷氨酸 Glu 147.12.3010.326.498.46丝氨酸 Ser 105.10.172.602.602.61组氨酸 His 155.22.090.630.330.30甘氨酸 Gly 75.1021.5423.4425.20苏氨酸 Thr 119.11.871.832.561.58精氨酸 Arg 174.23.057.305.016.86丙氨酸 Ala 89.13.058.7512.3710.36酪氨酸 Tyr 181.212.000.200.070.59半胱氨酸 Cys 121.200.030.030.11缬氨酸 Val 117.17.062.513.792.43蛋氨酸 Met 149.25.430.270.150.19苯丙氨酸 Phe 165.211.081.841.348.06异亮氨酸 Ile 131.212.411.341.951.47亮氨酸 Leu 131.210.122.803.205.17赖氨酸 Lys 146.26.273.163.203.16脯氨酸 Pro 115.110.8715.8018.608.76疏水性Q值/ kJ/mol 3.6993.9033.515疏水性氨基酸比例/%38.5646.5442.32极性氨基酸比例/%36.5027.1128.43必需氨基酸比例/%15.9118.1924.14芳香族氨基比例/%2.361.5810.04抗氧化性氨基酸比例/%63.6263.5363.45TI活性氨基酸比例/%41.1232.8844.40
注:疏水性氨基酸:Leu、Ala、Val、Met、Phe、Pro、Trp和Ile;极性氨基酸:Ser、Thr、Tyr、Cys、Lys、Arg、His、Asp和Glu;必需氨基酸:Phe、Leu、Lys、Val、Ile、Thr、Trp和Met;芳香族氨基酸:Tyr、Phe和Trp;抗氧化性氨基酸:Val、Ala、Glu、Leu、Phe、Pro、Tyr、Ile、Arg、His、Cys、Met和Lys;TI活性氨基酸:Asp、Glu、Ser、His、Thr、Arg、Tyr、Cys、Val、Leu和Phe。
多肽链中是否有疏水性氨基酸的存在,对功能活性肽的酪氨酸酶抑制能力来说非常关键。SCHURINK等[25]研究表明,若生物活性肽的TI能力较强,那氨基酸组成通常会出现一个或多个精氨酸残基或者苯丙氨酸残基。如果天冬氨酸、丝氨酸、半胱氨酸等不带电荷的极性氨基酸存在于多肽中,那这些氨基酸可能与酪氨酸酶催化多巴形成的多巴醌形成共轭从而抑制黑色素形成[26]。精氨酸可以增强细胞渗透性,促进多肽与酪氨酸酶之间的相互作用,芳香族氨基酸如苯丙氨酸、酪氨酸等不仅可以作为底物结构类似物和酪氨酸酶形成竞争性抑制作用从而起到抑制其酶活性的作用[27],也可以提供质子直接猝灭或者抑制自由基,发挥抗氧化功能。丝氨酸和苏氨酸可以与酪氨酸酶酶促反应中的中间产物多巴醌结合产生复合物,抑制其进一步转化成为黑色素从而达到抑制酪氨酸酶活性的效果[28]。因此,YBCP-2-2中多肽含有十分丰富的有利于抑制酪氨酸酶活性的氨基酸,这些具有明显TI性的氨基酸占蛋白总量的44.44%,远高于YBCP的41.12%和YBCP-2-1的32.88%。尤其是YBCP-2-2中的苯丙氨酸、酪氨酸、亮氨酸、精氨酸、天冬氨酸和半胱氨酸等氨基酸残基含量都远远高于YBCP和YBCP-2-1组分,这进一步有效解释了为什么YBCP-2-2具有较强的TIA。
必需氨基酸在食源性蛋白质中的占比是评价蛋白质营养价值最重要的指标之一。根据世界卫生组织(World Health Organization,WHO)和联合国粮食及农业组织(Food and Agriculture Organization,FAO)提出的理想蛋白质中必需氨基酸模式标准[29]来对各组分进行蛋白质质量评价,结果如表5可知,YBCP、YBCP-2-1和YBCP-2-2的必需氨基酸含量都基本小于FAO/WHO模式的要求,尤其是蛋氨酸和半胱氨酸的含量都非常少,评分均不到0.10,只有YBCP-2-2的酪氨酸和苯丙氨酸的含量超过了此模式的要求。同时,在这3个组分中YBCP-2-2的氨基酸评分(amino acid scores,AAS)总和相比其他2个组分有明显的提升,说明YBCP-2-2营养价值更高。但是该组分的必需氨基酸含量离理想蛋白模式还有一定距离,说明若使用此肽开发功能性营养食品应用到市场上,可能还需额外添加相应缺少的必需氨基酸以满足人体营养需要。
表5 各组分的氨基酸评分
Table 5 Amino acid scores of each component
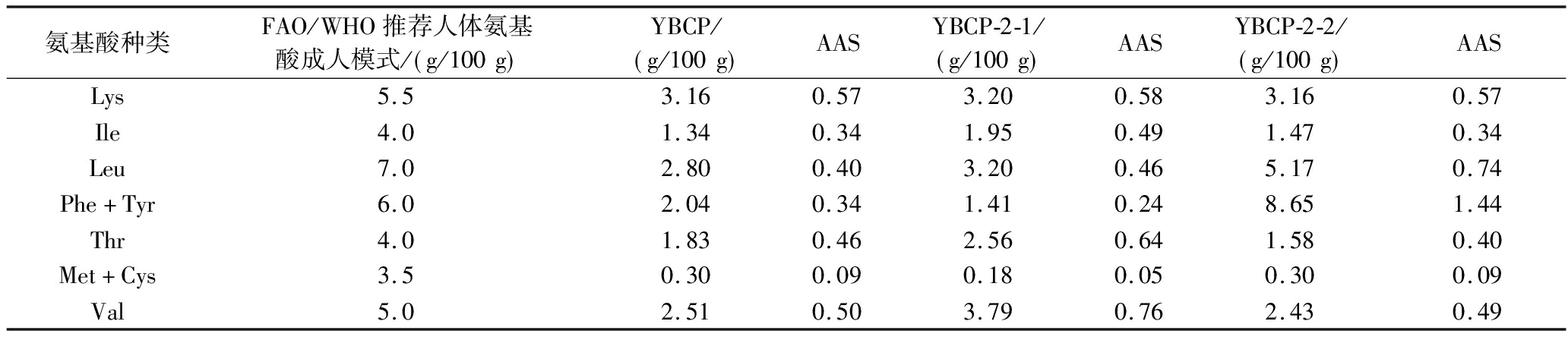
氨基酸种类FAO/WHO推荐人体氨基酸成人模式/ g/100g YBCP/ g/100g AASYBCP-2-1/ g/100g AASYBCP-2-2/ g/100g AASLys5.53.160.573.200.583.160.57Ile4.01.340.341.950.491.470.34Leu7.02.800.403.200.465.170.74Phe+Tyr6.02.040.341.410.248.651.44Thr4.01.830.462.560.641.580.40Met+Cys3.50.300.090.180.050.300.09Val5.02.510.503.790.762.430.49
2.6 分子质量分析
对分离纯化前的胶原蛋白肽和SephadexG-15分离纯化得到的各组分进行分子质量分析对比,结果如表6和图6所示。YBCP-2-1组分分子质量介于180~500 Da(2~4肽)含量最多,约占总量的62.34%。其次是500~1 000 Da(4~8肽)的组分,占26.72%。将YBCP-2-2按分子质量大小可以分为5个部分,且均在3 000 Da(28肽)以下,小于1 000 Da(8肽)的部分达到了96.56%,其中Mw为259~608 Da的肽段较为集中,含量约为90.73%,还有5.83%的组分为游离氨基酸。氨基酸残基平均分子质量约为110 Da[30],因此分离纯化出来的YBCP-2-2大多是由少于6个氨基酸组成的肽段。而生物活性肽一般由2~20个氨基酸残基组成,可以通过肠道的屏障发挥其生物功能,所以多肽的氨基酸组成和其在肽序列中的独特位置对肽的生物活性有着很大的影响。例如DENG等[31]发现通过分离纯化得到的分子质量为658.010 Da的小肽表现出优越的酪氨酸酶抑制力和铜离子螯合力,IC50分别为1.15 mg/mL和0.93 mg/mL。
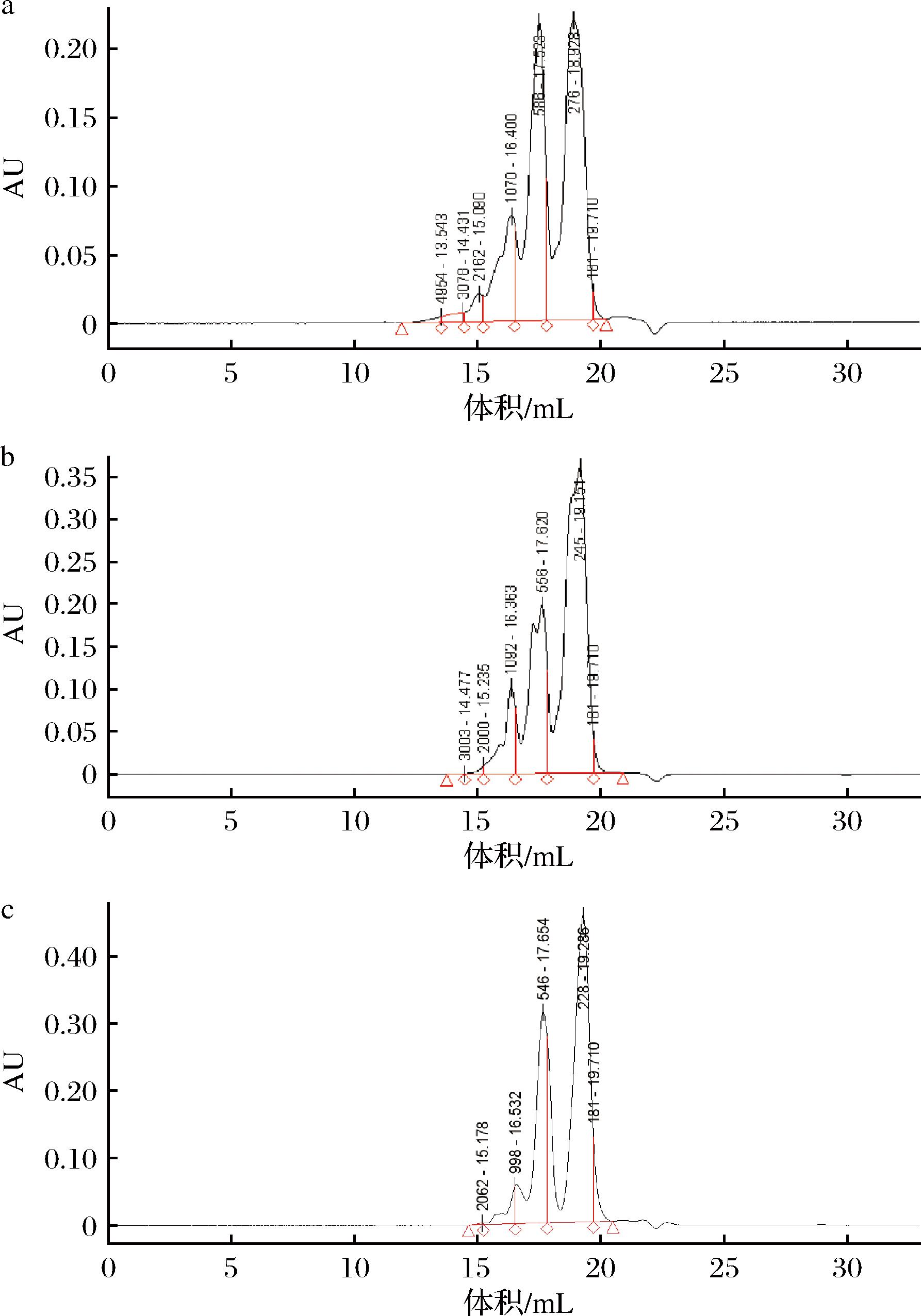
图6 各组分分子质量分布峰图
Fig.6 Peak distribution of each component
表6 各组分的分子质量分析
Table 6 Molecular weight analysis of each component
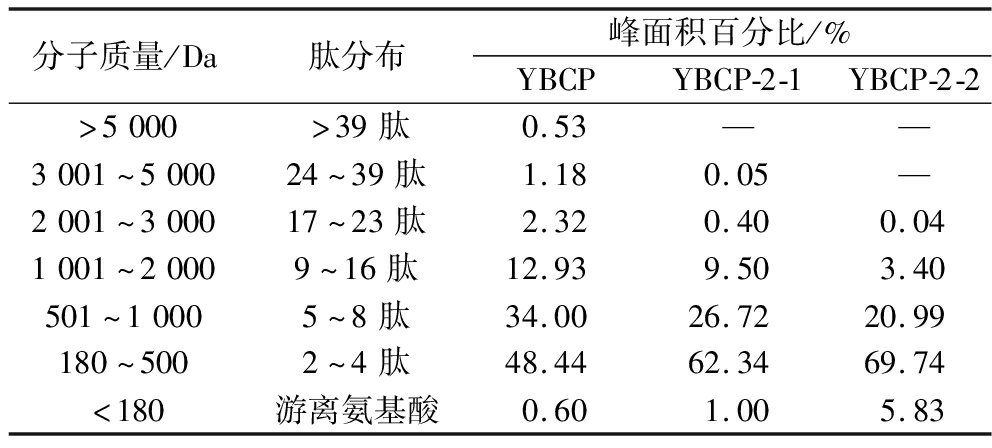
分子质量/Da肽分布峰面积百分比/%YBCPYBCP-2-1YBCP-2-2>5000>39肽0.53——3001~500024~39肽1.180.05—2001~300017~23肽2.320.400.041001~20009~16肽12.939.503.40501~10005~8肽34.0026.7220.99180~5002~4肽48.4462.3469.74<180游离氨基酸0.601.005.83
与YBCP相比,YBCP-2-1和YBCP-2-2的分子质量主要分布在1 000 Da(2~8肽)以下,尤其是500 Da以下的分子含量远高于分离纯化前的含量,这部分主要由2~4肽和游离氨基酸组成,且YBCP、YBCP-2-1和YBCP-2-2这部分小肽的峰面积分别占总面积的49.04%、63.34%和75.54%,酪氨酸酶抑制活性最高的YBCP-2-2<500 Da(2~4肽)的部分比YBCP高26.53%,说明胶原蛋白肽的酪氨酸酶抑制活性与多肽的分子质量分布密切相关,分子质量越小,酪氨酸酶抑制能力越高。通常,低分子质量的胶原蛋白水解产物具有较好的分散性和较高的疏水性,因此其生物活性也更好[32]。
3 结论与讨论
本研究以牦牛骨胶原蛋白水解物为原料,采用超滤、大孔吸附树脂以及葡聚糖凝胶G-15,G-50柱层析法进行多次分离纯化,获得较高活性成分YBCP-2-2,在10.00 mg/mL浓度下其TIA高达49.07%。经氨基酸组成分析显示,在YBCP-2-2中对TIA活性有贡献的疏水性氨基酸、芳香族氨基酸及TI活性氨基酸含量显著提高,分别为42.32%、10.04%和44.40%,特别是苯丙氨酸、亮氨酸、酪氨酸和半胱氨酸含量明显增加,即YBCP-2-2中含有十分丰富的有利于抑制酪氨酸酶活性的氨基酸,这进一步有效解释了为什么该组分具有较强的TIA;通过对YBCP、YBCP-2-1和YBCP-2-2三个组分进行氨基酸评分发现,YBCP-2-2的氨基酸评分总和相比其他2个组分有明显的提升,说明YBCP-2-2具有更高的营养价值,具备良好的应用前景;YBCP-2-2中主要含2~8肽(分子质量<1 000 Da)占蛋白总量的96.56%,其中2~4肽(分子质量<500 Da)占75.54%,这部分比YBCP高26.53%,这表明TIA与多肽分子质量分布紧密相关,且分子质量越小,酪氨酸酶抑制能力越强。本研究对牦牛骨源酪氨酸酶抑制肽的分离纯化及构效关系进行了系统分析,相信未来应用于医疗美容或化妆品行业将会有较好的市场前景,随着后续产品研发的深入,可以考虑制定牦牛骨源酪氨酸酶抑制肽产品的安全性、有效性的评价体系,加强该功能性产品的市场推广力,并加强科普宣传,进一步提升广大消费者对牦牛骨胶原多肽产品的认知度和接受度。
[1] BASKARAN R,CHAUHAN S S,PARTHASARATHI R,et al.In silico investigation and assessment of plausible novel tyrosinase inhibitory peptides from sesame seeds[J].LWT,2021,147:111619.
[2] 陈海雁,陈向东,俞黎姗.黑色素形成机理、生物学功能和应用开发的研究进展[J].生物资源,2020,42(6):652-659.CHEN H Y,CHEN X D,YU L S.Biosynthesis,function and applications of melanin[J].Biotic Resources,2020,42(6):652-659.
[3] 张龙.间苯二酚类黄酮衍生物对酪氨酸酶抑制机理研究[D].无锡:江南大学,2017.ZHANG L.Study on the inhibitory mechanism of resorcinol flavonoid derivatives on tyrosinase[D].Wuxi:Jiangnan University,2017.
[4] YAMAGUCHI Y,HEARING V J.Physiological factors that regulate skin pigmentation[J].BioFactors,2009,35(2):193-199.
[5] SONG Y Q,CHEN S J,LI L H,et al.The hypopigmentation mechanism of tyrosinase inhibitory peptides derived from food proteins:An overview[J].Molecules,2022,27(9):2710.
[6] JU X Y,CHENG S Z,LI H,et al.Tyrosinase inhibitory effects of the peptides from fish scale with the metal copper ions chelating ability[J].Food Chemistry,2022,390:133146.
[7] YU Z P,LV H,ZHOU M J,et al.Identification and molecular docking of tyrosinase inhibitory peptides from allophycocyanin in Spirulina platensis[J].Journal of the Science of Food and Agriculture,2024,104(6):3648-3653.
[8] 杨欣.飞蝗酪氨酸酶抑制肽的制备、分离和抑制机理研究[D].太原:山西大学,2024.YANG X.Preparation,isolation and mechanism of tyrosinase-inhibiting peptides from Locusta migratoria[D].Taiyuan:Shanxi University,2024.
[9] WANG L,ZHANG Y,ZHU Z L,et al.Food-derived collagen peptides:Safety,metabolism,and anti-skin-aging effects[J].Current Opinion in Food Science,2023,51:101012.
[10] EIVAZZADEH-KEIHAN R,BAHREINIZAD H,AMIRI Z,et al.Functionalized magnetic nanoparticles for the separation and purification of proteins and peptides[J].TrAC Trends in Analytical Chemistry,2021,141:116291.
[11] 张丰文,董超,周丽亚,等.抗氧化多肽来源、提取及检测的研究进展[J].生物技术,2021,31(1):96-103;64.ZHANG F W,DONG C,ZHOU L Y,et al.Research progress of antioxidant peptides[J].Biotechnology,2021,31(1):96-103;64.
[12] 张亚,苏品,廖晓兰,等.多肽的分离纯化技术研究进展[J].微生物学杂志,2013,33(5):87-91.ZHANG Y,SU P,LIAO X L,et al.Advanced in separation and purification of polypeptide technology[J].Journal of Microbiology,2013,33(5):87-91.
[13] 王丹丹,刘芫汐,左甜甜,等.大孔吸附树脂及其在中药领域应用研究进展[J].中国药事,2022,36(7):826-835.WANG D D,LIU Y X,ZUO T T,et al.Research progress of macroporous adsorption resin and its application in traditional Chinese medicines[J].Chinese Pharmaceutical Affairs,2022,36(7):826-835.
[14] OLIVEIRA A S,PEREIRA A M,FERREIRA C M H,et al.Purification of bioactive peptides from spent yeast autolysates[J].Food and Bioproducts Processing,2024,143:45-53.
[15] 孙强,王瑞丹,黄纪念,等.亚临界水制备芝麻ACE抑制肽的分离纯化、构效、分子对接[J].食品科学,2023,44(16):106-112.SUN Q,WANG R D,HUANG J N,et al.Separation,purification,structure-activity relationship and molecular docking of sesame angiotension converting enzyme inhibitory peptides prepared by subcritical water hydrolysis[J].Food Science,2023,44(16):106-112.
[16] 叶孟亮.牦牛骨胶原蛋白肽抗骨质疏松作用机制研究[D].北京:中国农业科学院,2019.YE M L.Study on the underlying mechanism of anti-osteoporosis of yak (Bos grunniens) bone collagen peptides[D].Beijing:Chinese Academy of Agricultural Sciences,2019.
[17] 刘春雨,衣大龙,杨玉亮,等.牦牛骨胶原蛋白肽体外调节肠道菌群的研究[J].食品与发酵工业,2021,47(16):59-65.LIU C Y,YI D L,YANG Y L,et al.Modulation effects of yak bone collagen peptides on gut microbiota in vitro[J].Food and Fermentation Industries,2021,47(16):59-65.
[18] 王子俊,徐鹏飞,朱天晴,等.牦牛骨胶原蛋白肽的抗氧化活性验证、稳定性评估及机制分析[J].食品与发酵工业,2025,51(19):126-134.WANG Z J,XU P F,ZHU T Q,et al.Verification of antioxidant activity,stability evaluation,and mechanism analysis of yak bone collagen peptide[J].Food and Fermentation Industries,2025,51(19):126-134.
[19] CHEN Y S,LEE S M,LIN C C,et al.Kinetic study on the tyrosinase and melanin formation inhibitory activities of Carthamus yellow isolated from Carthamus tinctorius L.[J].Journal of Bioscience and Bioengineering,2013,115(3):242-245.
[20] ZHANG X Y,LIU C,NEPAL S,et al.A hybrid approach for scalable sub-tree anonymization over big data using MapReduce on cloud[J].Journal of Computer and System Sciences,2014,80(5):1008-1020.
[21] 宫霞,赵骏.大孔吸附树脂对酪蛋白酶解液的脱盐作用研究[J].食品科学,2006,27(11):301-303.GONG X,ZHAO J.Study on macroporous adsorption resins desalination for casein hydrolysate[J].Food Science,2006,27(11):301-303.
[22] 夏光华,申铉日,酒志强,等.大孔树脂对罗非鱼皮胶原蛋白抗氧化肽脱盐作用的研究[J].现代食品科技,2013,29(5):1052-1056.XIA G H,SHEN X R,JIU Z Q,et al.Desalination of macroporous absorption resin on antioxidant peptides from Tilapia skin collagen[J].Modern Food Science and Technology,2013,29(5):1052-1056.
[23] 陈丽丽,赵利,袁美兰,等.大孔吸附树脂对草鱼蛋白水解液脱盐的作用[J].食品科学,2016,37(5):84-88.CHEN L L,ZHAO L,YUAN M L,et al.Desalination of grass carp protein hydrolysate using macroporous adsorption resin[J].Food Science,2016,37(5):84-88.
[24] 邓惠玲,郑炯,阚建全.大孔树脂DA201-C对猪血红蛋白ACE抑制肽吸附性能的研究[J].食品科学,2013,34(12):27-31.DENG H L,ZHENG J,KAN J Q.Macroporous resin adsorption for separation and purification of ACE inhibitory peptides from porcine hemoglobin[J].Food Science,2013,34(12):27-31.
[25] SCHURINK M,VAN BERKEL W J H,WICHERS H J,et al.Novel peptides with tyrosinase inhibitory activity[J].Peptides,2007,28(3):485-495.
[26] WU J J,LIN J C,WANG C H,et al.Extraction of antioxidative compounds from wine lees using supercritical fluids and associated anti-tyrosinase activity[J].The Journal of Supercritical Fluids,2009,50(1):33-41.
[27] ISHIKAWA M,KAWASE I,ISHII F.Combination of amino acids reduces pigmentation in B16F0 melanoma cells[J].Biological &Pharmaceutical Bulletin,2007,30(4):677-681.
[28] HU Z Z,SHA X M,ZHANG L,et al.From fish scale gelatin to tyrosinase inhibitor:A novel peptides screening approach application[J].Frontiers in Nutrition,2022,9:853442.
[29] 朱圣陶,吴坤.蛋白质营养价值评价:氨基酸比值系数法[J].营养学报,1988,10(2):187-190.ZHU S T,WU K.Nutritional evaluation of protein:Ratio coefficient of amino acid[J].Acta Nutrimenta Sinica,1988,10(2):187-190.
[30] 陈昱.碧根果蛋白及降脂蛋白肽的制备、筛选、鉴定与应用研究[D].无锡:江南大学,2022.CHEN Y.Studies on preparation,identification,screening,and application of pecan protein and lipid-lowering peptides[D].Wuxi:Jiangnan University,2022.
[31] DENG Y J,HUANG L X,ZHANG C H,et al.Skin-care functions of peptides prepared from Chinese quince seed protein:Sequences analysis,tyrosinase inhibition and molecular docking study[J].Industrial Crops and Products,2020,148:112331.
[32] ZHANG Y H,ZHANG Y S,LIU X M,et al.Influence of hydrolysis behaviour and microfluidisation on the functionality and structural properties of collagen hydrolysates[J].Food Chemistry,2017,227:211-218.