烤鹅是一种北方特色肉制品,代表产品是起源于黑龙江省对青山镇的对青烤鹅,其具有营养丰富、肥而不腻、肉质鲜嫩等特点,现已成为东北市场畅销产品。企业为了延长烤鹅货架期,通常采用真空包装和冷链运输等方法,但冷链运输成本较高,室温下真空包装烤鹅又极易腐败变质引起胀袋。目前普遍采用真空包装后进行二次杀菌来解决这一问题,但二次杀菌对产品质地及风味均会产生一定不良影响[1]。因此,针对性地分析二次杀菌对烤鹅品质的影响及其胀袋后菌群的多样性,对延长烤鹅货架期及杀菌方式的选择具有重要意义。
基于培养基分离的传统细菌鉴定方法仅能评价细菌总数的1%以下,高通量测序技术对微生物多样性的分析更加深入可靠,可以检测到低丰度属微生物,越来越多地用于监测食品加工、运输和贮藏过程中微生物的群落结构和物种丰度。ZHANG等[2]研究了干腌青鱼贮藏过程中微生物群落多样性、演替及其与脂质氧化的关系;ZHANG等[3]研究了中国传统食品肴肉在真空包装冷藏过程中微生物的群落特征。但尚无采用高通量测序技术分析胀袋真空包装烤鹅微生物多样性的研究,明确烤鹅胀袋后的细菌群落结构有助于加工过程中对产品的品质进行控制。本研究评价了二次杀菌对烤鹅4 ℃贮藏过程中微生物数量和品质变化的影响,并采用高通量测序技术分析了二次高温杀菌对胀袋真空包装烤鹅微生物多样性的影响,为揭示烤鹅胀袋的微生物致腐机理、产品货架期的延长提供理论依据和技术支持。
1 材料与方法
1.1 材料与试剂
样品由黑龙江省当地烤鹅加工企业提供,采用真空包装。平板计数琼脂(plate count agar,PCA)培养基、MRS琼脂(de Man Rogosa Sharpe,MRS)培养基、结晶紫中性红胆盐葡萄糖琼脂(violet red bile glucose agar,VRBGA)培养基,青岛海博生物技术有限公司;BC1370索莱宝总巯基含量检测试剂盒,北京索莱宝科技有限公司;硫代巴比妥酸,Sigma-Aldrich公司;牛血清白蛋白,上海源叶生物科技有限公司;三氯乙酸等其他试剂,国药集团化学试剂有限公司。所有试剂均为分析纯。
1.2 仪器与设备
Specord 210 plus紫外-可见分光光度计,德国耶拿分析仪器有限公司;CR-410色差仪,日本Konica Minolta公司;TA-XT2i质构仪,英国Stable Micro Systems公司;SW-CJ-1 FD超净工作台,苏州安泰空气技术有限公司;PSX智能恒温恒湿培养箱,波莱福科技有限公司。
1.3 实验方法
1.3.1 样品处理
真空包装烤鹅制备工艺流程如下:
生鹅前处理→清洗(水温≤15 ℃)→风干(6~10 ℃,2 h)→老汤卤制(80 ℃,2 h)→冷却至30 ℃→熏烤(300~350 ℃,5 min)→冷却至常温(≤18 ℃)→真空包装
对照组烤鹅:按照上述工艺流程加工后经真空包装的烤鹅产品;二次杀菌组:参考戴妍[1]的方法,对加工真空包装后的烤鹅进行二次高温杀菌(121 ℃,10 min)。所有样品冷链运输回实验室分别进行胀袋试验[(25±2) ℃]和贮藏试验(4 ℃)。胀袋试验:将不同处理组样品置于室温[(25±2) ℃],发现胀袋现象后立即开袋进行细菌群落分析和微生物数量测定;贮藏试验:将不同处理组样品置于4 ℃贮藏21 d,在0、7、14、21 d取样进行微生物数量测定及品质分析。
1.3.2 微生物数量的测定
无菌条件下取烤鹅样品25 g加入225 mL无菌生理盐水后进行拍打均质,取均质液进行连续10倍梯度稀释,选取3个适宜的稀释梯度进行平板计数,37 ℃培养48 h后计数。菌落总数参考GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》;乳酸菌数量参考GB 4789.35—2023《食品安全国家标准 食品微生物学检验 乳酸菌检验》;肠肝菌科数量采用VRBGA测定。
1.3.3 微生物多样性分析
对烤鹅样品中的微生物进行收集,无菌条件下取各处理组烤鹅样品胸、腿和翅3个部位肉样各10 g于200 mL无菌生理盐水中进行拍打均质,结束后进行过滤收集滤液并离心(4 ℃,10 000 r/min,15 min),收集菌体沉淀进行总DNA提取,提取方法参考试剂盒说明书。提取DNA经纯度、浓度检测合格后,对其16S rDNA V3-V4区域进行扩增,PCR产物检测合格后进行回收及文库构建。文库经检测合格后,基于Illumina NovaSeq测序平台对构建文库进行双末端测序。以上总DNA提取、DNA纯度及浓度检测、测序与生物信息学服务委托北京诺禾致源生物信息科技有限公司进行。
1.3.4 品质分析
1.3.4.1 水分含量测定
参照GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。
1.3.4.2 色差测定
采用色差仪进行测定,光源选取D65/2°,反射模式,取样品均匀铺满比色杯,确保没有空隙,测定样品的亮度值L*和红度值a*。
1.3.4.3 硬度测定
选取相同部位切割成大小统一的肉块,采用质构仪HDP/BS探头,测试速率5 mm/s,触发力5 g。
1.3.4.4 pH值测定
参照GB 5009.237—2016《食品安全国家标准 食品pH值的测定》。
1.3.4.5 感官品质分析
参考朱东喜[4]及GB 2726—2016《食品安全国家标准 熟肉制品》的方法,对4 ℃贮藏过程中的烤鹅样品进行感官评价,由受过培训的男女同学各5名分别从色泽、组织结构、滋、气味、油脂析出和总体可接受度5个方面进行感官评价(满分10分,6分以下为不及格),评价标准如表1所示。
表1 真空包装烤鹅贮藏过程中(4 ℃)感官评价标准表
Table 1 Sensory evaluation criteria for vacuum-packed roasted goose during storage at 4 ℃

色泽组织结构滋、气味油脂析出总体可接受度感官评分/分色泽明亮 具有烤鸭本身的色泽肉质紧密 具有弹性滋、气味浓郁 无异味基本无油脂析出接受度高 8 10 色泽较暗肉质较紧密滋、气味较淡少量油脂析出可以接受 6 8 无光泽或存在异色肉质软烂 无弹性有异味或无法品尝油脂析出多难以接受 0 6
1.3.5 蛋白质和脂肪氧化分析
1.3.5.1 蛋白质总巯基含量测定
采用总巯基测定试剂盒进行检测,取1 g样品加入10 mL提取液,冰浴条件下匀浆后进行离心(8 000×g,4 ℃,10 min),取上清后置于4 ℃待测,测定方法参照说明书进行。
1.3.5.2 蛋白质羰基含量测定
取1 g样品于10 mL磷酸盐缓冲液中(0.2 mol/L,0.6 mol/L NaCl,pH 6.5),冰浴条件下进行匀浆后进行离心(13 000×g,4 ℃,15 min),收集上清液待测,测定参考WANG等[5]的方法,370 nm处测定吸光值。双缩脲法测定蛋白质含量,标准曲线采用牛血清白蛋白建立。羰基含量按公式(1)计算:
羰基含量![]()
(1)
式中:ρ,蛋白质质量浓度,mg/mL;D,光程,1 cm;ε,摩尔消光系数,22 000 L/(mol·cm);n,稀释倍数。
1.3.5.3 硫代巴比妥酸反应物(thiobarbituric acid reactive substance,TBARS)值测定
参考HU等[6]的方法,略作修改。称取2.5 g样品与1.5 mL 1%(质量分数)硫代巴比妥酸溶液、8.5 mL 2.5%(质量分数)三氯乙酸溶液混匀后沸水浴反应30 min,冷却后取5 mL上清液加入5 mL氯仿,混匀后离心取上清液测定吸光值A532 nm。TBARS值以单位质量脂质氧化样品中含有丙二醛质量表示,按公式(2)计算:
(2)
式中:V,样品体积,10 mL;M,TBARS的摩尔质量,144.15 g/mol;m,样品质量,g;ε,摩尔消光系数,152 000 L/(mol·cm);I,光程,1 cm。
1.4 数据统计与分析
所有试验指标重复3次,结果表示为“平均值±标准差”。数据统计分析采用Statistix 8.1软件包中Linear Models程序进行,差异显著性分析使用Tukey HSD程序,P<0.05表示差异显著。采用Sigmaplot 12.5软件绘图。测序数据经处理去除嵌合体序列,得到有效数据。以97%的一致性将序列聚类成为操作分类单元(operational taxonomic units,OTUs),并筛选出代表序列进行快速多序列比对。样本复杂度分析(Alpha Diversity)使用Qiime软件(Version 1.9.1)和R软件(Version 2.15.3)进行,包括Chao1、Shannon、Simpson、ACE指数和覆盖度等。
2 结果与分析
2.1 真空包装烤鹅胀袋菌群结构分析
2.1.1 微生物数量变化
将不同处理组真空包装烤鹅置于室温[(25±2) ℃]条件下贮藏,二次杀菌组在第11天发生胀袋,对照组在第6天发生胀袋,分析其微生物数量变化。由表2可知,对照组细菌总数为6.65 lg CFU/g,显著高于二次杀菌组5.74 lg CFU/g(P<0.05),2个处理组的菌落总数均已超过GB 2726—2016《食品安全国家标准 熟肉制品》中规定的最高安全限值,说明此时2个处理组都已经不再适宜食用。真空包装产品内部氧气含量较低,乳酸菌可在厌氧环境大量繁殖,有研究表明真空包装肉制品中,乳酸菌是导致其腐败的主要微生物[7],与本研究结果一致。对照组乳酸菌数量为5.91 lg CFU/g显著高于二次杀菌组(P<0.05),占细菌总数比例(88.87%)也远高于对照组(46.17%),说明乳酸菌可能是对照组样品中的优势微生物,但在二次杀菌组的菌群结构中不占优势。对照组肠杆菌数量也显著高于二次杀菌组(P<0.05),说明二次高温杀菌处理对真空包装烤鹅胀袋微生物的数量影响显著。
表2 胀袋烤鹅的微生物数量分析 单位:lg CFU/g
Table 2 Microbial counts of swollen roasted goose
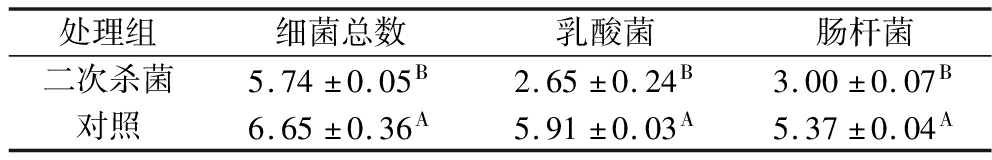
处理组细菌总数乳酸菌肠杆菌二次杀菌5.74±0.05B2.65±0.24B3.00±0.07B对照6.65±0.36A5.91±0.03A5.37±0.04A
注:不同大写字母表示同一列差异显著(P<0.05)。
2.1.2 菌群结构分析
如表3所示,不同样品的覆盖度均达到99.7%以上,说明构建的文库可以真实有效地反应样品微生物数量的多样性。以97%的一致性将序列聚类成为OTUs,二次杀菌组OTUs为564,对照组为663。如图1所示,2个处理组共有OTUs数目为533,占总OTUs数目的76.80%,而对照组与二次杀菌组独有OTUs数目分别为130和31,说明2个处理组的菌群结构存在差异,且对照组物种丰度较大,二次杀菌处理降低了烤鹅中的微生物种类。Shannon和Simpson指数可以评价样品群落的多样性,Shannon指数越高、Simpson指数越低则群落物种多样性程度越高。Chao1和ACE指数常用于评价样品群落物种的丰富度,数值越大群落物种的丰富度越高。对照组的Shannon指数高于二次杀菌组,Simpson指数则低于二次杀菌组,证明对照组细菌菌群多样性高于二次杀菌组。且对照组的Chao1和ACE指数均高于二次杀菌组,对照组烤鹅中的细菌菌群丰富度高于二次杀菌组,说明二次杀菌处理对于胀袋真空包装烤鹅的菌群结构影响显著。
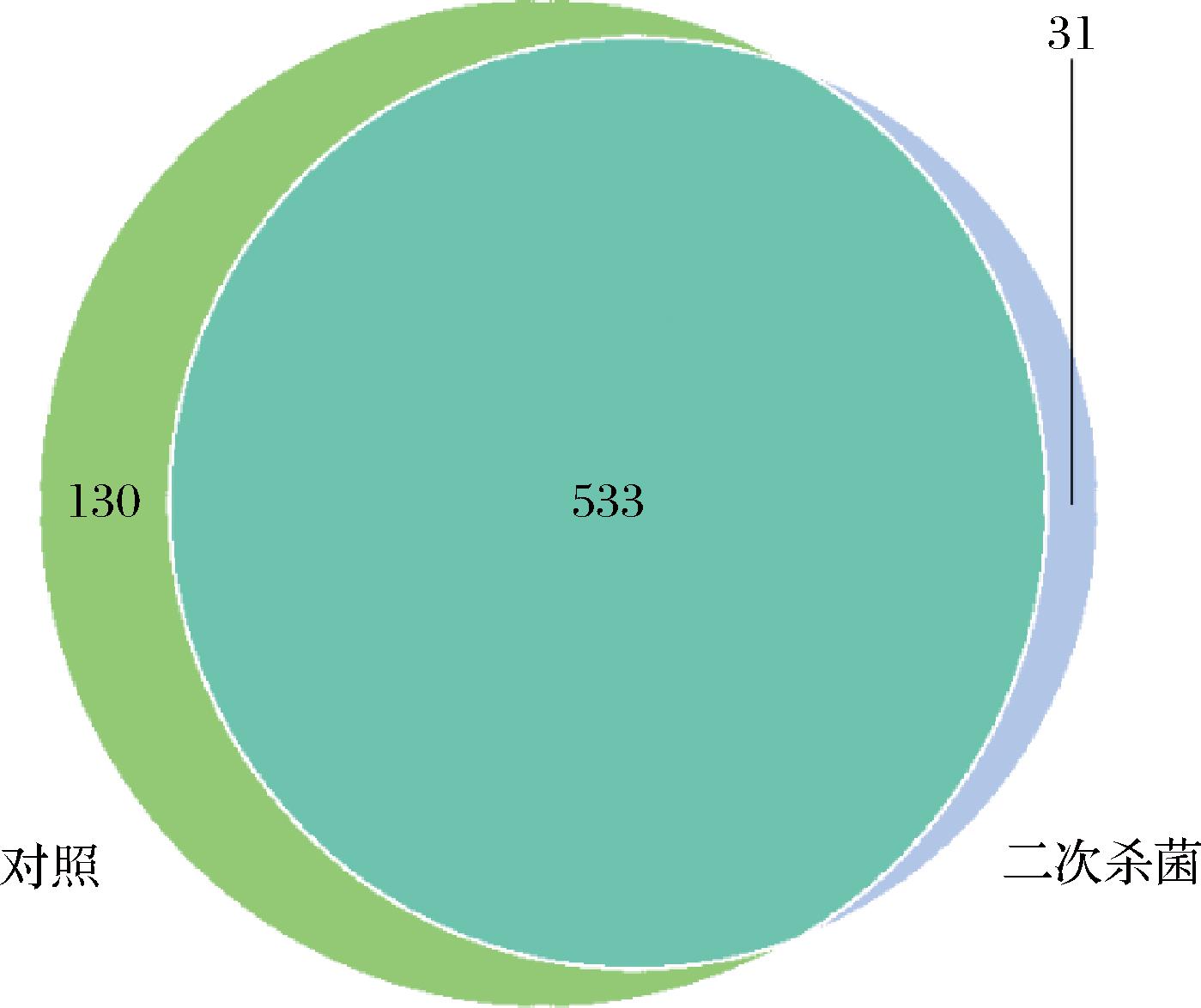
图1 胀袋烤鹅OTUs分布韦恩图
Fig.1 Venn diagram of OTUs distribution of swollen roasted goose
表3 胀袋烤鹅菌群Alpha多样性指数分析
Table 3 Alpha diversity indices of swollen roasted goose
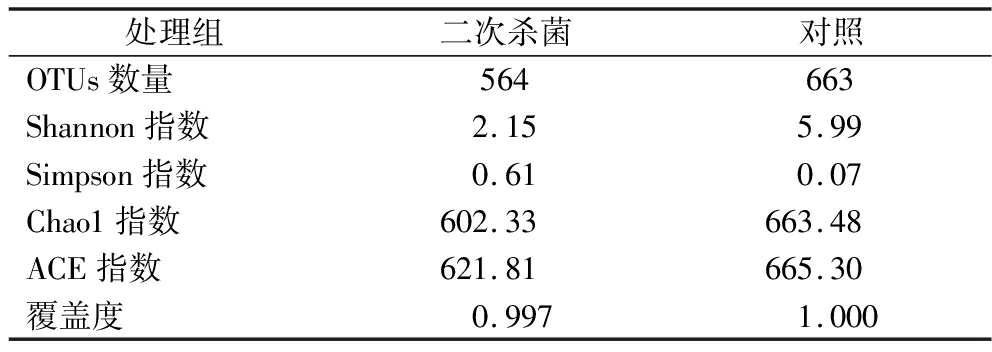
处理组二次杀菌对照OTUs数量564663Shannon指数2.155.99Simpson指数0.610.07Chao1指数602.33663.48ACE指数621.81665.30覆盖度0.9971.000
2个处理组样品共检测到1 227 OTUs,全部属于细菌域。图2所示为相对丰度占比前10的门,其中二次杀菌组在门水平细菌组成较为简单,主要为84.51%的厚壁菌门(Firmicutes)、11.30%的变形菌门(Proteobacteria)和1.96%的放线菌门(Actinobacteria),其余门水平细菌相对丰度均小于1%。对照组在门水平相对丰度超1%的包括厚壁菌门57.22%、变形菌门21.94%、放线菌门10.47%、酸杆菌门(Acidobacteria)3.9%、芽单胞菌门(Gemmatimonadetes)2.03%和绿弯菌门(Chloroflexi)1.8%。说明导致真空包装烤鹅胀袋腐败的细菌可能主要是厚壁菌门,在2个处理组中相对丰度均超过50%,但二次杀菌处理使细菌组成在门水平变得较为简单,相对丰度超过1%的细菌减少。有研究表明厚壁菌门和变形菌门是具有致腐能力的常见菌门[8]。杨鸿博等[9]在研究牛排贮藏过程中也发现厚壁菌门是气调包装和真空包装牛排贮藏末期的优势菌群,与本研究结果一致。
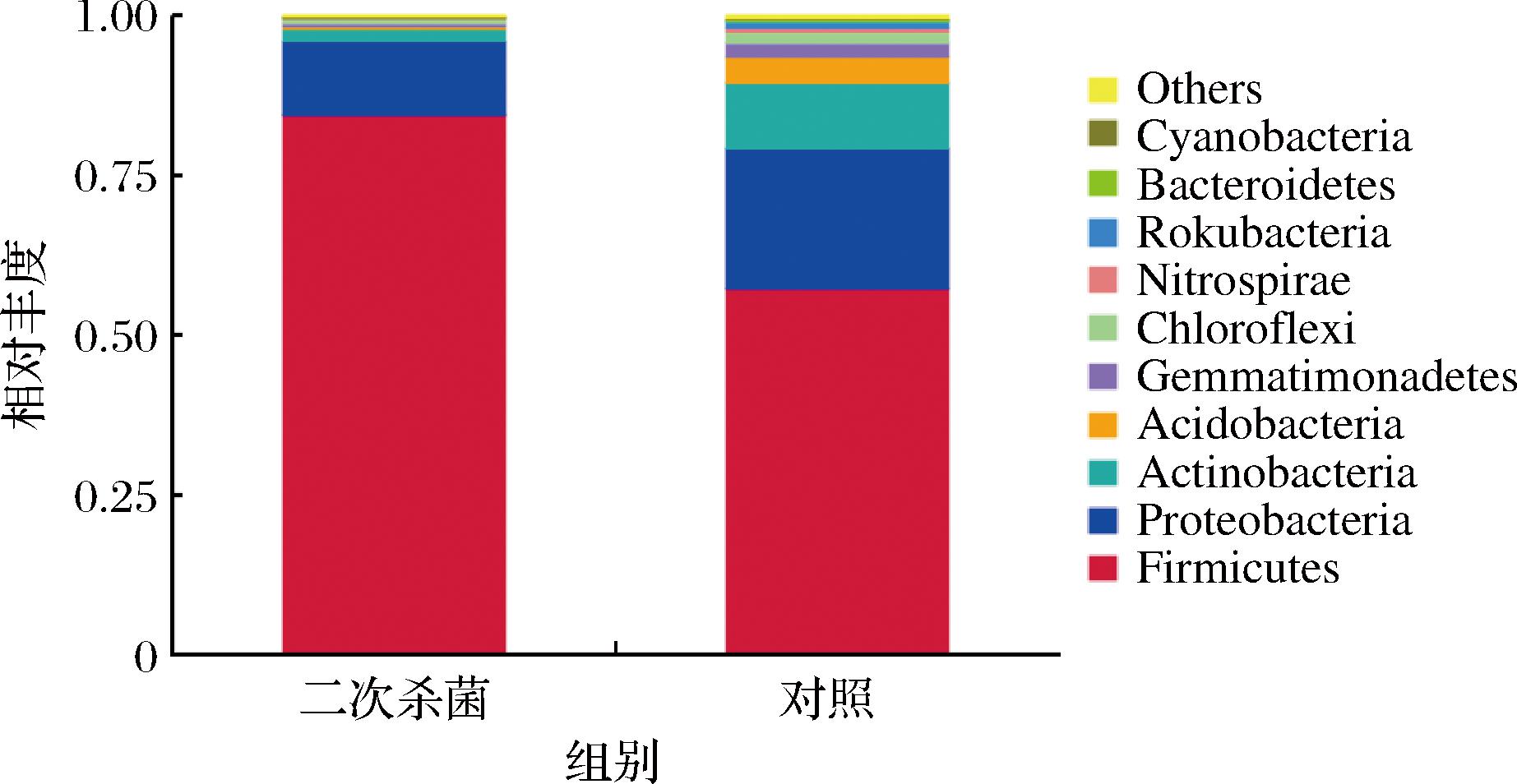
图2 胀袋烤鹅菌群多样性组成分析(门水平)
Fig.2 Bacterial community diversity analysis of swollen roasted goose (phylum level)
注:Nitrospirae:硝化螺旋菌门;Rokubacteria:己科河菌门;Bacteroidetes:拟杆菌门;Cyanobacteria:蓝藻门;Others:其他。
属水平共检测到192个属,图3选取相对丰度占比前30的属进行分析,结果表明属水平上不同处理组真空包装烤鹅胀袋条件下的菌群结构差异较大,优势腐败菌完全不同。二次杀菌组细菌组成较简单,其中类芽孢杆菌属(Paenibacillus)是最主要的优势腐败菌,相对丰度高达77.79%,其余相对丰度超1%的菌属包括假单胞菌属(Pseudomonas)4.39%和葡萄球菌属(Staphylococcus)1.08%。类芽孢杆菌是食品中常见的优势腐败菌,在胀袋食品中也经常发现。李慧等[10]对胀桶番茄酱中的腐败微生物进行分离鉴定,发现主要腐败微生物中包括厚壁类芽孢杆菌(Paenibacilluscineris)。王虎虎等[11]也发现真空包装盐水鹅贮藏末期的优势腐败菌包括类芽孢杆菌属。类芽孢杆菌属原属于芽孢杆菌的分支,具有较强的蛋白质分解能力,芽孢对高温、压力和紫外线等均具有较强的耐受能力,且菌株含有冷适应的相关蛋白,在低温下也可以良好生长,这可能是导致二次杀菌组烤鹅胀袋条件下类芽孢杆菌属相对丰度较高的原因。
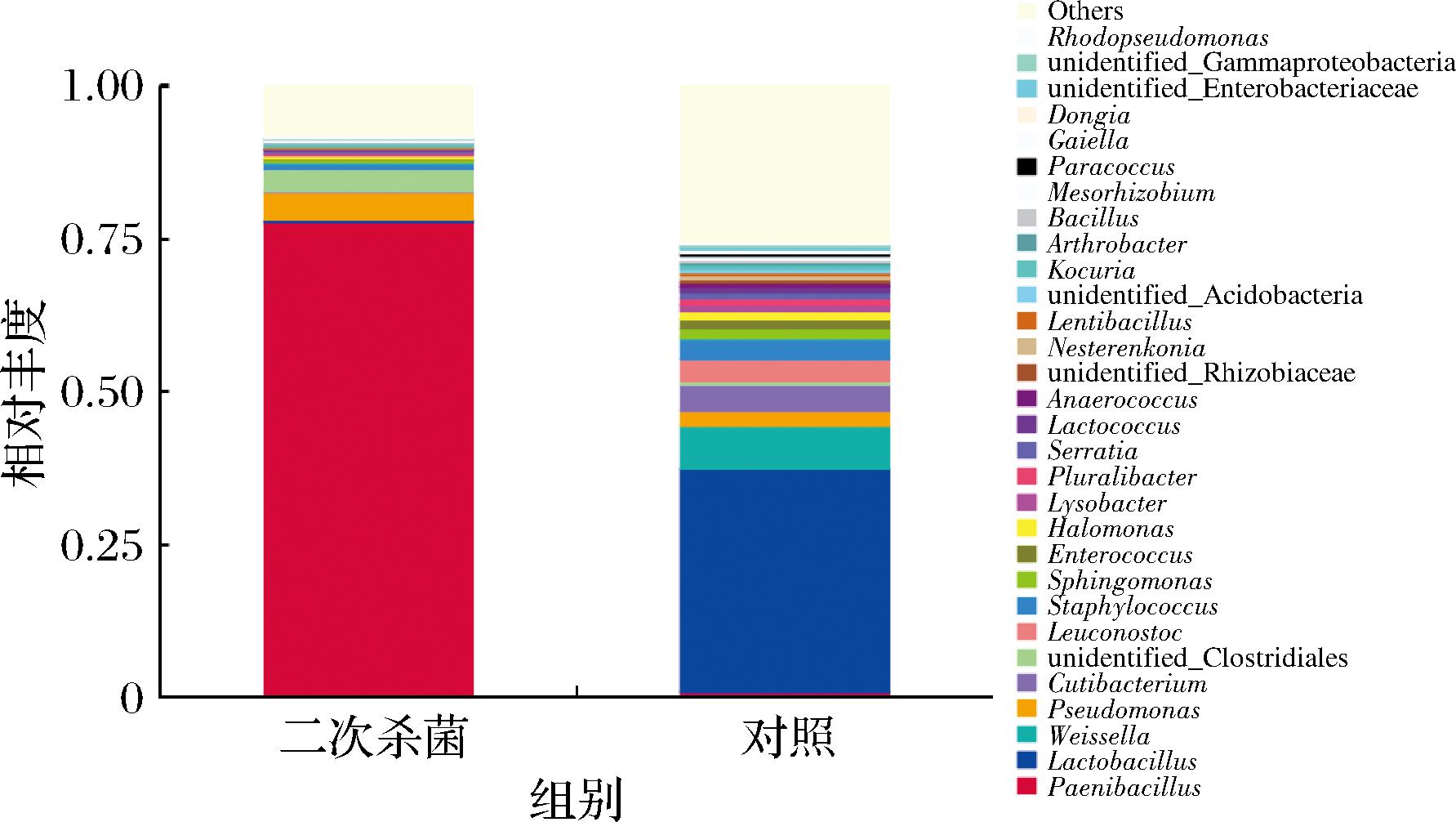
图3 真空包装烤鹅胀袋条件下菌群结构组成分析(属水平)
Fig.3 Bacterial community diversity analysis of swollen roasted goose (genus level)
注:Rhodopseudomonas:红假单胞菌属;unidentified_Gammaproteobacteria:γ-变形菌纲未鉴定属;unidentified_Enterobacteriaceae:肠杆菌科未鉴定属;Dongia:东吉氏菌属;Gaiella:盖氏菌属;Paracoccus:副球菌属;Mesorhizobium:中慢生根瘤菌属;Bacillus:芽孢杆菌属;Arthrobacter:节杆菌属;Kocuria:考克氏菌属;unidentified_Acidobacteria:酸杆菌门未鉴定属;Lentibacillus:慢生芽孢杆菌属;Nesterenkonia:涅斯捷连科氏菌属;unidentified_Rhizobiaceae:根瘤菌科未鉴定属;Anaerococcus:厌氧球菌属;Lactococcus:乳球菌属;Serratia:沙雷氏菌属;Pluralibacter:多源杆菌属;Lysobacter:溶杆菌属;Halomonas:盐单胞菌属;Enterococcus:肠球菌属;Sphingomonas:鞘脂单胞菌属;Staphylococcus:葡萄球菌属;Leuconostoc:明串珠菌属;unidentified_Clostridiales:梭菌目未鉴定属;Cutibacterium:丙酸杆菌属;Pseudomonas:假单胞菌属;Weissella: 魏斯氏菌属;Lactobacillus:乳杆菌属;Paenibacillus:类芽孢杆菌属
对照组属水平细菌组成较二次杀菌组复杂,且与二次杀菌组优势腐败菌差异较大。属水平上相对丰度超过1%的菌属有11个,其中超过2%的菌属分别为乳杆菌属(Lactobacillus)36.60%、魏斯氏菌属(Weissella)6.99%、丙酸杆菌属(Cutibacterium)4.07%、明串珠菌属(Leuconostoc)3.55%、葡萄球菌属(Staphylococcus)3.41%和假单胞菌属(Pseudomonas)2.50%,该结果与乳酸菌数量(表2)检测结果一致。许多研究也表明乳杆菌属、魏斯氏菌属和明串珠菌属是真空包装肉制品中的优势腐败菌[12]。穆罡等[7]采用不同高阻隔包装材料对烤鸭进行真空包装,发现镀氧化硅类、乙烯醇聚合物、聚偏二氯乙烯3种材料真空包装烤鸭的优势腐败菌中都含有乳酸菌菌属、魏斯氏菌属。LI等[13]发现真空包装熏肉贮藏中后期的优势菌为明串珠菌属、贮藏末期的优势菌则主要为乳杆菌属。综上,在门水平及属水平上二次杀菌处理均有助于降低真空包装烤鹅细菌菌群的多样性,且经二次杀菌后胀袋真空包装烤鹅的优势腐败菌为类芽孢杆菌属,与对照组的优势腐败菌完全不同。为了更好地解决真空包装烤鹅腐败胀袋问题,在二次高温杀菌的基础上可以选择结合其他杀菌方式针对类芽孢杆菌属进行抑制,如化学防腐剂的添加等。
2.2 真空包装烤鹅贮藏过程中微生物数量及品质变化
2.2.1 微生物数量变化
表4为真空包装烤鹅4 ℃贮藏过程中微生物数量的变化,结果表明随着贮藏时间的延长,不同处理组样品的细菌总数、乳酸菌和肠杆菌的数量均呈显著增长(P<0.05)。GB 2726—2016《食品安全国家标准 熟肉制品》规定熟肉制品中细菌总数不得超过5 lg CFU/g,贮藏第21天时二次杀菌组样品细菌总数为4.95 lg CFU/g,尚未达到5 lg CFU/g,符合国家标准的要求,而对照组细菌总数为5.29 lg CFU/g,已超过微生物限量,不适合食用。并且在贮藏过程中对照组的乳酸菌和肠杆菌数量也显著高于二次杀菌组(P<0.05),说明二次高温杀菌有助于抑制烤鹅贮藏过程中微生物数量的增长。
表4 烤鹅贮藏过程中(4 ℃)微生物数量的变化 单位:lg CFU/g
Table 4 Microbial counts of roasted goose during storage at 4 ℃
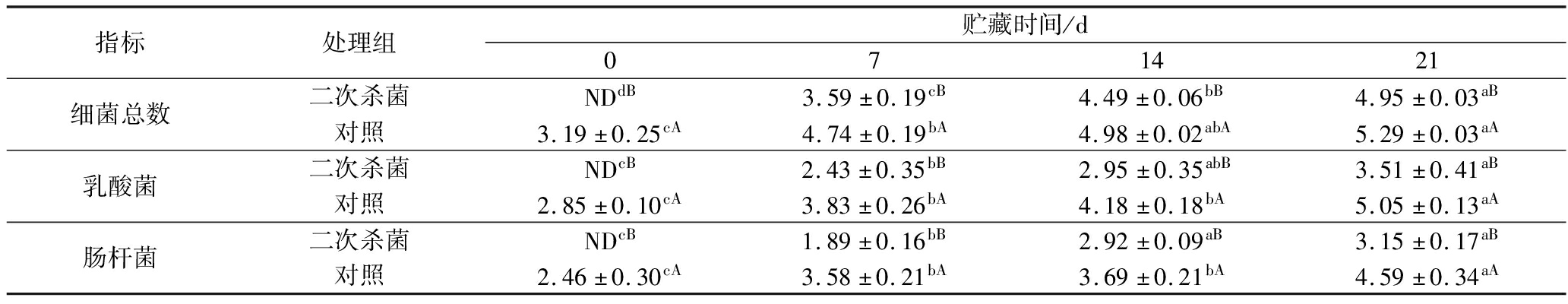
指标处理组贮藏时间/d071421细菌总数二次杀菌NDdB3.59±0.19cB4.49±0.06bB4.95±0.03aB对照3.19±0.25cA4.74±0.19bA4.98±0.02abA5.29±0.03aA乳酸菌二次杀菌NDcB2.43±0.35bB2.95±0.35abB3.51±0.41aB对照2.85±0.10cA3.83±0.26bA4.18±0.18bA5.05±0.13aA肠杆菌二次杀菌NDcB1.89±0.16bB2.92±0.09aB3.15±0.17aB对照2.46±0.30cA3.58±0.21bA3.69±0.21bA4.59±0.34aA
注:不同小写字母表示同一处理组和同一指标,不同贮藏时间差异显著(P<0.05);不同大写字母表示同一指标和同一时间,不同处理组差异显著(P<0.05);ND表示未检出(下同)。
2.2.2 品质变化
表5为真空包装烤鹅贮藏过程中理化品质指标的变化。不同处理组样品水分含量随着贮藏时间延长均呈显著下降趋势,且二次杀菌组水分损失显著高于对照组(P<0.05),这可能是由于高温杀菌处理,肌原纤维蛋白变性严重,表面张力、氢键结合能力和毛细管作用力发生变化,肌肉持水性变差,自由水大量损失,且温度越高损失率越大,增加水分和油脂的析出[14],戴妍[1]也发现二次杀菌处理的盐水鸭水分损失严重。pH值可以反映产品的新鲜程度,对照组和二次杀菌组pH值均随着贮藏时间的延长呈显著下降趋势,其中对照组在贮藏第7天和第14天与二次杀菌组pH值差异并不显著,这可能是由于肌肉组织在微生物酶的作用下分解产生了氨类等碱性物质导致的[15],但在第21天显著低于二次杀菌组,这可能是由于乳酸菌在贮藏后期大量生长繁殖产生乳酸等有机酸导致的。肉色是影响消费者购买产品的最直观指标,不同处理组样品的亮度值L*和红度值a*均随着贮藏时间的延长呈显著下降趋势,二次杀菌组样品的L*和a*均显著低于对照组(P<0.05),肉色的劣变可能是贮藏过程中微生物、脂肪、蛋白质氧化的共同作用的结果[16]。L*的下降可能是由于真空包装烤鹅在贮藏过程中水分和油脂含量逐渐降低所导致的,同时加热处理会使美拉德反应程度增加,肉制品表面的反射率下降,从而影响L*[17]。肌红蛋白的含量及结构对肉色有关键性影响,肌红蛋白虽然具有一定耐热性,但高温(>70 ℃)会使其二、三级结构发生不可逆的变性,温度越高变性越剧烈,因此二次杀菌组烤鹅的a*显著低于对照组样品(P<0.05)。随着贮藏时间的延长,不同处理组烤鹅的硬度均呈显著降低(P<0.05),这可能是由于烤鹅营养丰富,微生物生长繁殖分解蛋白质所导致的。在初期0~7 d,二次杀菌组样品的硬度显著高于对照组(P<0.05),7 d后差异不显著(P>0.05),可能是由于高温处理使得肌肉蛋白质结构发生变化,加剧水分损失所导致的,且高温处理导致蛋白质变性程度加剧也可能是导致硬度增加的原因[18],而贮藏后期差异不显著的原因可能是由于微生物作用肌纤维结构破坏程度较严重。综上,二次高温杀菌虽然可以抑制微生物的生长繁殖,延长产品货架期,但会对产品品质,如水分含量和色差影响较大。
表5 烤鹅贮藏过程中(4 ℃)理化品质的变化
Table 5 Changes in physicochemical properties of roasted goose during storage at 4 ℃
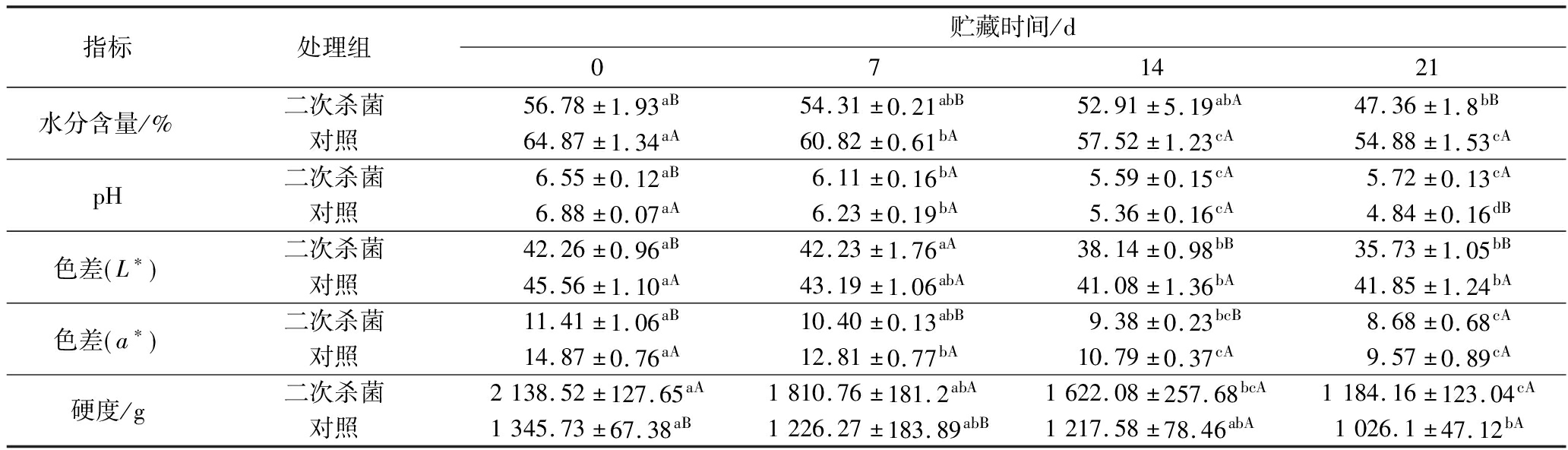
指标处理组贮藏时间/d071421水分含量/%二次杀菌56.78±1.93aB54.31±0.21abB52.91±5.19abA47.36±1.8bB对照64.87±1.34aA60.82±0.61bA57.52±1.23cA54.88±1.53cApH二次杀菌6.55±0.12aB6.11±0.16bA5.59±0.15cA5.72±0.13cA对照6.88±0.07aA6.23±0.19bA5.36±0.16cA4.84±0.16dB色差 L∗ 二次杀菌42.26±0.96aB42.23±1.76aA38.14±0.98bB35.73±1.05bB对照45.56±1.10aA43.19±1.06abA41.08±1.36bA41.85±1.24bA色差 a∗ 二次杀菌11.41±1.06aB10.40±0.13abB9.38±0.23bcB8.68±0.68cA对照14.87±0.76aA12.81±0.77bA10.79±0.37cA9.57±0.89cA硬度/g二次杀菌2138.52±127.65aA1810.76±181.2abA1622.08±257.68bcA1184.16±123.04cA对照1345.73±67.38aB1226.27±183.89abB1217.58±78.46abA1026.1±47.12bA
如图4所示,随着贮藏时间的延长,对照组(图4-a)及二次杀菌组(图4-b)各项感官评价指标均显著降低(P<0.05),但在贮藏初期(0~7 d)二次杀菌组的各项评分均低于对照组,贮藏后期(14~21 d)二次杀菌组各项评分高于对照组或差异不显著(P>0.05)。这可能是由于高温处理对肌肉蛋白质结构和风味物质的变化影响较大,使得产品的初始感官评价得分较低[19],但可以降低产品的初始菌落总数,避免腐败细菌造成的品质劣变。有研究表明真空包装烤牛肉经二次杀菌后品质和风味均低于未杀菌样品[20],与本研究结果一致。

a-对照组;b-二次杀菌组
图4 烤鹅贮藏过程中(4 ℃)综合感官评价结果
Fig.4 Integrated sensory evaluation results of roasted goose during storage at 4 ℃
2.2.3 蛋白质和脂肪氧化
脂肪氧化对肉制品品质及货架期影响较大,TBARS是评价脂肪氧化的常用指标。如表6所示,不同处理组真空包装烤鹅在贮藏过程中TBARS值呈显著升高(P<0.05)。有研究表明加热处理会破坏肌肉组织的纤维膜,脂肪暴露从而氧化加速[21],并且加热温度越高、时间越长TBARS值增长越明显,且二次杀菌处理组烤鹅由于水分损失更严重,盐含量相对升高也可能会增强铁离子的效应而使其产品更易氧化[22]。因此在贮藏初期(0 d)二次杀菌组TBARS值显著高于对照组(P<0.05),而第7天2个处理组的TBARS值差异不显著(P>0.05);在贮藏后期(14~21 d)对照组TBARS值增加更快,显著高于二次杀菌组(P<0.05)。蛋白质的羰基和巯基含量是评价蛋白质氧化程度的重要指标,蛋白质氧化程度与羰基含量呈正相关,与巯基含量呈负相关。不同处理组羰基含量均呈显著上升,总巯基含量呈显著下降趋势(P<0.05)。贮藏初期(0 d)二次杀菌组羰基含量显著高于对照组(P<0.05),这可能是由于高压和加热会破坏蛋白质的三维结构,暴露出了更多的氨基酸残基生成氧化物导致的[23]。总巯基含量为蛋白质表面和内部的巯基总和,贮藏初期(0~7 d)二次杀菌组总巯基含量显著低于对照组(P<0.05),这可能是由于加热使得巯基转变成二硫键以维持结构稳定[24]。但在贮藏中后期,二次杀菌组羰基含量与对照组差异不显著(P>0.05),总巯基含量显著高于对照组(P<0.05),脂肪氧化与蛋白质氧化是互作的,脂肪氧化产生的二级产物会促进蛋白质氧化,这与TBARS结果的是一致的,且与李冉[25]的研究结果一致。适当的蛋白质氧化可以促进风味物质形成,如羰基化合物与游离氨基酸产生美拉德反应,巯基基团与风味化合物的共价结合等。但蛋白质和脂肪氧化程度过高也会影响烤鹅的组织状态和风味,这与感官评价结果一致。
表6 烤鹅贮藏过程中(4 ℃)蛋白质及脂肪的氧化变化
Table 6 Changes in protein and lipid oxidation of roasted goose during storage at 4 ℃

指标处理组贮藏时间/d071421TBARS值/ mg/kg 二次杀菌0.30±0.07cA0.37±0.03cA0.64±0.07bB0.92±0.03aB对照0.16±0.05cB0.32±0.06cA0.84±0.04bA1.09±0.10aA羰基/ nmol/mgprotein 二次杀菌0.63±0.05aA0.79±0.03bA1.21±0.04cA2.06±0.19dA对照0.51±0.04aB0.81±0.04bA1.36±0.10cA2.30±0.14dA总巯基/ μmol/g 二次杀菌53.21±1.44aB50.14±0.27bB41.79±0.94cA37.71±0.57dA对照60.04±0.59aA54.21±1.15bA43.39±1.36cA35.54±0.96dB
3 结论
本研究分析了二次杀菌处理对烤鹅胀袋后微生物多样性的影响,以及对4 ℃贮藏过程中烤鹅微生物数量和品质的变化。结果表明,不同处理组真空包装烤鹅胀袋后的菌群多样性及优势腐败菌完全不同,二次杀菌可以减少微生物种类,以类芽孢杆菌属为主;对照组菌群结构较为复杂,以乳杆菌属和魏斯氏菌属。且加热杀菌可以延长产品的货架期,降低微生物数量,但会对品质产生不良影响。因此,亟须研究开发对真空包装烤鹅品质无影响的靶向抑菌方法,目前部分研究[26]表明天然抑菌物质,如乳酸链球菌素和壳聚糖等可以抑制类芽孢杆菌属的生长繁殖,但化学物质的额外添加对产品的品质和风味可能会存在影响;此外,脉冲电场、超声波和冷等离子体等新型非加热杀菌技术对产品品质影响较小,也具有较好的发展潜力。本研究为此提供了理论基础,有助于烤鹅产品的推广和销售。
[1] 戴妍.二次杀菌南京盐水鸭风味及脂肪氧化的影响分析[D].南京:南京农业大学,2011.DAI Y.Study on changes of flavour and lipid oxidation of Chinese Nanjing cooked ducks during different post production heat treatments[D].Nanjing:Nanjing Agricultural University,2011.
[2] ZHANG Q,CHEN X C,DING Y T,et al.Diversity and succession of the microbial community and its correlation with lipid oxidation in dry-cured black carp (Mylopharyngodon piceus) during storage[J].Food Microbiology,2021,98:103686.
[3] ZHANG Y T,YAO Y J,GAO L F,et al.Characterization of a microbial community developing during refrigerated storage of vacuum packed Yao meat,a Chinese traditional food[J].LWT,2018,90:562-569.
[4] 朱东喜.基于群体感应信号分子AI-2的吴山贡鹅的腐败机制研究[D].合肥:合肥工业大学,2021.ZHU D X,Study on the role of Quorum Sensing signal molecule AI-2 in the spoilage process of Wushan Gong goose[D].Hefei:Hefei University of Technology,2021.
[5] WANG Y,TIAN X J,LIU X Z,et al.Effects of different cooking methods on physicochemical,textural properties of yak meat and its changes with intramuscular connective tissue during in vitro digestion[J].Food Chemistry,2023,422:136188.
[6] HU Y Y,ZHANG L,ZHANG H,et al.Physicochemical properties and flavour profile of fermented dry sausages with a reduction of sodium chloride[J].LWT,2020,124:109061.
[7] 穆罡,罗欣,梁荣蓉,等.不同高阻隔包装材料对烤鸭微生物及菌群多样性的影响[J].食品科学,2020,41(3):171-177.MU G,LUO X,LIANG R R,et al.Effect of different high barrier packaging materials on physicochemical properties and microbial community diversity of roast duck[J].Food Science,2020,41(3):171-177.
[8] 邹灿敏,刘梦遥,钟榕斌,等.不同包装方式对清蒸大黄鱼贮藏过程中品质及菌群的影响[J].肉类研究,2024,38(7):38-47.ZOU C M,LIU M Y,ZHONG R B,et al.Effect of different packaging methods on the quality and microbial community of steamed large yellow croaker during storage[J].Meat Research,2024,38(7):38-47.
[9] 杨鸿博,杨啸吟,张一敏,等.包装方式对牛排贮藏期间微生物数量和演替的影响[J].食品科学,2021,42(13):166-173.YANG H B,YANG X Y,ZHANG Y M,et al.Effect of packaging atmospheres on microbial counts and succession in beef steaks during storage[J].Food Science,2021,42(13):166-173.
[10] 李慧,李赫,陈历水,等.胀桶番茄酱中腐败微生物的分离及鉴定[J].食品工业科技,2019,40(8):90-96.LI H,LI H,CHEN L S,et al.Isolation and identification of spoilage microorganisms in swell barrelled tomato sauce[J].Science and Technology of Food Industry,2019,40(8):90-96.
[11] 王虎虎,董洋,李诺,等.真空包装盐水鹅贮藏期菌群多样性动态分析[J].中国食品学报,2017,17(4):258-264.WANG H H,DONG Y,LI N,et al.Dynamic analysis of microbial community of vacuum-packed salted goose in storage period[J].Journal of Chinese Institute of Food Science and Technology,2017,17(4):258-264.
[12] 李其轩,陈倩,王浩,等.不同包装方式对高水分含量肉粉肠微生物菌群及品质特性的影响[J].食品科学,2021,42(5):237-245.LI Q X,CHEN Q,WANG H,et al.Effects of different packaging methods on microbial community and quality properties of starch-meat sausages with high moisture content[J].Food Science,2021,42(5):237-245.
[13] LI X F,LI C,YE H,et al.Changes in the microbial communities in vacuum-packaged smoked bacon during storage[J].Food Microbiology,2019,77:26-37.
[14] JU REZ M,FAILLA S,FICCO A,et al.Buffalo meat composition as affected by different cooking methods[J].Food and Bioproducts Processing,2010,88(2-3):145-148.
REZ M,FAILLA S,FICCO A,et al.Buffalo meat composition as affected by different cooking methods[J].Food and Bioproducts Processing,2010,88(2-3):145-148.
[15] 李琳,胡子羿,匡柳莎,等.基于Illumina MiSeq测序与相关性分析探究冷鲜宁乡猪肉贮藏过程中微生物及品质的动态变化规律[J/OL].食品工业科技,2025.DOI:10.13386/j.issn1002-0306.2025010024.LI L,HU Z Y,KUANG L S,et al.Exploring the dynamic changes of microorganisms and quality in cold-fresh Ningxiang pork during storage based on Illumina MiSeq sequencing and correlation analysis[J/OL].Science and Technology of Food Industry,2025.DOI:10.13386/j.issn1002-0306.2025010024.
[16] CULLERE M,HOFFMAN L C,DALLE ZOTTE A.First evaluation of unfermented and fermented rooibos (Aspalathus linearis) in preventing lipid oxidation in meat products[J].Meat Science,2013,95(1):72-77.
[17] 付丽,刘旖旎,高雪琴,等.不同杀菌条件对酱牛肉品质的影响[J].肉类研究,2019,33(1):7-13.FU L,LIU Y N,GAO X Q,et al.Effect of different sterilization conditions on quality of spice beef[J].Meat Research,2019,33(1):7-13.
[18] RAHMAN M S,AL-FARSI S A.Instrumental texture profile analysis (TPA) of date flesh as a function of moisture content[J].Journal of Food Engineering,2005,66(4):505-511.
[19] JIANG Q X,HAN J W,GAO P,et al.Effect of heating temperature and duration on the texture and protein composition of Bighead Carp (Aristichthys nobilis) muscle[J].International Journal of Food Properties,2018,21(1):2110-2120.
[20] LI R,WANG C,ZHOU G H,et al.The effects of thermal treatment on the bacterial community and quality characteristics of meatballs during storage[J].Food Science &Nutrition,2021,9(1):564-573.
[21] 郭强.手撕牛肉品质提升工艺研究[D].成都:成都大学,2021.GUO Q,Study on the technology of improving the quality of shredded beef[D].Chengdu:Chengdu University,2021.
[22] RUBIO B,MART NEZ B,DOLORES GARC
NEZ B,DOLORES GARC A-CACH
A-CACH N M A,et al.Effect of the packaging method and the storage time on lipid oxidation and colour stability on dry fermented sausage salchichón manufactured with raw material with a high level of mono and polyunsaturated fatty acids[J].Meat Science,2008,80(4):1182-1187.
N M A,et al.Effect of the packaging method and the storage time on lipid oxidation and colour stability on dry fermented sausage salchichón manufactured with raw material with a high level of mono and polyunsaturated fatty acids[J].Meat Science,2008,80(4):1182-1187.
[23] 王智慧,刘煊,肖天雨,等.超高压与超声处理对克氏原螯虾微观结构、蛋白质氧化及消化特性的影响[J/OL].食品工业科技,2025.DOI:10.13386/j.issn1002-0306.2025010179.WANG Z H,LIU X,XIAO T Y,et al.Effects of ultrahigh pressure and ultrasound treatment on the microstructure,protein oxidation,and digestive properties of Procambarus clarkii[J/OL].Science and Technology of Food Industry,2025.DOI:10.13386/j.issn1002-0306.2025010179.
[24] 郑金月.热杀菌导致猪肉糜乳化凝胶质构劣变的机制及其调控技术研究[D].沈阳:沈阳农业大学,2024.ZHENG J Y.Study on mechanism and regulation technology of thermal sterilization resulting in texture deterioration of pork batter emulsified gel[D].Shenyang:Shenyang Agricultural University,2024.
[25] 李冉.调理猪肉丸贮藏特性及其保鲜技术研究[D].南京:南京农业大学,2021.LI R.Studies on storage characteristics and the preservation technology of prepared pork meatballs[D].Nanjing:Nanjing Agricultural University,2021.
[26] 杨蕾.姜叶提取物/壳聚糖在食品包装膜和草莓保鲜涂液中的应用研究[D].成都:成都大学,2023.YANG L.Application of ginger leaf extract/chitosan composite in food packaging and its preservation coating in strawberry[D].Chengdu:Chengdu University,2023.