宣威火腿是我国传统的腌腊肉制品,其独特品质源于云南宣威地区的传统工艺,以肉质紧实、瘦肉率高、蛋白质含量丰富及口感鲜嫩著称,深受消费者青睐。在火腿的加工过程中,硫氨素降解、氨基酸分解、蛋白质和脂肪氧化、美拉德反应和微生物发酵等对于火腿形成独特的风味起着至关重要的作用[1]。脂肪组织微结构的改变反映出脂肪酶对脂肪的作用[2]。脂质氧化反应能够生成醇类、醛类、酮类等风味化合物,约60%以上的风味化合物源于脂肪的氧化过程[2]。有研究表明,组织蛋白酶B、L、H、D和钙激活中性蛋白酶能使肌肉组织发生蛋白质降解,降解为肽和游离氨基酸等物质,并可以进一步经过Strecker降解和美拉德反应生成风味化合物[3]。股二头肌(biceps femoris,BF)与半膜肌(semimembranosus,SM)是目前火腿中研究比较广泛的2种肌肉[4]。在干腌火腿的加工期间,即使它们所处的条件相同,品质也会产生一定的区别[4]。SM是外部肌肉,在加工的第一阶段会经历更快的脱水和盐摄入。内部肌肉BF在生产过程中表现出比SM更高的含水量和蛋白水解活性[4]。肌肉类型之间的差异导致蛋白水解强度不同[4]。此外,在火腿发酵期间,火腿肌肉发生的脂质氧化和蛋白质氧化会对火腿风味的形成和品质特性产生重要的影响。肌肉部位的不同可能也会导致BF和SM氧化程度不同,进而影响火腿风味的形成。目前,关于宣威火腿不同部位肌肉对其脂质氧化、蛋白质氧化程度的影响,相关研究较少。同时,蛋白质氧化和脂质氧化对宣威火腿风味形成的贡献,现有研究也较为匮乏。因此,研究不同肌肉部位的化学变化以及挥发性化合物对宣威火腿风味的形成十分重要。
近年来,顶空固相微萃取-气相色谱-质谱联用技术(headspace solid-phase microextraction,HS-SPME-GC-MS)和电子鼻已成为分析肉制品风味的常见方法[5]。在各类分析技术中,GC-MS在食品领域的分析中广泛应用,它能够高效且准确地鉴定出样品里的未知化合物[5]。电子鼻作为一种依托于传感器阵列的专业分析设备,具备在多样的环境条件下,对复杂气味进行识别与检测的能力[5]。基于此,本研究以宣威火腿为研究对象,探讨不同部位肌肉(BF和SM)在发酵成熟过程中的脂质氧化和蛋白氧化情况。通过电子鼻分析宣威火腿的整体风味,利用HS-SPME-GC-MS测定挥发性化合物的含量,同时测定品质特性指标进行评价,偏最小二乘法分析宣威火腿发酵成熟过程中的蛋白质氧化和脂质氧化对挥发性化合物形成的贡献。以期深入了解宣威火腿在发酵成熟过程中不同部位肌肉的品质特性和风味变化,为精准调控其风味提供理论依据,促进宣威火腿的标准化和产业化发展。
1 材料与方法
1.1 宣威火腿的加工和取样
参考易永鑫等[6]的工艺,选用同批次12月龄的云南省宣威市本地黑猪的后腿为原料。在11月,将猪腿进行修割定形后分4次上盐,堆码翻压,最终上盐量为11%(质量分数)。腌制2个月后,冲洗猪腿表面的食盐并晾干。随后将猪腿挂于发酵室自然发酵12个月。在宣威火腿发酵阶段(0、6、12个月)各随机选取6只火腿,去除火腿氧化表层约1~2 cm。接着将火腿分割为上、中、下部3个部分,选用上部火腿为原料并将其分割为BF与SM,放-4 ℃冷藏备用。
1.2 材料与试剂
NaCl、三氯乙酸、β-巯基乙醇、十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、硫代巴比妥酸、乙醇、牛血清白蛋白、盐酸胍、5,5′-二硫代-双-(2-硝基苯甲酸)、尿素、NaOH、乙酸乙酯、KCl、8-苯胺基-1-萘磺酸、三羟甲基氨基甲烷(Tris)、溴酚蓝、EDTA、2,4-二硝基苯肼(2,4-dinitrophenylhydrazine,DNPH)(均为分析纯),云南贝斯泰生物科技有限公司;标准品1,2-二氯苯,上海安谱实验科技股份有限公司。
1.3 仪器与设备
pHS-25型pH计,上海雷磁有限公司;HD-3A水分活度测量仪,无锡市华科仪器仪表有限公司;UV-5100B紫外-可见分光光度计,北京普析通用仪器有限责任公司;CR-400色差计,柯尼卡美能达投资有限公司;TA-XT plus C质构分析仪,英国Stable Micro Systems公司;GCMS-QP2020 NX气相色谱-质谱联用仪,日本岛津有限公司;PEN3电子鼻,北京盈盛恒泰科技有限责任公司。
1.4 实验方法
1.4.1 水分含量测定
依据GB 5009.3—2016《食品安全国家标准 食品中水分的测定》。将宣威火腿BF和SM去除脂肪和结缔组织后切碎,分别取2 g切碎的BF和SM样品置于105 ℃烘箱中干燥至恒重,通过重量差计算水分含量。
1.4.2 pH的测定
pH值测定按GB 5009.237—2016《食品安全国家标准 食品pH值的测定》,将宣威火腿BF和SM去除脂肪和结缔组织后切碎,取2 g切碎的火腿样品与8 mL蒸馏水均质混匀,随后过滤,采用pH计测定滤液酸碱度。
1.4.3 水分活度(aw)的测定
参照CHEN等[7]的方法,将宣威火腿BF和SM去除脂肪和结缔组织后切碎,取适量切碎的样品放置于样品池里,使用水分活度仪测定。
1.4.4 颜色测定
参照GUO等[8]的方法,将火腿BF和SM去除脂肪和结缔组织后,使用CR-400色差计测定L*值(亮度)、a*值(红度)和b*值(黄度),校准白板的L*值为83.7,a*值为0.321,b*值为0.338。每个样品重复6次。
1.4.5 质构的测定
根据曹建新等[9]的方法,采用P50探头通过质地剖面分析(texture profile analysis,TPA)模式测定宣威火腿的硬度、弹性、咀嚼性、回复性和内聚性。压缩比例:80%,触发力5.0 g,时间5.0 s,测前速度:1.0 mm/s,测试时速度:5.0 mm/s,测试后速度:5.0 mm/s,时间5.0 s。每个样品重复测定10次。
1.4.6 脂肪氧化程度测定
1.4.6.1 过氧化物值(peroxide value,POV)的测定
参照VARELTZIS等[10]的方法并适当修改,精确称取2.00 g的样品,加入15 mL由氯仿-甲醇(2∶1,体积比)配制而成的溶液高速均质处理30 s。随后添加3 mL 0.5%(质量分数)的NaCl溶液并离心(3 820×g,5 min),取出5 mL下层溶液加入5 mL氯仿-甲醇(2∶1,体积比),充分混匀5 s。再依次加入25 μL的FeCl2溶液以及25 μL 300 g/L的硫氰酸铵溶液,充分混匀5 s。在室温下(25 ℃)静置5 min,取上清液,在500 nm波长的条件下测量其吸光度。通过还原铁粉的吸光度数据绘制标准曲线。标准曲线为:y=0.243 5x+0.018 3,R2=0.999 6,代入样品吸光度即可计算出POV。
1.4.6.2 硫代巴比妥酸反应产物(thiobarbituric acid reactive substances,TBARS)值的测定
按照刘鹏雪等[11]的方法,将火腿BF和SM去除脂肪和结缔组织后切碎,准确称取2.00 g火腿样品,依次加入3.0 mL硫代巴比妥酸反应液及17.0 mL三氯乙酸-盐酸混合提取液,涡旋振荡使其充分混匀后,置于沸水浴中显色30 min。反应结束后立即冰浴冷却,移取5 mL澄清液与等体积氯仿,1 910×g条件下离心10 min分离有机相与水相,取上层水相在532 nm波长处测定上清液吸光度值。TBARS的定量分析以脂质过氧化产物丙二醛(malondialdehyde,MDA)为表征指标,其含量以单位质量(kg)待测样品中MDA质量数(mg)计,TBARS按公式(1)计算:
(1)
式中:A532为溶液的吸光值;m为样品的质量,g;9.48为常数。
1.4.7 蛋白质氧化程度测定
1.4.7.1 肌原纤维蛋白的提取
参考CHEN等[12]的方法提取BF和SM肌原纤维蛋白。将火腿BF和SM去除脂肪和结缔组织后切碎,用4倍体积的冷却分离缓冲液(10 mmol/L Na2HPO4/NaH2PO4,0.1 mol/L NaCl,2 mmol/L MgCl2,1 mmol/L EGTA,pH 7.0,4 ℃)匀浆60 s后提取肌原纤维蛋白。在4 ℃下以3 000×g离心15 min。倒出上清液,沉淀物重复上述步骤2次。然后,将沉淀物混合在4倍体积的NaCl溶液(0.1 mol/L)中,在3 000×g条件下离心15 min,并洗涤3次。在最终洗涤之前,用3层纱布过滤,获得肌原纤维蛋白沉淀物,收集后保存于4 ℃恒温环境,并确保在48 h时效范围内完成后续实验分析。采用双缩脲法测定蛋白质浓度。
1.4.7.2 活性巯基含量的测定
参考CHEN等[12]的方法,取1 mL 2 mg/mL肌原纤维蛋白溶液与8 mL Tris-甘氨酸缓冲液(pH 8.0,含0.1 mol/L Tris、0.09 mol/L甘氨酸、3.2 mmol/L EDTA)充分均质后,于4 ℃,10 000×g离心15 min去除不溶性蛋白。取0.5 mL上清液与0.5 mL 10 mmol/L Ellman试剂[5,5′-二硫代双(2-硝基苯甲酸)]混合,同时设置空白对照(4.5 mL Tris-甘氨酸缓冲液和0.5 mL 10 mmol/L Ellman试剂),于25 ℃避光反应30 min后,采用紫外-可见分光光度计分别在412 nm(特征吸收峰)和540 nm(背景校正)处测定吸光值。
1.4.7.3 羰基含量的测定
参考CHEN等[12]的方法。取1 mL质量浓度为2 mg/mL的肌原纤维蛋白溶液,加入1 mL浓度为10 mmol/L 的DNPH溶液,在室温下反应1 h。以1 mL浓度为2 mol/L的HCl溶液替代DNPH溶液作为对照组。向实验组和对照组中均加入1 mL体积分数为20%的三氯乙酸溶液,然后以8 500×g的离心力离心5 min,倒掉上清液,留下沉淀。将得到的沉淀物用1 mL由乙醇-乙酸乙酯(1∶1,体积比)配制的溶液洗涤3次。把洗涤后的沉淀物置于37 ℃环境中,使其溶解在3 mL浓度为6 mol/L的盐酸胍溶液,保温15 min以确保沉淀完全溶解。随后,离心去除不溶物。在波长为370 nm处测量上清液的吸光度。
1.4.7.4 表面疏水性
参考CHELH等[13]的方法,采用溴酚蓝(bromophenol blue,BPB)法测定表面疏水性。用纯水配制质量浓度为1 mg/mL的BPB溶液。移取1 mL 2 mg/mL SM与BF的肌原纤维蛋白溶液与200 μL的BPB(5 mg/mL)溶液混合,在室温(25 ℃)下反应10 min。接着以4 000×g离心15 min,将离心后的上清液稀释10倍,在595 nm处测定吸光度,记为Abs样品。在对照组实验中,将1 mL磷酸盐缓冲液(含0.1 mol/L NaCl)与200 μL BPB溶液混合,重复上面样品的后续实验步骤进行,测定的吸光度记为Abs空白。肌原纤维蛋白的表面疏水性通过溴酚蓝结合量(BPB bound,μg)进行表示,计算如公式(2)所示:
(2)
1.4.8 电子鼻测定
参照刘红娜等[14]的方法并做适当修改,利用PEN3型电子鼻进行分析。PEN3系统配备10个金属氧化物气体传感器,分别为W1C、W5S、W5C、W1S、W1W、W3C、W6S、W2S、W2W和W3S。称取3.0 g样品,置于20 mL顶空小瓶中,密封后在45 ℃下平衡30 min。仪器气体流速设为200 mL/min,测量时间100 s,每个样本重复测量3次,取平均值用于分析。电子鼻传感器的信号强度特性见电子版增强出版附表1(https://doi.org/10.13995/jcnki.11-1802/ts.042479,下同)。
表1 宣威火腿发酵成熟过程中不同部位肌肉的质构
Table 1 Texture of muscles from different parts of Xuanwei ham during fermentation and ripening
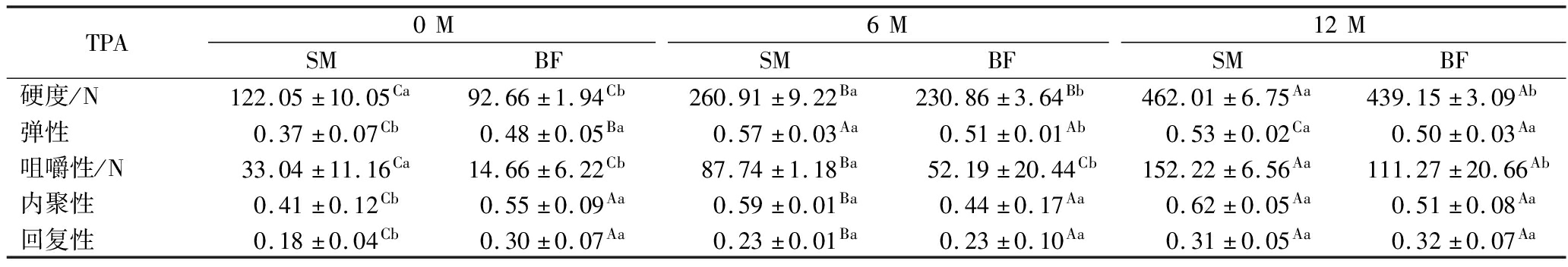
TPA0M6M12MSMBFSMBFSMBF硬度/N122.05±10.05Ca92.66±1.94Cb260.91±9.22Ba230.86±3.64Bb462.01±6.75Aa439.15±3.09Ab弹性0.37±0.07Cb0.48±0.05Ba0.57±0.03Aa0.51±0.01Ab0.53±0.02Ca0.50±0.03Aa咀嚼性/N33.04±11.16Ca14.66±6.22Cb87.74±1.18Ba52.19±20.44Cb152.22±6.56Aa111.27±20.66Ab内聚性0.41±0.12Cb0.55±0.09Aa0.59±0.01Ba0.44±0.17Aa0.62±0.05Aa0.51±0.08Aa回复性0.18±0.04Cb0.30±0.07Aa0.23±0.01Ba0.23±0.10Aa0.31±0.05Aa0.32±0.07Aa
注:不同的大写字母表示不同发酵时间同一部位肌肉之间具有显著差异(P<0.05),不同的小写字母表示同一发酵时间不同部位肌肉之间具有显著差异(P<0.05)(下同)。
1.4.9 挥发性化合物的测定
参考曹建新等[9]的方法采用顶空固相微萃取(headspace solid phase microextraction,HS-SPME)技术提取挥发性化合物和利用GC-MS对挥发性化合物进行定性和定量分析。将BF和SM切碎后在20 mL顶空瓶中放置3.00 g,加入1 μL 1,2-二氯苯(100 mg/L甲醇)内标,聚四氟乙烯密封后于45 ℃水浴振荡平衡10 min,同步完成30 min吸附萃取。GC-MS分析采用DB-WAX毛细管柱(30 m×0.25 mm×0.25 μm),进样口温度250 ℃(分流比1∶5),SPME纤维解吸5 min;程序升温:40 ℃保持2 min,以3 ℃/min升至90 ℃保持5 min,同速率升至200 ℃,再以15 ℃/min升至230 ℃保持10 min;载气为高纯He(1.5 mL/min)。通过NIST 21质谱库匹配(相似度>90%)和线性保留指数对化合物定性,内标法定量计算组分含量。
1.5 数据统计分析
所有试验均重复3次,将得到的数据表示为“平均值±标准差”。采用SPSS 27进行数据统计分析,显著性差异(P<0.05)分析使用Tukey HSD程序,绘图使用Origin 21软件,偏最小二乘法使用The Unscrambler软件。
2 结果与讨论
2.1 宣威火腿发酵成熟过程中不同部位肌肉的水分含量、aw和pH分析
在宣威火腿发酵过程中,水分含量的变化对其品质和口感有显著影响[15]。如图1-a所示,随着发酵时间的延长,火腿中的水分含量逐渐减少(P<0.05)。在同一发酵时间,SM的水分含量显著低于BF(P<0.05)。这可能是因为水分蒸发主要发生在火腿的表面,与BF相比,SM更靠近火腿的表面,因此水分的流失较多[15]。

a-水分含量;b-水分活度;c-pH
图1 宣威火腿发酵成熟过程中不同部位的水分含量、aw和pH
Fig.1 Water content,water activity,and pH of muscles from different parts of Xuanwei ham during fermentation and ripening
注:不同的大写字母表示不同发酵时间同一部位肌肉之间具有显著差异(P<0.05),不同的小写字母表示同一发酵时间不同部位肌肉之间具有显著差异(P<0.05)(下同)。
Aw是表征水与各类非水成分结合紧密程度的指标,相较于水分含量,能更可靠地预测食品的稳定性,也更能切实反映出食品的特性。在宣威火腿中,相对较低的aw利于抑制微生物的生长,进而延长保质期。由图1-b可知,随着发酵时间的延长,aw逐渐下降(P<0.05)。这一变化趋势与水分含量的变化相一致。PETROVA等[16]对挪威干腌火腿的研究表明水分含量以及aw会随着加工时间的延长而降低。同一发酵时间,在发酵0个月和6个月,SM和BF具有显著性差异(P<0.05)。
如图1-c所示,在宣威火腿发酵过程中,宣威火腿所处的环境为酸性。BF和SM的pH均随着发酵时间的延长先显著上升,随后显著下降(P<0.05)。这可能是由于蛋白质和脂质在蛋白酶与脂肪酶的作用下,分别发生分解,生成了胺、氨、碱性氨基酸以及其他碱性风味物质前体[17];随着发酵时间的延长,脂肪水解产生脂肪酸,进而使得pH值降低[18]。
2.2 宣威火腿发酵成熟过程中不同部位肌肉的质构和色差分析
如表1所示,随着发酵时间的延长,BF和SM的硬度和咀嚼性均显著增加(P<0.05)。然而,在内聚性和回复性方面,发酵6个月和12个月的不同部位肌肉之间并无显著差异(P>0.05),弹性方面发酵12个月的不同部位肌肉之间无显著差异(P>0.05)。该结果与刘毕琴等[19]对诺邓火腿质构的研究结果相似,不同发酵时间火腿的弹性、内聚性和回复性均未有明显差异。在同一发酵时间,与BF相比,SM的硬度和咀嚼性显著较高(P<0.05),这可能是由于水分的流失导致宣威火腿的质地发生变化[19]。
颜色是接触食品时的第一感官印象,对食品的品质判断具有重要意义,对于肉制品而言,a*值更能体现肉的品质。如表2所示,随着发酵时间的延长,BF和SM的L*值均显著降低(P<0.05),a*值显著升高(P<0.05)。同一发酵时间,BF的L*值和a*值分别显著高于SM的L*值和a*值(P<0.05)。这可能是由于不同部位肌肉之间的含水量和位置差异,相对于BF,SM水分流失导致肌红蛋白等色素蛋白积累所致[20]。
表2 宣威火腿发酵成熟过程中不同部位肌肉的色差
Table 2 Color of muscles from different parts of Xuanwei ham during fermentation and ripening
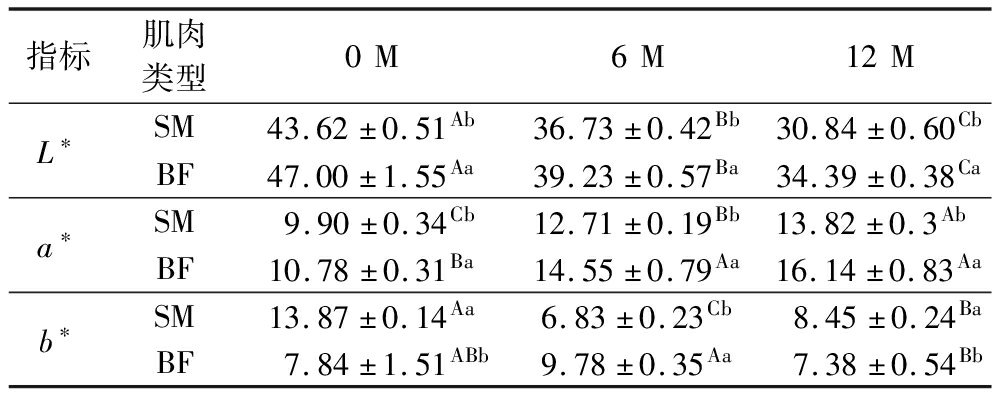
指标肌肉类型0M6M12ML∗SM43.62±0.51Ab36.73±0.42Bb30.84±0.60CbBF47.00±1.55Aa39.23±0.57Ba34.39±0.38Caa∗SM9.90±0.34Cb12.71±0.19Bb13.82±0.3Ab BF10.78±0.31Ba14.55±0.79Aa16.14±0.83Aab∗SM13.87±0.14Aa6.83±0.23Cb8.45±0.24BaBF7.84±1.51ABb9.78±0.35Aa7.38±0.54Bb
2.3 宣威火腿发酵成熟过程中不同部位肌肉POV和TBARS值分析
脂肪氧化是宣威火腿风味物质的重要来源之一,POV是衡量脂质氧化程度的重要指标。由图2可知,随着发酵时间的延长,宣威火腿的POV显著降低(P<0.05),这可能是由于宣威火腿在加工初期产生了大量初级氧化产物的积累,而在后续发酵阶段,这些过氧化物被进一步分解为酸类、醛类和酮类等次级氧化产物,最终导致其含量显著降低(P<0.05)[17]。同一发酵时间,SM与BF的过氧化值存在显著差异(P<0.05)。SM位于火腿外部,O2和食盐的利用率较高,脂肪氧化程度较高,从而使SM的POV降低速率较大。
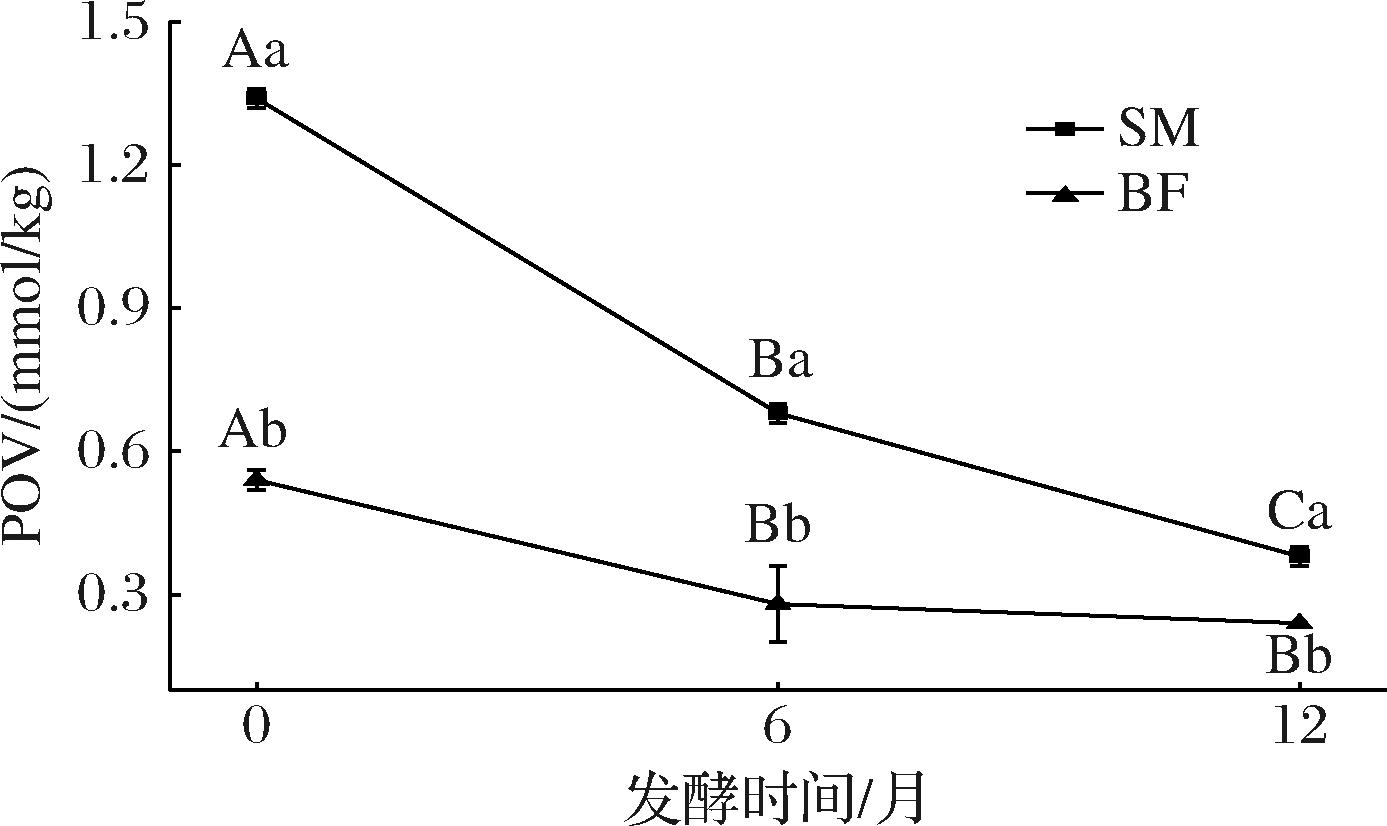
图2 宣威火腿发酵成熟过程中不同部位肌肉的POV
Fig.2 POV of muscles from different parts of Xuanwei ham during fermentation and ripening
氢过氧化物作为脂质氧化反应的初级产物,在后续反应中可进一步降解为醛类、酮类、羧酸和烃类等次级氧化产物。TBARS是常用于检测脂质氧化过程中产生的次级产物的指标。如图3所示,随着发酵时间的延长,TBARS值逐渐增加(P<0.05)。这一现象的产生可能是源于在发酵过程中脂肪酶活性的增强。该酶促过程不仅促进脂肪水解生成大量游离脂肪酸,同时导致不饱和脂肪酸含量上升。这些不饱和脂肪酸在氧化条件下首先生成氢过氧化物,随后氢过氧化物进一步降解为丙二醛等次级氧化产物[21]。在同一发酵时间,SM的TBARS值显著高于BF(P<0.05),表明SM的氧化程度比BF更高。
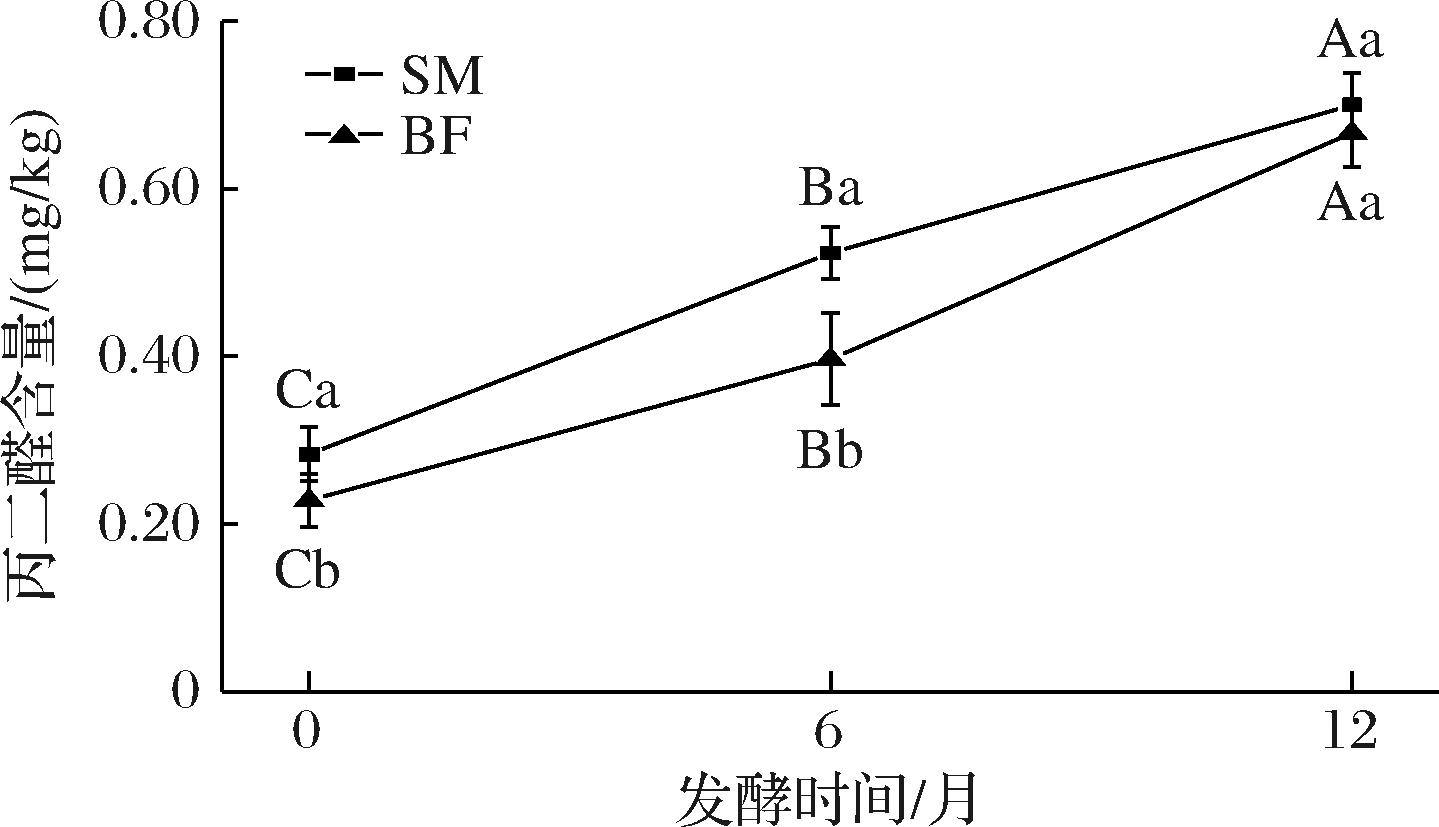
图3 宣威火腿发酵成熟过程中不同部位肌肉的TBARS值
Fig.3 TBARS of muscles from different parts of Xuanwei ham during fermentation and ripening
2.4 宣威火腿发酵成熟过程中不同部位肌肉的肌原纤维蛋白的活性巯基含量分析
蛋白质氧化作为宣威火腿加工过程中的关键生化反应,对其品质特征与风味形成具有双重调控作用。巯基含量的变化在一定程度上可以反映肉制品中的蛋白质的氧化程度,蛋白质氧化后巯基会产生原子间和原子内的二硫键,随着肉制品蛋白质氧化的增加,巯基含量会减少[22]。如图4所示,随着发酵时间的延长,巯基含量逐渐减少(P<0.05)。BF的活性巯基含量从初始的4.73 μmol/mg下降至1.72 μmol/mg。这可能是由于活性巯基在氧化过程中形成了二硫键,从而导致其含量减少[8]。在发酵6个月时,SM和BF存在显著性差异(P<0.05),在其他阶段这种差异并不显著(P>0.05)。这可能是由于在发酵0个月时,火腿处于发酵初始阶段,BF和SM的活性巯基含量均较高,两者初始状态相近,未发生显著氧化导致BF与SM之间差异不显著。在发酵6个月时,活性巯基含量显著下降,氧化速率较高,而SM位于火腿表层,O2渗透率高,加速巯基氧化为二硫键,导致BF与SM之间差异显著;在发酵12个月时,剩余巯基结构稳定(如包埋于蛋白质内部,难以被氧化),微生物活性下降,自由基生成减少,氧化速率趋于一致,导致BF与SM的活性巯基含量差异缩小使BF与SM之间差异不显著[17]。
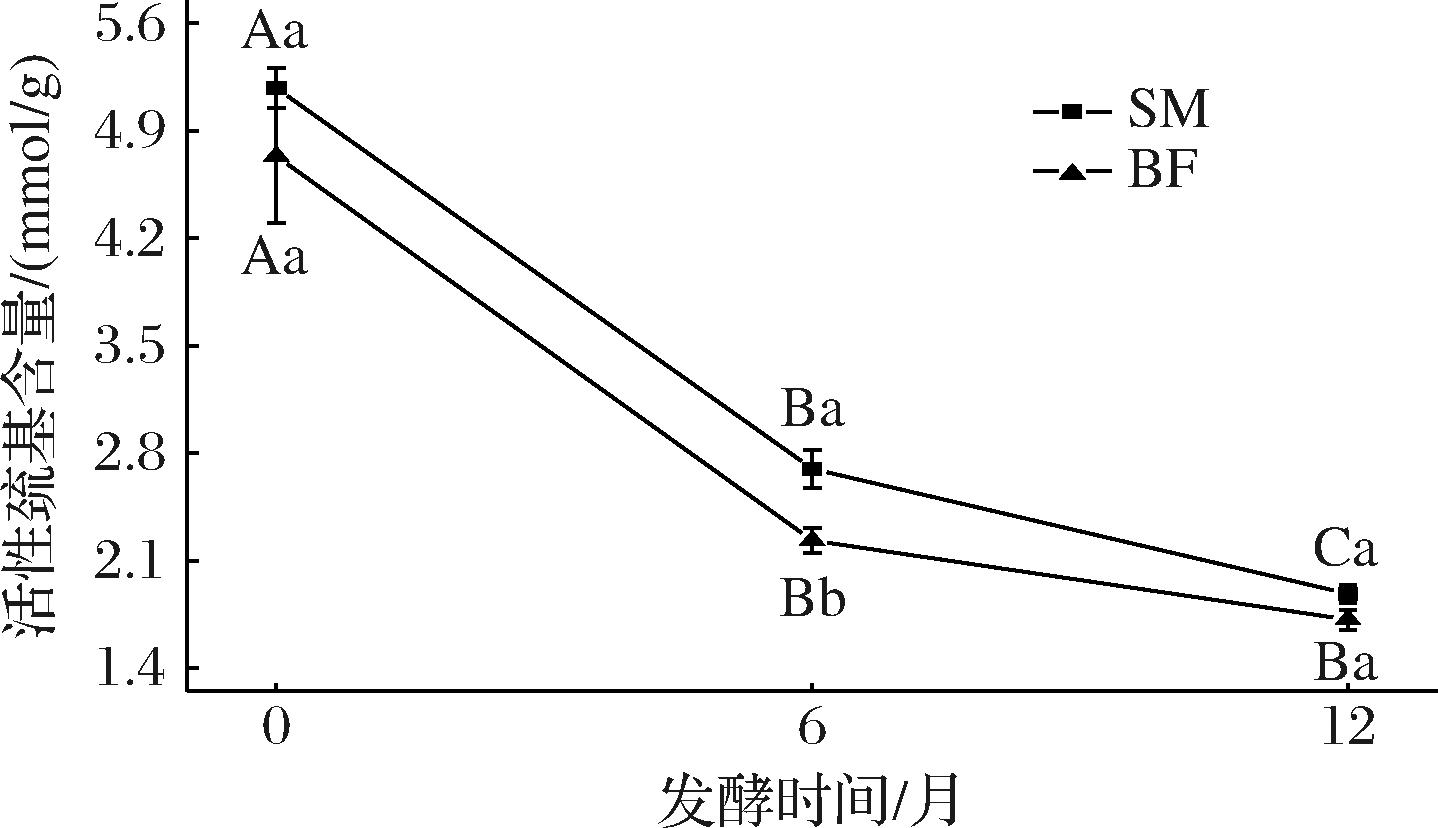
图4 宣威火腿发酵成熟过程不同部位肌肉的活性巯基含量
Fig.4 Contents of active sulfhydryl groups of muscles from different parts of Xuanwei ham during fermentation and ripening
2.5 宣威火腿发酵成熟过程中不同部位肌肉肌原纤维蛋白的羰基含量分析
如图5所示,随着发酵时间的延长,宣威火腿的BF和SM的羰基含量均显著增加(P<0.05)。具体来说,SM从1.78 nmol/mg增长到了2.90 nmol/mg,BF从1.21 nmol/mg上升至2.29 nmol/mg。羰基含量的升高反映了发酵过程中蛋白质的持续氧化过程。一些含侧链氨基酸(如赖氨酸、精氨酸及脯氨酸)通过侧链氧化生成相应羰基产物[23]。此外,α-酰氨基化反应与谷氨酰胺侧链的氧化断裂也可通过肽链降解途径产生羰基化合物,进而导致羰基含量的累积[24]。同一发酵时间的羰基含量,SM显著高于BF(P<0.05),这种差异很可能是因为SM处于相对更接近表面的位置,所以更容易发生氧化反应。
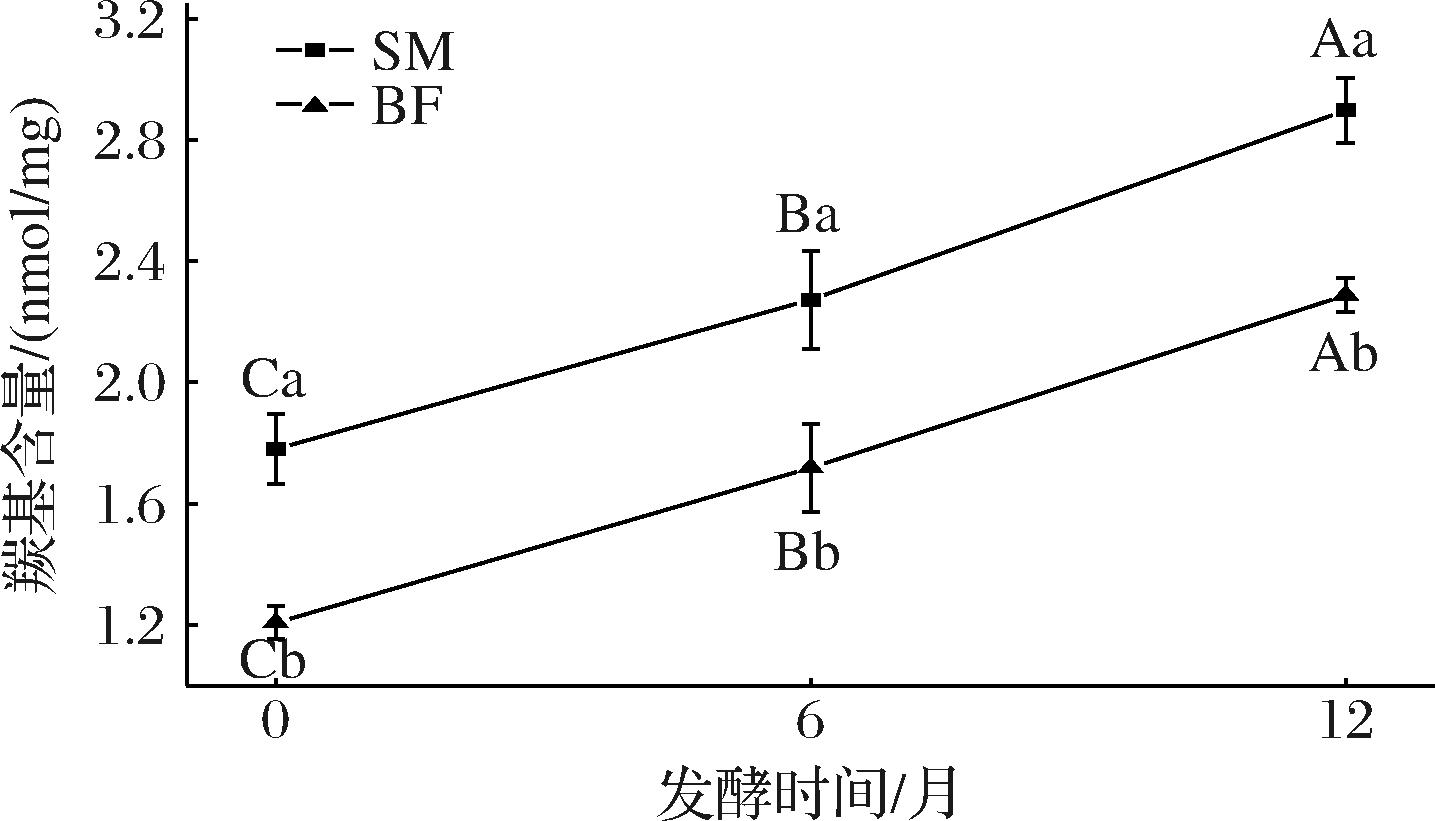
图5 宣威火腿发酵成熟过程中不同部位肌肉的羰基含量
Fig.5 Contents of carbonyl groups of muscles from different parts of Xuanwei ham during fermentation and ripening
2.6 宣威火腿发酵成熟过程中不同部位肌肉的肌原纤维蛋白表面疏水性分析
如图6所示,随着发酵时间的延长,BF和SM的肌原纤维蛋白表面疏水性均显著增加(P<0.05)。这可能是因为在发酵过程中,蛋白质发生了氧化反应,导致其结构破坏。这种结构破坏使得原本包埋在蛋白质内部的疏水性氨基酸残基(如色氨酸、苯丙氨酸)暴露于分子表面,从而显著提高了表面疏水性。肌原纤维蛋白表面疏水性的这一变化情况与广式腊肠在发酵过程中的变化趋势是相契合的[23]。同一发酵时间,SM和BF的表疏水性存在着显著差异(P<0.05)。这或许和肌肉部位中食盐的含量有关[24]。WEN等[25]的研究结果表明,蛋白质的表面疏水性与其食盐添加量存在显著相关性。在宣威火腿加工过程中,由于食盐在不同肌肉部位的渗透作用存在差异,随着发酵时间延长,各部位肌肉的盐含量会产生差异[4]。本研究发现,表面疏水性的变化趋势与羰基含量变化趋势保持高度一致性。
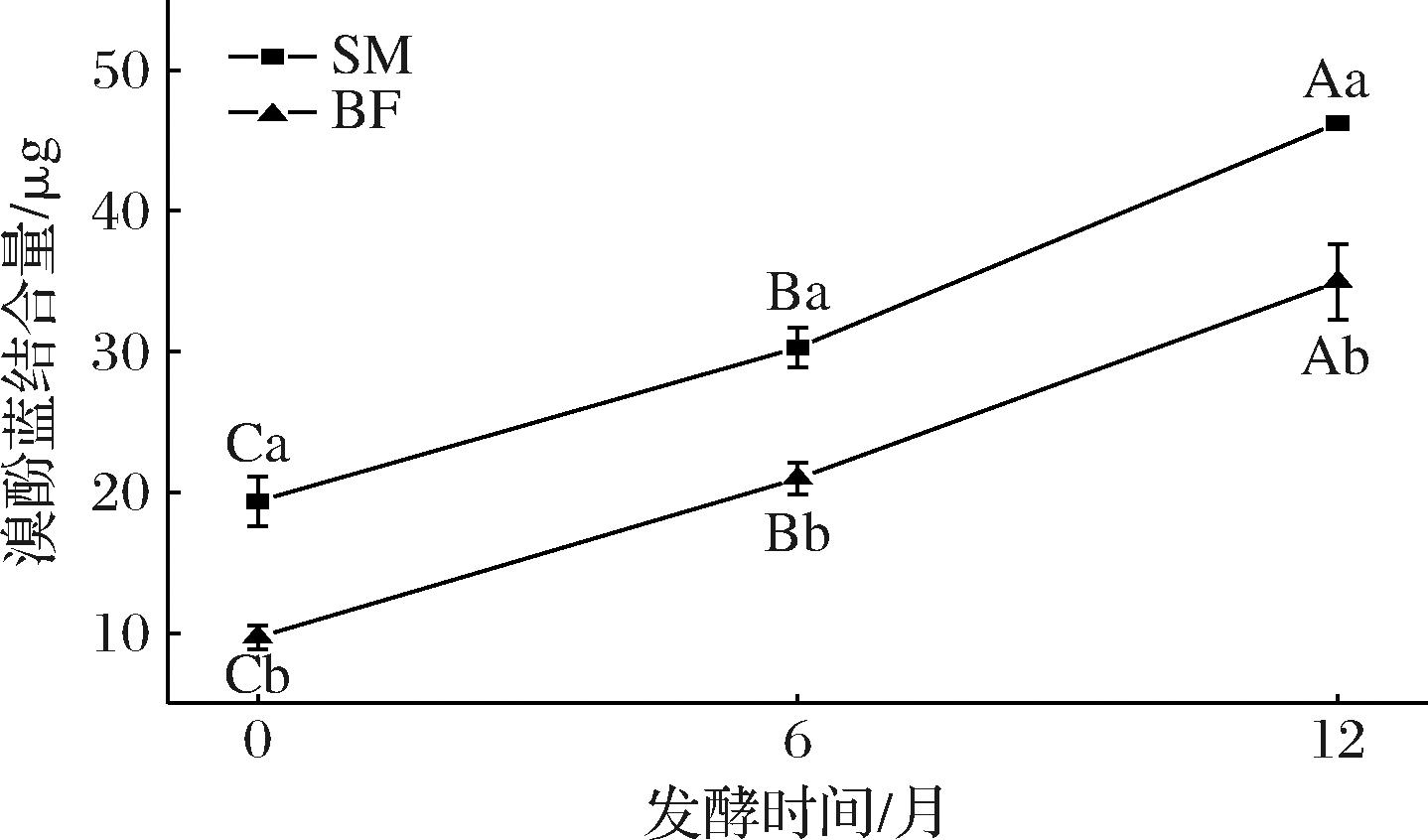
图6 宣威火腿发酵成熟过程中不同部位肌肉的表面疏水性
Fig.6 Surface hydrophobicity of muscles from different parts of Xuanwei ham during fermentation and ripening
2.7 宣威火腿发酵成熟过程中不同部位肌肉的电子鼻分析
电子鼻对于样品的香气极为敏感,挥发性化合物的细微变动,都可能使得传感器的响应数值产生差异。电子鼻结果如图7-a所示。W1S、W2S、W6S传感器对样品有较高响应值,尤其是W1S,说明宣威火腿中酮类、醇类、醛类、甲基类化合物和氢化物对宣威火腿的香气贡献较大。随着宣威火腿发酵时间不断延长,SM的W1S、W2S、W6S传感器的响应数值呈现出逐渐上升的趋势(P<0.05)。而对于BF而言,其W1S、W2S以及W6S传感器的响应数值变化趋势则为先降低而后升高。最终BF和SM在发酵12个月时均达到最高响应值。SM和BF的W1W、W1C、W3C、W2S、W3S、W5C、W5S的传感器的响应值较低,可能是由于这些传感器检测的挥发性物质具有较高的阈值[26]。

a-雷达图;b-主成分分析
图7 宣威火腿发酵成熟过程中不同部位肌肉的电子鼻响应值雷达图和主成分分析
Fig.7 The radar chart of E-nose response data and the principal component analysis of E-nose response data of muscles from different parts of Xuanwei Ham during fermentation and ripening
主成分分析(principal component analysis,PCA)属于一种统计方法,它能够筛选出数据中占据大部分方差的关键成分,以此来实现对大型数据集维度的缩减。结果如图7-b所示。PC1和PC2贡献了总方差的95.4%,说明主成分可以反映宣威火腿加工过程的挥发性气味的全部特征。从样品分布上看,PCA可以很好地区分所有样品。PC1的解释率为80.3%,与W1S、W2S、W6S、W1W、W3S、W5S传感器呈正相关,与W2W、W1C、W3C和W5C传感器负相关;PC2的解释率为15.10%,与W2W、W1C、W3C、W5C、W6S、W3S、W5S传感器呈正相关,与W1W传感器负相关。值得注意的是,发酵12个月的SM与W1S、W2S、W6S、W1W传感器的距离较近,BF与W1C、W3C、W5C传感器距离较近,具有较好的相关性。表明BF中的短链烷烃、氨类、芳香族化合物相对较多,而SM中甲基类、醇类、醛类和酮类、氢化物化合物占主导地位,且响应值较高。
2.8 宣威火腿发酵过程中不同部位肌肉的挥发性化合物分析
挥发性化合物大多是由风味前体物质通过脂质氧化、蛋白质氧化和硫胺素降解等反应形成[27]。对于宣威火腿而言,风味是其关键指标之一,不同的挥发性化合物构成使其具有独特的风味特征。宣威火腿GC-MS检测结果见电子版增强出版附表2,共检测到84种挥发性化合物。尽管所有样品中存在相同的化合物,但电子鼻分析的差异是由于不同样品中主要挥发性化合物之间含量的差异引起的。随着发酵时间的延长,宣威火腿的挥发性化合物含量在不同的时间出现了显著变化。发酵0个月的样品中鉴定出的挥发性化合物种类和数量最少(P<0.05)。宣威火腿的主要风味化合物为醛类、醇类及酯类。
醛类化合物往往呈现出青草和脂肪的气味特征,对宣威火腿风味的形成具有一定的贡献[18],其主要生成途径包括不饱和脂肪酸的氧化,以及苯丙氨酸、亮氨酸等氨基酸的氧化反应。在宣威火腿中,醛类物质的含量最丰富。随着发酵时间的延长,己醛、辛醛和壬醛等一些直链醛在SM以及BF中的含量均上升。而苯甲醛等是支链醛,它是宣威火腿经过蛋白质氧化和Strecker降解反应而形成的[28],其在BF和SM内的含量同样呈现出增长的趋势醇类化合物的形成与脂质氧化有关。通常来说,宣威火腿中的线性醇可能与脂质氢过氧化物密切相关,但其气味阈值较高,从而对宣威火腿的风味和香气影响较小[29]。随着发酵时间的延长,醇类物质的总含量显著增加(P<0.05)。SM和BF的1-辛烯-3-醇、乙醇和己醇的含量相对较高。1-辛烯-3-醇存在于许多种类的干腌火腿中,被视为重要的风味化合物[30]。
酯类是脂肪水解产物(游离脂肪酸)与醇类通过酯化反应生成的化合物,其对宣威火腿的果香、花香等风味特征起着重要作用。随着发酵时间的延长,BF以及SM中酯类物质的总含量呈现出先上升而后下降的趋势(P<0.05)。其中,BF和SM中含量相对较高的酯类物质包括2-甲基丁酸甲酯、丁酸甲酯以及异戊酸甲酯。由于其气味阈值均很低,有助于形成整体香气,赋予干腌火腿一种水果和甜味[31]。在同一发酵时间,发酵6个月和发酵12个月的SM与BF存在显著性差异(P<0.05)。另外,由于受酯类化合物链长的影响,短链和长链脂肪酸分别形成水果和脂肪香气的酯类[32]。
酮类化合物主要来源于脂质氧化与美拉德反应,在肉制品风味形成中发挥着关键作用,其通常呈现青草香气,兼具奶油与果香等特征。不饱和酮不仅贡献动物源性特征风味及植物性脂香,同时作为干腌火腿的重要风味组分,可显著提升其整体风味特性[33]。相较于前面提到的醛类、醇类和酯类这3种风味物质,酮类化合物的含量较低。随着宣威火腿的发酵时间的延长,酮类总量显著增加(P<0.05)。在BF和SM中,含量相对较高的酮类物质有3-羟基-2-丁酮、甲基庚烯酮以及2-庚酮。
共检测出11种烷烃类物质。其在干腌火腿中广泛存在。因为其高阈值,对干腌火腿整体香气的影响相对较小[34]。此外,其余挥发性化合物(如呋喃、酸类、酚类)在宣威火腿中的种类和含量均较少。
2.9 偏最小二乘法分析相关性
通过偏最小二乘法对GC-MS和蛋白质和脂质氧化数据进行建模,以84种挥发性成分为X自变量、蛋白质氧化和脂质氧化相关数据为Y因变量,如图8所示。5个Y变量和大部分X变量位于r2为50%和100%椭圆之间,说明偏最小二乘法模型可以较好解释其相关性。十二烷、2-甲基-3-辛酮、2,3-辛二酮、2,3-戊二酮、庚醇、仲戊醇、异丙醇、乙醇、3-甲基-1-丁醇、苯乙醛、辛醛、2-甲基丁醛、苯甲醛、正丁醛、硬脂烷醛、异戊醛、甲酸辛酯、戊酸甲酯、乙基苯19种物质与脂质和蛋白质氧化呈现显著的相关性。表明在宣威火腿的加工过程中,脂质氧化和蛋白质氧化程度对火腿风味的形成具有重要的作用。
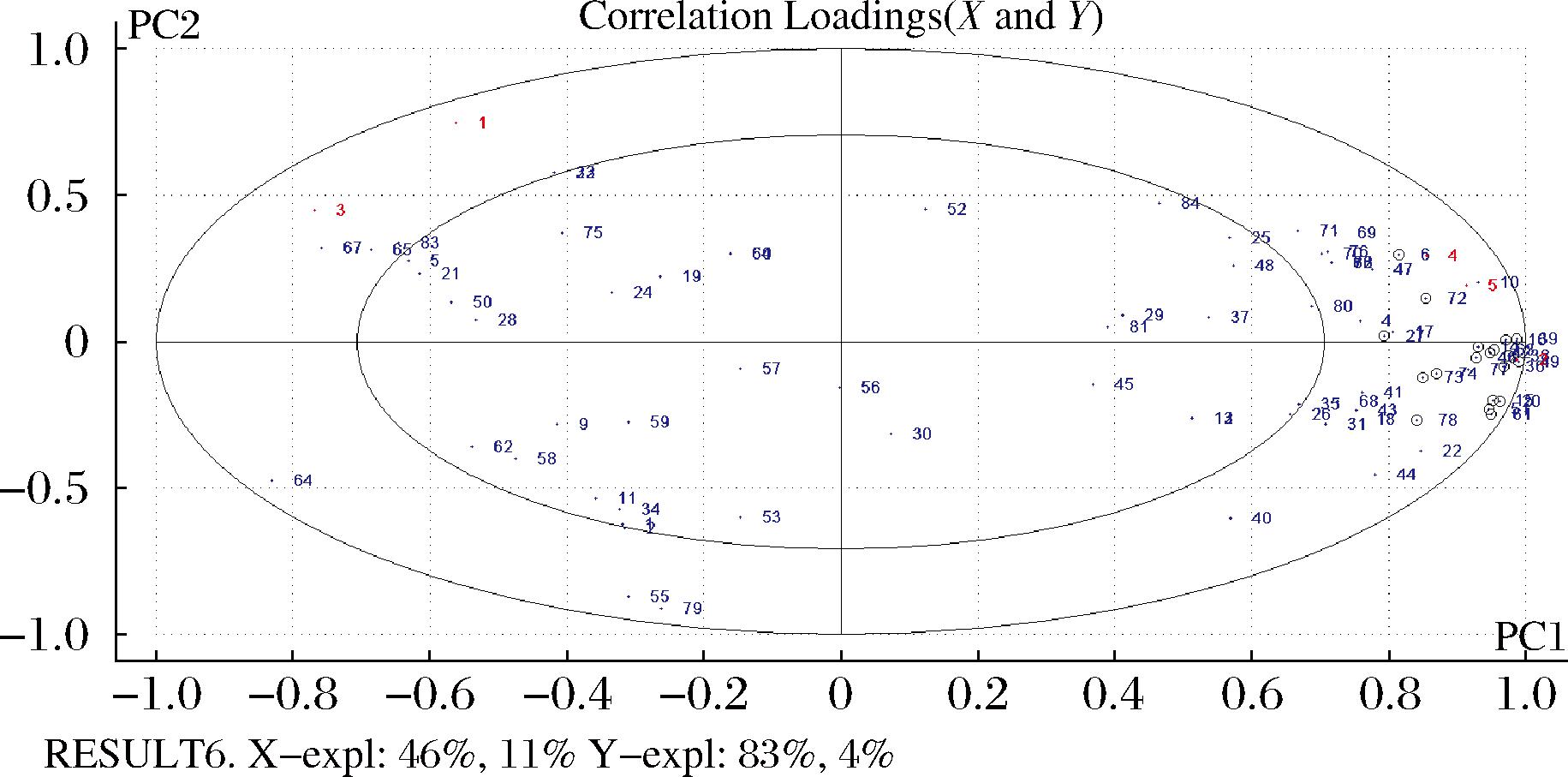
图8 偏最小二乘法评估宣威火腿发酵成熟过程中蛋白质氧化、脂质氧化和挥发性化合物之间的关系
Fig.8 Evaluation of the relationships among proteins,lipid oxidation,and volatile compounds during the fermentation and ripening process of Xuanwei ham using partial least squares analysis
注:图中蓝色编号代表挥发性化合物,同附表2。红色编号代表脂质氧化和蛋白质氧化指标,其中1-POV,2-TBARS,3-活性巯基含量,4-羰基含量,5-表面疏水性。
3 结论
本文通过测定宣威火腿在不同发酵时间和不同部位肌肉的理化指标、蛋白质氧化、脂质氧化和挥发性化合物,通过偏最小二乘法分析宣威火腿发酵成熟过程中蛋白、脂质氧化和挥发性化合物之间的关系。随着发酵时间的延长,宣威火腿的BF和SM中水分含量、aw、L*值、活性巯基含量和过氧化值均呈显著下降的趋势,不同部位肌肉间具有显著性差异。BF和SM的硬度、咀嚼性、a*值、羰基含量、表面疏水性和TBARS值随着发酵时间的延长呈显著上升趋势,BF与SM间差异显著;电子鼻W1S、W2S、和W6S传感器对样品有较高响应值,表明宣威火腿中氢化物等化合物的含量较丰富。相较于BF,SM的风味化合物种类较多。偏最小二乘法进一步分析出19种挥发性化合物与宣威火腿发酵成熟过程中的蛋白质和脂质氧化存在显著相关性。在风味物质的复杂变化规律及形成机制中,脂质氧化与蛋白质的氧化是风味形成的关键途径。本研究可为宣威火腿产业化发展提供理论支持。未来的研究可进一步探究宣威火腿加工工艺参数对氧化-风味形成途径的调控作用,并结合宏基因组学解析微生物群落对特征风味形成的贡献。通过建立“加工条件-生物化学变化-感官品质”的量化模型,优化传统生产工艺,同时利用分子感官组学技术精准识别区域特色风味标记物,为火宣威腿品质标准化与风味定向调控提供理论支撑。
[1] 郭新,卢士玲,王斌,等.中国传统火腿风味分析研究进展[J].粮食与油脂,2019,32(3):18-21.GUO X,LU S L,WANG B,et al.Progress on flavor analysis of Chinese traditional ham[J].Cereals &Oils,2019,32(3):18-21.
[2] 张新亮,徐幸莲.干腌火腿风味研究进展[J].食品科学,2007,28(8):510-513.ZHANG X L,XU X L.Research development of dry-cured ham flavor[J].Food Science,2007,28(8):510-513.
[3] 郑云,郑爽,周天硕,等.肌肉蛋白质降解对发酵肉制品品质影响的研究进展[J].食品工业科技,2023,44(18):476-483.ZHENG Y,ZHENG S,ZHOU T S,et al.Research progress on the effect of muscle protein degradation on the quality of fermented meat products[J].Science and Technology of Food Industry,2023,44(18):476-483.
[4] WANG H Y,YIN X Y,ZHANG L,et al.Insight into the relationship between the causes of off-odour and microorganism communities in Xuanwei ham[J].Foods,2024,13(5):776.
[5] YAO W S,MA S Y,WU H Y,et al.Flavor profile analysis of grilled lamb seasoned with classic salt,chili pepper,and cumin (Cuminum cyminum) through HS-SPME-GC-MS,HS-GC-IMS,E-nose techniques,and sensory evaluation on Sonit sheep[J].Food Chemistry,2024,454:139514.
[6] 易永鑫,王雪敏,向俊,等.腌制剂及冲洗工艺对宣威火腿滋味的影响[J].食品与发酵工业,2024,50(4):85-92.YI Y X,WANG X M,XIANG J,et al.Effects of different curing agents and rinsing processes on taste of Xuanwei hams[J].Food and Fermentation Industries,2024,50(4):85-92.
[7] CHEN L,WANG Z L,JI L L,et al.Flavor composition and microbial community structure of Mianning ham[J].Frontiers in Microbiology,2020,11:623775.
[8] GUO X,WANG Y Q,LU S L,et al.Changes in proteolysis,protein oxidation,flavor,color and texture of dry-cured mutton ham during storage[J].LWT,2021,149:111860.
[9] 曹建新,张璐,殷小钰,等.基于脂质和蛋白质氧化的火腿发酵品质监测方法及应用:中国,CN202311343290.5[P].2024-03-01.CAO J X,ZHANG L,YIN X Y,et al.Ham fermentation quality monitoring method based on lipid and protein oxidation and its application:China,CN202311343290.5[P].2024-03-01.
[10] VARELTZIS P,HULTIN H O,AUTIO W R.Hemoglobin-mediated lipid oxidation of protein isolates obtained from cod and haddock white muscle as affected by citric acid,calcium chloride and pH[J].Food Chemistry,2008,108(1):64-74.
[11] 刘鹏雪,孔保华.亚硝酸钠对自然发酵哈尔滨风干肠微生物生长、脂肪氧化及挥发性化合物的影响[J].食品科学,2018,39(16):74-81.LIU P X,KONG B H.Effect of sodium nitrite on microbial growth,lipid oxidation and volatile compounds in naturally fermented Harbin air-dried sausages[J].Food Science,2018,39(16):74-81.
[12] CHEN Q,KONG B H,HAN Q,et al.The role of bacterial fermentation in the hydrolysis and oxidation of sarcoplasmic and myofibrillar proteins in Harbin dry sausages[J].Meat Science,2016,121:196-206.
[13] CHELH I,GATELLIER P,SANTÉ-LHOUTELLIER V.Technical note:A simplified procedure for myofibril hydrophobicity determination[J].Meat Science,2006,74(4):681-683.
[14] 刘红娜,梁晓琳,田越,等.兰州糟肉加工过程中挥发性风味物质的分析[J].中国食品学报,2023,23(9):356-367.LIU H N,LIANG X L,TIAN Y,et al.Analysis of volatile flavor components in Lanzhou stewed pork with sufu during processing[J].Journal of Chinese Institute of Food Science and Technology,2023,23(9):356-367.
[15] 杨子江,赵娅英,王桂瑛,等.云南5种火腿水分分布与质构特性研究[J].食品安全质量检测学报,2022,13(10):3134-3140.YANG Z J,ZHAO Y Y,WANG G Y,et al.Study on moisture distribution and texture characteristics of 5 kinds of hams in Yunnan[J].Journal of Food Safety &Quality,2022,13(10):3134-3140.
[16] PETROVA I,TOLSTOREBROV I,MORA L,et al.Evolution of proteolytic and physico-chemical characteristics of Norwegian dry-cured ham during its processing[J].Meat Science,2016,121:243-249.
[17] KOUTINA G,JONGBERG S,SKIBSTED L H.Protein and lipid oxidation in Parma ham during production[J].Journal of Agricultural and Food Chemistry,2012,60(38):9737-9745.
[18] LORENZO J M,CARBALLO J.Changes in physico-chemical properties and volatile compounds throughout the manufacturing process of dry-cured foal loin[J].Meat Science,2015,99:44-51.
[19] 刘毕琴,王馨蕊,赵文华,等.不同来源和年份诺邓火腿的理化和呈味性质[J].肉类研究,2021,35(8):1-8.LIU B Q,WANG X R,ZHAO W H,et al.Physicochemical and taste properties of Nuodeng dry-cured hams from different pig breeds and of different ages[J].Meat Research,2021,35(8):1-8.
[20] MOLINERO C,MART NEZ B,RUBIO B,et al.The effects of extended curing on the microbiological,physicochemical and sensorial characteristics of Cecina de León[J].Meat Science,2008,80(2):370-379.
NEZ B,RUBIO B,et al.The effects of extended curing on the microbiological,physicochemical and sensorial characteristics of Cecina de León[J].Meat Science,2008,80(2):370-379.
[21] JIN G F,ZHANG J H,YU X,et al.Lipolysis and lipid oxidation in bacon during curing and drying-ripening[J].Food Chemistry,2010,123(2):465-471.
[22] DENG S Y,LIU Y H,HUANG F,et al.Evaluation of volatile flavor compounds in bacon made by different pig breeds during storage time[J].Food Chemistry,2021,357:129765.
[23] YANG L,LI H J,WU H,et al.Quality relationship between smoked and air-dried bacon of Sichuan-Chongqing in China:Free amino acids,volatile compounds,and microbial diversity[J].Food Research International,2023,164:112274.
[24] 陈紫婷,陈梦婷,孙智达.芬顿反应诱导的肉类蛋白质氧化及干预研究进展[J].肉类研究,2023,37(5):72-80.CHEN Z T,CHEN M T,SUN Z D.Research progress on Fenton reaction-induced meat protein oxidation and its inhibition[J].Meat Research,2023,37(5):72-80.
[25] WEN R X,HU Y Y,ZHANG L,et al.Effect of NaCl substitutes on lipid and protein oxidation and flavor development of Harbin dry sausage[J].Meat Science,2019,156:33-43.
[26] RAM REZ M R,CAVA R.Effect of Iberian×Duroc genotype on dry-cured loin quality[J].Meat Science,2007,76(2):333-341.
REZ M R,CAVA R.Effect of Iberian×Duroc genotype on dry-cured loin quality[J].Meat Science,2007,76(2):333-341.
[27] WU W D,ZHAN J L,TANG X Y,et al.Characterization and identification of pork flavor compounds and their precursors in Chinese indigenous pig breeds by volatile profiling and multivariate analysis[J].Food Chemistry,2022,385:132543.
[28] ZHOU T M,GAO H T,XING B F,et al.Effect of heating temperature and time on the formation of volatile organic compounds during reactions between linoleic acid and free amino acids or myofibrillar proteins[J].International Journal of Food Science &Technology,2022,57(12):7644-7652.
[29] 文志勇,孙宝国,梁梦兰,等.脂质氧化产生香味物质[J].中国油脂,2004,29(9):41-44.WEN Z Y,SUN B G,LIANG M L,et al.Flavour compounds from lipid oxidation[J].China Oils and Fats,2004,29(9):41-44.
[30] LI P,ZHOU H,WANG Z Q,et al.Analysis of flavor formation during the production of Jinhua dry-cured ham using headspace-gas chromatography-ion mobility spectrometry (HS-GC-IMS)[J].Meat Science,2022,194:108992.
[31] 郭新.羊肉火腿加工及贮藏期间风味形成与脂质代谢的研究[D].石河子:石河子大学,2022.GUO X.Study on flavor formation and lipid metabolism during processing and storage of mutton ham[D].Shihezi:Shihezi University,2022.
[32] PETRI EVI
EVI S,MARU
S,MARU I
I RADOV
RADOV I
I N,LUKI
N,LUKI K,et al.Differentiation of dry-cured hams from different processing methods by means of volatile compounds,physico-chemical and sensory analysis[J].Meat Science,2018,137:217-227.
K,et al.Differentiation of dry-cured hams from different processing methods by means of volatile compounds,physico-chemical and sensory analysis[J].Meat Science,2018,137:217-227.
[33] BERM DEZ R,FRANCO D,CARBALLO J,et al.Influence of muscle type on the evolution of free amino acids and sarcoplasmic and myofibrillar proteins through the manufacturing process of Celta dry-cured ham[J].Food Research International,2014,56:226-235.
DEZ R,FRANCO D,CARBALLO J,et al.Influence of muscle type on the evolution of free amino acids and sarcoplasmic and myofibrillar proteins through the manufacturing process of Celta dry-cured ham[J].Food Research International,2014,56:226-235.
[34] 熊哲民,丽蕊,杨江,等.宣恩火腿的加工工艺和品质特性研究进展[J].肉类研究,2021,35(8):64-70.XIONG Z M,LI R,YANG J,et al.Progress in processing technology and quality characteristics of Xuan’en dry-cured ham[J].Meat Research,2021,35(8):64-70.