据统计,自2020年以来,每年虾蟹类产量约在700万~800万t,虾蟹壳质量约为虾蟹的30%~50%。而其中少部分被用于生产甲壳素及其衍生物,大部分被当作垃圾直接丢弃或填埋,资源化程度较低[1]。这种处理方式不仅造成了虾蟹壳中生物活性物质如壳聚糖、虾青素、蛋白质、碳酸钙等的浪费,还导致了环境污染。虾青素是一种天然存在于虾蟹壳中的脂溶性酮式类胡萝卜素,以其卓越的自由基和活性氧清除能力被誉为“抗氧化之王”[2]。虾青素存在多种异构体,包括2种几何异构体和3种手性异构体,几何异构体中全反式抗氧化活性高于顺式异构,手性异构体中内消旋体活性较弱,左旋式抗氧化活性最强,右旋异构稍弱[3]。目前,工业化生产虾青素的方法主要包括雨生红球藻/工程菌发酵及人工合成。天然虾青素主要来源于雨生藻类植物,甲壳类动物通过摄食这些植物将其积累在体内。一般来说,虾蟹壳中的虾青素含量大约在0.1%~0.8%,以左旋全反式异构体为主,相比人工合成内消旋异构占比较高的虾青素具有更高的生物活性、吸收利用率和稳定性[4]。从虾蟹壳中提取虾青素的现有技术主要包括碱提法、油溶法、有机溶剂法、酶解法和超临界CO2提取法等。然而,强酸强碱条件容易导致虾青素氧化分解,而常用的有机溶剂如丙酮、苯、乙醇等存在毒性、成本高、提取效率低等问题[5-7]。因此,作为虾蟹壳废弃物资源化的重要途径之一,亟需研发绿色、环保、高效的虾青素提取技术。
深共晶溶剂(deep eutectic solvent,DES),又名低共熔溶剂,是由氢键受体(hydrogen bond acceptor,HBA)和氢键供体(hydrogen bond donor,HBD)组成的共晶混合物,是一种十分适合生物活性物质提取的低毒性、低成本、绿色可持续溶剂[8-10]。DES可以分为亲水性DES和疏水性DES,前者通常由极性组分(如氯化胆碱、尿素、甘油等)组成,易溶于水,适用于极性物质的提取和溶解。而疏水性DES通常由非极性或弱极性组分(如胺类、酚类、长链脂肪酸等)组成,难溶于水,适用于非极性或疏水性物质的提取和分离[11]。相比亲水性DES,疏水性DES通常具有更低的黏度,在提取中表现出更高的传质效率和可操作性。ZHANG等[12]曾运用氯化胆碱和1,2-丁二醇组成的亲水性DES从虾蟹壳中提取虾青素,而运用疏水性DES提取虾青素的研究较少。
本研究采用可食用的百里香酚和油酸分别作为HBA和HBD构成疏水性DES溶剂,结合超声辅助技术,提取虾蟹壳中的虾青素。对比不同百里香酚/油酸摩尔配比DES的理化性质,通过单因素和响应面法优化料液比、超声功率与时间,以提取量为评价指标确定最优提取条件。通过扫描电子显微镜(scanning electron microscope,SEM)观察虾蟹壳粉末DES提取和丙酮提取后的微观结构,比较不同提取方法对结构的破坏程度。以传统丙酮提取和化学合成的虾青素为对照,对比考察超声辅助深共晶溶剂提取获得的虾青素DPPH自由基体外抗氧化活性,并比较虾青素在DES与丙酮中保存的热稳定性、光照稳定性和pH稳定性。
1 材料与方法
1.1 材料与试剂
干制虾蟹壳,福建乡艾廊海鲜产品有限公司;百里香酚,上海泰坦科技有限公司;油酸,上海阿拉丁生化科技股份有限公司;丙酮,国药试剂有限公司;虾青素(96.5%,化学合成),上海麦克林科技有限公司。所有化学试剂均为分析纯。
1.2 仪器与设备
NE-500Z超声波细胞破碎仪,上海方需科技有限公司;DK-S24电热恒温水浴锅,上海森信实验仪器有限公司;HWCL-5恒温磁力搅拌器,郑州长城科工贸易有限公司;PHS-3C pH计,上海雷磁仪器厂;HR20流变仪,美国TA仪器沃特斯公司;DIGICEN 21R高速离心机,日本Hitachi公司;Nicolet6700傅里叶变换红外光谱仪,美国TA仪器公司。
1.3 实验方法
1.3.1 DES的制备
以百里香酚为HBA、油酸为HBD,按照摩尔比1∶3、3∶1、1∶1加入到烧杯中,在60 ℃、转速500 r/min下,磁力搅拌10 min,得到的DES分别命名为DES-1,DES-2,DES-3。最终液体呈澄清透明状,冷却后置于室温备用。
1.3.2 DES理化性质测定
1.3.2.1 DES极性测定
参考GUAN等[13]的方法,以尼罗红染料作为荧光探针测定DES最大波长并计算极性。配制1 mg/mL尼罗红乙醇溶液,4 ℃避光贮存,使用时稀释10倍后取1 mL添加到9 mL的DES中,采用紫外-可见分光光度计在400~700 nm波长进行光谱扫描,记录最大吸收波长。按公式(1)计算DES极性。
DES极性=H×C×NA/λmax=28 591/λmax
(1)
式中:H为普朗克常数;C为光速;NA为阿伏加德罗常数;λmax为最大吸收波长。
1.3.2.2 pH测定
室温下使用pH仪测定DES溶液pH值。
1.3.2.3 黏度
室温下使用黏度计测定DES溶液黏度。
1.3.3 DES傅里叶变换红外光谱(Fourier transform infrared spectroscopy,FTIR)分析
参考刘宇航等[14]的方法。百里香酚样品压片:取3 g KBr用玛瑙研钵研磨成均匀粉末,加入0.03 g百里香酚继续研磨至无明显颗粒,使用压片机将粉末压片。油酸和DES样品压片:取适量KBr研磨成均匀的粉末并压片,油酸或DES分别均匀滴加到KBr薄片上晾干后待测。
将样品压片置于傅里叶变换红外光谱仪样品池中,扫描范围4 000~400 cm-1,扫描次数32次。
1.3.4 虾蟹壳预处理
虾蟹壳清洗→50 ℃烘箱烘干→粉碎机粉碎→200目筛网过筛→ 2 mol/L盐酸溶液中(1∶20,g∶mL)脱矿1 h→纯水洗涤至中性→50 ℃烘箱中烘干备用
1.3.5 超声辅助深共晶溶剂法提取虾青素及条件优化
1.3.5.1 单因素试验设计
通过单因素法研究虾蟹壳/DES料液比、超声功率和时间对超声辅助深共晶溶剂法对虾蟹壳中提取量的影响,以组成DES的百里香酚、油酸,以及虾青素提取使用较广泛的丙酮作为对照。
料液比:设定超声时间为 60 min,超声功率400 W,料液比(g∶mL)分别为1∶10、1∶15、1∶20、1∶25、1∶30,研究虾蟹壳/DES料液比对虾蟹壳中虾青素提取量的影响。
超声功率:设定料液比为1∶20(g∶mL),超声时间60 min,超声功率分别为100、200、300、400、500 W,研究不同超声功率对虾蟹壳中虾青素提取量的影响。
超声时间:设定料液比为1∶30(g∶mL),超声功率为400 W,超声时间分别为0、30、60、90、120 min,研究不同超声时间对虾蟹壳中虾青素提取量的影响。
1.3.5.2 响应面试验设计
为确定提取虾青素的最佳工艺条件,在单因素试验的基础上,采用Box-Behnken Design响应面法,选取料液比(A)、超声时间(B)、超声功率(C)3个对响应值(提取量)有显著影响的因子作为试验因素,以虾青素提取量(Y)作为输出响应指标。将单因素试验确定的最优值设定为0水平,各响应面因素水平编码如表1所示。
表1 响应面试验水平因素表
Table 1 Response surface experiment factor

因素编码水平-101A料液比/ g/mL 1∶151∶201∶25B超声时间/min306090C超声功率/W300400500
1.3.6 紫外-可见分光光度计法检测提取液虾青素含量
参考LIU等[15]的方法测定提取液中的虾青素含量。精确配制梯度质量浓度为0.8、1.6、2.4、3.2、4.0 μg/mL的虾青素标准品溶液,在λ=475 nm处通过紫外-可见分光光度计测标准品的吸光值并绘制成虾青素标准品的标准曲线。通过拟合分析,得到标准曲线的回归方程为Y=0.127 3x+0.020 9,相关系数R2=0.999 1。
将各提取液置于475 nm波段下检测吸光度,按照标准曲线计算浓度后,根据提取所用虾蟹壳质量,计算虾青素提取量。提取量按公式(2)计算:
(2)
式中:A为虾青素提取量,μg/g;OD为在475 nm波段下检测的吸光度值;X为稀释倍数;m为虾蟹壳质量,g。
1.3.7 DPPH抗氧化活性
以DPPH自由基清除效率评价虾青素提取液的抗氧化活性。取0.05 mg/mL超声辅助深共晶溶剂法提取的虾青素溶液80 μL加入到120 μL 0.1 mmol/L DPPH乙醇溶液中。充分混匀后,避光静置30 min。测定百里香酚/油酸溶剂的DPPH自由基清除率作为空白对照,并与有机溶剂丙酮提取获得的虾青素和化学合成的商品化虾青素进行对比。使用紫外分光光度计在517 nm 波长下测定每种溶液的吸光度。DPPH自由基清除率计算如公式(3)所示:
(3)
式中:D为DPPH 自由基清除率,%;A1为DPPH乙醇溶液的吸光度;A2为DPPH的虾青素溶液的吸光度。
1.3.8 虾蟹壳提取残渣的SEM观察
将未经虾青素提取的虾蟹壳残渣、DES-2提取后和丙酮提取后的虾蟹壳残渣置于150 ℃烘箱中烘干后,用导电胶带固定于载物台上,喷金处理使样品具有导电性,于SEM下观察,工作电压为5.0 kV,放大倍数为1 000倍,比较不同提取方法对虾蟹壳残渣微观结构的影响。
1.3.9 虾青素稳定性研究
精确配制含有5.0 μg/mL虾青素的DES-2溶液和虾青素丙酮溶液,按照1.3.6节的方法分别测试不同处理后溶液中虾青素的剩余量以评估其对光、热和pH的稳定性。
1.3.9.1 热稳定性
为测试2组溶液中虾青素的热稳定性,将2组样品溶液分别在20、30、40、50、60、70、80 ℃的水浴锅中避光保存3 h,每隔0.5 h测试溶液中虾青素的含量。
1.3.9.2 光稳定性
为测试2组溶液中虾青素的光稳定性,将样品溶液置于室温中避光或白炽灯(9 W)保存0、6、12、18、24 h后测定虾青素含量。
1.3.9.3 pH 稳定性
为测试2组溶液中虾青素的酸碱稳定性,将2组样品分别添加1 mol/L的HCl或NaOH溶液将pH值调节为1、3、5、7、9、11、13。在室温下黑暗保存0、6、12、18、24 h后测定虾青素的含量。
1.4 数据处理
本研究中所有试验均重复3次,试验结果以“平均值±标准差”表示。采用SPSS 26.0软件处理分析数据,选择Duncan法进行多组样本间差异显著性分析(P<0.05)。采用Origin 2022软件进行数据可视化,利用 Design-Expert 13软件进行响应面试验设计与分析。
2 结果与分析
2.1 DES理化性质
深共晶溶剂的极性、pH值和黏度是影响其从虾蟹壳中提取虾青素效率的关键理化性质,不同摩尔比百里香酚/油酸的DES的极性、pH值和黏度测定结果如表2所示。实验测得DES-1、DES-2、DES-3组的极性分别为49.90、50.93、51.61 kcal/mol,属于弱极性,低于亲水性DES(氯化胆碱∶尿素)的65.91 kcal/mol[16]。溶剂极性通常用于描述分子内部电荷分布的不均匀程度,它对溶剂溶解能力的影响遵循“相似相溶”原则,极性溶剂对极性或离子型溶质通常具有更高的溶解度,而非极性溶剂则更适合溶解分子内部电荷分布均匀没有明显的偶极矩的非极性溶质[17]。疏水性DES通常由非极性和弱极性物质组成,含有羧基的长链脂肪酸是构成疏水DES常用的HBA,常与作为HBD的酚类或胺类化合物组合使用。考虑到低挥发性是亲水性和疏水性DES的共同特征,导致提取的生物活性成分难以与溶剂分离[18]。因此,本研究选择安全、可食用的油酸和百里香酚组成疏水DES用于弱极性的虾青素提取,同时百里香酚的抗氧化性能够在提取过程中减少氧化引起的虾青素分解。
表2 不同百里香酚/油酸摩尔比的DES溶液的极性、pH值与黏度
Table 2 Polarity,pH and viscosity of DES solutions with different thymol/oleic acid molar ratios

样品极性/ kcal/mol pH值黏度/ mPa s DES-149.90±0.31c2.30±0.08b65.41±1.65aDES-250.93±0.10a2.75±0.33b34.99±1.5aDES-351.61±0.13b3.46±0.30a28.29±2.1b
注:同列不同字母表示组间差异显著(P<0.05)。
DES的pH值通常因所使用的HBD不同有明显的差异,pH值会影响DES的稳定性、溶剂化特性和反应性。pH值的变化会影响溶剂中官能团的质子化或去质子化过程,以及盐类成分的解离。这些变化进一步影响DES的溶剂化能力,从而影响其溶解能力及与其他物质的相互作用能力[19]。由表2可知,百里香酚和油酸组成的DES呈酸性,有助于分解矿物质和蛋白,从而促进与蛋白结合的虾青素的释放,进而提高从虾蟹壳中提取虾青素的效率。
DES的黏度也是影响其提取效率的关键因素。高黏度的DES体系会减缓溶质分子在溶剂中的扩散速度,从而降低提取效率。这是因为溶质分子需要更长的时间才能从原料中溶解并扩散到溶剂中。由表2可知,DES的黏度随着HBD(油酸)比例的提高而降低,DES-室温20 ℃环境下黏度为34.99 mPa·s,低于尿素-氯化胆碱组成的亲水性DES(摩尔比2∶1)在298.15 K时的黏度(750 mPa·s),低黏度说明流动性较强,在浸提萃取过程中,可以高效地与虾蟹壳粉末状原料结合,提高萃取虾青素的效率[20]。
2.2 FTIR
DES中的HBA和HBD通过氢键的结合,获得稳定的液态结构,氢键的强度决定了DES的黏度、极性和溶解能力。运用FTIR确认DES中百里香酚/油酸间氢键的形成。百里香酚分子中含有羟基,能够与油酸中的羧基结合,形成稳定的氢键结构。如图1所示,在2 944、2 360、1 704 cm-1波段附近,具有明显特征峰。羧基中的O—H 伸缩振动通常在3 300~2 500 cm-1,表现为宽而强的吸收峰。DES-2在2 944 cm-1波段附近特征峰有所增强,波带变宽,和其他组分相比峰出现红移现象,—OH 的红移表明电子云从氧原子转移到氢键,氢键结合强度更高[21]。饱和烃(如烷烃)中的C—H键,C![]() O键的伸缩振动通常出现在1 650~1 750 cm-1波段。DES-2在该波段出峰明显,说明油酸提供的C
O键的伸缩振动通常出现在1 650~1 750 cm-1波段。DES-2在该波段出峰明显,说明油酸提供的C![]() O与羟基结合形成羧基,并与百里香酚提供的羟基结合,形成稳定的氢键结构。同时这种氢键网络可以与虾青素分子中的羟基、羰基等官能团结合,从而使得DES与虾青素分子之间产生较强的相互作用,促使虾青素分子从原料的晶格结构或其他结合状态中脱离出来,进入到深共晶溶剂体系中[22]。
O与羟基结合形成羧基,并与百里香酚提供的羟基结合,形成稳定的氢键结构。同时这种氢键网络可以与虾青素分子中的羟基、羰基等官能团结合,从而使得DES与虾青素分子之间产生较强的相互作用,促使虾青素分子从原料的晶格结构或其他结合状态中脱离出来,进入到深共晶溶剂体系中[22]。
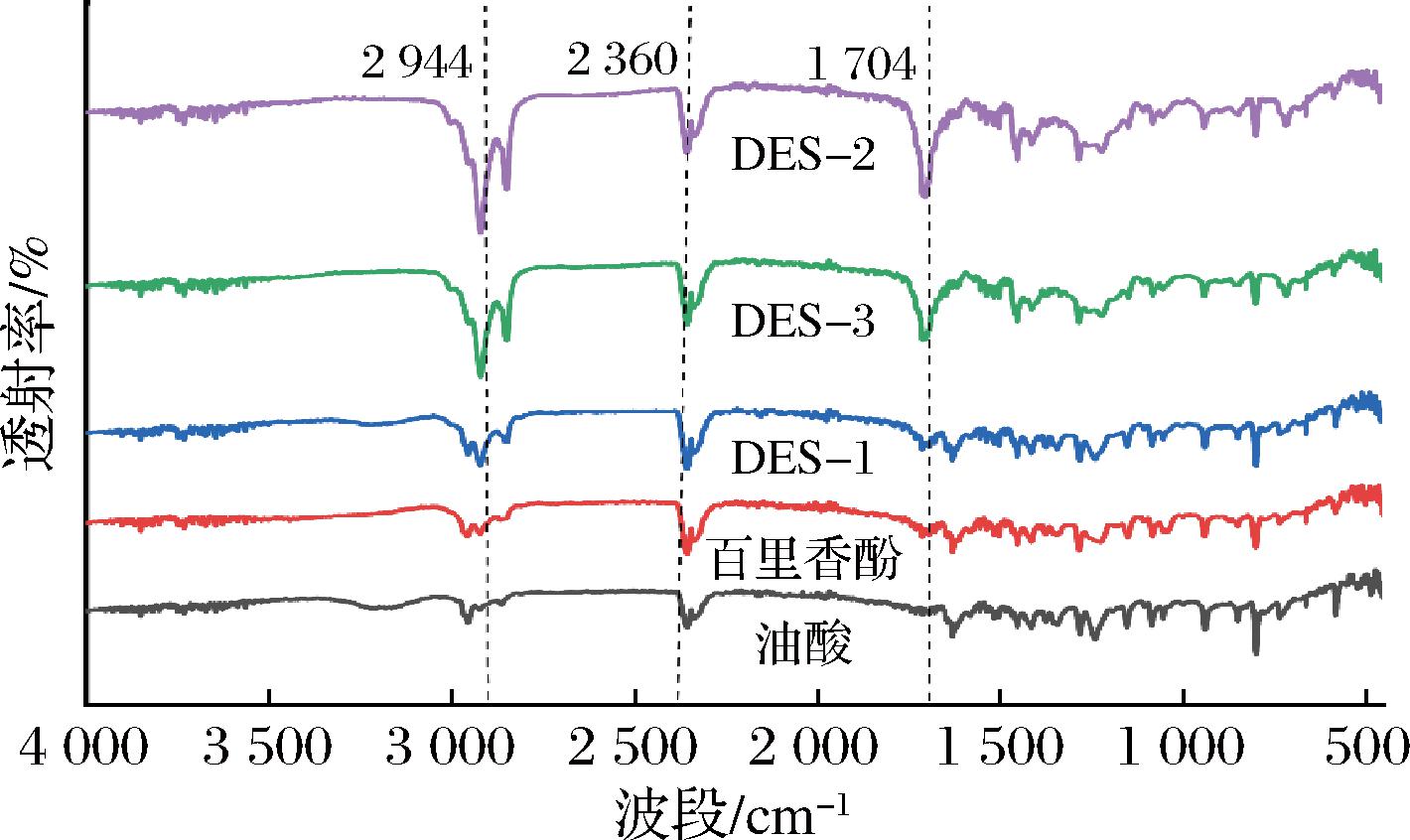
图1 不同DES溶剂和其组分的FTIR图
Fig.1 FTIR pattern of different DES and their components
2.3 超声辅助深共晶溶剂法提取虾青素及条件优化
2.3.1 单因素试验
如图2-a所示,百里香酚和油酸的单独提取率分别为(8.23±3.27) μg/g和(16.09±2.40) μg/g,均低于二者组成的DES-1、DES-2和DES-3,这表明百里香酚/油酸之间的氢键相互作用实现了溶剂理化性质的优化,增强了对虾青素的溶解能力。虾青素提取常用的有机溶剂丙酮对照组的提取率为(31.96±6.06) μg/g,低于DES-2组的(41.07±4.17) μg/g,与SHARAYEI等[23]报道的35.76 μg/g的结果相近,表明DES能够作为丙酮提取虾青素的绿色替代品。此外,DES-2的提取率显著高于DES-1和DES-3,因此后续研究选择百里香酚/油酸摩尔比为3∶1的DES-2作为虾青素的提取溶剂。
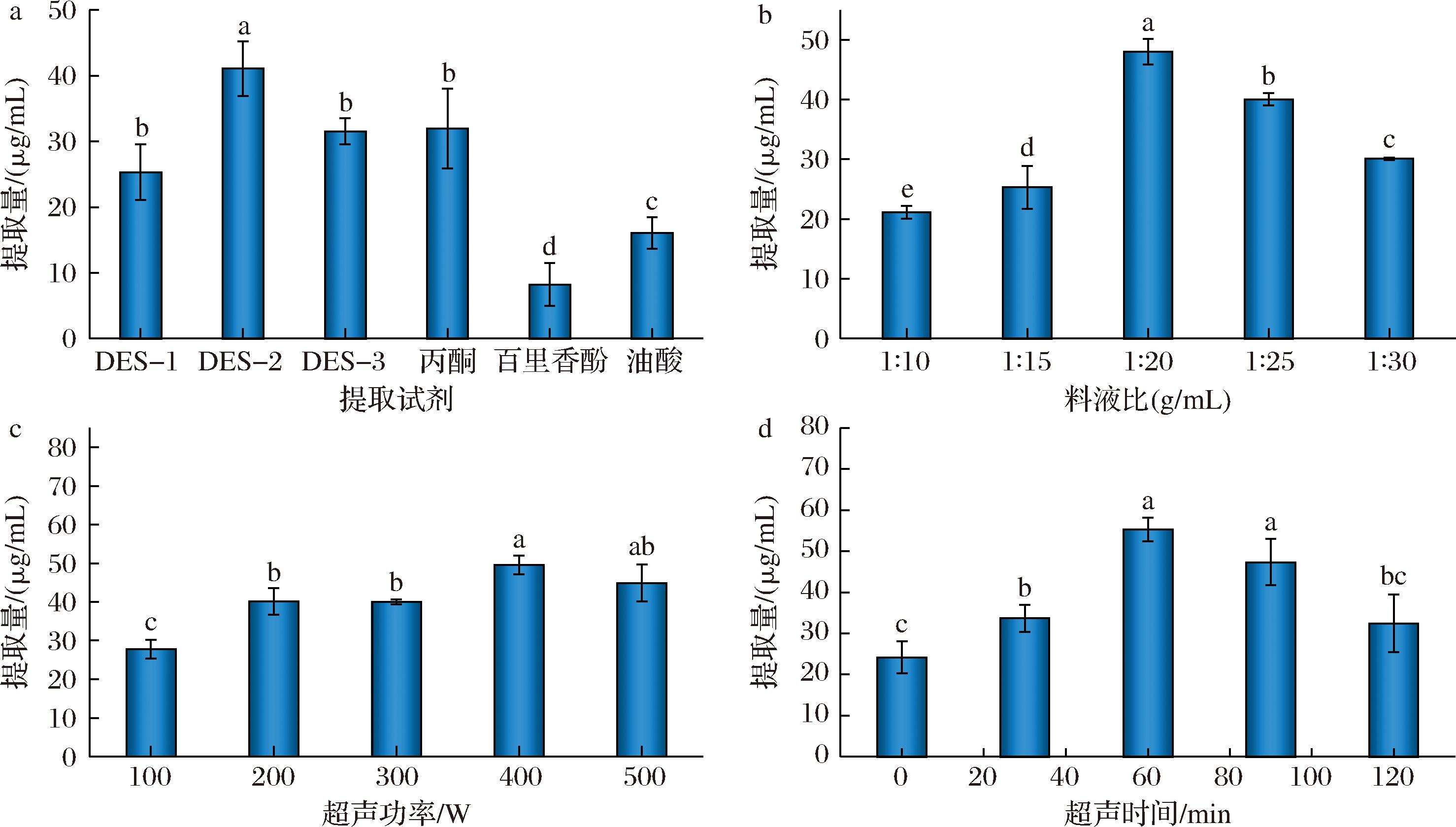
a-提取试剂;b-料液比;c-超声功率;d-超声时间
图2 DES提取虾蟹壳中虾青素单因素试验
Fig.2 experiments on the extraction of astaxanthin from shrimp shells by DES
注:不同小写字母表示差异显著(P<0.05)(下同)。
图2-b表明虾青素的提取量随料液比的增加先增高后下降,当料液比为1∶20(g∶mL)时,提取量达到峰值,为(48.03±2.14) μg/g,这是因为在一定范围内增加DES溶剂比例可增强溶剂对虾蟹壳的覆盖,增大接触面积,从而提高提取效率;当料液比超过1∶20(g∶mL)后,过量的溶剂会因稀释效应导致提取出的虾青素浓度降低,造成溶剂的浪费和提取成本的增加,因此综合提取效率和资源节约的因素下,选择1∶20(g∶mL)为最佳料液比。
超声辅助可通过空化效应、机械效应和热效应提高提取效率,因此,优化了超声时间和超声功率对虾青素提取率的影响。图2-c显示了超声功率对于提取量的影响,在400 W的超声功率下,虾青素提取量达到最高值,为(49.5±2.36) μg/g,这是由于高功率超声波能够引发显著的空化效应,加速粒子间的相互碰撞,从而减小固体基质边界层中的粒径,增加料液之间的表面积,提高传质速率,进而导致虾蟹壳结构快速破坏,使其中的生物活性成分释放并溶解在溶剂中[24]。然而,过高的超声功率产生的温度在溶剂中无法消散,升温使得虾青素的结构加速分解氧化,从而影响虾青素的提取量[25]。图2-d则显示了超声时间对虾青素提取量的影响。当提取时间为60 min时,DES对虾青素的提取量最高,为(55.32±2.86) μg/g。充分的超声提取时间有助于虾蟹壳结构瓦解,使虾青素等生物活性物质充分进入到溶剂中,但当超声时间过长时,不仅溶剂温度升高,因超声产生的过多气泡将阻止超声波的传播,也会降低虾青素的提取效率[26]。因此提取虾青素的超声辅助调节最佳超声时间为60 min,最佳超声功率为400 W。
2.3.2 响应面试验
基于单因素试验的结果,采用响应面法分析DES料液比、超声时间,超声功率之间的交互作用,探究最优实验提取条件。利用Design-Expert13软件,以料液比(A),超声时间(B),超声功率(C)作为自变量,以提取量(Y)为响应值进行多元回归拟合分析,得到回归方程:Y=52.78+0.850 0A+0.612 5B-3.11C+0.4AB+0.6AC+0.875BC-9.85A2-9.53B2-10.28C2,(R2=0.995 2)。由表3可知,模型P<0.000 1极显著,表明拟合度良好,失拟项为0.337 0不显著,表明该模型能很好地描述实际情况,具备统计学有效性。根据显著性,单因素对虾青素提取量的影响顺序为C>A>B,即提取中超声功率对DES提取虾青素的作用最为显著。交互作用显著性顺序为BC>AC>AB,即超声功率超声时间的交互作用最为显著。
表3 响应面分析表
Table 3 Variance analysis of response surface regression model
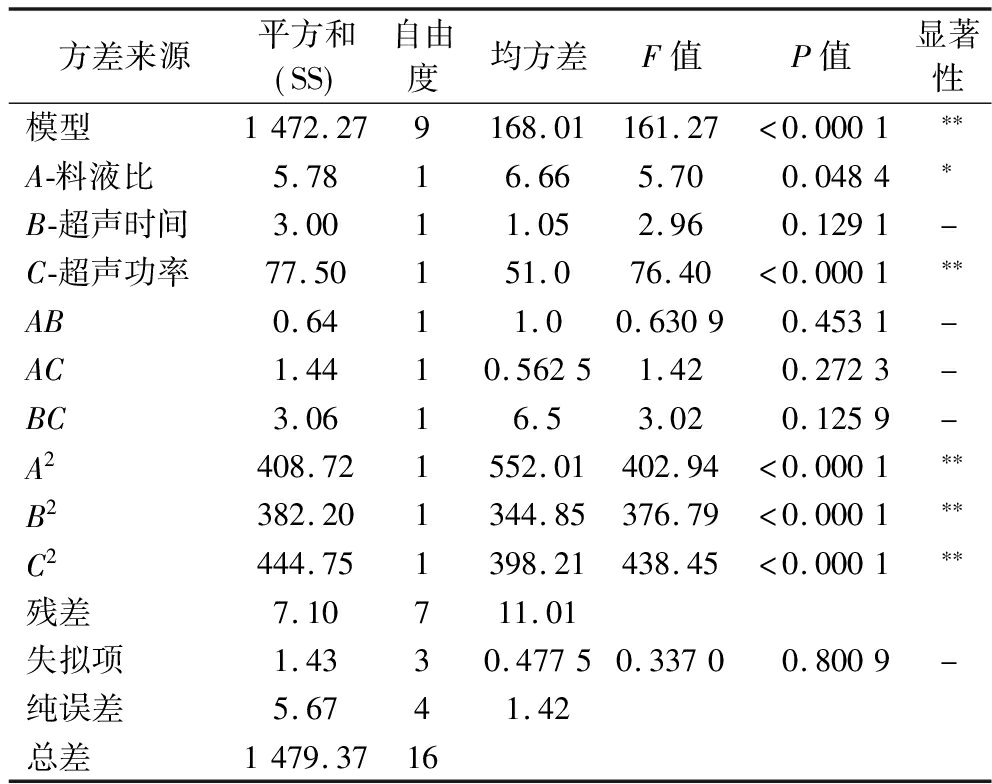
方差来源平方和 SS 自由度均方差F值P值显著性模型1472.279168.01161.27<0.0001∗∗A-料液比5.7816.665.700.0484∗B-超声时间3.0011.052.960.1291-C-超声功率77.50151.076.40<0.0001∗∗AB0.6411.00.63090.4531-AC1.4410.56251.420.2723-BC3.0616.53.020.1259-A2408.721552.01402.94<0.0001∗∗B2382.201344.85376.79<0.0001∗∗C2444.751398.21438.45<0.0001∗∗残差7.10711.01失拟项1.4330.47750.33700.8009-纯误差5.6741.42总差1479.3716
注:*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。
为进一步分析3个因素对响应值的影响,需固定其中1个因素为中心水平值,绘制其他2个因素交互作用的等高线图和3D曲面图,并对这2个因素的相互作用进行分析。由图3可知,因素B(超声功率)和C(超声时间)的交互作用的响应面曲度较大,等高线较密集,表明它们之间的相互作用对提取效率的影响显著。这主要可能是因为超声辅助造成的空化效应,对虾蟹壳粉末的结构破坏起到关键作用。此外,热效应和机械效应也大幅提升了虾青素的提取效率,因此超声时间和功率的交互作用对虾青素的提取效率具有影响显著[27]。

a-超声时间和料液比;b-超声时间和料液比;c-超声时间和功率
图3 不同因素影响DES提取虾青素的响应面图和等高线图
Fig.3 Response surface and contour plots of different factors affecting the extraction of astaxanthin by DES
根据Design-Expert13软件拟合得出最佳的工艺条件为料液比1∶19.86(g∶mL),超声时间67.89 min,超声功率320.31 W,在此条件下预测虾青素提取量为48.03 μg/g。在实际操作中,为了方便控制,取料液比1∶20(g∶mL),超声时间68 min,超声功率320 W,得到的实际提取量为49.50 μg/g,与预测值非常接近。该提取量高于DOS SANTOS等[28]采用的氯化胆碱/甘油辅助乙醇提取法在最优条件下获得的虾蟹壳中虾青素提取量32.71 μg/g,与SHARAYEI等[23]超声6 h辅助石油醚/丙酮/水三元混合得到的虾蟹壳中虾青素提取量47.23 μg/g相近,但能大幅缩减提取时间,节约能源的同时避免了有毒有机溶剂的使用。
2.4 虾蟹壳微观结构对比
通过SEM观察虾蟹壳在有机溶剂丙酮及DES-2提取虾青素前后的微观结构变化,以分析不同溶剂造成虾青素提取效率差异的可能原因。由图4可知,未经提取处理的虾表面粗糙斑驳,呈疏松的多层结构。经过超声辅助丙酮和DES提取后,虾蟹壳粉末表面均出现气孔状结构,破坏痕迹明显,说明超声的空化和机械作用破坏了虾粉结构,由于固体基质边界层中的粒径减小、表面积增加传质速率增加,快速碎裂导致生物活性成分在溶剂中溶解[29]。而DES提取后的虾蟹壳粉末表面可见油状包裹,DES充分浸润虾蟹壳粉末,增大了溶剂的接触面积,提高了虾青素的提取效率。

a-未处理;b-丙酮处理;c-DES处理
图4 虾蟹壳粉末SEM图(1 000×)
Fig.4 SEM image of freeze-dried shrimp shell powder(1 000×)
2.5 DPPH抗氧化实验
抗氧化能力是虾青素的重要指标,虾青素的抗氧化活性主要源于其共轭多烯链及末端环状结构,可通过直接提供氢原子或电子与自由基结合,形成稳定的非自由基产物,从而中断脂质过氧化链式反应[30]。图5为化学合成、丙酮提取以及DES提取液中虾青素的DPPH自由基清除率的比较。对照组DES溶剂的自由基清除率为11.76%,这主要归因于百里香酚的抗氧化作用[31]。扣除DES溶剂对DPPH清除作用,DES中虾青素的实际DPPH自由基清除率为38.73%,略高于丙酮提取虾青素的37.74%,再次证实了百里香酚/油酸DES替代丙酮用于虾青素绿色提取的潜力。化学合成的虾青素的DPPH清除率最低,仅为28.43%,这是由于化学合成的虾青素通常为3种异构体的混合体,而天然的虾青素由抗氧化较强的左旋和右旋异构体组成。此外,DES提取液中虾青素的自由基清除活性高于丙酮提取液,说明DES中的百里香酚与虾青素之间存在积极的抗氧化协同作用。这一发现为DES作为虾青素的良好保存溶剂提供了重要参考[32]。
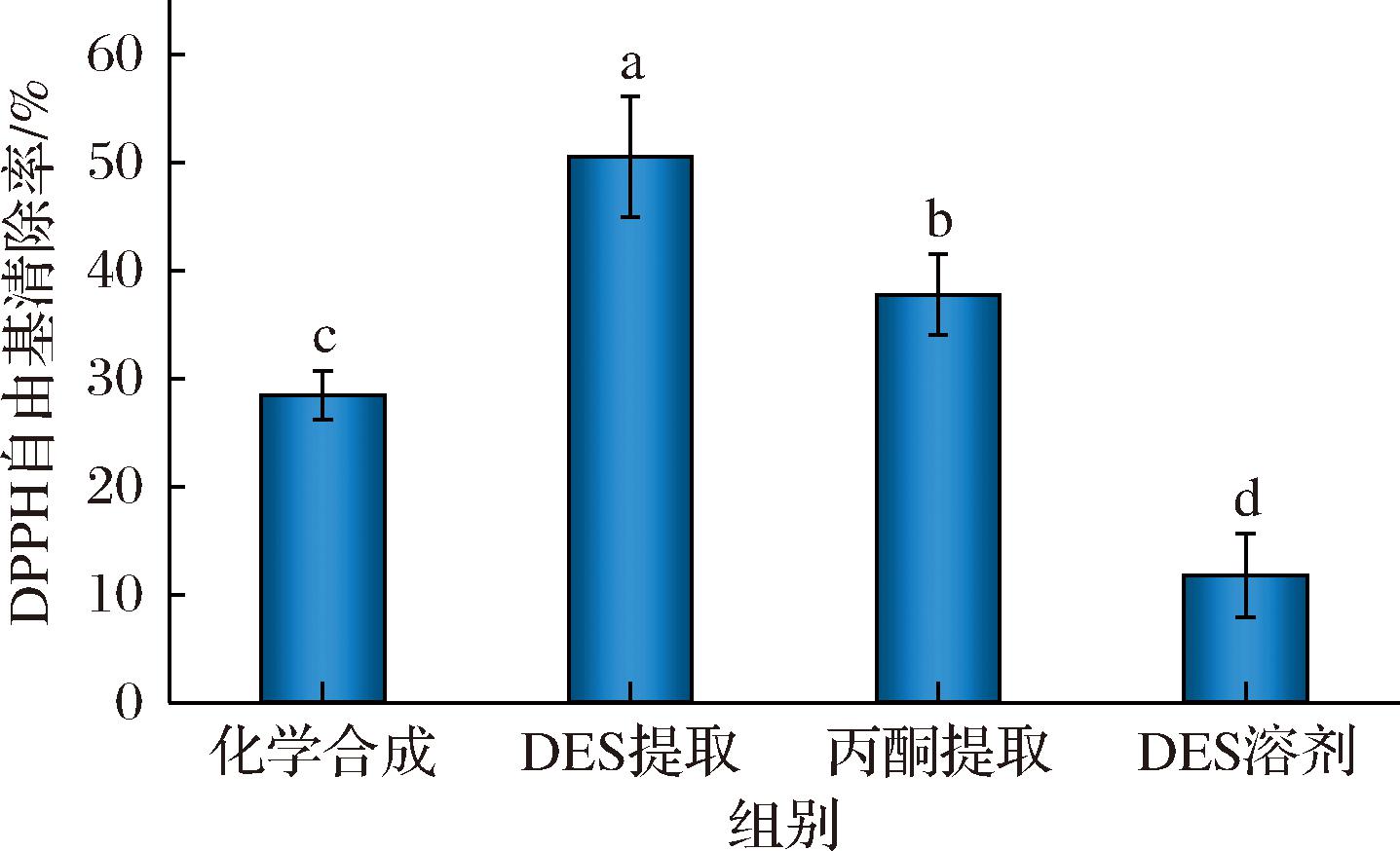
图5 不同方法得到虾青素以及DES溶剂的DPPH自由基清除率
Fig.5 DPPH radical scavenging of astaxanthin obtained by different methods
2.6 虾青素稳定性研究
虾青素具有强抗氧化活性,但其在保存过程中容易受环境中温度、酸碱条件和光照的影响而分解。
图6显示了虾青素DES溶液和丙酮溶液在不同温度、光照和pH条件下的稳定性。虾青素为热敏感物质,图6-a、图6-b分别显示了在4、20、40、60、80 ℃条件下,随时间延长,2组溶剂中虾青素含量的变化。在加热前(0 h),虾青素的初始质量浓度为5.0 μg/mL,在40、60、80 ℃加热反应3 h后,DES溶剂中的虾青素质量浓度分别为4.47、4.05、3.71 μg/mL,而在丙酮溶剂中的虾青素为3.80、3.75、2.74 μg/mL。从60 ℃开始,虾青素含量下降较快,相比之下,DES溶剂中剩余虾青素含量明显高于丙酮溶剂中的含量(P<0.05)。在80 ℃下,DES中虾青素含量下降了25.8%,而丙酮溶液中虾青素下降了45.2%。这说明了百里香酚/油酸组成的DES溶剂作为虾青素的保存溶剂可以提高虾青素的热稳定性,可能是因为DES溶剂与虾青素的氢键结合,增强了结构的稳定性,并且油状DES可以在虾青素的表面形成物理屏障,形成温度传播的缓冲区,降低温度的影响[33]。

a、c、e-虾青素DES的稳定性的变化;b、d、f-虾青素丙酮溶剂的稳定性变化
图6 温度、不同光照和pH条件对虾青素含量的影响
Fig.6 Effect of temperature,different light and pH conditions on astaxanthin content
注:大写字母(A~D)表示组间显著性差异,小写字母(a~f)表示组内显著性差异。
DES溶剂和丙酮中虾青素在遮光、白炽灯光和紫外灯光照条件反应24 h后的浓度变化如图6-c、图6-d所示。3种条件下,虾青素对紫外光最为敏感,24 h反应后,DES中的虾青素质量浓度在遮光、白炽灯光和紫外灯光照下分别由5.0 μg/mL降低至4.16、3.49、3.10 μg/mL,而丙酮中虾青素分别降低至3.9、3.31、3.0 μg/mL(P<0.05)。空气中的有机物和氮氧化合物在紫外光的照射下发生一系列反应,生成H2O2等物质,H2O2能够加速虾青素的分解[34]。虾青素与DES的HBD或HBA形成氢键,使虾青素的共轭双键体系得到一定程度的稳定,减少因光激发导致的双键异构化或降解反应,进而提高其光稳定性。
图6-e、图6-f分别显示了不同pH条件下,DES溶剂和丙酮溶剂中虾青素随时间延长的浓度变化,在pH为3~9时,2组中溶剂虾青素含量趋势相似,含量下降并不明显。然而,在极端的pH条件下(pH 1、pH 11 和pH 13),虾青素含量随着贮存时间的延长而显著降低 (P<0.05)。DES中虾青素在pH 1、pH 11 和pH 13条件下分别降低了51.2%、37.2%和40.8%,而丙酮中虾青素含量分别降低了52%、58.2%和50%。这些结果表明虾青素在强酸和强碱环境下,降解程度明显提高,这与ZHANG等[35]研究类胡萝卜素的稳定性结果相符。DES溶剂中油酸的羧基具有一定的酸性解离能力,在一定程度上可以起到缓冲作用,调节虾青素周围的微环境pH。油酸可以通过释放或接受质子来维持微环境的相对稳定,避免虾青素直接暴露在过酸或过碱的环境中,降低了pH变化对虾青素结构和稳定性的破坏作用。
综上,DES溶液能显著提高虾青素的热稳定性、光稳定性和pH稳定性,可以作为虾青素提取后的一种良好保护溶剂。
3 结论
DES可以根据提取对象的需要设计组合HBA和HBD的种类和比例,本文通过比较不同摩尔比的百里香酚和油酸构成DES的理化性质,确定当百里香酚和油酸的摩尔比为3∶1(DES-2)时,虾青素的提取率较高。FTIR结果也证明了DES-2具有更强的氢键结合能力。单因素试验和响应面优化法确定超声辅助DES提取虾蟹壳中虾青素的实际最佳条件是料液比为1∶20(g∶mL),超声时间为68 min,超声功率为320 W,此时提取量可以达到49.5 μg/g。超声波的辅助破坏了虾蟹壳粉末结构,促进了虾青素脱离虾蟹壳溶解于DES中,提高了提取的效率。DES提取液中的虾青素的DPPH自由基清除率比丙酮提取的高12.74%。同时DES相比丙酮,其作为虾青素的良好保存溶剂,能够提高虾青素的热稳定性、光稳定性和酸碱稳定性。综上,绿色环保的百里香酚/油酸DES溶剂能够替代传统有毒有害的有机试剂作为虾青素提取的一种高效的方法,并可作为良好的保存溶剂,可以进一步实现虾蟹壳的综合利用。
[1] BOENISH R,KRITZER J P,KLEISNER K,et al.The global rise of crustacean fisheries[J].Frontiers in Ecology and the Environment,2022,20(2):102-110.
[2] GONG Z K,WANG H L,TANG J L,et al.Coordinated expression of astaxanthin biosynthesis genes for improved astaxanthin production in Escherichia coli[J].Journal of Agricultural and Food Chemistry,2020,68(50):14917-14927.
[3] LIU X J,ZHOU L S,XIE J T,et al.Astaxanthin isomers:A comprehensive review of isomerization methods and analytic techniques[J].Journal of Agricultural and Food Chemistry,2023,71(50):19920-19934.
[4] GUAN L Y,JI R Y,ZANG J C,et al.Both hemocyanin and β-1,3-glucan-binding protein from the shrimp shell of litopenaeus vannamei are responsible for its color change from brown to red during thermal processing[J].Journal of Agricultural and Food Chemistry,2024,72(42):23544-23553.
[5] 程婉婷,陈世钰,贤凤,等.酸性低共熔溶剂的理化特性及其与虾青素溶解度的相关性研究[J].化学试剂,2023,45(2):106-113.CHENG W T,CHEN S Y,XIAN F,et al.Physicochemical properties of acidic deep eutectic solvents and the correlation with astaxanthin solubility[J].Chemical Reagents,2023,45(2):106-113.
[6] 钱建瑛,王雨露,李恒,等.利用沼虾废弃物制备富含虾青素的食用油和虾露调味液的工艺研究[J].中国调味品,2022,47(11):99-104.QIAN J Y,WANG Y L,LI H,et al.Study on preparation of edible oil and shrimp sauce flavoring liquid rich in astaxanthin from Macrobrachium rosenbergii waste[J].China Condiment,2022,47(11):99-104.
[7] 李念,陈露珠,安鑫,等.3种虾壳中虾青素提取工艺优化及其抗氧化活性比较[J].上海海洋大学学报,2022,31(1):298-308.LI N,CHEN L Z,AN X,et al.Optimization of extraction process and comparison of antioxidant activities of astaxanthin from three kinds of shrimp shells[J].Journal of Shanghai Ocean University,2022,31(1):298-308.
[8] 孙兆远,侯会绒,孔令伟.结合型虾青素酶法水解工艺的研究[J].食品研究与开发,2017,38(12):35-39.SUN Z Y,HOU H R,KONG L W.Optimizing hydrolysis techniques of bound astaxanthin compounds by papain[J].Food Research and Development,2017,38(12):35-39.
[9] TOMÉ L I N,BAI O V,DA SILVA W,et al.Deep eutectic solvents for the production and application of new materials[J].Applied Materials Today,2018,10:30-50.
O V,DA SILVA W,et al.Deep eutectic solvents for the production and application of new materials[J].Applied Materials Today,2018,10:30-50.
[10] SU W J,XU W H,POLYAKOV N E,et al.Zero-waste utilization and conversion of shrimp shell by mechanochemical method[J].Journal of Cleaner Production,2023,425:139028.
[11] MUSSAGY C U,SANTOS-EBINUMA V C,HERCULANO R D,et al.Ionic liquids or eutectic solvents? Identifying the best solvents for the extraction of astaxanthin and β-carotene from Phaffia rhodozyma yeast and preparation of biodegradable films[J].Green Chemistry,2022,24(1):118-123.
[12] ZHANG H,TANG B K,ROW K H.A green deep eutectic solvent-based ultrasound-assisted method to extract astaxanthin from shrimp byproducts[J].Analytical Letters,2014,47(5):742-749.
[13] GUAN W,CHANG N,YANG L L,et al.Determination and prediction for the polarity of ionic liquids[J].Journal of Chemical &Engineering Data,2017,62(9):2610-2616.
[14] 刘宇航,相欢,黄卉,等.低共熔溶剂提取虾壳中虾青素工艺优化及机理初探[J].南方水产科学,2024,20(3):164-172.LIU Y H,XIANG H,HUANG H,et al.Optimization of process and mechanism of extracting astaxanthin from shrimp shells with deep eutectic solvent[J].South China Fisheries Science,2024,20(3):164-172.
[15] LIU R G,LI Y,ZHOU C F,et al.Pickering emulsions stabilized with a Spirulina protein-chitosan complex for astaxanthin delivery[J].Food &Function,2023,14(9):4254-4266.
[16] PANDEY A,RAI R,PAL M,et al.How polar are choline chloride-based deep eutectic solvents?[J].Physical Chemistry Chemical Physics,2014,16(4):1559-1568.
[17] FLORINDO C,MCINTOSH A J S,WELTON T,et al.A closer look into deep eutectic solvents:Exploring intermolecular interactions using solvatochromic probes[J].Physical Chemistry Chemical Physics,2018,20(1):206-213.
[18] CHEN Y,YU D K,LU Y H,et al.Volatility of deep eutectic solvent choline chloride:N-methylacetamide at ambient temperature and pressure[J].Industrial &Engineering Chemistry Research,2019,58(17):7308-7317.
[19] JAN
 KOV
KOV V,MAJOV
V,MAJOV V,JABLONSK
V,JABLONSK M.Acidity and pH of DES-like mixtures and the possibilities of their determination[J].Journal of Molecular Liquids,2024,394:123728.
M.Acidity and pH of DES-like mixtures and the possibilities of their determination[J].Journal of Molecular Liquids,2024,394:123728.
[20] LIU Y T,CHEN Y N,XING Y J.Synthesis and characterization of novel ternary deep eutectic solvents[J].Chinese Chemical Letters,2014,25(1):104-106.
[21] KHEZELI T,DANESHFAR A,SAHRAEI R.A green ultrasonic-assisted liquid-liquid microextraction based on deep eutectic solvent for the HPLC-UV determination of ferulic,caffeic and cinnamic acid from olive,almond,sesame and cinnamon oil[J].Talanta,2016,150:577-585.
[22] ABO-HAMAD A,HAYYAN M,ALSAADI M A,et al.Potential applications of deep eutectic solvents in nanotechnology[J].Chemical Engineering Journal,2015,273:551-567.
[23] SHARAYEI P,AZARPAZHOOH E,ZOMORODI S,et al.Optimization of ultrasonic-assisted extraction of astaxanthin from green tiger (Penaeus semisulcatus) shrimp shell[J].Ultrasonics Sonochemistry,2021,76:105666.
[24] RUEN-NGAM D,SHOTIPRUK A,PAVASANT P.Comparison of extraction methods for recovery of astaxanthin from Haematococcus pluvialis[J].Separation Science and Technology,2010,46(1):64-70.
[25] XU Y,PAN S Y.Effects of various factors of ultrasonic treatment on the extraction yield of all-trans-lycopene from red grapefruit (Citrus paradise Macf.)[J].Ultrasonics Sonochemistry,2013,20(4):1026-1032.
[26] LOU Z X,WANG H X,ZHANG M,et al.Improved extraction of oil from chickpea under ultrasound in a dynamic system[J].Journal of Food Engineering,2010,98(1):13-18.
[27] RI L,HO R.Comparison of ionic liquids and deep eutectic solvents as additives for the ultrasonic extraction of astaxanthin from marine plants[J].Journal of Industrial and Engineering Chemistry,2016,39:87-92.
[28] DOS SANTOS C,PADILHA C E A,DAMASCENO K S F S C,et al.Astaxanthin recovery from shrimp residue by solvent ethanol extraction using choline chloride:Glycerol deep eutectic solvent as adjuvant[J].Journal of the Brazilian Chemical Society,2021,32:1030-1039.
[29] ROSELL -SOTO E,KOUBAA M,MOUBARIK A,et al.Emerging opportunities for the effective valorization of wastes and by-products generated during olive oil production process:Non-conventional methods for the recovery of high-added value compounds[J].Trends in Food Science &Technology,2015,45(2):296-310.
-SOTO E,KOUBAA M,MOUBARIK A,et al.Emerging opportunities for the effective valorization of wastes and by-products generated during olive oil production process:Non-conventional methods for the recovery of high-added value compounds[J].Trends in Food Science &Technology,2015,45(2):296-310.
[30] CHENG W T,XIAN F,ZHOU Z L,et al.Solubility and stability of carotenoids in ammonium-and phosphonium-based ionic liquids:Effect of solvent nature,temperature and water[J].Molecules,2023,28(8):3618.
[31] LI F Y,MAO S,ZHOU X B,et al.The Cyperus esculentus starch-based bioactive films:Characterisation,UV-shielding and antioxidant capacity[J].International Journal of Food Science &Technology,2023,58(8):4446-4454.
[32] CELEBIOGLU A,YILDIZ Z I,UYAR T.Thymol/cyclodextrin inclusion complex nanofibrous webs:Enhanced water solubility,high thermal stability and antioxidant property of thymol[J].Food Research International,2018,106:280-290.
[33] SANCHEZ-FERNANDEZ A,PREVOST S,WAHLGREN M.Deep eutectic solvents for the preservation of concentrated proteins:The case of lysozyme in 1∶2 choline chloride∶glycerol[J].Green Chemistry,2022,24(11):4437-4442.
[34] LI N,FAN M C,LI Y,et al.Stability assessment of crocetin and crocetin derivatives in gardenia yellow pigment and Gardenia fruit pomace in presence of different cooking methods[J].Food Chemistry,2020,312:126031.
[35] ZHANG Y Q,ZHAO X Y,MA Y,et al.Comparison of blue discoloration in radish root among different varieties and blue pigment stability analysis[J].Food Chemistry,2021,340:128164.