红托竹荪(Dictyophora rubrovolvata)是我国名贵的药食两用真菌,主要分布于中国福建、四川、贵州和云南等地区[1]。“织金竹荪”已获得国家地理标志保护产品认证,是贵州省优势食用菌品种之一,贵州省“十三五”食用菌产业发展规划期间,红托竹荪在提供就业、提高经济方面发挥了重要作用[2]。红托竹荪组织脆嫩,菌盖为钟形,菌柄为圆柱形,含多种维生素、多糖等有益于人体健康的营养物质,具有抗肿瘤、保肝和降血糖等作用[3-4]。竹荪鲜品含水量高,呼吸速率快,采收后其子实体易自溶和腐烂[5]。红托竹荪鲜品不耐贮藏,市场上主要以干制品销售为主,但竹荪干品经长时间贮藏返潮现象严重,易发生褐变,使其感官和营养价值急剧劣变,严重影响了红托竹荪的商品价值[6]。
代谢组学可以通过全面、系统地分析果蔬褐变过程中代谢产物的变化,探索其与褐变过程的关系,从而揭示果蔬褐变的代谢途径和机制[7-8],其中,非靶向代谢组学指无需预先确定要监测的代谢物,利用高通量分析技术,揭示褐变的代谢通路和关键代谢过程。代谢组学技术已被广泛运用在果蔬褐变成因研究中,如LI等[9]利用非靶向代谢组学鉴定了谷氨酸、亚麻酸和谷胱甘肽等15种代谢物为鲜切马铃薯褐变过程中的关键代谢物。ZHANG等[10]在利用代谢组学技术和蛋白组学技术对生菜茎叶褐变机理探究中,发现胱甘肽代谢、吲哚生物碱生物合成、氧化磷酸化和半乳糖代谢水平的变化与生菜茎褐变有关。在羊肚菌贮藏褐变中同样采用代谢组学技术确认酪氨酸代谢是导致羊肚菌贮藏过程中褐变的重要途径[11]。目前,国内外学者主要从竹荪加工或贮藏过程中多酚氧化酶(polyphenol oxidase,PPO)、还原糖、总酚和氨基酸等生理生化指标含量变化情况分析,明确各指标间相关性,从而判断竹荪褐变成因可能性[12],然而,利用代谢组学技术分析竹荪干品贮藏过程中发生褐变后的代谢物质目前尚无研究报道。本研究以红托竹荪干品为试验材料,利用非靶向代谢组学技术对竹荪干品在贮藏期褐变的代谢物进行分析,以探明竹荪干品褐变过程中的关键代谢物及富集通路进行分析,为进一步完善竹荪褐变机理及其控制提供理论参考。
1 材料与方法
1.1 材料与仪器
红托竹荪子实体鲜品,贵州菇农汇科技服务有限公司。挑选新鲜、成熟度一致、大小均匀和无病虫害的试样,运至实验室。
HT-KRZH-1IV型热泵烘干机,贵州九鼎新能源科技开发有限公司;JE203型电子天平,上海浦春计量仪器有限公司;DW-HL218超低温冰箱,中科美菱低温科技股份有限公司;SN-DHS-16A型卤素水分仪,上海尚普仪器设备有限公司;色差仪,深圳市三恩驰科技有限公司;Nexera LC-30AD超高压液相色谱仪,日本岛津公司;Triple-TOF 5600质谱仪,赛默飞世尔科技公司。
1.2 样品处理
用纸擦去红托竹荪表面的泥,子实体鲜品通过空气能热泵进行干燥,热泵干燥条件为:温度为50 ℃、时间为6 h。将红托竹荪干品装入24丝的自封袋中,分别放入低温4 ℃、常温25 ℃及高温37 ℃环境中避光贮藏42 d,每7 d取样一次,一部分用于测定色差,一部分于液氮下速冻后迅速转移至-80 ℃冰箱,用于后续实验测定。其中代谢组学样品分别为:红托竹荪干品贮藏初期0 d(CK-0 d);4 ℃贮藏21、42 d竹荪组织(LT-21 d、LT-42 d);25 ℃贮藏21、42 d竹荪组织(RT-21 d、RT-42 d);37 ℃贮藏21、42 d竹荪组织(HT-21 d、HT-42 d),共7组竹荪样品。
1.3 色差测定
参考ZENG等[13]的方法,将色差仪进行校正后测定红托竹荪干品的亮度值L*、红绿值a*、黄蓝值b*(n=15),总色差值(ΔE)的计算如公式(1)所示,褐变指数的计算如公式(2)所示:
(1)
式中:ΔE,总色差值;L*、a*、b*,不同贮藏时间下样品的亮度、红绿和黄蓝测定值;L0、a0、b0,样品贮藏第0天的亮度、红绿和黄蓝测定值。
褐变指数![]()
(2)
(3)
1.4 非靶代谢组学测定
红托竹荪样品于4 ℃解冻,每个样品称取100 mg,加入500 μL预冷的V(甲醇)∶V(水)=4∶1的混合物,在组织破碎仪中低温匀浆,再加入1 000 μL预冷的V(甲醇)∶V(水)=4∶1溶液,在冰浴中超声波20 min,-20 ℃静置1 h,离心20 min(16 000×g,4 ℃),上清液在高速真空浓缩离心机中挥干。质谱检测时加入200 μL预冷的V(甲醇)∶V(水)=1∶1的溶液复溶,再离心15 min(20 000×g,4 ℃),上清液用于超高效液相色谱-串联质谱(UPLC-MS/MS)分析。选取ACQUITY UPLC® HSS T3色谱柱(1.8 μm,2.1 mm×100 mm;Waters,Milford,MA,USA);柱温:40 ℃;色谱流动相A:0.1%(体积分数)甲酸水溶液;色谱流动相B:100%(体积分数)乙腈;进样量4 μL;流速300 μL/min。采用正、负离子模式检测,离子源:气体1:50 psi,气体2:50 psi。离子源温度:550 ℃(正离子)和500 ℃(负离子)。喷射电压:5 500 V(正离子)和4 500 V(负离子)。飞行时间质量扫描范围:60~1 200 Da,0.08 s,离子扫描范围:50~1 000 Da,0.01 s。
1.5 数据分析
使用MSDIAL软件对红托竹荪干品褐变前后所鉴定的代谢物数据进行相对定性和定量分析。采用主成分分析(principal component analysis,PCA)、正交偏最小二乘判别分析(orthogonal partial least squares discriminant analysis,OPLS-DA)方法进行代谢物的差异分析,依据投影重要度(VIP>1)、T检验(P<0.05)和差异倍数(FC>2或FC<1/2)筛选显著差异代谢物,并利用KEGG数据库进行代谢通路注释分析。使用Excel 2019软件进行数据整理,SPSS 27软件进行显著性分析,Origin 2022软件作图。
2 结果与分析
2.1 不同贮藏温度对红托竹荪干品色差及褐变的影响
不同食品褐变过程中L*、a*、b*值3个参数的变化规律并不相同,如在干辣椒贮藏过程中褐变表现L*值、a*值均呈下降趋势,b*值呈上升趋势[14];草莓脯在贮藏过程褐变发生后,L*、a*、b*值均呈下降趋势[15]。由图1可知,红托竹荪干品在贮藏褐变过程中,L*值下降,但a*、b*值整体上升,并且贮藏温度越高变化越快。另外,3个贮藏温度下ΔE和褐变指数均随贮藏时间延长呈现上升趋势,ΔE增加说明色泽变化越来越明显,褐变指数增加说明竹荪褐变程度越来越严重,4、25、37 ℃竹荪干品的褐变指数在贮藏21 d开始出现显著差异(P<0.05)。结合图2得出4 ℃低温贮藏会缓解干红托竹荪的褐变程度,表面颜色保持最好。
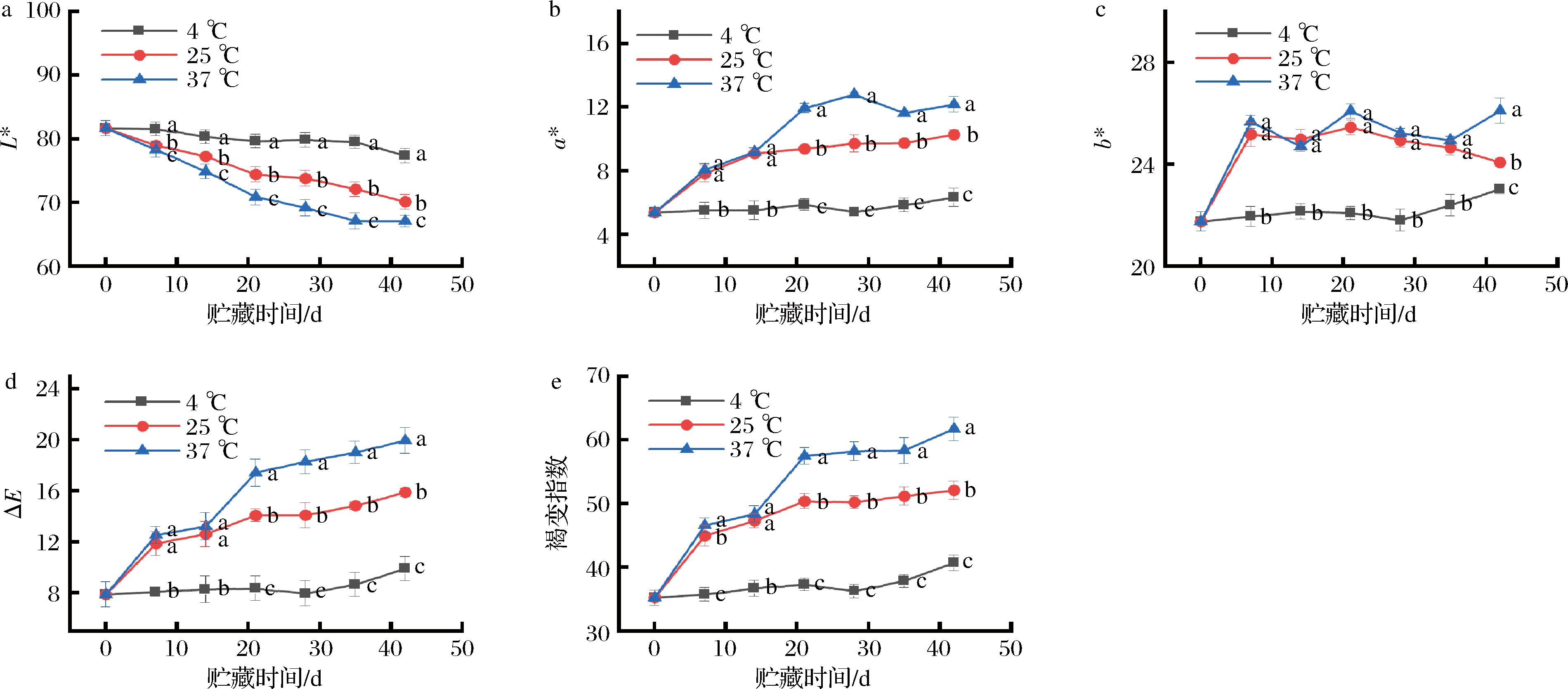
a-L*;b-a*;c-b*;d-ΔE;e-褐变指数
图1 贮藏温度对红托竹荪干品色泽指标的影响
Fig.1 Effects of storage temperatures on color parameters of D.rubrovolvata dry products
注:小写字母不同表示各组存在显著差异(P<0.05)。

图2 贮藏温度对红托竹荪干品外观的影响
Fig.2 Effects of storage temperatures on the visual quality of D.rubrovolvata dry products
2.2 非靶代谢物分析
通过非靶代谢组学技术对不同贮藏条件下红托竹荪干品进行鉴定并分析,各处理正离子+负离子模式下共鉴定出1 690个代谢物,所有代谢物可区分为16类,各类物质百分含量占比如图3-a所示,含量占比前5的分别为羧酸及其衍生物占18.64%、脂肪酰基占16.33%、异戊二烯脂质占10.36%、有机氧化合物占7.04%、甘油磷脂占6.09%。
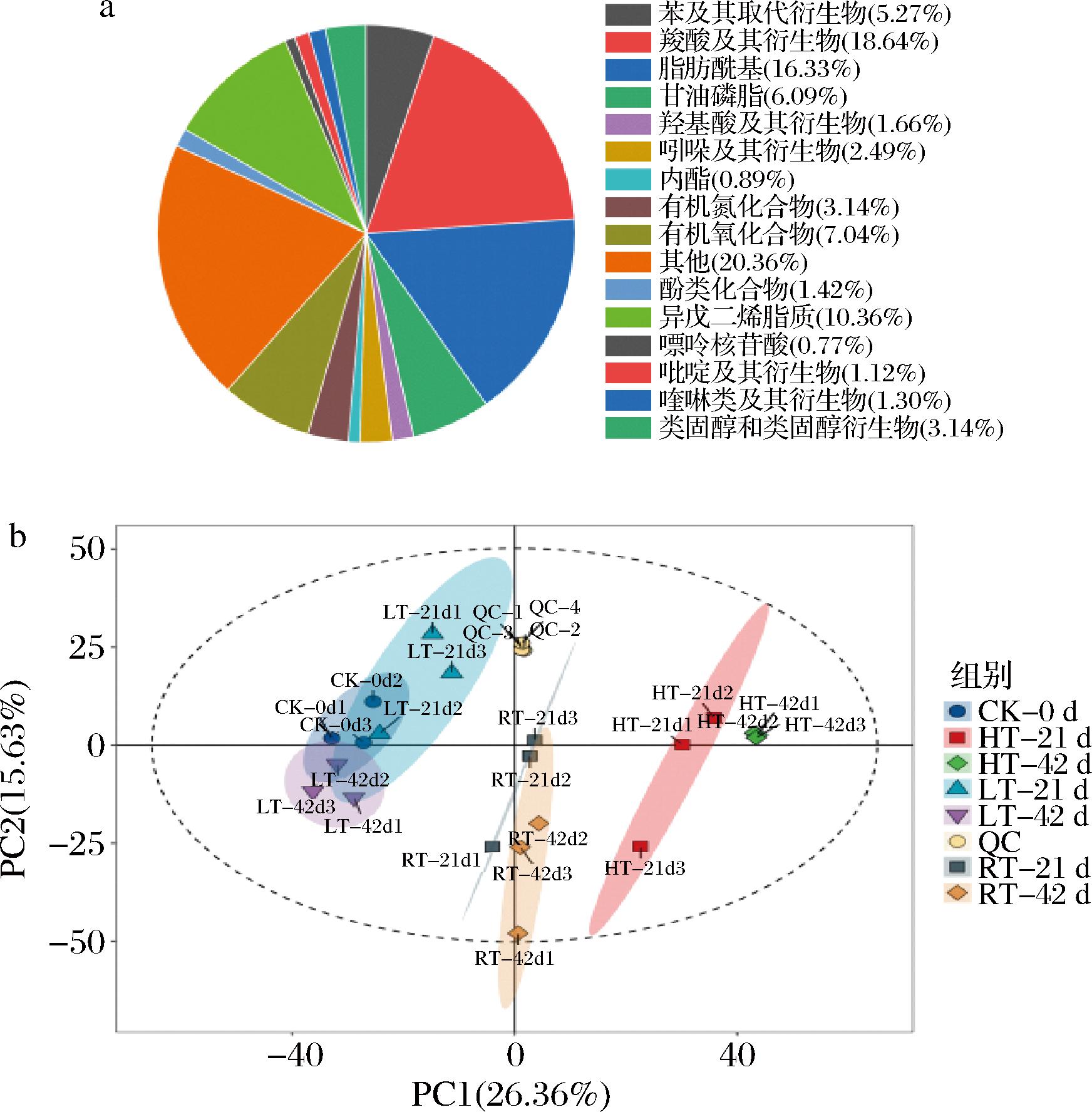
a-饼状图;b-PCA图
图3 代谢物分类饼状图和不同样本间PCA图
Fig.3 Pie chart of metabolite classification and PCA plot of different samples
对所有检测到的代谢物生成所有样品进行PCA(图3-b),QC样本均集中分布在坐标轴位置,说明数据质量较好,重现性较高。各组代谢产物之间有一定的分离趋势,其中横坐标PC1和纵坐标PC2分别代表着第一主成分和第二主成分的得分。PC1解释26.36%总方差变量,PC2解释了15.63%总方差变量。RT21、42 d和HT21、42 d分别与0 d显著分离,表明褐变过程中代谢产物含量存在显著差异。
2.3 不同贮藏温度红托竹荪干品代谢物的OPLS-DA
PCA虽可提取大部分数据信息,但对组间差异不敏感。为进一步探讨不同贮藏温度处理组间的差异,使用有监督的OPLS-DA以观察不同贮藏温度红托竹荪样本中代谢物的整体代谢轮廓差异,横坐标代表组间差异,纵坐标代表组内差异[9]。如图4所示,6个比较组LT-21 d vs CK-0 d、LT-42 d vs CK-0 d、RT-21 d vs CK-0 d、RT-42 d vs CK-0 d、HT-21 d vs CK-0 d、HT-42 d vs CK-0 d组内均显示出明显的差异,且同样本组内聚集相对集中,与贮藏初期(CK-0 d)样本相比,不同贮藏温度的样本均分别位于坐标轴两侧,说明4、25、37 ℃贮藏条件对红托竹荪干品代谢物具有显著影响,与PCA结果一致。![]() 表示OPLS-DA模型红托竹荪干品样本的判别解释能力,Q2表示模型对未知样本的预测能力,
表示OPLS-DA模型红托竹荪干品样本的判别解释能力,Q2表示模型对未知样本的预测能力,![]() 和Q2值接近1,说明模型稳定可靠[11]。6个OPLS-DA模型的
和Q2值接近1,说明模型稳定可靠[11]。6个OPLS-DA模型的![]() 值为0.536~0.819,Q2值为0.929~1,均大于0.5,表明模型可靠有效,检测数据可用于后续差异代谢物分析。
值为0.536~0.819,Q2值为0.929~1,均大于0.5,表明模型可靠有效,检测数据可用于后续差异代谢物分析。
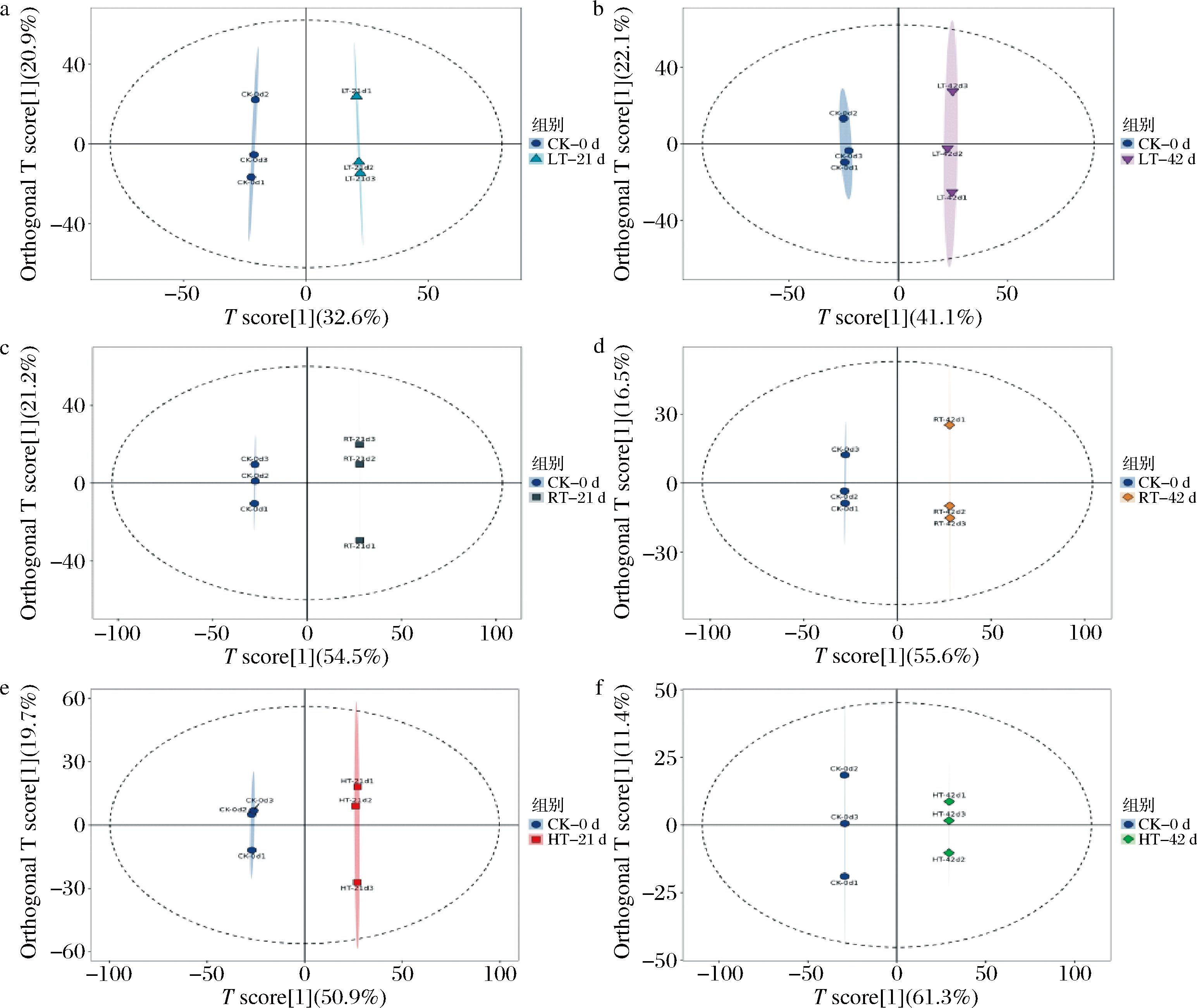
a-LT-21 d vs CK-0 d;b-LT-42 d vs CK-0 d;c-RT-21 d vs CK-0 d;d-RT-42 d vs CK-0 d;e-HT-21 d vs CK-0 d;f-HT-42 d vs CK-0 d
图4 不同贮藏温度下红托竹荪干品代谢物OPLS-DA得分图
Fig.4 OPLS-DA score plots of metabolites in D.rubrovolvata dry products under different storage temperatures
2.4 不同贮藏温度红托竹荪干品差异代谢物的筛选与鉴定
根据VIP>1,P<0.05,FC>2或FC<1/2筛选各组间显著差异代谢物,比较了各组之间的变化,以评估贮藏条件对竹荪代谢物的影响。如图5所示,4 ℃冷藏21、42 d与贮藏初期0 d的竹荪样品显著差异代谢物分别为115(上调和下调代谢物分别为62、53个)、185个(上调和下调代谢物分别为59、126个),25 ℃贮藏21、42 d与贮藏初期0 d的竹荪样品中显著差异代谢物分别为511(上调和下调代谢物分别为152、359个)、555个(上调和下调代谢物分别为162、393个),37 ℃贮藏21、42 d与贮藏初期0 d的竹荪样品中显著差异代谢物分别为564(上调和下调代谢物分别为156、408个)、692个(上调和下调代谢物分别为228、464个)。结果表明,与贮藏初期竹荪(CK-0 d)相比,贮藏第21天时,25和37 ℃贮藏竹荪都是出现更多显著下调差异代谢物数量,而4 ℃贮藏处理则是出现更多上调代谢物表达;贮藏第42天时,3种温度贮藏竹荪都是下调代谢物数量比上调代谢物多。与贮藏初期0 d相比,显著差异代谢物的个数随贮藏时间的延长呈增加的趋势,随贮藏温度的升高也呈增加的趋势。
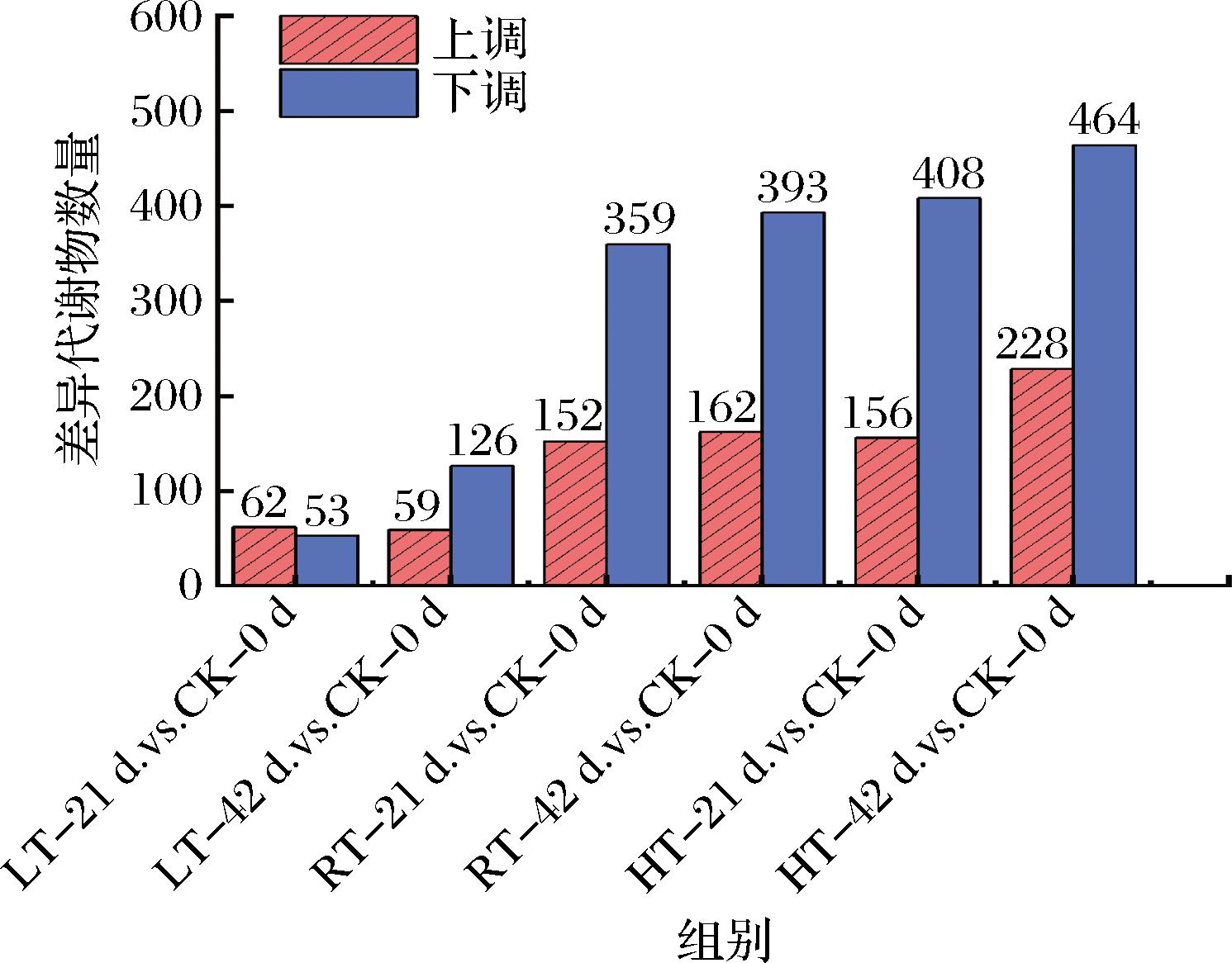
图5 红托竹荪干品显著差异代谢物
Fig.5 Significant difference metabolites of D.rubrovolvata dry products
2.5 不同贮藏温度红托竹荪干品中差异代谢物的KEGG通路分析
桑基图适用于上下调代谢物与各级通路之间的数据流走向可视化分析。如图6所示,左边第一列表示上下调的差异代谢物,红色流线表示上调代谢物的流向,蓝色流线表示下调代谢物的流向,第二、三、四列均表示通路,层级依此升高。

a-LT-42 d vs CK-0 d组差异代谢物通路分析;b-RT-42 d vs CK-0 d组差异代谢物通路分析;c-HT-42 d vs CK-0 d组差异代谢物通路分析
图6 红托竹荪干品不同实验组间的差异代谢物通路分析
Fig.6 Metabolic pathway analysis of differential metabolites in D.rubrovolvata dry products across experimental groups
对4 ℃贮藏42 d(LT-42 d)与贮藏初期(CK-0 d)的红托竹荪干品的显著差异代谢物进行KEGG通路注释分析,如图6-a所示,代谢物分为代谢、遗传信息处理、环境信息处理、生物体系统和人类疾病5大类,其中代谢包括氨基酸代谢和其他氨基酸代谢2个2级分类。在4 ℃贮藏过程中相对表达丰度逐渐增加的差异代谢物有3种,包括还原型谷胱甘肽、富马酸、LPA(18∶0),表达丰度逐渐减少的差异代谢物有8种,包括焦谷氮酸、烟酸、谷氨酸、天冬氨酸、谷氨酰胺、精氨酸、肌氨酸和乙酸胆碱。
对25 ℃贮藏42 d(RT-42 d)与贮藏初期(CK-0 d)红托竹荪干品的显著差异代谢物进行KEGG通路富集注释分析,如图6-b所示,代谢物分为代谢、遗传信息处理、细胞过程、生物体系统和人类疾病5大类,其中代谢包括氨基酸代谢、其他氨基酸代谢和核苷酸代谢3个2级分类。吲哚、富马酸、色氨酸和二磷酸腺苷(adenosine diphosphate,ADP)等7种代谢物显著上调,谷氨酰胺、丙氨酸、组氨酸、甲硫氨酸、精氨酸、肌苷酸(inosine monophosphate,IMP)、黄嘌呤和腺嘌呤等14种代谢物显著下调。
对37 ℃贮藏42 d(HT-42 d)与贮藏初期(CK-0 d)红托竹荪干品的显著差异代谢物进行KEGG通路注释分析,如图6-c所示,代谢物分为代谢、遗传信息处理、环境信息处理、生物体系统和人类疾病5大类,其中代谢包括能量代谢、其他氨基酸代谢和异种生物降解代谢3个2级分类。海藻糖、精氨酸、异柠檬酸、单磷酸腺苷(adenosine monophosphate,AMP)和ADP等8种代谢物显著上调,还原型谷胱甘肽、苏氨酸、丝氨酸、赖氨酸、组氨酸、酪氨酸、苯酚、亚麻酸、邻苯二酚、邻苯二甲酸、还原型烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)、烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD)等25种代谢物显著下调。
3 讨论
温度是影响红托竹荪干品贮藏过程中褐变的重要因素之一。在本研究中,随着贮藏时间的延长,褐变指数均明显上升,贮藏21~42 d期间,4 ℃贮藏的红托竹荪干品褐变指数显著低于另外2种贮藏温度(P<0.05),说明低温贮藏可延缓红托竹荪干品褐变,与夏紫茜等[6]的研究结果一致。酚类物质是果蔬褐变的底物之一,酚类物质在酚代谢酶的作用下与O2发生酶促反应生成醌类物质,醌类化合物再经过一系列的非酶促反应,最终氧化聚合形成一类称为黑色素的物质[16]。目前大多数学者认为,果蔬中酚类底物的含量随着果蔬褐变症状的严重而表现出降低的趋势。XU等[17]在苹果汁褐变过程研究中,发现儿茶素、表儿茶素、绿原酸和咖啡酸的含量与苹果汁褐变密切相关,儿茶素的含量随着儿茶素的氧化降解迅速下降,随后儿茶素与儿茶素醌经过复杂的聚合反应形成褐色聚合物。在本实验中,与贮藏初期(CK-0 d)相比较,25、37 ℃贮藏42 d(RT-42 d、HT-42 d)后红托竹荪干品褐变指数显著增加(P<0.05),儿茶素、邻苯二酚和表儿茶素等酚类差异代谢物均呈显著下调表达的趋势,在一定程度上表明高温贮藏红托竹荪多酚类底物可能发生氧化作用,增加了竹荪褐变的发生。
本研究中共鉴定到47种氨基酸及其衍生物,氨基酸作为植物体中不可缺少的重要成分,对于采后果实的外观变化也有一定影响。研究表明[18-20],还原型谷胱甘肽、半胱氨酸和乙酰基半胱氨酸等巯基氨基酸有很强的抗褐变能力,巯基氨基酸可以与醌类物质形成无色加成产物来防止褐变,也可通过抑制多酚氧化酶的活性来抑制褐变。在本研究中,相对于贮藏初期0 d,4 ℃贮藏红托竹荪干品中还原型谷胱甘肽在第42天呈上调表达,但37 ℃贮藏红托竹荪干品中还原型谷胱甘肽、酪氨酸在第42天呈下调表达,故推断,4 ℃低温贮藏可以通过增加这几类巯基氨基酸的含量来延缓红托竹荪干品贮藏期间褐变,高温处理因降低了这几类巯基氨基酸的含量导致红托竹荪贮藏期间褐变严重。此外,苏氨酸、丝氨酸、赖氨酸、组氨酸、苯丙氨酸、谷氨酰胺等17种差异氨基酸在HT-42 d vs CK-0 d比较组中显著下调,有研究表明[21],在30 ℃以上贮藏期间更易发生的褐变,是由非酶促褐变的美拉德反应所致,所以,这些氨基酸含量显著降低可能是因为参与美拉德反应,导致红托竹荪干品发生褐变。
近年来的研究表明,果蔬贮藏中的能量亏缺能引起细胞膜的损伤,加剧果蔬褐变的发生[22]。LI等[9]认为鲜切马铃薯贮藏过程褐变的发生与腺嘌呤、AMP含量增加有关。王志华等[23]发现低温诱导处理可减少苹果贮藏过程中ATP和ADP的含量,这2种核苷酸含量的减少会加速苹果果肉的褐变。本研究结果显示,褐变程度中等的竹荪干品(RT-42 d)和贮藏初期的竹荪干品(CK-0 d)富集的代谢通路中,IMP、黄嘌呤和腺嘌呤在25 ℃贮藏过程中相对表达丰度减少,ADP相对表达丰度增加,核苷酸代谢途径显著。褐变程度严重的竹荪干品(HT-42 d)和贮藏初期竹荪样品(CK-0 d)富集的代谢通路中,发现NAD、NADH和NAD+都呈下调表达,AMP和ADP显著上调,能量代谢通路呈显著性差异,所以推测红托竹荪干品高温贮藏发生的褐变可能与能量代谢有关,这与LI等[24]研究白蘑菇褐变时的研究结果类似。
4 结论
红托竹荪干品在贮藏过程中共鉴定出1 690种代谢产物,主要包括羧酸及其衍生物、脂肪酰基、异戊二烯脂质等物质。与贮藏初期(CK-0 d)相比,显著差异代谢物的个数随贮藏温度的升高呈增加的趋势。KEGG代谢通路富集分析表明,还原型谷胱甘肽、天冬氨酸和谷氨酰胺等11种差异代谢物可作为竹荪干品4 ℃冷藏过程中品质变化的潜在生物标记物;吲哚、富马酸、色氨酸、谷氨酰胺、精氨酸、ADP、黄嘌呤等21种差异代谢物可作为竹荪干品25 ℃贮藏过程中品质变化的潜在生物标记物;海藻糖、异柠檬酸、还原型谷胱甘肽、丝氨酸、酪氨酸、亚麻酸、ADP、AMP、苯酚、邻苯二甲酸和邻苯二酚等33种差异代谢物可作为竹荪干品37 ℃贮藏过程中品质变化的潜在生物标记物。红托竹荪干品在不同温度贮藏过程中,儿茶素、邻苯二酚、表儿茶素和D-氨基苯甲酸等酚类差异代谢物的含量显著下降,这些代谢物质可能作为红托竹荪干品褐变的底物,被逐渐氧化消耗;酪氨酸、丝氨酸、苯丙氨酸、谷氨酰胺等氨基酸含量也被显著下调,可能是因为参与美拉德反应,导致贮藏期间红托竹荪干品发生严重褐变。在HT-42 d vs CK-0 d样本中,发现NAD和NADH差异代谢物呈下调表达,AMP和ADP被显著上调,能量代谢通路呈显著性差异,推测红托竹荪干品高温贮藏的褐变发生可能与能量代谢有关。本研究结果为进一步揭示不同温度贮藏过程中红托竹荪褐变的作用机理提供了新的思路。
[1] ZHANG Y Q,WEI S N,XIONG Q Q,et al.Ultrasonic-assisted extraction of Dictyophora rubrovolvata volva proteins:Process optimization,structural characterization,intermolecular forces,and functional properties[J].Foods,2024,13(8):1265.
[2] XIA Z Q,WANG R,MA C,et al.Effect of controlled atmosphere packaging on the physiology and quality of fresh-cut Dictyophora rubrovolvata[J].Foods,2023,12(8),1665.
[3] 董慧,赵晓燕,李晓贝,等.贵州红托竹荪和冬荪的品质评价[J].食品科学,2024,45(20):198-205.DONG H,ZHAO X Y,LI X B,et al.Quality evaluation of Dictyophora rubrovolvata and Phallus dongsun in Guizhou[J].Food Science,2024,45(20):198-205.
[4] SUN L P,BAO C J,CHANG W D,et al.Preparation,characterisation,antioxidant and antiglycation activities of the novel polysaccharides from the pileus of Dictyophora rubrovolvata[J].International Journal of Food Science &Technology,2017,52(1):161-170.
[5] ZHANG X,WANG R,ZHANG W C,et al.Microwave treatment for Dictyophora rubrovolvata in regulating postharvest autolysis and energy metabolism[J].Food and Bioprocess Technology,2024,17(12):4694-4710.
[6] 夏紫茜,王瑞,马超,等.不同温度、气体微环境对红托竹荪干品储藏品质的影响[J].菌物学报,2022,41(12):2057-2073.XIA Z Q,WANG R,MA C,et al.Effects of different temperature and gaseous micro-environment on storage quality of dried Dictyophora rubrovolvata[J].Mycosystema,2022,41(12):2057-2073.
[7] 王森.超声波对石榴果实品质的影响及基于代谢组解析褐变机理[D].郑州:河南农业大学,2023.WANG S.Effect of ultrasound on pomegranate fruit quality and analyzing browning mechanism based on metabolome[D].Zhengzhou:Henan Agricultural University,2023.
[8] FU Y,YU Y,TAN H,et al.Metabolomics reveals dopa melanin involved in the enzymatic browning of the yellow cultivars of East Asian golden needle mushroom (Flammulina filiformis)[J].Food Chemistry,2022,370:131295.
[9] LI B H,FU Y J,XI H,et al.Untargeted metabolomics using UHPLC-HRMS reveals metabolic changes of fresh-cut potato during browning process[J].Molecules,2023,28(8):3375.
[10] ZHANG L,WANG Z Q,ZENG S X,et al.Browning mechanism in stems of freshcut lettuce[J].Food Chemistry,2023,405:134575.
[11] GAO F H,XIE W Y,ZHANG H,et al.Metabolomic analysis of browning mechanisms of morels (Morchella sextelata) during storage[J].Postharvest Biology and Technology,2022,185:111801.
[12] 刘庆庆,丁有财,冯绍彪,等.竹荪褐变机理的初探[J].安徽农学通报,2020,26(11):36-38.LIU Q Q,DING Y C,FENG S B,et al.Preliminary study on the browning mechanism of Dictyophora[J].Anhui Agricultural Science Bulletin,2020,26(11):36-38.
[13] ZENG S Y,WANG B,ZHAO D L,et al.Microwave infrared vibrating bed drying of ginger:Drying qualities,microstructure and browning mechanism[J].Food Chemistry,2023,424:136340.
[14] 杨晶,沙迪昕,张月,等.不同贮藏条件下干辣椒颜色劣变的主要途径[J].食品研究与开发,2024,45(4):58-67.YANG J,SHA D X,ZHANG Y,et al.Main paths of color deterioration of dried peppers under different storage conditions[J].Food Research and Development,2024,45(4):58-67.
[15] 牛丽影,胡丽丽,李大婧,等.草莓脯贮藏期间非酶褐变的化学途径分析[J].食品科学,2022,43(17):248-254.NIU L Y,HU L L,LI D J,et al.Chemical pathway analysis of non-enzymatic browning in preserved strawberry during storage[J].Food Science,2022,43(17):248-254.
[16] TILLEY A,MCHENRY M P,MCHENRY J A,et al.Enzymatic browning:The role of substrates in polyphenol oxidase mediated browning[J].Current Research in Food Science,2023,7:100623.
[17] XU Z J,YANG Z H,JI J F,et al.Polyphenol mediated non-enzymatic browning and its inhibition in apple juice[J].Food Chemistry,2023,404:134504.
[18] 李彩云,李洁,严守雷,等.果蔬酶促褐变机理的研究进展[J].食品科学,2021,42(9):283-292.LI C Y,LI J,YAN S L,et al.Progress in research on the mechanism of enzymatic browning in fruits and vegetables[J].Food Science,2021,42(9):283-292.
[19] GACCHE R N,WARANGKAR S C,GHOLE V S.Glutathione and cinnamic acid:Natural dietary components used in preventing the process of browning by inhibition of polyphenol oxidase in apple juice[J].Journal of Enzyme Inhibition and Medicinal Chemistry,2004,19(2):175-179.
[20] WILLS R B H,LI Y X.Use of arginine to inhibit browning on fresh cut apple and lettuce[J].Postharvest Biology and Technology,2016,113:66-68.
[21] 吴胤霆,王洋,付继梅,等.护色剂和贮藏温度对南酸枣糕非酶促褐变的影响[J].食品科技,2022,47(4):40-47.WU Y T,WANG Y,FU J M,et al.Effects of color protectants and storage temperature on non enzymatic browning of Choerospondias axillaris cake[J].Food Science and Technology,2022,47(4):40-47.
[22] 王静.能量亏缺对果蔬采后组织衰老、褐变与病害的影响[J].保鲜与加工,2020,20(1):237-242.WANG J.Effects of energy deficiency on tissue senescence,browning and diseases of postharvest fruits and vegetables[J].Storage and Process,2020,20(1):237-242.
[23] 王志华,贾朝爽,王文辉,等.低温贮藏对‘金红’苹果能量代谢和品质的影响[J].园艺学报,2020,47(12):2277-2289.WANG Z H,JIA C S,WANG W H,et al.Effects of low temperature storage on energy metabolism,related physiology and quality in ‘Jinhong’ apple fruit[J].Acta Horticulturae Sinica,2020,47(12):2277-2289.
[24] LI L,KITAZAWA H,ZHANG X H,et al.Melatonin retards senescence via regulation of the electron leakage of postharvest white mushroom (Agaricus bisporus)[J].Food Chemistry,2021,340:127833.