果蔬作为人类膳食结构的重要组成部分,其采后品质与安全性不仅影响消费者的健康,还对产业链的可持续发展产生深远影响。在果蔬采后流通环节,微生物侵染引发的腐败变质是亟待解决的关键问题[1]。据联合国粮农组织统计,全球每年约有30%的果蔬因微生物污染在供应链中损耗,由此引发的经济浪费与食源性疾病风险已成为制约产业升级的瓶颈问题[2]。当前主流的微生物控制技术中,传统方法如化学杀菌剂(NaClO、ClO2)虽应用广泛,但其化学残留引发的毒性与病原菌耐药性风险饱受争议;物理方法(紫外线、辐照)则受限于设备成本高且对果蔬品质存在潜在损伤。因此,开发高效、安全且环境友好的新型杀菌技术已成为果蔬行业迫切需要解决的问题。
电解水(electrolyzed water,EW)因具备广谱杀菌性在食品加工领域受到广泛关注。其中,酸性电解水(acidic electrolyzed water,AEW)已实现一定程度的产业化应用,但其强酸性(pH 2.0~3.0)导致的设备腐蚀及高质量浓度活性氯(>50 mg/L)衍生的健康风险限制了其适用范围[3]。相较而言,自来水基中性电解水(tap water-based neutral electrolyzed water,TNEW)[4]通过电解自来水原位生成羟自由基(·OH)及微量活性氯,在避免外源添加剂的同时实现无选择性杀菌。TNEW终产物仅为水,兼具环境友好性与经济性,展现出替代传统含氯消毒剂的潜力。尽管已有研究报道了TNEW在癌细胞增殖抑制[5]与水培系统抑菌[6]中的应用,但其对果蔬常见微生物的杀灭效果与机制、对真实果蔬样品的应用效果及品质影响等,仍缺乏系统研究。
鉴于此,本研究聚焦TNEW的杀菌机制,及对真实果蔬样品的应用效果评价。以大肠杆菌(Escherichia coli)和金黄色葡萄球菌(Staphylococcus aureus)等2种在果蔬中常见的微生物为对象,系统研究了TNEW的杀灭效果,及对微生物细胞膜完整性、细胞壁通透性、胞内生物分子含量、细胞形态等影响,解析TNEW的杀菌机制。进一步,以真实果蔬样品为对象,探究TNEW的杀菌效果及对其抗坏血酸含量的影响以加深对TNEW杀菌机制的理解,并为TNEW在果蔬采后预处理的工业化应用提供理论依据与技术范式。
1 材料与方法
1.1 材料
新鲜生菜和蓝莓购自浙江省湖州市德清县世纪联华超市,要求新鲜度佳,大小均匀,无病虫害和破损痕迹,成熟度相近。
供试菌株为E.coli(编号:CMCC 44102)和S.aureus(编号:CMCC 26003),中国微生物菌种保藏管理中心。
1.2 试剂与仪器
培养基:平板计数琼脂(plate count agar,PCA)、营养琼脂(nutrient agar,NA)、LB肉汤,杭州邦易化工有限公司。
化学试剂:NaCl、NaOH、NaNO2、Na2CO3、无水乙醇、Al(NO3)3、福林酚、三氯乙酸(trichloroacetic acid,TCA)、FeCl3、H3PO4(分析纯),国药集团化学试剂有限公司;芦丁、没食子酸(分析纯),上海泰坦科技股份有限公司。
检测试剂盒:BCA蛋白浓度测定试剂盒、三磷酸腺苷(adenosine triphosphate,ATP)检测试剂盒,上海碧云天生物技术有限公司;碱性磷酸酶(alkaline phosphatase,AKP)测定试剂盒,南京建成生物工程研究所。
仪器设备:KL-SC01食材清洗消毒一体机—TNEW电极发生装置,浙江康蕾科技有限公司;PTY-124/223电子天平,福建华志电子科技有限公司;SCB-VF2A超净工作台,苏州西班泰克净化设备有限公司;IMJ-54A高压灭菌锅,上海施都凯仪器设备有限公司;LRH-250F生化培养箱,上海一恒科学仪器有限公司;ZHWY-200B恒温振荡摇床,上海智城分析仪器制造有限公司;CR22N高速冷冻离心机、SU8100场发射扫描电镜,日立高新技术国际贸易有限公司。
1.3 实验方法
1.3.1 菌悬液的制备
将活化后的E.coli和S.aureus在NA平板上进行划线培养后,采用无菌接种环挑取单个菌落,接种于LB肉汤培养基中,置于37 ℃、150 r/min下振荡培养12 h。培养结束,在4 ℃、8 000 r/min条件下离心10 min,将所得细菌团块经无菌生理盐水洗涤3次后重悬,采用OD600值校准法调整菌悬液浓度为1×107 CFU/mL。
1.3.2 TNEW杀菌效果评估
取上述菌悬液6 L置于清洗槽中,启动TNEW电极发生装置。分别处理0、3、6、9、12、15 min时取样,进行存活菌数的测定。样品经梯度稀释后,取1 mL稀释液涂布于NA平板,每个稀释梯度设2个重复,经37 ℃培养48 h后统计菌落形成单位(CFU)。实验结果以对数值表示,单位为lg CFU/mL。
1.3.3 细胞膜完整性的测定
将处理后的菌液在4 ℃、8 000 r/min离心5 min,取上清液。使用紫外分光光度计测定其在260、280 nm波长下吸光度值(OD260和OD280),评估胞内核酸和蛋白的泄漏情况。
1.3.4 细胞壁通透性的测定
将处理后的菌液在4 ℃、10 000 r/min离心10 min,取上清液。按照试剂盒说明书测定胞外AKP活性。
1.3.5 胞内蛋白含量的测定
将处理后的菌液在4 ℃、10 000 r/min离心10 min,弃上清液,留细胞沉淀。用磷酸盐缓冲液洗涤3次并重悬,冰浴超声波破碎(功率300 W,10 min,间隔1.1 s),按照BCA蛋白浓度测试盒说明书测定胞内蛋白含量。
1.3.6 胞内ATP含量的测定
将处理后的菌液在4 ℃、10 000 r/min离心10 min,弃上清液,留细胞沉淀。按照检测试剂盒说明书测定胞内ATP含量。
1.3.7 表面微观结构的观察
收集TNEW处理9 min的E.coli和S.aureus菌液,在4 ℃、8 000 r/min离心5 min,弃上清液,留细胞沉淀。加入4 ℃预冷的2.5%戊二醛溶液固定过夜,离心收集固定后的细胞,用0.1 mol/L磷酸缓冲液(pH 7.4)洗涤2次。随后依次用30%、50%、70%、80%、90%、100%(体积分数)的乙醇溶液分级洗脱,每种浓度洗脱15 min。样品临界点干燥后铂金喷涂镀膜,使用扫描电镜观察细胞形态。
1.3.8 生菜和蓝莓的TNEW处理
选取新鲜生菜,剔除外层破损叶片,取主茎两侧深绿色部分切成4 cm×4 cm规格样本;筛选成熟度一致,直径约18 mm,单果重约5 g的蓝莓,去除果梗后备用。实验样本分为3个处理组:①无污染样本,保留其天然存在的微生物群落,用于菌落总数的测定;②E.coli接种样本;③S.aureus接种样本。
样本接种步骤如下:首先将样品置于50 mg/L二氧化氯水溶液中浸泡15 min进行表面消毒,随后用无菌水冲洗晾干备用。按照料液比1:9(g:mL)将预处理后的果蔬样品放入浓度约为1×107 CFU/mL的E.coli和S.aureus菌悬液中浸泡10 min。取出样品置于生物安全柜中风干,随后装入无菌保鲜盒,于4 ℃条件下静置5 h,以确保微生物充分附着。
将上述每大类果蔬样品随机分为2组:①对照组:将样品置于6 L自来水中,分别浸泡0、3、6、9、12、15 min;②TNEW处理组:将样品置于6 L自来水,置入TNEW电极发生装置,通电处理0、3、6、9、12、15 min。所有处理后的样品均装入无菌采样袋待测。
微生物的测定根据GB 4789.2—2022《食品安全国家标准 食品微生物学检验 菌落总数测定》中的方法进行。
1.3.9 果蔬抗坏血酸含量的测定
采用分光光度计法[7]进行测定。称取10 g果蔬样品,加入20 mL 50 g/L TCA溶液,冰浴研磨至匀浆,用TCA溶液定容至100 mL,提取10 min后过滤。取1 mL滤液,依次加入1 mL TCA溶液、1 mL无水乙醇,0.5 mL磷酸-乙醇溶液、1 mL红菲咯啉-乙醇溶液、0.5 mL氯化铁-乙醇溶液,将混合液置于30 ℃下反应60 min,测定反应液在534 nm波长下的吸光度。以抗坏血酸为标准品绘制标准曲线。抗坏血酸含量按公式(1)计算:
抗坏血酸含量![]()
(1)
式中:mc,从标曲中求得的抗坏血酸质量,μg;Vs,测定时所用样品提取液体积,mL;V,样品提取液总体积,mL;m,样品质量,g。
1.4 数据统计与分析
每个实验重复3次,数据以“平均值±标准差”表示。使用Excel 2023整理数据,采用Origin 64进行统计分析并绘图,SPSS 26进行正态检验和单因素方差分析,Tukey检验进行多重比较,P<0.05表示差异显著。
2 结果与讨论
2.1 TNEW处理对E.coli和S.aureus悬浮液杀菌效果的影响
如表1所示,E.coli和S.aureus的初始浓度分别为(6.72±0.02)、(7.25±0.19) lg CFU/mL,经TNEW处理3 min后,菌液浓度分别降至(4.52±0.05)、(1.06±0.08) lg CFU/mL。随着处理时间延长至6、9 min时,E.coli浓度持续下降至(3.87±0.11)、(2.39±0.29) lg CFU/mL,而S.aureus在6 min处理组中已低于检测限(<1.0 lg CFU/mL)。统计学分析显示,TNEW处理对2种细菌均具有显著的杀灭效果(P<0.05),且对S.aureus的灭活速率高于E.coli。这一结果与HAO等[8]的研究结果一致。猜测这种差异可能与2种细菌细胞壁结构差异相关:S.aureus细胞壁含有大量的肽聚糖和磷壁酸,而E.coli细胞壁肽聚糖含量极低且不含磷壁酸,但其外膜结构复杂,包括脂多糖、磷脂层和脂蛋白,其脂多糖层可作为阻渗透层有效延缓·OH和活性氯对细胞的攻击[9]。WANG等[10]通过表面增强拉曼光谱研究也发现,AEW必须先作用于革兰氏阴性菌的外膜系统,通过氧化破坏外膜脂多糖结构,降低其疏水性,继而增强·OH和活性氯的渗透。相比之下,S.aureus因缺乏外膜屏障,其肽聚糖层更易受到直接攻击而遭到破坏。上述结果表明,TNEW的杀菌效果受目标菌株细胞壁结构的影响,其中革兰氏阴性菌外膜的复杂结构对·OH和活性氯的渗透具有一定的阻碍作用。
表1 TNEW对E.coli和S.aureus悬浮液的杀菌效果
Table 1 Bactericidal effect of TNEW on E.coli and S.aureus in suspensions

细菌名称处理时间/min存活菌数/ lgCFU/mL 杀灭对数值/ lgCFU/mL E.coli06.72±0.02a34.52±0.05b63.87±0.11b92.39±0.29b12NDb15NDb02.202.854.33>6.72S.aureus07.25±0.19a31.06±0.08b6NDb9NDb12NDb15NDb06.19>7.25
注:ND表示通过平板计数法未检测到活菌(低于检测限1.0 lg CFU/mL);不同小写字母表示组内差异显著(P<0.05)(下同)。
2.2 TNEW对E.coli和S.aureus的杀灭机制
2.2.1 TNEW对细菌细胞膜完整性的影响
细胞质内容物外渗是衡量细胞膜完整性的重要指标。当细胞膜受损失,核酸和蛋白质等生物大分子会从细胞内泄露出来[11]。为此,通过检测上清液的OD260值(核酸特征吸收波长)和OD280值(蛋白质特征吸收波长)来评估TNEW对细胞膜完整性的影响。如图1所示,随着TNEW处理时间的延长,E.coli和S.aureus上清液的OD260和OD280值均呈显著上升趋势(P<0.05)。与对照组的OD260和OD280值相比(E.coli:0.049/0.033;S.aureus:0.050/0.038),经TNEW处理3、6、9、12、15 min后,E.coli和S.aureus上清液的OD260值分别增加至0.134、0.272、0.404、0.524、0.627和0.105、0.231、0.394、0.526、0.643,OD280值分别增加至0.265、0.612、0.936、1.242、1.540和0.165、0.497、0.886、1.224、1.538。结果表明,TNEW处理可显著破坏E.coli和S.aureus的细胞膜完整性,导致其通透性增加,进而引发胞内核酸和蛋白质等大分子的持续外泄。该结果与荧光素二乙酸酯-碘化丙啶双染色实验结论一致[12-13],微酸性电解水可破坏细胞膜完整性和损伤细胞酯酶活性。这一结果表明,TNEW中的·OH和活性氯可能通过攻击细胞膜,引发其氧化损伤,继而造成细胞内含物的外泄。细胞膜作为维持微生物正常生理功能的关键屏障,当细胞膜发生不可逆损伤时,会导致跨膜电位崩溃、渗透压失衡及物质转运功能障碍等,最终引发细胞死亡[14]。
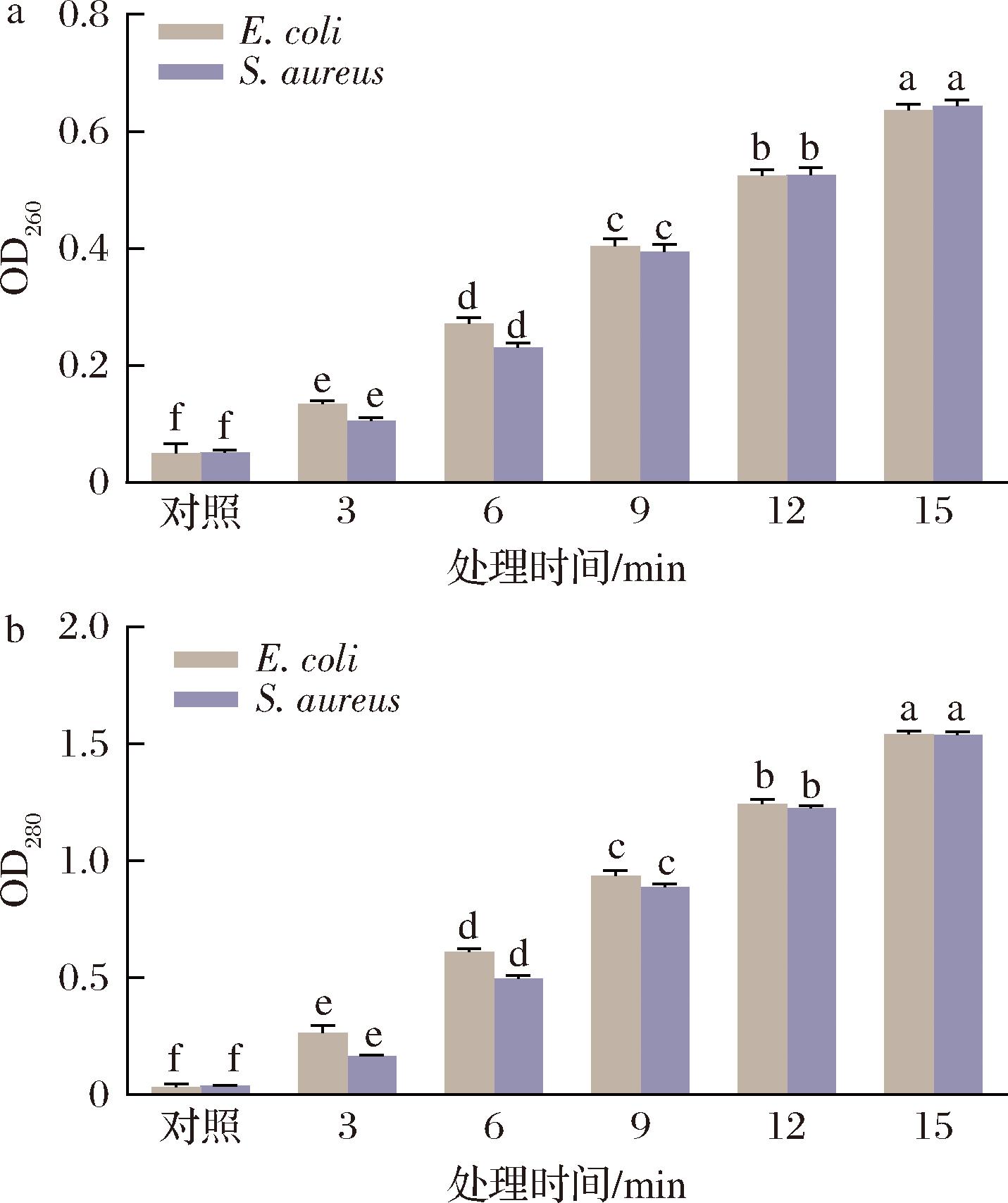
a-细菌核酸;b-蛋白质
图1 TNEW对细菌核酸和蛋白质泄漏量的影响
Fig.1 Effect of TNEW on the leakage of bacterial nucleic acid and protein
注:不同小写字母表示组内差异显著(P<0.05)(下同)。
2.2.2 TNEW对细菌细胞壁通透性的影响
AKP作为定位于细菌细胞周质空间的标志性酶,其释放量与细胞壁结构完整性密切相关。当细胞壁受损时,AKP会从周质空间泄漏至胞外,导致胞外AKP活性升高,因此其胞外释放量可作为评估细胞壁完整性的有效生物标志物[15]。实验数据显示(图2-a),对照组中E.coli和S.aureus的细胞外AKP活性分别为0.24、0.09 U/100 mL,经TNEW处理3、6、9、12、15 min后,2种细菌的胞外AKP活性依次升至1.78、2.38、2.75、3.00、3.08 U/100 mL和1.05、1.82、2.48、2.60、2.69 U/100 mL。这种时间依赖性损伤表明,TNEW处理对细胞壁完整性的破坏随处理时间的延长而持续增强(P<0.05)。上述结果与张晓丽[16]的电化学消毒实验结果一致。TNEW产生的·OH可能优先攻击细胞壁肽聚糖的关键化学键(β-1,4糖苷键),导致细胞壁网状结构解体[17];同时,活性氯凭借其高渗透特性,可穿透细胞壁屏障,通过修饰细胞壁特异性酶(青霉素结合蛋白)的活性位点,抑制肽聚糖交联修复过程[18]。这种双途径协同作用导致细胞壁完整性受到破坏,进而引发渗透压调节功能丧失、代谢紊乱及细胞形态改变,最终导致细胞生长抑制和程序性死亡。
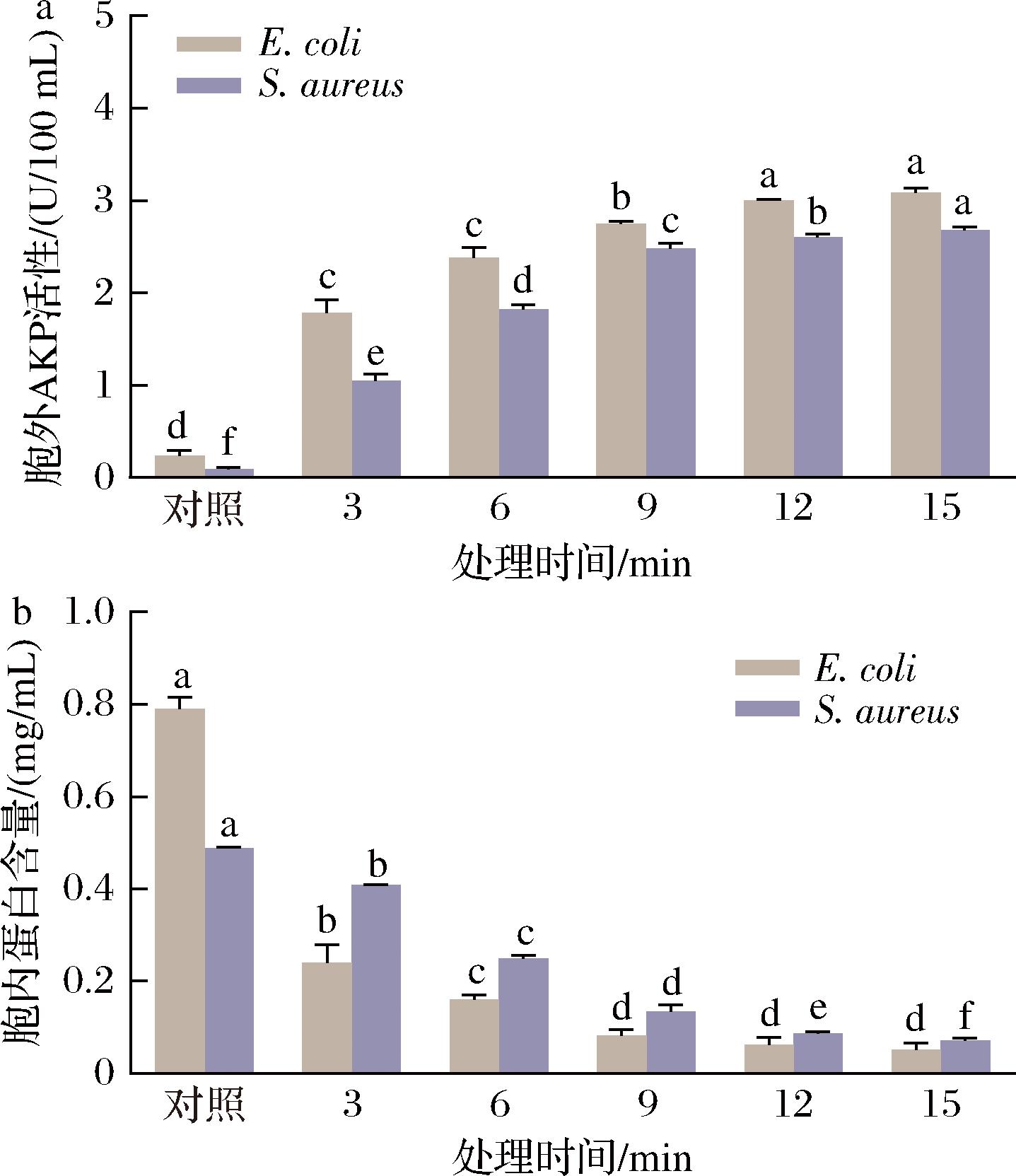
a-胞外AKP活性;b-胞内蛋白含量
图2 TNEW对细菌胞外AKP活性和胞内蛋白含量的影响
Fig.2 Effects of TNEW on extracellular AKP activity and intracellular protein content of bacteria
2.2.3 TNEW对细菌胞内蛋白质含量的影响
胞内蛋白质作为细菌代谢调控的关键功能分子,其含量动态变化可有效表征细胞生理状态和功能完整性[19]。如图2-b所示,TNEW处理可显著诱导E.coli和S.aureus胞内蛋白质浓度下降(P<0.05)。对照组中2种细菌的胞内蛋白质量浓度分别为0.79、0.49 mg/mL,而经TNEW处理3、6、9、12、15 min后分别降至0.24、0.16、0.08、0.06、0.05 mg/mL和0.41、0.25、0.13、0.09、0.07 mg/mL。该结果与2.2.1节中胞外蛋白吸光度(OD280值)的递增趋势相吻合,进一步证实TNEW会通过破坏细胞壁和细胞膜完整性形成蛋白质外泄通道,导致胞内蛋白质大量外泄。同时,·OH和活性氯通过外泄通道渗透至细胞内部,通过调控胞内糖酵解途径关键酶和氨基酸代谢相关蛋白(如磷酸果糖激酶及谷氨酰胺合成酶)的表达,干扰细菌的代谢途径[20]。此外,活性氧积累引发DNA的氧化损伤,导致遗传信息传递和复制功能丧失,从而加速细胞死亡[8]。
2.2.4 TNEW对细菌胞内ATP代谢的影响
ATP作为细菌能量代谢的核心载体,其胞内动态平衡可直观反映微生物的代谢活性及能量稳态[21]。本研究通过荧光素酶法检测发现(图3),TNEW处理可显著抑制E.coli和S.aureus的胞内ATP代谢(P<0.05)。实验数据显示,对照组中E.coli和S.aureus的胞内ATP含量分别为2.06、1.45 μmol/L,经TNEW处理3 min后分别下降至1.45、1.33 μmol/L,延长TNEW的处理时间,两者的ATP含量基本稳定在1.30 μmol/L。初步推测TNEW处理初期(<3 min)胞内ATP含量显著下降与ATP生物合成受阻和代谢消耗加剧有关:一方面,TNEW可能通过抑制呼吸链脱氢酶活性降低氧化磷酸化效率[22];另一方面,·OH和活性氯诱导的DNA损伤可能激活SOS修复系统,导致ATP储备过度消耗[23]。然而,当处理时间超过6 min后,ATP含量处于降幅趋缓,结合前期膜通透性(2.2.1节)及蛋白质代谢研究(2.2.3节),认为细胞已进入不可逆死亡阶段,具体表现为:细胞膜完整性丧失引发质子梯度崩溃,抗氧化系统失效导致能量代谢网络瓦解,ATP合成与消耗通路终止。此时检测到的ATP可能源于细胞裂解释放的胞内组分[24]。ATP的含量变化表明,TNEW的杀菌机制主要源于其对细胞壁/膜复合结构的靶向损伤:通过破坏细胞壁和细胞膜完整性,导致胞内成分大量外泄。
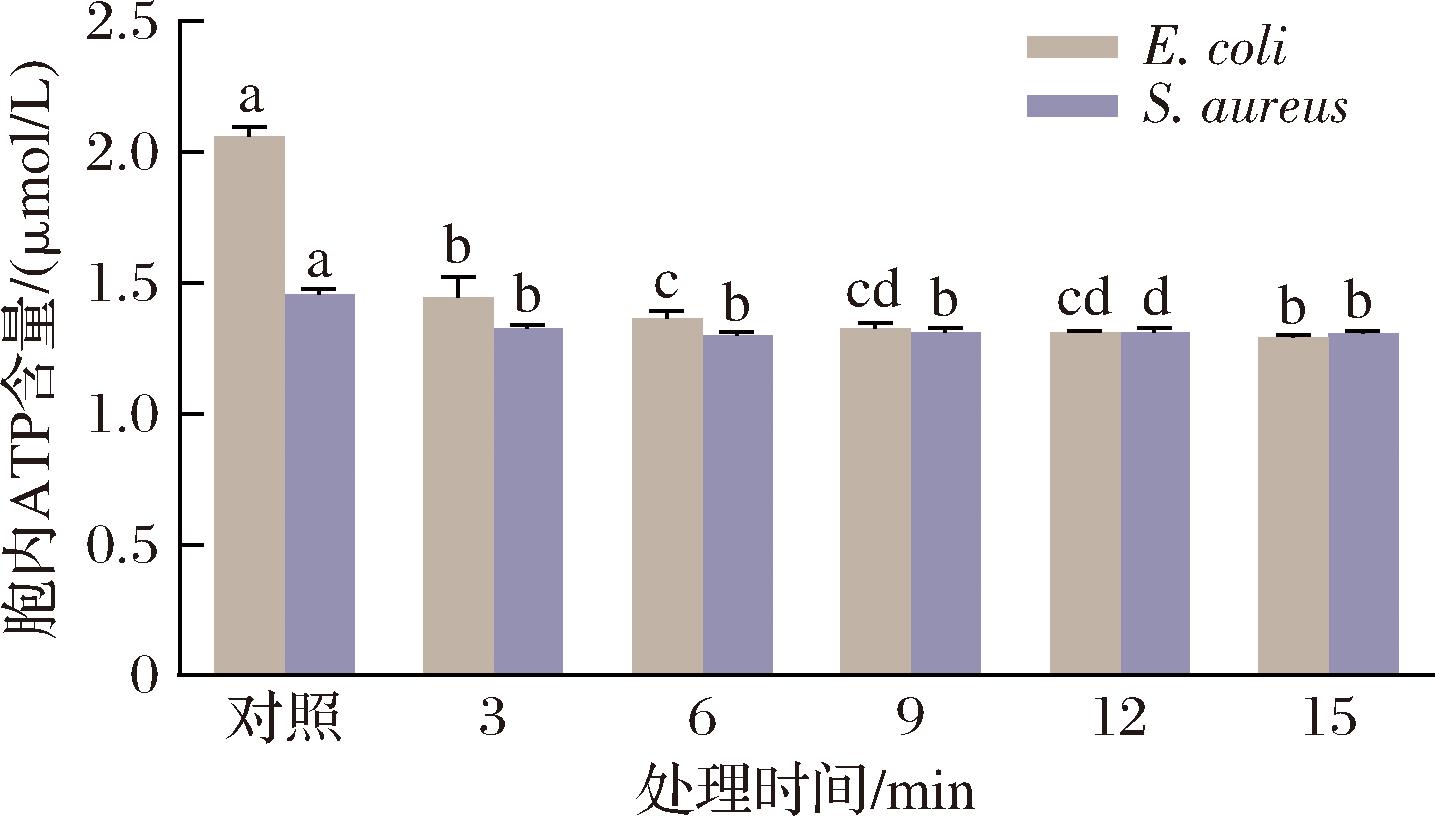
图3 TNEW对细菌胞内ATP含量的影响
Fig.3 Effect of TNEW on intracellular ATP content of bacteria
2.2.5 TNEW对细菌表面微观结构的影响
通过扫描电镜观察TNEW处理9 min后的细菌微观结构,结果如图4所示。对照组的E.coli呈规则的长杆状,表面光滑且分散均匀(图4-a);经TNEW处理后,菌体发生显著形变,表现为长度缩短,表面膜结构大面积崩解(红色箭头所示),并伴有胞质内容物外泄及细胞间异常黏附(图4-b)。对照组S.aureus表现为包裹致密的规则球形、表面完整光滑(图4-c);而处理组S.aureus细胞表面粗糙度增加,形变明显,出现皱缩与凹陷,生物膜部分消失(图4-d)。结果表明,TNEW产生的·OH和活性氯能诱导细胞形态改变。

a-对照组E.coli;b-TNEW处理的E.coli;c-对照组S.aureus;d-TNEW处理的S.aureus
图4 TNEW处理9 min对细菌表面微观结构的影响
Fig.4 Effect of TNEW treatment for 9 min on the surface microstructure of bacteria
2.3 TNEW对果蔬杀菌效果及对其品质的影响
2.3.1 TNEW对果蔬微生物的杀灭作用
菌落总数作为评估微生物负载量的关键指标,其动态变化可有效量化清洗技术的卫生安全效能。如表2所示,TNEW处理可显著减少蓝莓和生菜表面的天然微生物负载量(P<0.05)。新鲜蓝莓的初始菌落总数为(2.37±0.09) lg CFU/g,经TNEW处理9 min后降至(1.77±0.17) lg CFU/g,低于自来水清洗组[(2.15±0.12) lg CFU/g]。生菜样本中,TNEW处理9 min使菌落总数从(5.32±0.04) lg CFU/g显著降低至(3.32±0.12) lg CFU/g,显著优于自来水组处理效果[(4.96±0.10) lg CFU/g]。值得注意的是,当处理时间≥9 min时,TNEW对果蔬表面的菌落清除效率趋于平缓,推测此现象可能与延长处理时间导致水温升高,加速·OH等活性成分失活有关[25]。同时由于·OH的半衰期极短,仅能作用于表面微生物,难易渗透至果蔬深层组织,因此对果蔬的减菌效果有限。基于上述发现,建议在实际应用中需优化清洗参数(建议6~9 min),在保证减菌效果的同时兼顾果蔬品质及能耗控制。
表2 TNEW处理对果蔬菌落总数的影响 单位:lg CFU/g
Table 2 Effect of TNEW treatment on the total number of colonies of fruits and vegetables
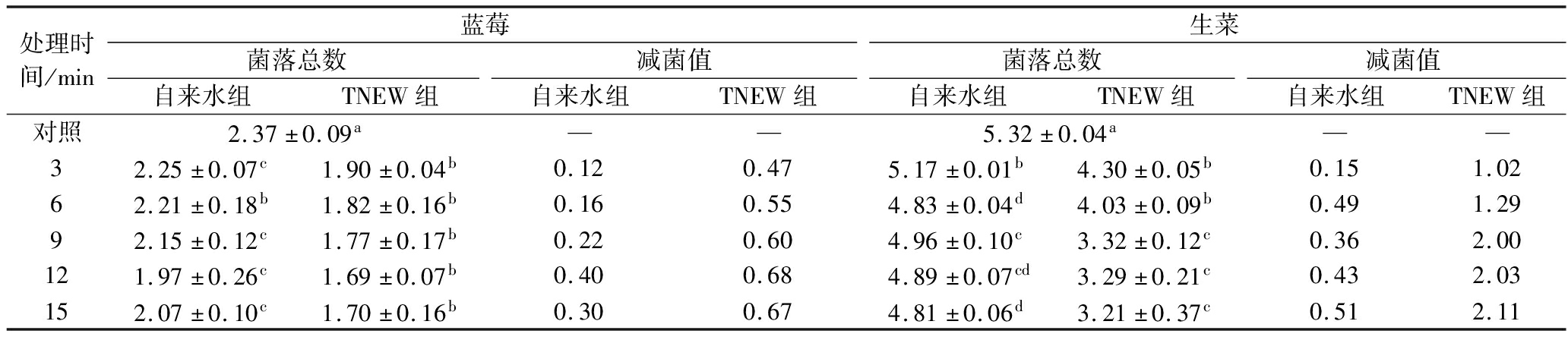
处理时间/min蓝莓生菜菌落总数减菌值菌落总数减菌值自来水组TNEW组自来水组TNEW组自来水组TNEW组自来水组TNEW组对照2.37±0.09a——5.32±0.04a——32.25±0.07c1.90±0.04b0.120.475.17±0.01b4.30±0.05b0.151.0262.21±0.18b1.82±0.16b0.160.554.83±0.04d4.03±0.09b0.491.2992.15±0.12c1.77±0.17b0.220.604.96±0.10c3.32±0.12c0.362.00121.97±0.26c1.69±0.07b0.400.684.89±0.07cd3.29±0.21c0.432.03152.07±0.10c1.70±0.16b0.300.674.81±0.06d3.21±0.37c0.512.11
通过浸渍法将E.coli和S.aureus人工接种于蓝莓和生菜表面,果蔬表面的E.coli和S.aureus初始接种量分别为(5.36±0.02)、(6.19±0.07) lg CFU/g和(6.06±0.06)、(7.12±0.07) lg CFU/g。如表3所示,经TNEW处理9 min后,两者表面的E.coli菌载量分别降至(4.24±0.04)、(5.01±0.06) lg CFU/g,显著低于自来水清洗组[(5.33±0.01)、(5.63±0.06) lg CFU/g](P<0.05)。如表4所示,S.aureus菌载量也分别下降至(4.07±0.18)、(5.77±0.20) lg CFU/g,而自来水清洗组中的S.aureus仍维持在(5.98±0.09)、(6.54±0.16) lg CFU/g(表4)。实验结果表明,TNEW能有效去除果蔬表面附着的S.aureus 和E.coli,且杀菌效果显著高于自来水。值得注意的是,传统自来水清洗仅能去除表面附着松散的菌体,这与INATSU等[26]关于传统清洗局限性的研究结论一致。此外,清洗废水中未检出活菌残留,证实TNEW技术具有防控微生物二次污染的环境友好特性。
表3 TNEW处理对果蔬大肠杆菌总数的影响 单位:lg CFU/g
Table 3 Effect of TNEW treatment on the total number of E.coli in fruits and vegetables
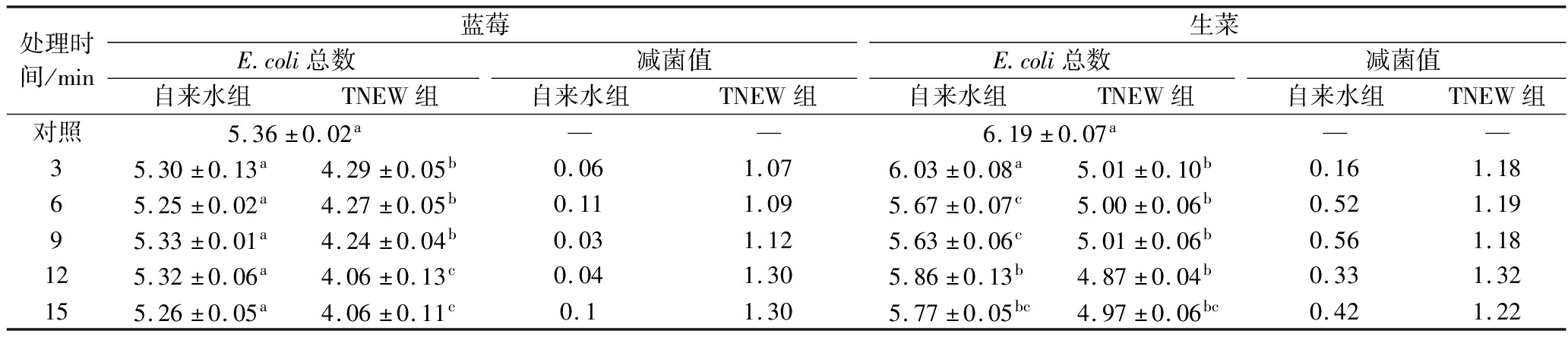
处理时间/min蓝莓生菜E.coli总数减菌值E.coli总数减菌值自来水组TNEW组自来水组TNEW组自来水组TNEW组自来水组TNEW组对照5.36±0.02a——6.19±0.07a——35.30±0.13a4.29±0.05b0.061.076.03±0.08a5.01±0.10b0.161.1865.25±0.02a4.27±0.05b0.111.095.67±0.07c5.00±0.06b0.521.1995.33±0.01a4.24±0.04b0.031.125.63±0.06c5.01±0.06b0.561.18125.32±0.06a4.06±0.13c0.041.305.86±0.13b4.87±0.04b0.331.32155.26±0.05a4.06±0.11c0.11.305.77±0.05bc4.97±0.06bc0.421.22
表4 TNEW处理对果蔬金黄色葡萄球菌总数的影响 单位:lg CFU/g
Table 4 Effect of TNEW treatment on the total number of S.aureus in fruits and vegetables
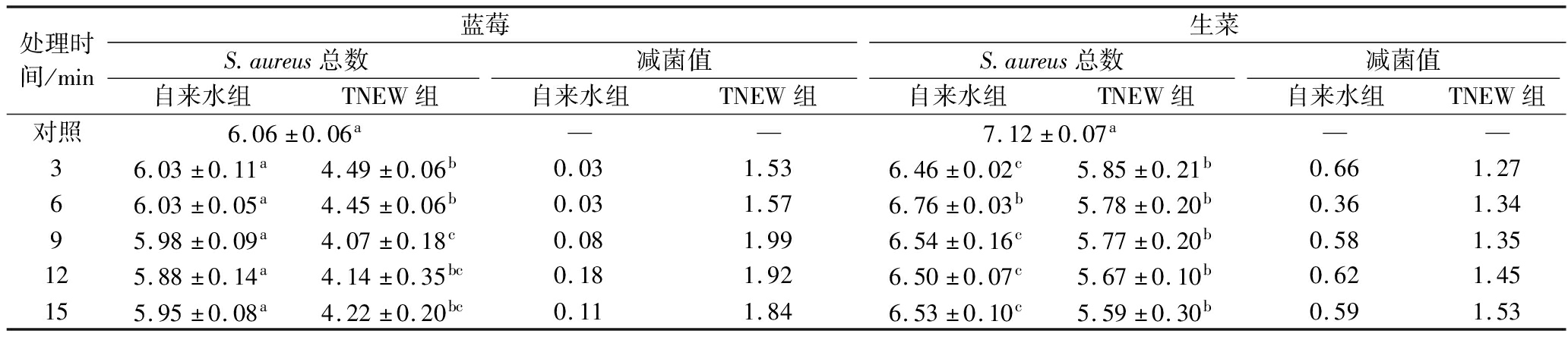
处理时间/min蓝莓生菜S.aureus总数减菌值S.aureus总数减菌值自来水组TNEW组自来水组TNEW组自来水组TNEW组自来水组TNEW组对照6.06±0.06a——7.12±0.07a——36.03±0.11a4.49±0.06b0.031.536.46±0.02c5.85±0.21b0.661.2766.03±0.05a4.45±0.06b0.031.576.76±0.03b5.78±0.20b0.361.3495.98±0.09a4.07±0.18c0.081.996.54±0.16c5.77±0.20b0.581.35125.88±0.14a4.14±0.35bc0.181.926.50±0.07c5.67±0.10b0.621.45155.95±0.08a4.22±0.20bc0.111.846.53±0.10c5.59±0.30b0.591.53
2.3.2 TNEW对抗坏血酸含量的影响
抗坏血酸作为果蔬中兼具营养功能与抗氧化特性的关键生物活性物质,其动态含量是评估采后处理技术对果蔬营养品质影响的重要指标。如图6所示,TNEW处理对生菜和蓝莓中的抗坏血酸含量未产生显著性影响(P>0.05)。实验数据显示,未经处理的蓝莓和生菜的抗坏血酸含量分别为(65.75±4.16)、(29.51±4.58) mg/100 g。经TNEW处理3、6、9、12、15 min后,测得蓝莓中抗坏血酸含量依次为:(69.23±2.04)、(61.94±1.67)、(62.22±1.52)、(69.71±0.33)、(71.43±0.41) mg/100 g,生菜中的抗坏血酸含量依次为:(27.24±1.55)、(28.69±1.10)、(30.56±1.19)、(27.42±3.73)、(27.99±3.39) mg/100 g,与对照组相比较均未呈现统计学差异。但观察到经TNEW处理的生菜样本中抗坏血酸含量普遍低于自来水清洗组,这一现象可能是由于样品切割过程中造成的机械损伤加速抗坏血酸流失或由于生菜组织结构较薄,TNEW产生的·OH和活性氯可能对抗坏血酸产生氧化作用。尽管如此,实验结果表明TNEW处理能够较好地维持果蔬中的抗坏血酸含量,与前人的研究结果[27]相吻合,即EW处理在有效降解果蔬表面微生物负载的同时,几乎不会对其营养品质产生显著影响。
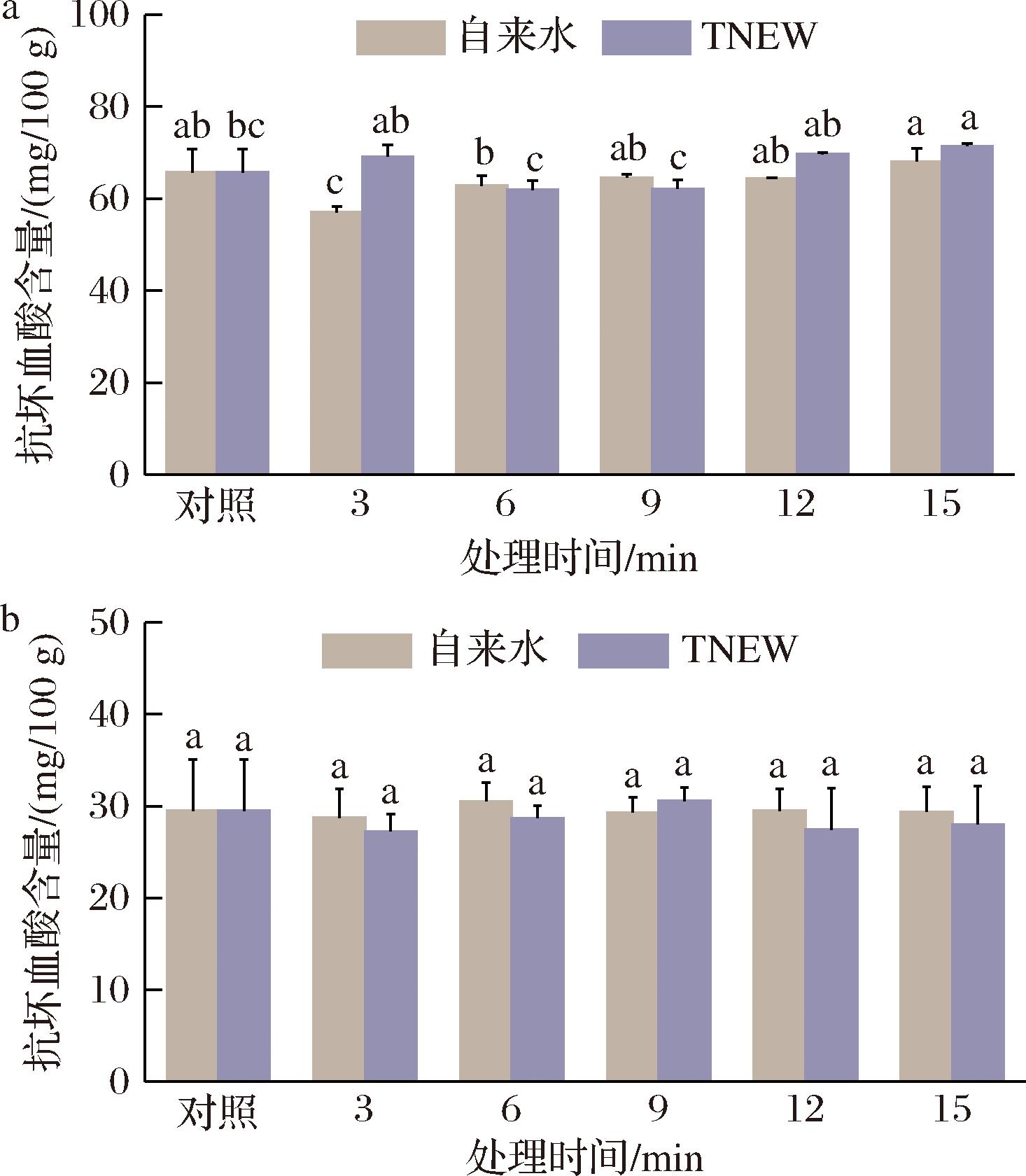
a-蓝莓;b-生菜
图6 TNEW处理对果蔬中抗坏血酸含量的影响
Fig.6 Effect of TNEW treatment on ascorbic acid content in fruits and vegetables
3 结论
本研究系统揭示了TNEW对常见腐败微生物(E.coli、S.aureus)的杀菌机制及其在鲜食果蔬清洗中的应用潜力。结果表明,TNEW对E.coli和S.aureus的杀菌效果呈时间依赖性,当处理E.coli 12 min、S.aureus 6 min时,2种菌悬液中的存活菌落数均降至检测限以下,且S.aureus因缺乏外膜屏障更易受TNEW攻击。机制研究显示,TNEW通过破坏细菌细胞壁与细胞膜完整性,诱导胞内核酸、蛋白质及AKP持续外泄,并显著降低胞内ATP水平,最终导致细胞形态崩解与代谢功能丧失。在真实果蔬体系中,TNEW清洗9 min可显著减少蓝莓和生菜中菌落总数(0.60、2.00 lg CFU/g),可分别减少E.coli载量1.12、1.18 lg CFU/g,减少S.aureus载量1.99、1.35 lg CFU/g,减菌效率显著优于传统自来水清洗(P<0.05)。此外,TNEW处理未对果蔬中抗坏血酸含量产生显著负面影响(P>0.05),表明其兼具高效杀菌性与营养品质保护能力。本研究结果为TNEW在果蔬清洗中的应用提供了理论依据与技术参数,也为食品非热减菌方法提供了新思路。
[1] SINGLA G,CHATURVEDI K,SANDHU P P.Status and recent trends in fresh-cut fruits and vegetables[M].Fresh-Cut Fruits and Vegetables.Amsterdam:Elsevier,2020:17-49.
[2] 王璐,蒋沙沙,李德海,等.乳酸菌对果蔬产品的抑菌机理及应用[J].中国食品学报,2024,24(2):432-441.WANG L,JIANG S S,LI D H,et al.Antimicrobial mechanism and application of lactic acid bacteria on fruit and vegetable products[J].Journal of Chinese Institute of Food Science and Technology,2024,24(2):432-441.
[3] HA J W,JEE D Y.Simultaneous treatment with tap water-based neutral electrolyzed water and citric acid for inactivating foodborne pathogens on stainless steel and their synergistic bactericidal mechanisms[J].LWT,2024,211:116927.
[4] JEE D Y,HA J W.Synergistic interaction of tap water-based neutral electrolyzed water combined with UVA irradiation to enhance microbial inactivation on stainless steel[J].Food Research International,2021,150:110773.
[5] NAKAMURA K,MURAOKA O.Effect of electrolyzed water produced using carbon electrodes on HeLa cell proliferation[J].Bioscience Trends,2018,11(6):688-693.
[6] SUGIHARTA I,SARI D I,FEBRIYANI V,et al.The application of response surface method in producing water spinach (Ipomoea reptans Poir) through hydroponics technique with iron-electrode electrolyzed water[J].Journal of Physics:Conference Series,2021,1796(1):012032.
[7] 罗志辉,陈丽娜,陈冠丹,等.新型紫外可见光法测定沙田柚中维生素C的含量[J].食品安全质量检测学报,2018,9(10):2321-2325.LUO Z H,CHEN L N,CHEN G D,et al.A novel UV-visible method for the detection of vitamin C in Shatian pumelo[J].Journal of Food Safety &Quality,2018,9(10):2321-2325.
[8] HAO J X,WU T J,LI H Y,et al.Differences of bactericidal efficacy on Escherichia coli,Staphylococcus aureus,and Bacillus subtilis of slightly and strongly acidic electrolyzed water[J].Food and Bioprocess Technology,2017,10(1):155-164.
[9] BREIJYEH Z,JUBEH B,KARAMAN R.Resistance of gram-negative bacteria to current antibacterial agents and approaches to resolve it[J].Molecules,2020,25(6):1340.
[10] WANG F,LIN Y N,XU Y,et al.Mechanisms of acidic electrolyzed water killing bacteria[J].Food Control,2023,147:109609.
[11] 于芳,王倩宁,田欢欢,等.石榴皮提取物对蜡样芽孢杆菌的抑菌活性及对细胞膜影响的研究[J].食品与发酵工业,2025,51(7):159-166.YU F,WANG Q N,TIAN H H,et al.Antibacterial activity of pomegranate peel extract against Bacillus cereus and its effect on cell membrane[J].Food and Fermentation Industries,2025,51(7):159-166.
[12] YE Z Y,WANG S,CHEN T,et al.Inactivation mechanism of Escherichia coli induced by slightly acidic electrolyzed water[J].Scientific Reports,2017,7:6279.
[13] LIAO X Y,XUAN X T,LI J,et al.Bactericidal action of slightly acidic electrolyzed water against Escherichia coli and Staphylococcus aureus via multiple cell targets[J].Food Control,2017,79:380-385.
[14] JEE D Y,HA J W.Inactivation of Escherichia coli O157:H7,Salmonella typhimurium,and Listeria monocytogenes on stainless steel by synergistic effects of tap water-based neutral electrolyzed water and lactic acid[J].Food Microbiology,2023,112:104233.
[15] XUAN X T,ZHANG Z Y,SHANG H T,et al.Microbial diversity and antibacterial mechanism of slightly acidic electrolyzed water against Pseudomonas fluorescens in razor clam during storage[J].Food Research International,2025,204:115929.
[16] 张晓丽.电化学消毒对抗生素耐药菌的灭活效果及机理研究[D].沈阳:沈阳工业大学,2024.ZhANG X L.Study on inactivation effect and mechanism of electrochemical disinfection on antibiotic-resistant bacteria[D].Shenyang:Shenyang University of Technology,2024.
[17] 杨晋一,耿珑瑶,杨乔越,等.苯乳酸-肉桂醛联用对腐败希瓦氏菌的协同抑菌效果及作用机制[J].食品与发酵工业,2025,51(15):80-87.YANG J Y,GENG L Y,YANG Q Y,et al.Synergistic bacteriostatic effect and mechanism of combination of phenyl lactic acid and cinnamaldehyde against Shewanella putrefaciens[J].Food and Fermentation Industries,2025,51(15):80-87.
[18] PITTAS T,ZUO W Y,BOERSMA A J.Cell wall damage increases macromolecular crowding effects in the Escherichia coli cytoplasm[J].iScience,2023,26(4):106367.
[19] 王晓芸,张婷,黄剑,等.3种多酚对腐败希瓦氏菌的抑菌效果和机理[J].食品科学,2024,45(16):1-9.WANG X Y,ZHANG T,HUANG J,et al.Antibacterial effects and mechanisms of three polyphenols against Shewanella putrefaciens[J].Food Science,2024,45(16):1-9.
[20] 杨君,罗欣,梁荣蓉,等.减菌技术在冷却肉关键安全控制点抑菌分子机制的研究进展[J].食品科学,2021,42(21):235-245.YANG J,LUO X,LIANG R R,et al.Progress in research on molecular mechanisms of decontamination technologies applied in critical control points for the microbiological safety of chilled meat[J].Food Science,2021,42(21):235-245.
[21] LI B,CHEN X,YANG J Y,et al.Intracellular ATP concentration is a key regulator of bacterial cell fate[J].Journal of Bacteriology,2024,206(12):e0020824.
[22] DING T,XUAN X T,LI J,et al.Disinfection efficacy and mechanism of slightly acidic electrolyzed water on Staphylococcus aureus in pure culture[J].Food Control,2016,60:505-510.
[23] CHENG J H,LYU X Y,PAN Y Y,et al.Foodborne bacterial stress responses to exogenous reactive oxygen species (ROS) induced by cold plasma treatments[J].Trends in Food Science &Technology,2020,103:239-247.
[24] 亓峥.氯消毒诱导的活而不可培养态细菌的低代谢活性机制[D].济南:山东大学,2023.QI Z.Mechanism of hypometabolic regulation of viable but nonculturable bacteria induced by chlorine disinfection[D].Jinan:Shandong University,2023.
[25] 洪文龙,谢春芹,赵见营,等.过氧化氢基等离子体活化溶液制备及杀菌性能研究[J].食品科技,2024,49(3):33-40.HONG W L,XIE C Q,ZHAO J Y,et al.Preparation and bactericidal effect of hydrogen peroxide based plasma activated solution[J].Food Science and Technology,2024,49(3):33-40.
[26] INATSU Y,KITAGAWA T,NAKAMURA N,et al.Effectiveness of stable ozone microbubble water on reducing bacteria on the surface of selected leafy vegetables[J].Food Science and Technology Research,2011,17(6):479-485.
[27] ADAL S,DELIKANL K
K YAK B,ÇAL
YAK B,ÇAL
 KAN KOÇ G,et al.Applications of electrolyzed water in the food industry:A comprehensive review of its effects on food texture[J].Future Foods,2024,9:100369.
KAN KOÇ G,et al.Applications of electrolyzed water in the food industry:A comprehensive review of its effects on food texture[J].Future Foods,2024,9:100369.